引用本文: 張俊慧, 熊炳鈞, 邱娟娟, 譚秋雯, 張憶, 楊濟橋, 呂青. 脂肪干細胞及血管內皮細胞提高游離脂肪移植成活的實驗研究. 中國修復重建外科雜志, 2018, 32(8): 1074-1080. doi: 10.7507/1002-1892.201802069 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
血管新生不足是限制脂肪移植成活的主要因素,實現快速且廣泛的毛細血管新生是提高脂肪移植成活率的重要策略[1]。脂肪來源干細胞(adipose-derived stem cells,ADSCs)及血管內皮細胞(endothelial cells,ECs)與血管新生密切相關[2-3]。體外研究證實,ECs 可促進血管新生,并可通過細胞因子的旁分泌等作用機制與 ADSCs 產生協同作用[4-6]。本研究旨在初步探索 ADSCs 及 ECs 在提高移植脂肪血管生成以及移植脂肪成活中的作用。
1 材料與方法
1.1 實驗動物及主要儀器
健康 4~6 周齡雄性裸鼠 80 只,體質量 14~19 g,由成都達碩生物科技有限公司提供。脂肪組織均由四川大學華西醫院乳腺外科行乳房切除術的早期乳腺癌患者自愿捐贈,脂肪組織置于無菌 PBS 緩沖液在離體 2 h 內運送至實驗室。實驗所用 ECs 為 EA.hy926 人臍靜脈內皮細胞株(human umbilical vein endothelial cells,HUVECs),購自上海賽百慷生物技術有限公司。Image-Pro Plus 6.0 圖像分析軟件(Media Cybernetics 公司,美國);超聲檢測儀(Philips 公司,荷蘭)。
1.2 ADSCs 分離及培養
參照課題組前期細胞培養方法[7]分離培養 ADSCs。將患者自愿捐贈的脂肪組織取部分置于 1 mg/mL Ⅰ型膠原酶震蕩消化 30~40 min,加入等體積 DMEM/F12 培養基終止消化。組織消化液以 200×g 離心 5 min,下層片狀沉淀即為 ADSCs。經體外培養后選擇第 3 代細胞進行實驗。
1.3 實驗分組及方法
將 80 只裸鼠隨機分為 4 組,每組 20 只,分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組。取部分患者自愿捐贈的脂肪組織,采用眼科剪和眼科鑷剔取脂肪顆粒,然后剪至勻漿狀,移入離心管中,以 280×g 離心 5 min,取中間層脂肪,即為游離脂肪顆粒[7]。使用 1 mL 注射器針筒將 1 mL 脂肪顆粒移入安瓿瓶中,根據分組在安瓿瓶另加入 0.3 mL 生理鹽水(對照組)、2×106 個 HUVECs+0.3 mL 生理鹽水(ECs 組)、2×106 個 ADSCs+ 0.3 mL 生理鹽水(ADSCs 組)、1×106 個 HUVECs+1×106 個 ADSCs+ 0.3 mL 生理鹽水(ADSCs+ECs 組),搖勻。脂肪注射方法參考 Coleman 技術[8],具體步驟:取 8 號(0.8 mm)注射器穿刺入裸鼠背部皮下,建立長度約 2 cm 的皮下通道,回抽未見回血后,將制備的各組游離脂肪顆粒緩慢注射至裸鼠背部皮下。注射后裸鼠正常飼養。于術后 2、4、8、12 周,每組各取 5 只裸鼠進行觀測。
1.4 觀測指標
1.4.1 大體及超聲檢查
注射后觀察各組裸鼠存活情況,大體觀察背部移植區色澤、形狀。各時間點,室溫條件下采用超聲檢測儀對移植區行影像學檢測,觀察移植區有無囊腫、實性結節、液化壞死等異常。
1.4.2 移植脂肪體積測量
超聲檢查后使用頸椎脫臼法處死裸鼠,于背部作切口剝離移植物,通過排水法測量移植脂肪體積。
1.4.3 組織學觀察
取移植脂肪置于 4% 多聚甲醛固定,石蠟包埋切片,片厚 5 μm。取部分切片行常規 HE 染色,光鏡下觀察各組移植脂肪結構變化。
1.4.4 免疫熒光染色觀察
取各組剩余切片行 CD31 免疫熒光染色,評估移植脂肪內微血管新生情況。其中紅色熒光為新生血管內皮細胞 CD31 染色,藍色熒光為細胞核 DAPI 染色。于 200 倍鏡下,各組各時間點取 3 張切片,每張切片隨機選取 5 個視野,計數微血管,以視野內形成明顯完整血管結構的區域視作 1 個微血管。使用 Image-Pro Plus 6.0 圖像分析軟件,計算移植脂肪內單位面積微血管數(個/mm2)。
1.5 統計學方法
采用 SPSS18.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 法;檢驗水準 α=0.05。
2 結果
2.1 大體及超聲觀察
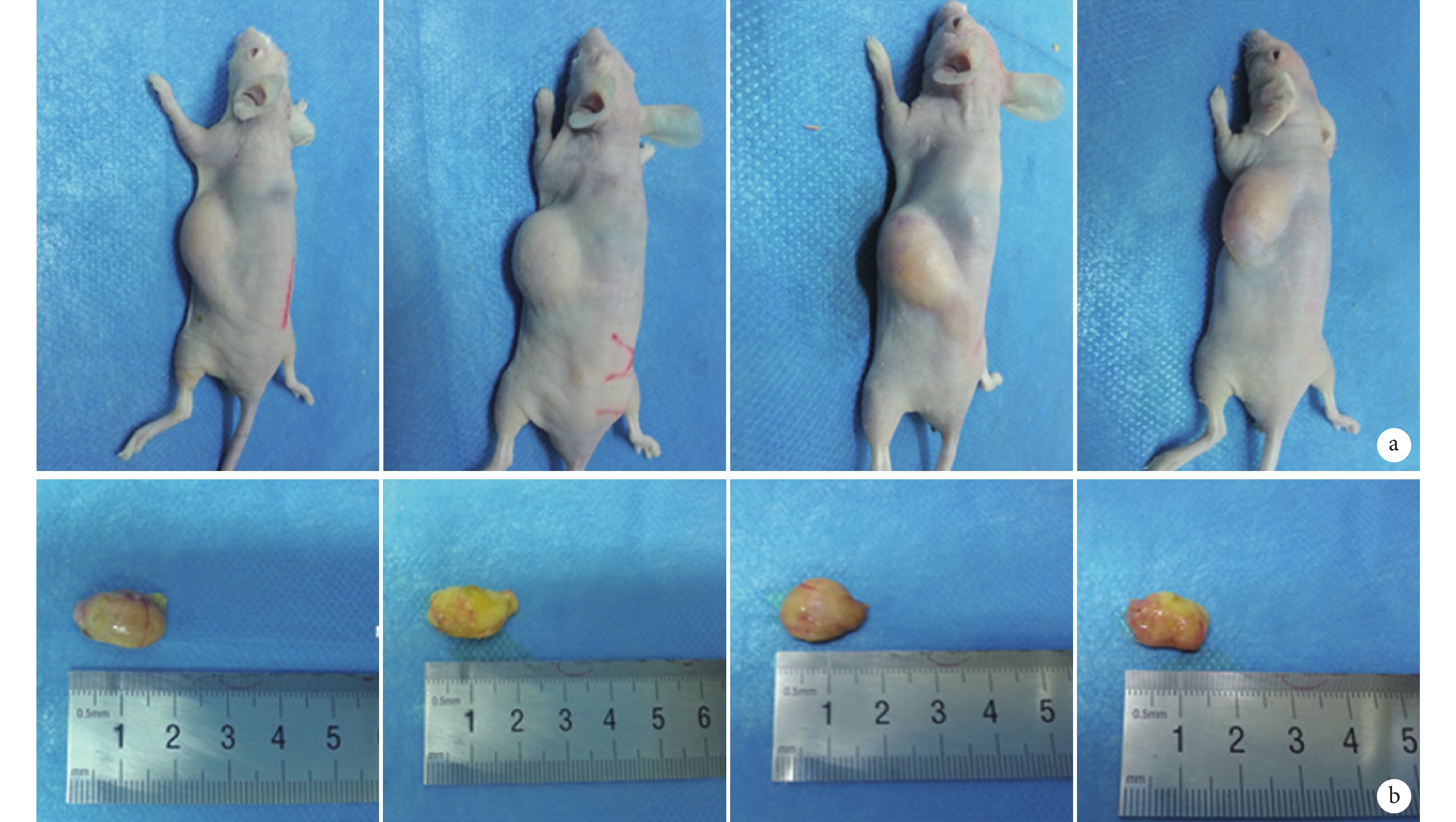
各組裸鼠均存活至實驗完成,無手術相關并發癥發生。大體觀察見各組裸鼠背部脂肪移植區皮膚色澤正常,注射部位局部呈半球形隆起,該隆起隨時間延長進行性縮小,組間變化無明顯差異。見圖 1。
超聲檢測示各組無明顯差異,移植脂肪呈半橢圓形弱回聲團塊,內部均未見明顯血流信號,未見囊腫、鈣化、實性結節等異常表現,部分脂肪內部可觀察到無回聲病灶(脂肪液化)。移植后 2 周,移植脂肪內部回聲粗糙、不均勻,邊界較清,形態欠規則,周邊無明顯包膜;4 周時移植脂肪內部回聲較前均勻,形態規則,周邊出現強回聲包膜;8 周時移植脂肪內部回聲均勻,輪廓清晰,周邊強回聲包膜增厚;12 周時各組移植脂肪回聲均勻,接近正常脂肪組織,外周可見完整強回聲包膜。見圖 2。
2.2 移植脂肪體積測量
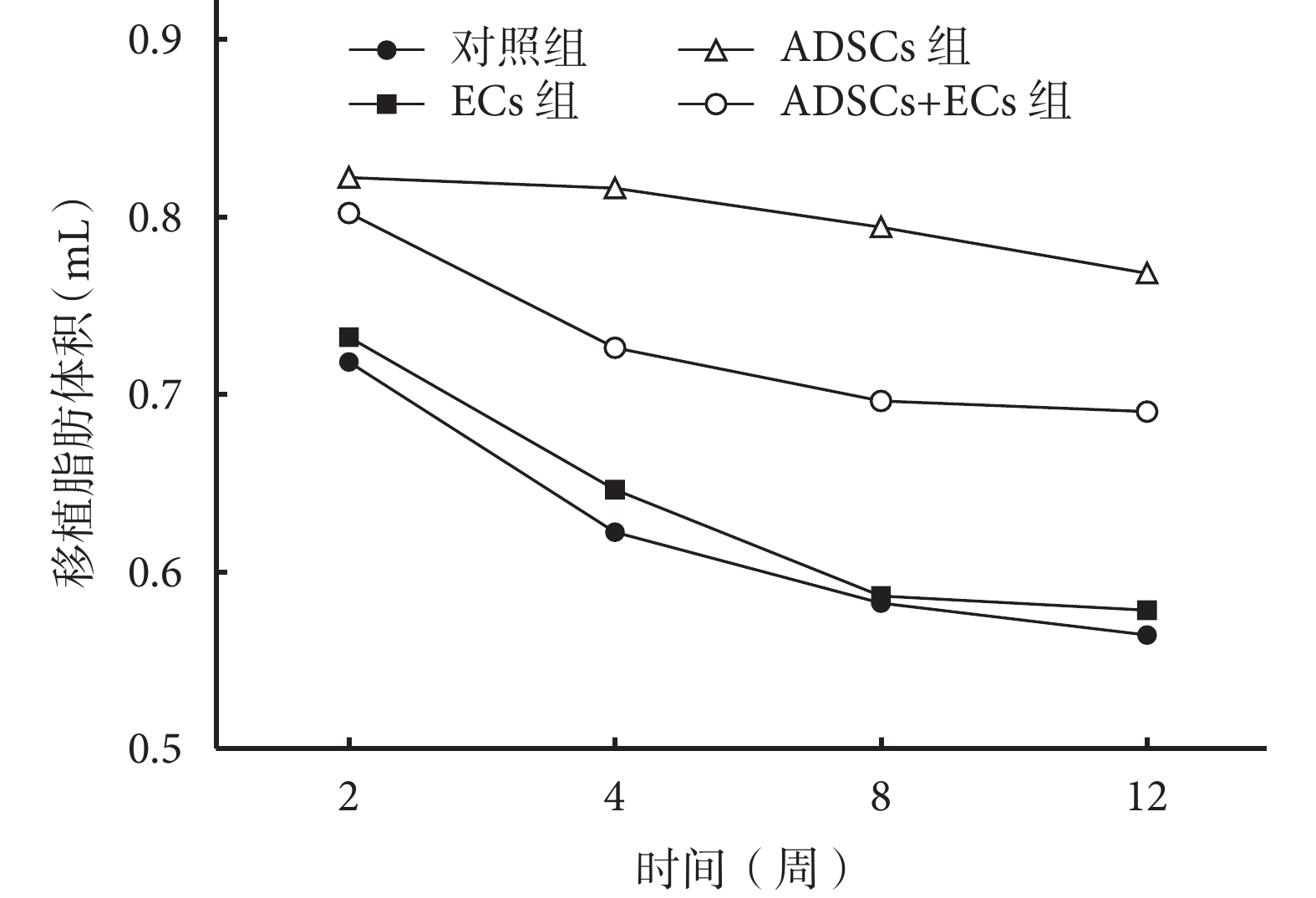
隨時間延長各組移植脂肪體積均呈進行性縮小趨勢,其中 ADSCs 組體積縮小最慢、ADSCs+ECs 組次之、ECs 組及對照組下降最快。移植后各時間點,ADSCs 組及 ADSCs+ECs 組移植脂肪體積均高于 ECs 組及對照組,比較差異有統計學意義(P<0.05);ECs 組與對照組比較,差異無統計學意義(P>0.05)。移植后 2、4 周,ADSCs 組及 ADSCs+ECs 組比較差異無統計學意義(P<0.05);8、12 周時,ADSCs 組明顯高于 ADSCs+ECs 組,差異有統計學意義(P<0.05)。見圖 3。
2.3 組織學觀察
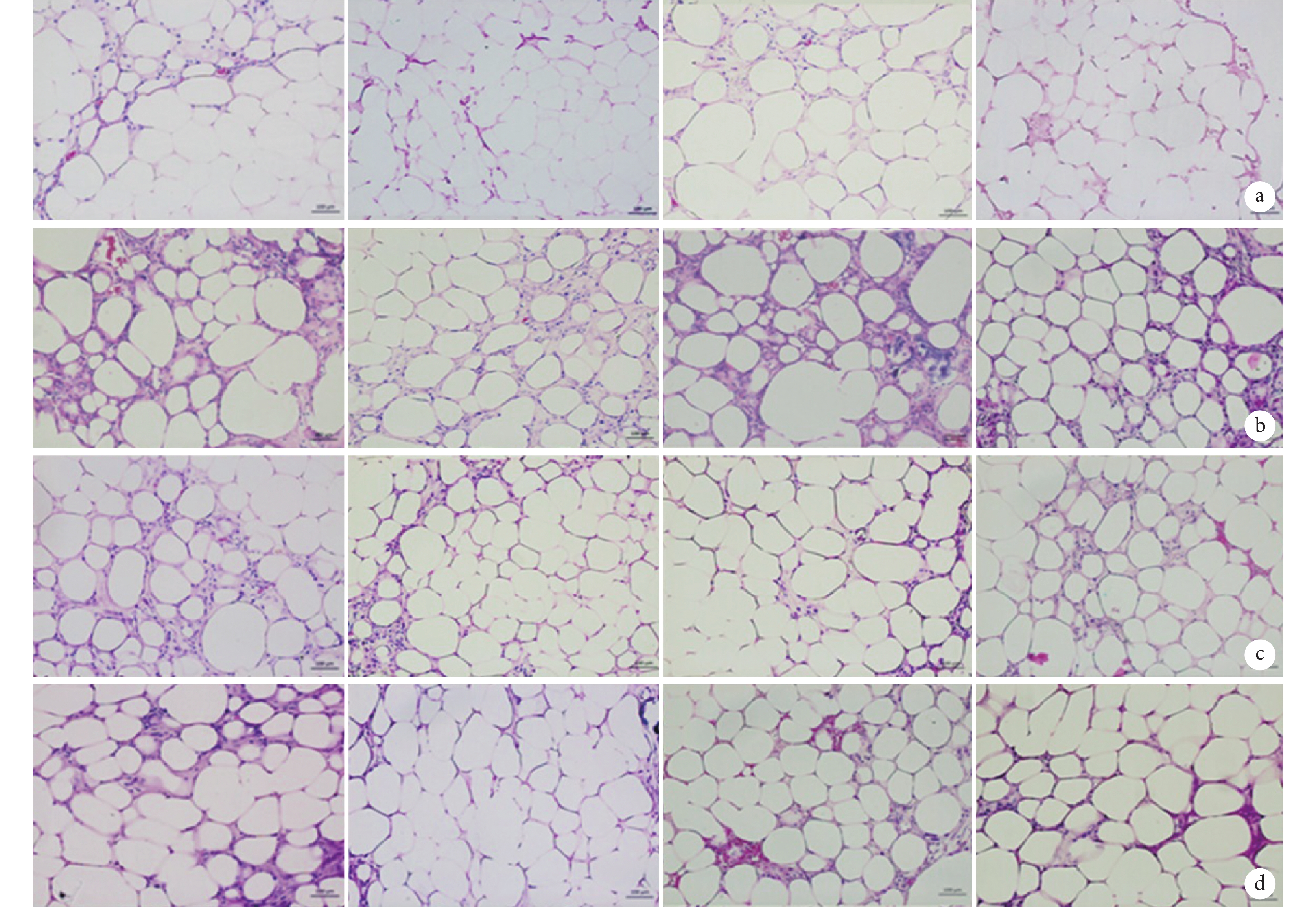
移植后各組組織學形態變化趨勢相似,移植后 2 周移植脂肪由大小不一的空腔狀脂肪囊泡構成,局部有液化壞死,部分脂肪細胞間質及脂肪團塊周圍少許纖維結締組織形成,內可見少量細小新生血管,周圍大量炎性細胞浸潤;4 周時脂肪細胞間及周圍纖維結締組織較前增加,新生血管數量增加,炎性細胞減少;8 周時脂肪細胞清晰可見,大小較前均一,液化壞死區范圍縮小,新生血管易見,管狀結構明顯,管徑更粗,炎性反應消退;12 周時脂肪細胞形態規整,液化壞死少見,鏡下見脂肪細胞間及周圍纖維結締組織內大量成熟血管呈完整的管狀結構。但 ADSCs 組組織重塑速度快于其他各組,各時間點新生血管更多,脂滴大小更均一;ECs 組與 ADSCs+ECs 組重塑速度較 ADSCs 組稍慢,對照組組織重塑速度最慢且脂滴大小較為不均。見圖 4。
2.4 免疫熒光染色觀察
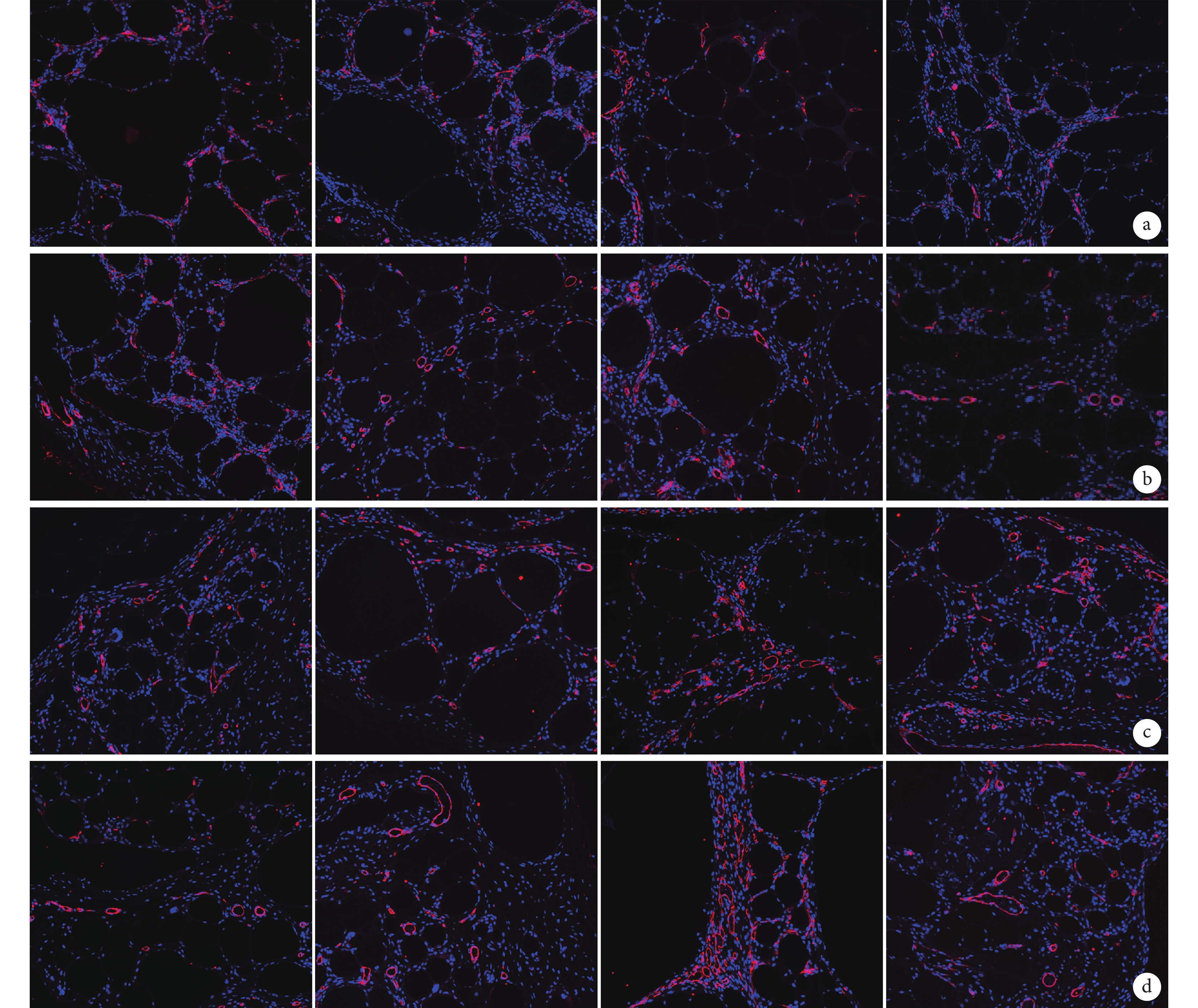
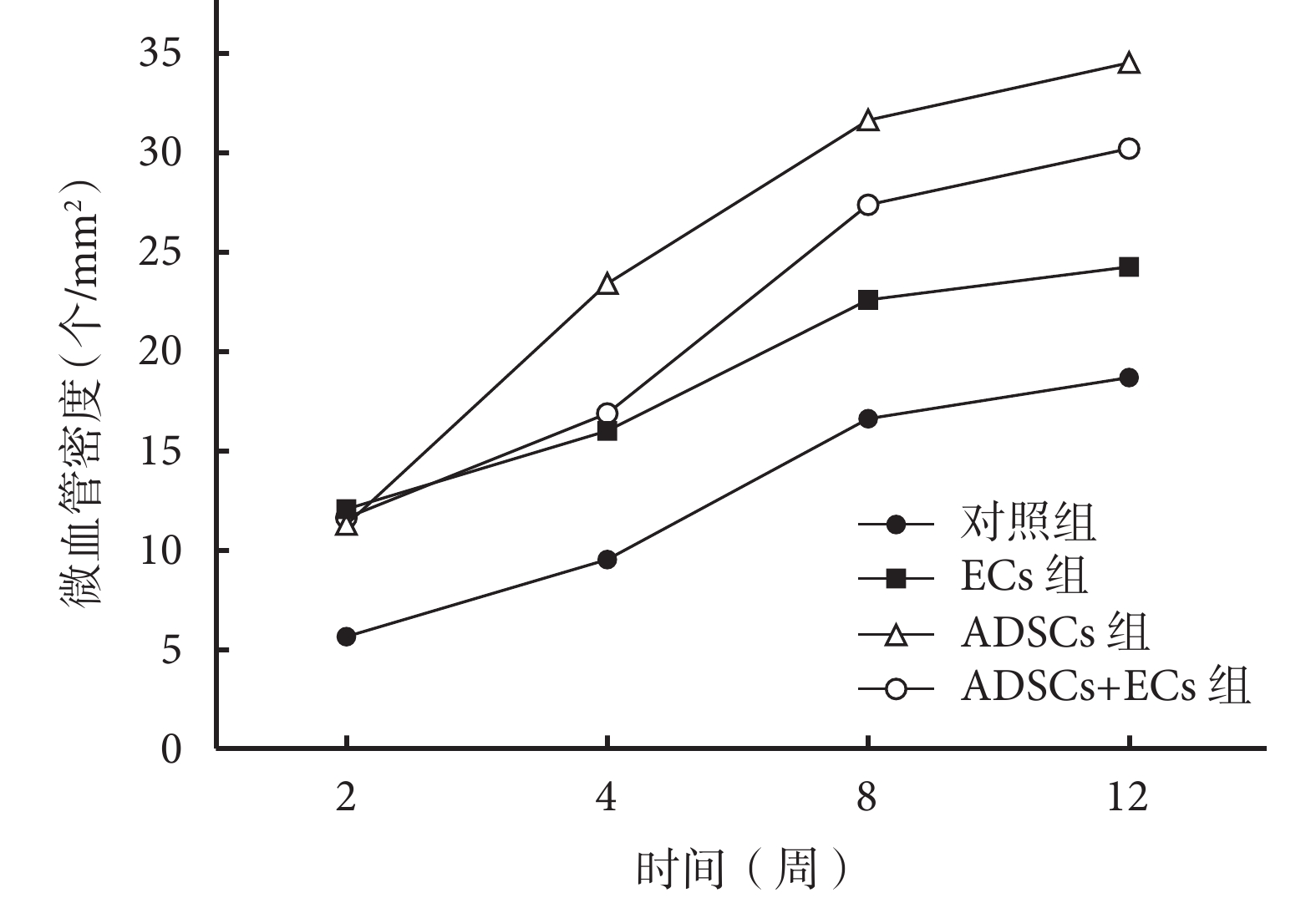
隨時間延長各組新生血管逐漸增加,見圖 5。各時間點,ECs 組、ADSCs 組、ADSCs+ECs 組微血管密度均高于對照組,比較差異有統計學意義(P<0.05)。移植后 2 周,ECs 組、ADSCs+ECs 組及 ADSCs 組間比較差異無統計學意義(P>0.05);4 周時,ADSCs 組微血管密度高于 ECs 組及 ADSCs+ECs 組(P<0.05),ECs 組及 ADSCs+ECs 組間差異無統計學意義(P>0.05);8、12 周時,ADSCs 組及 ADSCs+ECs 組微血管密度高于 ECs 組(P<0.05),ADSCs 組及 ADSCs+ECs 組間比較差異無統計學意義(P>0.05)。見圖 6。
3 討論
在成熟脂肪組織內部,毛細血管網分布廣泛,每個脂肪細胞周圍都存在一個或多個毛細血管[9],脂肪細胞的增生和生長分別依賴于持續性的毛細血管網的新生和舊有血管的擴張和重塑。在生理環境中,ECs 作為血管和淋巴管道的外壁,發揮著維持血管和淋巴管內外穩態的作用。針對這一情況,有學者提出了促血管化治療這一概念,旨在通過使用生長因子和細胞輔助療法,使嚴重缺血的組織獲得更好血供[10]。
目前研究證實,ADSCs 具有多向分化潛能,并通過分泌多種細胞因子促進移植脂肪成活[11]。而且 ADSCs 可通過旁分泌途徑對脂肪組織中固有 ECs 進行調控,達到增加新生血管數量及提高移植脂肪組織成活的目的[5, 12]。本研究中,通過脂肪體積測量及新生血管觀察發現,ADSCs 能提高游離移植脂肪組織內的血管密度,提高移植物成活率,這與 Choi 等[13]的研究結果一致。但 ADSCs 組脂肪體積測量結果提示 ADSCs 促脂肪成活效果不及 Yoshimura 等[14]和 K?lle 等[15]的研究,分析可能與加入的 ADSCs 濃度較低且觀察時間較短有關。Yoshimura 等[14]的研究顯示,不同濃度 ADSCs 輔助脂肪移植術后 1 年,脂肪成活率為 40%~80%。因此,ADSCs 輔助脂肪移植時,細胞制備方法以及適宜濃度仍需要探討。同時,也亟需進一步研究來明確 ADSCs 輔助脂肪移植過程中,其發揮的生理功能和作用機制。
ECs 是血管形成過程中的重要因素。多項研究證實,ECs 能夠加速脂肪移植早期的血管化進程[2-3, 16-17]。本研究中,ECs 組各時間點微血管密度均高于對照組,但移植脂肪體積與對照組無統計學差異,提示 ECs 輔助脂肪移植以促進血管新生為主,而對移植脂肪成活的改善不明顯,這可能與添加細胞數量的差異有關。Luo 等[16]研究表明移植脂肪凈重及新生血管形成隨著 ECs 濃度增加而提高,且隨時間延長,加入 4×106 個 ECs 的實驗組剩余移植脂肪凈重反而略有提高,而本研究 ECs 組添加數量為 2×106 個。因此,下一步需要探索 ECs 輔助脂肪移植的適宜濃度及作用機制,明確移植區血管密度與組織活性的關系。
研究證實,ADSCs 和 ECs 在成血管方面具有協同作用 [4-5, 12]。本研究中,通過對 ECs 組、ADSCs 組及 ADSCs+ECs 組新生血管密度及移植脂肪體積比較,發現在保證接種細胞數量一致的前提下,移植后各組各時間點移植脂肪體積和新生血管數量隨 ADSCs 細胞比例和數量的提高而增加。Strassburg 等 [12]提出 ADSCs 在移植早期主要通過細胞間的旁分泌信號通路激活組織中 ECs,而非直接分化為 ECs,參與調控脂肪移植早期的血管化進程,進而減少脂肪缺血性壞死。在本研究中,ECs 組移植脂肪組織中僅有少量固有 ADSCs,對 ECs 的調控作用弱,血管密度增長緩慢。ADSCs+ECs 組與 ADSCs 組比較,移植物內微血管密度隨 ADSCs 細胞數量絕對值的增加而顯著增多,提示新生血管的生成與 ADSCs 的數量密切相關,且 ECs 的成血管作用受 ADSCs 調控。
綜上述,本研究結果發現,ADSCs 可提高移植脂肪存活率,且該促進作用可能與促進血管新生相關。當添加本研究中細胞數量級的前提下,ADSCs 促進移植脂肪成活及誘導新生血管的作用較 ECs 強。然而 ECs 及 ADSCs 最佳濃度及共添加比例對提高自體脂肪移植的術后效果,還需要更多研究證實。此外,細胞輔助自體脂肪移植的技術可行性及腫瘤安全性等問題也需要進一步研究。
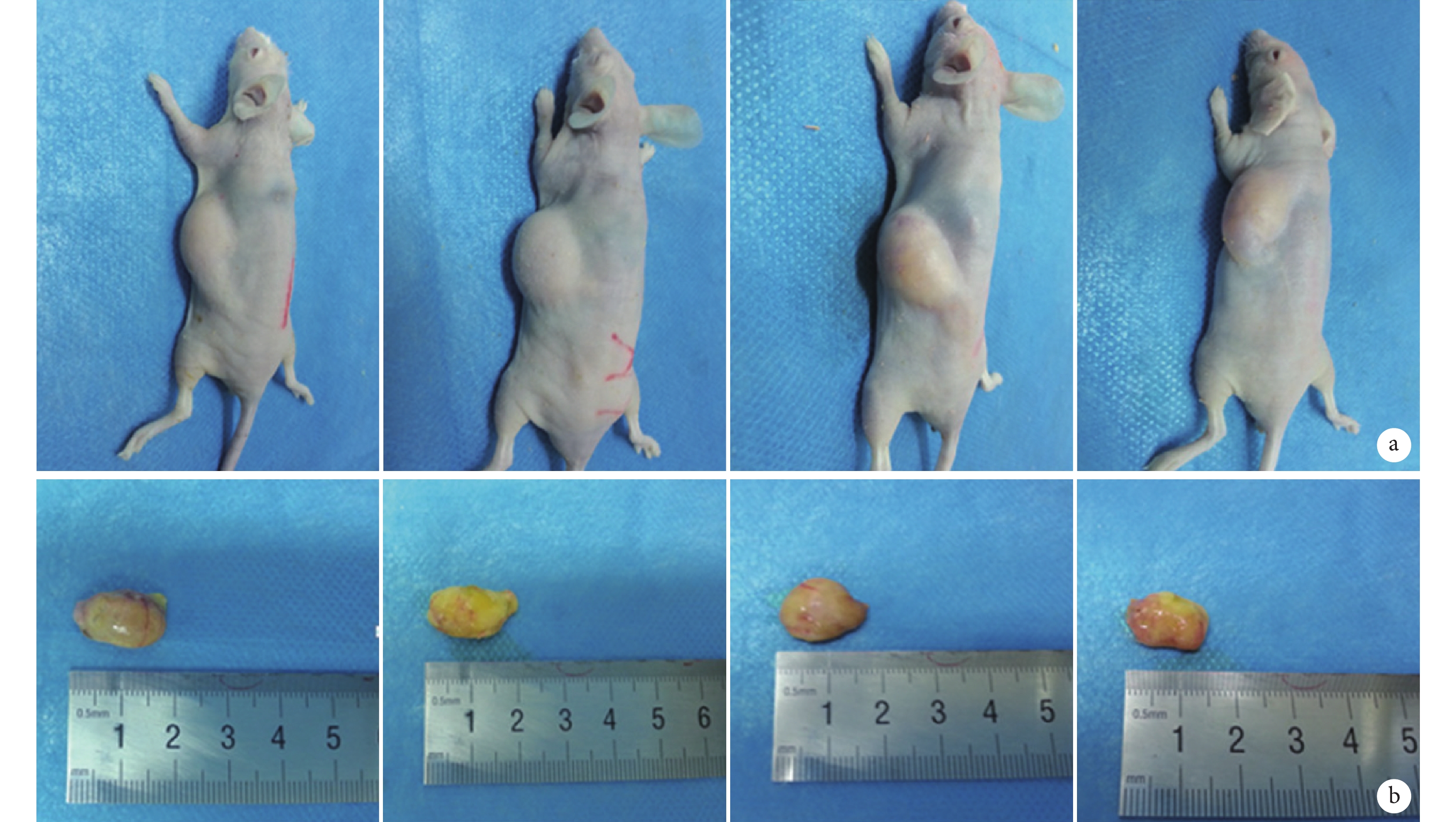 圖1
移植后 12 周各組大體觀察
圖1
移植后 12 周各組大體觀察
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 移植脂肪受區;b. 移植脂肪標本
Figure1. General observations of the grafted fat tissue in each group at 12 weeks after injectionFrom left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Recipient area; b. Grafted fat tissue
 圖2
移植后各組超聲檢查
圖2
移植后各組超聲檢查
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 2 周;b. 4 周;c. 8 周;d. 12 周
Figure2. Ultrasonography observation of each group after injectionFrom left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Two weeks; b. Four weeks; c. Eight weeks; d. Twelve weeks
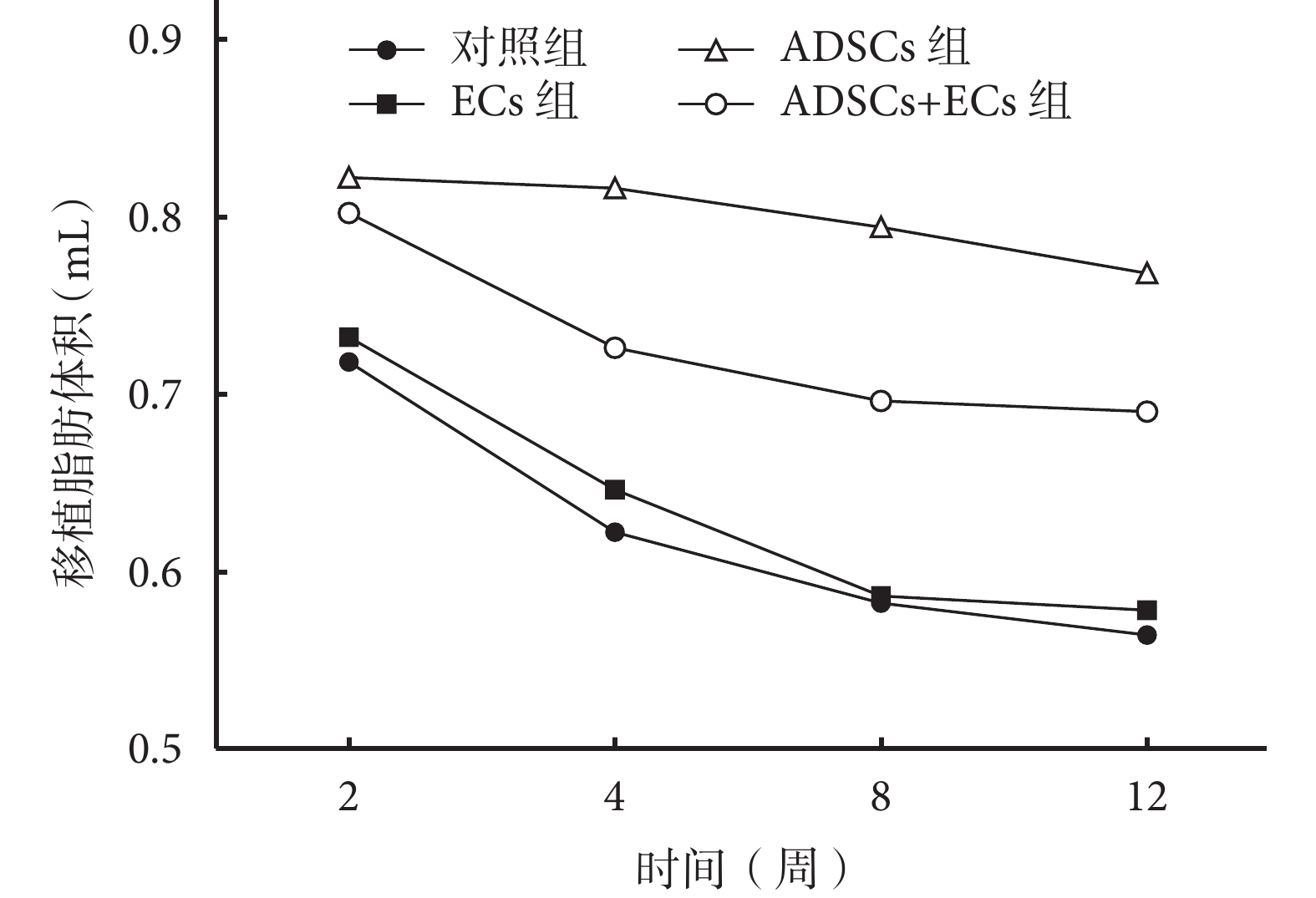 圖3
移植后各組移植脂肪體積
Figure3.
The volume of grafted fat tissue in each group after injection
圖3
移植后各組移植脂肪體積
Figure3.
The volume of grafted fat tissue in each group after injection
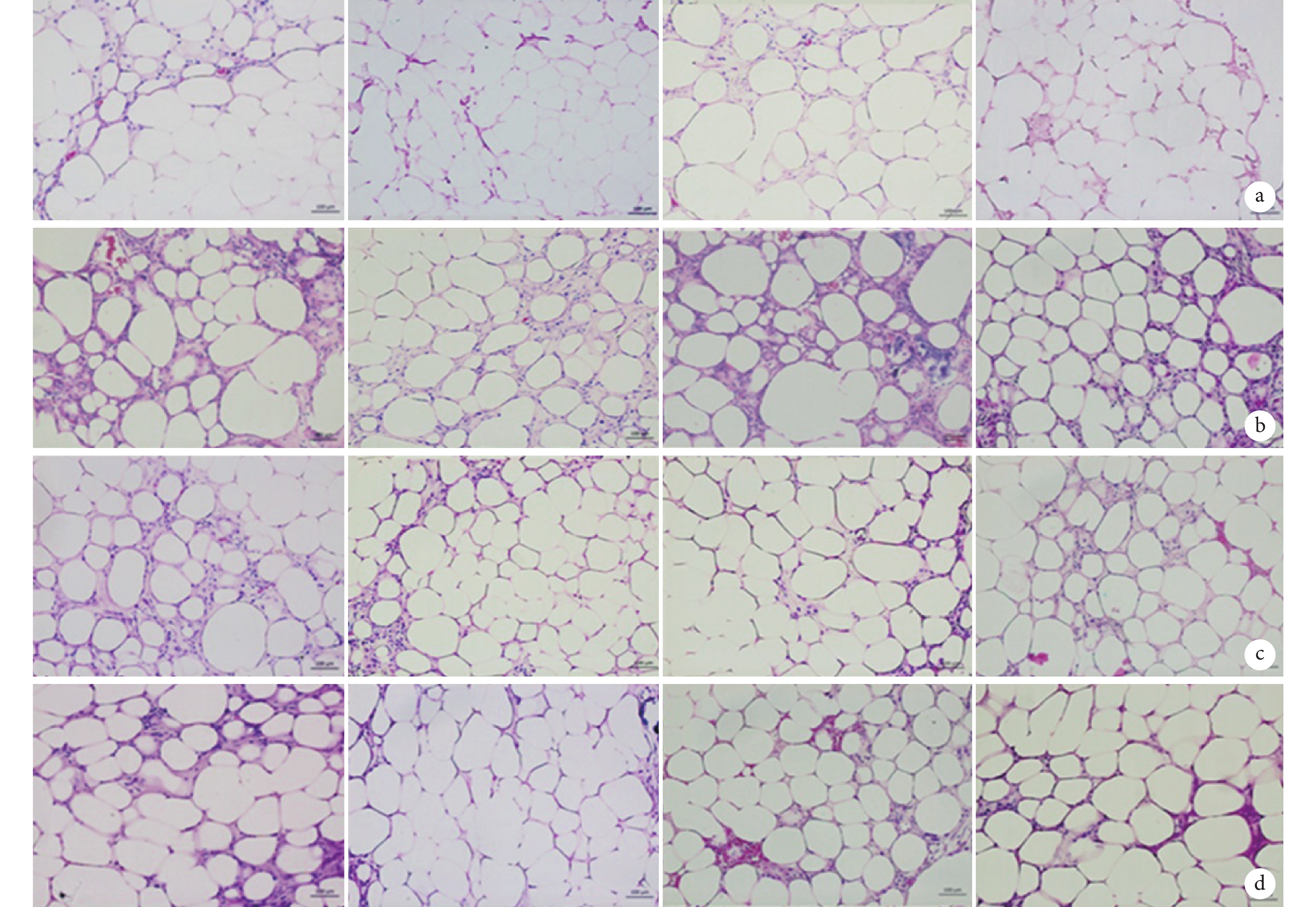 圖4
移植后各組組織學觀察(HE×200)
圖4
移植后各組組織學觀察(HE×200)
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 2 周;b. 4 周;c. 8 周;d. 12 周
Figure4. Histology observation of each group after injection (HE×200)From left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Two weeks; b. Four weeks; c. Eight weeks; d. Twelve weeks
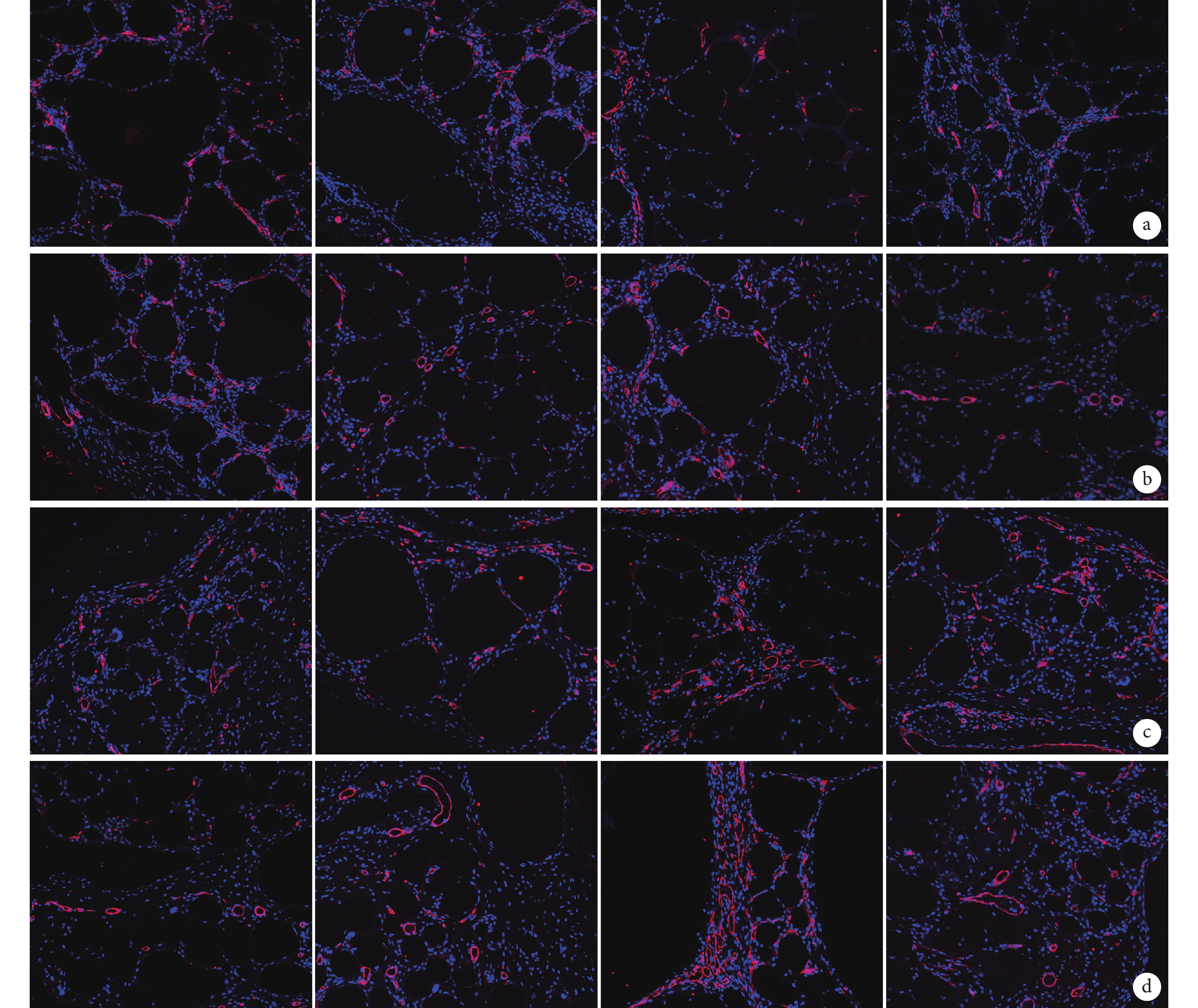 圖5
移植后各組免疫熒光染色觀察(×200)
圖5
移植后各組免疫熒光染色觀察(×200)
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 2 周;b. 4 周;c. 8 周;d. 12 周
Figure5. Immunofluorescence staining observation of each group after injection (×200)From left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Two weeks; b. Four weeks; c. Eight weeks; d. Twelve weeks
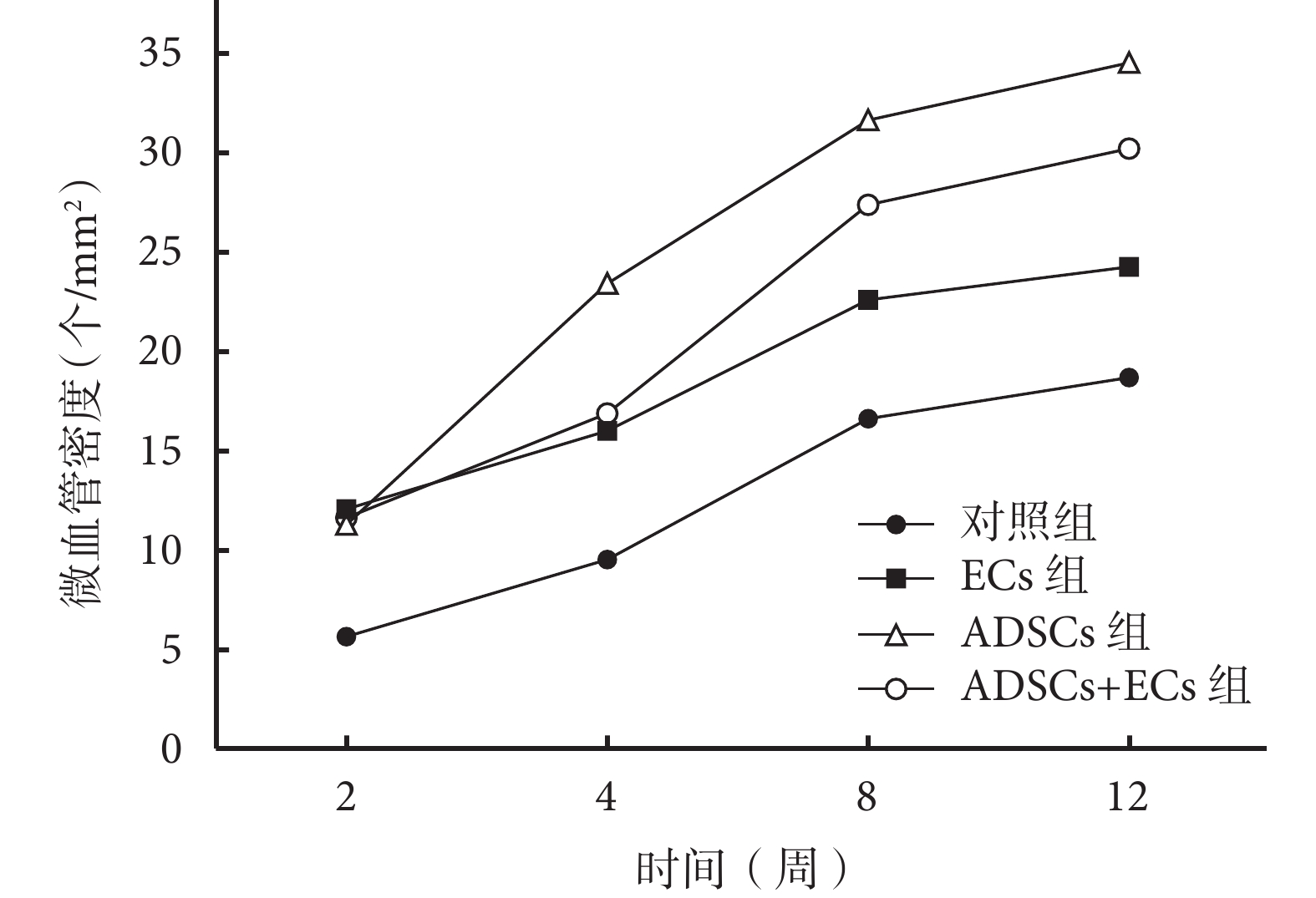 圖6
移植后各組微血管密度
Figure6.
The vessel density of each group after injection
圖6
移植后各組微血管密度
Figure6.
The vessel density of each group after injection
血管新生不足是限制脂肪移植成活的主要因素,實現快速且廣泛的毛細血管新生是提高脂肪移植成活率的重要策略[1]。脂肪來源干細胞(adipose-derived stem cells,ADSCs)及血管內皮細胞(endothelial cells,ECs)與血管新生密切相關[2-3]。體外研究證實,ECs 可促進血管新生,并可通過細胞因子的旁分泌等作用機制與 ADSCs 產生協同作用[4-6]。本研究旨在初步探索 ADSCs 及 ECs 在提高移植脂肪血管生成以及移植脂肪成活中的作用。
1 材料與方法
1.1 實驗動物及主要儀器
健康 4~6 周齡雄性裸鼠 80 只,體質量 14~19 g,由成都達碩生物科技有限公司提供。脂肪組織均由四川大學華西醫院乳腺外科行乳房切除術的早期乳腺癌患者自愿捐贈,脂肪組織置于無菌 PBS 緩沖液在離體 2 h 內運送至實驗室。實驗所用 ECs 為 EA.hy926 人臍靜脈內皮細胞株(human umbilical vein endothelial cells,HUVECs),購自上海賽百慷生物技術有限公司。Image-Pro Plus 6.0 圖像分析軟件(Media Cybernetics 公司,美國);超聲檢測儀(Philips 公司,荷蘭)。
1.2 ADSCs 分離及培養
參照課題組前期細胞培養方法[7]分離培養 ADSCs。將患者自愿捐贈的脂肪組織取部分置于 1 mg/mL Ⅰ型膠原酶震蕩消化 30~40 min,加入等體積 DMEM/F12 培養基終止消化。組織消化液以 200×g 離心 5 min,下層片狀沉淀即為 ADSCs。經體外培養后選擇第 3 代細胞進行實驗。
1.3 實驗分組及方法
將 80 只裸鼠隨機分為 4 組,每組 20 只,分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組。取部分患者自愿捐贈的脂肪組織,采用眼科剪和眼科鑷剔取脂肪顆粒,然后剪至勻漿狀,移入離心管中,以 280×g 離心 5 min,取中間層脂肪,即為游離脂肪顆粒[7]。使用 1 mL 注射器針筒將 1 mL 脂肪顆粒移入安瓿瓶中,根據分組在安瓿瓶另加入 0.3 mL 生理鹽水(對照組)、2×106 個 HUVECs+0.3 mL 生理鹽水(ECs 組)、2×106 個 ADSCs+ 0.3 mL 生理鹽水(ADSCs 組)、1×106 個 HUVECs+1×106 個 ADSCs+ 0.3 mL 生理鹽水(ADSCs+ECs 組),搖勻。脂肪注射方法參考 Coleman 技術[8],具體步驟:取 8 號(0.8 mm)注射器穿刺入裸鼠背部皮下,建立長度約 2 cm 的皮下通道,回抽未見回血后,將制備的各組游離脂肪顆粒緩慢注射至裸鼠背部皮下。注射后裸鼠正常飼養。于術后 2、4、8、12 周,每組各取 5 只裸鼠進行觀測。
1.4 觀測指標
1.4.1 大體及超聲檢查
注射后觀察各組裸鼠存活情況,大體觀察背部移植區色澤、形狀。各時間點,室溫條件下采用超聲檢測儀對移植區行影像學檢測,觀察移植區有無囊腫、實性結節、液化壞死等異常。
1.4.2 移植脂肪體積測量
超聲檢查后使用頸椎脫臼法處死裸鼠,于背部作切口剝離移植物,通過排水法測量移植脂肪體積。
1.4.3 組織學觀察
取移植脂肪置于 4% 多聚甲醛固定,石蠟包埋切片,片厚 5 μm。取部分切片行常規 HE 染色,光鏡下觀察各組移植脂肪結構變化。
1.4.4 免疫熒光染色觀察
取各組剩余切片行 CD31 免疫熒光染色,評估移植脂肪內微血管新生情況。其中紅色熒光為新生血管內皮細胞 CD31 染色,藍色熒光為細胞核 DAPI 染色。于 200 倍鏡下,各組各時間點取 3 張切片,每張切片隨機選取 5 個視野,計數微血管,以視野內形成明顯完整血管結構的區域視作 1 個微血管。使用 Image-Pro Plus 6.0 圖像分析軟件,計算移植脂肪內單位面積微血管數(個/mm2)。
1.5 統計學方法
采用 SPSS18.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 法;檢驗水準 α=0.05。
2 結果
2.1 大體及超聲觀察
各組裸鼠均存活至實驗完成,無手術相關并發癥發生。大體觀察見各組裸鼠背部脂肪移植區皮膚色澤正常,注射部位局部呈半球形隆起,該隆起隨時間延長進行性縮小,組間變化無明顯差異。見圖 1。
超聲檢測示各組無明顯差異,移植脂肪呈半橢圓形弱回聲團塊,內部均未見明顯血流信號,未見囊腫、鈣化、實性結節等異常表現,部分脂肪內部可觀察到無回聲病灶(脂肪液化)。移植后 2 周,移植脂肪內部回聲粗糙、不均勻,邊界較清,形態欠規則,周邊無明顯包膜;4 周時移植脂肪內部回聲較前均勻,形態規則,周邊出現強回聲包膜;8 周時移植脂肪內部回聲均勻,輪廓清晰,周邊強回聲包膜增厚;12 周時各組移植脂肪回聲均勻,接近正常脂肪組織,外周可見完整強回聲包膜。見圖 2。
2.2 移植脂肪體積測量
隨時間延長各組移植脂肪體積均呈進行性縮小趨勢,其中 ADSCs 組體積縮小最慢、ADSCs+ECs 組次之、ECs 組及對照組下降最快。移植后各時間點,ADSCs 組及 ADSCs+ECs 組移植脂肪體積均高于 ECs 組及對照組,比較差異有統計學意義(P<0.05);ECs 組與對照組比較,差異無統計學意義(P>0.05)。移植后 2、4 周,ADSCs 組及 ADSCs+ECs 組比較差異無統計學意義(P<0.05);8、12 周時,ADSCs 組明顯高于 ADSCs+ECs 組,差異有統計學意義(P<0.05)。見圖 3。
2.3 組織學觀察
移植后各組組織學形態變化趨勢相似,移植后 2 周移植脂肪由大小不一的空腔狀脂肪囊泡構成,局部有液化壞死,部分脂肪細胞間質及脂肪團塊周圍少許纖維結締組織形成,內可見少量細小新生血管,周圍大量炎性細胞浸潤;4 周時脂肪細胞間及周圍纖維結締組織較前增加,新生血管數量增加,炎性細胞減少;8 周時脂肪細胞清晰可見,大小較前均一,液化壞死區范圍縮小,新生血管易見,管狀結構明顯,管徑更粗,炎性反應消退;12 周時脂肪細胞形態規整,液化壞死少見,鏡下見脂肪細胞間及周圍纖維結締組織內大量成熟血管呈完整的管狀結構。但 ADSCs 組組織重塑速度快于其他各組,各時間點新生血管更多,脂滴大小更均一;ECs 組與 ADSCs+ECs 組重塑速度較 ADSCs 組稍慢,對照組組織重塑速度最慢且脂滴大小較為不均。見圖 4。
2.4 免疫熒光染色觀察
隨時間延長各組新生血管逐漸增加,見圖 5。各時間點,ECs 組、ADSCs 組、ADSCs+ECs 組微血管密度均高于對照組,比較差異有統計學意義(P<0.05)。移植后 2 周,ECs 組、ADSCs+ECs 組及 ADSCs 組間比較差異無統計學意義(P>0.05);4 周時,ADSCs 組微血管密度高于 ECs 組及 ADSCs+ECs 組(P<0.05),ECs 組及 ADSCs+ECs 組間差異無統計學意義(P>0.05);8、12 周時,ADSCs 組及 ADSCs+ECs 組微血管密度高于 ECs 組(P<0.05),ADSCs 組及 ADSCs+ECs 組間比較差異無統計學意義(P>0.05)。見圖 6。
3 討論
在成熟脂肪組織內部,毛細血管網分布廣泛,每個脂肪細胞周圍都存在一個或多個毛細血管[9],脂肪細胞的增生和生長分別依賴于持續性的毛細血管網的新生和舊有血管的擴張和重塑。在生理環境中,ECs 作為血管和淋巴管道的外壁,發揮著維持血管和淋巴管內外穩態的作用。針對這一情況,有學者提出了促血管化治療這一概念,旨在通過使用生長因子和細胞輔助療法,使嚴重缺血的組織獲得更好血供[10]。
目前研究證實,ADSCs 具有多向分化潛能,并通過分泌多種細胞因子促進移植脂肪成活[11]。而且 ADSCs 可通過旁分泌途徑對脂肪組織中固有 ECs 進行調控,達到增加新生血管數量及提高移植脂肪組織成活的目的[5, 12]。本研究中,通過脂肪體積測量及新生血管觀察發現,ADSCs 能提高游離移植脂肪組織內的血管密度,提高移植物成活率,這與 Choi 等[13]的研究結果一致。但 ADSCs 組脂肪體積測量結果提示 ADSCs 促脂肪成活效果不及 Yoshimura 等[14]和 K?lle 等[15]的研究,分析可能與加入的 ADSCs 濃度較低且觀察時間較短有關。Yoshimura 等[14]的研究顯示,不同濃度 ADSCs 輔助脂肪移植術后 1 年,脂肪成活率為 40%~80%。因此,ADSCs 輔助脂肪移植時,細胞制備方法以及適宜濃度仍需要探討。同時,也亟需進一步研究來明確 ADSCs 輔助脂肪移植過程中,其發揮的生理功能和作用機制。
ECs 是血管形成過程中的重要因素。多項研究證實,ECs 能夠加速脂肪移植早期的血管化進程[2-3, 16-17]。本研究中,ECs 組各時間點微血管密度均高于對照組,但移植脂肪體積與對照組無統計學差異,提示 ECs 輔助脂肪移植以促進血管新生為主,而對移植脂肪成活的改善不明顯,這可能與添加細胞數量的差異有關。Luo 等[16]研究表明移植脂肪凈重及新生血管形成隨著 ECs 濃度增加而提高,且隨時間延長,加入 4×106 個 ECs 的實驗組剩余移植脂肪凈重反而略有提高,而本研究 ECs 組添加數量為 2×106 個。因此,下一步需要探索 ECs 輔助脂肪移植的適宜濃度及作用機制,明確移植區血管密度與組織活性的關系。
研究證實,ADSCs 和 ECs 在成血管方面具有協同作用 [4-5, 12]。本研究中,通過對 ECs 組、ADSCs 組及 ADSCs+ECs 組新生血管密度及移植脂肪體積比較,發現在保證接種細胞數量一致的前提下,移植后各組各時間點移植脂肪體積和新生血管數量隨 ADSCs 細胞比例和數量的提高而增加。Strassburg 等 [12]提出 ADSCs 在移植早期主要通過細胞間的旁分泌信號通路激活組織中 ECs,而非直接分化為 ECs,參與調控脂肪移植早期的血管化進程,進而減少脂肪缺血性壞死。在本研究中,ECs 組移植脂肪組織中僅有少量固有 ADSCs,對 ECs 的調控作用弱,血管密度增長緩慢。ADSCs+ECs 組與 ADSCs 組比較,移植物內微血管密度隨 ADSCs 細胞數量絕對值的增加而顯著增多,提示新生血管的生成與 ADSCs 的數量密切相關,且 ECs 的成血管作用受 ADSCs 調控。
綜上述,本研究結果發現,ADSCs 可提高移植脂肪存活率,且該促進作用可能與促進血管新生相關。當添加本研究中細胞數量級的前提下,ADSCs 促進移植脂肪成活及誘導新生血管的作用較 ECs 強。然而 ECs 及 ADSCs 最佳濃度及共添加比例對提高自體脂肪移植的術后效果,還需要更多研究證實。此外,細胞輔助自體脂肪移植的技術可行性及腫瘤安全性等問題也需要進一步研究。
 圖1
移植后 12 周各組大體觀察
圖1
移植后 12 周各組大體觀察
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 移植脂肪受區;b. 移植脂肪標本
Figure1. General observations of the grafted fat tissue in each group at 12 weeks after injectionFrom left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Recipient area; b. Grafted fat tissue
 圖2
移植后各組超聲檢查
圖2
移植后各組超聲檢查
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 2 周;b. 4 周;c. 8 周;d. 12 周
Figure2. Ultrasonography observation of each group after injectionFrom left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Two weeks; b. Four weeks; c. Eight weeks; d. Twelve weeks
 圖3
移植后各組移植脂肪體積
Figure3.
The volume of grafted fat tissue in each group after injection
圖3
移植后各組移植脂肪體積
Figure3.
The volume of grafted fat tissue in each group after injection
 圖4
移植后各組組織學觀察(HE×200)
圖4
移植后各組組織學觀察(HE×200)
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 2 周;b. 4 周;c. 8 周;d. 12 周
Figure4. Histology observation of each group after injection (HE×200)From left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Two weeks; b. Four weeks; c. Eight weeks; d. Twelve weeks
 圖5
移植后各組免疫熒光染色觀察(×200)
圖5
移植后各組免疫熒光染色觀察(×200)
從左至右分別為對照組、ECs 組、ADSCs 組、ADSCs+ECs 組 a. 2 周;b. 4 周;c. 8 周;d. 12 周
Figure5. Immunofluorescence staining observation of each group after injection (×200)From left to right for control group, ECs group, ADSCs group, ADSCs+ECs group a. Two weeks; b. Four weeks; c. Eight weeks; d. Twelve weeks
 圖6
移植后各組微血管密度
Figure6.
The vessel density of each group after injection
圖6
移植后各組微血管密度
Figure6.
The vessel density of each group after injection