引用本文: 諶斯, 杜昶. 具有開放孔結構的左旋聚乳酸/卵磷脂多孔支架的制備及成骨性能研究. 中國修復重建外科雜志, 2018, 32(9): 1123-1130. doi: 10.7507/1002-1892.201804127 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
在骨組織工程中,支架作為細胞外基質,為細胞的黏附、生長、增殖和遷移提供適當的環境,同時還需要引導新組織的再生[1-2]。因此,支架除了需有良好的生物相容性、合適的孔徑、孔隙率和強度外,還需要有適當的表面性能以便于細胞在支架上黏附、增殖和分化等[3-4]。左旋聚乳酸[poly(L-lactic acid),PLLA]具有良好的生物相容性,已被美國食品與藥品監督管理局(FDA)允許用在外科手術縫合線、微膠囊、植入材料中[5]。但是 PLLA 親水性比較差,分子鏈段上缺乏與細胞識別因子或其他生物活性分子相鍵合的官能團,不利于細胞在其表面黏附與生長,同時在生物礦化過程中缺乏成核位點,較難礦化[6-7]。
卵磷脂是由磷脂質和中性脂質構成的天然混合物。其中磷脂質是細胞膜的主要成分[8],其化學結構中含有親水的磷酸基極性基團和疏水的脂肪酰基長鏈,因此具有兩親性質,作為表面活性劑卵磷脂可以有效降低溶液的表面張力[9]。在之前的研究中,已經發現卵磷脂能夠作為成核位點促進骨礦物的增長[10-11]。Park 等[12]利用卵磷脂作為表面活性劑,成功制備了表面光滑、一致性好的海藻酸鈉/聚氧乙烯復合納米纖維。除了具有良好的生物相容性外,卵磷脂還可以與 PLLA、聚乳酸-羥基乙酸共聚物、聚己內酯等聚合物以任意比例混合[13]。在 PLLA/卵磷脂復合材料中,卵磷脂含量的增加可以增加材料的親水性,同時血管平滑肌細胞在卵磷脂含量 3%~7% 的共混膜材料上黏附和增殖程度有明顯提高[14]。Zhu 等[15]最先將卵磷脂與 PLLA 結合制備組織工程膜材料,以提升 PLLA 的親水性和生物相容性,同時保持 PLLA 的機械性能。Wang 等[16]制備了 PLLA/卵磷脂/納米羥基磷灰石多孔支架,卵磷脂的加入顯著增加了支架的親水性,細胞在含有卵磷脂的支架上增殖和黏附情況更好。同時卵磷脂含量增加也會導致支架的機械性能降低,但卵磷脂含量為 10% 的支架其機械性能仍然高于松質骨的強度。徐忠華等[8]研究了 PLLA/卵磷脂共混物膜的血液相容性,發現 PLLA 中卵磷脂的含量在 5%~10% 時材料的血液相容性最佳。
本實驗制備了具有開放孔和納米纖維結構的 PLLA/卵磷脂支架,通過廣角 X 射線衍射(X-ray diffraction,XRD)、差示掃描量熱法(differential scanning calorimetry,DSC)等方法研究卵磷脂的加入對 PLLA 相分離過程的影響,通過體外成骨細胞聯合培養法觀察細胞在支架上的增殖和分化情況,最后使用大鼠顱骨缺損修復模型觀察支架在體內的骨修復情況,旨在尋找一種較好的骨組織工程支架,并為其在骨修復的應用提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8 周齡雄性 SD 大鼠 24 只,體質量(280±10)g,由廣東藥科大學實驗動物中心提供。
小鼠 BMSCs 購自美國 ATCC 細胞庫,細胞編號 CRL-12424。細胞采用完全培養基(含 10%FBS 的 H-DMEM 培養基)于 37℃、5%CO2 環境下培養,每 2 天換液 1 次,待細胞密度達到約 90% 時,用 0.25% 胰蛋白酶消化,并按 1 ∶ 3 比例傳代培養。
PLLA(相對分子質量 1×105,黏度 2.4 dL/g;山東岱罡生物材料有限公司);卵磷脂(上海阿拉丁生化科技股份有限公司);二氧六環(分析純)、醋酸(分析純)(天津大茂化學試劑廠);去離子水、Vitamin C(分析純)、地塞米松(分析純)[西格瑪奧德里奇(上海)貿易有限公司];甘油磷酸鈉(分析純)(Merck 公司,德國);培養基、FBS、鏈霉素-青霉素雙抗(GIBCO 公司,美國);PBS(武漢博士德生物工程有限公司);細胞計數試劑盒 8(cell counting kit 8,CCK-8)試劑盒(同仁化學研究所,日本);ALP 活性檢測試劑盒(上海碧云天生物技術研究所);BCA 蛋白定量分析試劑盒[賽默飛世爾科技(中國)有限公司];RNA 抽提試劑盒(帶 DNA 過濾柱;廣州美基生物科技有限公司);反轉錄試劑盒(帶 gDNA Eraser 試劑盒;Takara 公司,日本);All-in-One qPCR Mix 試劑盒(GeneCopoeia 公司,美國)。JADE 5 軟件(MDI 公司,美國)。
Quanta 200 掃描電鏡(FEI 公司,荷蘭);Genesis G25EL4 冷凍干燥機(Virtis 公司,美國);D8 ADVANCE XRD 儀(Bruker 公司,德國);DIAMOND DSC 儀(PerkinElmer 公司,美國);Thermo3001 酶標儀[賽默飛世爾科技(中國)有限公司];ZKKS-MCT-Sharp-Ⅱ Micro-CT 系統(廣州中科愷盛醫療科技有限公司)。
1.2 PLLA/卵磷脂多孔支架制備
將 3%w/t PLLA 和不同比例(0、5%、10%、20%、30%、40%、50%)的卵磷脂溶于二氧六環與去離子水混合溶劑(混合比例為 88 ∶ 12)中,60℃ 下攪拌溶解 2 h 以得到均勻透明的溶液,隨后將溶液分裝并迅速轉移至–80℃ 冰箱中相分離 2 h;之后用去離子水在 4℃ 冰箱內進行溶劑置換,每天換水 3 次,持續 2 d;最后經過真空冷凍干燥得到含不同比例卵磷脂(0、5%、10%、20%、30%、40%、50%)的 PLLA/卵磷脂多孔支架(分別對應為 A、B、C、D、E、F、G 組)。
1.3 觀測指標
1.3.1 掃描電鏡觀察
取不同卵磷脂比例的 PLLA/卵磷脂多孔支架,經濺射鍍膜機噴金處理 120 s 后,加速電壓 5~15 kV 下采用掃描電鏡觀察支架表面形貌。
1.3.2 廣角 XRD 檢測
每組各取 6 個樣本,Cu 靶,Kα 線(λ=0.154 2 nm),管電壓 40 kV,管電流 40 mA;掃描角度 2θ=5~55°,掃描速率 0.2°/min。將得到的譜圖數據使用 JADE 5 軟件進行分析,并計算各樣品的結晶度。
1.3.3 DSC 檢測
參照文獻[17-18]方法進行 DSC 檢測并計算各樣品結晶度。每組各取 6 個樣本,氮氣環境,溫度范圍為室溫至 250℃,溫度變化速率為 10℃/min。通過以下公式計算樣品結晶度:χc=ΔHm/ΔHm0。其中 ΔHm 是測得的熱焓值,ΔHm0 是 100% 結晶的聚合物的熱焓值(PLLA 的 ΔHm0 為 135 J/g)。
1.3.4 吸水能力測試
每組各取 6 個樣本,制成直徑 10 mm、厚 10 mm 的圓柱體,測試前稱量并記錄干燥支架的質量(記為 md)。于 37℃ 環境下將支架置于 10 mL PBS 溶液中分別浸泡 5、15、30、60、120、180 min 后,再次稱量支架質量(記為 ms),稱量前用濾紙吸去支架表面殘留水分。通過以下公式計算吸水率:(ms–md)/md×100%。
1.3.5 細胞增殖能力檢測
每組各取 6 個樣本,制成直徑 10 mm、厚 2 mm 的圓柱形切片,滅菌后置于 48 孔板中,每孔接種 2×104 個第 5 代小鼠 BMSCs。培養 1、4、7 d 后,使用 CCK-8 法檢測細胞在各支架表面的增殖情況。
1.3.6 成骨分化能力實驗
每組各取 6 個樣本,制成直徑 10 mm、厚 2 mm 的圓柱形切片,滅菌后置于 48 孔板中,在每個支架上接種 3×104個第 5 代小鼠 BMSCs,采用完全培養基培養 1 d 后,改用成骨細胞誘導培養液(含 10%FBS、0.1 μmol/L 地塞米松、10 mmol/L 甘油磷酸鈉、0.05 mmol/L Vitamin C 的 H-DMEM 培養基)培養,每 2 天換液 1 次。參照文獻[19]方法,于培養 7、14 d 后檢測 ALP 活性。
1.3.7 動物體內骨修復實驗
取 24 只 SD 大鼠,用水合氯醛(0.1 mL/100 g)腹腔注射麻醉后,于頭部正中作長約 1.5 cm 切口顯露顱骨,在左右兩側對稱鉆孔形成雙側直徑均為 5 mm 的顱骨缺損。將大鼠分為 4 個大組,每組 6 只。第 1 大組左右側骨缺損處分別植入卵磷脂含量為 5%(A1 組)和 10%(B1 組)的 PLLA/卵磷脂多孔支架材料;第 2 大組左右側分別植入卵磷脂含量為 20%(C1 組)和 30%(D1 組)的 PLLA/卵磷脂多孔支架材料;第 3 大組左右側分別植入卵磷脂含量為 40%(E1 組)和 50%(F1 組)的 PLLA/卵磷脂多孔支架材料;第 4 大組左側植入鉆頭取下的顱骨(G1 組),右側不植入任何材料作為空白對照組(H1 組)。手術完成后縫合骨膜,逐層關閉切口。術后 3 d 每天注射 10 萬 U 青霉素。術后 12 周處死動物,取出顱骨,用 PBS 潤洗 3 次后,置于 4% 多聚甲醛溶液 4℃ 下浸泡 48 h。然后用 Micro-CT 對缺損處進行三維模型重建,并對缺損處的新生骨體積和骨礦物密度進行定量分析(G1 組為自體骨,未進行定量分析)。
1.4 統計學方法
采用臨床醫師統計學助手 V4.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 掃描電鏡觀察
支架內孔徑均為 300~500 μm,孔與孔之間具有很好的聯通性;支架內部則是孔徑為 20~30 μm 的小孔。隨著卵磷脂含量增加,PLLA/卵磷脂多孔支架仍然保持開放孔結構,支架孔徑略微變小,但仍保持在 300 μm 以上。A 組單純 PLLA 支架表面是由 100~500 nm 的 PLLA 納米纖維構成;隨著卵磷脂含量增加,PLLA 納米纖維的排列方式由扇形逐漸變得雜亂無章,同時 PLLA 纖維變粗。當卵磷脂含量為 50%(G 組)時,支架表面出現了少量片狀結構。見圖 1。
2.2 廣角 XRD 檢測
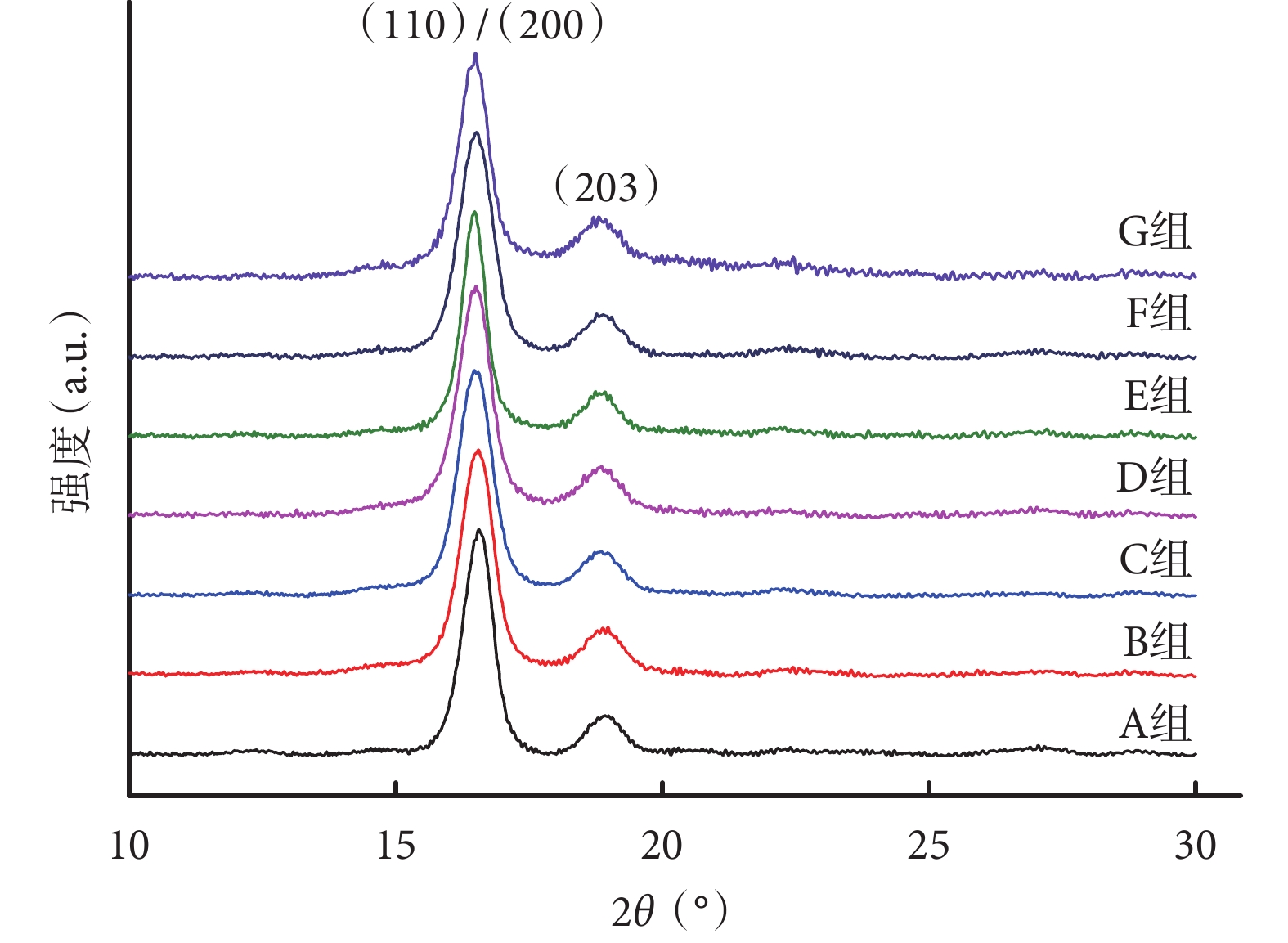
A 組單純 PLLA 支架的 XRD 圖譜出現了 2 個特征結晶峰(110)/(200)和(203),分別對應 2θ=16.4° 和 18.8°,是典型的 α’型晶體的結晶峰[20]。隨著卵磷脂含量的增加,XRD 譜圖中特征峰的位置并未出現明顯變化。見圖 2。通過 JADE 5 軟件計算得出,A、B、C、D、E、F、G 組支架的結晶度分別為 33.02%±1.78%、29.75%±2.92%、29.33%±3.79%、26.90%±2.11%、21.44%±4.62%、20.26%±2.78%、17.37%±1.91%,隨卵磷脂含量的升高而逐漸降低。
2.3 DSC 檢測
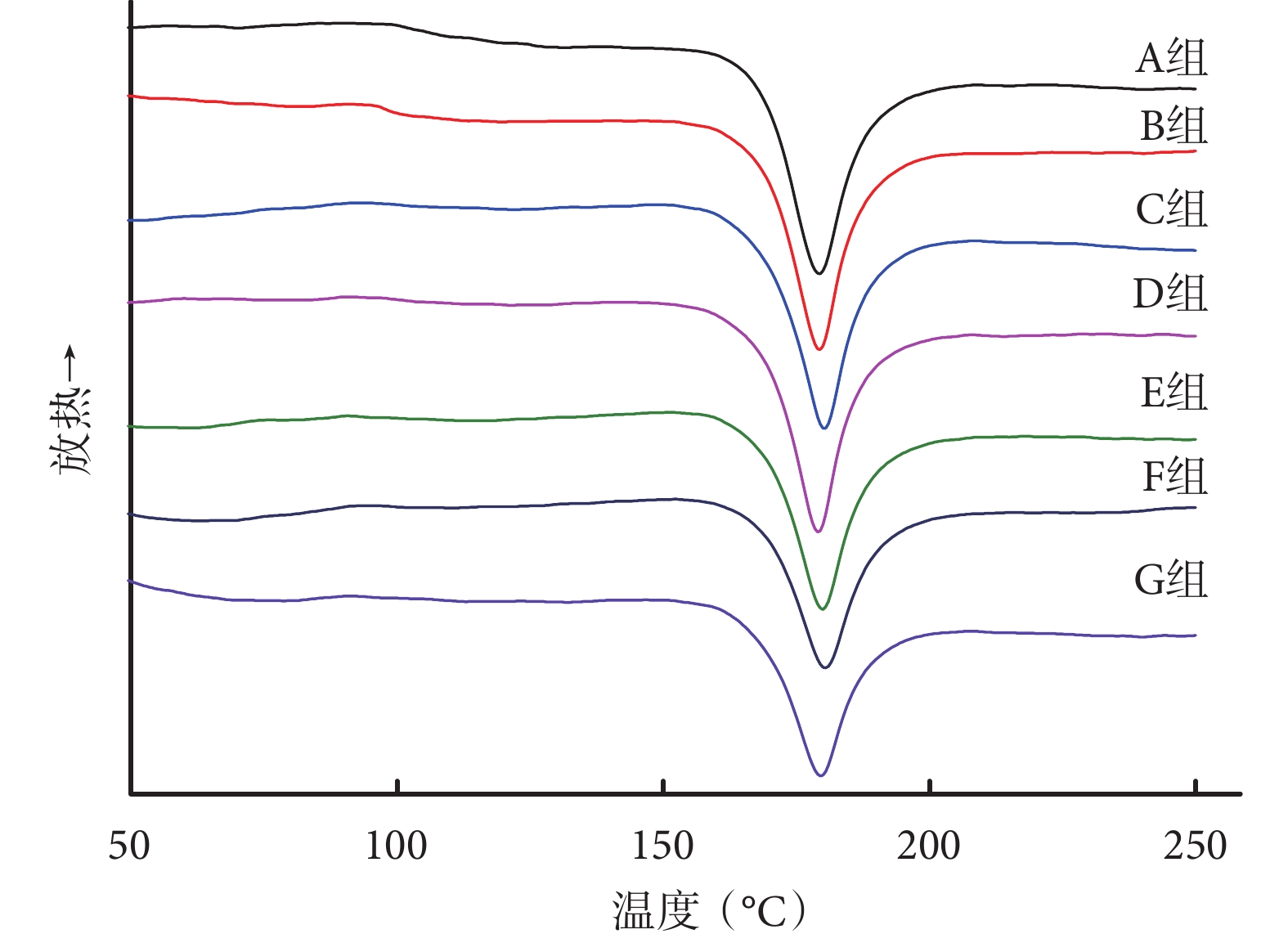
DSC 測得的 A、B、C、D、E、F、G 組支架的結晶度分別為 45.54%±3.04%、44.83%±3.63%、44.23%±2.02%、43.51%±3.37%、39.98%±1.23%、36.17%±2.05%、35.83%±1.77%,隨卵磷脂含量的升高而逐漸降低。雖然與廣角 XRD 測得的結晶度有少量偏差,但總體變化趨勢一致。見圖 3。
2.4 吸水能力測試
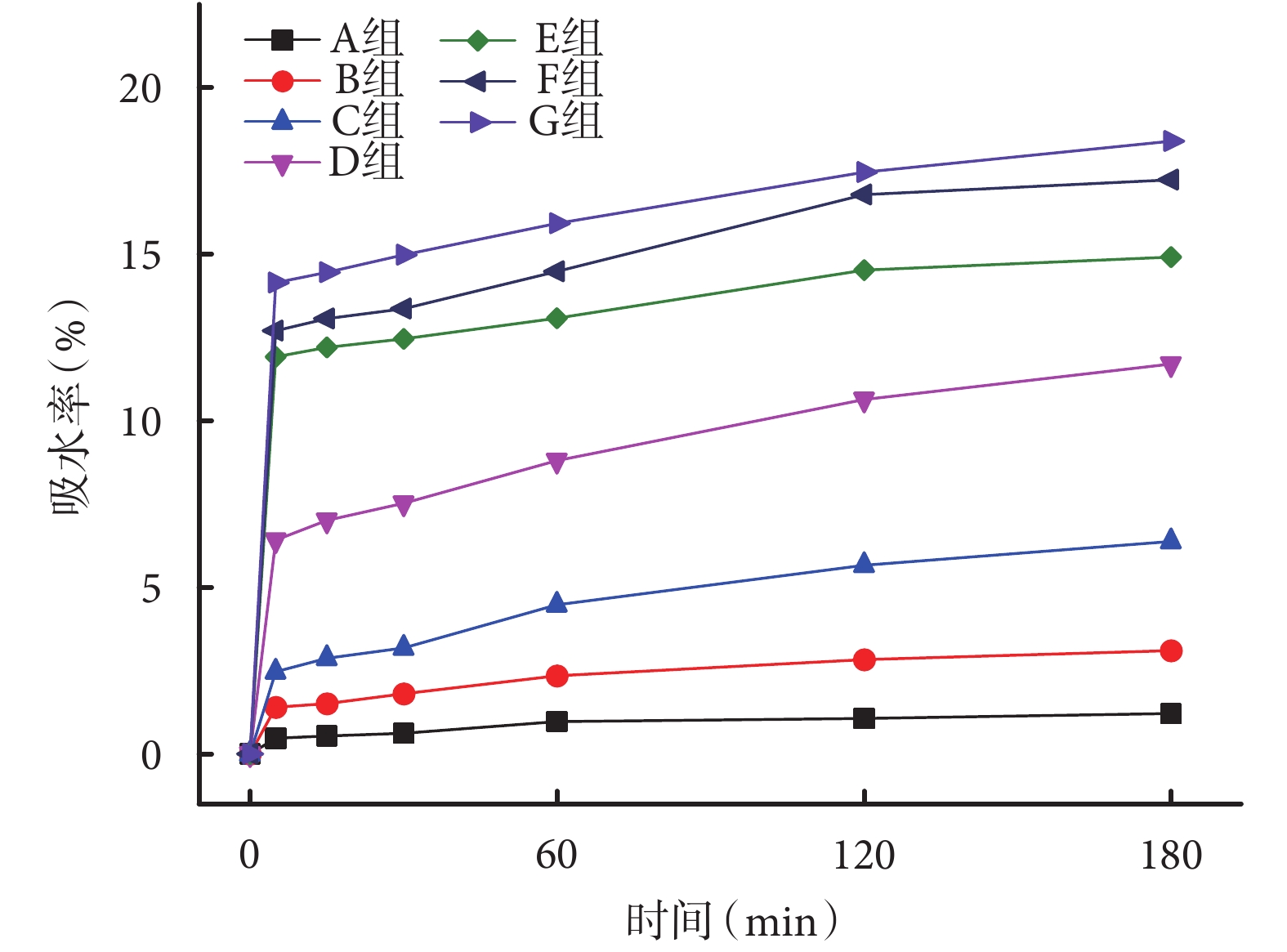
各時間點 A 組單純 PLLA 支架吸水率均很低;隨著卵磷脂含量增加,支架的吸水率呈逐漸增加趨勢。見圖 4。
2.5 細胞增殖能力檢測
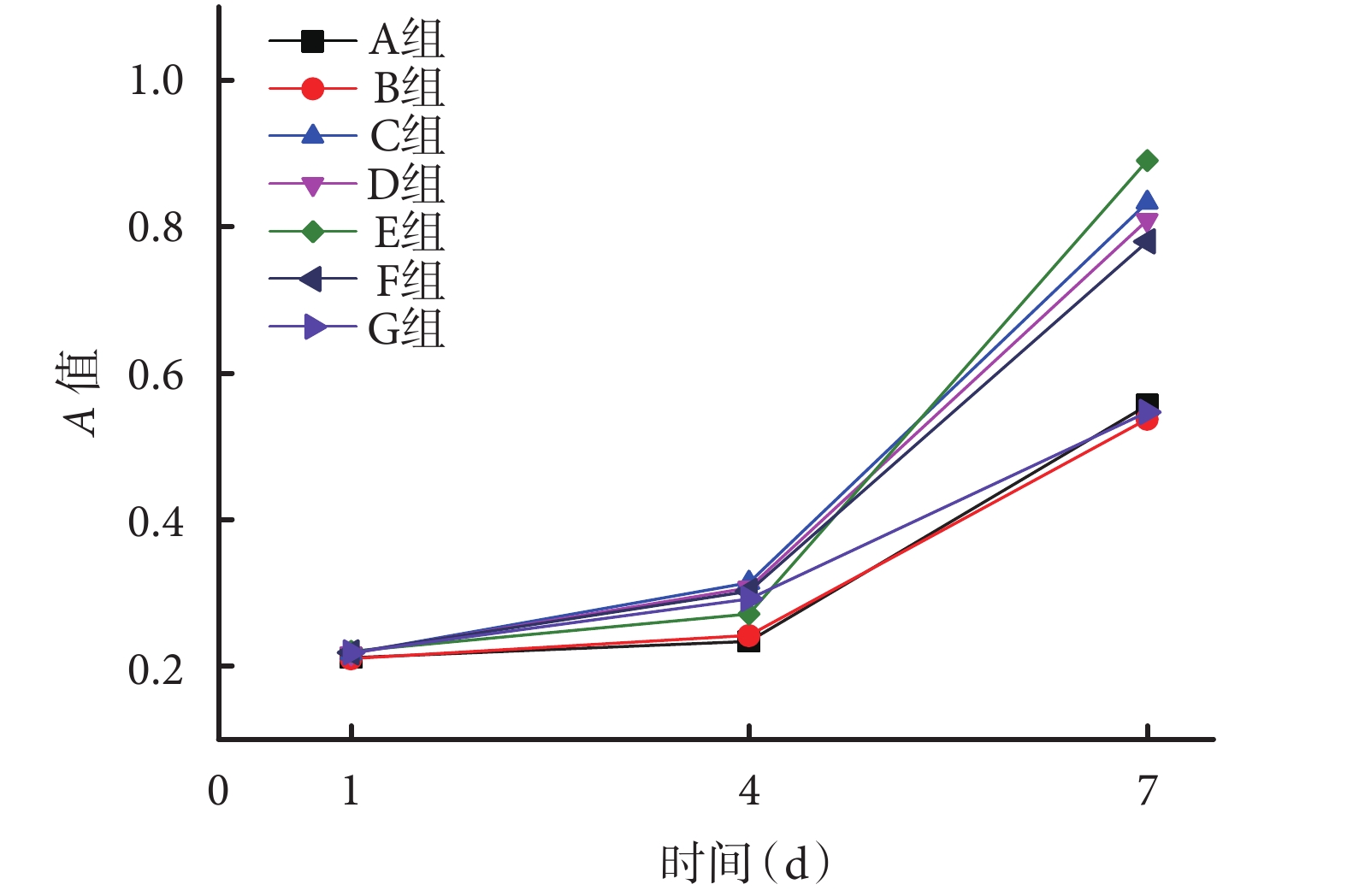
隨培養時間增加,BMSCs 在各組支架上均有明顯增殖。培養 1、4 d 時,各組吸光度(A)值比較差異均無統計學意義(P>0.05)。培養 7 d 時,隨卵磷脂含量增加,BMSCs 在支架上的增殖速率也隨之提高,但當卵磷脂含量超過 30% 時,細胞增殖速率出現下降趨勢;C、D、E、E 組A 值顯著高于 A、B、G 組,差異有統計學意義(P<0.05);C、D、E、F 組間比較差異無統計學意義(P>0.05)。見圖 5。
2.6 成骨分化實驗
成骨誘導 7 d,各組支架 ALP 活性比較差異無統計學意義(P>0.05)。14 d 時,隨卵磷脂含量增加,各組 ALP 活性出現了顯著差異,D、E、F、G 組 ALP 活性顯著高于 A、B、C 組,差異有統計學意義(P<0.05);D、E、F、G 組間比較差異無統計學意義(P>0.05)。見表 1。
 )
Table1.
The ALP activity at 7 and 14 days after osteogenic induc tion in each group (n=6,
)
Table1.
The ALP activity at 7 and 14 days after osteogenic induc tion in each group (n=6,
 )
)
2.7 動物體內骨修復實驗
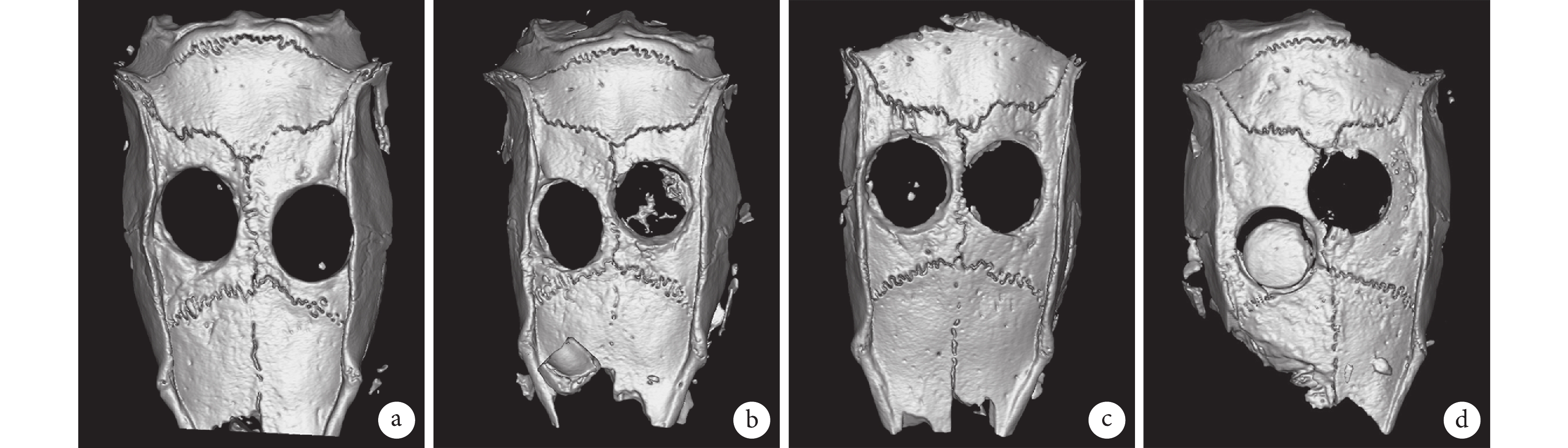
Micro-CT 檢測示,在不加入支架或支架中卵磷脂含量較低(A1、B1、C1、H1 組)的情況下,大鼠顱骨缺損僅在邊緣處有少量新骨生成;而當卵磷脂含量為 30%(D1 組)時,顱骨缺損內部有顯著新骨生成;之后繼續提高卵磷脂含量(E1、F1 組),PLLA/卵磷脂多孔支架的骨修復效果反而降低。見圖 6。新生骨體積和骨礦物密度結果也顯示出了同樣的趨勢,D1 組兩指標顯著高于其余各組,差異有統計學意義(P<0.05);其余各組間差異無統計學意義(P>0.05)。見表 2。
 )
Table2.
The bone volume and bone mineral density of each group at 12 weeks after operation (n=6,
)
Table2.
The bone volume and bone mineral density of each group at 12 weeks after operation (n=6,
 )
)
 圖1
各組支架掃描電鏡觀察
圖1
各組支架掃描電鏡觀察
左:×250 右:×20 k a. A 組;b. B 組;c. C 組;d. D 組;e. E 組;f. F 組;g. G 組(箭頭示片狀結構)
Figure1. SEM observation of scaffolds in each groupLeft: ×250 Right: ×20 k a. Group A; b. Group B; c. Group C; d. Group D; e. Group E; f. Group F; g. Group G (Arrows indicated the platelet-like structures)
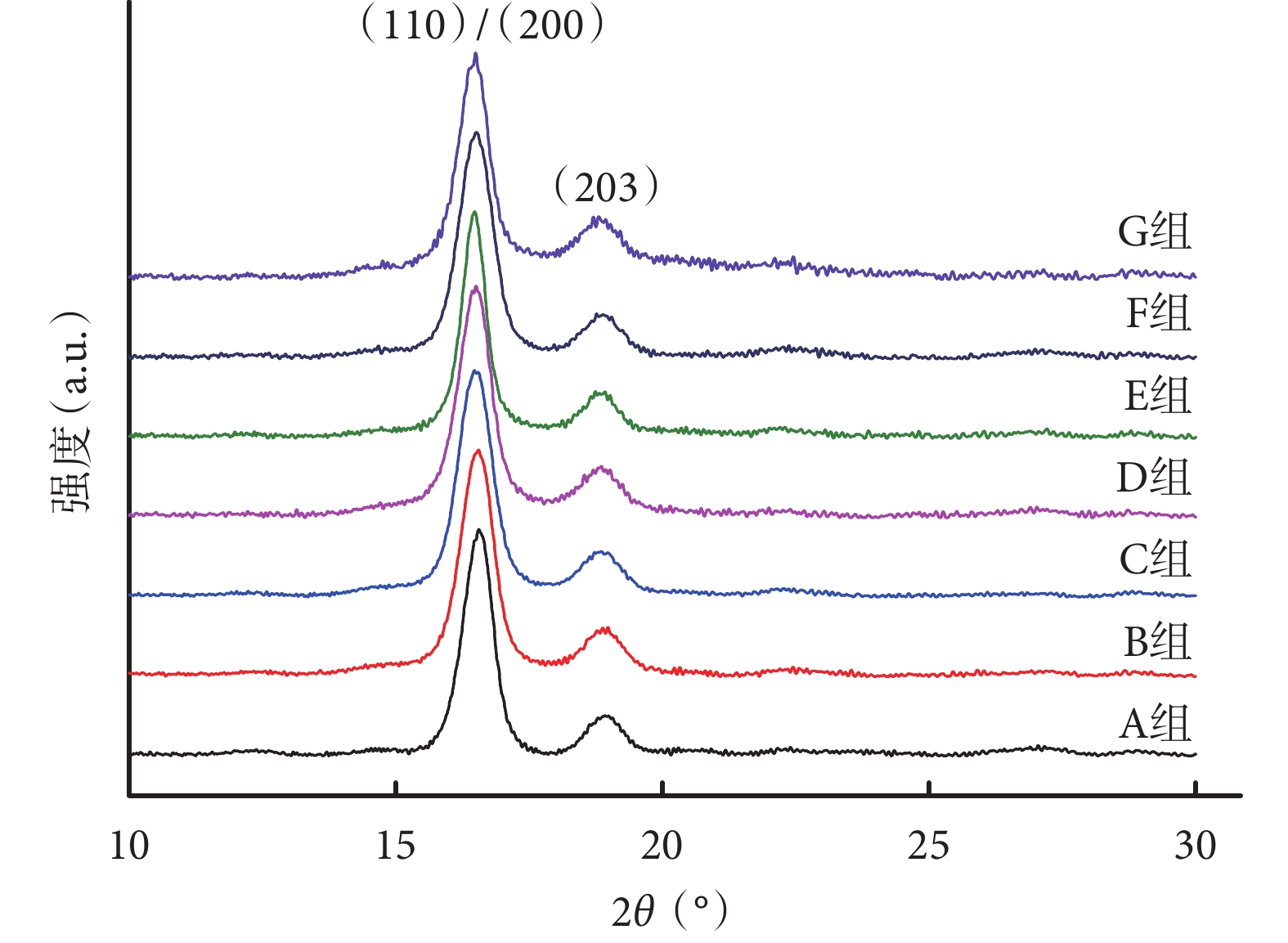 圖2
各組支架 XRD 圖譜
Figure2.
The XRD patterns of scaffolds in each group
圖2
各組支架 XRD 圖譜
Figure2.
The XRD patterns of scaffolds in each group
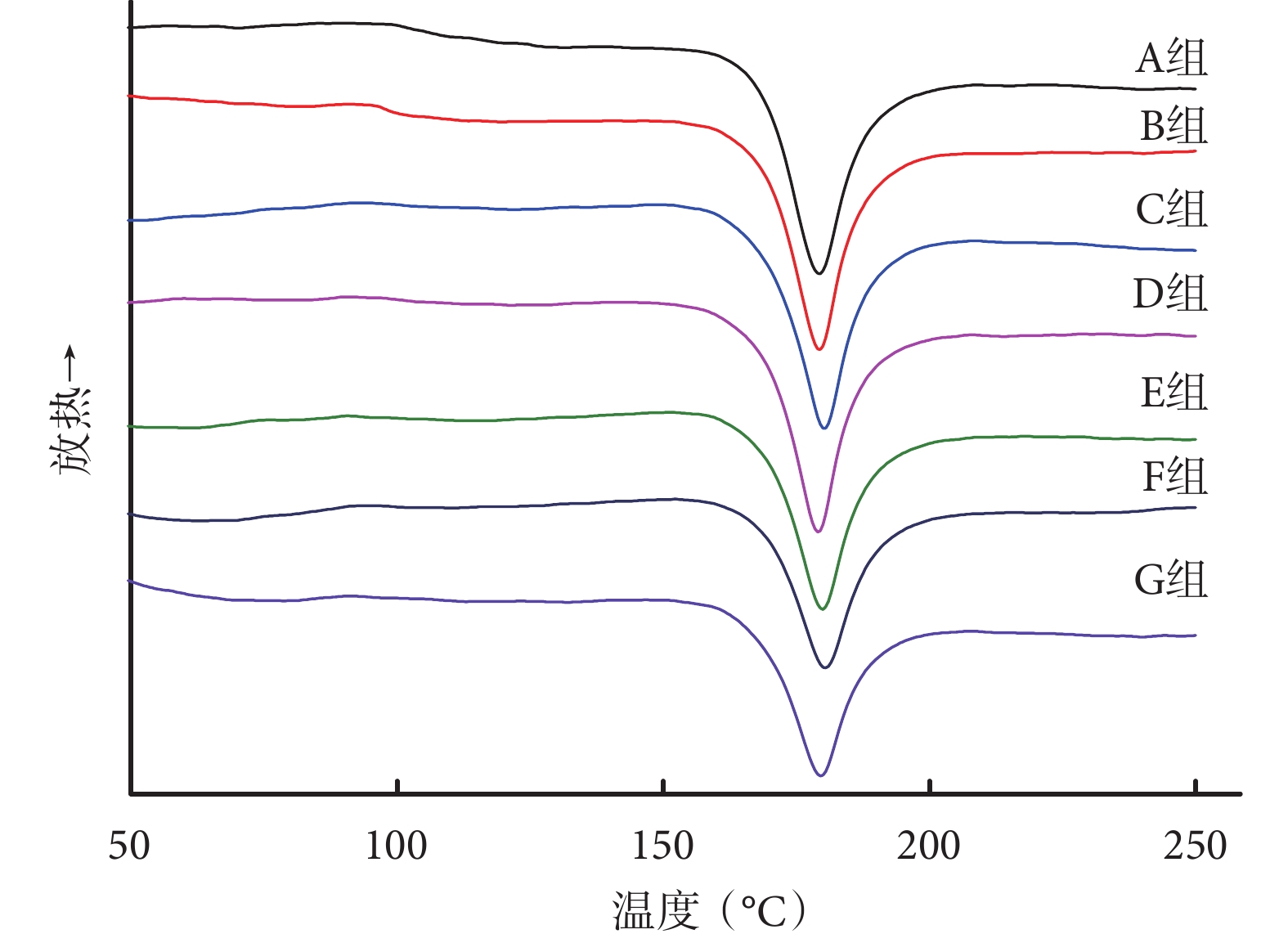 圖3
各組支架 DSC 圖譜
Figure3.
The DSC thermograms of scaffolds in each group
圖3
各組支架 DSC 圖譜
Figure3.
The DSC thermograms of scaffolds in each group
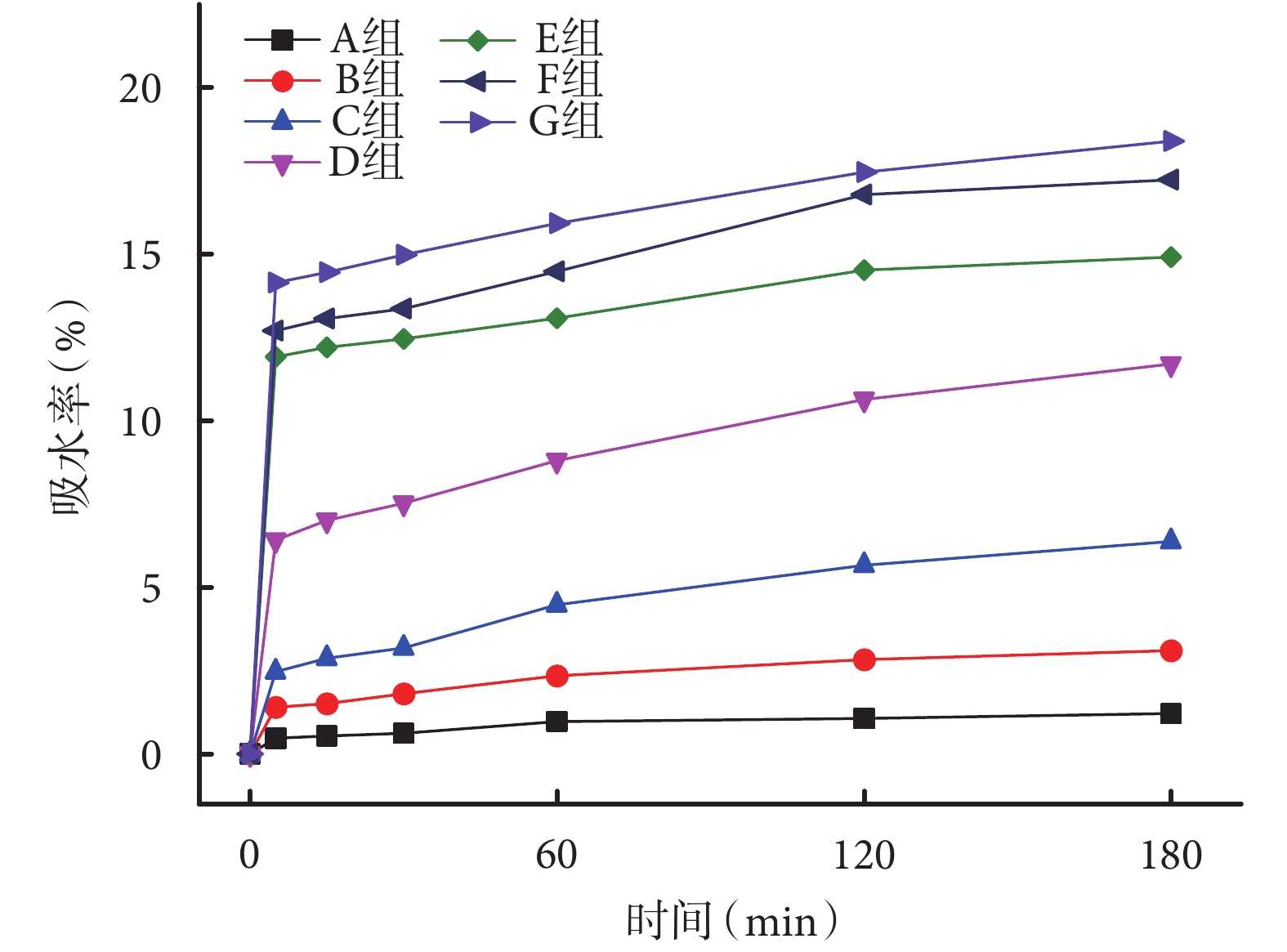 圖4
各組支架吸水率檢測
Figure4.
The water uptake ability of scaffolds in each group
圖4
各組支架吸水率檢測
Figure4.
The water uptake ability of scaffolds in each group
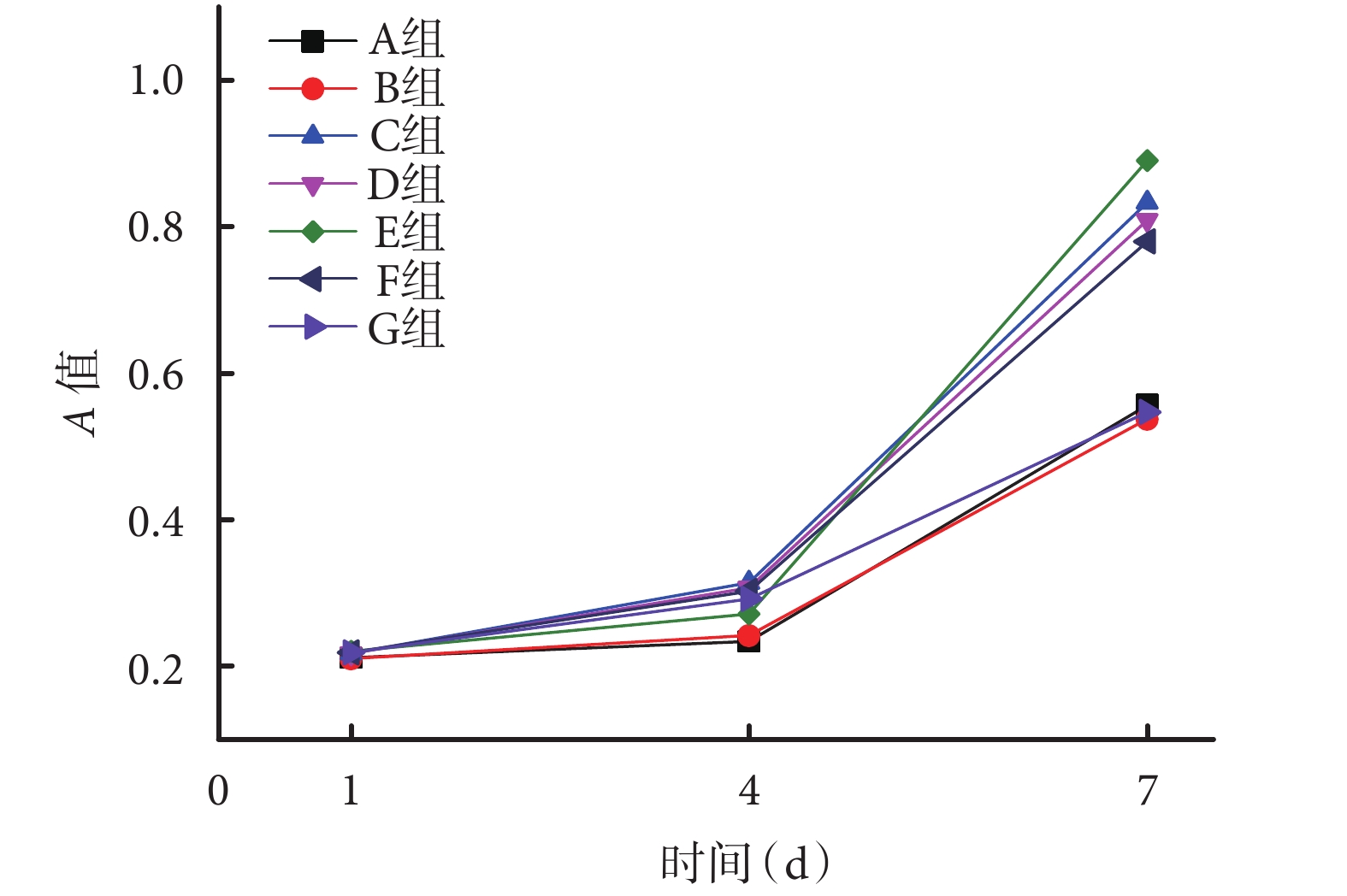 圖5
CCK-8 法檢測各組支架上 BMSCs 增殖情況
Figure5.
The proliferation of BMSCs on each scaffold detected by CCK-8 method
圖5
CCK-8 法檢測各組支架上 BMSCs 增殖情況
Figure5.
The proliferation of BMSCs on each scaffold detected by CCK-8 method
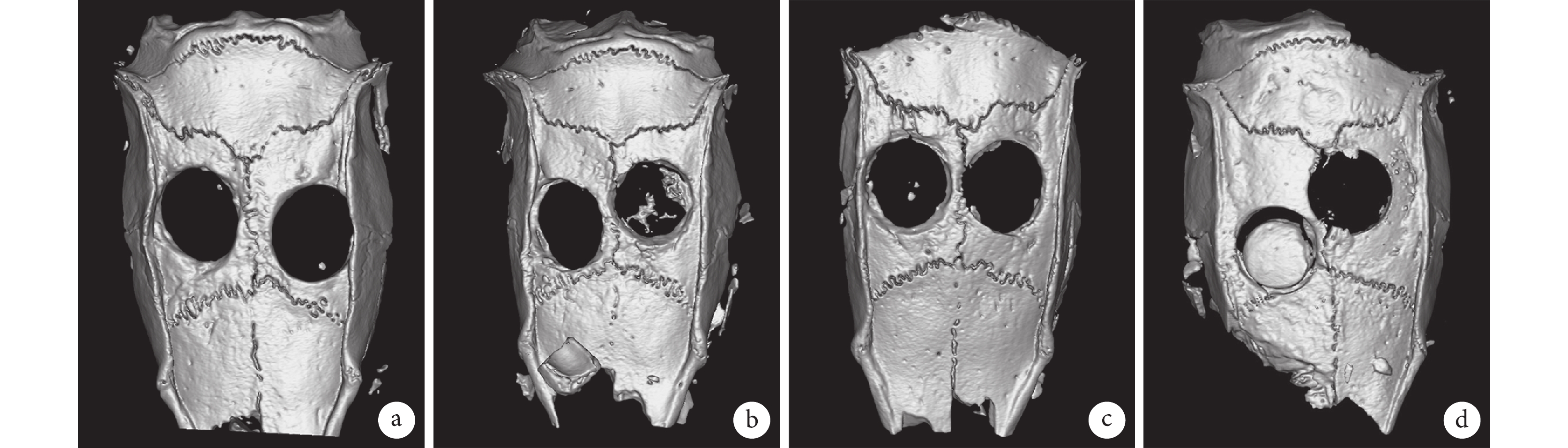 圖6
各組材料植入大鼠顱骨缺損處后 12 周 Micro-CT 檢測
圖6
各組材料植入大鼠顱骨缺損處后 12 周 Micro-CT 檢測
a. A1 組(左)和 B1 組(右);b. C1 組(左)和 D1 組(右);c. E1 組(左)和 F1 組(右);d. G1 組(左)和 H1 組(右)
Figure6. Micro-CT results of rat skull defect in each group after repairing for 12 weeksa. Group A1 (left) and group B1 (right); b. Group C1 (left) and group D1 (right); c. Group E1 (left) and group F1 (right); d. Group G1 (left) and group H1 (right)
3 討論
骨組織工程支架必須有足夠大的孔徑以保證骨修復效果,通常認為 200~400 μm 最適宜[21-22];支架內部孔與孔之間良好的聯通性也是組織順利修復的必要條件[23]。本研究中通過熱致相分離法制得的 PLLA/卵磷脂多孔支架具有合適的孔徑和開放的孔結構,有利于營養物質和代謝廢物的輸送。同時在支架的孔壁上具有納米纖維結構的 PLLA,既往研究中表明納米纖維結構有利于細胞在支架表面的黏附、增殖與分化[24-25]。在熱致相分離過程中,支架中孔的大小與結構主要受體系退火效果的影響[23]。在退火過程中富有機相與富溶劑相會各自相互融合,以降低兩相間的界面自由能。而卵磷脂作為一種兩親性的表面活性劑,能夠有效降低界面自由能,從而在相分離過程中穩定溶液體系,弱化退火效果的影響。因此隨著卵磷脂含量的增加,支架孔徑會略微減小。廣角 XRD 和 DSC 檢測結果顯示,卵磷脂的加入并未改變相分離過程中 PLLA 的結晶方式,仍然為 α’型晶體。但是在相分離過程中卵磷脂可能被包裹于 PLLA 鏈段中,從而起到塑化劑的作用,使 PLLA 鏈段的流動性增加,因此降低了支架中 PLLA 的結晶度[15]。
對于高分子多孔支架而言,親水性是一項非常重要的影響因素。親水性對細胞在支架上的分布以及氧氣和營養物質在支架內部的輸送都有很大影響[26-27]。本研究中,吸水率測試結果顯示,單純 PLLA 支架的吸水率很低,這是因為 PLLA 具有很強的疏水性,會導致其在組織工程中應用時細胞和血液很難進入到支架內部,限制了修復效果。而隨著卵磷脂含量的增加,支架的吸水量和吸水速度得到了大幅增強。卵磷脂的加入顯著改善了支架的親水性。
體外 CCK-8 細胞毒性實驗進一步驗證了卵磷脂的加入改善了支架的細胞相容性,更有利于細胞黏附。但是當卵磷脂含量超過 30% 時,細胞在支架上的增長速率反而出現了下降趨勢。同時在體外成骨分化實驗中,加入卵磷脂后,支架上細胞的 ALP 活性和增長速率均大于對照組。而隨著卵磷脂含量的增加,PLLA/卵磷脂多孔支架之間的 ALP 活性也出現了顯著性差異,說明增加支架中卵磷脂的含量更有利于細胞成骨分化。在本研究的 SD 大鼠顱骨缺損修復實驗中,Micro-CT 檢測結果與體外細胞實驗結果一致,30% 卵磷脂含量制備的 PLLA/卵磷脂多孔支架的新生骨體積和骨礦物密度與其他組比較差異均有統計學意義,說明適當的卵磷脂含量能有效促進缺損處新骨的生成,但是過量的卵磷脂則會抑制缺損處的組織修復。Xu 等[11]制備了 PLLA/卵磷脂膜并進行了細胞毒性研究,發現卵磷脂容易被氧化形成過氧化氫液體,從而對細胞產生毒性。因此,支架制備過程中卵磷脂用量太多反而不利于細胞生長和組織修復。
綜上述,本研究結果顯示,支架中加入卵磷脂首先可以大幅提升了 PLLA 支架的親水性,同時使 PLLA 支架孔徑減小,支架表面出現少量片狀結晶;其次,還可以降低支架中 PLLA 的結晶度;最后,適宜含量的卵磷脂還能促進細胞在 PLLA 支架上的增殖,提升支架的成骨分化性能和骨修復性能。
在骨組織工程中,支架作為細胞外基質,為細胞的黏附、生長、增殖和遷移提供適當的環境,同時還需要引導新組織的再生[1-2]。因此,支架除了需有良好的生物相容性、合適的孔徑、孔隙率和強度外,還需要有適當的表面性能以便于細胞在支架上黏附、增殖和分化等[3-4]。左旋聚乳酸[poly(L-lactic acid),PLLA]具有良好的生物相容性,已被美國食品與藥品監督管理局(FDA)允許用在外科手術縫合線、微膠囊、植入材料中[5]。但是 PLLA 親水性比較差,分子鏈段上缺乏與細胞識別因子或其他生物活性分子相鍵合的官能團,不利于細胞在其表面黏附與生長,同時在生物礦化過程中缺乏成核位點,較難礦化[6-7]。
卵磷脂是由磷脂質和中性脂質構成的天然混合物。其中磷脂質是細胞膜的主要成分[8],其化學結構中含有親水的磷酸基極性基團和疏水的脂肪酰基長鏈,因此具有兩親性質,作為表面活性劑卵磷脂可以有效降低溶液的表面張力[9]。在之前的研究中,已經發現卵磷脂能夠作為成核位點促進骨礦物的增長[10-11]。Park 等[12]利用卵磷脂作為表面活性劑,成功制備了表面光滑、一致性好的海藻酸鈉/聚氧乙烯復合納米纖維。除了具有良好的生物相容性外,卵磷脂還可以與 PLLA、聚乳酸-羥基乙酸共聚物、聚己內酯等聚合物以任意比例混合[13]。在 PLLA/卵磷脂復合材料中,卵磷脂含量的增加可以增加材料的親水性,同時血管平滑肌細胞在卵磷脂含量 3%~7% 的共混膜材料上黏附和增殖程度有明顯提高[14]。Zhu 等[15]最先將卵磷脂與 PLLA 結合制備組織工程膜材料,以提升 PLLA 的親水性和生物相容性,同時保持 PLLA 的機械性能。Wang 等[16]制備了 PLLA/卵磷脂/納米羥基磷灰石多孔支架,卵磷脂的加入顯著增加了支架的親水性,細胞在含有卵磷脂的支架上增殖和黏附情況更好。同時卵磷脂含量增加也會導致支架的機械性能降低,但卵磷脂含量為 10% 的支架其機械性能仍然高于松質骨的強度。徐忠華等[8]研究了 PLLA/卵磷脂共混物膜的血液相容性,發現 PLLA 中卵磷脂的含量在 5%~10% 時材料的血液相容性最佳。
本實驗制備了具有開放孔和納米纖維結構的 PLLA/卵磷脂支架,通過廣角 X 射線衍射(X-ray diffraction,XRD)、差示掃描量熱法(differential scanning calorimetry,DSC)等方法研究卵磷脂的加入對 PLLA 相分離過程的影響,通過體外成骨細胞聯合培養法觀察細胞在支架上的增殖和分化情況,最后使用大鼠顱骨缺損修復模型觀察支架在體內的骨修復情況,旨在尋找一種較好的骨組織工程支架,并為其在骨修復的應用提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8 周齡雄性 SD 大鼠 24 只,體質量(280±10)g,由廣東藥科大學實驗動物中心提供。
小鼠 BMSCs 購自美國 ATCC 細胞庫,細胞編號 CRL-12424。細胞采用完全培養基(含 10%FBS 的 H-DMEM 培養基)于 37℃、5%CO2 環境下培養,每 2 天換液 1 次,待細胞密度達到約 90% 時,用 0.25% 胰蛋白酶消化,并按 1 ∶ 3 比例傳代培養。
PLLA(相對分子質量 1×105,黏度 2.4 dL/g;山東岱罡生物材料有限公司);卵磷脂(上海阿拉丁生化科技股份有限公司);二氧六環(分析純)、醋酸(分析純)(天津大茂化學試劑廠);去離子水、Vitamin C(分析純)、地塞米松(分析純)[西格瑪奧德里奇(上海)貿易有限公司];甘油磷酸鈉(分析純)(Merck 公司,德國);培養基、FBS、鏈霉素-青霉素雙抗(GIBCO 公司,美國);PBS(武漢博士德生物工程有限公司);細胞計數試劑盒 8(cell counting kit 8,CCK-8)試劑盒(同仁化學研究所,日本);ALP 活性檢測試劑盒(上海碧云天生物技術研究所);BCA 蛋白定量分析試劑盒[賽默飛世爾科技(中國)有限公司];RNA 抽提試劑盒(帶 DNA 過濾柱;廣州美基生物科技有限公司);反轉錄試劑盒(帶 gDNA Eraser 試劑盒;Takara 公司,日本);All-in-One qPCR Mix 試劑盒(GeneCopoeia 公司,美國)。JADE 5 軟件(MDI 公司,美國)。
Quanta 200 掃描電鏡(FEI 公司,荷蘭);Genesis G25EL4 冷凍干燥機(Virtis 公司,美國);D8 ADVANCE XRD 儀(Bruker 公司,德國);DIAMOND DSC 儀(PerkinElmer 公司,美國);Thermo3001 酶標儀[賽默飛世爾科技(中國)有限公司];ZKKS-MCT-Sharp-Ⅱ Micro-CT 系統(廣州中科愷盛醫療科技有限公司)。
1.2 PLLA/卵磷脂多孔支架制備
將 3%w/t PLLA 和不同比例(0、5%、10%、20%、30%、40%、50%)的卵磷脂溶于二氧六環與去離子水混合溶劑(混合比例為 88 ∶ 12)中,60℃ 下攪拌溶解 2 h 以得到均勻透明的溶液,隨后將溶液分裝并迅速轉移至–80℃ 冰箱中相分離 2 h;之后用去離子水在 4℃ 冰箱內進行溶劑置換,每天換水 3 次,持續 2 d;最后經過真空冷凍干燥得到含不同比例卵磷脂(0、5%、10%、20%、30%、40%、50%)的 PLLA/卵磷脂多孔支架(分別對應為 A、B、C、D、E、F、G 組)。
1.3 觀測指標
1.3.1 掃描電鏡觀察
取不同卵磷脂比例的 PLLA/卵磷脂多孔支架,經濺射鍍膜機噴金處理 120 s 后,加速電壓 5~15 kV 下采用掃描電鏡觀察支架表面形貌。
1.3.2 廣角 XRD 檢測
每組各取 6 個樣本,Cu 靶,Kα 線(λ=0.154 2 nm),管電壓 40 kV,管電流 40 mA;掃描角度 2θ=5~55°,掃描速率 0.2°/min。將得到的譜圖數據使用 JADE 5 軟件進行分析,并計算各樣品的結晶度。
1.3.3 DSC 檢測
參照文獻[17-18]方法進行 DSC 檢測并計算各樣品結晶度。每組各取 6 個樣本,氮氣環境,溫度范圍為室溫至 250℃,溫度變化速率為 10℃/min。通過以下公式計算樣品結晶度:χc=ΔHm/ΔHm0。其中 ΔHm 是測得的熱焓值,ΔHm0 是 100% 結晶的聚合物的熱焓值(PLLA 的 ΔHm0 為 135 J/g)。
1.3.4 吸水能力測試
每組各取 6 個樣本,制成直徑 10 mm、厚 10 mm 的圓柱體,測試前稱量并記錄干燥支架的質量(記為 md)。于 37℃ 環境下將支架置于 10 mL PBS 溶液中分別浸泡 5、15、30、60、120、180 min 后,再次稱量支架質量(記為 ms),稱量前用濾紙吸去支架表面殘留水分。通過以下公式計算吸水率:(ms–md)/md×100%。
1.3.5 細胞增殖能力檢測
每組各取 6 個樣本,制成直徑 10 mm、厚 2 mm 的圓柱形切片,滅菌后置于 48 孔板中,每孔接種 2×104 個第 5 代小鼠 BMSCs。培養 1、4、7 d 后,使用 CCK-8 法檢測細胞在各支架表面的增殖情況。
1.3.6 成骨分化能力實驗
每組各取 6 個樣本,制成直徑 10 mm、厚 2 mm 的圓柱形切片,滅菌后置于 48 孔板中,在每個支架上接種 3×104個第 5 代小鼠 BMSCs,采用完全培養基培養 1 d 后,改用成骨細胞誘導培養液(含 10%FBS、0.1 μmol/L 地塞米松、10 mmol/L 甘油磷酸鈉、0.05 mmol/L Vitamin C 的 H-DMEM 培養基)培養,每 2 天換液 1 次。參照文獻[19]方法,于培養 7、14 d 后檢測 ALP 活性。
1.3.7 動物體內骨修復實驗
取 24 只 SD 大鼠,用水合氯醛(0.1 mL/100 g)腹腔注射麻醉后,于頭部正中作長約 1.5 cm 切口顯露顱骨,在左右兩側對稱鉆孔形成雙側直徑均為 5 mm 的顱骨缺損。將大鼠分為 4 個大組,每組 6 只。第 1 大組左右側骨缺損處分別植入卵磷脂含量為 5%(A1 組)和 10%(B1 組)的 PLLA/卵磷脂多孔支架材料;第 2 大組左右側分別植入卵磷脂含量為 20%(C1 組)和 30%(D1 組)的 PLLA/卵磷脂多孔支架材料;第 3 大組左右側分別植入卵磷脂含量為 40%(E1 組)和 50%(F1 組)的 PLLA/卵磷脂多孔支架材料;第 4 大組左側植入鉆頭取下的顱骨(G1 組),右側不植入任何材料作為空白對照組(H1 組)。手術完成后縫合骨膜,逐層關閉切口。術后 3 d 每天注射 10 萬 U 青霉素。術后 12 周處死動物,取出顱骨,用 PBS 潤洗 3 次后,置于 4% 多聚甲醛溶液 4℃ 下浸泡 48 h。然后用 Micro-CT 對缺損處進行三維模型重建,并對缺損處的新生骨體積和骨礦物密度進行定量分析(G1 組為自體骨,未進行定量分析)。
1.4 統計學方法
采用臨床醫師統計學助手 V4.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 掃描電鏡觀察
支架內孔徑均為 300~500 μm,孔與孔之間具有很好的聯通性;支架內部則是孔徑為 20~30 μm 的小孔。隨著卵磷脂含量增加,PLLA/卵磷脂多孔支架仍然保持開放孔結構,支架孔徑略微變小,但仍保持在 300 μm 以上。A 組單純 PLLA 支架表面是由 100~500 nm 的 PLLA 納米纖維構成;隨著卵磷脂含量增加,PLLA 納米纖維的排列方式由扇形逐漸變得雜亂無章,同時 PLLA 纖維變粗。當卵磷脂含量為 50%(G 組)時,支架表面出現了少量片狀結構。見圖 1。
2.2 廣角 XRD 檢測
A 組單純 PLLA 支架的 XRD 圖譜出現了 2 個特征結晶峰(110)/(200)和(203),分別對應 2θ=16.4° 和 18.8°,是典型的 α’型晶體的結晶峰[20]。隨著卵磷脂含量的增加,XRD 譜圖中特征峰的位置并未出現明顯變化。見圖 2。通過 JADE 5 軟件計算得出,A、B、C、D、E、F、G 組支架的結晶度分別為 33.02%±1.78%、29.75%±2.92%、29.33%±3.79%、26.90%±2.11%、21.44%±4.62%、20.26%±2.78%、17.37%±1.91%,隨卵磷脂含量的升高而逐漸降低。
2.3 DSC 檢測
DSC 測得的 A、B、C、D、E、F、G 組支架的結晶度分別為 45.54%±3.04%、44.83%±3.63%、44.23%±2.02%、43.51%±3.37%、39.98%±1.23%、36.17%±2.05%、35.83%±1.77%,隨卵磷脂含量的升高而逐漸降低。雖然與廣角 XRD 測得的結晶度有少量偏差,但總體變化趨勢一致。見圖 3。
2.4 吸水能力測試
各時間點 A 組單純 PLLA 支架吸水率均很低;隨著卵磷脂含量增加,支架的吸水率呈逐漸增加趨勢。見圖 4。
2.5 細胞增殖能力檢測
隨培養時間增加,BMSCs 在各組支架上均有明顯增殖。培養 1、4 d 時,各組吸光度(A)值比較差異均無統計學意義(P>0.05)。培養 7 d 時,隨卵磷脂含量增加,BMSCs 在支架上的增殖速率也隨之提高,但當卵磷脂含量超過 30% 時,細胞增殖速率出現下降趨勢;C、D、E、E 組A 值顯著高于 A、B、G 組,差異有統計學意義(P<0.05);C、D、E、F 組間比較差異無統計學意義(P>0.05)。見圖 5。
2.6 成骨分化實驗
成骨誘導 7 d,各組支架 ALP 活性比較差異無統計學意義(P>0.05)。14 d 時,隨卵磷脂含量增加,各組 ALP 活性出現了顯著差異,D、E、F、G 組 ALP 活性顯著高于 A、B、C 組,差異有統計學意義(P<0.05);D、E、F、G 組間比較差異無統計學意義(P>0.05)。見表 1。
 )
Table1.
The ALP activity at 7 and 14 days after osteogenic induc tion in each group (n=6,
)
Table1.
The ALP activity at 7 and 14 days after osteogenic induc tion in each group (n=6,
 )
)
2.7 動物體內骨修復實驗
Micro-CT 檢測示,在不加入支架或支架中卵磷脂含量較低(A1、B1、C1、H1 組)的情況下,大鼠顱骨缺損僅在邊緣處有少量新骨生成;而當卵磷脂含量為 30%(D1 組)時,顱骨缺損內部有顯著新骨生成;之后繼續提高卵磷脂含量(E1、F1 組),PLLA/卵磷脂多孔支架的骨修復效果反而降低。見圖 6。新生骨體積和骨礦物密度結果也顯示出了同樣的趨勢,D1 組兩指標顯著高于其余各組,差異有統計學意義(P<0.05);其余各組間差異無統計學意義(P>0.05)。見表 2。
 )
Table2.
The bone volume and bone mineral density of each group at 12 weeks after operation (n=6,
)
Table2.
The bone volume and bone mineral density of each group at 12 weeks after operation (n=6,
 )
)
 圖1
各組支架掃描電鏡觀察
圖1
各組支架掃描電鏡觀察
左:×250 右:×20 k a. A 組;b. B 組;c. C 組;d. D 組;e. E 組;f. F 組;g. G 組(箭頭示片狀結構)
Figure1. SEM observation of scaffolds in each groupLeft: ×250 Right: ×20 k a. Group A; b. Group B; c. Group C; d. Group D; e. Group E; f. Group F; g. Group G (Arrows indicated the platelet-like structures)
 圖2
各組支架 XRD 圖譜
Figure2.
The XRD patterns of scaffolds in each group
圖2
各組支架 XRD 圖譜
Figure2.
The XRD patterns of scaffolds in each group
 圖3
各組支架 DSC 圖譜
Figure3.
The DSC thermograms of scaffolds in each group
圖3
各組支架 DSC 圖譜
Figure3.
The DSC thermograms of scaffolds in each group
 圖4
各組支架吸水率檢測
Figure4.
The water uptake ability of scaffolds in each group
圖4
各組支架吸水率檢測
Figure4.
The water uptake ability of scaffolds in each group
 圖5
CCK-8 法檢測各組支架上 BMSCs 增殖情況
Figure5.
The proliferation of BMSCs on each scaffold detected by CCK-8 method
圖5
CCK-8 法檢測各組支架上 BMSCs 增殖情況
Figure5.
The proliferation of BMSCs on each scaffold detected by CCK-8 method
 圖6
各組材料植入大鼠顱骨缺損處后 12 周 Micro-CT 檢測
圖6
各組材料植入大鼠顱骨缺損處后 12 周 Micro-CT 檢測
a. A1 組(左)和 B1 組(右);b. C1 組(左)和 D1 組(右);c. E1 組(左)和 F1 組(右);d. G1 組(左)和 H1 組(右)
Figure6. Micro-CT results of rat skull defect in each group after repairing for 12 weeksa. Group A1 (left) and group B1 (right); b. Group C1 (left) and group D1 (right); c. Group E1 (left) and group F1 (right); d. Group G1 (left) and group H1 (right)
3 討論
骨組織工程支架必須有足夠大的孔徑以保證骨修復效果,通常認為 200~400 μm 最適宜[21-22];支架內部孔與孔之間良好的聯通性也是組織順利修復的必要條件[23]。本研究中通過熱致相分離法制得的 PLLA/卵磷脂多孔支架具有合適的孔徑和開放的孔結構,有利于營養物質和代謝廢物的輸送。同時在支架的孔壁上具有納米纖維結構的 PLLA,既往研究中表明納米纖維結構有利于細胞在支架表面的黏附、增殖與分化[24-25]。在熱致相分離過程中,支架中孔的大小與結構主要受體系退火效果的影響[23]。在退火過程中富有機相與富溶劑相會各自相互融合,以降低兩相間的界面自由能。而卵磷脂作為一種兩親性的表面活性劑,能夠有效降低界面自由能,從而在相分離過程中穩定溶液體系,弱化退火效果的影響。因此隨著卵磷脂含量的增加,支架孔徑會略微減小。廣角 XRD 和 DSC 檢測結果顯示,卵磷脂的加入并未改變相分離過程中 PLLA 的結晶方式,仍然為 α’型晶體。但是在相分離過程中卵磷脂可能被包裹于 PLLA 鏈段中,從而起到塑化劑的作用,使 PLLA 鏈段的流動性增加,因此降低了支架中 PLLA 的結晶度[15]。
對于高分子多孔支架而言,親水性是一項非常重要的影響因素。親水性對細胞在支架上的分布以及氧氣和營養物質在支架內部的輸送都有很大影響[26-27]。本研究中,吸水率測試結果顯示,單純 PLLA 支架的吸水率很低,這是因為 PLLA 具有很強的疏水性,會導致其在組織工程中應用時細胞和血液很難進入到支架內部,限制了修復效果。而隨著卵磷脂含量的增加,支架的吸水量和吸水速度得到了大幅增強。卵磷脂的加入顯著改善了支架的親水性。
體外 CCK-8 細胞毒性實驗進一步驗證了卵磷脂的加入改善了支架的細胞相容性,更有利于細胞黏附。但是當卵磷脂含量超過 30% 時,細胞在支架上的增長速率反而出現了下降趨勢。同時在體外成骨分化實驗中,加入卵磷脂后,支架上細胞的 ALP 活性和增長速率均大于對照組。而隨著卵磷脂含量的增加,PLLA/卵磷脂多孔支架之間的 ALP 活性也出現了顯著性差異,說明增加支架中卵磷脂的含量更有利于細胞成骨分化。在本研究的 SD 大鼠顱骨缺損修復實驗中,Micro-CT 檢測結果與體外細胞實驗結果一致,30% 卵磷脂含量制備的 PLLA/卵磷脂多孔支架的新生骨體積和骨礦物密度與其他組比較差異均有統計學意義,說明適當的卵磷脂含量能有效促進缺損處新骨的生成,但是過量的卵磷脂則會抑制缺損處的組織修復。Xu 等[11]制備了 PLLA/卵磷脂膜并進行了細胞毒性研究,發現卵磷脂容易被氧化形成過氧化氫液體,從而對細胞產生毒性。因此,支架制備過程中卵磷脂用量太多反而不利于細胞生長和組織修復。
綜上述,本研究結果顯示,支架中加入卵磷脂首先可以大幅提升了 PLLA 支架的親水性,同時使 PLLA 支架孔徑減小,支架表面出現少量片狀結晶;其次,還可以降低支架中 PLLA 的結晶度;最后,適宜含量的卵磷脂還能促進細胞在 PLLA 支架上的增殖,提升支架的成骨分化性能和骨修復性能。