引用本文: 楊繼琛, 邱良婷, 黃云超, 陳雅, 饒孫銀, 阮文鵬, 趙光強, 葉聯華. 表皮葡萄球菌附屬基因調節子 C 特異結合多肽對聚氯乙烯材料表面細菌生物膜形成作用的體外研究. 中國修復重建外科雜志, 2019, 33(3): 349-355. doi: 10.7507/1002-1892.201806110 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
臨床上常應用由聚氯乙烯(polyvinyl chloride,PVC)制備的材料,如人工心臟瓣膜、氣管插管、靜脈導管等,這些材料在體內使用過程中或植入人體后可能發生感染。表皮葡萄球菌作為一種條件致病菌,可黏附在這些材料表面形成細菌生物膜[1-3],有效抵御抗生素滲透,抵抗機體防御反應,導致感染難以控制[4-5]。因此,探討有效的表皮葡萄球菌感染防治方法成為研究焦點。
生物膜形成需要多種因子參與,表皮葡萄球菌附屬基因調節子(accessory gene regulator,agr)介導的群體密度感應系統是最重要的毒力調節因子,參與表皮葡萄球菌生物膜的形成、分散以及毒力因子生長階段的依賴性調節,幾乎所有的胞外和細胞表面的毒力因子均受 agr 的調節[6]。agrC 作為系統中的信號轉導因子,在 agr 系統對毒力調節中起到關鍵的調控作用[4]。研究發現,一些群體密度感應信號分子類似物能夠抑制致病因子生成或表皮葡萄球菌的生長[7],因此通過干擾群體密度感應系統以減少表皮葡萄球菌毒素的釋放、致病因素的表達及細菌生物膜的形成,已成為防治表皮葡萄球菌感染的突破口,為解決傳統抗生素耐藥問題提供了新的靶點。我們在前期工作中利用噬菌體隨機肽庫技術篩選合成了表皮葡萄球菌 agrC 特異結合多肽,本次實驗旨在通過體外觀察,探討其對 PVC 材料表面表皮葡萄球菌生物膜形成的影響,為治療頑固的表皮葡萄球菌生物膜感染提供新思路。
1 材料與方法
1.1 主要試劑及儀器
表皮葡萄球菌 ATCC35984(生物膜表型陽性)菌株和表皮葡萄球菌 ATCC12228(生物膜表型陰性)菌株由昆明醫科大學第三附屬醫院(云南省腫瘤醫院)微生物室惠贈。agrC 特異結合多肽(以下簡稱為 N1)、agrC 特異結合無關肽(以下簡稱為 N0),購自上海波泰生物科技有限公司。PVC 材料(東莞科威醫療器械有限公司);掃描電鏡(Hitachi 公司,日本);激光共聚焦顯微鏡(Leica 公司,德國);全波段多功能酶標儀(Therm 公司,美國)。
1.2 實驗方法
1.2.1 細菌懸液制備
將表皮葡萄球菌 ATCC35984 和 ATCC12228 菌株分別接種于 MH 瓊脂平板恒溫培養,挑取單個菌落,分別接種至 TSB 培養基中,于 37℃、150 r/min 培養 16~18 h,待細菌生長至對數生長期后配制成 1×107 CFU/mL 菌液,即配即用。
1.2.2 N1 最佳抑菌濃度檢測
根據不同培養條件,實驗分為 2 組。ATCC35984 菌株中 A1 組以 N1 培養、A0 組以 N0 培養,ATCC12228 菌株中對應為 B1、B0 組;根據 N1 及 N0 不同濃度,各組分為 5 個亞組,具體分組方法見表 1。用蒸餾水分別將 N1 和 N0 配制成 5 個倍比濃度溶液,即 100、200、400、800、1 600 μg/mL。首先,將細菌菌液加入無菌 96 孔細胞培養板(100 μL/孔)。然后,A1、B1 組各亞組加入對應濃度 N1 溶液(100 μL/孔),A0、B0 組各亞組加入對應濃度 N0 溶液(100 μL/孔);以 TSB 培養基作為空白對照。37℃ 恒溫培養 24 h 后,PBS 洗滌、甲醛固定、干燥,采用多功能酶標儀測定波長 490 nm 處吸光度(A)值,以 A 值大小反應細菌黏附能力強弱,間接反映細菌生物膜形成厚度。實驗重復 4 次。比較 A 值確定 N1 最佳抑菌濃度,并以該濃度進行以下實驗。
1.2.3 N1 對表皮葡萄球菌生物膜形成能力的影響
根據不同培養條件,實驗分為 3 組。ATCC35984 菌株中 A1 組采用 N1 培養,A2 組采用 N0 培養,A0 組采用 TSB 培養基培養(作為空白對照);ATCC12228 菌株中對應為 B1、B2、B0 組。將細菌菌液加入由 PVC 材料制成的無菌 96 孔細胞培養板中(100 μL/孔),按照分組方法分別加入最佳抑菌濃度的 N1、N0 以及 TSB 培養基(100 μL/孔),置于 37℃ 恒溫培養箱培養。于 6、12、18、24、30、48 h[8]取出培養板,PBS 洗滌、甲醛固定、干燥,多功能酶標儀測定波長 490 nm 處 A 值,觀察表皮葡萄球菌生物膜形成情況。實驗重復 4 次。
1.2.4 掃描電鏡觀察 PVC 材料表面細菌生物膜的表面結構
采用定制模型設備將 PVC 材料加工成 1 cm×1 cm 大小的材料片,75% 乙醇消毒 30 min、紫外線燈照射 30 min,備用。根據不同培養條件,實驗分為 2 組。ATCC35984 菌株中 A1 組采用 N1 培養,A0 組采用 N0 培養;ATCC12228 菌株中對應為 B1、B0 組。在 PVC 材料制成的無菌 24 孔細胞培養板中,每孔放入 1 片滅菌 PVC 材料片,加入 1 mL TSB 培養液和 200 μL 細菌懸液;然后,按照分組分別加入最佳抑菌濃度的 N1 和 N0(200 μL/孔),置于 37℃ 恒溫培養。于 6、12、18、24、30 h 吸出培養液,PBS 重復洗滌 2 遍去除未黏附細菌,取出 PVC 材料片,置于新的無菌 24 孔細胞培養板中,2.5% 戊二醛 4℃ 固定,乙醇梯度脫水、CO2 臨界點干燥、真空鍍金后,掃描電鏡下觀察 PVC 材料表面細菌生物膜的表面結構。
1.2.5 激光共聚焦顯微鏡觀察細菌生物膜厚度
取 ATCC35984 菌株進行觀測,實驗分為 2 組;A1 組加入 N1 培養,A0 組加入 N0 培養。在無菌 24 孔細胞培養板中放入滅菌 PVC 材料片,每孔 1 片;每孔加入 1 mL TSB 培養液、200 μL 細菌懸液;然后按照分組,分別加入最佳抑菌濃度 N1 和 N0,每孔 200 μL;置于 37℃ 恒溫培養箱培養。于 6、12、18、24 h 吸取培養液,生理鹽水漂洗 PVC 材料片,加入活/死細菌熒光染色劑,常溫下避光染色 15 min,漂洗后激光共聚焦顯微鏡下觀測 PVC 材料表面細菌數量以及生物膜厚度。實驗重復 4 次。
1.3 統計學方法
采用 SPSS21.0 統計軟件進行分析。數據以均數±標準差表示,兩組間比較用獨立樣本 t 檢驗;組內多個時間點間比較及多組間比較采用方差分析,兩兩比較采用 q 檢驗。檢驗水準 α=0.05。
2 結果
2.1 N1 最佳抑菌濃度檢測
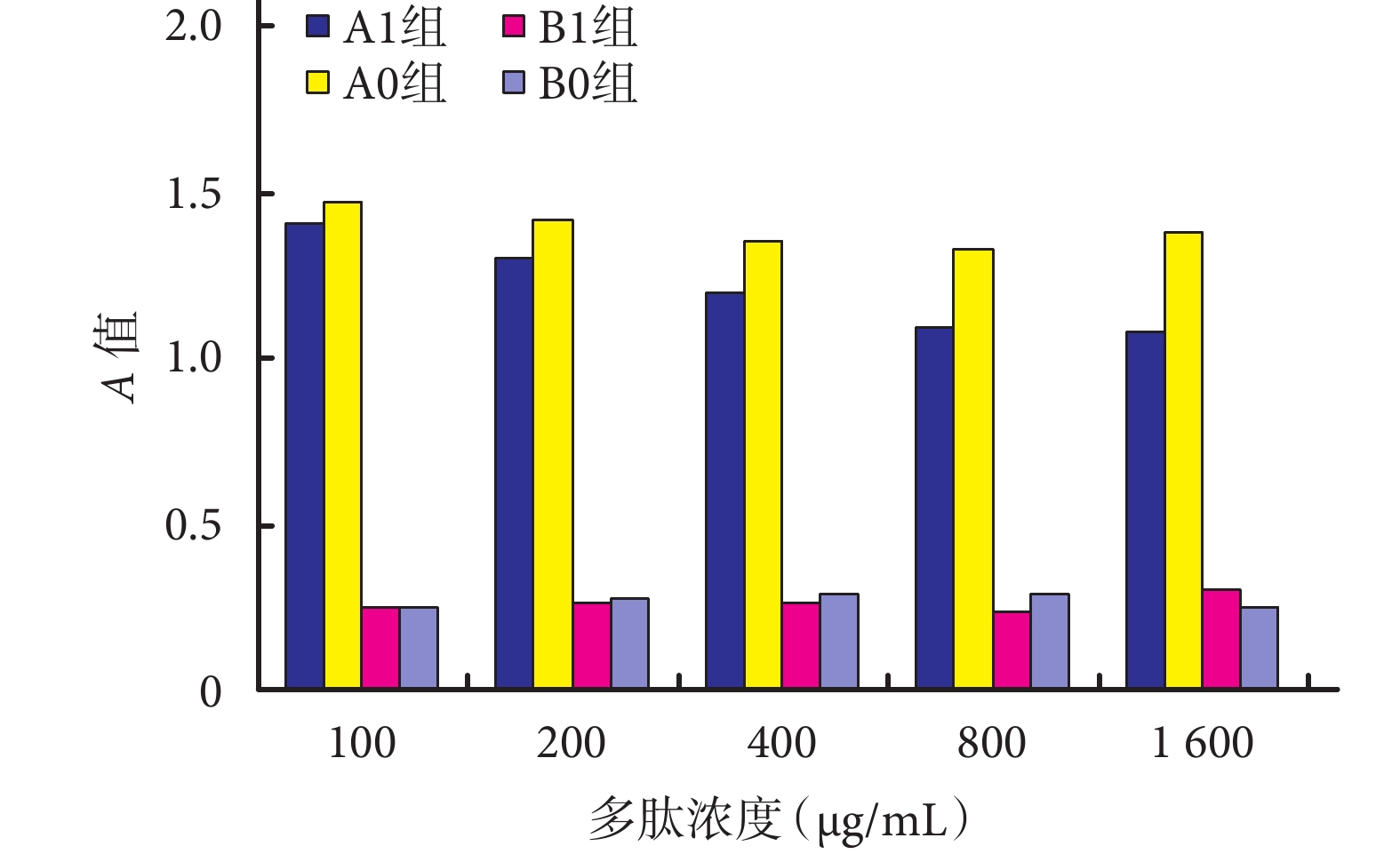
ATCC35984 菌株中,A1 組各濃度 N1 對生物膜形成抑制作用均高于 A0 組相應濃度 N0(P<0.05)。A0 組中當濃度達 800 μg/mL 時抑制作用較強,與 100、200 μg/mL 濃度組比較差異有統計學意義(P<0.05),但與 400、1 600 μg/mL 濃度組比較差異無統計學意義(P>0.05)。A1 組中隨濃度增加,N1 對生物膜形成抑制作用逐漸增強,當濃度達 800 μg/mL 時抑制作用最強,與 100、200、400 μg/mL 濃度組比較差異有統計學意義(P<0.05),與 1 600 μg/mL 濃度組比較差異無統計學意義(P>0.05);表明 N1 對表皮葡萄球菌 ATCC35984 菌株生物膜形成的抑制作用具有濃度依賴關系,最佳抑菌濃度為 800 μg/mL。見圖 1。
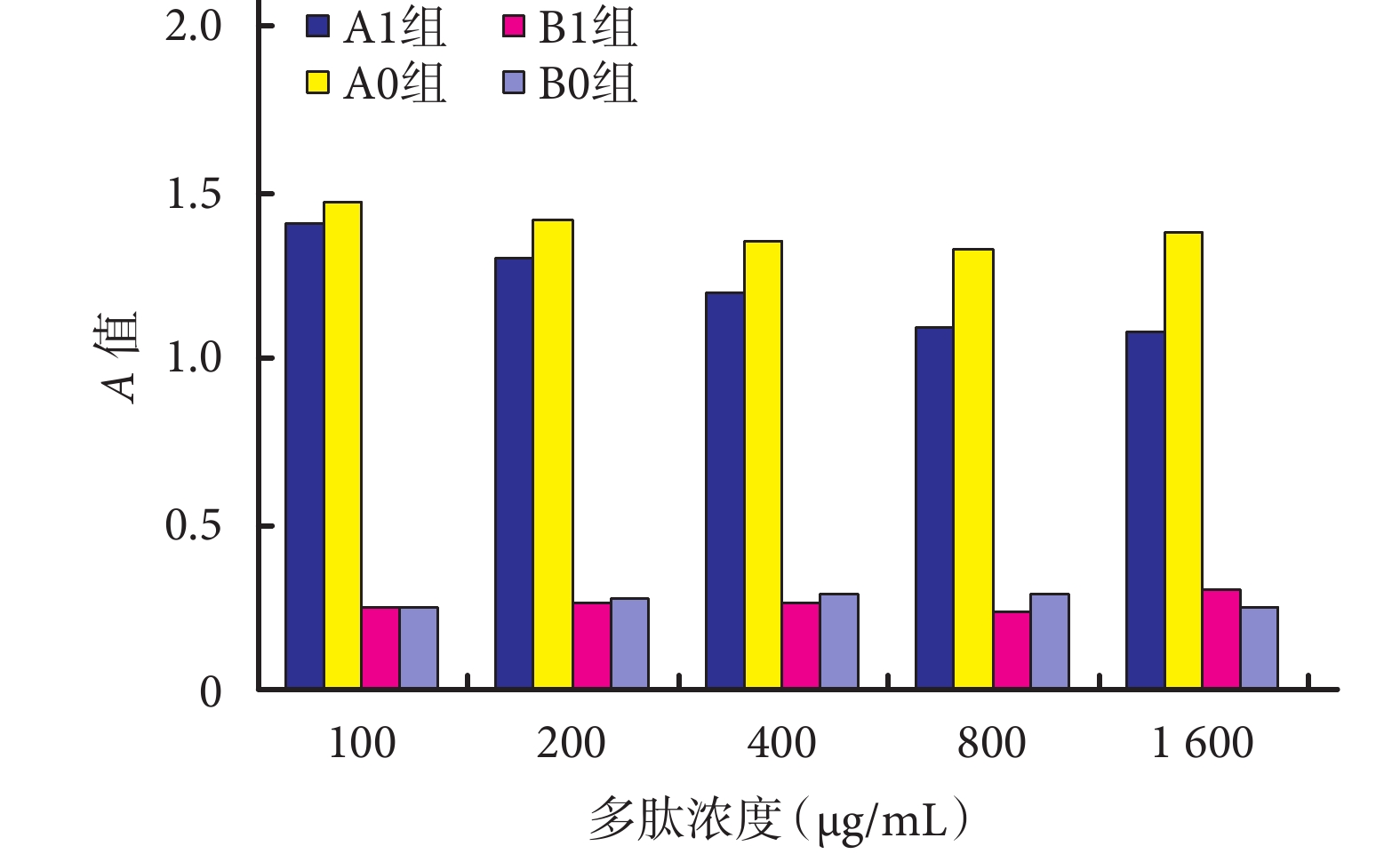 圖1
不同濃度 N1 對表皮葡萄球菌生物膜形成能力的影響
Figure1.
Effect of different concentrations of N1 on the biofilm for mation ability of Staphylococcus epidermidis
圖1
不同濃度 N1 對表皮葡萄球菌生物膜形成能力的影響
Figure1.
Effect of different concentrations of N1 on the biofilm for mation ability of Staphylococcus epidermidis
ATCC 12228 菌株中,B1、B0 組對應濃度亞組間以及組內不同濃度組間比較,差異均無統計學意義(P>0.05),表明 N1 及 N0 對細菌生物膜形成無抑制作用。見圖 1。
2.2 N1 對表皮葡萄球菌生物膜形成能力的影響
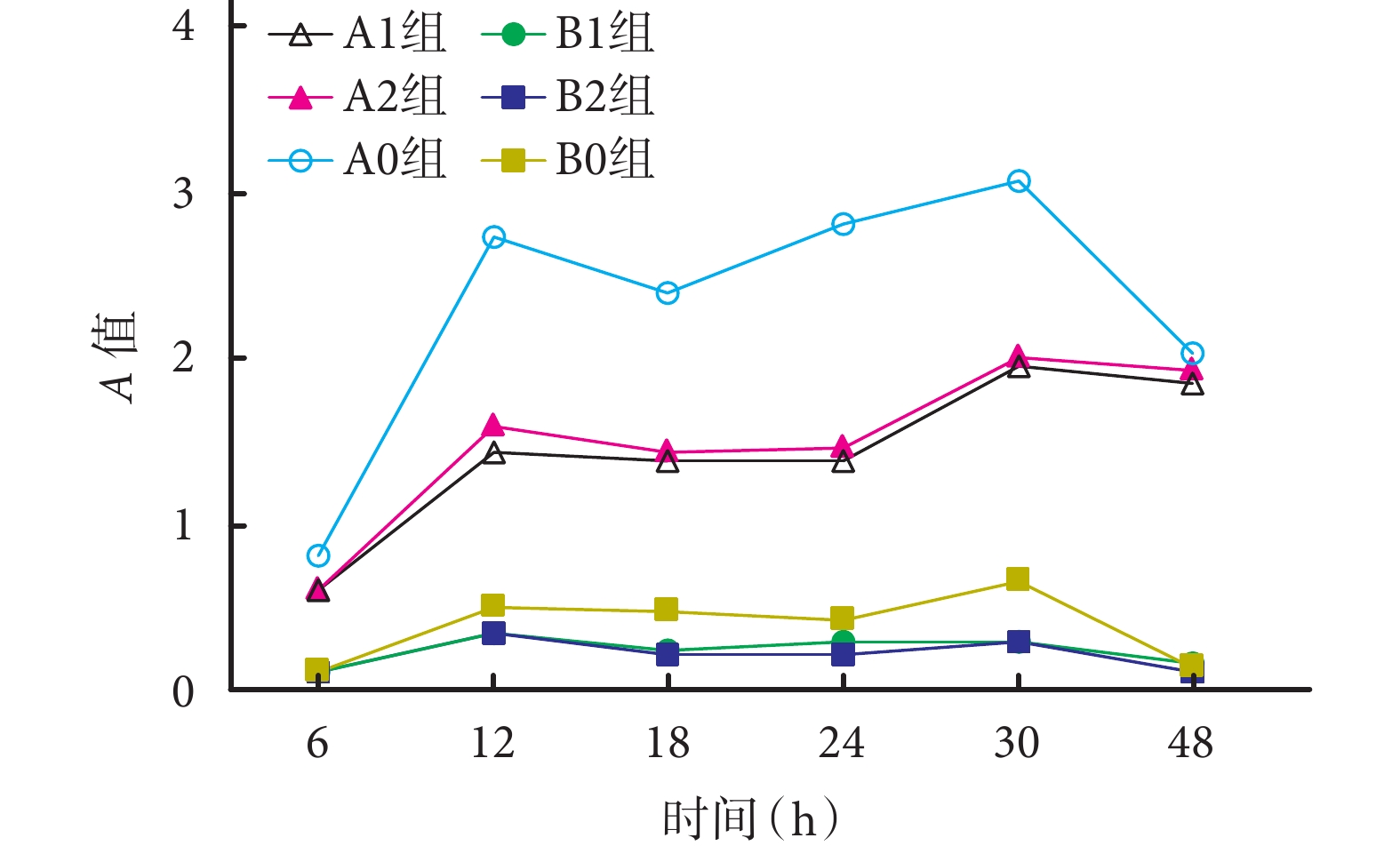
ATCC35984 菌株培養 12、18、24、30 h 時 A1、A2 組 A 值較 A0 組顯著下降,差異有統計學意義(P<0.05);6、48 h 時比較差異無統計學意義(P>0.05)。培養 12 h 時,A1 組 A 值明顯低于 A2 組,差異有統計學意義(P<0.05);其余各時間點 A1 組與 A2 組比較差異無統計學意義(P>0.05)。A1 組組內培養 12、18、24 h 時 A 值與 6、30、48 h 比較,差異有統計學意義(P<0.05)。
ATCC12228 菌株中,B1 及 B2 組均未形成明顯生物膜;各時間點各組 A 值比較,差異均無統計學意義(P>0.05)。見圖 2。
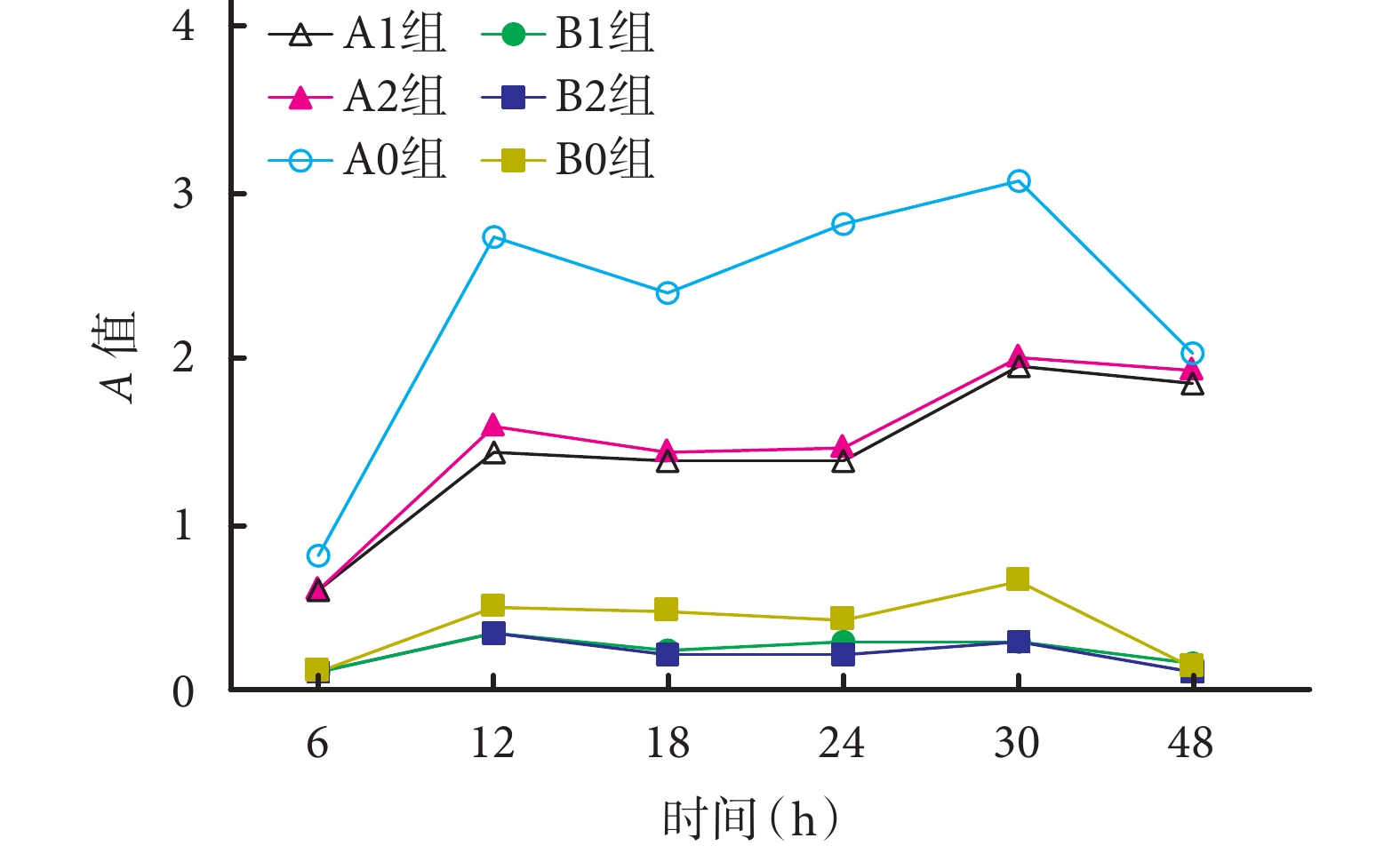 圖2
各時間點 N1 對表皮葡萄球菌生物膜形成的影響
Figure2.
Effect of N1 on the biofilm formation ability of Staphy lococcus epidermidis at different time points
圖2
各時間點 N1 對表皮葡萄球菌生物膜形成的影響
Figure2.
Effect of N1 on the biofilm formation ability of Staphy lococcus epidermidis at different time points
2.3 掃描電鏡觀察 PVC 材料表面細菌生物膜的表面結構
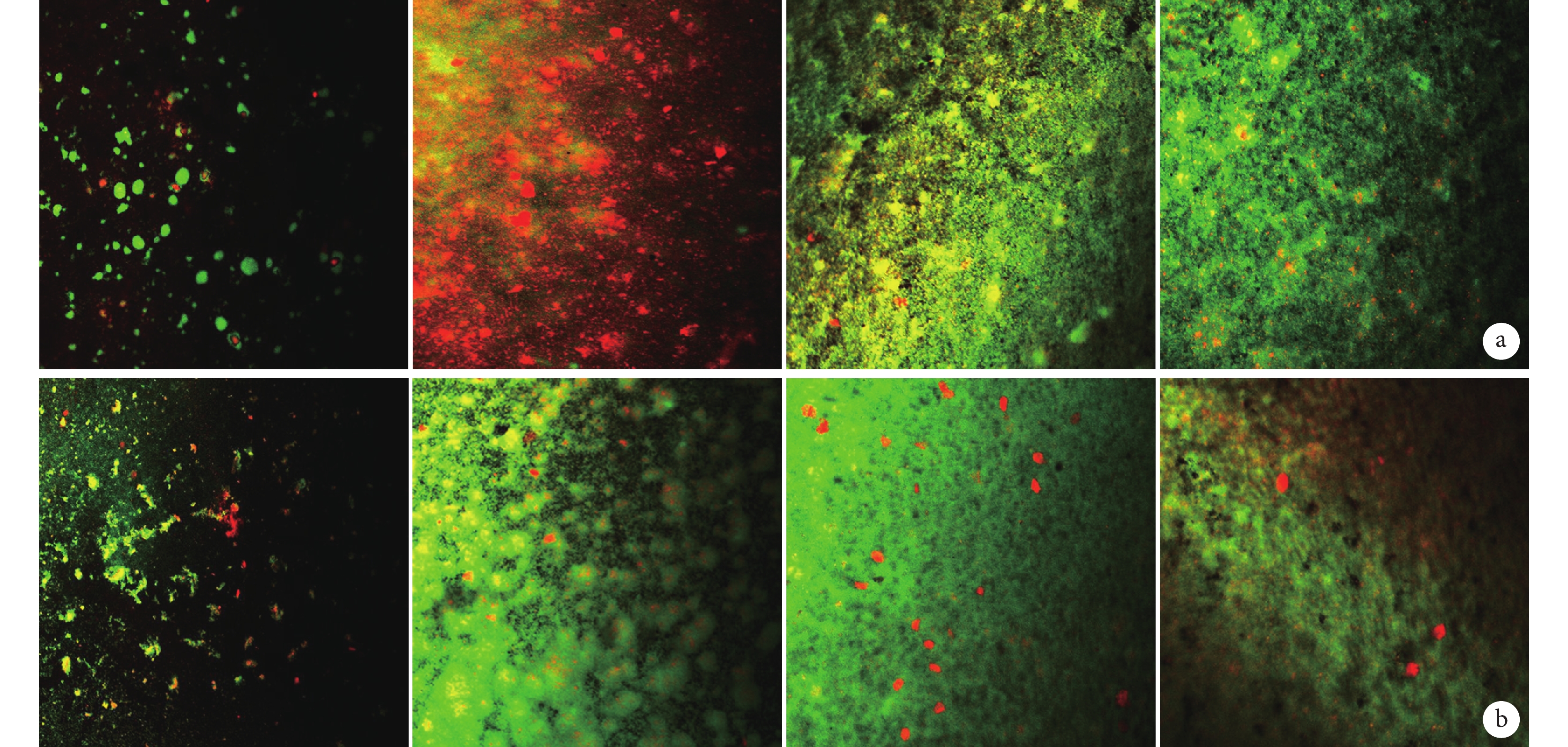
ATCC35984 菌株中,培養 6 h 時兩組 PVC 材料表面均可見散在的小細菌團塊;12 h 時 A1 組細菌團塊明顯少于 A0 組;18 h 時兩組均可見細菌團塊相互連接成片狀及塔狀結構;24 h 時兩組均可見成熟生物膜結構,有大量無定形細胞外基質填充;30 h 時兩組均可見生物膜結構,但有部分呈分解狀。見圖 3。ATCC12228 菌株中,各時間點兩組 PVC 材料表面均未見細菌生物膜形成,只有散落的細菌。見圖 4。
 圖3
各時間點表皮葡萄球菌 ATCC35984 生物膜形成掃描電鏡觀察(×1 000)
圖3
各時間點表皮葡萄球菌 ATCC35984 生物膜形成掃描電鏡觀察(×1 000)
從左至右分別為 6、12、24、30 h a. A1 組;b. A0 組
Figure3. Scanning electron microscopy observation of the biofilm formation of ATCC35984 strain at different time points (×1 000)From left to right for 6, 12, 24, and 30 hours a. Group A1; b. Group A0
 圖4
各時間點表皮葡萄球菌 ATCC12228 生物膜形成掃描電鏡觀察(×1 000)
圖4
各時間點表皮葡萄球菌 ATCC12228 生物膜形成掃描電鏡觀察(×1 000)
從左至右分別為 6、12、24、30 h a. B1 組;b. B0 組
Figure4. Scanning electron microscopy observation of the biofilm formation of ATCC12228 strain at different time points (×1 000)From left to right for 6, 12, 24, and 30 hours a. Group B1; b. Group B0
2.4 激光共聚焦顯微鏡觀察細菌生物膜厚度
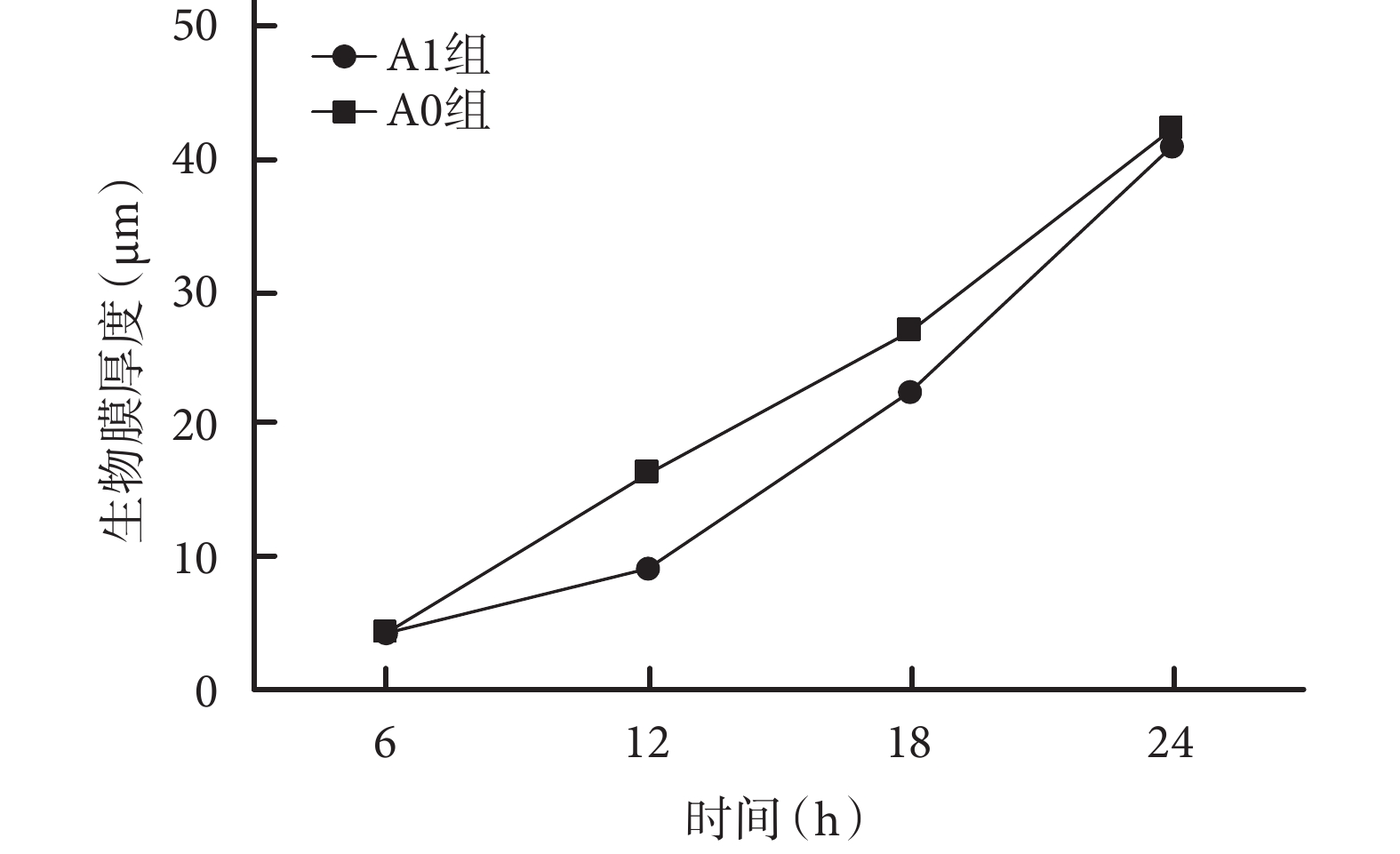
培養 6 h 時,兩組細菌數量無明顯差別,且以活細菌為主;A1 組生物膜厚度稍小于 A0 組,但差異無統計學意義(t=0.183,P=0.859)。12 h 時,A1 組黏附于 PVC 材料表面的細菌明顯少于 A0 組,且 A1 組細菌以死細菌為主、A0 組以活細菌為主;A1 組生物膜厚度明顯小于 A0 組,差異有統計學意義(t=11.504,P=0.001);18 h 時,兩組細菌數量均較前增加,均以活細菌為主,但 A1 組仍少于 A0 組;A1 組生物膜厚度亦明顯小于 A0 組,差異有統計學意義(t=7.092,P=0.001)。24 h 時,兩組細菌數量無明顯差別,且以活細菌為主;兩組細菌生物膜厚度差異無統計學意義(t=1.758,P=0.117)。A1、A0 組組內各時間點間生物膜厚度比較,差異均有統計學意義(P<0.05)。見圖 5、6。
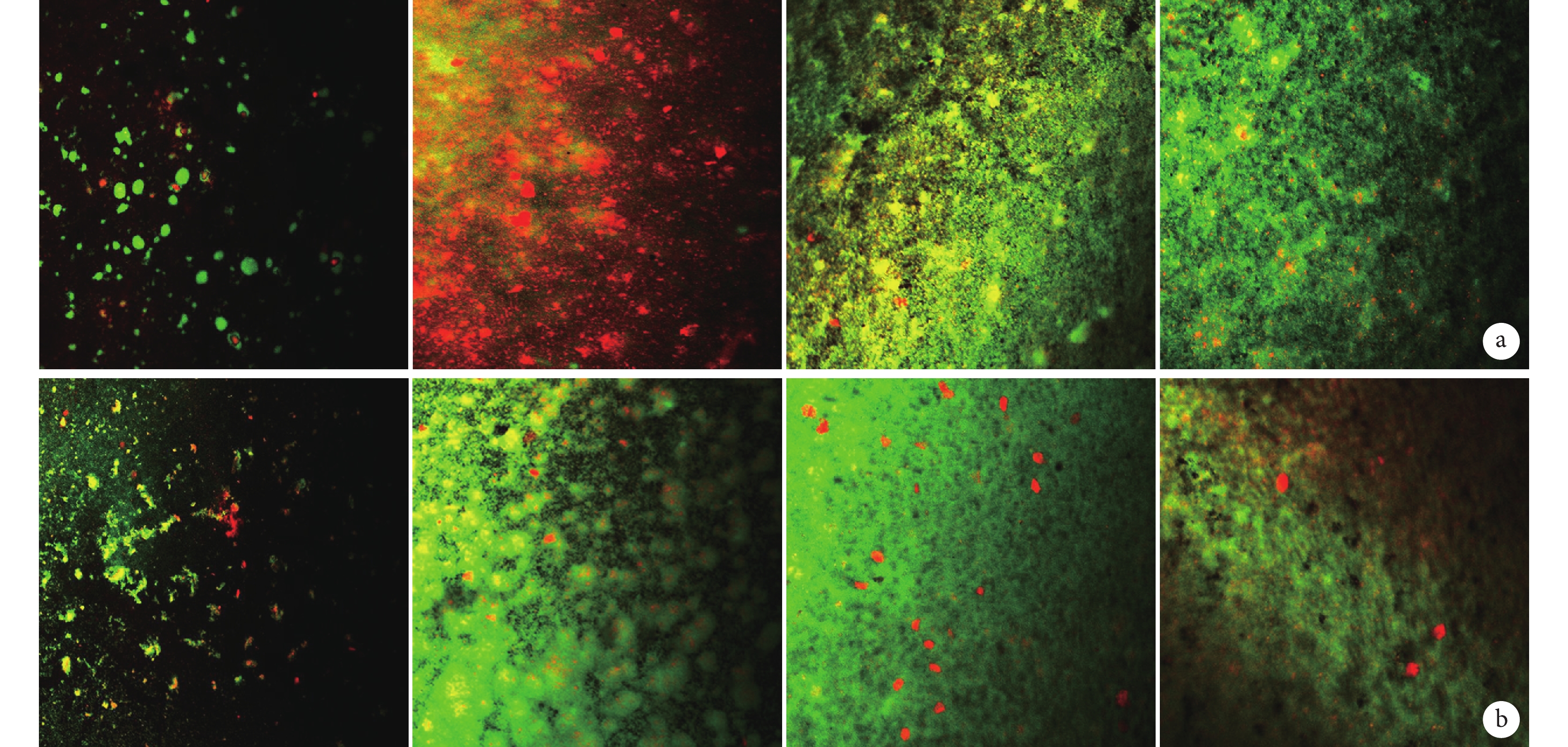 圖5
各時間點表皮葡萄球菌 ATCC35984 生物膜形成激光共聚焦顯微鏡觀察(×200)
圖5
各時間點表皮葡萄球菌 ATCC35984 生物膜形成激光共聚焦顯微鏡觀察(×200)
從左至右分別為 6、12、18、24 h a. A1 組;b. A0 組
Figure5. Laser confocal microscopy observation of biofilm formation of ATCC35984 strain at different time points (×200)From left to right for 6, 12, 18, and 24 hours a. Group A1; b. Group A0
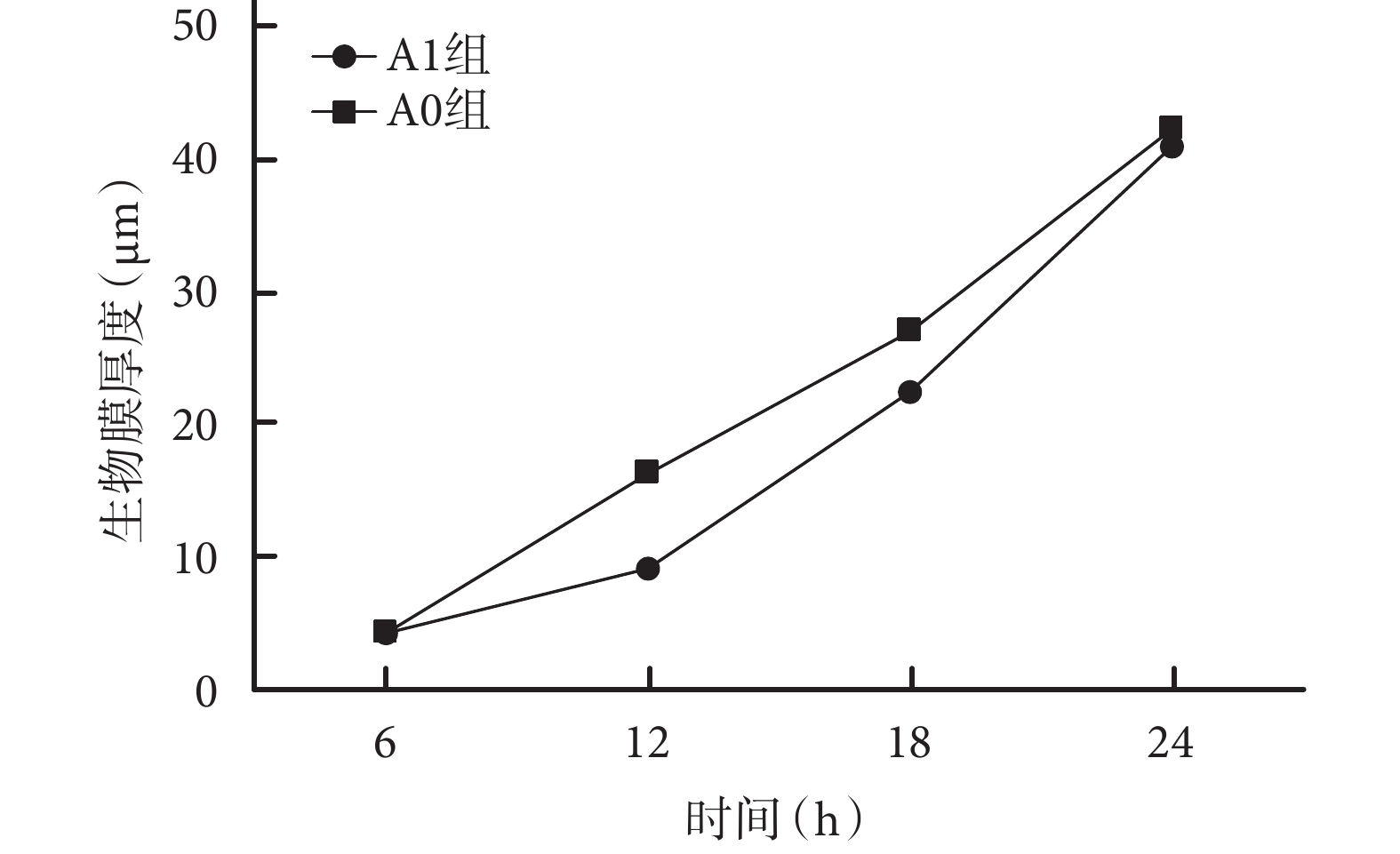 圖6
各時間點表皮葡萄球菌 ATCC35984 生物膜厚度
Figure6.
The biofilm thickness of ATCC35984 strain at different time points
圖6
各時間點表皮葡萄球菌 ATCC35984 生物膜厚度
Figure6.
The biofilm thickness of ATCC35984 strain at different time points
3 討論
表皮葡萄球菌隨醫用材料植入人體后,在材料表面形成生物膜的感染呈現慢性、持續性、反復性的特點[9],形成過程包括起始黏附、聚集和增殖、分化成熟及生物膜細菌脫落等階段[10]。與野生菌株相比,表皮葡萄球菌 agr 突變株在 PVC 材料表面具有更好的定植能力,能增加材料表面生物膜形成能力、細菌群落數量以及生物膜厚度,表明 agr 缺失能增加形成生物膜感染的能力,提示 agr 基因在生物膜形成中起重要的調控作用[7, 11]。細菌黏附在生物材料表面是細菌從浮游狀態到生物膜形成至關重要的階段,此階段需要多種黏附分子相互作用。agr 系統可通過上調黏附分子、下調脫落分子,促進表皮葡萄球菌在生物材料表面上的初始黏附[12]。隨著生物膜的聚集和成熟,小的細菌群落從成熟的生物膜表面脫落擴散到遠處不同位置,生物膜的脫落可能是導致生物膜相關感染擴散的首要原因。研究顯示,agr 在生物膜脫落過程中起主要調節作用[13]。因此,有效地干擾 agr 系統的調節作用,減少細菌毒素產生、致病因子表達及生物膜形成,成為預防和治療生物材料植入引發的難治性生物膜感染的突破口[14-15]。
agr 系統由組氨酸激酶域和反應調節蛋白結合域兩部分組成[10],包含 RNAⅡ、RNAⅢ 兩個相對獨立的轉錄單位。RNAⅡ 包括 agrA、agrB、agrC、agrD 4 個開放閱讀框。agrA 編碼反應調節蛋白;agrB 具有蛋白酶活性;agrC 通過對自誘導肽的特異識別,激活蛋白激酶胞內域部分活性,誘導轉錄操縱子 RNAⅡ 和 RNAⅢ 的轉錄,從而調控 agr 系統,在 agr 調節系統中對毒力因子調節及生物膜形成起關鍵的調控作用[16-17]。因此,以 agrC 為基礎研究表皮葡萄球菌生物膜的形成及毒力因子的分泌調節,設計針對 agrC 靶點的新型抗菌藥物具有重要意義。本研究采用能形成生物膜的表皮葡萄球菌 ATCC35984 菌株(生物膜表型陽性)進行觀測,以表皮葡萄球菌 ATCC12228(生物膜表型陰性)菌株作陰性對照,以 TSB 培養基作為空白對照,來探討 agr C 結合多肽對葡萄球菌生物膜形成的抑制作用。
動物實驗發現表皮葡萄球菌濃度≥1×107 CFU/mL 才能穩定形成生物膜[18-19]。對表皮葡萄球菌 1×107 CFU/mL 和 1×108 CFU/mL 兩種濃度進行觀察顯示,1×107 CFU/mL 細菌懸液隨著時間推移,細菌生長能力和生物膜厚度均顯著優于 1×108 CFU/mL 細菌懸液[19]。因此我們選用前者作為本次實驗濃度,以便更好地觀察 N1 對 PVC 材料表面細菌生物膜形成的影響。本研究顯示,在 ATCC35984 菌株的培養中,隨著 N1 濃度增加,其對細菌生物膜形成的抑制作用逐漸增強,當濃度達到 800 μg/mL 時,對生物膜形成能力的抑制作用最強,之后即使再增加濃度,細菌生物膜形成受到的抑制作用不再繼續增加,表明 N1 最佳抑菌濃度為 800 μg/mL。ATCC12228 菌株在培養過程中沒有生物膜形成。
有研究對生物膜形成過程中 agr 基因表達進行檢測,發現 agr 基因的表達隨時間發生變化,并且只能在生長旺盛的細菌中發生表達[20-21]。本研究將 N1、N0 分別加入 ATCC35984 菌株進行培養,于不同時間點測量 A 值(間接反映細菌生物膜形成厚度),行掃描電鏡及激光共聚焦顯微鏡觀察。結果顯示,培養 12 h(生物膜形成聚集期)時,N1 對生物膜形成有抑制作用;培養至 18 h(生物膜形成初期)時,N1 對生物膜形成仍有抑制作用,但較之前作用下降;培養 24 h(生物膜形成成熟期)時,N1 對生物膜形成抑制作用無增強;培養至 30 h 時(生物膜形成的成熟期后),N1 對生物膜形成的抑制作用減弱;培養至 48 h 時(細菌生物膜形成的脫落期),N1 對生物膜形成的抑制作用有所加強。此外,N0 在培養不同時段也對生物膜形成產生一定抑制作用,培養 6 h(生物膜形成的黏附期)、48 h(生物膜形成的脫落期)時,A1 組及 A0 組相比差異無統計學意義。N0 抑制生物膜形成是否與其和 agrC 分子產生了某種形式的結合,進而影響了 agrC 通路的傳遞與表達有關,有待于進一步探討。
綜上述,本研究各項檢測指標結果表明 N1 能顯著抑制聚集期生物膜的形成,而在生物膜初始黏附期、分化成熟階段的作用降低,提示 agr 系統抑制劑在生物膜感染形成后效果可能不理想,可能作為預防用藥更有效。而且 N1 抑制表皮葡萄球菌生物膜形成的強度存在量效關系。本研究對于探討 agrC 對表皮葡萄球菌毒力和生物膜形成的調節作用,設計以 argC 為靶分子的抗菌多肽藥物提供了實驗依據。
臨床上常應用由聚氯乙烯(polyvinyl chloride,PVC)制備的材料,如人工心臟瓣膜、氣管插管、靜脈導管等,這些材料在體內使用過程中或植入人體后可能發生感染。表皮葡萄球菌作為一種條件致病菌,可黏附在這些材料表面形成細菌生物膜[1-3],有效抵御抗生素滲透,抵抗機體防御反應,導致感染難以控制[4-5]。因此,探討有效的表皮葡萄球菌感染防治方法成為研究焦點。
生物膜形成需要多種因子參與,表皮葡萄球菌附屬基因調節子(accessory gene regulator,agr)介導的群體密度感應系統是最重要的毒力調節因子,參與表皮葡萄球菌生物膜的形成、分散以及毒力因子生長階段的依賴性調節,幾乎所有的胞外和細胞表面的毒力因子均受 agr 的調節[6]。agrC 作為系統中的信號轉導因子,在 agr 系統對毒力調節中起到關鍵的調控作用[4]。研究發現,一些群體密度感應信號分子類似物能夠抑制致病因子生成或表皮葡萄球菌的生長[7],因此通過干擾群體密度感應系統以減少表皮葡萄球菌毒素的釋放、致病因素的表達及細菌生物膜的形成,已成為防治表皮葡萄球菌感染的突破口,為解決傳統抗生素耐藥問題提供了新的靶點。我們在前期工作中利用噬菌體隨機肽庫技術篩選合成了表皮葡萄球菌 agrC 特異結合多肽,本次實驗旨在通過體外觀察,探討其對 PVC 材料表面表皮葡萄球菌生物膜形成的影響,為治療頑固的表皮葡萄球菌生物膜感染提供新思路。
1 材料與方法
1.1 主要試劑及儀器
表皮葡萄球菌 ATCC35984(生物膜表型陽性)菌株和表皮葡萄球菌 ATCC12228(生物膜表型陰性)菌株由昆明醫科大學第三附屬醫院(云南省腫瘤醫院)微生物室惠贈。agrC 特異結合多肽(以下簡稱為 N1)、agrC 特異結合無關肽(以下簡稱為 N0),購自上海波泰生物科技有限公司。PVC 材料(東莞科威醫療器械有限公司);掃描電鏡(Hitachi 公司,日本);激光共聚焦顯微鏡(Leica 公司,德國);全波段多功能酶標儀(Therm 公司,美國)。
1.2 實驗方法
1.2.1 細菌懸液制備
將表皮葡萄球菌 ATCC35984 和 ATCC12228 菌株分別接種于 MH 瓊脂平板恒溫培養,挑取單個菌落,分別接種至 TSB 培養基中,于 37℃、150 r/min 培養 16~18 h,待細菌生長至對數生長期后配制成 1×107 CFU/mL 菌液,即配即用。
1.2.2 N1 最佳抑菌濃度檢測
根據不同培養條件,實驗分為 2 組。ATCC35984 菌株中 A1 組以 N1 培養、A0 組以 N0 培養,ATCC12228 菌株中對應為 B1、B0 組;根據 N1 及 N0 不同濃度,各組分為 5 個亞組,具體分組方法見表 1。用蒸餾水分別將 N1 和 N0 配制成 5 個倍比濃度溶液,即 100、200、400、800、1 600 μg/mL。首先,將細菌菌液加入無菌 96 孔細胞培養板(100 μL/孔)。然后,A1、B1 組各亞組加入對應濃度 N1 溶液(100 μL/孔),A0、B0 組各亞組加入對應濃度 N0 溶液(100 μL/孔);以 TSB 培養基作為空白對照。37℃ 恒溫培養 24 h 后,PBS 洗滌、甲醛固定、干燥,采用多功能酶標儀測定波長 490 nm 處吸光度(A)值,以 A 值大小反應細菌黏附能力強弱,間接反映細菌生物膜形成厚度。實驗重復 4 次。比較 A 值確定 N1 最佳抑菌濃度,并以該濃度進行以下實驗。
1.2.3 N1 對表皮葡萄球菌生物膜形成能力的影響
根據不同培養條件,實驗分為 3 組。ATCC35984 菌株中 A1 組采用 N1 培養,A2 組采用 N0 培養,A0 組采用 TSB 培養基培養(作為空白對照);ATCC12228 菌株中對應為 B1、B2、B0 組。將細菌菌液加入由 PVC 材料制成的無菌 96 孔細胞培養板中(100 μL/孔),按照分組方法分別加入最佳抑菌濃度的 N1、N0 以及 TSB 培養基(100 μL/孔),置于 37℃ 恒溫培養箱培養。于 6、12、18、24、30、48 h[8]取出培養板,PBS 洗滌、甲醛固定、干燥,多功能酶標儀測定波長 490 nm 處 A 值,觀察表皮葡萄球菌生物膜形成情況。實驗重復 4 次。
1.2.4 掃描電鏡觀察 PVC 材料表面細菌生物膜的表面結構
采用定制模型設備將 PVC 材料加工成 1 cm×1 cm 大小的材料片,75% 乙醇消毒 30 min、紫外線燈照射 30 min,備用。根據不同培養條件,實驗分為 2 組。ATCC35984 菌株中 A1 組采用 N1 培養,A0 組采用 N0 培養;ATCC12228 菌株中對應為 B1、B0 組。在 PVC 材料制成的無菌 24 孔細胞培養板中,每孔放入 1 片滅菌 PVC 材料片,加入 1 mL TSB 培養液和 200 μL 細菌懸液;然后,按照分組分別加入最佳抑菌濃度的 N1 和 N0(200 μL/孔),置于 37℃ 恒溫培養。于 6、12、18、24、30 h 吸出培養液,PBS 重復洗滌 2 遍去除未黏附細菌,取出 PVC 材料片,置于新的無菌 24 孔細胞培養板中,2.5% 戊二醛 4℃ 固定,乙醇梯度脫水、CO2 臨界點干燥、真空鍍金后,掃描電鏡下觀察 PVC 材料表面細菌生物膜的表面結構。
1.2.5 激光共聚焦顯微鏡觀察細菌生物膜厚度
取 ATCC35984 菌株進行觀測,實驗分為 2 組;A1 組加入 N1 培養,A0 組加入 N0 培養。在無菌 24 孔細胞培養板中放入滅菌 PVC 材料片,每孔 1 片;每孔加入 1 mL TSB 培養液、200 μL 細菌懸液;然后按照分組,分別加入最佳抑菌濃度 N1 和 N0,每孔 200 μL;置于 37℃ 恒溫培養箱培養。于 6、12、18、24 h 吸取培養液,生理鹽水漂洗 PVC 材料片,加入活/死細菌熒光染色劑,常溫下避光染色 15 min,漂洗后激光共聚焦顯微鏡下觀測 PVC 材料表面細菌數量以及生物膜厚度。實驗重復 4 次。
1.3 統計學方法
采用 SPSS21.0 統計軟件進行分析。數據以均數±標準差表示,兩組間比較用獨立樣本 t 檢驗;組內多個時間點間比較及多組間比較采用方差分析,兩兩比較采用 q 檢驗。檢驗水準 α=0.05。
2 結果
2.1 N1 最佳抑菌濃度檢測
ATCC35984 菌株中,A1 組各濃度 N1 對生物膜形成抑制作用均高于 A0 組相應濃度 N0(P<0.05)。A0 組中當濃度達 800 μg/mL 時抑制作用較強,與 100、200 μg/mL 濃度組比較差異有統計學意義(P<0.05),但與 400、1 600 μg/mL 濃度組比較差異無統計學意義(P>0.05)。A1 組中隨濃度增加,N1 對生物膜形成抑制作用逐漸增強,當濃度達 800 μg/mL 時抑制作用最強,與 100、200、400 μg/mL 濃度組比較差異有統計學意義(P<0.05),與 1 600 μg/mL 濃度組比較差異無統計學意義(P>0.05);表明 N1 對表皮葡萄球菌 ATCC35984 菌株生物膜形成的抑制作用具有濃度依賴關系,最佳抑菌濃度為 800 μg/mL。見圖 1。
 圖1
不同濃度 N1 對表皮葡萄球菌生物膜形成能力的影響
Figure1.
Effect of different concentrations of N1 on the biofilm for mation ability of Staphylococcus epidermidis
圖1
不同濃度 N1 對表皮葡萄球菌生物膜形成能力的影響
Figure1.
Effect of different concentrations of N1 on the biofilm for mation ability of Staphylococcus epidermidis
ATCC 12228 菌株中,B1、B0 組對應濃度亞組間以及組內不同濃度組間比較,差異均無統計學意義(P>0.05),表明 N1 及 N0 對細菌生物膜形成無抑制作用。見圖 1。
2.2 N1 對表皮葡萄球菌生物膜形成能力的影響
ATCC35984 菌株培養 12、18、24、30 h 時 A1、A2 組 A 值較 A0 組顯著下降,差異有統計學意義(P<0.05);6、48 h 時比較差異無統計學意義(P>0.05)。培養 12 h 時,A1 組 A 值明顯低于 A2 組,差異有統計學意義(P<0.05);其余各時間點 A1 組與 A2 組比較差異無統計學意義(P>0.05)。A1 組組內培養 12、18、24 h 時 A 值與 6、30、48 h 比較,差異有統計學意義(P<0.05)。
ATCC12228 菌株中,B1 及 B2 組均未形成明顯生物膜;各時間點各組 A 值比較,差異均無統計學意義(P>0.05)。見圖 2。
 圖2
各時間點 N1 對表皮葡萄球菌生物膜形成的影響
Figure2.
Effect of N1 on the biofilm formation ability of Staphy lococcus epidermidis at different time points
圖2
各時間點 N1 對表皮葡萄球菌生物膜形成的影響
Figure2.
Effect of N1 on the biofilm formation ability of Staphy lococcus epidermidis at different time points
2.3 掃描電鏡觀察 PVC 材料表面細菌生物膜的表面結構
ATCC35984 菌株中,培養 6 h 時兩組 PVC 材料表面均可見散在的小細菌團塊;12 h 時 A1 組細菌團塊明顯少于 A0 組;18 h 時兩組均可見細菌團塊相互連接成片狀及塔狀結構;24 h 時兩組均可見成熟生物膜結構,有大量無定形細胞外基質填充;30 h 時兩組均可見生物膜結構,但有部分呈分解狀。見圖 3。ATCC12228 菌株中,各時間點兩組 PVC 材料表面均未見細菌生物膜形成,只有散落的細菌。見圖 4。
 圖3
各時間點表皮葡萄球菌 ATCC35984 生物膜形成掃描電鏡觀察(×1 000)
圖3
各時間點表皮葡萄球菌 ATCC35984 生物膜形成掃描電鏡觀察(×1 000)
從左至右分別為 6、12、24、30 h a. A1 組;b. A0 組
Figure3. Scanning electron microscopy observation of the biofilm formation of ATCC35984 strain at different time points (×1 000)From left to right for 6, 12, 24, and 30 hours a. Group A1; b. Group A0
 圖4
各時間點表皮葡萄球菌 ATCC12228 生物膜形成掃描電鏡觀察(×1 000)
圖4
各時間點表皮葡萄球菌 ATCC12228 生物膜形成掃描電鏡觀察(×1 000)
從左至右分別為 6、12、24、30 h a. B1 組;b. B0 組
Figure4. Scanning electron microscopy observation of the biofilm formation of ATCC12228 strain at different time points (×1 000)From left to right for 6, 12, 24, and 30 hours a. Group B1; b. Group B0
2.4 激光共聚焦顯微鏡觀察細菌生物膜厚度
培養 6 h 時,兩組細菌數量無明顯差別,且以活細菌為主;A1 組生物膜厚度稍小于 A0 組,但差異無統計學意義(t=0.183,P=0.859)。12 h 時,A1 組黏附于 PVC 材料表面的細菌明顯少于 A0 組,且 A1 組細菌以死細菌為主、A0 組以活細菌為主;A1 組生物膜厚度明顯小于 A0 組,差異有統計學意義(t=11.504,P=0.001);18 h 時,兩組細菌數量均較前增加,均以活細菌為主,但 A1 組仍少于 A0 組;A1 組生物膜厚度亦明顯小于 A0 組,差異有統計學意義(t=7.092,P=0.001)。24 h 時,兩組細菌數量無明顯差別,且以活細菌為主;兩組細菌生物膜厚度差異無統計學意義(t=1.758,P=0.117)。A1、A0 組組內各時間點間生物膜厚度比較,差異均有統計學意義(P<0.05)。見圖 5、6。
 圖5
各時間點表皮葡萄球菌 ATCC35984 生物膜形成激光共聚焦顯微鏡觀察(×200)
圖5
各時間點表皮葡萄球菌 ATCC35984 生物膜形成激光共聚焦顯微鏡觀察(×200)
從左至右分別為 6、12、18、24 h a. A1 組;b. A0 組
Figure5. Laser confocal microscopy observation of biofilm formation of ATCC35984 strain at different time points (×200)From left to right for 6, 12, 18, and 24 hours a. Group A1; b. Group A0
 圖6
各時間點表皮葡萄球菌 ATCC35984 生物膜厚度
Figure6.
The biofilm thickness of ATCC35984 strain at different time points
圖6
各時間點表皮葡萄球菌 ATCC35984 生物膜厚度
Figure6.
The biofilm thickness of ATCC35984 strain at different time points
3 討論
表皮葡萄球菌隨醫用材料植入人體后,在材料表面形成生物膜的感染呈現慢性、持續性、反復性的特點[9],形成過程包括起始黏附、聚集和增殖、分化成熟及生物膜細菌脫落等階段[10]。與野生菌株相比,表皮葡萄球菌 agr 突變株在 PVC 材料表面具有更好的定植能力,能增加材料表面生物膜形成能力、細菌群落數量以及生物膜厚度,表明 agr 缺失能增加形成生物膜感染的能力,提示 agr 基因在生物膜形成中起重要的調控作用[7, 11]。細菌黏附在生物材料表面是細菌從浮游狀態到生物膜形成至關重要的階段,此階段需要多種黏附分子相互作用。agr 系統可通過上調黏附分子、下調脫落分子,促進表皮葡萄球菌在生物材料表面上的初始黏附[12]。隨著生物膜的聚集和成熟,小的細菌群落從成熟的生物膜表面脫落擴散到遠處不同位置,生物膜的脫落可能是導致生物膜相關感染擴散的首要原因。研究顯示,agr 在生物膜脫落過程中起主要調節作用[13]。因此,有效地干擾 agr 系統的調節作用,減少細菌毒素產生、致病因子表達及生物膜形成,成為預防和治療生物材料植入引發的難治性生物膜感染的突破口[14-15]。
agr 系統由組氨酸激酶域和反應調節蛋白結合域兩部分組成[10],包含 RNAⅡ、RNAⅢ 兩個相對獨立的轉錄單位。RNAⅡ 包括 agrA、agrB、agrC、agrD 4 個開放閱讀框。agrA 編碼反應調節蛋白;agrB 具有蛋白酶活性;agrC 通過對自誘導肽的特異識別,激活蛋白激酶胞內域部分活性,誘導轉錄操縱子 RNAⅡ 和 RNAⅢ 的轉錄,從而調控 agr 系統,在 agr 調節系統中對毒力因子調節及生物膜形成起關鍵的調控作用[16-17]。因此,以 agrC 為基礎研究表皮葡萄球菌生物膜的形成及毒力因子的分泌調節,設計針對 agrC 靶點的新型抗菌藥物具有重要意義。本研究采用能形成生物膜的表皮葡萄球菌 ATCC35984 菌株(生物膜表型陽性)進行觀測,以表皮葡萄球菌 ATCC12228(生物膜表型陰性)菌株作陰性對照,以 TSB 培養基作為空白對照,來探討 agr C 結合多肽對葡萄球菌生物膜形成的抑制作用。
動物實驗發現表皮葡萄球菌濃度≥1×107 CFU/mL 才能穩定形成生物膜[18-19]。對表皮葡萄球菌 1×107 CFU/mL 和 1×108 CFU/mL 兩種濃度進行觀察顯示,1×107 CFU/mL 細菌懸液隨著時間推移,細菌生長能力和生物膜厚度均顯著優于 1×108 CFU/mL 細菌懸液[19]。因此我們選用前者作為本次實驗濃度,以便更好地觀察 N1 對 PVC 材料表面細菌生物膜形成的影響。本研究顯示,在 ATCC35984 菌株的培養中,隨著 N1 濃度增加,其對細菌生物膜形成的抑制作用逐漸增強,當濃度達到 800 μg/mL 時,對生物膜形成能力的抑制作用最強,之后即使再增加濃度,細菌生物膜形成受到的抑制作用不再繼續增加,表明 N1 最佳抑菌濃度為 800 μg/mL。ATCC12228 菌株在培養過程中沒有生物膜形成。
有研究對生物膜形成過程中 agr 基因表達進行檢測,發現 agr 基因的表達隨時間發生變化,并且只能在生長旺盛的細菌中發生表達[20-21]。本研究將 N1、N0 分別加入 ATCC35984 菌株進行培養,于不同時間點測量 A 值(間接反映細菌生物膜形成厚度),行掃描電鏡及激光共聚焦顯微鏡觀察。結果顯示,培養 12 h(生物膜形成聚集期)時,N1 對生物膜形成有抑制作用;培養至 18 h(生物膜形成初期)時,N1 對生物膜形成仍有抑制作用,但較之前作用下降;培養 24 h(生物膜形成成熟期)時,N1 對生物膜形成抑制作用無增強;培養至 30 h 時(生物膜形成的成熟期后),N1 對生物膜形成的抑制作用減弱;培養至 48 h 時(細菌生物膜形成的脫落期),N1 對生物膜形成的抑制作用有所加強。此外,N0 在培養不同時段也對生物膜形成產生一定抑制作用,培養 6 h(生物膜形成的黏附期)、48 h(生物膜形成的脫落期)時,A1 組及 A0 組相比差異無統計學意義。N0 抑制生物膜形成是否與其和 agrC 分子產生了某種形式的結合,進而影響了 agrC 通路的傳遞與表達有關,有待于進一步探討。
綜上述,本研究各項檢測指標結果表明 N1 能顯著抑制聚集期生物膜的形成,而在生物膜初始黏附期、分化成熟階段的作用降低,提示 agr 系統抑制劑在生物膜感染形成后效果可能不理想,可能作為預防用藥更有效。而且 N1 抑制表皮葡萄球菌生物膜形成的強度存在量效關系。本研究對于探討 agrC 對表皮葡萄球菌毒力和生物膜形成的調節作用,設計以 argC 為靶分子的抗菌多肽藥物提供了實驗依據。