引用本文: 劉慶喜, 陳洪冉, 李惠, 張同存, 馬文建. 腫瘤干細胞的分離及耐雙氧水模型的建立. 中國修復重建外科雜志, 2019, 33(11): 1433-1438. doi: 10.7507/1002-1892.201809014 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
惡性腫瘤所致死亡人數越來越多,目前腫瘤治療手段仍為手術切除、放療和化療等,多數腫瘤很難得到根治且復發率極高[1-2],導致患者生存質量較差[3]。隨著科技發展,越來越多證據表明腫瘤中存在干細胞樣腫瘤細胞,這類細胞具有很強的增殖、自我更新能力和分化潛能,被稱為腫瘤干細胞(cancer stem cells,CST)[4-5]。有研究表明,CST 的存在導致了常規手術及放化療效果差且復發可能性高[6-7]。
由于 CST 可作為腫瘤細胞修復的種子細胞,常規放療、化療治療只能殺死腫瘤細胞,而對 CST 不敏感,導致化療后 CST 快速修復腫瘤細胞,導致腫瘤復發。因而研究 CST 的存在及其耐藥性機制是國際前沿研究熱點[8]。目前,CST 主要從腫瘤組織或腫瘤細胞系中獲取。由于腫瘤組織獲得困難、獲取量少,以及受腫瘤組織所處病理階段影響(例如良性期難以獲取)等一系列問題,導致 CST 提取困難,使得腫瘤組織來源的 CST 研究受到一定限制[9-10]。從腫瘤細胞系中獲得 CST 方法簡便,細胞系資源豐富,因此應用前景比較廣泛[11]。
目前抗腫瘤藥種類繁多,盡管眾多藥物臨床前試驗中對腫瘤細胞顯示很好的殺傷效果,但實際臨床應用效果卻不理想[12-13]。因而藥物研發耗資大、成效低,體外實驗模型的不足造成了很大的資源浪費。隨著近年來對 CST 耐藥特性的逐步了解,靶向具有高度致瘤性的 CST 成為藥物研發的熱點,有望彌補臨床上現有治療手段的缺陷,提高抗腫瘤藥物的臨床成功率,節省資源。
本研究采用無血清成球培養 MCF-7 細胞(人乳腺癌細胞),旨在建立一種簡單有效的 CST 獲取及功能測定方法,以期用于高效抗腫瘤藥物篩選及腫瘤耐藥性機制研究。
1 材料與方法
1.1 主要試劑及儀器
MCF-7 細胞由武漢科技大學醫學院饋贈,液氮存儲,干冰運輸。DMEM/F12 培養液、EGF、bFGF、B27、FBS、谷氨酰胺、0.5% 胰蛋白酶-EDTA、雙抗(GIBCO 公司,美國);鼠源 CD133 抗體(美天旎公司,德國);鼠源 γH2AX(histone H2AX phosphorylation)單克隆抗體、山羊抗小鼠 Alexa Fluor488 二抗(Abcam 公司,英國)。細胞培養箱、離心機(Thermo 公司,美國);超凈工作臺(蘇州凈化設備有限公司);超純水機(Millipore 公司,美國);倒置熒光顯微鏡(Olympus 公司,日本)。
1.2 MCF-7 細胞復蘇培養
將 MCF-7 細胞培養液(含 10%FBS、1% 谷氨酰胺、1% 青-鏈霉素的 DMEM/F12 培養液)與 DMEM/F12 基礎培養液分別置于水浴鍋內預熱至 37℃。在 15 mL 離心管中加入 6 mL 預熱的 DMEM/F12 基礎培養基,將 MCF-7 細胞從液氮中取出并迅速置于 37℃ 水浴鍋中解凍,然后吸取細胞懸液(1 mL)至上述離心管中,室溫以離心半徑 20 cm、1 000 r/min 離心 5 min;棄上清液,加入適量 MCF-7 細胞培養液,調整細胞濃度為 1×105個/mL 接種于培養瓶中,置于 37℃、5%CO2 培養箱中培養。
1.3 MCF-7 細胞懸浮成球培養
待 MCF-7 細胞生長密度達培養瓶底面積 80% 后棄培養液,0.01 mol/L PBS 清洗 2 次后換成懸浮成球培養基(含 10 ng/mL bFGF、20 ng/mL EGF、1%B27 的 DMEM/F12 培養液)培養;每隔 2 d 換液 1 次,直至出現腫瘤球后輕輕吹懸腫瘤球,棄掉單個貼壁生長的腫瘤細胞;0.05% 胰蛋白酶消化腫瘤球,然后以 1×105個/mL 密度鋪種于新的 10 cm 培養皿中,置于 37℃、5%CO2 培養箱中培養。腫瘤球直徑達 150 μm 左右時行傳代培養。采用倒置相差顯微鏡觀察細胞形態變化,取 MCF-7 細胞培養液培養的 MCF-7 細胞作為對照。
1.4 觀測指標
1.4.1 免疫細胞化學染色觀察
取第 3 代懸浮成球生長的 MCF-7 細胞,室溫以離心半徑 20 cm、1 000 r/min 離心 5 min, 0.01 mol/L PBS 清洗 2 次,0.05% 胰蛋白酶消化腫瘤球,以 1×105個/mL 密度鋪種于 24 孔板,作為實驗組;對照組取 MCF-7 細胞以相同密度接種。待實驗組腫瘤球直徑達 100 μm 左右、對照組 MCF-7 細胞密度達培養瓶底面積 70% 左右時,吸棄培養基(實驗組腫瘤球每次換液前,置于 15 mL 離心管中,室溫以離心半徑 20 cm、1 000 r/min 離心 5 min,去除培養液),0.01 mol/L PBS 洗 3 次,每次 5 min;加入 4% 多聚甲醛固定 15 min,0.01 mol/L PBS 洗 3 次,每次 5 min;加入 0.25% Triton X-100 作用 15 min,用羊血清封閉 30 min,添加鼠源 CD133 抗體(1∶50)、1 μg/mL 鼠源 γH2AX 單克隆抗體,4℃ 過夜;加入山羊抗鼠 Alexa Fluor488 二抗,避光孵育 2 h,DAPI 核染 10 min,0.01 mol/L PBS 浸洗 3 次,每次 5 min;倒置熒光顯微鏡下觀察 CST 標志物 CD133 及細胞 DNA 損傷標志物 γH2AX 表達情況。
1.4.2 CST 流式細胞儀鑒定
收集直徑達 150 μm 的第 3 代腫瘤球細胞,經 0.05% 胰蛋白酶消化 5 min,使用 DMEM/F12 基礎培養液對其進行稀釋,以離心半徑 20 cm、1 000 r/min 離心 5 min,0.01 mol/L PBS 洗滌 2 次后重懸計數。調整細胞密度為 1×106個/管,加入 4% 多聚甲醛固定液固定 15 min,0.01 mol/L PBS 清洗 2 次,每次 5 min;以離心半徑 20 cm、1 000 r/min 離心 5 min,加入 CD133 一抗(1∶50)4℃ 過夜(對照管不加 CD133 抗體);0.01 mol/L PBS 清洗 2 次,每次 5 min,加入山羊抗小鼠 Alexa Fluor488 二抗室溫孵育 2 h;0.01 mol/L PBS 清洗 2 次,每次 5 min,取 500 μL 吹懸細胞過濾后上流式細胞儀檢測。
1.4.3 細胞 DNA 損傷實驗
收集直徑達到 150 μm 的第 2 代腫瘤球細胞(實驗組)以及相應代數的 MCF-7 細胞(對照組),經 0.05% 胰蛋白酶消化 5 min,使用各自基礎培養液對其進行稀釋;以離心半徑 20 cm、1 000 r/min 離心 5 min,棄培養液,0.01 mol/L PBS 洗滌 2 次后重懸計數,調整細胞密度,以 2×104個/孔接種于 24 孔板。對直徑達到 100 μm 的 CST 腫瘤球、融合度達到 70% 的 MCF-7 細胞進行 DNA 損傷處理,分別加入 50 μmol/L H2O2 損傷 120 min。然后使用 0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),加入 4% 多聚甲醛固定液固定 15 min,0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),每次 5 min;加入鼠源 γH2AX 單克隆抗體一抗(1 μg/mL),4℃ 過夜;0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),每次 5 min,加入山羊抗小鼠 Alexa Fluor488 二抗室溫孵育 2 h,DAPI 核染 10 min;0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),每次 5 min。取 CST 腫瘤球及 MCF-7 細胞于倒置熒光顯微鏡下觀察 γH2AX 表達情況。
2 結果
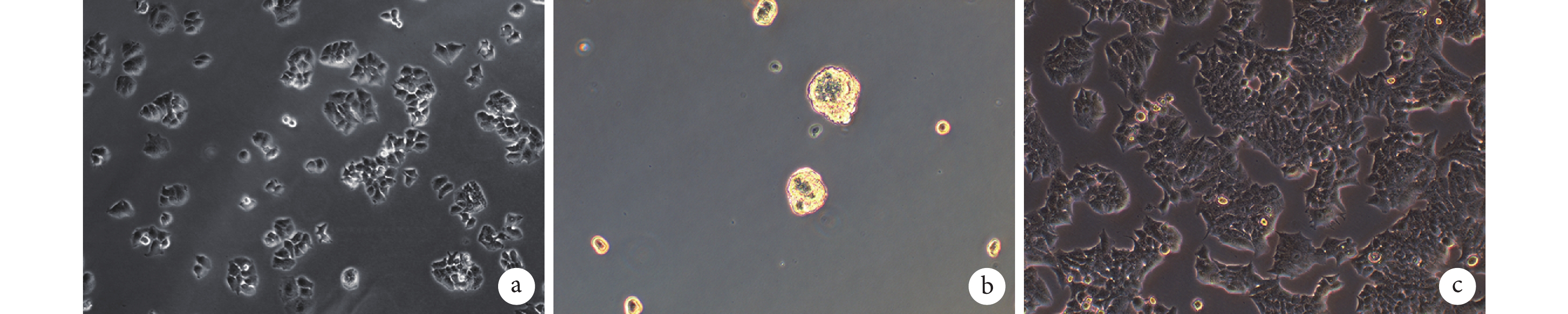
2.1 MCF-7 細胞及 CST 球形態觀察
倒置相差顯微鏡觀察示,MCF-7 細胞最初以單細胞貼壁狀態生長;經懸浮成球培養基培養及去貼壁純化后,細胞呈球狀、懸浮生長,遮光性強。而經 MCF-7 細胞培養液培養的對照 MCF-7 細胞呈伸展狀貼壁生長,不能成球懸浮生長。見圖 1。
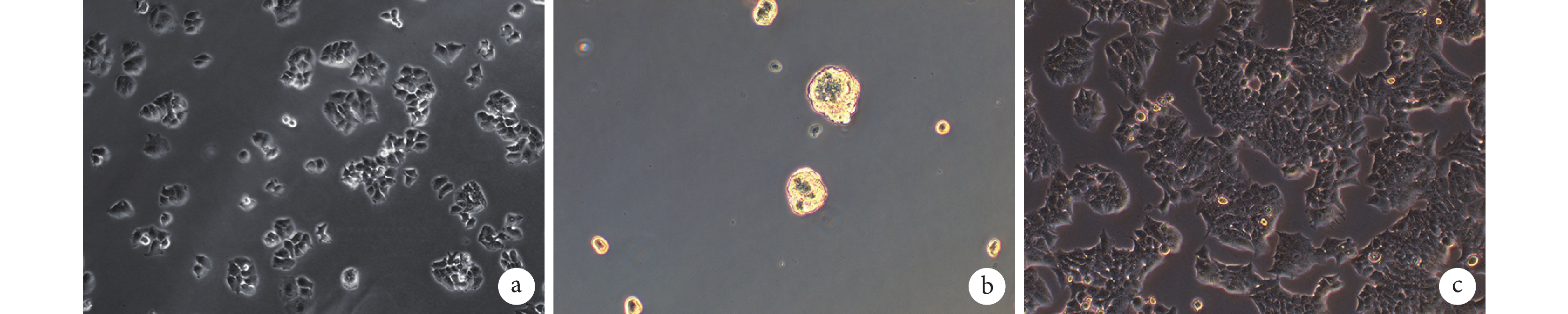 圖1
CST 形成過程形態觀察(倒置相差顯微鏡×200)
圖1
CST 形成過程形態觀察(倒置相差顯微鏡×200)
a. 初始 MCF-7 細胞;b. 經懸浮成球培養基培養約 3 d 的 CST,直徑約 100 μm;c. 經 MCF-7 培養基培養約 3 d 的 MCF-7 細胞
Figure1. Morphological observation during the formation of CST (Inverted phase contrast microscope×200)a. Initial MCF-7 cells; b. CST cultured in suspension balling medium for about 3 days with a diameter of about 100 μm; c. Adherent MCF-7 cells cultured in MCF-7 medium for about 3 days
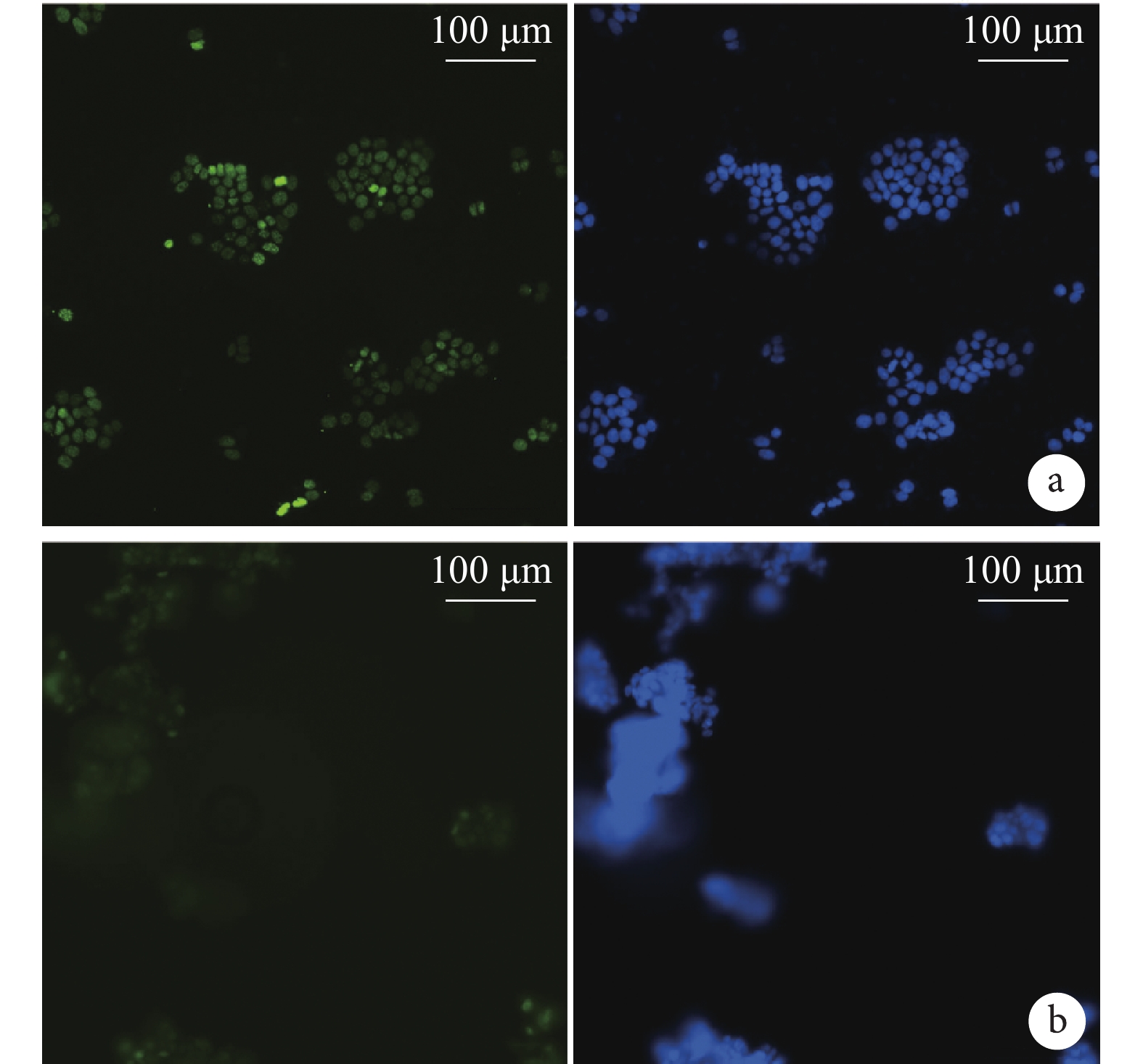
2.2 免疫細胞化學染色觀察
倒置熒光顯微鏡觀察示,對照組 MCF-7 細胞 CD133 為陰性表達,而實驗組腫瘤球 CD133 為陽性表達。見圖 2。
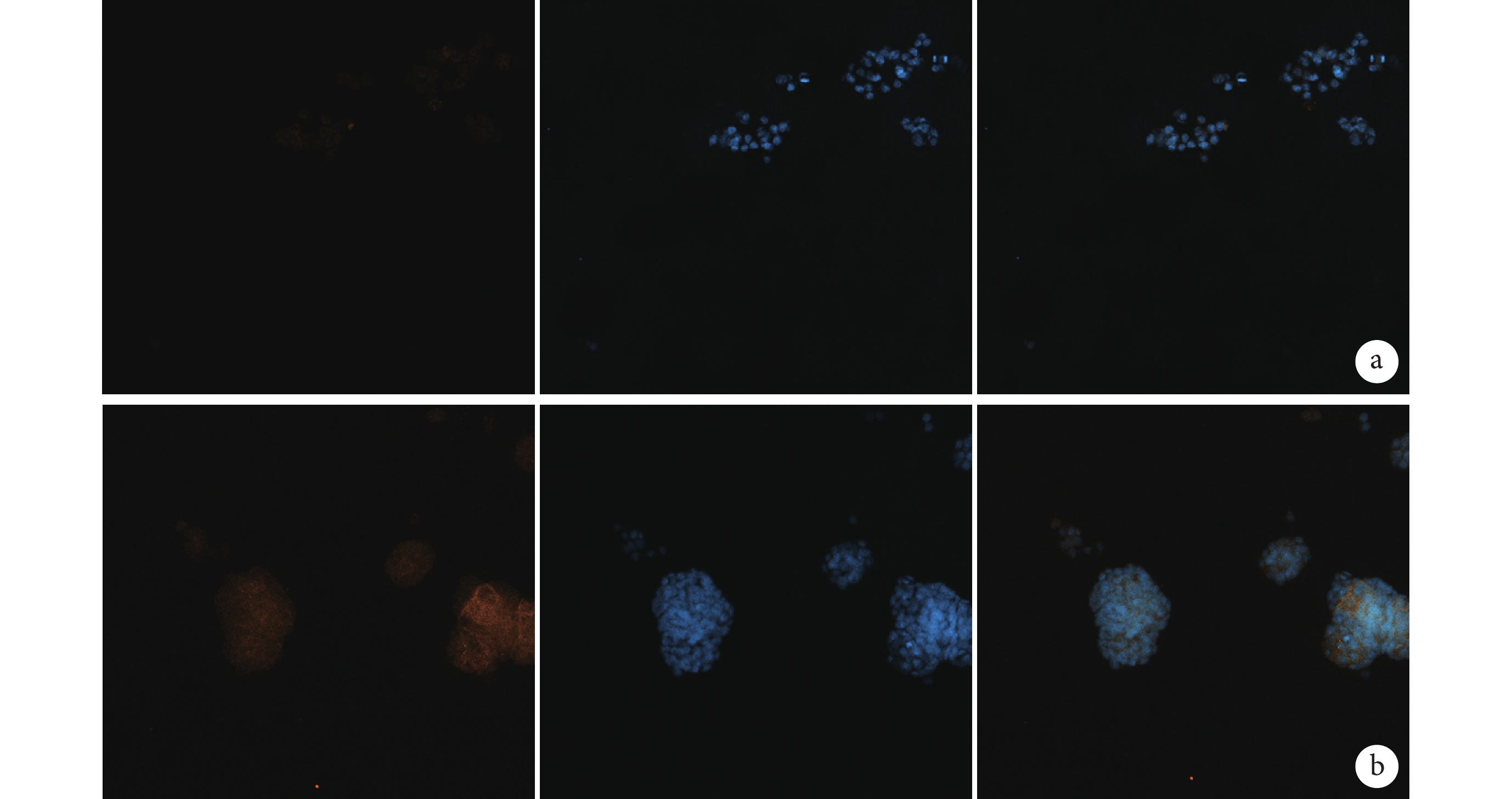 圖2
實驗組及對照組免疫細胞化學染色觀察(倒置熒光顯微鏡×200)
圖2
實驗組及對照組免疫細胞化學染色觀察(倒置熒光顯微鏡×200)
從左至右為 CD133、DAPI 及二者重疊 a. 對照組;b. 實驗組
Figure2. Immunocytochemical staining in experimental group and control group (Inverted fluorescence microscope×200)From left to right for CD133, DAPI, and merge a. Control group; b. Experimental group2.3 CST 流式細胞儀鑒定
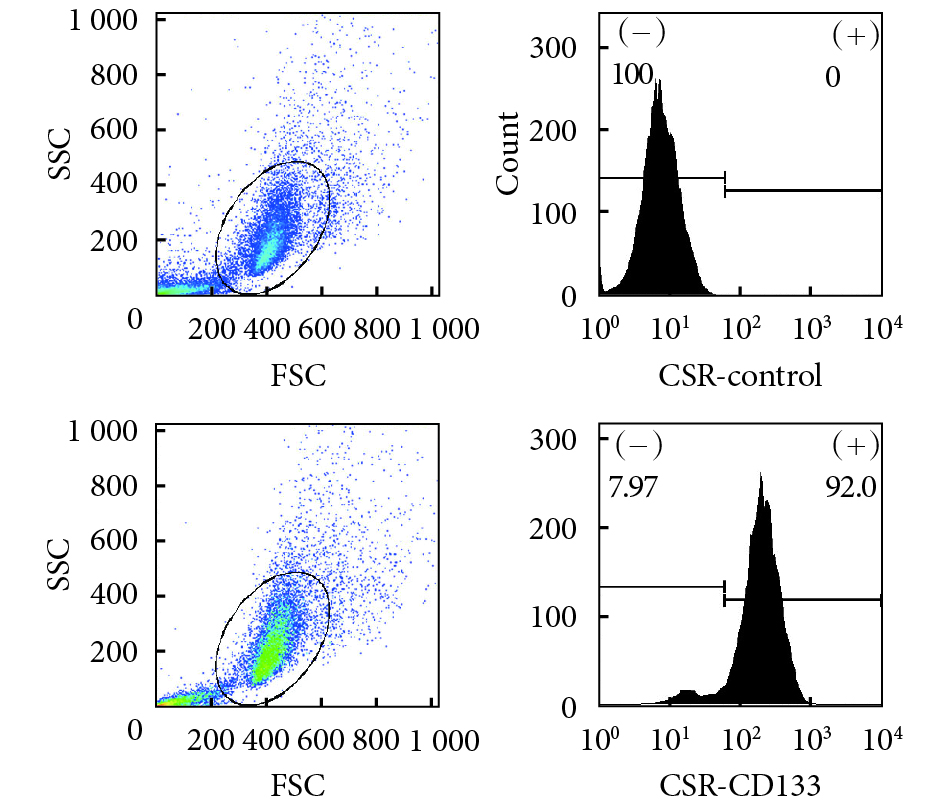
流式細胞儀檢測示,CST 中 CD133 呈陽性表達,陽性率為 92%。見圖 3。
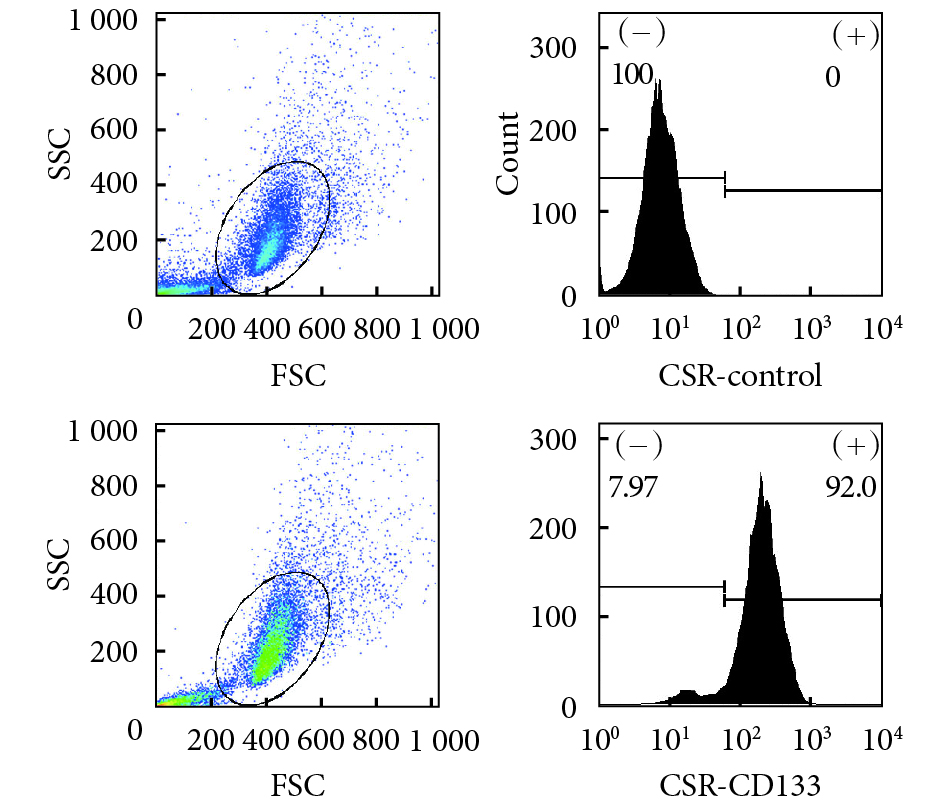 圖3
CST 流式細胞儀鑒定
Figure3.
Identification of CST by flow cytometry
圖3
CST 流式細胞儀鑒定
Figure3.
Identification of CST by flow cytometry
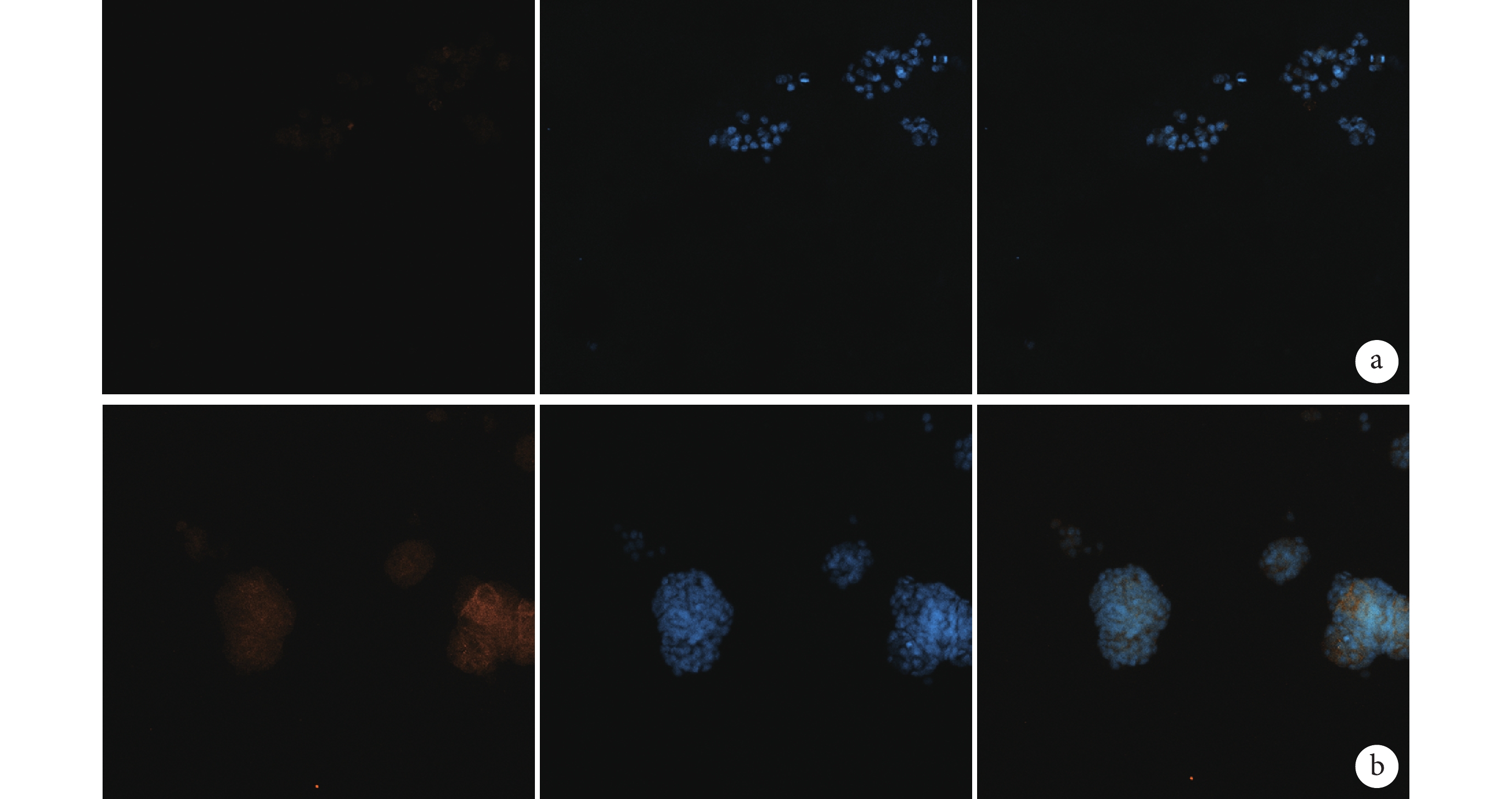
2.4 細胞 DNA 損傷實驗
倒置熒光顯微鏡觀察示,實驗組 CST 腫瘤球經 H2O2 損傷 120 min 后,其 γH2AX 表達較對照組 MCF-7 細胞明顯降低。見圖 4。
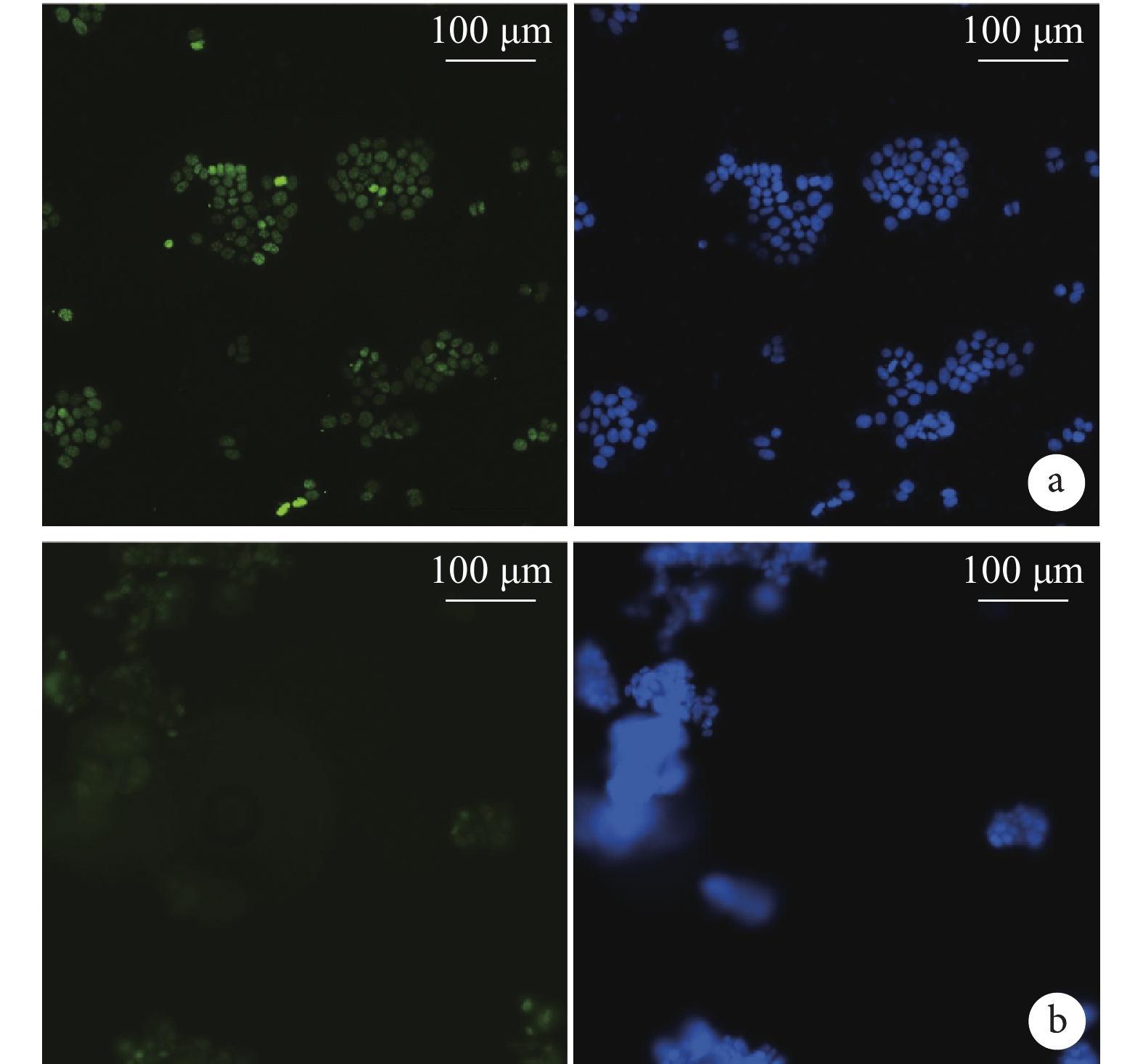 圖4
細胞 DNA 損傷實驗觀察(倒置熒光顯微鏡×200)
圖4
細胞 DNA 損傷實驗觀察(倒置熒光顯微鏡×200)
從左至右依次為 γH2AX、DAPI a. 對照組;b. 實驗組
Figure4. Observation of DNA damage (Inverted fluorescence microscopy×200)From left to right for γH2AX, DAPI a. Control group; b. Experimental group
3 討論
近年來大量研究證明腫瘤組織中存在 CST,這些干細胞有很強的自我更新及分化潛力,并具有很強的致瘤性[14-15]。傳統化療藥物以殺傷增殖活躍期腫瘤細胞為主,對處于“休眠期”的 CST 無殺傷作用。患者服用抗腫瘤藥物后,腫瘤會有不同程度縮小,但腫瘤細胞遭到藥物破壞后會激發 CST 增殖、分化,對腫瘤細胞起到修復與補充的作用,導致腫瘤進一步復發、惡化。而以 CST 為靶細胞,運用抗腫瘤藥物對其靶向殺傷,腫瘤細胞失去補充來源,可導致腫瘤退化、消失。CST 的發現深化了研究人員對腫瘤生物學分子機制的認知,其研究對于優化腫瘤治療措施、解決耐藥性等藥物開發和應用瓶頸有著積極影響[16-18]。由于 CST 在腫瘤細胞中所占比例少,CST 的有效分離和培養對于進一步研究 CST 生物學特性及藥物篩選意義重大[19-21]。
針對從腫瘤組織中獲取 CST 存在的客觀弊端,諸如組織來源少、組織數量少及部分基礎科研單位很難獲得等問題,本研究通過 MCF-7 細胞系無血清培養及去貼壁純化后得到懸浮腫瘤球,經免疫細胞化學染色及流式細胞儀檢測干細胞表面標志物,建立了快速簡便的 CST 分離和培養方法。懸浮球狀細胞大部分為 CD133 陽性細胞,而 CD133 為公認的 CST 表面標志物,因此本研究所獲得的懸浮成球細胞為 CST。
CST 具有特殊的損傷修復機制,可以修復因細胞分裂失控引發的 DNA 損傷。所以體外尋找 CST 損傷模型,可對后期抗腫瘤藥物篩選提供重要的評價標準及技術指標。氧化性損傷是新陳代謝 DNA 損傷的主要來源。正常情況下機體的氧化與抗氧化體系處于動態平衡,體內一定量的氧自由基是維持生命活動所必須的,但過量氧自由基會導致機體內 DNA 堿基突變、單雙鏈斷裂,進而導致細胞死亡。H2O2 是一種結構簡單、可彌散且相對溫和的氧化劑[22-23],本研究以 H2O2 作為刺激因素,初步研究了 CST 對氧化損傷的耐受性。在 50 μmol/L H2O2 處理下,通過 γH2AX 表達量的變化,可觀察到 MCF-7 細胞中產生了大量 DNA 損傷,而 CST 腫瘤球中 γH2AX 的表達較 MCF-7 細胞明顯降低。提示 MCF-7 細胞經無血清培養基培養及去貼壁純化后,得到的懸浮球狀細胞具備干細胞特性,對氧化損傷的耐受性增強。
綜上述,本研究建立了從 MCF-7 腫瘤細胞系中獲得 CD133 陽性 CST 的方法,并通過 H2O2 損傷檢測其具備一定抗氧化損傷效果,可以代替普通的腫瘤細胞系應用于高效抗腫瘤藥物篩選和腫瘤耐藥性機制研究 。
作者貢獻:馬文建、張同存負責文章整體思路的設計,并提供項目基金、科研實驗室的全方位支持,且馬文建負責文章修改;劉慶喜負責實驗設計、主要操作及文章撰寫;陳洪冉、李惠負責實驗實施,且陳洪冉負責統計分析。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
惡性腫瘤所致死亡人數越來越多,目前腫瘤治療手段仍為手術切除、放療和化療等,多數腫瘤很難得到根治且復發率極高[1-2],導致患者生存質量較差[3]。隨著科技發展,越來越多證據表明腫瘤中存在干細胞樣腫瘤細胞,這類細胞具有很強的增殖、自我更新能力和分化潛能,被稱為腫瘤干細胞(cancer stem cells,CST)[4-5]。有研究表明,CST 的存在導致了常規手術及放化療效果差且復發可能性高[6-7]。
由于 CST 可作為腫瘤細胞修復的種子細胞,常規放療、化療治療只能殺死腫瘤細胞,而對 CST 不敏感,導致化療后 CST 快速修復腫瘤細胞,導致腫瘤復發。因而研究 CST 的存在及其耐藥性機制是國際前沿研究熱點[8]。目前,CST 主要從腫瘤組織或腫瘤細胞系中獲取。由于腫瘤組織獲得困難、獲取量少,以及受腫瘤組織所處病理階段影響(例如良性期難以獲取)等一系列問題,導致 CST 提取困難,使得腫瘤組織來源的 CST 研究受到一定限制[9-10]。從腫瘤細胞系中獲得 CST 方法簡便,細胞系資源豐富,因此應用前景比較廣泛[11]。
目前抗腫瘤藥種類繁多,盡管眾多藥物臨床前試驗中對腫瘤細胞顯示很好的殺傷效果,但實際臨床應用效果卻不理想[12-13]。因而藥物研發耗資大、成效低,體外實驗模型的不足造成了很大的資源浪費。隨著近年來對 CST 耐藥特性的逐步了解,靶向具有高度致瘤性的 CST 成為藥物研發的熱點,有望彌補臨床上現有治療手段的缺陷,提高抗腫瘤藥物的臨床成功率,節省資源。
本研究采用無血清成球培養 MCF-7 細胞(人乳腺癌細胞),旨在建立一種簡單有效的 CST 獲取及功能測定方法,以期用于高效抗腫瘤藥物篩選及腫瘤耐藥性機制研究。
1 材料與方法
1.1 主要試劑及儀器
MCF-7 細胞由武漢科技大學醫學院饋贈,液氮存儲,干冰運輸。DMEM/F12 培養液、EGF、bFGF、B27、FBS、谷氨酰胺、0.5% 胰蛋白酶-EDTA、雙抗(GIBCO 公司,美國);鼠源 CD133 抗體(美天旎公司,德國);鼠源 γH2AX(histone H2AX phosphorylation)單克隆抗體、山羊抗小鼠 Alexa Fluor488 二抗(Abcam 公司,英國)。細胞培養箱、離心機(Thermo 公司,美國);超凈工作臺(蘇州凈化設備有限公司);超純水機(Millipore 公司,美國);倒置熒光顯微鏡(Olympus 公司,日本)。
1.2 MCF-7 細胞復蘇培養
將 MCF-7 細胞培養液(含 10%FBS、1% 谷氨酰胺、1% 青-鏈霉素的 DMEM/F12 培養液)與 DMEM/F12 基礎培養液分別置于水浴鍋內預熱至 37℃。在 15 mL 離心管中加入 6 mL 預熱的 DMEM/F12 基礎培養基,將 MCF-7 細胞從液氮中取出并迅速置于 37℃ 水浴鍋中解凍,然后吸取細胞懸液(1 mL)至上述離心管中,室溫以離心半徑 20 cm、1 000 r/min 離心 5 min;棄上清液,加入適量 MCF-7 細胞培養液,調整細胞濃度為 1×105個/mL 接種于培養瓶中,置于 37℃、5%CO2 培養箱中培養。
1.3 MCF-7 細胞懸浮成球培養
待 MCF-7 細胞生長密度達培養瓶底面積 80% 后棄培養液,0.01 mol/L PBS 清洗 2 次后換成懸浮成球培養基(含 10 ng/mL bFGF、20 ng/mL EGF、1%B27 的 DMEM/F12 培養液)培養;每隔 2 d 換液 1 次,直至出現腫瘤球后輕輕吹懸腫瘤球,棄掉單個貼壁生長的腫瘤細胞;0.05% 胰蛋白酶消化腫瘤球,然后以 1×105個/mL 密度鋪種于新的 10 cm 培養皿中,置于 37℃、5%CO2 培養箱中培養。腫瘤球直徑達 150 μm 左右時行傳代培養。采用倒置相差顯微鏡觀察細胞形態變化,取 MCF-7 細胞培養液培養的 MCF-7 細胞作為對照。
1.4 觀測指標
1.4.1 免疫細胞化學染色觀察
取第 3 代懸浮成球生長的 MCF-7 細胞,室溫以離心半徑 20 cm、1 000 r/min 離心 5 min, 0.01 mol/L PBS 清洗 2 次,0.05% 胰蛋白酶消化腫瘤球,以 1×105個/mL 密度鋪種于 24 孔板,作為實驗組;對照組取 MCF-7 細胞以相同密度接種。待實驗組腫瘤球直徑達 100 μm 左右、對照組 MCF-7 細胞密度達培養瓶底面積 70% 左右時,吸棄培養基(實驗組腫瘤球每次換液前,置于 15 mL 離心管中,室溫以離心半徑 20 cm、1 000 r/min 離心 5 min,去除培養液),0.01 mol/L PBS 洗 3 次,每次 5 min;加入 4% 多聚甲醛固定 15 min,0.01 mol/L PBS 洗 3 次,每次 5 min;加入 0.25% Triton X-100 作用 15 min,用羊血清封閉 30 min,添加鼠源 CD133 抗體(1∶50)、1 μg/mL 鼠源 γH2AX 單克隆抗體,4℃ 過夜;加入山羊抗鼠 Alexa Fluor488 二抗,避光孵育 2 h,DAPI 核染 10 min,0.01 mol/L PBS 浸洗 3 次,每次 5 min;倒置熒光顯微鏡下觀察 CST 標志物 CD133 及細胞 DNA 損傷標志物 γH2AX 表達情況。
1.4.2 CST 流式細胞儀鑒定
收集直徑達 150 μm 的第 3 代腫瘤球細胞,經 0.05% 胰蛋白酶消化 5 min,使用 DMEM/F12 基礎培養液對其進行稀釋,以離心半徑 20 cm、1 000 r/min 離心 5 min,0.01 mol/L PBS 洗滌 2 次后重懸計數。調整細胞密度為 1×106個/管,加入 4% 多聚甲醛固定液固定 15 min,0.01 mol/L PBS 清洗 2 次,每次 5 min;以離心半徑 20 cm、1 000 r/min 離心 5 min,加入 CD133 一抗(1∶50)4℃ 過夜(對照管不加 CD133 抗體);0.01 mol/L PBS 清洗 2 次,每次 5 min,加入山羊抗小鼠 Alexa Fluor488 二抗室溫孵育 2 h;0.01 mol/L PBS 清洗 2 次,每次 5 min,取 500 μL 吹懸細胞過濾后上流式細胞儀檢測。
1.4.3 細胞 DNA 損傷實驗
收集直徑達到 150 μm 的第 2 代腫瘤球細胞(實驗組)以及相應代數的 MCF-7 細胞(對照組),經 0.05% 胰蛋白酶消化 5 min,使用各自基礎培養液對其進行稀釋;以離心半徑 20 cm、1 000 r/min 離心 5 min,棄培養液,0.01 mol/L PBS 洗滌 2 次后重懸計數,調整細胞密度,以 2×104個/孔接種于 24 孔板。對直徑達到 100 μm 的 CST 腫瘤球、融合度達到 70% 的 MCF-7 細胞進行 DNA 損傷處理,分別加入 50 μmol/L H2O2 損傷 120 min。然后使用 0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),加入 4% 多聚甲醛固定液固定 15 min,0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),每次 5 min;加入鼠源 γH2AX 單克隆抗體一抗(1 μg/mL),4℃ 過夜;0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),每次 5 min,加入山羊抗小鼠 Alexa Fluor488 二抗室溫孵育 2 h,DAPI 核染 10 min;0.01 mol/L PBS 清洗 2 次(CST 腫瘤球以離心半徑 20 cm、1 000 r/min 離心 5 min,收集沉淀),每次 5 min。取 CST 腫瘤球及 MCF-7 細胞于倒置熒光顯微鏡下觀察 γH2AX 表達情況。
2 結果
2.1 MCF-7 細胞及 CST 球形態觀察
倒置相差顯微鏡觀察示,MCF-7 細胞最初以單細胞貼壁狀態生長;經懸浮成球培養基培養及去貼壁純化后,細胞呈球狀、懸浮生長,遮光性強。而經 MCF-7 細胞培養液培養的對照 MCF-7 細胞呈伸展狀貼壁生長,不能成球懸浮生長。見圖 1。
 圖1
CST 形成過程形態觀察(倒置相差顯微鏡×200)
圖1
CST 形成過程形態觀察(倒置相差顯微鏡×200)
a. 初始 MCF-7 細胞;b. 經懸浮成球培養基培養約 3 d 的 CST,直徑約 100 μm;c. 經 MCF-7 培養基培養約 3 d 的 MCF-7 細胞
Figure1. Morphological observation during the formation of CST (Inverted phase contrast microscope×200)a. Initial MCF-7 cells; b. CST cultured in suspension balling medium for about 3 days with a diameter of about 100 μm; c. Adherent MCF-7 cells cultured in MCF-7 medium for about 3 days
2.2 免疫細胞化學染色觀察
倒置熒光顯微鏡觀察示,對照組 MCF-7 細胞 CD133 為陰性表達,而實驗組腫瘤球 CD133 為陽性表達。見圖 2。
 圖2
實驗組及對照組免疫細胞化學染色觀察(倒置熒光顯微鏡×200)
圖2
實驗組及對照組免疫細胞化學染色觀察(倒置熒光顯微鏡×200)
從左至右為 CD133、DAPI 及二者重疊 a. 對照組;b. 實驗組
Figure2. Immunocytochemical staining in experimental group and control group (Inverted fluorescence microscope×200)From left to right for CD133, DAPI, and merge a. Control group; b. Experimental group2.3 CST 流式細胞儀鑒定
流式細胞儀檢測示,CST 中 CD133 呈陽性表達,陽性率為 92%。見圖 3。
 圖3
CST 流式細胞儀鑒定
Figure3.
Identification of CST by flow cytometry
圖3
CST 流式細胞儀鑒定
Figure3.
Identification of CST by flow cytometry
2.4 細胞 DNA 損傷實驗
倒置熒光顯微鏡觀察示,實驗組 CST 腫瘤球經 H2O2 損傷 120 min 后,其 γH2AX 表達較對照組 MCF-7 細胞明顯降低。見圖 4。
 圖4
細胞 DNA 損傷實驗觀察(倒置熒光顯微鏡×200)
圖4
細胞 DNA 損傷實驗觀察(倒置熒光顯微鏡×200)
從左至右依次為 γH2AX、DAPI a. 對照組;b. 實驗組
Figure4. Observation of DNA damage (Inverted fluorescence microscopy×200)From left to right for γH2AX, DAPI a. Control group; b. Experimental group
3 討論
近年來大量研究證明腫瘤組織中存在 CST,這些干細胞有很強的自我更新及分化潛力,并具有很強的致瘤性[14-15]。傳統化療藥物以殺傷增殖活躍期腫瘤細胞為主,對處于“休眠期”的 CST 無殺傷作用。患者服用抗腫瘤藥物后,腫瘤會有不同程度縮小,但腫瘤細胞遭到藥物破壞后會激發 CST 增殖、分化,對腫瘤細胞起到修復與補充的作用,導致腫瘤進一步復發、惡化。而以 CST 為靶細胞,運用抗腫瘤藥物對其靶向殺傷,腫瘤細胞失去補充來源,可導致腫瘤退化、消失。CST 的發現深化了研究人員對腫瘤生物學分子機制的認知,其研究對于優化腫瘤治療措施、解決耐藥性等藥物開發和應用瓶頸有著積極影響[16-18]。由于 CST 在腫瘤細胞中所占比例少,CST 的有效分離和培養對于進一步研究 CST 生物學特性及藥物篩選意義重大[19-21]。
針對從腫瘤組織中獲取 CST 存在的客觀弊端,諸如組織來源少、組織數量少及部分基礎科研單位很難獲得等問題,本研究通過 MCF-7 細胞系無血清培養及去貼壁純化后得到懸浮腫瘤球,經免疫細胞化學染色及流式細胞儀檢測干細胞表面標志物,建立了快速簡便的 CST 分離和培養方法。懸浮球狀細胞大部分為 CD133 陽性細胞,而 CD133 為公認的 CST 表面標志物,因此本研究所獲得的懸浮成球細胞為 CST。
CST 具有特殊的損傷修復機制,可以修復因細胞分裂失控引發的 DNA 損傷。所以體外尋找 CST 損傷模型,可對后期抗腫瘤藥物篩選提供重要的評價標準及技術指標。氧化性損傷是新陳代謝 DNA 損傷的主要來源。正常情況下機體的氧化與抗氧化體系處于動態平衡,體內一定量的氧自由基是維持生命活動所必須的,但過量氧自由基會導致機體內 DNA 堿基突變、單雙鏈斷裂,進而導致細胞死亡。H2O2 是一種結構簡單、可彌散且相對溫和的氧化劑[22-23],本研究以 H2O2 作為刺激因素,初步研究了 CST 對氧化損傷的耐受性。在 50 μmol/L H2O2 處理下,通過 γH2AX 表達量的變化,可觀察到 MCF-7 細胞中產生了大量 DNA 損傷,而 CST 腫瘤球中 γH2AX 的表達較 MCF-7 細胞明顯降低。提示 MCF-7 細胞經無血清培養基培養及去貼壁純化后,得到的懸浮球狀細胞具備干細胞特性,對氧化損傷的耐受性增強。
綜上述,本研究建立了從 MCF-7 腫瘤細胞系中獲得 CD133 陽性 CST 的方法,并通過 H2O2 損傷檢測其具備一定抗氧化損傷效果,可以代替普通的腫瘤細胞系應用于高效抗腫瘤藥物篩選和腫瘤耐藥性機制研究 。
作者貢獻:馬文建、張同存負責文章整體思路的設計,并提供項目基金、科研實驗室的全方位支持,且馬文建負責文章修改;劉慶喜負責實驗設計、主要操作及文章撰寫;陳洪冉、李惠負責實驗實施,且陳洪冉負責統計分析。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。