引用本文: 柴樂, 全仁夫, 胡勁濤, 黃小龍, 呂建蘭, 張燦, 邱銳, 蔡兵兵. BMP-2 明膠/殼聚糖水凝膠緩釋系統復合羥基磷灰石/二氧化鋯泡沫陶瓷與誘導多能干細胞來源 MSCs 的體外研究. 中國修復重建外科雜志, 2019, 33(2): 252-258. doi: 10.7507/1002-1892.201809060 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
大段骨缺損修復一直是骨科臨床難題之一。組織工程骨理念的提出,為骨缺損修復提供了新思路和新途徑。組織工程骨是由種子細胞、支架、生物活性物質等組成,通過這些物質的相互調控,可促進骨組織愈合。羥基磷灰石(hydroxyapatite,HA)/二氧化鋯(ZrO2)生物活性、抗壓強度等經深入研究,被認為可以作為組織工程骨支架材料。BMSCs 具有增殖分化、免疫調節、擴增方便等優點,但有限的增殖能力、長期培養細胞活力易喪失等因素限制了其發展[1]。誘導多能干細胞(induced pluripotent stem cells,iPS)表現出無限增長和分化能力[2],但其臨床使用的安全性及其衍生物尚未完全闡明[3-4]。近年有研究報道采用 iPS 來源 MSCs(iPS-MSCs)靶向骨和/或軟骨修復[5-9],故本實驗采用 iPS-MSCs 作為種子細胞。BMP 可誘導動物或人 BMSCs 分化為骨、軟骨、韌帶、肌腱和神經組織,且 BMP-2 可增強骨缺損愈合過程中 BMSCs 成骨分化能力[10-11]。但 BMP-2 循環半衰期相當短,如果通過靜脈注射使用,血液中的酶很容易使 BMP-2 失活[12-13];另一個缺點是靜脈注射 BMP-2 可能產生爆發效應,導致軟組織血腫和骨吸收現象[14]。而殼聚糖的遞送系統能夠使 BMP-2 在特定位置持續釋放[15]。故本實驗采用 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植人 iPS-MSCs ,與 HA/ZrO2 多孔生物泡沫陶瓷材料體外共培養,探索緩釋系統對 iPS-MSCs 成骨分化作用,并觀察 iPS-MSCs 在HA/ZrO2 多孔生物泡沫陶瓷材料上的黏附及活性,為后期體內研究奠定理論基礎。
1 材料與方法
1.1 主要材料、試劑及儀器
β-甘油磷酸鈉(北京索萊寶科技有限公司);ALP 試劑盒、一抗、FITC 標記二抗、Hoechst(碧云天生物技術公司);RPMI1640 完全培養基、殼聚糖粉末、BMP-2(Sigma 公司,美國);iPS-MSCs(本課題組黃小龍提供);明膠粉末、氯仿、異丙醇、無水乙醇、乙酸異戊酯(上海國藥集團);HA/ZrO2 多孔生物泡沫陶瓷材料(上海大學材料學院);Trizol(Invitrogen 公司,美國);DEPC 處理水、2.5% 戊二醛(上海諾辰生物技術有限公司);SYBR Green PCR 試劑盒、逆轉錄試劑盒(Thermo 公司,美國);4% 多聚甲醛(上海潤捷化學試劑有限公司);5%FBS(HyClone 公司,美國)。
低溫冷凍離心機(Sigma 公司,美國);倒置顯微鏡、熒光顯微鏡(Leica 公司,德國);酶聯免疫測試儀(Thermo Scientific Varioskan Flash 公司,美國);ABI-7500 RT-PCR 儀(Thermo Fisher 公司,美國);S4800 掃描電鏡(日立公司,日本)。
1.2 BMP-2 明膠/殼聚糖水凝膠緩釋系統構建及觀測
1.2.1 BMP-2 明膠/殼聚糖水凝膠微球構建
采用油包水相溶液法制備 BMP-2 明膠/殼聚糖水凝膠微球。具體方法:① 取 1 g 明膠粉末于 50°C 溶解于 10 mL 去離子水,500 r/min 磁力攪拌下將其逐滴加入預加熱至 50°C 的 60 mL 橄欖油中,持續攪拌下乳化 10 min;乳化液在攪拌中逐漸冷卻至 4°C,形成固態微球,時間約 40 min。4°C 丙酮和乙醇分別漂洗 3 次,得到明膠微球,凍干。② 將制備的凍干明膠微球分散加入制備好的含 50 mmol/L 乙二醛的乙醇溶液中,室溫 500 r/min 磁力攪拌 10 h,離心沉淀,將沉淀用乙醇洗滌 2 次,凍干;再用 100 μm 和 50 μm 濾網過濾,得到明膠微球。③ 將殼聚糖粉末溶于 0.75%(V/V)乙酸水溶液中制得 1.5%(W/V)殼聚糖溶液,待完全溶解后用 0.45 μm 濾膜過濾,4°C 保存。將 β-甘油磷酸鈉溶于去離子水得到 50%(W/V)β-甘油磷酸鈉溶液,0.22 μm 濾膜過濾,4°C 保存。④ 將上述明膠微球加入 50 mL 1.5%(W/V)殼聚糖溶液中,調節 pH 值至 6.3;再將溶解后的 BMP-2 加入 50 mL 1.5%(W/V)殼聚糖溶液中,將 50%(W/V)β-甘油磷酸鈉溶液在 500 r/min 磁力攪拌下逐滴加入 50 mL 1.5%(W/V)殼聚糖溶液中,使最后溶液含 β-甘油磷酸鈉溶度為 88 mmol/L,pH 值約 7.2。將 BMP-2 明膠/殼聚糖水凝膠微球在 37°C 孵育 3 h。以上步驟均在無菌條件下進行。
1.2.2 BMP-2 明膠/殼聚糖水凝膠微球藥物包封率、載藥率和體外緩釋速率檢測
采用 ELISA 試劑盒法檢測,具體方法:取 5 mL 試管 3 支,每支試管中置入 150 mg BMP-2 明膠/殼聚糖水凝膠微球,各加 PBS(pH7.2)2 mL,37℃ 水浴振蕩;分別于 6 h、12 h 及 1、2、3、6、9、12、15 d,每支試管各取上清液 100 μL,測定波長 450 nm 及校準 570 nm 處的吸光度(A)值,根據標準曲線方程計算上清液中 BMP-2 濃度,從而計算出上清液中 BMP-2 含量。按以下公式計算各指標:① 藥物包封率=(BMP-2 總含量?上清液 BMP-2 含量)/BMP-2 總含量×100%;② 載藥率=(BMP-2 總含量?上清液 BMP-2 含量)/微球總質量(150 mg)×100%;③ 體外緩釋速率=上清液 BMP-2 含量/BMP-2 總含量×100%,并繪制 BMP-2 明膠/殼聚糖水凝膠微球累積釋放曲線。
1.2.3 BMP-2 明膠/殼聚糖水凝膠微球形態觀察
將 BMP-2 明膠/殼聚糖水凝膠微球裁剪成 3 mm×1 mm 大小,固定于樣本臺,掃描電鏡觀察微球表面結構。
1.3 支架材料-微球-細胞共培養體系的建立及相關觀測
1.3.1 共培養體系的建立
將 HA/ZrO2 多孔生物泡沫陶瓷材料高溫滅菌后,用無菌 0.01%(W/V)多聚賴氨酸浸泡過夜,無菌條件下晾干,然后放入培養皿并用 RPMI1640 完全培養基浸潤。在培養皿底部放置磁鐵,將純化后的 iPS-MSCs 和 BMP-2 明膠/殼聚糖水凝膠緩釋系統制成懸浮液,然后逐滴緩慢滴至 HA/ZrO2 多孔生物泡沫陶瓷材料上。RPMI1640 完全培養基培養,置于 37℃、5%CO2 培養箱內液面下培養 2 周,細胞融合后改為氣?液界面培養 10 d,作為實驗組。另外,同上法將 HA/ZrO2 多孔生物泡沫陶瓷材料僅和純化后的 iPS-MSCs 共培養,作為對照組。
1.3.2 ALP 分泌量檢測
兩組共培養體系體外培養 3、7、10、14 d,采用 ALP 檢測試劑盒檢測 ALP 分泌量。
1.3.3 RT-PCR 檢測
兩組共培養體系體外培養 3、7、10、14 d,按 miRNA 試劑盒說明書進行操作。RT-PCR 擴增程序:熱變性 95℃、10 min;擴增 95℃、20 s,62℃、30 s,72℃、30 s;40 個循環。數據采用儀器自帶軟件分析 ABI Prism 7500 SDS Software 分析,采用 2–ΔΔCt法計算目的基因[核心結合因子 α1(core binding factor α1,Cbfa1)、Ⅰ型膠原、鋅指結構轉錄因子(Osterix,OSX)]相對表達量。目的基因引物序列見表 1。
1.3.4 免疫組織化學染色檢測Ⅰ型膠原表達
兩組共培養體系體外培養 14 d 取出,PBS 漂洗 1 次,4% 多聚甲醛固定 15~30 min,再用 PBS 漂洗 3 min×2 次;3.5%FBS 室溫下封閉 15 min,不洗;一抗Ⅰ型膠原抗體 4℃ 孵育過夜,PBS 洗 5 min×3 次;滴加二抗工作液,37℃ 孵育 1 h;室溫避光孵育 Hoechst 15 min;熒光顯微鏡下觀察。
1.3.5 掃描電鏡觀察細胞爬行及黏附狀態
兩組共培養體系培養 14 d 后取出,4℃ 預冷 PBS 漂洗,2.5% 冷戊二醛固定 24 h;吸出固定液,PBS 漂洗,徹底除去戊二醛;梯度乙醇脫水,乙酸異戊酯置換,臨界點干燥,表面噴金后掃描電鏡觀察。
1.4 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用采用獨立樣本 t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 BMP-2 明膠/殼聚糖水凝膠緩釋系統相關觀測
2.1.1 藥物包封率、載藥率和體外緩釋速率
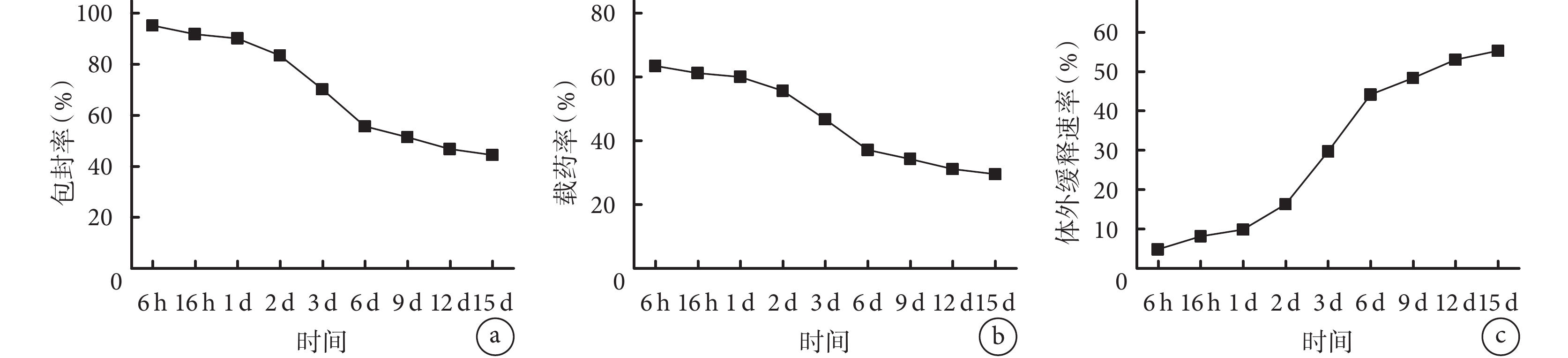
① 藥物包封率:在 1 d 內微球的藥物包封率均高達 90% 以上,隨時間推移藥物包封率逐漸降低,但在 15 d 時仍有 44.49%±0.20%。見圖 1a。② 載藥率:在 1 d 內微球的載藥率均達 60% 以上,隨時間推移載藥率緩慢下降,15 d 時仍有 29.6%±0.14%。見圖 1b。③ 體外緩釋速率:BMP-2 的釋放表現出階段性釋放規律,前 1 d 內釋放緩慢,處于適應階段;1~6 d 表現為 rhBMP-2 爆發性釋放階段,第 6 天累積釋放率達 44.27%±0.30%;之后逐漸進入 BMP-2 緩慢釋放階段(6~12 d),第 12 天時累積釋放率達 53.22%±0.18%;最后進入穩定階段(12~15 d),第 15 天時累積釋放率為 55.50%±0.20%。見圖 1 c。
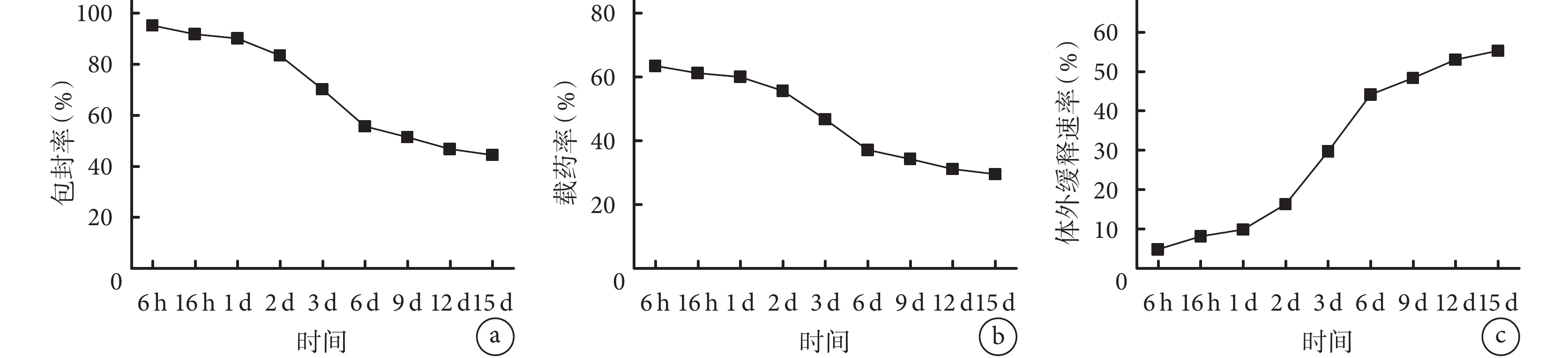 圖1
BMP-2 明膠/殼聚糖水凝膠微球 ELISA 檢測
圖1
BMP-2 明膠/殼聚糖水凝膠微球 ELISA 檢測
a. 藥物包封率;b. 載藥率;c. 體外緩釋速率
Figure1. ELISA detection of BMP-2 gelatin/chitosan hydrogel microspheresa. Drug encapsulation efficiency; b. Drug loading; c. In vitro sustained release rate
2.1.2 BMP-2 明膠/殼聚糖水凝膠微球掃描電鏡觀察
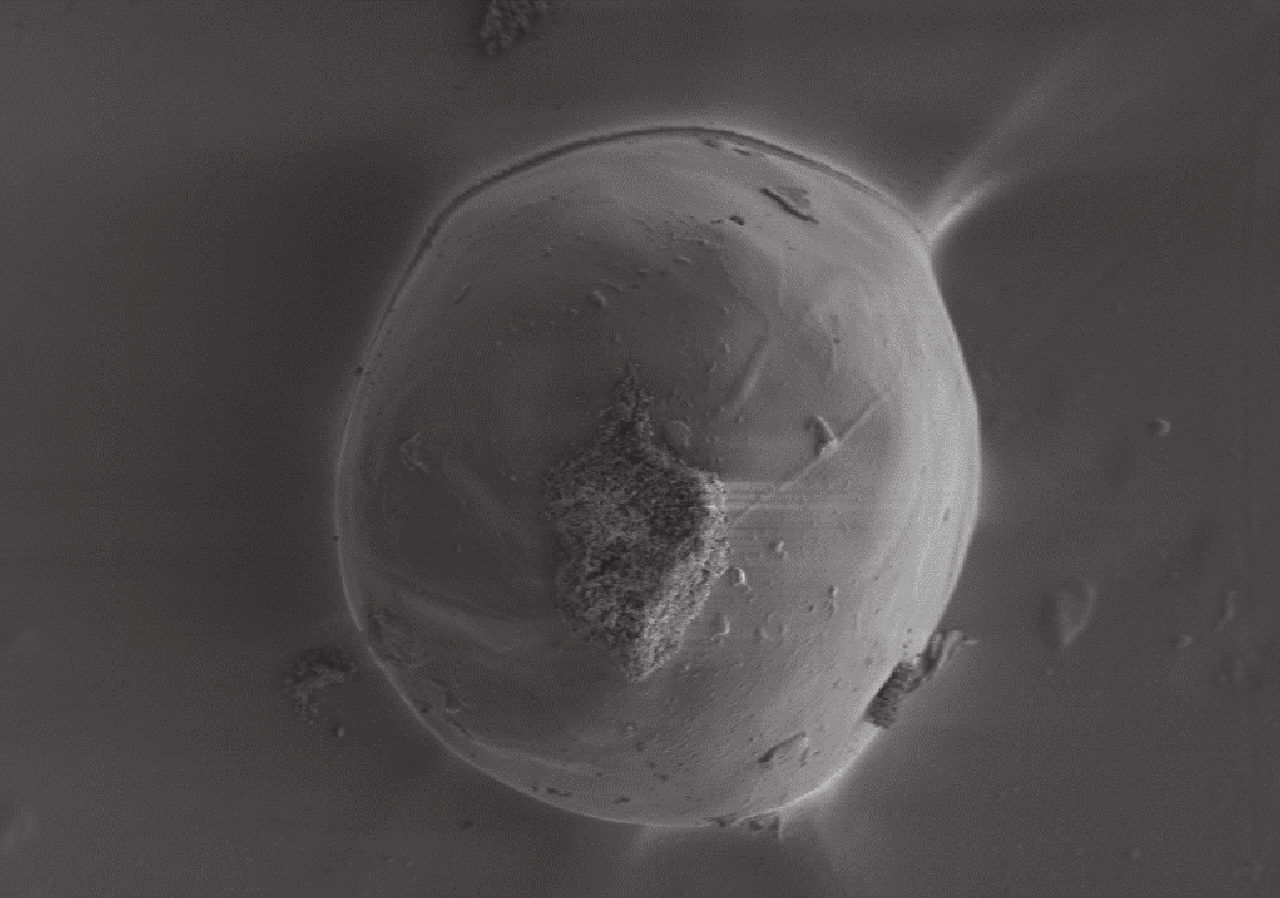
掃描電鏡觀察示 BMP-2 明膠/殼聚糖水凝膠微球的球形良好,球形表面較光滑,其直徑約為(255±26)μm。見圖 2。
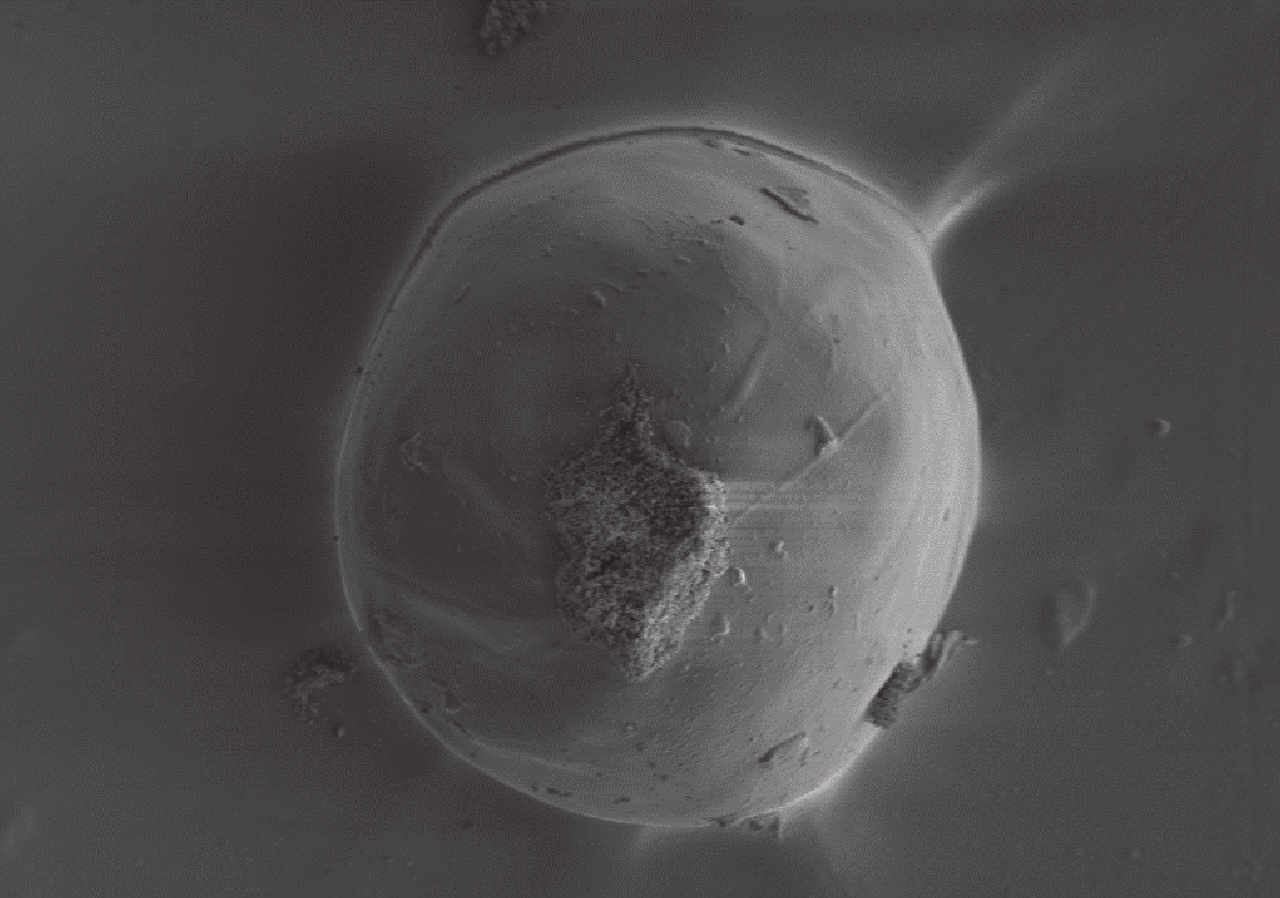 圖2
BMP-2 明膠/殼聚糖水凝膠微球掃描電鏡觀察(×200)
Figure2.
Scanning electron microscopy observation of BMP-2 gelatin/chitosan hydrogel microsphere (×200)
圖2
BMP-2 明膠/殼聚糖水凝膠微球掃描電鏡觀察(×200)
Figure2.
Scanning electron microscopy observation of BMP-2 gelatin/chitosan hydrogel microsphere (×200)
2.2 共培養體系相關觀測
2.2.1 ALP 分泌量檢測
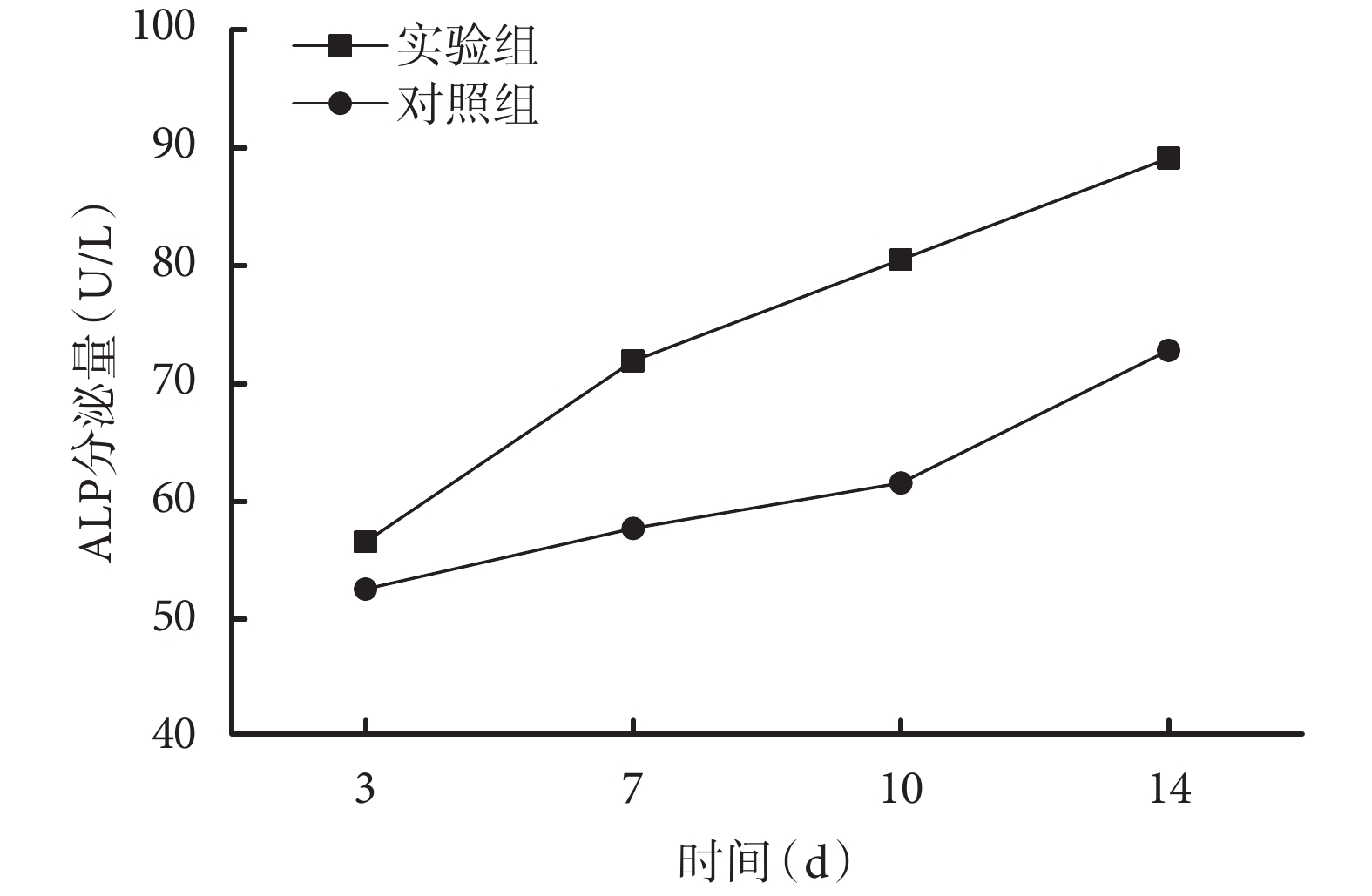
隨培養時間延長,兩組 ALP 分泌量均逐漸增加;各時間點實驗組 ALP 分泌量均顯著高于對照組,差異有統計學意義(P<0.05)。見圖 3。
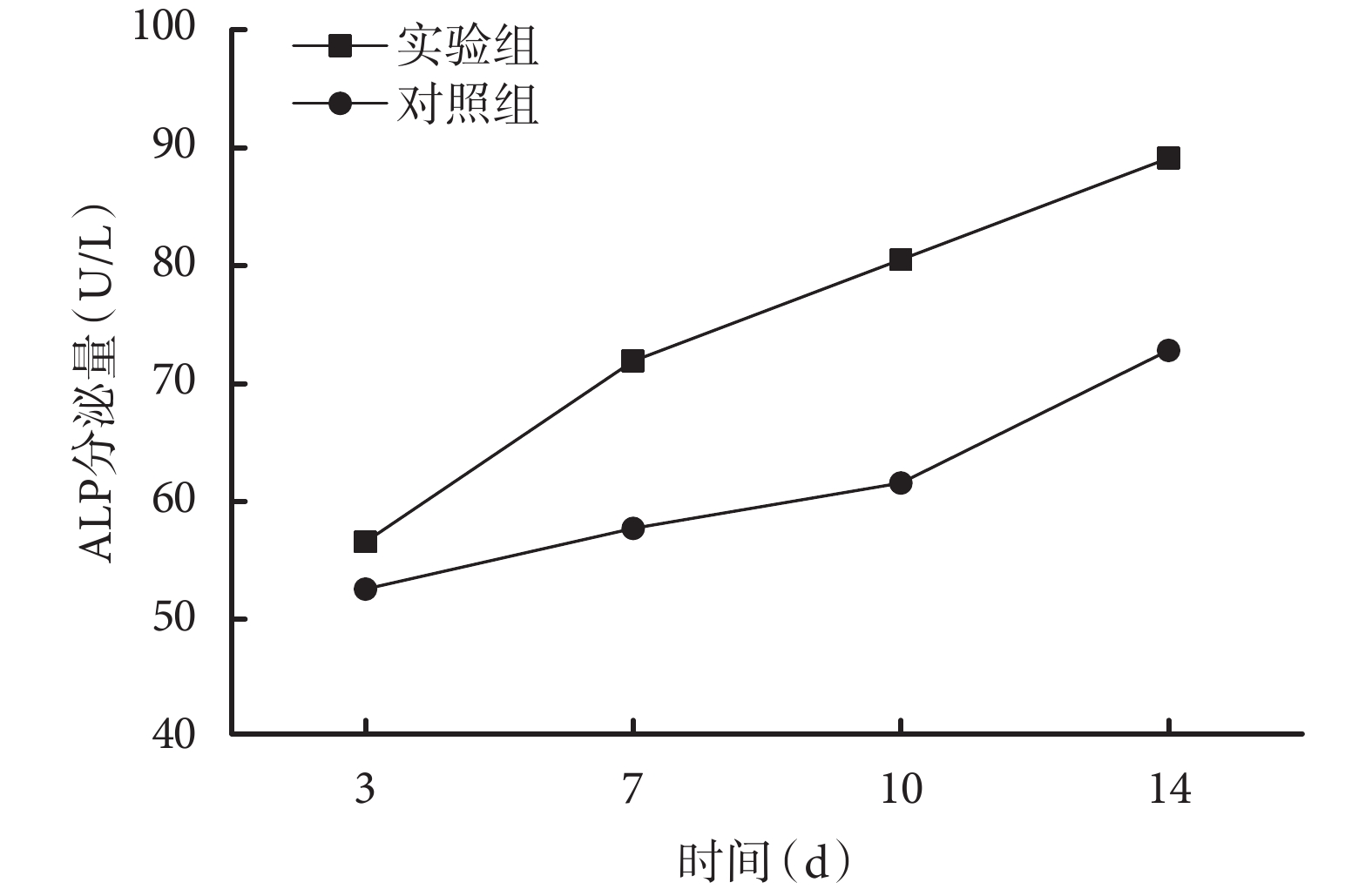 圖3
兩組培養各時間點 ALP 分泌量檢測
Figure3.
Detection of ALP secretion at different time points in the two groups
圖3
兩組培養各時間點 ALP 分泌量檢測
Figure3.
Detection of ALP secretion at different time points in the two groups
2.2.2 RT-PCR 檢測
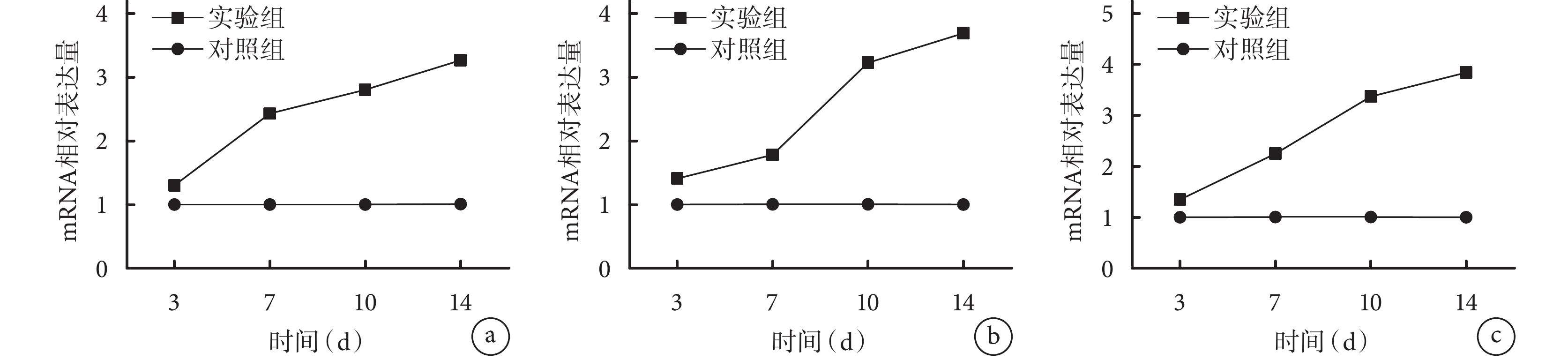
隨培養時間延長,對照組各目的基因相對表達量無明顯變化;實驗組各目的基因相對表達量均逐漸增加,其中 Cbfa1 在 3~7 d 增加明顯,Ⅰ型膠原在 7~10 d 增加明顯,OSX 增加趨勢較均勻,10 d 后各目的基因表達增幅均降低。各時間點實驗組各目的基因相對表達量均顯著高于對照組,差異有統計學意義(P<0.05)。見圖 4。
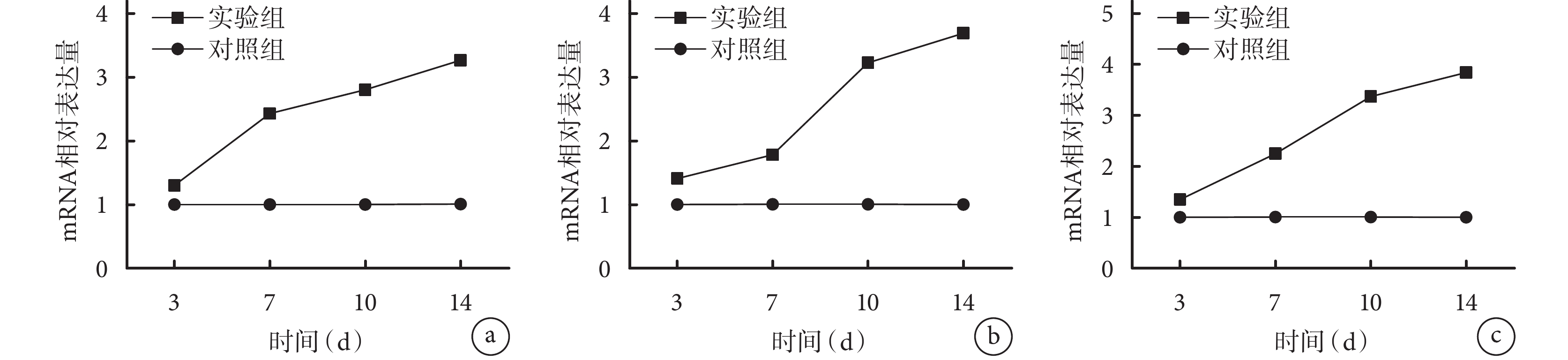 圖4
RT-PCR 檢測兩組培養各時間點各基因相對表達量
圖4
RT-PCR 檢測兩組培養各時間點各基因相對表達量
a. Cbfa1;b. Ⅰ型膠原;c. OSX
Figure4. RT-PCR detection of relative expression of genes in the two groups at different time pointsa. Cbfa1; b. Collagen type Ⅰ; c. OSX
2.2.3 免疫組織化學染色檢測Ⅰ型膠原表達
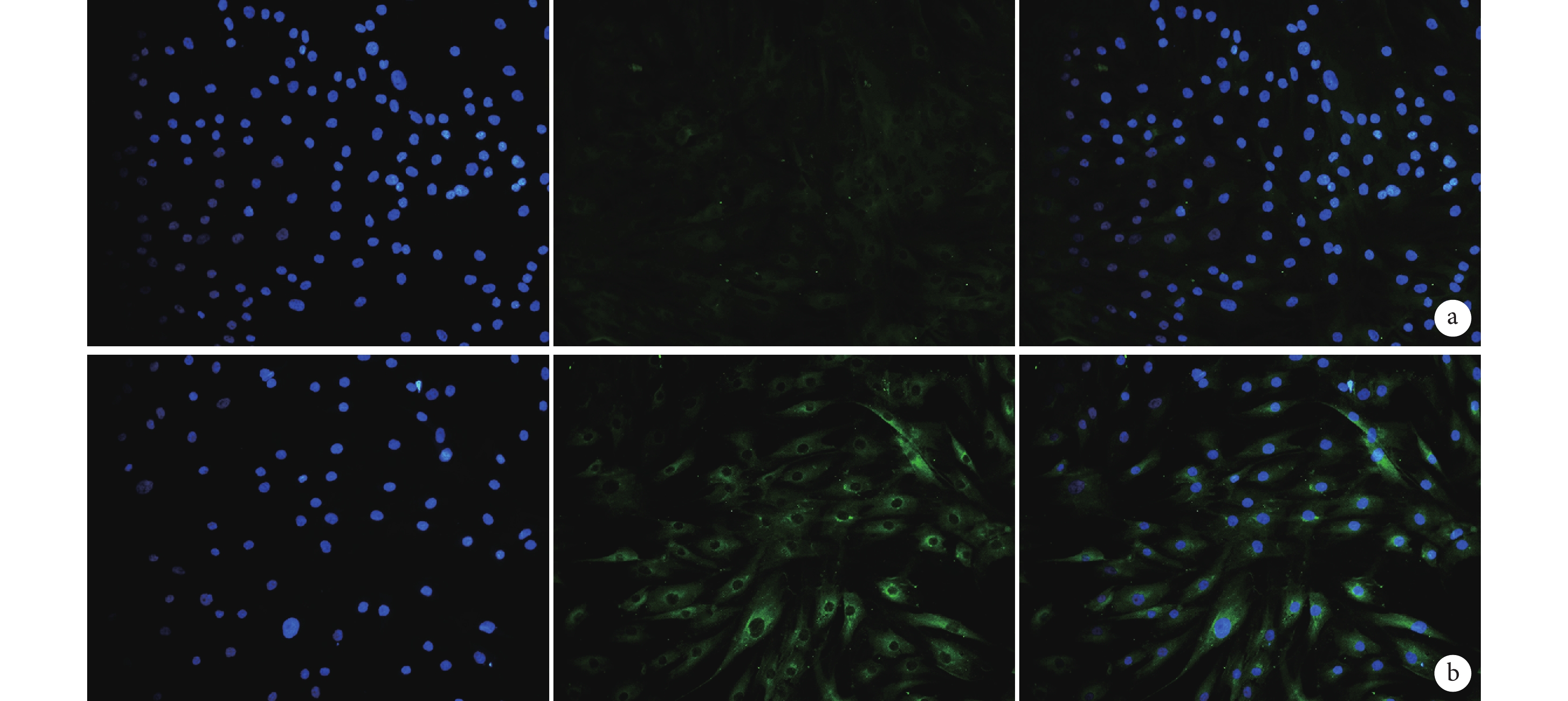
熒光顯微鏡觀察示,實驗組熒光數量明顯多于對照組,即Ⅰ型膠原表達水平高于對照組;細胞均能較均勻地分布于材料上,細胞形態良好。見圖 5。
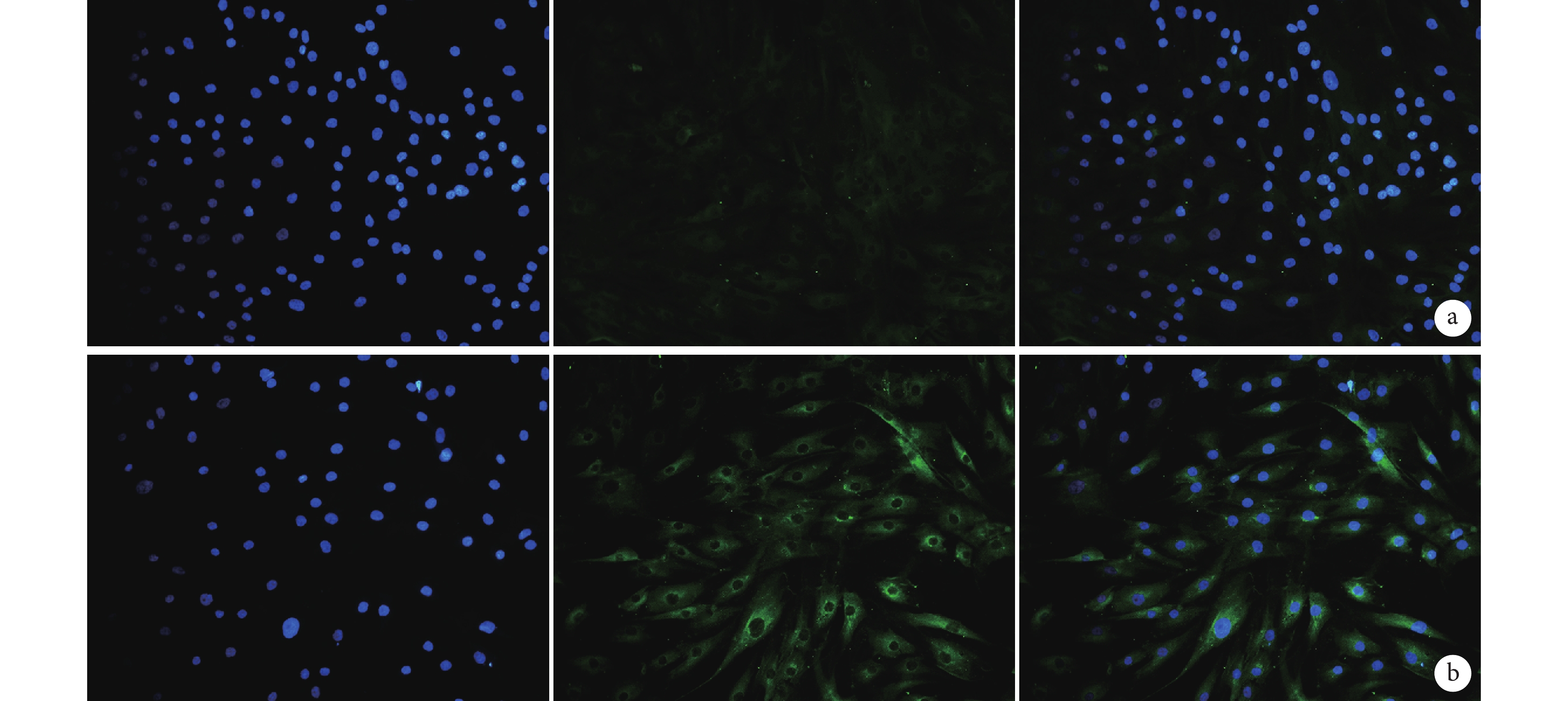 圖5
兩組培養 14 d 免疫組織化學染色觀察(×200)
圖5
兩組培養 14 d 免疫組織化學染色觀察(×200)
從左至右依次為 Hoechst 染色、Ⅰ型膠原染色和兩種染色重疊 a. 對照組;b. 實驗組
Figure5. Immunohistochemical staining at 14 days after culture in the two groups (×200)From left to right for Hoechst staining, Collagen type Ⅰ staining, and merge staining, respectively a. Control group; b. Experimental group
2.2.4 掃描電鏡觀察
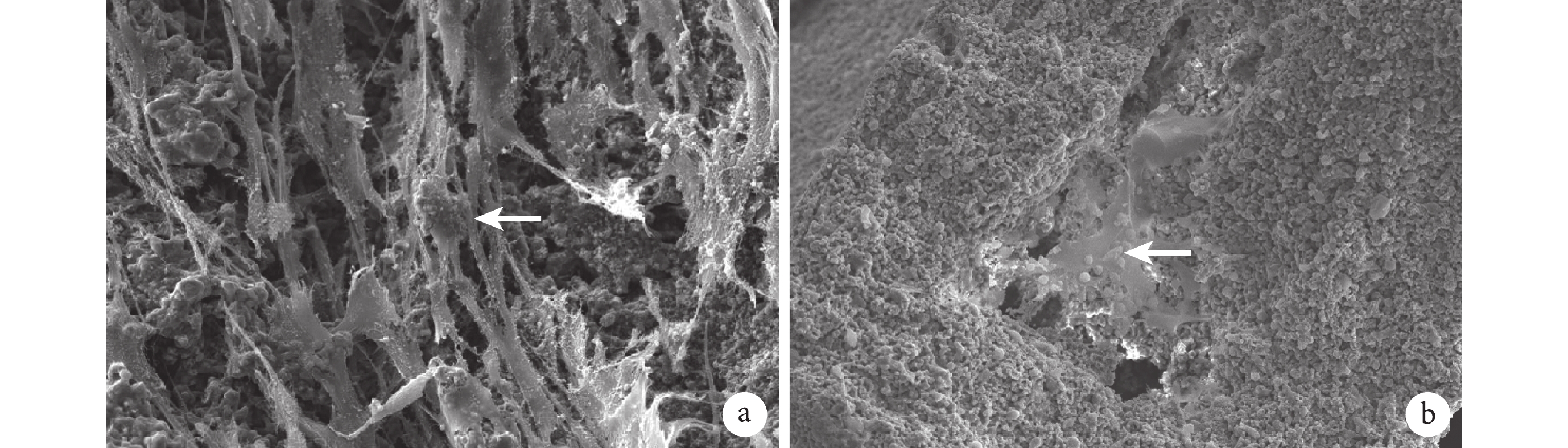
對照組材料表面均勻分布著 iPS-MSCs,細胞黏附良好且數量較多,可見圓球狀的 iPS-MSCs 細胞核、條索樣細胞樹突與軸突,細胞生長正常,形態良好。實驗組可見 iPS-MSCs 的細胞核與 BMP-2 明膠/殼聚糖水凝膠緩釋系統中的明膠微球有效黏附在一起,細胞核旁的細小灰色部分為細胞的樹突與軸突。見圖 6。
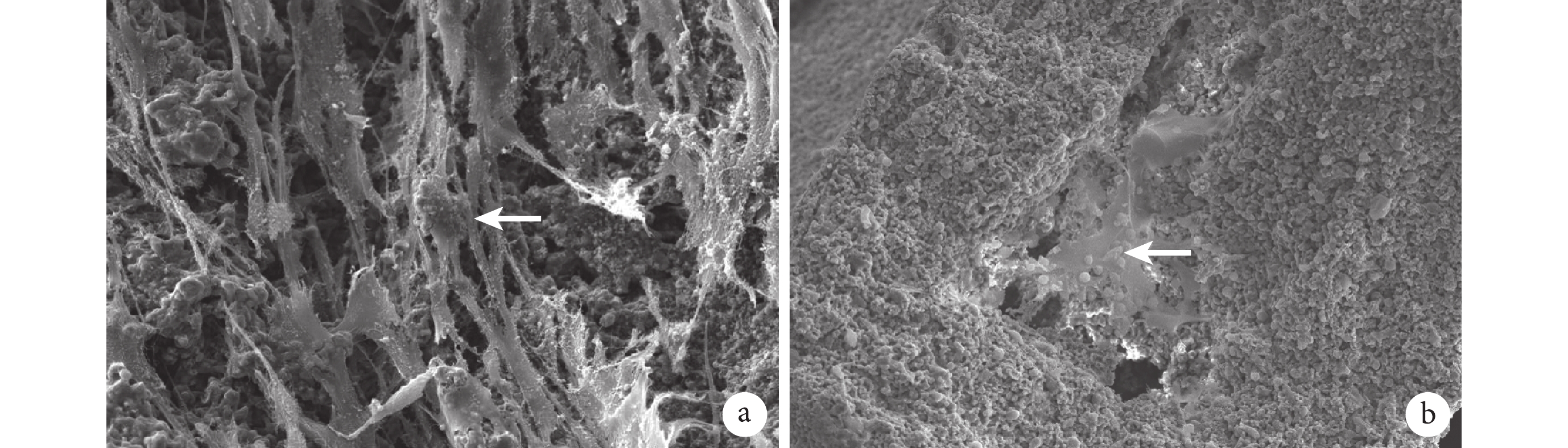 圖6
兩組培養 14 d 掃描電鏡觀察
圖6
兩組培養 14 d 掃描電鏡觀察
箭頭示細胞核 a. 對照組(×500);b. 實驗組(×200)
Figure6. Scanning electron microscopy observation at 14 days after culture in the two groupsArrow indicated nuclei a. Control group (×500); b. Experimental group (×200)
3 討論
ZrO2 作為 HA 增強體后,可獲得力學性能和生物相容性俱佳的生物復合材料[16]。由于 HA/ZrO2 致密體強度過大,同時也帶來了應力遮蔽的問題[17]。故將 HA/ZrO2 致密體制成生物多孔泡沫陶瓷材料后,不僅可調節其強度,還有利于營養物質和代謝產物在其內的運輸,提供了穩定的細胞外基質沉積、儲存場所,促進了 iPS-MSCs 在其內的繁殖和遷移[18-19]。這也是 HA/ZrO2 生物多孔泡沫陶瓷材料的最大優勢所在。
BMP 具有激活成熟成骨細胞中 ALP 活性的作用,也可作為 iPS 和 BMSCs 成骨分化的標志物[20]。 BMP 已初步應用于脊柱外科臨床[21]。殼聚糖作為一種無毒緩釋載體,其帶正電荷和-NH2 基團的特性使其可與帶負電荷的聚合物、大分子蛋白相互作用[22]。因 BMP-2 可能會產生爆發效應,故本實驗采用 BMP-2 明膠/殼聚糖水凝膠緩釋系統緩解 BMP-2 的爆發效應。殼聚糖對藥物的包封率和釋放率受殼聚糖相對分子質量、脫乙酰度和濃度等影響,既往研究表明[23],利用殼聚糖承載緩釋牛血清白蛋白,當殼聚糖相對分子質量從 10×103提高到 210×103,牛血清白蛋白的包封率提高約 2 倍,牛血清白蛋白的釋放速率從 73.9% 降至 17.6%。黃鑫等[24]采用乳化交聯法制備出的 BMP-2 殼聚糖緩釋微球包封率達到 85.4%±4.2%,前 10 d BMP-2 累積釋藥率為 62.5%±3.6%。殼聚糖作為 BMP-2 緩釋系統載體的潛力有待進一步挖掘。本實驗制備的 BMP-2 明膠/殼聚糖水凝膠緩釋系統,在 1 d 內其包封率高達 90% 以上,隨時間推移包封率逐漸降低,但 15 d 時仍有 44.49%±0.20%;1 d 內載藥率達 60%,之后緩慢下降,15 d 時仍達 29.6%±0.14%;體外緩釋速率得到顯著控制,15 d 時為 55.50%±0.20%。殼聚糖水凝膠緩釋系統可使 BMP-2 的活性延長,大大提高了 BMP-2 的生物利用度。
種子細胞必須具有較強的擴增能力,并能在支架上黏附生長。BMSCs 作為一種公認的種子細胞,不僅具有多向分化潛能,同時也是基因治療適宜的細胞載體[25-26]。但其獲取易造成額外損傷,且增殖能力會隨供體年齡的增長而下降。而胚胎干細胞(embryonic stem cells,ESCs)的獲取要破壞早期的胚囊,有悖倫理道德[27-28]。而 iPS 具有和 ESCs 類似甚至優于 ESCs 的特性,同時又不存在倫理和免疫排斥問題[29]。考慮到直接應用 iPS 或 ESCs 可能有形成畸胎瘤的潛在風險,因此我們采用 iPS 來源的 MSCs 作為新型組織工程骨種子細胞。
本實驗先將 iPS-MSCs 和 HA/ZrO2 共培養,再將 BMP-2 明膠/殼聚糖水凝膠緩釋系統與其復合共培養,并與單純 HA/ZrO2 復合 iPS-MSCs 進行比較,行 ALP 分泌量檢測、RT-PCR 檢測、Ⅰ型膠原免疫組織化學染色及掃描電鏡觀察。結果顯示,實驗組培養 14 d ALP 分泌量明顯高于對照組,表明 BMP-2 促進了 iPS-MSCs 中 ALP 表達,增強了 iPS-MSCs 成骨分化能力[26]。MSCs 可增殖分化為成骨細胞,具備成骨能力[30-33],本實驗結果顯示 iPS-MSCs 也具有成骨分化能力。對照組在無緩釋系統的作用下,Cbfa1、Ⅰ型膠原和 OSX 基因相對表達量隨時間推移無明顯變化;而實驗組隨時間推移,各目的基因相對表達量均增加,同時Ⅰ型膠原表達也顯著多于對照組,表明 BMP-2 增強了 iPS-MSCs 成骨分化潛能[34]。掃描電鏡觀察可見 BMP-2 明膠/殼聚糖水凝膠緩釋系統可包裹細胞;同時表面可見均勻分布的細胞,細胞與材料黏附良好,且生長正常,提示 iPS-MSCs 可在 HA/ZrO2 貼壁生長。故以 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植 iPS-MSCs 與 HA/ZrO2 多孔生物泡沫陶瓷材料,有望成為未來組織工程骨研究和應用的發展方向。
綜上述,本研究結果表明,BMP-2 明膠/殼聚糖水凝膠緩釋系統具有較好的藥物包封率及載藥率,可延長 BMP-2 活性時間,BMP-2 可促進 iPS-MSCs 成骨分化。同時 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植 iPS-MSCs 與 HA/ZrO2 多孔生物泡沫陶瓷材料在體外共培養后,iPS-BMSCs 黏附良好,細胞活性較好。下一步我們將對 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植 iPS-MSCs 與 HA/ZrO2 多孔生物泡沫陶瓷材料的體內共培養進行研究。
大段骨缺損修復一直是骨科臨床難題之一。組織工程骨理念的提出,為骨缺損修復提供了新思路和新途徑。組織工程骨是由種子細胞、支架、生物活性物質等組成,通過這些物質的相互調控,可促進骨組織愈合。羥基磷灰石(hydroxyapatite,HA)/二氧化鋯(ZrO2)生物活性、抗壓強度等經深入研究,被認為可以作為組織工程骨支架材料。BMSCs 具有增殖分化、免疫調節、擴增方便等優點,但有限的增殖能力、長期培養細胞活力易喪失等因素限制了其發展[1]。誘導多能干細胞(induced pluripotent stem cells,iPS)表現出無限增長和分化能力[2],但其臨床使用的安全性及其衍生物尚未完全闡明[3-4]。近年有研究報道采用 iPS 來源 MSCs(iPS-MSCs)靶向骨和/或軟骨修復[5-9],故本實驗采用 iPS-MSCs 作為種子細胞。BMP 可誘導動物或人 BMSCs 分化為骨、軟骨、韌帶、肌腱和神經組織,且 BMP-2 可增強骨缺損愈合過程中 BMSCs 成骨分化能力[10-11]。但 BMP-2 循環半衰期相當短,如果通過靜脈注射使用,血液中的酶很容易使 BMP-2 失活[12-13];另一個缺點是靜脈注射 BMP-2 可能產生爆發效應,導致軟組織血腫和骨吸收現象[14]。而殼聚糖的遞送系統能夠使 BMP-2 在特定位置持續釋放[15]。故本實驗采用 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植人 iPS-MSCs ,與 HA/ZrO2 多孔生物泡沫陶瓷材料體外共培養,探索緩釋系統對 iPS-MSCs 成骨分化作用,并觀察 iPS-MSCs 在HA/ZrO2 多孔生物泡沫陶瓷材料上的黏附及活性,為后期體內研究奠定理論基礎。
1 材料與方法
1.1 主要材料、試劑及儀器
β-甘油磷酸鈉(北京索萊寶科技有限公司);ALP 試劑盒、一抗、FITC 標記二抗、Hoechst(碧云天生物技術公司);RPMI1640 完全培養基、殼聚糖粉末、BMP-2(Sigma 公司,美國);iPS-MSCs(本課題組黃小龍提供);明膠粉末、氯仿、異丙醇、無水乙醇、乙酸異戊酯(上海國藥集團);HA/ZrO2 多孔生物泡沫陶瓷材料(上海大學材料學院);Trizol(Invitrogen 公司,美國);DEPC 處理水、2.5% 戊二醛(上海諾辰生物技術有限公司);SYBR Green PCR 試劑盒、逆轉錄試劑盒(Thermo 公司,美國);4% 多聚甲醛(上海潤捷化學試劑有限公司);5%FBS(HyClone 公司,美國)。
低溫冷凍離心機(Sigma 公司,美國);倒置顯微鏡、熒光顯微鏡(Leica 公司,德國);酶聯免疫測試儀(Thermo Scientific Varioskan Flash 公司,美國);ABI-7500 RT-PCR 儀(Thermo Fisher 公司,美國);S4800 掃描電鏡(日立公司,日本)。
1.2 BMP-2 明膠/殼聚糖水凝膠緩釋系統構建及觀測
1.2.1 BMP-2 明膠/殼聚糖水凝膠微球構建
采用油包水相溶液法制備 BMP-2 明膠/殼聚糖水凝膠微球。具體方法:① 取 1 g 明膠粉末于 50°C 溶解于 10 mL 去離子水,500 r/min 磁力攪拌下將其逐滴加入預加熱至 50°C 的 60 mL 橄欖油中,持續攪拌下乳化 10 min;乳化液在攪拌中逐漸冷卻至 4°C,形成固態微球,時間約 40 min。4°C 丙酮和乙醇分別漂洗 3 次,得到明膠微球,凍干。② 將制備的凍干明膠微球分散加入制備好的含 50 mmol/L 乙二醛的乙醇溶液中,室溫 500 r/min 磁力攪拌 10 h,離心沉淀,將沉淀用乙醇洗滌 2 次,凍干;再用 100 μm 和 50 μm 濾網過濾,得到明膠微球。③ 將殼聚糖粉末溶于 0.75%(V/V)乙酸水溶液中制得 1.5%(W/V)殼聚糖溶液,待完全溶解后用 0.45 μm 濾膜過濾,4°C 保存。將 β-甘油磷酸鈉溶于去離子水得到 50%(W/V)β-甘油磷酸鈉溶液,0.22 μm 濾膜過濾,4°C 保存。④ 將上述明膠微球加入 50 mL 1.5%(W/V)殼聚糖溶液中,調節 pH 值至 6.3;再將溶解后的 BMP-2 加入 50 mL 1.5%(W/V)殼聚糖溶液中,將 50%(W/V)β-甘油磷酸鈉溶液在 500 r/min 磁力攪拌下逐滴加入 50 mL 1.5%(W/V)殼聚糖溶液中,使最后溶液含 β-甘油磷酸鈉溶度為 88 mmol/L,pH 值約 7.2。將 BMP-2 明膠/殼聚糖水凝膠微球在 37°C 孵育 3 h。以上步驟均在無菌條件下進行。
1.2.2 BMP-2 明膠/殼聚糖水凝膠微球藥物包封率、載藥率和體外緩釋速率檢測
采用 ELISA 試劑盒法檢測,具體方法:取 5 mL 試管 3 支,每支試管中置入 150 mg BMP-2 明膠/殼聚糖水凝膠微球,各加 PBS(pH7.2)2 mL,37℃ 水浴振蕩;分別于 6 h、12 h 及 1、2、3、6、9、12、15 d,每支試管各取上清液 100 μL,測定波長 450 nm 及校準 570 nm 處的吸光度(A)值,根據標準曲線方程計算上清液中 BMP-2 濃度,從而計算出上清液中 BMP-2 含量。按以下公式計算各指標:① 藥物包封率=(BMP-2 總含量?上清液 BMP-2 含量)/BMP-2 總含量×100%;② 載藥率=(BMP-2 總含量?上清液 BMP-2 含量)/微球總質量(150 mg)×100%;③ 體外緩釋速率=上清液 BMP-2 含量/BMP-2 總含量×100%,并繪制 BMP-2 明膠/殼聚糖水凝膠微球累積釋放曲線。
1.2.3 BMP-2 明膠/殼聚糖水凝膠微球形態觀察
將 BMP-2 明膠/殼聚糖水凝膠微球裁剪成 3 mm×1 mm 大小,固定于樣本臺,掃描電鏡觀察微球表面結構。
1.3 支架材料-微球-細胞共培養體系的建立及相關觀測
1.3.1 共培養體系的建立
將 HA/ZrO2 多孔生物泡沫陶瓷材料高溫滅菌后,用無菌 0.01%(W/V)多聚賴氨酸浸泡過夜,無菌條件下晾干,然后放入培養皿并用 RPMI1640 完全培養基浸潤。在培養皿底部放置磁鐵,將純化后的 iPS-MSCs 和 BMP-2 明膠/殼聚糖水凝膠緩釋系統制成懸浮液,然后逐滴緩慢滴至 HA/ZrO2 多孔生物泡沫陶瓷材料上。RPMI1640 完全培養基培養,置于 37℃、5%CO2 培養箱內液面下培養 2 周,細胞融合后改為氣?液界面培養 10 d,作為實驗組。另外,同上法將 HA/ZrO2 多孔生物泡沫陶瓷材料僅和純化后的 iPS-MSCs 共培養,作為對照組。
1.3.2 ALP 分泌量檢測
兩組共培養體系體外培養 3、7、10、14 d,采用 ALP 檢測試劑盒檢測 ALP 分泌量。
1.3.3 RT-PCR 檢測
兩組共培養體系體外培養 3、7、10、14 d,按 miRNA 試劑盒說明書進行操作。RT-PCR 擴增程序:熱變性 95℃、10 min;擴增 95℃、20 s,62℃、30 s,72℃、30 s;40 個循環。數據采用儀器自帶軟件分析 ABI Prism 7500 SDS Software 分析,采用 2–ΔΔCt法計算目的基因[核心結合因子 α1(core binding factor α1,Cbfa1)、Ⅰ型膠原、鋅指結構轉錄因子(Osterix,OSX)]相對表達量。目的基因引物序列見表 1。
1.3.4 免疫組織化學染色檢測Ⅰ型膠原表達
兩組共培養體系體外培養 14 d 取出,PBS 漂洗 1 次,4% 多聚甲醛固定 15~30 min,再用 PBS 漂洗 3 min×2 次;3.5%FBS 室溫下封閉 15 min,不洗;一抗Ⅰ型膠原抗體 4℃ 孵育過夜,PBS 洗 5 min×3 次;滴加二抗工作液,37℃ 孵育 1 h;室溫避光孵育 Hoechst 15 min;熒光顯微鏡下觀察。
1.3.5 掃描電鏡觀察細胞爬行及黏附狀態
兩組共培養體系培養 14 d 后取出,4℃ 預冷 PBS 漂洗,2.5% 冷戊二醛固定 24 h;吸出固定液,PBS 漂洗,徹底除去戊二醛;梯度乙醇脫水,乙酸異戊酯置換,臨界點干燥,表面噴金后掃描電鏡觀察。
1.4 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用采用獨立樣本 t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 BMP-2 明膠/殼聚糖水凝膠緩釋系統相關觀測
2.1.1 藥物包封率、載藥率和體外緩釋速率
① 藥物包封率:在 1 d 內微球的藥物包封率均高達 90% 以上,隨時間推移藥物包封率逐漸降低,但在 15 d 時仍有 44.49%±0.20%。見圖 1a。② 載藥率:在 1 d 內微球的載藥率均達 60% 以上,隨時間推移載藥率緩慢下降,15 d 時仍有 29.6%±0.14%。見圖 1b。③ 體外緩釋速率:BMP-2 的釋放表現出階段性釋放規律,前 1 d 內釋放緩慢,處于適應階段;1~6 d 表現為 rhBMP-2 爆發性釋放階段,第 6 天累積釋放率達 44.27%±0.30%;之后逐漸進入 BMP-2 緩慢釋放階段(6~12 d),第 12 天時累積釋放率達 53.22%±0.18%;最后進入穩定階段(12~15 d),第 15 天時累積釋放率為 55.50%±0.20%。見圖 1 c。
 圖1
BMP-2 明膠/殼聚糖水凝膠微球 ELISA 檢測
圖1
BMP-2 明膠/殼聚糖水凝膠微球 ELISA 檢測
a. 藥物包封率;b. 載藥率;c. 體外緩釋速率
Figure1. ELISA detection of BMP-2 gelatin/chitosan hydrogel microspheresa. Drug encapsulation efficiency; b. Drug loading; c. In vitro sustained release rate
2.1.2 BMP-2 明膠/殼聚糖水凝膠微球掃描電鏡觀察
掃描電鏡觀察示 BMP-2 明膠/殼聚糖水凝膠微球的球形良好,球形表面較光滑,其直徑約為(255±26)μm。見圖 2。
 圖2
BMP-2 明膠/殼聚糖水凝膠微球掃描電鏡觀察(×200)
Figure2.
Scanning electron microscopy observation of BMP-2 gelatin/chitosan hydrogel microsphere (×200)
圖2
BMP-2 明膠/殼聚糖水凝膠微球掃描電鏡觀察(×200)
Figure2.
Scanning electron microscopy observation of BMP-2 gelatin/chitosan hydrogel microsphere (×200)
2.2 共培養體系相關觀測
2.2.1 ALP 分泌量檢測
隨培養時間延長,兩組 ALP 分泌量均逐漸增加;各時間點實驗組 ALP 分泌量均顯著高于對照組,差異有統計學意義(P<0.05)。見圖 3。
 圖3
兩組培養各時間點 ALP 分泌量檢測
Figure3.
Detection of ALP secretion at different time points in the two groups
圖3
兩組培養各時間點 ALP 分泌量檢測
Figure3.
Detection of ALP secretion at different time points in the two groups
2.2.2 RT-PCR 檢測
隨培養時間延長,對照組各目的基因相對表達量無明顯變化;實驗組各目的基因相對表達量均逐漸增加,其中 Cbfa1 在 3~7 d 增加明顯,Ⅰ型膠原在 7~10 d 增加明顯,OSX 增加趨勢較均勻,10 d 后各目的基因表達增幅均降低。各時間點實驗組各目的基因相對表達量均顯著高于對照組,差異有統計學意義(P<0.05)。見圖 4。
 圖4
RT-PCR 檢測兩組培養各時間點各基因相對表達量
圖4
RT-PCR 檢測兩組培養各時間點各基因相對表達量
a. Cbfa1;b. Ⅰ型膠原;c. OSX
Figure4. RT-PCR detection of relative expression of genes in the two groups at different time pointsa. Cbfa1; b. Collagen type Ⅰ; c. OSX
2.2.3 免疫組織化學染色檢測Ⅰ型膠原表達
熒光顯微鏡觀察示,實驗組熒光數量明顯多于對照組,即Ⅰ型膠原表達水平高于對照組;細胞均能較均勻地分布于材料上,細胞形態良好。見圖 5。
 圖5
兩組培養 14 d 免疫組織化學染色觀察(×200)
圖5
兩組培養 14 d 免疫組織化學染色觀察(×200)
從左至右依次為 Hoechst 染色、Ⅰ型膠原染色和兩種染色重疊 a. 對照組;b. 實驗組
Figure5. Immunohistochemical staining at 14 days after culture in the two groups (×200)From left to right for Hoechst staining, Collagen type Ⅰ staining, and merge staining, respectively a. Control group; b. Experimental group
2.2.4 掃描電鏡觀察
對照組材料表面均勻分布著 iPS-MSCs,細胞黏附良好且數量較多,可見圓球狀的 iPS-MSCs 細胞核、條索樣細胞樹突與軸突,細胞生長正常,形態良好。實驗組可見 iPS-MSCs 的細胞核與 BMP-2 明膠/殼聚糖水凝膠緩釋系統中的明膠微球有效黏附在一起,細胞核旁的細小灰色部分為細胞的樹突與軸突。見圖 6。
 圖6
兩組培養 14 d 掃描電鏡觀察
圖6
兩組培養 14 d 掃描電鏡觀察
箭頭示細胞核 a. 對照組(×500);b. 實驗組(×200)
Figure6. Scanning electron microscopy observation at 14 days after culture in the two groupsArrow indicated nuclei a. Control group (×500); b. Experimental group (×200)
3 討論
ZrO2 作為 HA 增強體后,可獲得力學性能和生物相容性俱佳的生物復合材料[16]。由于 HA/ZrO2 致密體強度過大,同時也帶來了應力遮蔽的問題[17]。故將 HA/ZrO2 致密體制成生物多孔泡沫陶瓷材料后,不僅可調節其強度,還有利于營養物質和代謝產物在其內的運輸,提供了穩定的細胞外基質沉積、儲存場所,促進了 iPS-MSCs 在其內的繁殖和遷移[18-19]。這也是 HA/ZrO2 生物多孔泡沫陶瓷材料的最大優勢所在。
BMP 具有激活成熟成骨細胞中 ALP 活性的作用,也可作為 iPS 和 BMSCs 成骨分化的標志物[20]。 BMP 已初步應用于脊柱外科臨床[21]。殼聚糖作為一種無毒緩釋載體,其帶正電荷和-NH2 基團的特性使其可與帶負電荷的聚合物、大分子蛋白相互作用[22]。因 BMP-2 可能會產生爆發效應,故本實驗采用 BMP-2 明膠/殼聚糖水凝膠緩釋系統緩解 BMP-2 的爆發效應。殼聚糖對藥物的包封率和釋放率受殼聚糖相對分子質量、脫乙酰度和濃度等影響,既往研究表明[23],利用殼聚糖承載緩釋牛血清白蛋白,當殼聚糖相對分子質量從 10×103提高到 210×103,牛血清白蛋白的包封率提高約 2 倍,牛血清白蛋白的釋放速率從 73.9% 降至 17.6%。黃鑫等[24]采用乳化交聯法制備出的 BMP-2 殼聚糖緩釋微球包封率達到 85.4%±4.2%,前 10 d BMP-2 累積釋藥率為 62.5%±3.6%。殼聚糖作為 BMP-2 緩釋系統載體的潛力有待進一步挖掘。本實驗制備的 BMP-2 明膠/殼聚糖水凝膠緩釋系統,在 1 d 內其包封率高達 90% 以上,隨時間推移包封率逐漸降低,但 15 d 時仍有 44.49%±0.20%;1 d 內載藥率達 60%,之后緩慢下降,15 d 時仍達 29.6%±0.14%;體外緩釋速率得到顯著控制,15 d 時為 55.50%±0.20%。殼聚糖水凝膠緩釋系統可使 BMP-2 的活性延長,大大提高了 BMP-2 的生物利用度。
種子細胞必須具有較強的擴增能力,并能在支架上黏附生長。BMSCs 作為一種公認的種子細胞,不僅具有多向分化潛能,同時也是基因治療適宜的細胞載體[25-26]。但其獲取易造成額外損傷,且增殖能力會隨供體年齡的增長而下降。而胚胎干細胞(embryonic stem cells,ESCs)的獲取要破壞早期的胚囊,有悖倫理道德[27-28]。而 iPS 具有和 ESCs 類似甚至優于 ESCs 的特性,同時又不存在倫理和免疫排斥問題[29]。考慮到直接應用 iPS 或 ESCs 可能有形成畸胎瘤的潛在風險,因此我們采用 iPS 來源的 MSCs 作為新型組織工程骨種子細胞。
本實驗先將 iPS-MSCs 和 HA/ZrO2 共培養,再將 BMP-2 明膠/殼聚糖水凝膠緩釋系統與其復合共培養,并與單純 HA/ZrO2 復合 iPS-MSCs 進行比較,行 ALP 分泌量檢測、RT-PCR 檢測、Ⅰ型膠原免疫組織化學染色及掃描電鏡觀察。結果顯示,實驗組培養 14 d ALP 分泌量明顯高于對照組,表明 BMP-2 促進了 iPS-MSCs 中 ALP 表達,增強了 iPS-MSCs 成骨分化能力[26]。MSCs 可增殖分化為成骨細胞,具備成骨能力[30-33],本實驗結果顯示 iPS-MSCs 也具有成骨分化能力。對照組在無緩釋系統的作用下,Cbfa1、Ⅰ型膠原和 OSX 基因相對表達量隨時間推移無明顯變化;而實驗組隨時間推移,各目的基因相對表達量均增加,同時Ⅰ型膠原表達也顯著多于對照組,表明 BMP-2 增強了 iPS-MSCs 成骨分化潛能[34]。掃描電鏡觀察可見 BMP-2 明膠/殼聚糖水凝膠緩釋系統可包裹細胞;同時表面可見均勻分布的細胞,細胞與材料黏附良好,且生長正常,提示 iPS-MSCs 可在 HA/ZrO2 貼壁生長。故以 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植 iPS-MSCs 與 HA/ZrO2 多孔生物泡沫陶瓷材料,有望成為未來組織工程骨研究和應用的發展方向。
綜上述,本研究結果表明,BMP-2 明膠/殼聚糖水凝膠緩釋系統具有較好的藥物包封率及載藥率,可延長 BMP-2 活性時間,BMP-2 可促進 iPS-MSCs 成骨分化。同時 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植 iPS-MSCs 與 HA/ZrO2 多孔生物泡沫陶瓷材料在體外共培養后,iPS-BMSCs 黏附良好,細胞活性較好。下一步我們將對 BMP-2 明膠/殼聚糖水凝膠緩釋系統復合種植 iPS-MSCs 與 HA/ZrO2 多孔生物泡沫陶瓷材料的體內共培養進行研究。