引用本文: 盧昌懷, 劉志軍, 張宏波, 段揚, 曹延林. TGF-β1 誘導的黃韌帶細胞增生效應及其對結締組織生長因子的表達影響. 中國修復重建外科雜志, 2019, 33(7): 883-888. doi: 10.7507/1002-1892.201812016 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
腰椎管狹窄癥是一種常見的老年人運動功能障礙性疾病[1],通常因腰椎退行性病變如黃韌帶增生肥厚、鈣化,椎體小關節增生,椎間盤突出等,導致腰椎后部結構改變所引起。其中椎管內黃韌帶增生肥厚被認為是腰椎管狹窄發展中最重要的致病因素之一。引起黃韌帶增生肥厚的原因很多,包括年齡、脊柱機械應力改變及細胞因子的調節等。在黃韌帶增生肥厚過程中,有研究表明結締組織生長因子(connective tissue growth factor,CTGF)和 TGF-β1 表達顯著增加[2-5]。然而關于兩者在黃韌帶增生肥厚發病機制中的具體作用機制,至今尚未完全闡明。因此,本研究以外源性重組 CTGF 蛋白和 TGF-β1 共同刺激黃韌帶細胞,觀察細胞生長增殖變化,探討二者在黃韌帶增生肥厚中的可能作用機制。
1 材料與方法
1.1 主要試劑及儀器
TGF-β1 蛋白、CTGF 蛋白(Invitrogen 公司,美國);CTGF 中和抗體(Sigma 公司,美國);兔抗Ⅰ、Ⅲ型膠原多克隆抗體、兔抗波形蛋白單克隆抗體(Abcam 公司,美國);辣根過氧化物酶標記的山羊抗兔 IgG(BOSTER 公司,美國);逆轉錄試劑盒、實時熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)試劑盒(DBI 公司,德國);RNA 提取試劑 Trizol(Takara 公司,日本)。StratageneMx3000P qRT-PCR 儀(Agilent 公司,美國);倒置光學顯微鏡(MOTIC 公司,中國);正置熒光顯微鏡(Zeiss 公司,德國)。
1.2 人腰椎黃韌帶細胞的分離培養與鑒定
1.2.1 細胞分離培養
取常德市第一中醫醫院骨傷科脊柱病區腰椎椎間盤突出患者髓核摘除術中的黃韌帶組織(術前均經影像學檢查確定無明顯黃韌帶增生,術后取材通過顯微鏡觀察,保證黃韌帶細胞健康,排除肥大及其他病理變化),采用膠原酶預消化組織塊培養法[6-7]分離,進行傳代培養得到黃韌帶細胞。
1.2.2 細胞鑒定
① 細胞形態觀察:采用倒置光學顯微鏡觀察分離培養過程中細胞形態變化。② 免疫熒光染色觀察:取第 1、3、5 代細胞,分別將細胞接種到 96 孔培養板中,待細胞長成單層后 PBS 洗 2 次;用冷丙酮固定 20 min,PBS 處理 3 次,每次 5 min;0.3%PBS-Triton X-100 通透 20 min,PBS 處理 3 次,每次 5 min;正常山羊血清封閉 30 min,分別滴加兔抗波形蛋白單克隆抗體(1∶100),兔抗Ⅰ、Ⅲ型膠原多克隆抗體(1∶100),4℃ 震動,過夜;PBS 處理 3 次,每次 5 min;加入 Alexa Fluor 488 山羊抗兔抗體(1∶100),37℃ 避光孵育 30 min,PBS 處理 3 次,每次 5 min;滴加 DAPI 染液常溫染色 10 min 晾干,抗熒光猝滅封片劑封片,4℃ 保存。熒光倒置顯微鏡拍照觀察。③ MTT 法檢測細胞增殖:取第 1、3、5 代細胞,PBS 洗滌 2 次,加入 0.25% 胰蛋白酶,顯微鏡下觀察當細胞質回縮時,加入新鮮的完全培養基,吸取細胞懸液滴在蓋玻片邊緣,靜置 3 min;調整細胞濃度為 1×105個/mL,取 100 μL 細胞懸液加入 96 孔板,放入培養箱培養。0、24、48、72 h 時按照 MTT 法采用酶標儀檢測 450 nm 波長下細胞吸光度(A)值。
1.3 實驗分組及方法
取第 3 代黃韌帶細胞,以 5×104 個/mL 密度接種于 96 孔板,常規培養 24 h 后將細胞分為 5 組。A 組于細胞中加入 3 ng/mL TGF-β1[8],B 組加入 50 ng/mL CTGF[8],C 組加入 3 ng/mL TGF-β1+CTGF 中和抗體(1∶500)封閉,D 組加入 50 ng/mL CTGF+CTGF 中和抗體(1∶500)封閉,E 組加入無血清 DMEM 作為對照。
1.4 觀測指標
1.4.1 MTT 法檢測 TGF-β1 和 CTGF 對黃韌帶細胞增殖的影響
各組繼續培養 24 h 后,同上法采用 MTT 法檢測各組細胞增殖 A 值。
1.4.2 Western blot 檢測 CTGF 蛋白表達
培養 24 h 分別收集各組細胞(每組約 1×107個),加入 0.5 mL 裂解液,按步驟提取樣本總蛋白并對蛋白定量;進行 SDS-PAGE 凝膠電泳,轉膜后將聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜分別放入裝有 3 mL CTGF(1∶1 000;轉膜條件:300 mA 恒流轉膜 38 min)的小槽內,置于搖床上室溫平緩搖動 1 h;再將 PVDF 膜放入含有 3 mL 辣根過氧化物酶標記的山羊抗兔 IgG 二抗溶液(1∶20 000)的小槽內,置于搖床上室溫平緩搖動 40 min;洗滌 PVDF 膜進行化學發光、顯影、定影。將膠片進行掃描,用 Image-Pro Plus 6.0 圖像處理系統分析條帶 A 值。以 GAPDH 為內參,將 CTGF 與 GAPDH 的 A 值比值作為 CTGF 蛋白相對表達量。實驗重復 3 次,取均值。
1.4.3 qRT-PCR 檢測各基因表達
取第 3 代細胞,于含 10%FBS 的 DMEM 中培養 24 h,使其處于 G0 期,然后按分組方法處理細胞 24 h。按 Trizol 試劑說明書方法提取細胞總 RNA,按逆轉錄試劑盒說明書配制逆轉錄反應體系合成 cDNA 第一鏈,配制 qPCR 擴增的反應體系,進行 PCR 檢測。PCR 反應條件:94℃、2 min,94℃、20 s,58℃、20 s,72℃、20 s,40 個循環;融解曲線分析:溫度 62~95℃。引物序列:Ⅰ型膠原正義鏈:5'-AGATCTGAA-GTGTGATGACTCAGG-3',反義鏈:5'-CAGATC-ACGTCATCGCACAAC-3';Ⅲ型膠原正義鏈:5'-ATGTTCCACGGAAACACTGG-3',反義鏈:5'-GGAGAGAAGTCGAAGGAATGC-3';GAPDH 正義鏈:5'- ACACCCACTCCTCTCCACCTTT-3',反義鏈:5'-TTACTCCTTGGACTGGCCATGT-3';CTGF 正義鏈:5'-GGAGTGGGTGCTTGTGAC-GAG-3',反義鏈:5'-GTCTTCCAGTCGGTAAGC-CG-3'。用 2?ΔΔCt法計算各組 CTGF、Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量。實驗重復 3 次,取均值。
1.5 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,組間比較及組內各時間點間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 黃韌帶細胞形態觀察及鑒定
2.1.1 形態觀察
培養 6~8 d,可見黃韌帶組織塊周圍有少量細胞爬出,細胞呈梭形;12 d 細胞數量增加,形態呈多樣性,包括梭形、多角形、扇形,細胞質豐富,細胞核呈橢圓形,細胞膜清晰。見圖 1。
 圖1
黃韌帶細胞形態觀察(倒置光學顯微鏡×100)
圖1
黃韌帶細胞形態觀察(倒置光學顯微鏡×100)
a. 培養 7 d;b. 培養 12 d
Figure1. Morphological observation of the ligamentum flavum cells (Inverted optical microscope×100)a. Cultured for 7 days; b. Cultured for 12 days
2.1.2 免疫熒光染色觀察
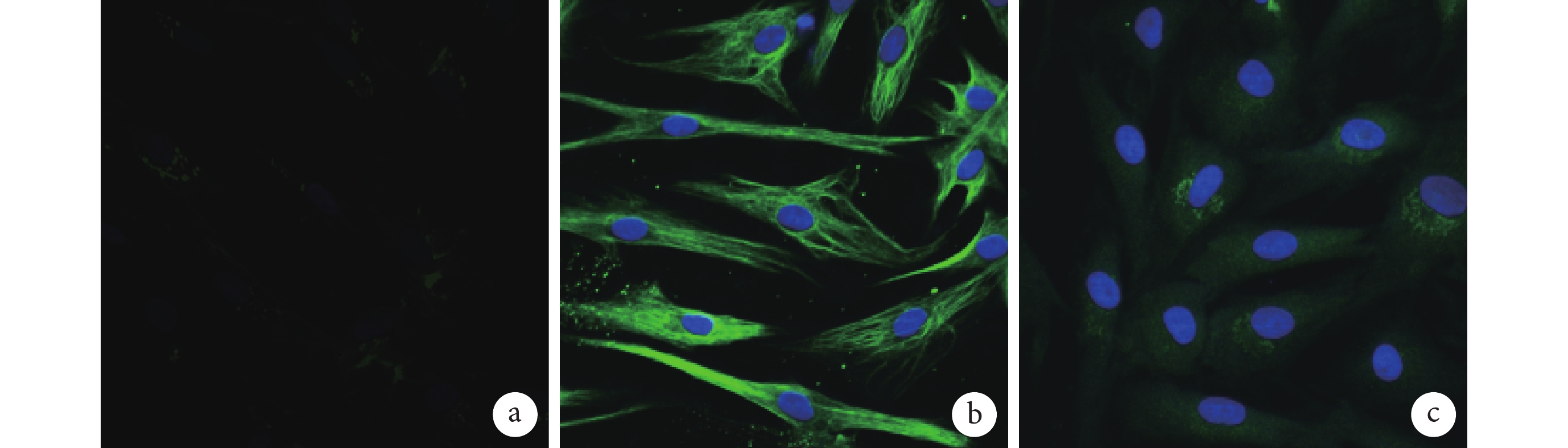
免疫熒光染色示,第 1、3、5 代細胞均呈陽性反應,均表現出典型的黃韌帶成纖維細胞的細胞表型。所有細胞均表達Ⅰ型膠原蛋白及波形蛋白,部分細胞表達Ⅲ型膠原蛋白。見圖 2。
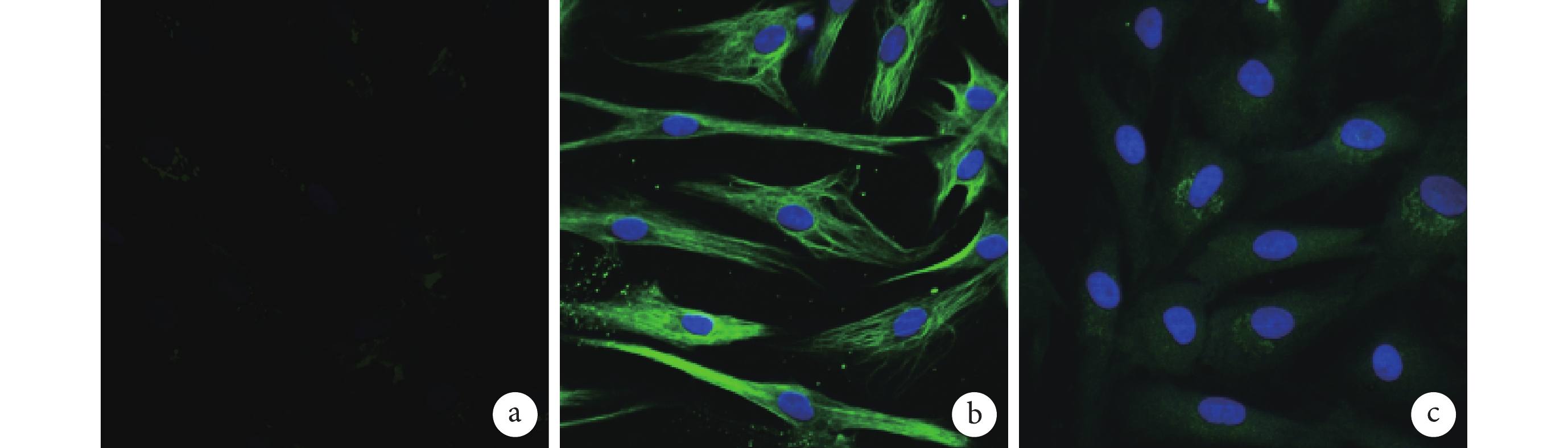 圖2
第 3 代細胞免疫熒光染色觀察(熒光倒置顯微鏡×100)
圖2
第 3 代細胞免疫熒光染色觀察(熒光倒置顯微鏡×100)
a. Ⅰ型膠原;b. 波形蛋白;c. Ⅲ型膠原
Figure2. Immunofluorescence staining of the 3rd generation cells (Fluorescence inverted microscope×100)a. Collagen typeⅠ; b. Vimentin; c. Collagen type Ⅲ
2.1.3 MTT 法檢測細胞增殖情況
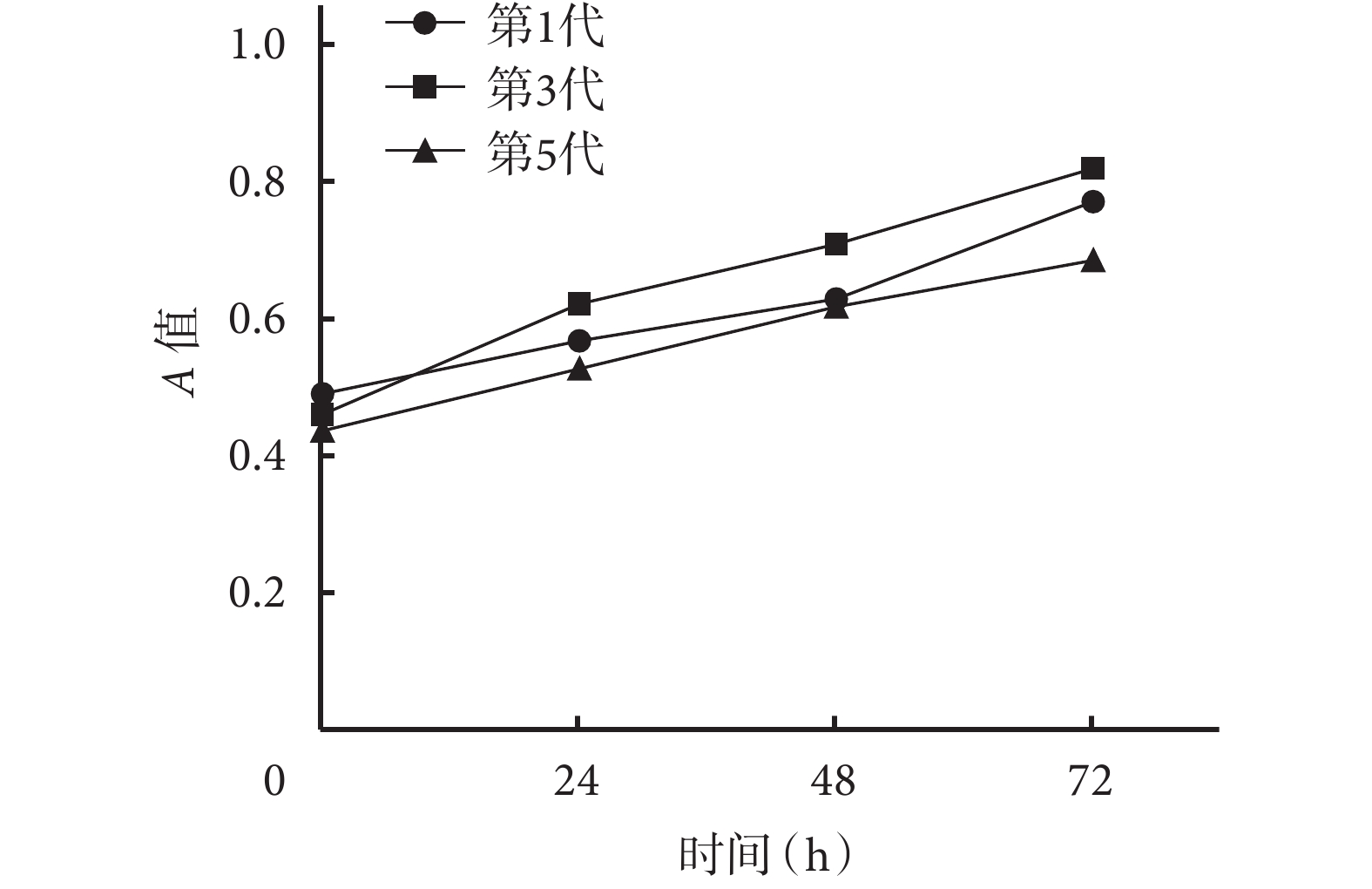
隨培養時間延長,各代細胞 A 值均逐漸增加,同代細胞各時間點間 A 值比較差異均有統計學意義(P<0.05);相同時間點各代細胞間 A 值比較差異均無統計學意義(P>0.05)。見圖 3。
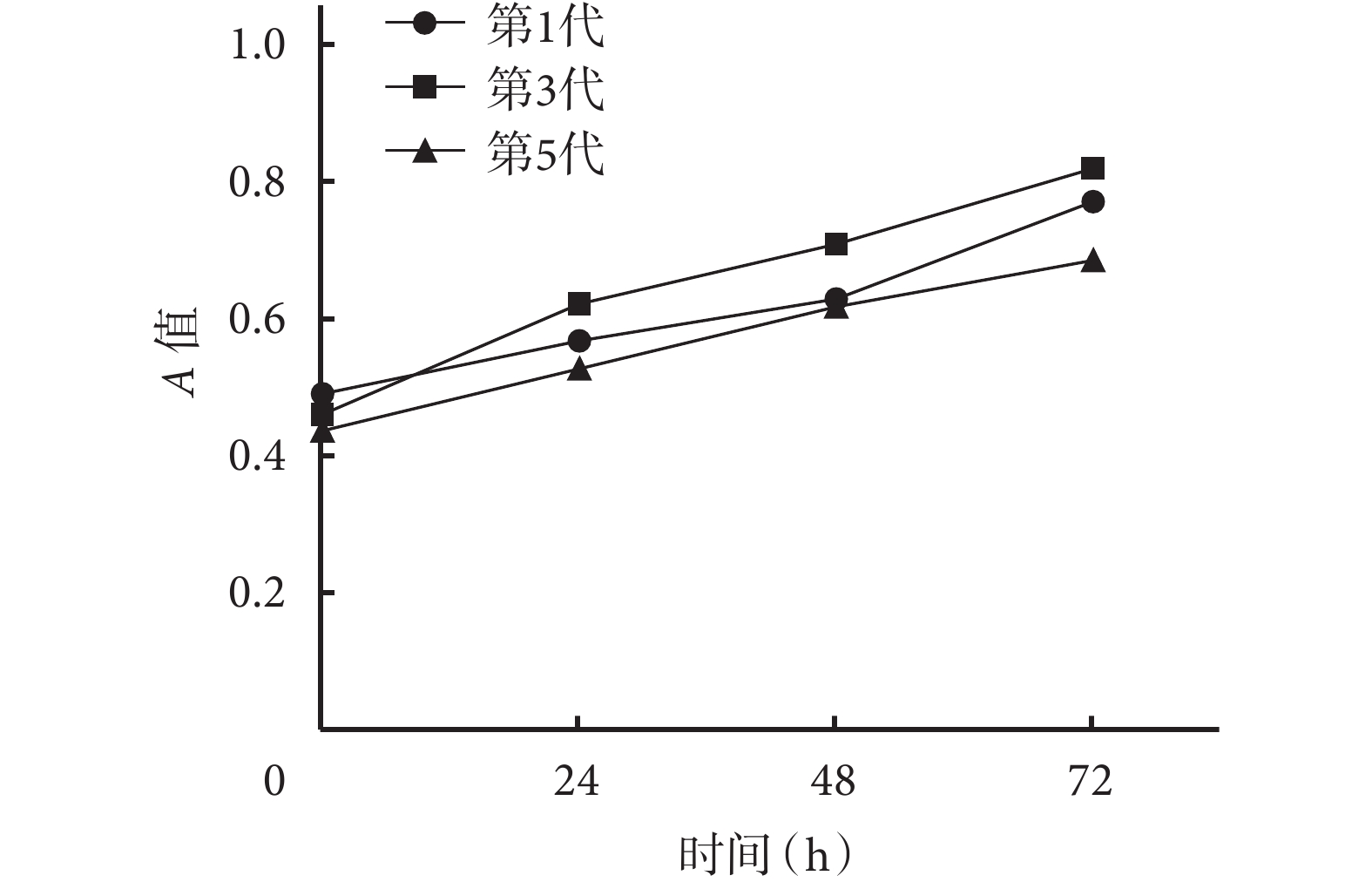 圖3
MTT 法檢測第 1、3、5 代黃韌帶細胞增殖情況
Figure3.
Detecting the proliferation of the 1st, 3rd, and 5th gene ration of ligamentum flavum cells with MTT assay
圖3
MTT 法檢測第 1、3、5 代黃韌帶細胞增殖情況
Figure3.
Detecting the proliferation of the 1st, 3rd, and 5th gene ration of ligamentum flavum cells with MTT assay
2.2 MTT 法檢測 TGF-β1 和 CTGF 對黃韌帶細胞增殖的影響
培養 24 h,A、B、C、D、E 組 A 值分別為 0.477±0.002、0.493±0.004、0.428±0.003、0.435±0.003、0.405±0.003。A、B 組 A 值顯著高于 E 組,差異有統計學意義(P<0.05);而加入 CTGF 中和抗體后,C、D 組 A 值降低,但仍高于 E 組,差異有統計學意義(P<0.05);A、C 組間及 B、D 組間比較差異亦有統計學意義(P<0.05)。
2.3 Western blot 檢測 CTGF 蛋白表達
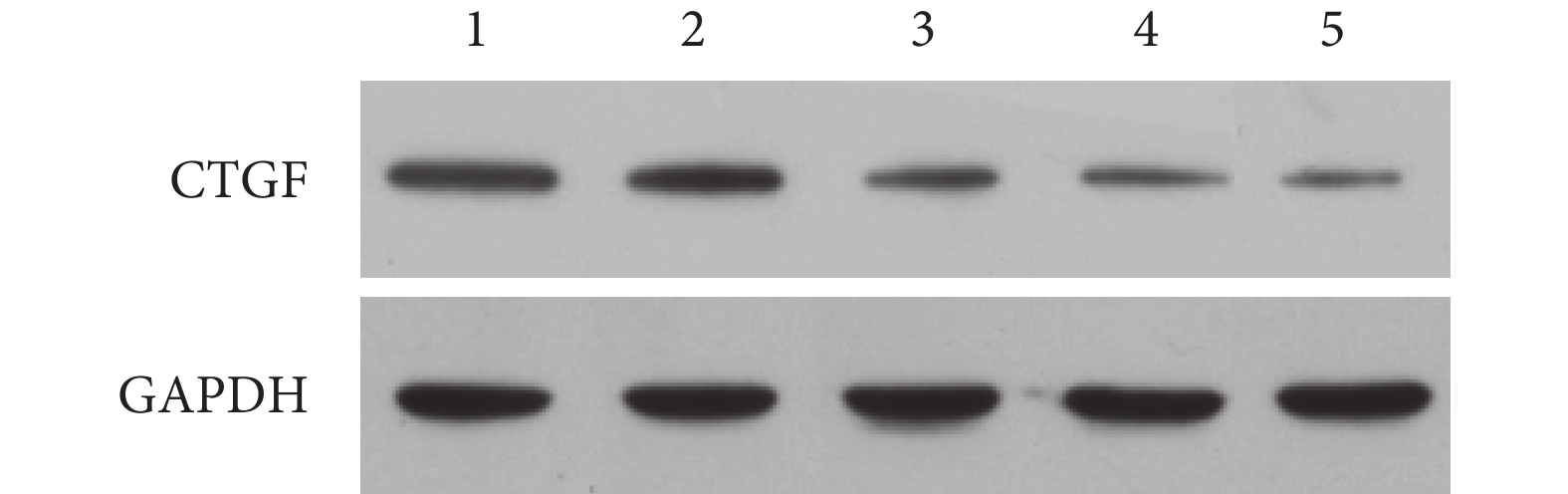
A、B、C、D、E 組 CTGF 蛋白相對表達量分別為 0.398±0.095、0.477±0.061、0.159±0.030、0.135±0.015、0.053±0.006。A、B 組 CTGF 蛋白相對表達量明顯高于 E 組,差異有統計學意義(P<0.05);而加入 CTGF 中和抗體后,C、D 組 CTGF 蛋白相對表達量顯著降低,但仍高于 E 組,差異有統計學意義(P<0.05);A、C 組間及 B、D 組間比較差異亦有統計學意義(P<0.05)。見圖 4。
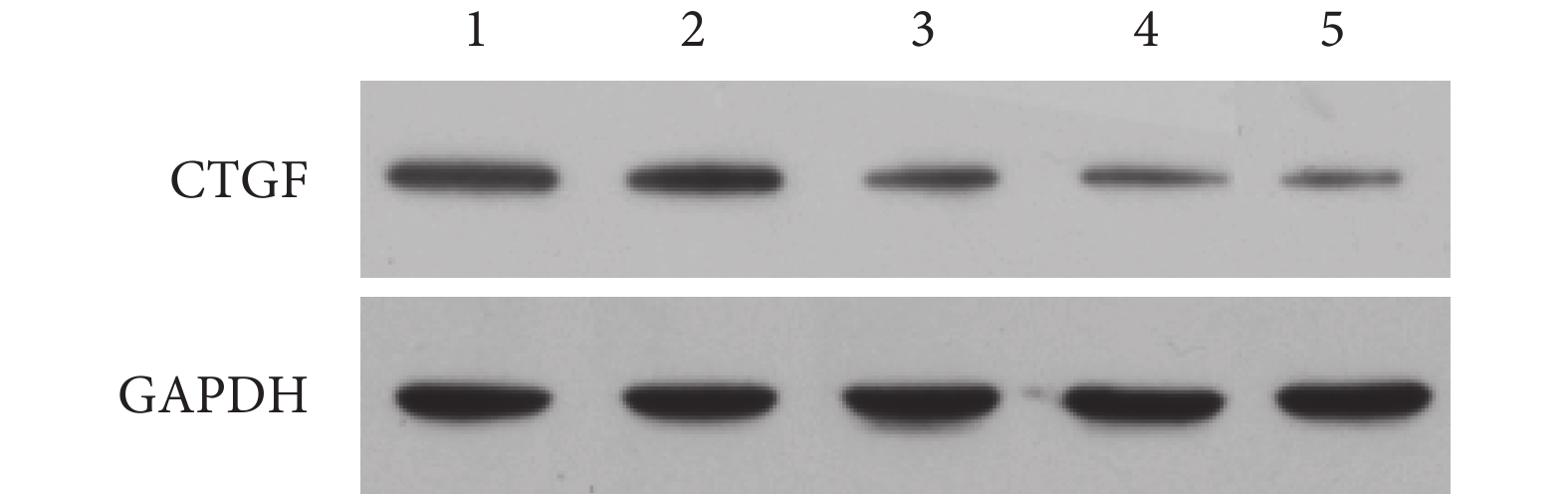 圖4
Western blot 檢測各組培養 24 h CTGF 蛋白表達
圖4
Western blot 檢測各組培養 24 h CTGF 蛋白表達
1:A 組 2:B 組 3:C 組 4:D 組 5:E 組
Figure4. Protein expression of CTGF at 24 hours detected by Western blot1: Group A 2: Group B 3: Group C 4: Group D5: Group E
2.4 qRT-PCR 檢測各基因表達
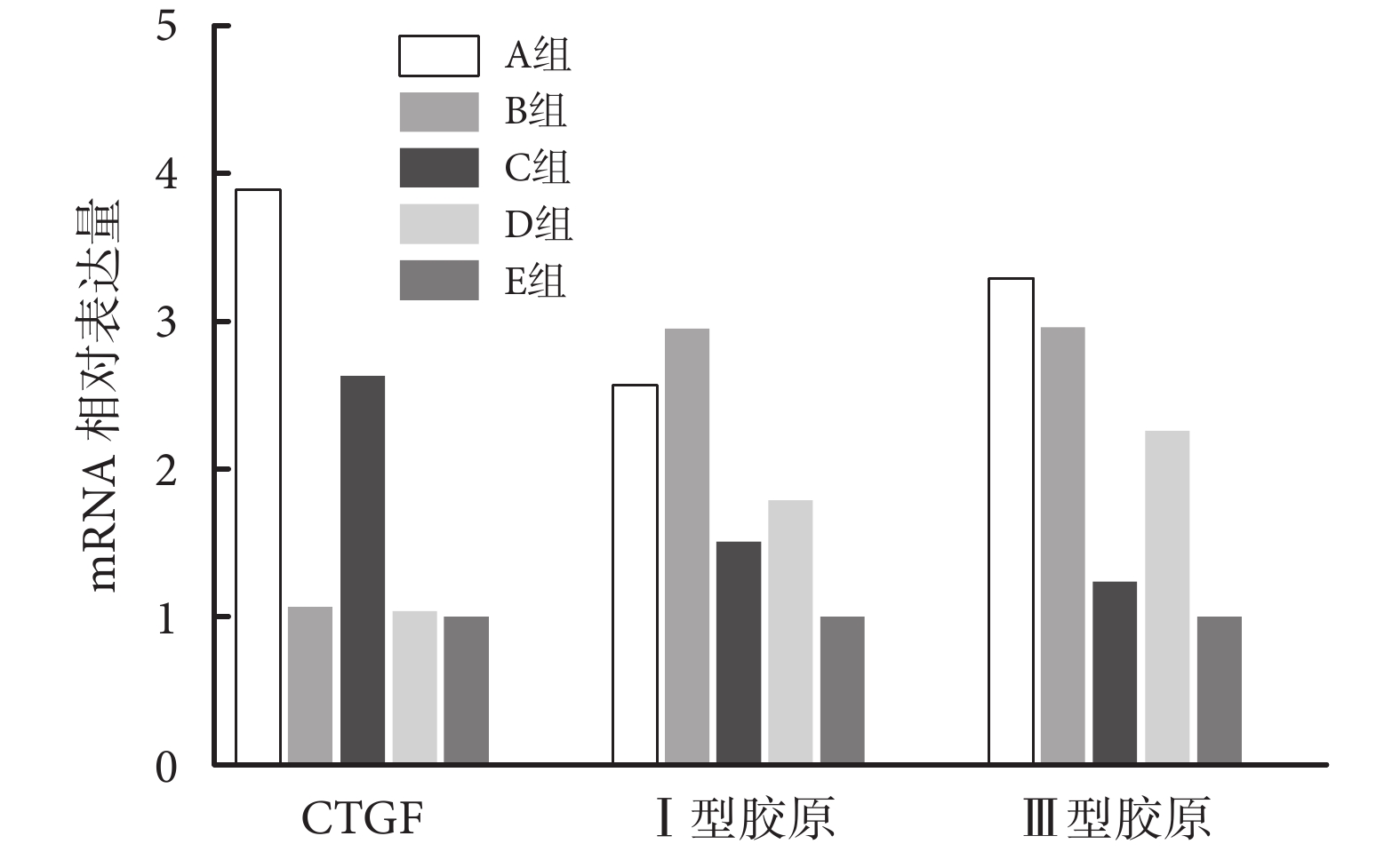
與 E 組比較,A 組 CTGF、Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量均顯著增高,差異有統計學意義(P<0.05);C 組各基因表達受到抑制,mRNA 相對表達量顯著低于 A 組,但仍顯著高于 E 組,差異均有統計學意義(P<0.05)。B 組Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量顯著高于 E 組,差異有統計學意義(P<0.05),但 CTGF mRNA 相對表達量與 E 組比較差異無統計學意義(P>0.05)。D 組Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量受到抑制,低于 B 組,但仍顯著高于 E 組,差異均有統計學意義(P<0.05);CTGF mRNA 相對表達量與 B、E 組比較差異無統計學意義(P>0.05)。見圖 5。
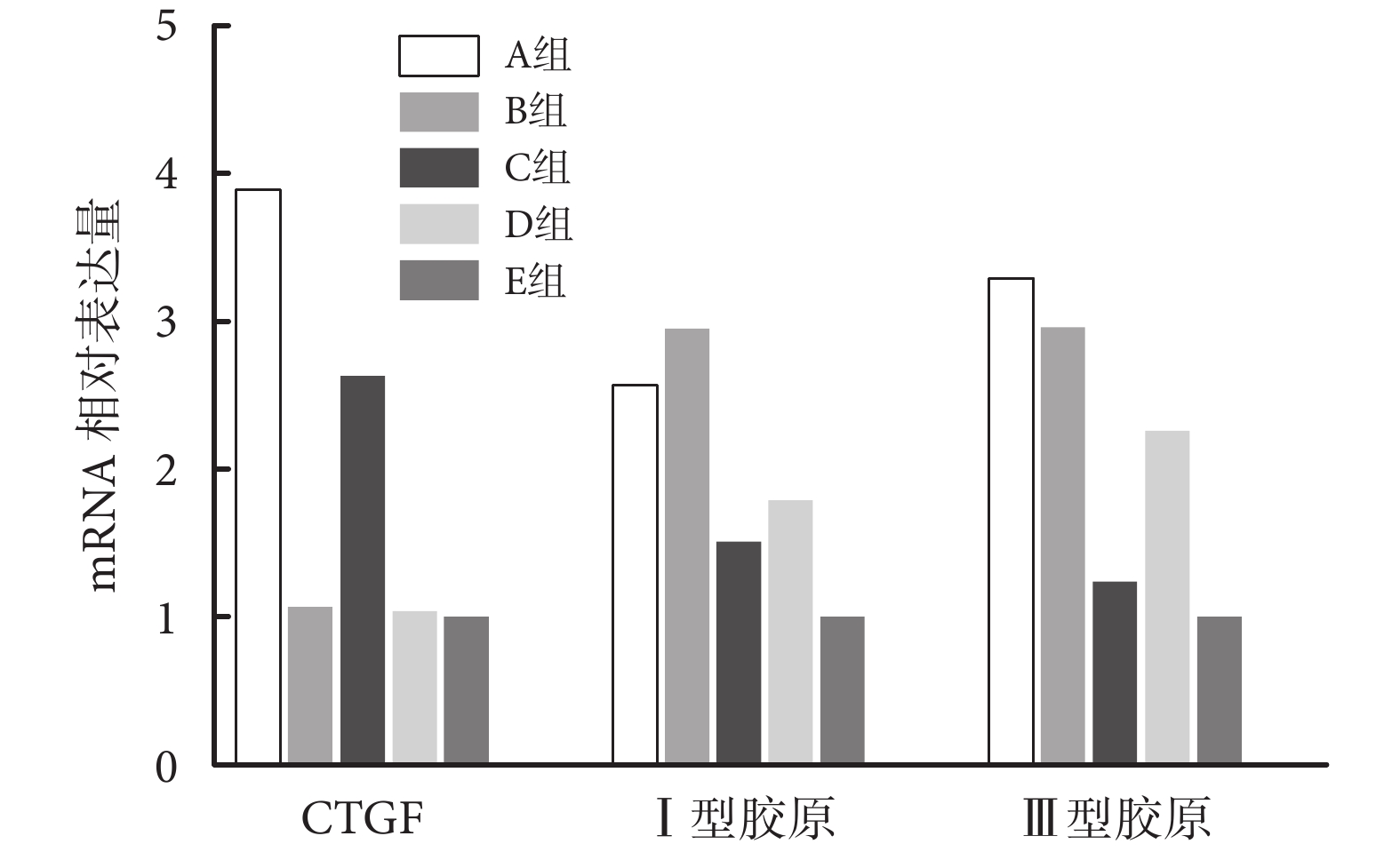 圖5
qRT-PCR 檢測各組各基因表達
Figure5.
Detection of relative expression of genes in each group by qRT-PCR
圖5
qRT-PCR 檢測各組各基因表達
Figure5.
Detection of relative expression of genes in each group by qRT-PCR
3 討論
黃韌帶肥厚是引起腰椎管狹窄癥的主要原因,肥厚和纖維化被認為是黃韌帶退變的病理基礎。通過流行病學調查發現,很多因素如脊柱椎體節段、年齡、椎體屈伸活動造成的機械應力改變[9]和生長因子調節[10]等,參與了黃韌帶增生、肥厚的病變過程。既往研究表明 TGF-β1 可以在腰椎管狹窄的肥厚、退變黃韌帶組織中大量表達[11-13]。連續的機械應力會刺激 TGF-β1 含量增加,導致黃韌帶變性[14]。彈性纖維丟失、組織纖維化、膠原組織增多是退變黃韌帶共同的病理特征[6-7]。研究發現[15]在黃韌帶輕度肥大階段,TGF-β1 mRNA 表達量最大,而在黃韌帶成熟肥大階段,TGF-β1 mRNA 表達量明顯降低,表明隨著黃韌帶厚度增加,TGF-β1 的表達卻成負相關。由此可見,TGF-β1 在黃韌帶細胞中表達上調與黃韌帶肥厚過程密切相關。
CTGF 是一個促纖維化因子,參與纖維化過程,促進細胞增殖、遷移、黏附及細胞外基質合成和新生血管形成等,參與創傷修復[16]。研究表明,將正常黃韌帶組織與增生肥厚黃韌帶組織細胞外基質進行對比發現,兩組 CTGF 含量有顯著差異,其表達的增加與韌帶肥厚程度成正相關[2]。在腰椎肥大的黃韌帶中 CTGF 表達增加,推測 CTGF 可能參與黃韌帶肥大的過程[17]。目前對 TGF-β1 及 CTGF 與黃韌帶增生肥厚之間的關系尚不清楚。因此,我們設想在黃韌帶微損傷早期,黃韌帶細胞釋放 TGF-β1 調控 CTGF 修復損傷的黃韌帶,而隨著修復持續發展,CTGF 引發的瘢痕炎性反應出現導致黃韌帶增生肥厚。本研究通過將 TGF-β1 和外源性 CTGF 蛋白共同刺激黃韌帶細胞,觀察細胞生長增殖變化,探討二者在黃韌帶增生肥厚中的可能作用機制。
我們通過膠原酶預消化組織塊培養法提取并培養黃韌帶細胞。加入外源性 TGF-β1 刺激后,發現可以促進黃韌帶細胞增殖,并從基因和蛋白水平提高 CTGF、Ⅰ型膠原和Ⅲ型膠原的表達。而當加入 CTGF 中和抗體后,TGF-β1 增加黃韌帶細胞Ⅰ、Ⅲ型膠原 mRNA 及 CTGF mRNA 表達的能力明顯下降,說明 TGF-β1 可通過 CTGF 途徑對黃韌帶細胞的膠原蛋白含量進行調節。TGF-β1 通過調節 CTGF mRNA 的表達,達到增加 CTGF 蛋白含量的目的,但這種聯系可以被中和抗體阻斷,說明 CTGF 抗體是通過阻斷 CTGF 和 CTGF 受體之間的相互作用來阻斷 TGF-β1,與細胞內 CTGF 的蛋白水平和 mRNA 水平無關。而加入外源性 CTGF 可以增加黃韌帶細胞 CTGF 蛋白的含量,但不能增加 CTGF mRNA 的表達,說明外源性 CTGF 可以進入細胞內,但無法影響 mRNA 合成。由此認為,在黃韌帶微損傷早期,黃韌帶細胞通過釋放 TGF-β1,介導調控 CTGF mRNA 生成,增加 CTGF 蛋白表達。而 CTGF 可提高膠原蛋白的生成,促進黃韌帶細胞纖維化,最終導致組織肥厚。因此,通過以上實驗可以推測,TGF-β1 增加Ⅰ型膠原和Ⅲ型膠原 mRNA 的表達,導致黃韌帶細胞增生是通過影響 CTGF mRNA 表達完成的;通過阻斷 CTGF,則可以抑制黃韌帶細胞的增生。
綜上述,我們的研究首次發現 TGF-β1 通過影響 CTGF 協同促進黃韌帶細胞增生,為探討黃韌帶增生肥厚的發病機制及防治措施提供了理論依據,為下一步繼續研究 TGF-β1 影響 CTGF mRNA 表達的可能信號通路提供可靠線索。
作者貢獻:劉志軍、段揚負責科研課題設計;盧昌懷、曹延林負責實驗實施及文章撰寫;張宏波負責數據收集、整理。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經常德市第一中醫醫院醫學倫理委員會批準(2016-S017)。
腰椎管狹窄癥是一種常見的老年人運動功能障礙性疾病[1],通常因腰椎退行性病變如黃韌帶增生肥厚、鈣化,椎體小關節增生,椎間盤突出等,導致腰椎后部結構改變所引起。其中椎管內黃韌帶增生肥厚被認為是腰椎管狹窄發展中最重要的致病因素之一。引起黃韌帶增生肥厚的原因很多,包括年齡、脊柱機械應力改變及細胞因子的調節等。在黃韌帶增生肥厚過程中,有研究表明結締組織生長因子(connective tissue growth factor,CTGF)和 TGF-β1 表達顯著增加[2-5]。然而關于兩者在黃韌帶增生肥厚發病機制中的具體作用機制,至今尚未完全闡明。因此,本研究以外源性重組 CTGF 蛋白和 TGF-β1 共同刺激黃韌帶細胞,觀察細胞生長增殖變化,探討二者在黃韌帶增生肥厚中的可能作用機制。
1 材料與方法
1.1 主要試劑及儀器
TGF-β1 蛋白、CTGF 蛋白(Invitrogen 公司,美國);CTGF 中和抗體(Sigma 公司,美國);兔抗Ⅰ、Ⅲ型膠原多克隆抗體、兔抗波形蛋白單克隆抗體(Abcam 公司,美國);辣根過氧化物酶標記的山羊抗兔 IgG(BOSTER 公司,美國);逆轉錄試劑盒、實時熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)試劑盒(DBI 公司,德國);RNA 提取試劑 Trizol(Takara 公司,日本)。StratageneMx3000P qRT-PCR 儀(Agilent 公司,美國);倒置光學顯微鏡(MOTIC 公司,中國);正置熒光顯微鏡(Zeiss 公司,德國)。
1.2 人腰椎黃韌帶細胞的分離培養與鑒定
1.2.1 細胞分離培養
取常德市第一中醫醫院骨傷科脊柱病區腰椎椎間盤突出患者髓核摘除術中的黃韌帶組織(術前均經影像學檢查確定無明顯黃韌帶增生,術后取材通過顯微鏡觀察,保證黃韌帶細胞健康,排除肥大及其他病理變化),采用膠原酶預消化組織塊培養法[6-7]分離,進行傳代培養得到黃韌帶細胞。
1.2.2 細胞鑒定
① 細胞形態觀察:采用倒置光學顯微鏡觀察分離培養過程中細胞形態變化。② 免疫熒光染色觀察:取第 1、3、5 代細胞,分別將細胞接種到 96 孔培養板中,待細胞長成單層后 PBS 洗 2 次;用冷丙酮固定 20 min,PBS 處理 3 次,每次 5 min;0.3%PBS-Triton X-100 通透 20 min,PBS 處理 3 次,每次 5 min;正常山羊血清封閉 30 min,分別滴加兔抗波形蛋白單克隆抗體(1∶100),兔抗Ⅰ、Ⅲ型膠原多克隆抗體(1∶100),4℃ 震動,過夜;PBS 處理 3 次,每次 5 min;加入 Alexa Fluor 488 山羊抗兔抗體(1∶100),37℃ 避光孵育 30 min,PBS 處理 3 次,每次 5 min;滴加 DAPI 染液常溫染色 10 min 晾干,抗熒光猝滅封片劑封片,4℃ 保存。熒光倒置顯微鏡拍照觀察。③ MTT 法檢測細胞增殖:取第 1、3、5 代細胞,PBS 洗滌 2 次,加入 0.25% 胰蛋白酶,顯微鏡下觀察當細胞質回縮時,加入新鮮的完全培養基,吸取細胞懸液滴在蓋玻片邊緣,靜置 3 min;調整細胞濃度為 1×105個/mL,取 100 μL 細胞懸液加入 96 孔板,放入培養箱培養。0、24、48、72 h 時按照 MTT 法采用酶標儀檢測 450 nm 波長下細胞吸光度(A)值。
1.3 實驗分組及方法
取第 3 代黃韌帶細胞,以 5×104 個/mL 密度接種于 96 孔板,常規培養 24 h 后將細胞分為 5 組。A 組于細胞中加入 3 ng/mL TGF-β1[8],B 組加入 50 ng/mL CTGF[8],C 組加入 3 ng/mL TGF-β1+CTGF 中和抗體(1∶500)封閉,D 組加入 50 ng/mL CTGF+CTGF 中和抗體(1∶500)封閉,E 組加入無血清 DMEM 作為對照。
1.4 觀測指標
1.4.1 MTT 法檢測 TGF-β1 和 CTGF 對黃韌帶細胞增殖的影響
各組繼續培養 24 h 后,同上法采用 MTT 法檢測各組細胞增殖 A 值。
1.4.2 Western blot 檢測 CTGF 蛋白表達
培養 24 h 分別收集各組細胞(每組約 1×107個),加入 0.5 mL 裂解液,按步驟提取樣本總蛋白并對蛋白定量;進行 SDS-PAGE 凝膠電泳,轉膜后將聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜分別放入裝有 3 mL CTGF(1∶1 000;轉膜條件:300 mA 恒流轉膜 38 min)的小槽內,置于搖床上室溫平緩搖動 1 h;再將 PVDF 膜放入含有 3 mL 辣根過氧化物酶標記的山羊抗兔 IgG 二抗溶液(1∶20 000)的小槽內,置于搖床上室溫平緩搖動 40 min;洗滌 PVDF 膜進行化學發光、顯影、定影。將膠片進行掃描,用 Image-Pro Plus 6.0 圖像處理系統分析條帶 A 值。以 GAPDH 為內參,將 CTGF 與 GAPDH 的 A 值比值作為 CTGF 蛋白相對表達量。實驗重復 3 次,取均值。
1.4.3 qRT-PCR 檢測各基因表達
取第 3 代細胞,于含 10%FBS 的 DMEM 中培養 24 h,使其處于 G0 期,然后按分組方法處理細胞 24 h。按 Trizol 試劑說明書方法提取細胞總 RNA,按逆轉錄試劑盒說明書配制逆轉錄反應體系合成 cDNA 第一鏈,配制 qPCR 擴增的反應體系,進行 PCR 檢測。PCR 反應條件:94℃、2 min,94℃、20 s,58℃、20 s,72℃、20 s,40 個循環;融解曲線分析:溫度 62~95℃。引物序列:Ⅰ型膠原正義鏈:5'-AGATCTGAA-GTGTGATGACTCAGG-3',反義鏈:5'-CAGATC-ACGTCATCGCACAAC-3';Ⅲ型膠原正義鏈:5'-ATGTTCCACGGAAACACTGG-3',反義鏈:5'-GGAGAGAAGTCGAAGGAATGC-3';GAPDH 正義鏈:5'- ACACCCACTCCTCTCCACCTTT-3',反義鏈:5'-TTACTCCTTGGACTGGCCATGT-3';CTGF 正義鏈:5'-GGAGTGGGTGCTTGTGAC-GAG-3',反義鏈:5'-GTCTTCCAGTCGGTAAGC-CG-3'。用 2?ΔΔCt法計算各組 CTGF、Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量。實驗重復 3 次,取均值。
1.5 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,組間比較及組內各時間點間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 黃韌帶細胞形態觀察及鑒定
2.1.1 形態觀察
培養 6~8 d,可見黃韌帶組織塊周圍有少量細胞爬出,細胞呈梭形;12 d 細胞數量增加,形態呈多樣性,包括梭形、多角形、扇形,細胞質豐富,細胞核呈橢圓形,細胞膜清晰。見圖 1。
 圖1
黃韌帶細胞形態觀察(倒置光學顯微鏡×100)
圖1
黃韌帶細胞形態觀察(倒置光學顯微鏡×100)
a. 培養 7 d;b. 培養 12 d
Figure1. Morphological observation of the ligamentum flavum cells (Inverted optical microscope×100)a. Cultured for 7 days; b. Cultured for 12 days
2.1.2 免疫熒光染色觀察
免疫熒光染色示,第 1、3、5 代細胞均呈陽性反應,均表現出典型的黃韌帶成纖維細胞的細胞表型。所有細胞均表達Ⅰ型膠原蛋白及波形蛋白,部分細胞表達Ⅲ型膠原蛋白。見圖 2。
 圖2
第 3 代細胞免疫熒光染色觀察(熒光倒置顯微鏡×100)
圖2
第 3 代細胞免疫熒光染色觀察(熒光倒置顯微鏡×100)
a. Ⅰ型膠原;b. 波形蛋白;c. Ⅲ型膠原
Figure2. Immunofluorescence staining of the 3rd generation cells (Fluorescence inverted microscope×100)a. Collagen typeⅠ; b. Vimentin; c. Collagen type Ⅲ
2.1.3 MTT 法檢測細胞增殖情況
隨培養時間延長,各代細胞 A 值均逐漸增加,同代細胞各時間點間 A 值比較差異均有統計學意義(P<0.05);相同時間點各代細胞間 A 值比較差異均無統計學意義(P>0.05)。見圖 3。
 圖3
MTT 法檢測第 1、3、5 代黃韌帶細胞增殖情況
Figure3.
Detecting the proliferation of the 1st, 3rd, and 5th gene ration of ligamentum flavum cells with MTT assay
圖3
MTT 法檢測第 1、3、5 代黃韌帶細胞增殖情況
Figure3.
Detecting the proliferation of the 1st, 3rd, and 5th gene ration of ligamentum flavum cells with MTT assay
2.2 MTT 法檢測 TGF-β1 和 CTGF 對黃韌帶細胞增殖的影響
培養 24 h,A、B、C、D、E 組 A 值分別為 0.477±0.002、0.493±0.004、0.428±0.003、0.435±0.003、0.405±0.003。A、B 組 A 值顯著高于 E 組,差異有統計學意義(P<0.05);而加入 CTGF 中和抗體后,C、D 組 A 值降低,但仍高于 E 組,差異有統計學意義(P<0.05);A、C 組間及 B、D 組間比較差異亦有統計學意義(P<0.05)。
2.3 Western blot 檢測 CTGF 蛋白表達
A、B、C、D、E 組 CTGF 蛋白相對表達量分別為 0.398±0.095、0.477±0.061、0.159±0.030、0.135±0.015、0.053±0.006。A、B 組 CTGF 蛋白相對表達量明顯高于 E 組,差異有統計學意義(P<0.05);而加入 CTGF 中和抗體后,C、D 組 CTGF 蛋白相對表達量顯著降低,但仍高于 E 組,差異有統計學意義(P<0.05);A、C 組間及 B、D 組間比較差異亦有統計學意義(P<0.05)。見圖 4。
 圖4
Western blot 檢測各組培養 24 h CTGF 蛋白表達
圖4
Western blot 檢測各組培養 24 h CTGF 蛋白表達
1:A 組 2:B 組 3:C 組 4:D 組 5:E 組
Figure4. Protein expression of CTGF at 24 hours detected by Western blot1: Group A 2: Group B 3: Group C 4: Group D5: Group E
2.4 qRT-PCR 檢測各基因表達
與 E 組比較,A 組 CTGF、Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量均顯著增高,差異有統計學意義(P<0.05);C 組各基因表達受到抑制,mRNA 相對表達量顯著低于 A 組,但仍顯著高于 E 組,差異均有統計學意義(P<0.05)。B 組Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量顯著高于 E 組,差異有統計學意義(P<0.05),但 CTGF mRNA 相對表達量與 E 組比較差異無統計學意義(P>0.05)。D 組Ⅰ型膠原和Ⅲ型膠原 mRNA 相對表達量受到抑制,低于 B 組,但仍顯著高于 E 組,差異均有統計學意義(P<0.05);CTGF mRNA 相對表達量與 B、E 組比較差異無統計學意義(P>0.05)。見圖 5。
 圖5
qRT-PCR 檢測各組各基因表達
Figure5.
Detection of relative expression of genes in each group by qRT-PCR
圖5
qRT-PCR 檢測各組各基因表達
Figure5.
Detection of relative expression of genes in each group by qRT-PCR
3 討論
黃韌帶肥厚是引起腰椎管狹窄癥的主要原因,肥厚和纖維化被認為是黃韌帶退變的病理基礎。通過流行病學調查發現,很多因素如脊柱椎體節段、年齡、椎體屈伸活動造成的機械應力改變[9]和生長因子調節[10]等,參與了黃韌帶增生、肥厚的病變過程。既往研究表明 TGF-β1 可以在腰椎管狹窄的肥厚、退變黃韌帶組織中大量表達[11-13]。連續的機械應力會刺激 TGF-β1 含量增加,導致黃韌帶變性[14]。彈性纖維丟失、組織纖維化、膠原組織增多是退變黃韌帶共同的病理特征[6-7]。研究發現[15]在黃韌帶輕度肥大階段,TGF-β1 mRNA 表達量最大,而在黃韌帶成熟肥大階段,TGF-β1 mRNA 表達量明顯降低,表明隨著黃韌帶厚度增加,TGF-β1 的表達卻成負相關。由此可見,TGF-β1 在黃韌帶細胞中表達上調與黃韌帶肥厚過程密切相關。
CTGF 是一個促纖維化因子,參與纖維化過程,促進細胞增殖、遷移、黏附及細胞外基質合成和新生血管形成等,參與創傷修復[16]。研究表明,將正常黃韌帶組織與增生肥厚黃韌帶組織細胞外基質進行對比發現,兩組 CTGF 含量有顯著差異,其表達的增加與韌帶肥厚程度成正相關[2]。在腰椎肥大的黃韌帶中 CTGF 表達增加,推測 CTGF 可能參與黃韌帶肥大的過程[17]。目前對 TGF-β1 及 CTGF 與黃韌帶增生肥厚之間的關系尚不清楚。因此,我們設想在黃韌帶微損傷早期,黃韌帶細胞釋放 TGF-β1 調控 CTGF 修復損傷的黃韌帶,而隨著修復持續發展,CTGF 引發的瘢痕炎性反應出現導致黃韌帶增生肥厚。本研究通過將 TGF-β1 和外源性 CTGF 蛋白共同刺激黃韌帶細胞,觀察細胞生長增殖變化,探討二者在黃韌帶增生肥厚中的可能作用機制。
我們通過膠原酶預消化組織塊培養法提取并培養黃韌帶細胞。加入外源性 TGF-β1 刺激后,發現可以促進黃韌帶細胞增殖,并從基因和蛋白水平提高 CTGF、Ⅰ型膠原和Ⅲ型膠原的表達。而當加入 CTGF 中和抗體后,TGF-β1 增加黃韌帶細胞Ⅰ、Ⅲ型膠原 mRNA 及 CTGF mRNA 表達的能力明顯下降,說明 TGF-β1 可通過 CTGF 途徑對黃韌帶細胞的膠原蛋白含量進行調節。TGF-β1 通過調節 CTGF mRNA 的表達,達到增加 CTGF 蛋白含量的目的,但這種聯系可以被中和抗體阻斷,說明 CTGF 抗體是通過阻斷 CTGF 和 CTGF 受體之間的相互作用來阻斷 TGF-β1,與細胞內 CTGF 的蛋白水平和 mRNA 水平無關。而加入外源性 CTGF 可以增加黃韌帶細胞 CTGF 蛋白的含量,但不能增加 CTGF mRNA 的表達,說明外源性 CTGF 可以進入細胞內,但無法影響 mRNA 合成。由此認為,在黃韌帶微損傷早期,黃韌帶細胞通過釋放 TGF-β1,介導調控 CTGF mRNA 生成,增加 CTGF 蛋白表達。而 CTGF 可提高膠原蛋白的生成,促進黃韌帶細胞纖維化,最終導致組織肥厚。因此,通過以上實驗可以推測,TGF-β1 增加Ⅰ型膠原和Ⅲ型膠原 mRNA 的表達,導致黃韌帶細胞增生是通過影響 CTGF mRNA 表達完成的;通過阻斷 CTGF,則可以抑制黃韌帶細胞的增生。
綜上述,我們的研究首次發現 TGF-β1 通過影響 CTGF 協同促進黃韌帶細胞增生,為探討黃韌帶增生肥厚的發病機制及防治措施提供了理論依據,為下一步繼續研究 TGF-β1 影響 CTGF mRNA 表達的可能信號通路提供可靠線索。
作者貢獻:劉志軍、段揚負責科研課題設計;盧昌懷、曹延林負責實驗實施及文章撰寫;張宏波負責數據收集、整理。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經常德市第一中醫醫院醫學倫理委員會批準(2016-S017)。