引用本文: 戎夢瑤, 昌震, 歐佳偉, 趙松川, 曾文, 劉琦. 包埋 NGF 的殼聚糖-PLGA 雙壁微球制備及其相關性能研究. 中國修復重建外科雜志, 2020, 34(1): 102-108. doi: 10.7507/1002-1892.201905074 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
周圍神經損傷是臨床常見的神經損傷類型,常導致患者出現感覺和運動功能障礙,嚴重影響患者生活質量。周圍神經損傷后的再生能力有限,主要與神經元的內在生長能力以及再生微環境相關[1-2]。為了修復神經損傷,一個重要的治療策略是在受損局部給予外源性神經營養因子[3-4]。神經營養因子主要包括 NGF、腦源性神經營養因子以及膠質細胞源性神經營養因子等[5-6]。NGF 不僅可以促進感覺神經元的存活,還可以促進神經損傷后的運動恢復[7-8]。然而,NGF 的生物半衰期短,易失去生物活性,不能長期有效地促進神經再生。因此,尋找一種安全有效的藥物緩釋載體至關重要。
近年來,微球類藥物緩釋載體受到學者的廣泛關注。以聚乳酸-聚乙醇酸共聚物[poly(lactide-co-glycolide),PLGA]制備的 PLGA 微球具有良好的生物相容性和低毒性等優點,在生物醫學領域受到廣泛應用[9]。然而,PLGA 微球具有高突釋性能,不利于神經損傷后的再生[10]。為了克服 PLGA 微球的上述缺點,有學者應用高分子生物材料對 PLGA 微球表面進行包埋與修飾。殼聚糖是一種天然多聚物材料,具有良好的生物相容性和生物可降解性,在醫療領域得到廣泛應用[11];有學者報道殼聚糖的降解產物可促進神經元的分化和軸突延長[12]。因此,應用殼聚糖材料包埋 PLGA 微球,具有降低 PLGA 微球高突釋性能的潛力,但目前尚未見相關研究。
本研究制備了一種包埋 NGF 的殼聚糖-PLGA 雙壁微球,該微球具有雙壁結構,殼聚糖為外壁,PLGA 微球為內壁。我們假設這種雙壁微球可顯著降低 PLGA 微球的高突釋率,同時可保護 NGF 的生物活性,促進神經再生。為了驗證這一假設是否成立,我們應用光鏡、掃描電鏡、激光共聚焦顯微鏡、紅外光譜分析、降解率以及緩釋性能等方法檢測雙壁微球的基本性能;此外,通過評估體外大鼠腎上腺嗜鉻細胞瘤(PC12)細胞的生物活性,進一步驗證雙壁微球緩釋的 NGF 是否具有生物活性。
1 材料與方法
1.1 主要試劑及儀器
PC12 細胞(ATCC 公司,美國)。PLGA、殼聚糖、重組大鼠 NGF、三聚磷酸鈉(sodium tripolyphosphate,TPP)、尼羅紅及 FITC 熒光染料(Sigma 公司,美國);NGF-ELISA 試劑盒(Promega 公司,美國);液體石蠟油、石油醚及異丙醇等常用化學試劑(國藥集團化學試劑有限公司)。激光共聚焦顯微鏡(Nikon 公司,日本);S-4800 掃描電鏡(Hitachi 公司,日本);激光粒徑分析儀(Malvern 公司,英國);紅外光譜分析儀(Shimadzu 公司,日本);超聲細胞粉碎儀(Sonics 公司,美國)。
1.2 包埋 NGF 的 PLGA 微球及殼聚糖-PLGA 雙壁微球制備
1.2.1 包埋 NGF 的 PLGA 微球
取 50 μg NGF 和 300 mg 牛血清白蛋白溶解于 50 μL PBS 溶液,200 mg PLGA 溶解于 10 mL 二氯甲烷溶液。將上述兩種溶液混合后,使用超聲細胞粉碎儀超聲分散 3 次(2 mm 探針頭、時間 20 s、40% 功率),得到初乳液;將初乳液加入由 Tween80 和水溶液混合的溶液中,繼續使用超聲細胞粉碎儀超聲分散 3 次(2 mm 探針頭、時間 20 s、40% 功率),得到終乳液;隨后經過磁力攪拌 30 min、過濾、離心(離心半徑 6 cm,10 000 r/min,10 min)、干燥,得到包埋 NGF 的 PLGA 微球。同法制備未包埋 NGF 的 PLGA 微球。
1.2.2 包埋 NGF 的殼聚糖-PLGA 雙壁微球
取 200 mg 殼聚糖與 200 mL 冰醋酸溶液混合溶解;將包埋 NGF 的 PLGA 微球與上述殼聚糖溶液混合均勻后,緩慢加入液體石蠟油中,機械攪拌 1 h;分別將濃度為 1%、3%、10%(W/V)的 TPP 溶液緩慢加入液體石蠟油中,充分交聯微球 1 h;依次使用石油醚、異丙醇反復清洗后,得到包埋 NGF 的殼聚糖-PLGA 雙壁微球,冰凍干燥后備用。同法制備未包埋 NGF 的殼聚糖-PLGA 雙壁微球。
1.3 觀測指標
1.3.1 包埋 NGF 的殼聚糖-PLGA 雙壁微球的基本特點
取 3%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球,用于檢測雙壁微球的基本特點。① 表面形態觀察:取上述雙壁微球分散于水溶液中,光鏡下觀察。另將上述雙壁微球均勻分散于金屬圓柱體上,噴金后真空干燥,掃描電鏡下觀察。② 內部形態觀察:在制備雙壁微球過程中,分別使用 FITC 和尼羅紅染色殼聚糖和 PLGA 進行熒光標記,然后將其分散于水溶液中,激光共聚焦顯微鏡下觀察 PLGA 微球在雙壁微球內的分布情況。③ 微球粒徑分析:將上述雙壁微球均勻分散于水溶液中,采用粒徑分析儀檢測其粒徑分布和粒徑大小。④ 物理-化學特性評價:分別取殼聚糖、PLGA 及未包埋 NGF 的殼聚糖-PLGA 雙壁微球,壓成薄片后,采用紅外光譜分析儀分析其物理-化學特性。
1.3.2 體外微球降解率測定
分別將 10 mg 包埋 NGF 的 PLGA 微球和 1%、3%、10%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球(分別設為 A、B、C、D 組)溶解于 10 mL PBS 溶液(pH7.4)中,充分混合均勻并磁力攪拌(100 r/min)。分別于 0~12 周每周以離心半徑 6 cm、10 000 r/min 離心 5 min,取出微球后真空干燥并稱重。按以下公式計算微球降解率:(W0–W1/W0)×100%,其中 W0 表示微球的初始質量,W1 表示降解后的微球質量。實驗重復 3 次,取均值。
1.3.3 體外微球中 NGF 緩釋檢測
分別將 10 mg 包埋 NGF 的 PLGA 微球和 1%、3%、10%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球(分別設為 A、B、C、D 組)溶解于 5 mL PBS 溶液(pH7.4)中,放置于恒溫搖床上勻速搖動。分別于 0~12 周每周以離心半徑 6 cm、10 000 r/min 離心 10 min,提取上清液,使用 NGF-ELISA 試劑盒測定 NGF 含量。按以下公式計算 NGF 的總緩釋率:R1/R0×100%,其中 R0 表示最初包埋 NGF 總量,R1 表示緩釋液中 NGF 實際含量。
1.3.4 體外微球緩釋液中 NGF 的生物活性評估
取 PC12 細胞以 1×105個/孔密度接種于含 2 mL 細胞培養液(含 5%FBS、10% 馬血清及 1% 青鏈霉素的 RPMI1640 培養液)的 24 孔培養板中培養。取未包埋 NGF 的殼聚糖-PLGA 雙壁微球以及 1%、3%、10%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球(分別設為 A1、B、C、D 組),同 1.3.3 方法,于 7、28、56、84 d 分別從緩釋液中吸取 300 μL 上清液,加入上述 24 孔培養板內,放入 37℃、5%CO2、飽和濕度培養箱內培養 3 d。隨機選擇 24 孔培養板內的 100 個 PC12 細胞計數,當細胞有 1 個或多個突起,且突起長度超過胞體長度則被認為是具有陽性軸突延長反應的 PC12 細胞。按以下公式計算具有陽性軸突延長反應的 PC12 細胞百分比:P1/P0×100%,其中 P0 表示最初隨機選擇的 100 個 PC12 細胞,P1 表示具有陽性軸突延長反應的 PC12 細胞數量。
1.4 統計學方法
采用 PRISM(GraphPad 軟件)統計軟件進行分析。數據以均數±標準差表示,各組間比較采用單因素方差分析,兩兩比較采用 Student t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 包埋 NGF 的殼聚糖-PLGA 雙壁微球的基本特點
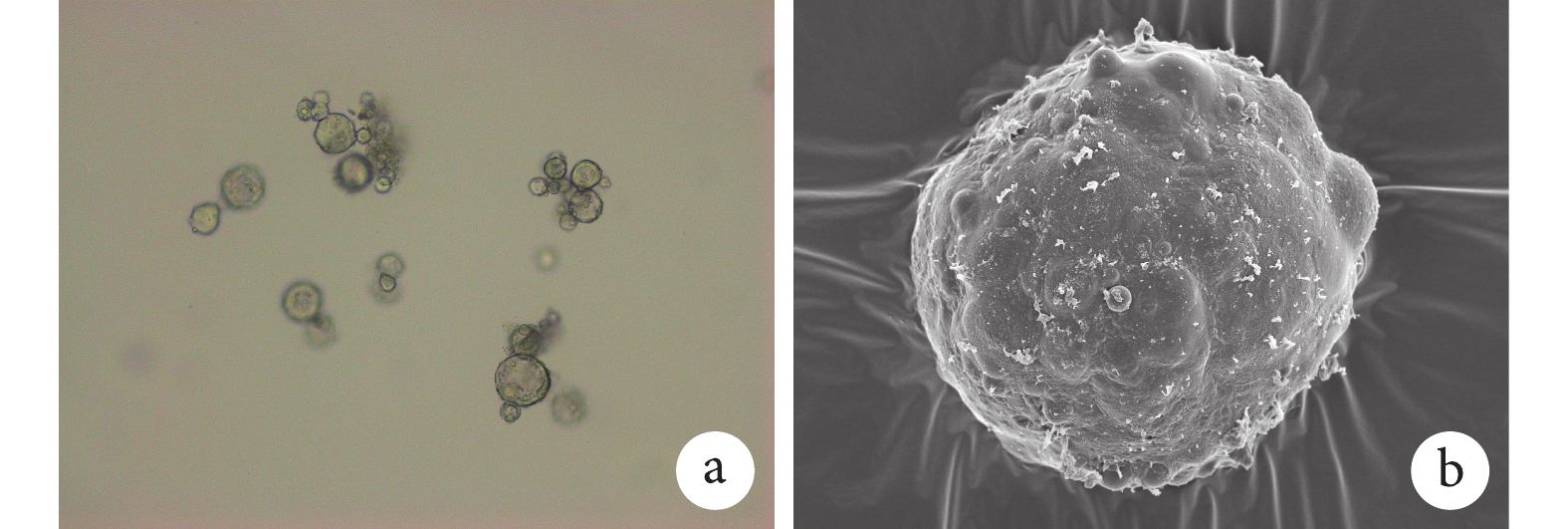
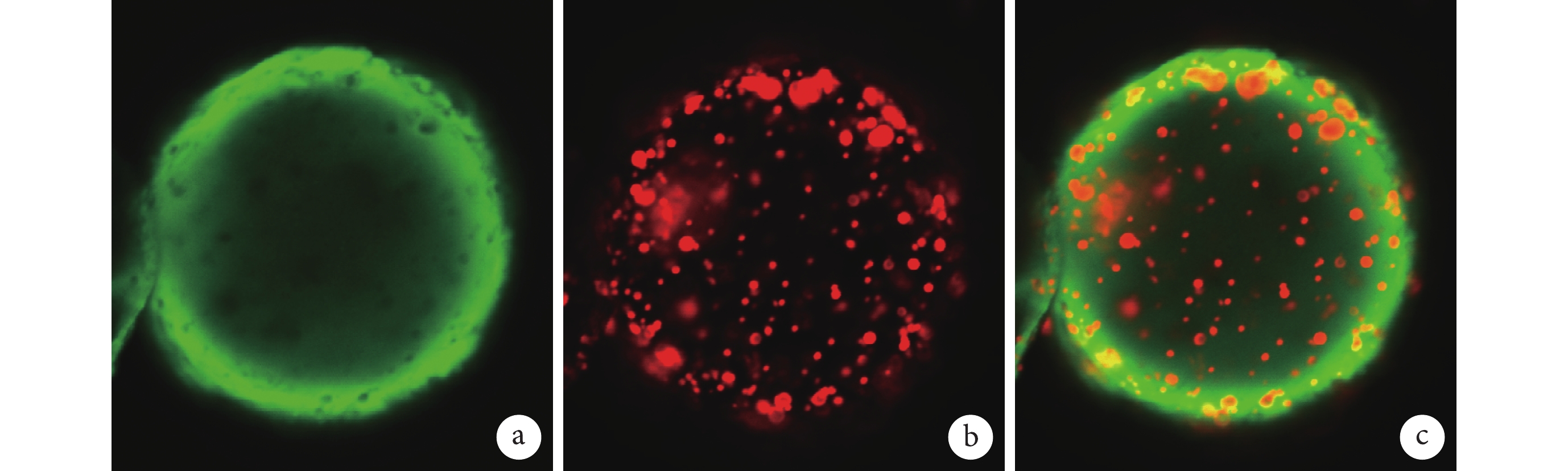
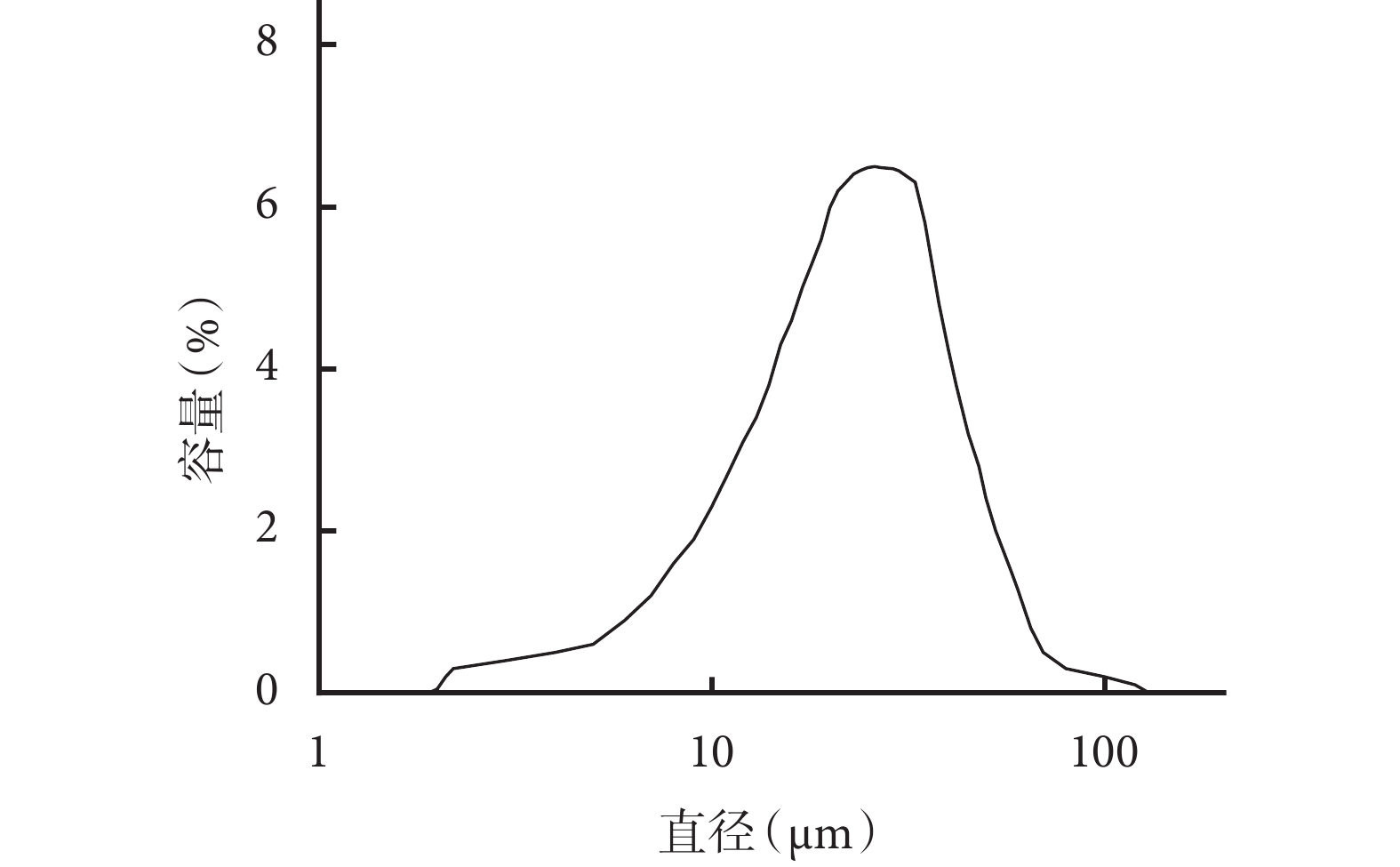
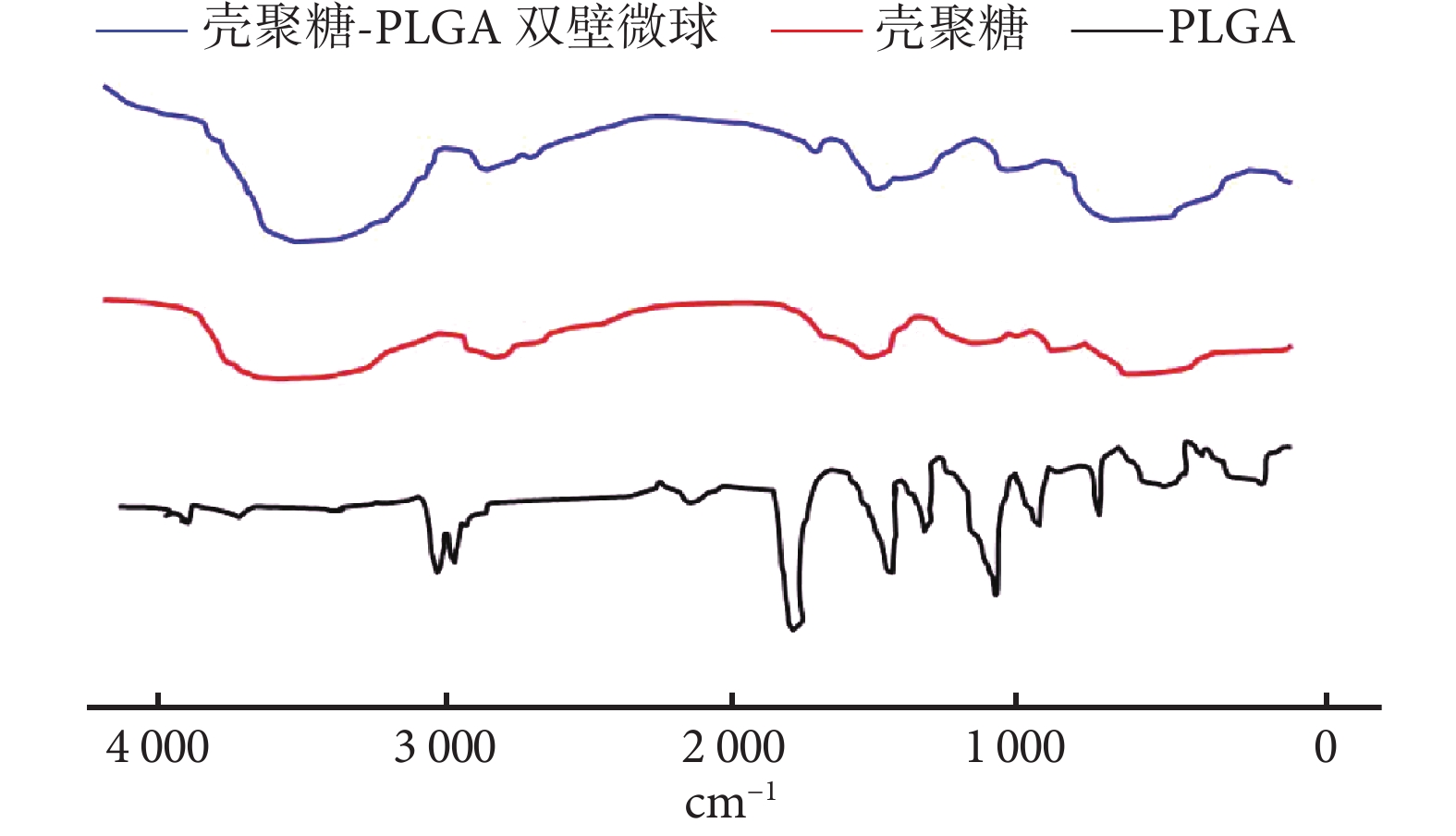
① 表面形態觀察:光鏡和掃描電鏡觀察示,雙壁微球呈球形結構,大小不等,分散較好,外表面相對粗糙,有很多小的球形凸起。見圖 1。② 內部形態觀察:激光共聚焦顯微鏡觀察示,雙壁微球的外殼為綠色(FITC 標記的殼聚糖),內核為紅色(尼羅紅標記的 PLGA 微球),PLGA 微球均勻分布于雙壁微球內。見圖 2。通過激光共聚焦顯微鏡結果,可以推出掃描電鏡雙壁微球外表面的凸起為 PLGA 微球,進一步說明該雙壁微球制備成功。③ 微球粒徑分析:雙壁微球的粒徑分布范圍為 18.5~42.7 μm,平均 29.3 μm。見圖 3。④ 物理-化學特性評價:紅外光譜分析結果示,未包埋 NGF 的殼聚糖-PLGA 雙壁微球在 3 432 cm?1處的吸收峰增寬,為殼聚糖基質中的-NH2 基團拉伸振動所致,表明雙壁微球在制備過程中保存了活性基團-NH2。與殼聚糖相比,雙壁微球在 1 640 cm?1處的吸收峰移動至 1 632 cm?1處,說明殼聚糖的氨基與 TPP 中的磷酸基發生了靜電反應。見圖 4。
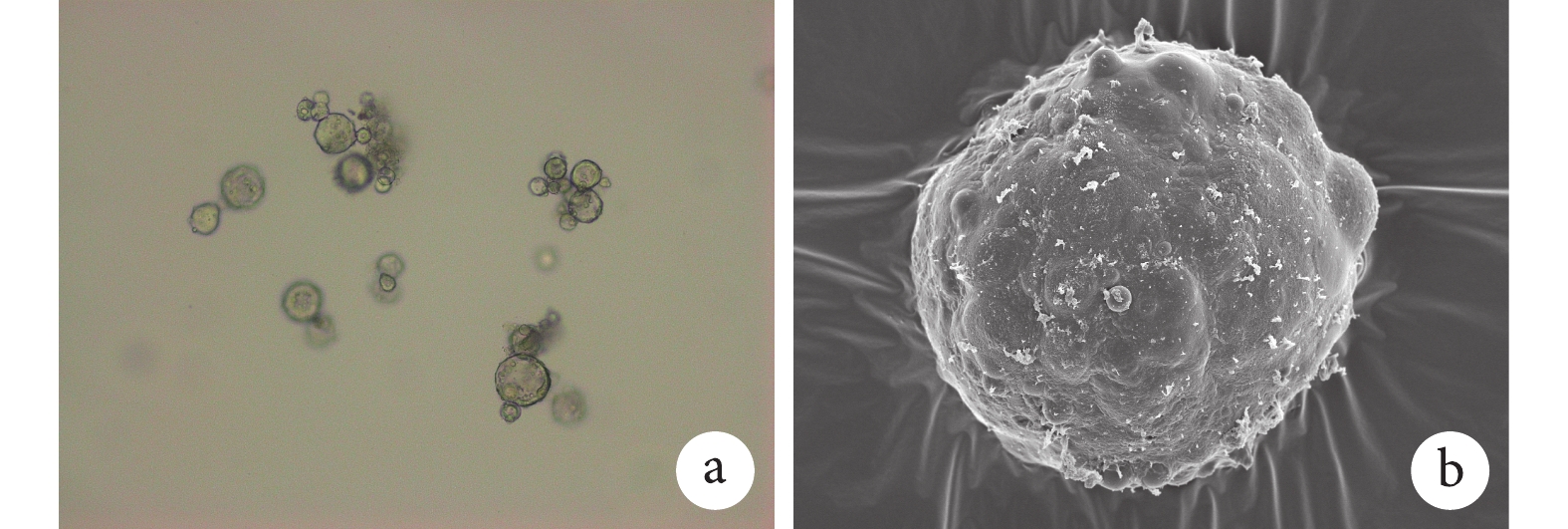 圖1
包埋 NGF 的殼聚糖-PLGA 雙壁微球表面形態特點
圖1
包埋 NGF 的殼聚糖-PLGA 雙壁微球表面形態特點
a. 光鏡觀察(×10);b. 掃描電鏡觀察(×50)
Figure1. Surface characteristics of NGF loaded chitosan-PLGA double-walled microspheresa. Light microscopy observation (×10); b. Scanning electron microscopy observation (×50)
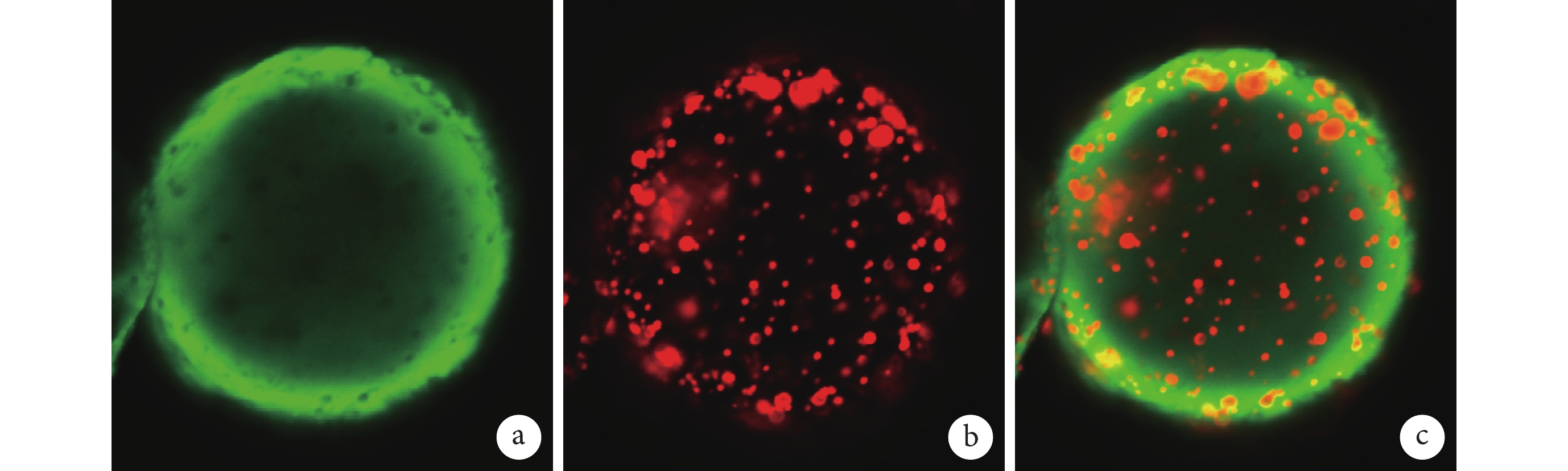 圖2
包埋 NGF 的殼聚糖-PLGA 雙壁微球內部形態(激光共聚焦顯微鏡×50)
圖2
包埋 NGF 的殼聚糖-PLGA 雙壁微球內部形態(激光共聚焦顯微鏡×50)
a. 經 FITC 染色的殼聚糖微球;b. 經尼羅紅染色的 PLGA 微球;c. 經 FITC 和尼羅紅染色的包埋 NGF 的殼聚糖-PLGA 雙壁微球
Figure2. Inner characteristics of NGF loaded chitosan-PLGA double-walled microspheres (Confocal laser scanning microscopy×50)a. FITC-stained chitosan microspheres; b. Nile red-stained PLGA microspheres; c. NGF loaded chitosan-PLGA double-walled microspheres stained by FITC and Nile red
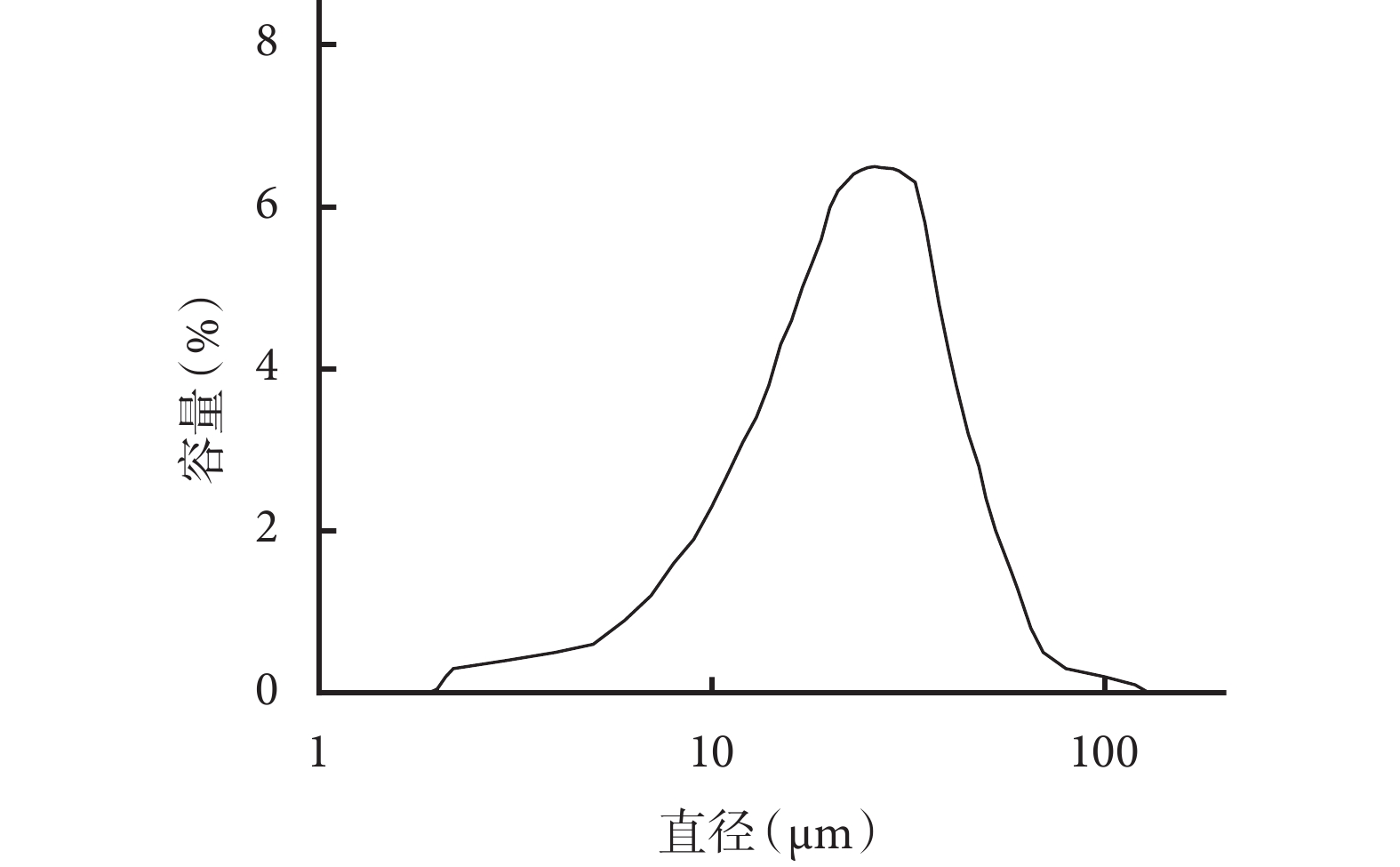 圖3
包埋 NGF 的殼聚糖-PLGA 雙壁微球粒徑分析
Figure3.
Size distribution of NGF loaded chitosan-PLGA double- walled microspheres
圖3
包埋 NGF 的殼聚糖-PLGA 雙壁微球粒徑分析
Figure3.
Size distribution of NGF loaded chitosan-PLGA double- walled microspheres
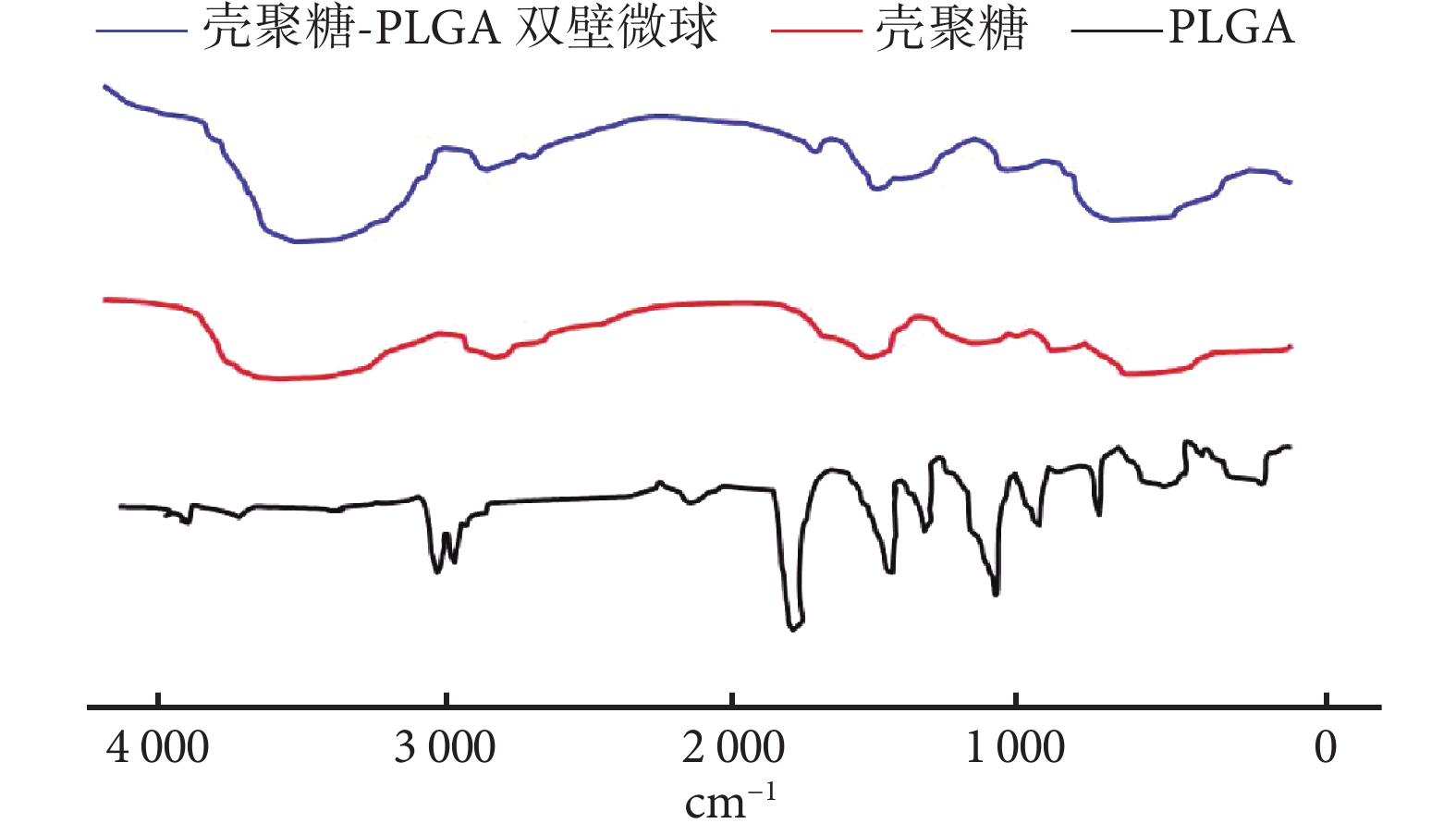 圖4
殼聚糖、PLGA 及未包埋 NGF 的殼聚糖-PLGA 雙壁微 球紅外光譜分析
Figure4.
FT-IR spectra of chitosan, PLGA, and chitosan-PLGA double-walled microspheres
圖4
殼聚糖、PLGA 及未包埋 NGF 的殼聚糖-PLGA 雙壁微 球紅外光譜分析
Figure4.
FT-IR spectra of chitosan, PLGA, and chitosan-PLGA double-walled microspheres
2.2 體外微球降解率測定
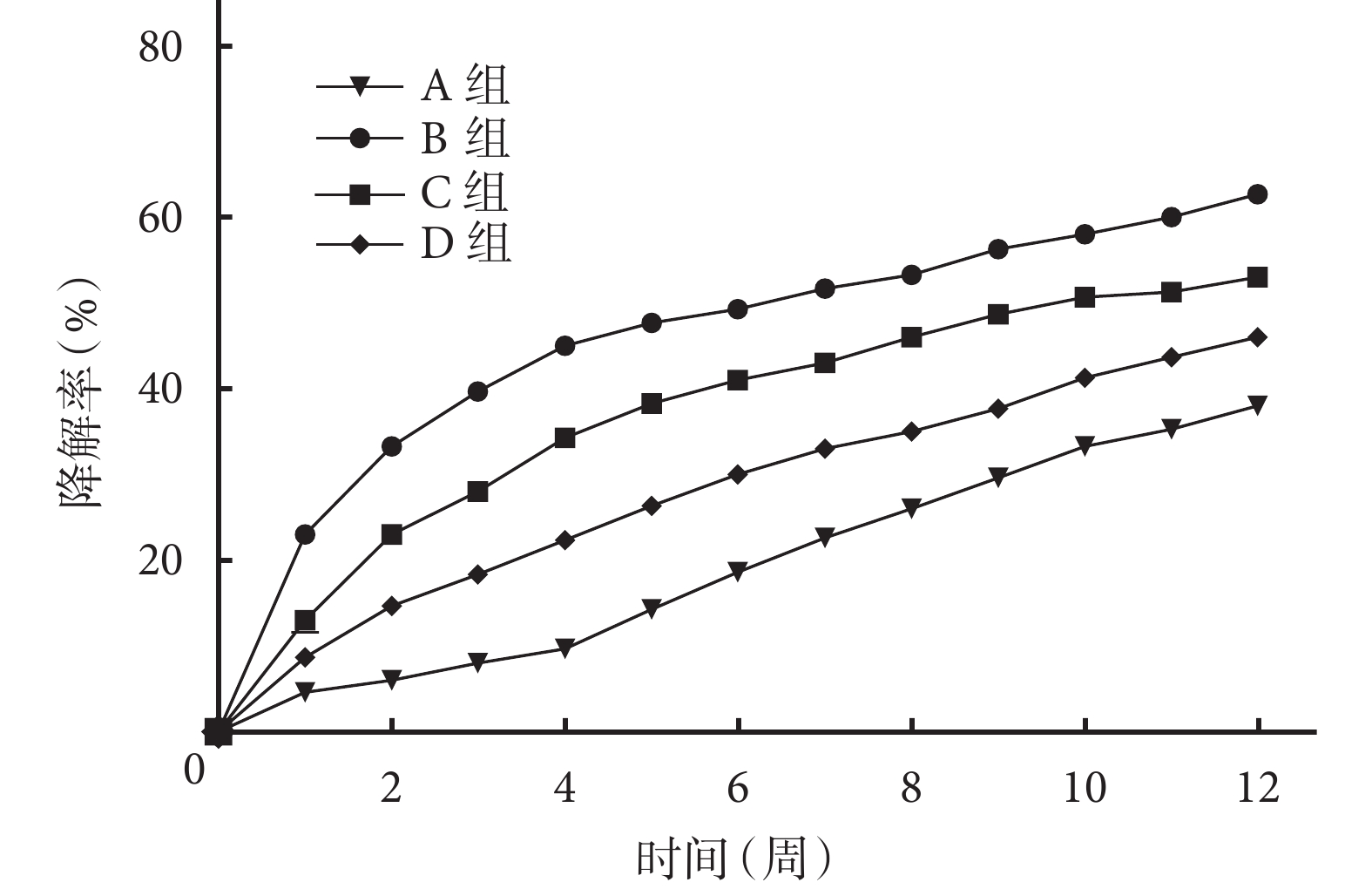
A 組:0~4 周微球降解速度逐漸增快,5~12 周降解速度較前減慢,12 周時微球降解率為 38.2%±2.8%。與 A 組相比,B、C、D 組雙壁微球降解速度明顯增快,并隨著 TPP 濃度的增加而逐漸減慢,12 周時 B、C、D 組雙壁微球的降解率分別達 62.3%±1.9%、53.0±2.8% 和 47.7%±2.1%。培養各時間點各組間微球降解率比較差異均有統計學意義(P<0.05)。見圖 5。
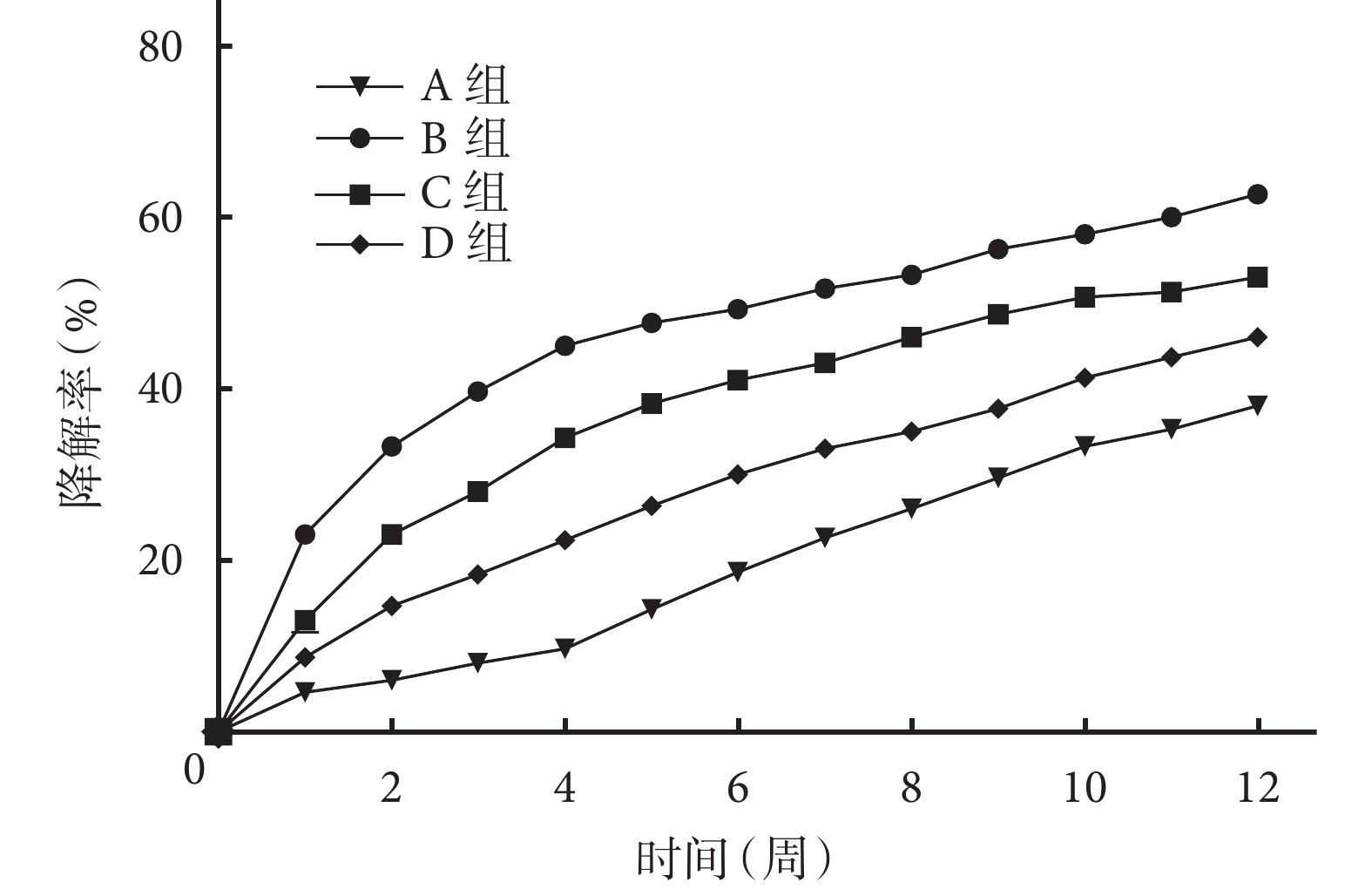 圖5
各組微球的體外降解率比較
Figure5.
In vitro degradation ratio in each microspheres group
圖5
各組微球的體外降解率比較
Figure5.
In vitro degradation ratio in each microspheres group
2.3 體外微球中 NGF 緩釋檢測
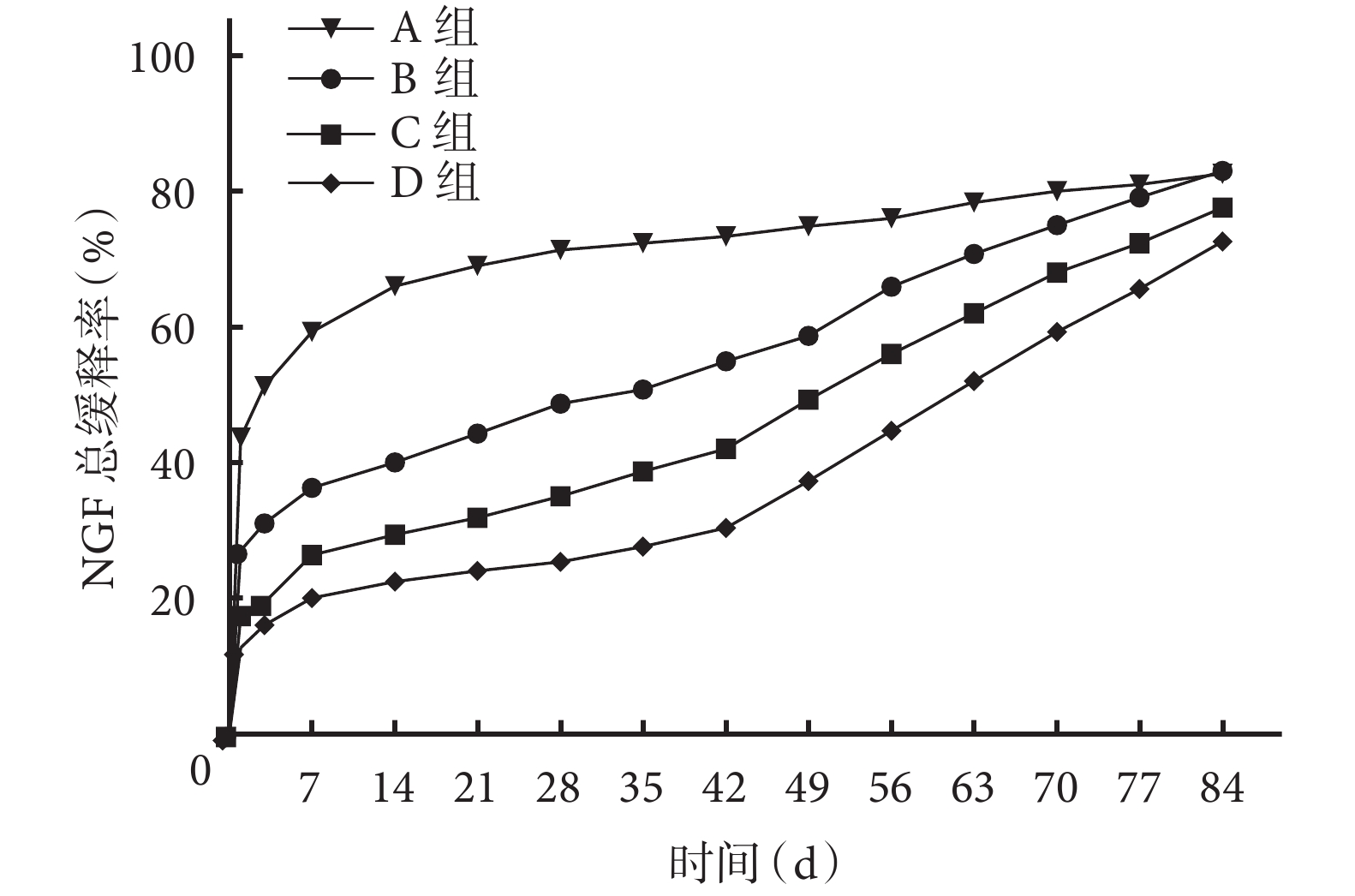
A 組 PLGA 微球緩釋 NGF 存在“突釋”現象,第 1 天 NGF 總緩釋率高達 43.6%±1.8%,隨后以相對較慢的速度緩釋 NGF,84 d 時 NGF 的總緩釋率達 81.2%±1.3%。與 A 組 PLGA 微球相比,B、C、D 組雙壁微球以相對較慢的速度緩釋 NGF,除 84 d 外,各時間點 B、C、D 組 NGF 總緩釋率均顯著低于 A 組,差異有統計學意義(P<0.05);B、C、D 組 NGF 的緩釋速度隨 TPP 濃度增加而減慢,除 84 d 外,各時間點 B、C、D 組間比較 NGF 總緩釋率差異均有統計學意義(P<0.05)。見圖 6。
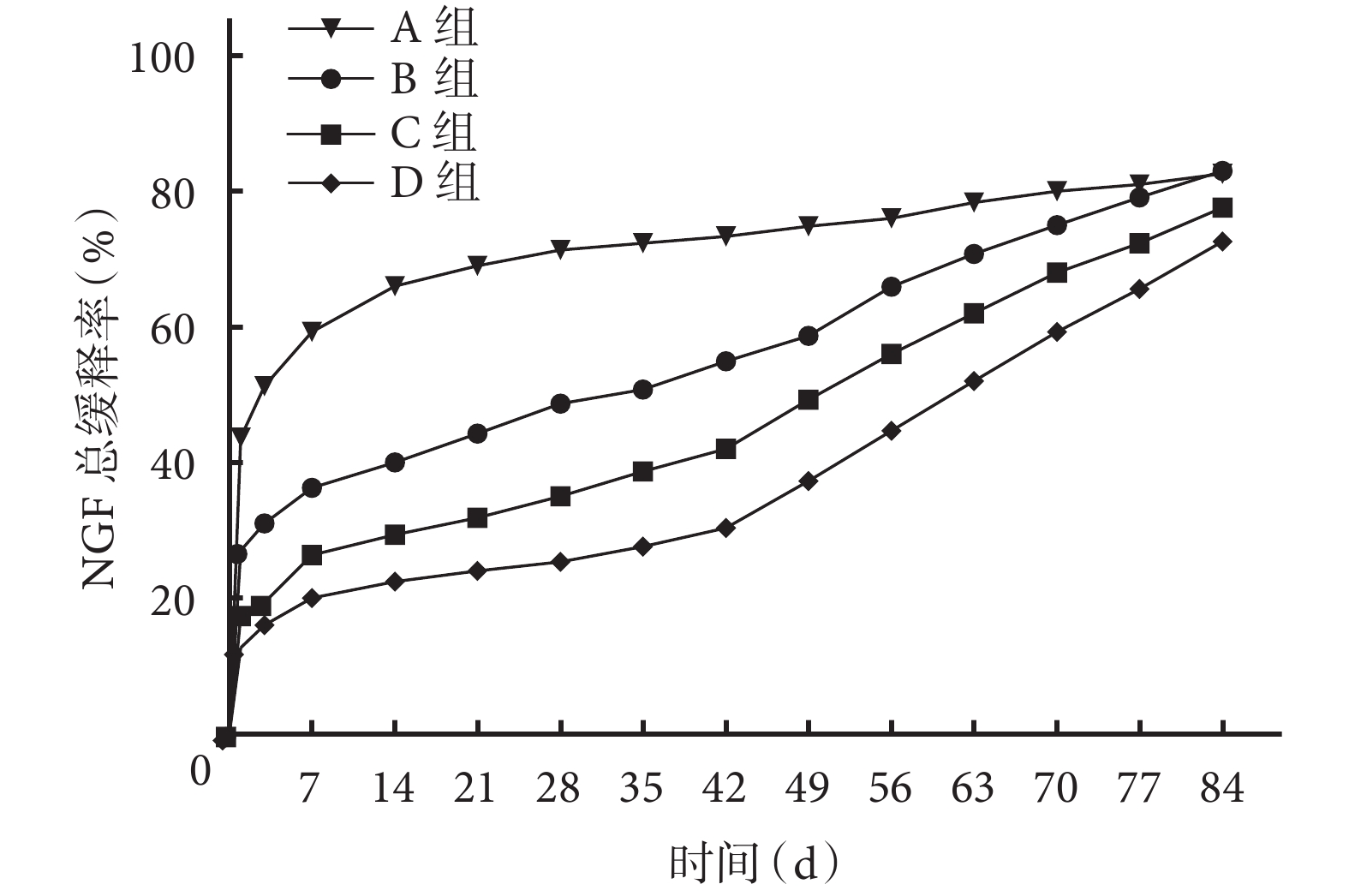 圖6
各組微球的體外 NGF 緩釋率比較
Figure6.
In vitro NGF sustained release ratio in each microspheres group
圖6
各組微球的體外 NGF 緩釋率比較
Figure6.
In vitro NGF sustained release ratio in each microspheres group
2.4 體外微球緩釋液中 NGF 的生物活性評估
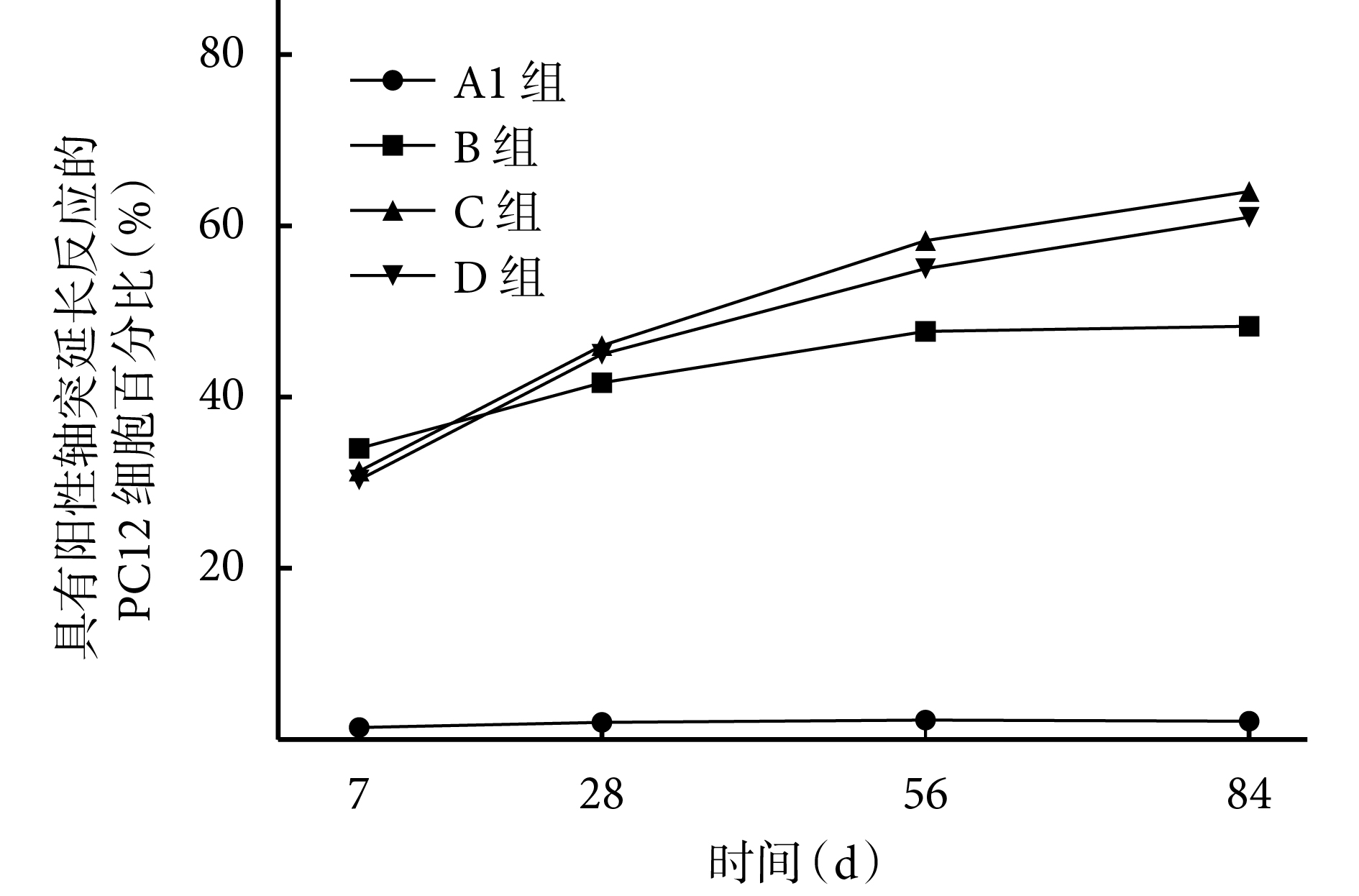
培養各時間點,B、C、D 組緩釋液中具有陽性軸突延長反應的 PC12 細胞百分比均顯著高于 A1 組,差異有統計學意義(P<0.05)。培養 7、28 d,B、C、D 組間比較差異無統計學意義(P>0.05);56、84 d 時,C、D 組緩釋液中具有陽性軸突延長反應的 PC12 細胞百分比顯著高于 B 組,差異有統計學意義(P<0.05),C、D 組間差異無統計學意義(P>0.05)。見圖 7。
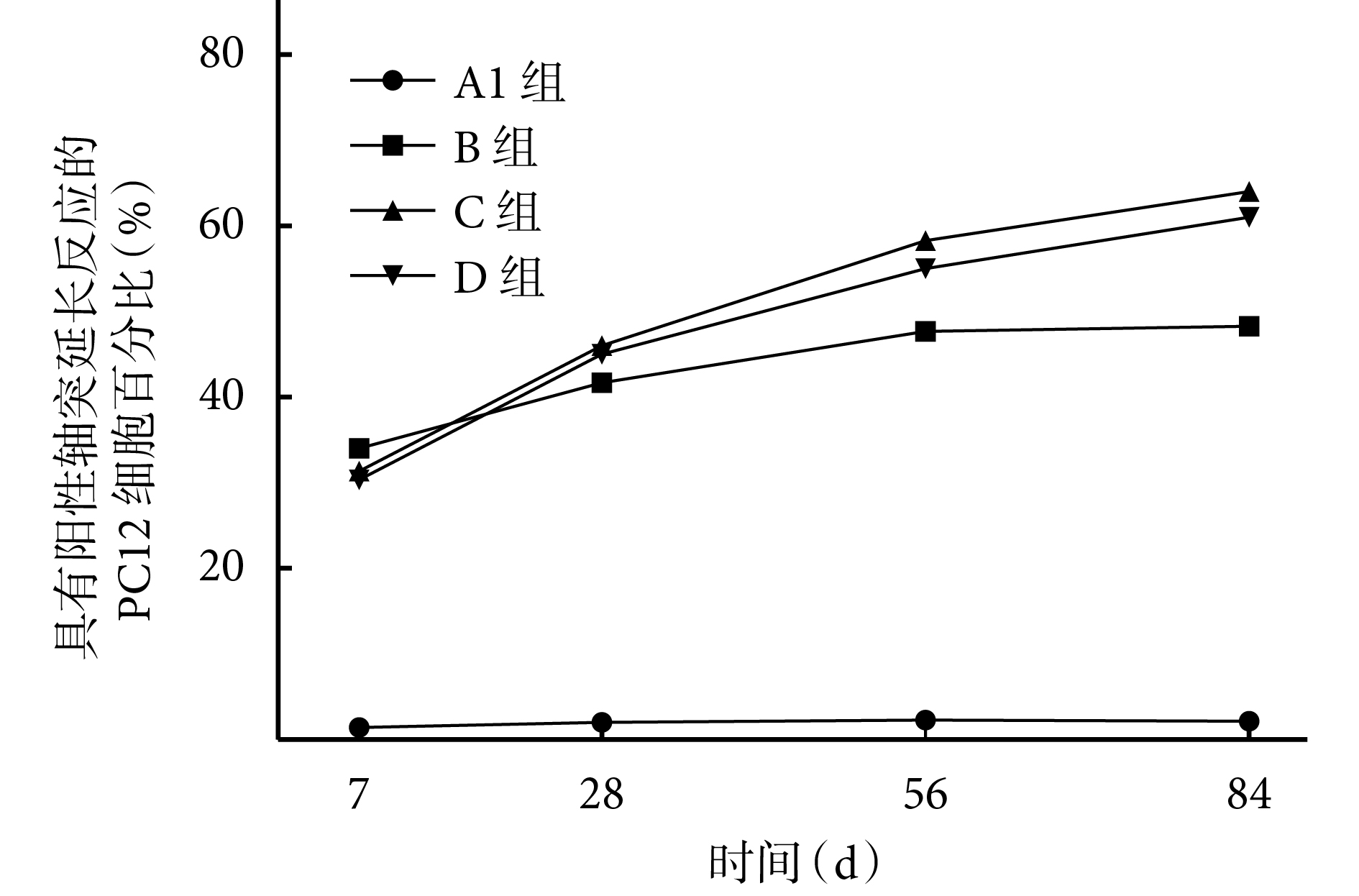 圖7
各組微球緩釋液中具有陽性軸突延長反應的 PC12 細胞 百分比比較
Figure7.
Percentage of PC12 cells with positive axonal elongation reaction in the sustained release solution in each microspheres group
圖7
各組微球緩釋液中具有陽性軸突延長反應的 PC12 細胞 百分比比較
Figure7.
Percentage of PC12 cells with positive axonal elongation reaction in the sustained release solution in each microspheres group
3 討論
周圍神經的再生需要一個良好的再生微環境,其中神經營養因子發揮著至關重要的作用。神經營養因子可提供化學營養支持,激活受損神經元的再生活力,促進神經再生。然而,在神經損傷部位的內在神經營養因子不足,需要提供外源性神經營養支持。本研究結果顯示,殼聚糖-PLGA 雙壁微球可包埋并緩釋具有生物活性的 NGF 達 84 d;此外,交聯劑 TPP 濃度的增加可影響殼聚糖-PLGA 雙壁微球的緩釋性能和 NGF 的生物活性。
近年來,微球類緩釋載體的迅速發展為臨床應用奠定了良好基礎。PLGA 微球是最受關注的一種微球緩釋系統,在生物醫學領域得到了廣泛應用。然而,PLGA 微球具有突釋性,在短時間內快速緩釋包埋的蛋白藥物,過量的蛋白藥物不利于神經再生早期的負反饋調節作用,從而產生抑制神經再生的作用[13-15]。此外,PLGA 微球的酸性降解產物可破壞包埋蛋白藥物的生物活性,降低蛋白藥物的藥學作用[16]。因此,尋找一種對 PLGA 微球改進的方法具有重要的臨床意義。本研究選擇殼聚糖修飾 PLGA 微球主要有以下兩個原因:首先,殼聚糖是一種天然多聚物材料,具有良好的生物降解性和無毒性,廣泛用于生物醫藥領域;其次,有學者報道殼聚糖的降解產物可促進軸突生長,加快神經再生[17-18]。然而,殼聚糖材料的機械強度較差,容易變形,需要交聯劑交聯以增強材料的強度。TPP 是一種物理離子交聯劑,帶負電荷,與帶正電荷的殼聚糖通過物理反應交聯。與化學交聯劑相比,TPP 具有無毒性和良好的生物相容性[19-21]。本研究選用不同濃度的 TPP 物理交聯雙壁微球,旨在了解交聯濃度對雙壁微球性能的影響,以選擇合適的交聯濃度,為后續體內研究奠定良好基礎。
體外緩釋動力學結果表明,與 PLGA 微球相比,經不同 TPP 濃度交聯的殼聚糖-PLGA 雙壁微球的 NGF 緩釋率均明顯降低,以較慢的速度緩釋 NGF。這可能是因為雙壁微球的殼聚糖外殼和交聯劑 TPP 使 NGF 從 PLGA 微球擴散至體外溶液的速度減慢,從而使 NGF 的緩釋率降低。此外,TPP 濃度的增加可顯著降低雙壁微球的突釋量,這可能是由于高濃度的 TPP 可以提高雙壁微球的機械強度,降低雙壁微球在溶液內的膨脹性,從而減慢 NGF 從雙壁微球內部向外部擴散的速度,實現持續可控地緩釋 NGF。體外微球緩釋液中 NGF 的生物活性結果表明,殼聚糖-PLGA 雙壁微球可有效保護 NGF 的生物活性,實現可控性緩釋具有生物活性的 NGF。我們分析包埋 NGF 的殼聚糖-PLGA 雙壁微球促 PC12 細胞具有陽性軸突延長反應的可能原因有以下幾點:首先,雙壁微球作為一種良好的緩釋載體,可有效保護 NGF 的生物活性免受降解或修飾,而失去生物活性;其次,TPP 濃度增加,可減慢 NGF 的緩釋速度,實現長期有效的緩慢釋放;最后,殼聚糖和其降解產物與包埋的 NGF 達到協同促進神經再生的作用。
綜上述,殼聚糖-PLGA 雙壁微球可有效保護 NGF 的生物活性,實現持續可控的緩釋,為下一步將其用于體內研究,或與神經支架聯合修復周圍神經缺損奠定良好的實驗基礎。
作者貢獻:戎夢瑤參與實驗設計、微球制備、統計分析及文章撰寫;昌震參與微球的相關性能檢測和數據收集;歐佳偉、趙松川參與實驗數據的統計分析;曾文參與實驗數據分析、文章修改;劉琦參與實驗設計、實驗數據整理,文章的思路設計及修改。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
周圍神經損傷是臨床常見的神經損傷類型,常導致患者出現感覺和運動功能障礙,嚴重影響患者生活質量。周圍神經損傷后的再生能力有限,主要與神經元的內在生長能力以及再生微環境相關[1-2]。為了修復神經損傷,一個重要的治療策略是在受損局部給予外源性神經營養因子[3-4]。神經營養因子主要包括 NGF、腦源性神經營養因子以及膠質細胞源性神經營養因子等[5-6]。NGF 不僅可以促進感覺神經元的存活,還可以促進神經損傷后的運動恢復[7-8]。然而,NGF 的生物半衰期短,易失去生物活性,不能長期有效地促進神經再生。因此,尋找一種安全有效的藥物緩釋載體至關重要。
近年來,微球類藥物緩釋載體受到學者的廣泛關注。以聚乳酸-聚乙醇酸共聚物[poly(lactide-co-glycolide),PLGA]制備的 PLGA 微球具有良好的生物相容性和低毒性等優點,在生物醫學領域受到廣泛應用[9]。然而,PLGA 微球具有高突釋性能,不利于神經損傷后的再生[10]。為了克服 PLGA 微球的上述缺點,有學者應用高分子生物材料對 PLGA 微球表面進行包埋與修飾。殼聚糖是一種天然多聚物材料,具有良好的生物相容性和生物可降解性,在醫療領域得到廣泛應用[11];有學者報道殼聚糖的降解產物可促進神經元的分化和軸突延長[12]。因此,應用殼聚糖材料包埋 PLGA 微球,具有降低 PLGA 微球高突釋性能的潛力,但目前尚未見相關研究。
本研究制備了一種包埋 NGF 的殼聚糖-PLGA 雙壁微球,該微球具有雙壁結構,殼聚糖為外壁,PLGA 微球為內壁。我們假設這種雙壁微球可顯著降低 PLGA 微球的高突釋率,同時可保護 NGF 的生物活性,促進神經再生。為了驗證這一假設是否成立,我們應用光鏡、掃描電鏡、激光共聚焦顯微鏡、紅外光譜分析、降解率以及緩釋性能等方法檢測雙壁微球的基本性能;此外,通過評估體外大鼠腎上腺嗜鉻細胞瘤(PC12)細胞的生物活性,進一步驗證雙壁微球緩釋的 NGF 是否具有生物活性。
1 材料與方法
1.1 主要試劑及儀器
PC12 細胞(ATCC 公司,美國)。PLGA、殼聚糖、重組大鼠 NGF、三聚磷酸鈉(sodium tripolyphosphate,TPP)、尼羅紅及 FITC 熒光染料(Sigma 公司,美國);NGF-ELISA 試劑盒(Promega 公司,美國);液體石蠟油、石油醚及異丙醇等常用化學試劑(國藥集團化學試劑有限公司)。激光共聚焦顯微鏡(Nikon 公司,日本);S-4800 掃描電鏡(Hitachi 公司,日本);激光粒徑分析儀(Malvern 公司,英國);紅外光譜分析儀(Shimadzu 公司,日本);超聲細胞粉碎儀(Sonics 公司,美國)。
1.2 包埋 NGF 的 PLGA 微球及殼聚糖-PLGA 雙壁微球制備
1.2.1 包埋 NGF 的 PLGA 微球
取 50 μg NGF 和 300 mg 牛血清白蛋白溶解于 50 μL PBS 溶液,200 mg PLGA 溶解于 10 mL 二氯甲烷溶液。將上述兩種溶液混合后,使用超聲細胞粉碎儀超聲分散 3 次(2 mm 探針頭、時間 20 s、40% 功率),得到初乳液;將初乳液加入由 Tween80 和水溶液混合的溶液中,繼續使用超聲細胞粉碎儀超聲分散 3 次(2 mm 探針頭、時間 20 s、40% 功率),得到終乳液;隨后經過磁力攪拌 30 min、過濾、離心(離心半徑 6 cm,10 000 r/min,10 min)、干燥,得到包埋 NGF 的 PLGA 微球。同法制備未包埋 NGF 的 PLGA 微球。
1.2.2 包埋 NGF 的殼聚糖-PLGA 雙壁微球
取 200 mg 殼聚糖與 200 mL 冰醋酸溶液混合溶解;將包埋 NGF 的 PLGA 微球與上述殼聚糖溶液混合均勻后,緩慢加入液體石蠟油中,機械攪拌 1 h;分別將濃度為 1%、3%、10%(W/V)的 TPP 溶液緩慢加入液體石蠟油中,充分交聯微球 1 h;依次使用石油醚、異丙醇反復清洗后,得到包埋 NGF 的殼聚糖-PLGA 雙壁微球,冰凍干燥后備用。同法制備未包埋 NGF 的殼聚糖-PLGA 雙壁微球。
1.3 觀測指標
1.3.1 包埋 NGF 的殼聚糖-PLGA 雙壁微球的基本特點
取 3%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球,用于檢測雙壁微球的基本特點。① 表面形態觀察:取上述雙壁微球分散于水溶液中,光鏡下觀察。另將上述雙壁微球均勻分散于金屬圓柱體上,噴金后真空干燥,掃描電鏡下觀察。② 內部形態觀察:在制備雙壁微球過程中,分別使用 FITC 和尼羅紅染色殼聚糖和 PLGA 進行熒光標記,然后將其分散于水溶液中,激光共聚焦顯微鏡下觀察 PLGA 微球在雙壁微球內的分布情況。③ 微球粒徑分析:將上述雙壁微球均勻分散于水溶液中,采用粒徑分析儀檢測其粒徑分布和粒徑大小。④ 物理-化學特性評價:分別取殼聚糖、PLGA 及未包埋 NGF 的殼聚糖-PLGA 雙壁微球,壓成薄片后,采用紅外光譜分析儀分析其物理-化學特性。
1.3.2 體外微球降解率測定
分別將 10 mg 包埋 NGF 的 PLGA 微球和 1%、3%、10%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球(分別設為 A、B、C、D 組)溶解于 10 mL PBS 溶液(pH7.4)中,充分混合均勻并磁力攪拌(100 r/min)。分別于 0~12 周每周以離心半徑 6 cm、10 000 r/min 離心 5 min,取出微球后真空干燥并稱重。按以下公式計算微球降解率:(W0–W1/W0)×100%,其中 W0 表示微球的初始質量,W1 表示降解后的微球質量。實驗重復 3 次,取均值。
1.3.3 體外微球中 NGF 緩釋檢測
分別將 10 mg 包埋 NGF 的 PLGA 微球和 1%、3%、10%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球(分別設為 A、B、C、D 組)溶解于 5 mL PBS 溶液(pH7.4)中,放置于恒溫搖床上勻速搖動。分別于 0~12 周每周以離心半徑 6 cm、10 000 r/min 離心 10 min,提取上清液,使用 NGF-ELISA 試劑盒測定 NGF 含量。按以下公式計算 NGF 的總緩釋率:R1/R0×100%,其中 R0 表示最初包埋 NGF 總量,R1 表示緩釋液中 NGF 實際含量。
1.3.4 體外微球緩釋液中 NGF 的生物活性評估
取 PC12 細胞以 1×105個/孔密度接種于含 2 mL 細胞培養液(含 5%FBS、10% 馬血清及 1% 青鏈霉素的 RPMI1640 培養液)的 24 孔培養板中培養。取未包埋 NGF 的殼聚糖-PLGA 雙壁微球以及 1%、3%、10%TPP 交聯的包埋 NGF 的殼聚糖-PLGA 雙壁微球(分別設為 A1、B、C、D 組),同 1.3.3 方法,于 7、28、56、84 d 分別從緩釋液中吸取 300 μL 上清液,加入上述 24 孔培養板內,放入 37℃、5%CO2、飽和濕度培養箱內培養 3 d。隨機選擇 24 孔培養板內的 100 個 PC12 細胞計數,當細胞有 1 個或多個突起,且突起長度超過胞體長度則被認為是具有陽性軸突延長反應的 PC12 細胞。按以下公式計算具有陽性軸突延長反應的 PC12 細胞百分比:P1/P0×100%,其中 P0 表示最初隨機選擇的 100 個 PC12 細胞,P1 表示具有陽性軸突延長反應的 PC12 細胞數量。
1.4 統計學方法
采用 PRISM(GraphPad 軟件)統計軟件進行分析。數據以均數±標準差表示,各組間比較采用單因素方差分析,兩兩比較采用 Student t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 包埋 NGF 的殼聚糖-PLGA 雙壁微球的基本特點
① 表面形態觀察:光鏡和掃描電鏡觀察示,雙壁微球呈球形結構,大小不等,分散較好,外表面相對粗糙,有很多小的球形凸起。見圖 1。② 內部形態觀察:激光共聚焦顯微鏡觀察示,雙壁微球的外殼為綠色(FITC 標記的殼聚糖),內核為紅色(尼羅紅標記的 PLGA 微球),PLGA 微球均勻分布于雙壁微球內。見圖 2。通過激光共聚焦顯微鏡結果,可以推出掃描電鏡雙壁微球外表面的凸起為 PLGA 微球,進一步說明該雙壁微球制備成功。③ 微球粒徑分析:雙壁微球的粒徑分布范圍為 18.5~42.7 μm,平均 29.3 μm。見圖 3。④ 物理-化學特性評價:紅外光譜分析結果示,未包埋 NGF 的殼聚糖-PLGA 雙壁微球在 3 432 cm?1處的吸收峰增寬,為殼聚糖基質中的-NH2 基團拉伸振動所致,表明雙壁微球在制備過程中保存了活性基團-NH2。與殼聚糖相比,雙壁微球在 1 640 cm?1處的吸收峰移動至 1 632 cm?1處,說明殼聚糖的氨基與 TPP 中的磷酸基發生了靜電反應。見圖 4。
 圖1
包埋 NGF 的殼聚糖-PLGA 雙壁微球表面形態特點
圖1
包埋 NGF 的殼聚糖-PLGA 雙壁微球表面形態特點
a. 光鏡觀察(×10);b. 掃描電鏡觀察(×50)
Figure1. Surface characteristics of NGF loaded chitosan-PLGA double-walled microspheresa. Light microscopy observation (×10); b. Scanning electron microscopy observation (×50)
 圖2
包埋 NGF 的殼聚糖-PLGA 雙壁微球內部形態(激光共聚焦顯微鏡×50)
圖2
包埋 NGF 的殼聚糖-PLGA 雙壁微球內部形態(激光共聚焦顯微鏡×50)
a. 經 FITC 染色的殼聚糖微球;b. 經尼羅紅染色的 PLGA 微球;c. 經 FITC 和尼羅紅染色的包埋 NGF 的殼聚糖-PLGA 雙壁微球
Figure2. Inner characteristics of NGF loaded chitosan-PLGA double-walled microspheres (Confocal laser scanning microscopy×50)a. FITC-stained chitosan microspheres; b. Nile red-stained PLGA microspheres; c. NGF loaded chitosan-PLGA double-walled microspheres stained by FITC and Nile red
 圖3
包埋 NGF 的殼聚糖-PLGA 雙壁微球粒徑分析
Figure3.
Size distribution of NGF loaded chitosan-PLGA double- walled microspheres
圖3
包埋 NGF 的殼聚糖-PLGA 雙壁微球粒徑分析
Figure3.
Size distribution of NGF loaded chitosan-PLGA double- walled microspheres
 圖4
殼聚糖、PLGA 及未包埋 NGF 的殼聚糖-PLGA 雙壁微 球紅外光譜分析
Figure4.
FT-IR spectra of chitosan, PLGA, and chitosan-PLGA double-walled microspheres
圖4
殼聚糖、PLGA 及未包埋 NGF 的殼聚糖-PLGA 雙壁微 球紅外光譜分析
Figure4.
FT-IR spectra of chitosan, PLGA, and chitosan-PLGA double-walled microspheres
2.2 體外微球降解率測定
A 組:0~4 周微球降解速度逐漸增快,5~12 周降解速度較前減慢,12 周時微球降解率為 38.2%±2.8%。與 A 組相比,B、C、D 組雙壁微球降解速度明顯增快,并隨著 TPP 濃度的增加而逐漸減慢,12 周時 B、C、D 組雙壁微球的降解率分別達 62.3%±1.9%、53.0±2.8% 和 47.7%±2.1%。培養各時間點各組間微球降解率比較差異均有統計學意義(P<0.05)。見圖 5。
 圖5
各組微球的體外降解率比較
Figure5.
In vitro degradation ratio in each microspheres group
圖5
各組微球的體外降解率比較
Figure5.
In vitro degradation ratio in each microspheres group
2.3 體外微球中 NGF 緩釋檢測
A 組 PLGA 微球緩釋 NGF 存在“突釋”現象,第 1 天 NGF 總緩釋率高達 43.6%±1.8%,隨后以相對較慢的速度緩釋 NGF,84 d 時 NGF 的總緩釋率達 81.2%±1.3%。與 A 組 PLGA 微球相比,B、C、D 組雙壁微球以相對較慢的速度緩釋 NGF,除 84 d 外,各時間點 B、C、D 組 NGF 總緩釋率均顯著低于 A 組,差異有統計學意義(P<0.05);B、C、D 組 NGF 的緩釋速度隨 TPP 濃度增加而減慢,除 84 d 外,各時間點 B、C、D 組間比較 NGF 總緩釋率差異均有統計學意義(P<0.05)。見圖 6。
 圖6
各組微球的體外 NGF 緩釋率比較
Figure6.
In vitro NGF sustained release ratio in each microspheres group
圖6
各組微球的體外 NGF 緩釋率比較
Figure6.
In vitro NGF sustained release ratio in each microspheres group
2.4 體外微球緩釋液中 NGF 的生物活性評估
培養各時間點,B、C、D 組緩釋液中具有陽性軸突延長反應的 PC12 細胞百分比均顯著高于 A1 組,差異有統計學意義(P<0.05)。培養 7、28 d,B、C、D 組間比較差異無統計學意義(P>0.05);56、84 d 時,C、D 組緩釋液中具有陽性軸突延長反應的 PC12 細胞百分比顯著高于 B 組,差異有統計學意義(P<0.05),C、D 組間差異無統計學意義(P>0.05)。見圖 7。
 圖7
各組微球緩釋液中具有陽性軸突延長反應的 PC12 細胞 百分比比較
Figure7.
Percentage of PC12 cells with positive axonal elongation reaction in the sustained release solution in each microspheres group
圖7
各組微球緩釋液中具有陽性軸突延長反應的 PC12 細胞 百分比比較
Figure7.
Percentage of PC12 cells with positive axonal elongation reaction in the sustained release solution in each microspheres group
3 討論
周圍神經的再生需要一個良好的再生微環境,其中神經營養因子發揮著至關重要的作用。神經營養因子可提供化學營養支持,激活受損神經元的再生活力,促進神經再生。然而,在神經損傷部位的內在神經營養因子不足,需要提供外源性神經營養支持。本研究結果顯示,殼聚糖-PLGA 雙壁微球可包埋并緩釋具有生物活性的 NGF 達 84 d;此外,交聯劑 TPP 濃度的增加可影響殼聚糖-PLGA 雙壁微球的緩釋性能和 NGF 的生物活性。
近年來,微球類緩釋載體的迅速發展為臨床應用奠定了良好基礎。PLGA 微球是最受關注的一種微球緩釋系統,在生物醫學領域得到了廣泛應用。然而,PLGA 微球具有突釋性,在短時間內快速緩釋包埋的蛋白藥物,過量的蛋白藥物不利于神經再生早期的負反饋調節作用,從而產生抑制神經再生的作用[13-15]。此外,PLGA 微球的酸性降解產物可破壞包埋蛋白藥物的生物活性,降低蛋白藥物的藥學作用[16]。因此,尋找一種對 PLGA 微球改進的方法具有重要的臨床意義。本研究選擇殼聚糖修飾 PLGA 微球主要有以下兩個原因:首先,殼聚糖是一種天然多聚物材料,具有良好的生物降解性和無毒性,廣泛用于生物醫藥領域;其次,有學者報道殼聚糖的降解產物可促進軸突生長,加快神經再生[17-18]。然而,殼聚糖材料的機械強度較差,容易變形,需要交聯劑交聯以增強材料的強度。TPP 是一種物理離子交聯劑,帶負電荷,與帶正電荷的殼聚糖通過物理反應交聯。與化學交聯劑相比,TPP 具有無毒性和良好的生物相容性[19-21]。本研究選用不同濃度的 TPP 物理交聯雙壁微球,旨在了解交聯濃度對雙壁微球性能的影響,以選擇合適的交聯濃度,為后續體內研究奠定良好基礎。
體外緩釋動力學結果表明,與 PLGA 微球相比,經不同 TPP 濃度交聯的殼聚糖-PLGA 雙壁微球的 NGF 緩釋率均明顯降低,以較慢的速度緩釋 NGF。這可能是因為雙壁微球的殼聚糖外殼和交聯劑 TPP 使 NGF 從 PLGA 微球擴散至體外溶液的速度減慢,從而使 NGF 的緩釋率降低。此外,TPP 濃度的增加可顯著降低雙壁微球的突釋量,這可能是由于高濃度的 TPP 可以提高雙壁微球的機械強度,降低雙壁微球在溶液內的膨脹性,從而減慢 NGF 從雙壁微球內部向外部擴散的速度,實現持續可控地緩釋 NGF。體外微球緩釋液中 NGF 的生物活性結果表明,殼聚糖-PLGA 雙壁微球可有效保護 NGF 的生物活性,實現可控性緩釋具有生物活性的 NGF。我們分析包埋 NGF 的殼聚糖-PLGA 雙壁微球促 PC12 細胞具有陽性軸突延長反應的可能原因有以下幾點:首先,雙壁微球作為一種良好的緩釋載體,可有效保護 NGF 的生物活性免受降解或修飾,而失去生物活性;其次,TPP 濃度增加,可減慢 NGF 的緩釋速度,實現長期有效的緩慢釋放;最后,殼聚糖和其降解產物與包埋的 NGF 達到協同促進神經再生的作用。
綜上述,殼聚糖-PLGA 雙壁微球可有效保護 NGF 的生物活性,實現持續可控的緩釋,為下一步將其用于體內研究,或與神經支架聯合修復周圍神經缺損奠定良好的實驗基礎。
作者貢獻:戎夢瑤參與實驗設計、微球制備、統計分析及文章撰寫;昌震參與微球的相關性能檢測和數據收集;歐佳偉、趙松川參與實驗數據的統計分析;曾文參與實驗數據分析、文章修改;劉琦參與實驗設計、實驗數據整理,文章的思路設計及修改。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。