引用本文: 王文朝, 王善璽, 張正東, 李軍, 謝偉, 蘇延林, 陳佳男, 劉雷. 創傷性脊髓損傷后環狀非編碼 RNA-微小 RNA 潛在調控網絡信息挖掘. 中國修復重建外科雜志, 2020, 34(2): 213-219. doi: 10.7507/1002-1892.201905079 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
創傷性脊髓損傷(traumatic spinal cord injury,TSCI)是一類具有高致死、高致殘特征的中樞神經損傷,常導致神經組織缺失和死亡,引起感覺和運動功能障礙[1-2]。目前對 TSCI 機制了解十分有限,尚無有效治療手段[3]。為了發掘軸突再生和功能恢復的新治療策略,需要對 TSCI 后細胞和分子病理生理機制進一步研究。
非編碼 RNA 是一類在諸多病理生理進程中調控遺傳編程、表觀遺傳和轉錄翻譯的關鍵因子[4],其中環狀非編碼 RNA(circular RNA,circRNA)-微小 RNA(microRNA,miRNA)調控軸已被證明在神經系統生長、成熟和退變等進程中發揮重要調控作用[5]。但是 circRNA-miRNA 調控軸在 TSCI 中的作用尚缺乏系統研究,為此我們使用 miRNA 與 circRNA 的高通量測序,篩選 miRNA 與 circRNA 差異表達譜,預測并構建 TSCI 后發揮潛在調控作用的 circRNA-miRNA 調控軸,為臨床診斷和治療 TSCI 奠定理論基礎。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
清潔級健康雄性 8 周齡 C57BL/6 小鼠 48 只,體質量 18~22 g,購于山東大學動物中心。戊巴比妥鈉(國藥集團化學試劑有限公司);HE 染色試劑盒(廣州凱秀貿易有限公司);Trizol 裂解液(Takara 公司,日本); Ribo-Zero 試劑盒、TruSeq Small RNA Sample Prep 試劑盒(Illumina 公司,美國)。
NanoDrop 微量分光光度計(Thermo Fisher 公司,美國);Agilent 2100 生物分析儀、Hiseq2000/2500 測序系統、HiSeq4000 測序系統(Agilent 公司,美國);ACGT101-miR 系統(LC Sciences 公司,美國)。標準 Allen’s 打擊器械由濟南市骨生物力學與骨代謝實驗室提供。
1.2 動物模型制備
將 48 只小鼠隨機分為 TSCI 組及假手術組(Sham 組),每組 24 只。兩組小鼠腹腔注射戊巴比妥鈉(30 mg /kg)麻醉后,背部逐層切開,暴露及定位 T8~10 節段,去除椎板暴露脊髓。TSCI 組采用標準 Allen’s 打擊器械以 6 g 重物于 6 cm 高度自由落下,對已暴露脊髓進行打擊[6],逐層縫合切口。Sham 組暴露脊髓后不作任何處理,直接縫合切口。
1.3 組織學觀察
術后 3 d 兩組各取 3 只小鼠脊髓損傷中心組織行 HE 染色觀察。小鼠同上法麻醉后,切開心包自左心室插入導管至主動脈,持續灌注生理鹽水,剪開右心耳待流出清亮液體后更換為 4% 多聚甲醛灌注至小鼠變硬。剝離損傷中心區域脊髓組織,置于 4% 多聚甲醛中過夜,脫水,石蠟包埋后切片,片厚 5 μm。常規 HE 染色后,光鏡下觀察脊髓損傷前后病理改變。
1.4 測序文庫構建與測序實驗
1.4.1 總 RNA 提取及檢測
術后 3 d,兩組剩余小鼠提取總 RNA。同上法麻醉后,按照原切口入路,剝離損傷中心區域脊髓組織,冰上研磨加入 Trizol 裂解后,加入氯仿,震蕩混勻;取中層,加入異丙醇,4℃,以 12 000×g 離心 15 min,棄上清;加入乙醇,4℃,以 7 500×g 離心 5 min,干燥沉淀;加無 RNA 酶水溶解。使用分光光度計檢測總 RNA 的純度,根據吸光度(A)260/280 比值評估其無污染及降解,且經生物分析儀檢測 RNA 完整度后構建測序文庫。
1.4.2 miRNA 建庫及測序
所有測序均按照美國 Illumina 公司提供的標準步驟執行。使用 T4 RNA 連接酶 2 將 1 個腺苷化單鏈 DNA 3’ 接頭和 5’ 接頭相繼連接到小 RNA 上,帶有 5’ 與 3’ 接頭的小 RNA 序列通過與 3’ 端互補的 RT 引物進行反轉錄反應,對反轉錄產生的 cDNA 序列進行 PCR 擴增。最后,對 140~160 bp 長度范圍的 PCR 產物進行 6% polyacrylamideTris-borate-EDTA 膠回收,完成建庫。設定測序讀長參數為單端 1×50 bp,對文庫進行測序。
1.4.3 circRNA 建庫及測序
去除總 RNA 核糖體 RNA,純化回收剩余 RNA,用片段化試劑隨機打斷成短片段,以片段化 circRNA 為模板,用六堿基隨機引物合成第 1 鏈 cDNA,進一步與脫氧核苷酸、核糖核酸酶和脫氧核糖核酸聚合酶進行第 2 鏈 cDNA 合成。使用核酸純化磁珠純化雙鏈產物,利用 T4 DNA 聚合酶和 Klenow DNA 聚合酶活性將 DNA 的黏性末端修復為平末端,3’ 端加堿基腺嘌呤(A)并加接頭,核酸純化磁珠進行片段選擇,之后用尿嘧啶-特異性切除試劑酶降解含有尿嘧啶(U)的 cDNA 第 2 鏈,最后進行 PCR 擴增即建立測序文庫。設定測序讀長參數為雙端 2×150 bp,對文庫進行測序。
1.5 表達譜數據分析及差異表達數據整理
1.5.1 miRNA 的表達鑒定與差異分析
將非典型 miRNA 序列以及 N 特征序列清理后,篩選長度為 18~26 nt 的序列,剩余序列與 mRNA、RFam 和重復序列數據庫中信息對比鑒定。篩選出的序列與 miRBase21.0 數據庫中對比,鑒定為已知 miRNA 并進行 RNA 二級結構預測,最后對 TSCI 組和 Sham 組樣本 miRNA 進行差異統計。通過 miRNA 檢出率統計 TSCI 組和 Sham 組 miRNA 表達的重合情況,利用獨立樣本 t 檢驗進行差異顯著性分析。為篩選具有高研究潛能的差異表達 miRNA,設定以下條件:排除組織中低表達的 miRNA,以 log2 差異倍數降序排列,其中表達倍數≥2 的 miRNA 設定為顯著差異表達。
1.5.2 circRNA 的表達鑒定與差異分析
RNA 成環分為外顯子環化和內含子環化,均有反向剪切位點,由反向剪切位點鑒定序列來自 circRNA 的可能,進一步使用 CIRCExplorer 對 circRNA 序列本身進行預測,并用 Tophat 比對結果。進一步通過 circRNA 位置關系分類進行注釋,統計樣本基因表達值分布,比較不同樣本間表達趨勢,確認樣本的生物學重復情況,最后對不同樣本組織之間的 circRNA 進行差異統計。通過韋恩圖分析 TSCI 組和 Sham 組 circRNA 表達的重合情況,進一步排除組織中低表達的 circRNA,利用獨立樣本 t 檢驗進行差異顯著性分析,選擇表達倍數≥1、P<0.05,并以差異表達倍數降序排列。
1.6 差異表達 circRNA 的功能預測分析
基因本體分析(gene ontology,GO)結果柱狀圖反映在生物過程、細胞組分和分子功能方面,富集的 GO 詞條上差異基因的數量分布情況,通過 GO 功能顯著性富集分析能確定差異表達基因行使的主要生物學功能。將差異表達 circRNA 的宿主基因導入 GO 分析。
circRNA 宿主基因的 GO 分析基本單位是詞條,每個詞條都對應 1 個屬性。GO 分析首先把所有顯著性差異表達基因向 GeneOntology 數據庫的各詞條映射,計算每個詞條的基因數目,應用超幾何檢驗后與整個基因組背景相比,并以 P≤0.05 為閾值篩選在顯著性差異表達基因中顯著富集的 GO 條目,進而預測差異表達基因行使的主要生物學功能。
1.7 miRNA-circRNA 靶向互作預測分析
分別使用 TargetScan、miRanda 軟件預測 miRNA 的靶基因,從而預測 miRNA-circRNA 的靶向互作。TargetScan 軟件通過種子區中種子匹配的方式預測序列完全互補信息;miRanda 軟件以堿基互補(A=U、G=C)構建打分矩陣預測靶點信息。TargetScan 分析設定閾值為≥50,miRanda 分析設定閾值為 Max_Energy<?10;兩種算法結果取交集,即為靶向互作預測分析的最終結果。進一步使用 Cytoscape 軟件繪制 miRNA-circRNA 互作圖,直觀闡明預測的互作網絡信息。
2 結果
2.1 組織學觀察
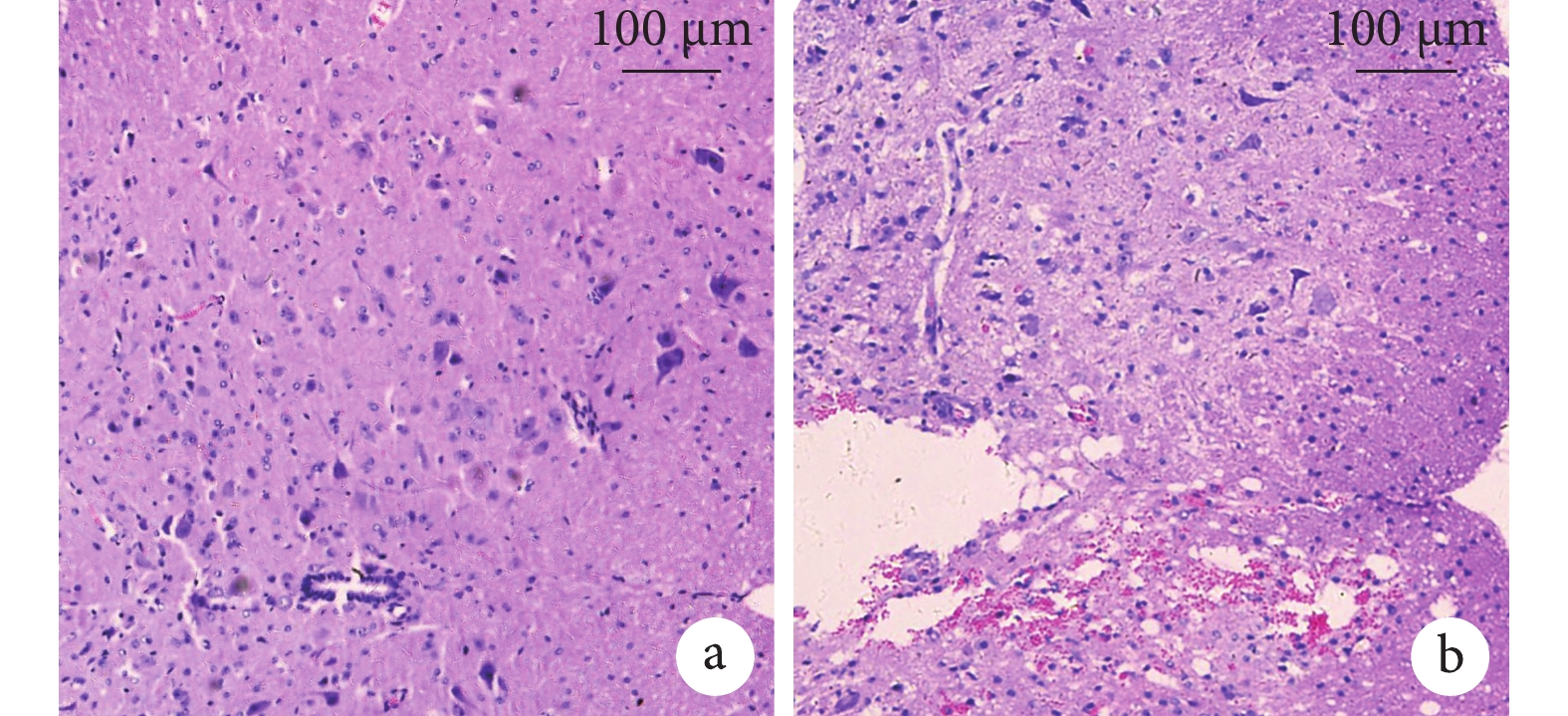
Sham 組小鼠脊髓結構清晰,脊膜完整無破裂,中央管居中,無出血,未見損傷痕跡(圖 1a)。TSCI 組小鼠脊髓有明顯損傷破裂,脊膜缺損,中央管破裂或偏于一側,可見血管破裂引起的紅細胞廣泛彌散和炎性細胞浸潤(圖 1b)。
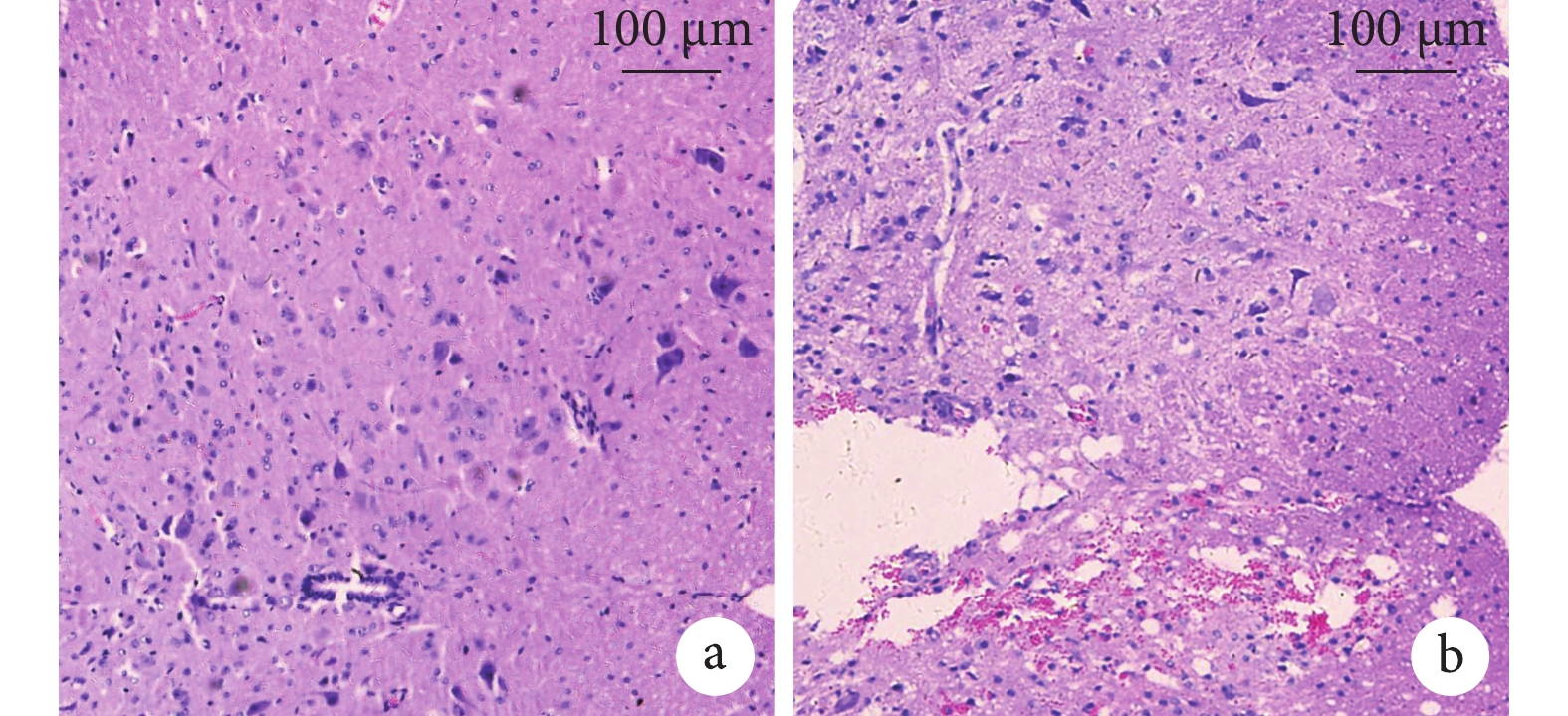 圖1
兩組小鼠脊髓組織 HE 染色觀察(×100)
圖1
兩組小鼠脊髓組織 HE 染色觀察(×100)
a. TSCI 組;b. Sham 組
Figure1. HE staining of spinal cord tissue in two groups (×100)a. TSCI group; b. Sham group2.2 miRNA/circRNA 表達譜及差異表達分析
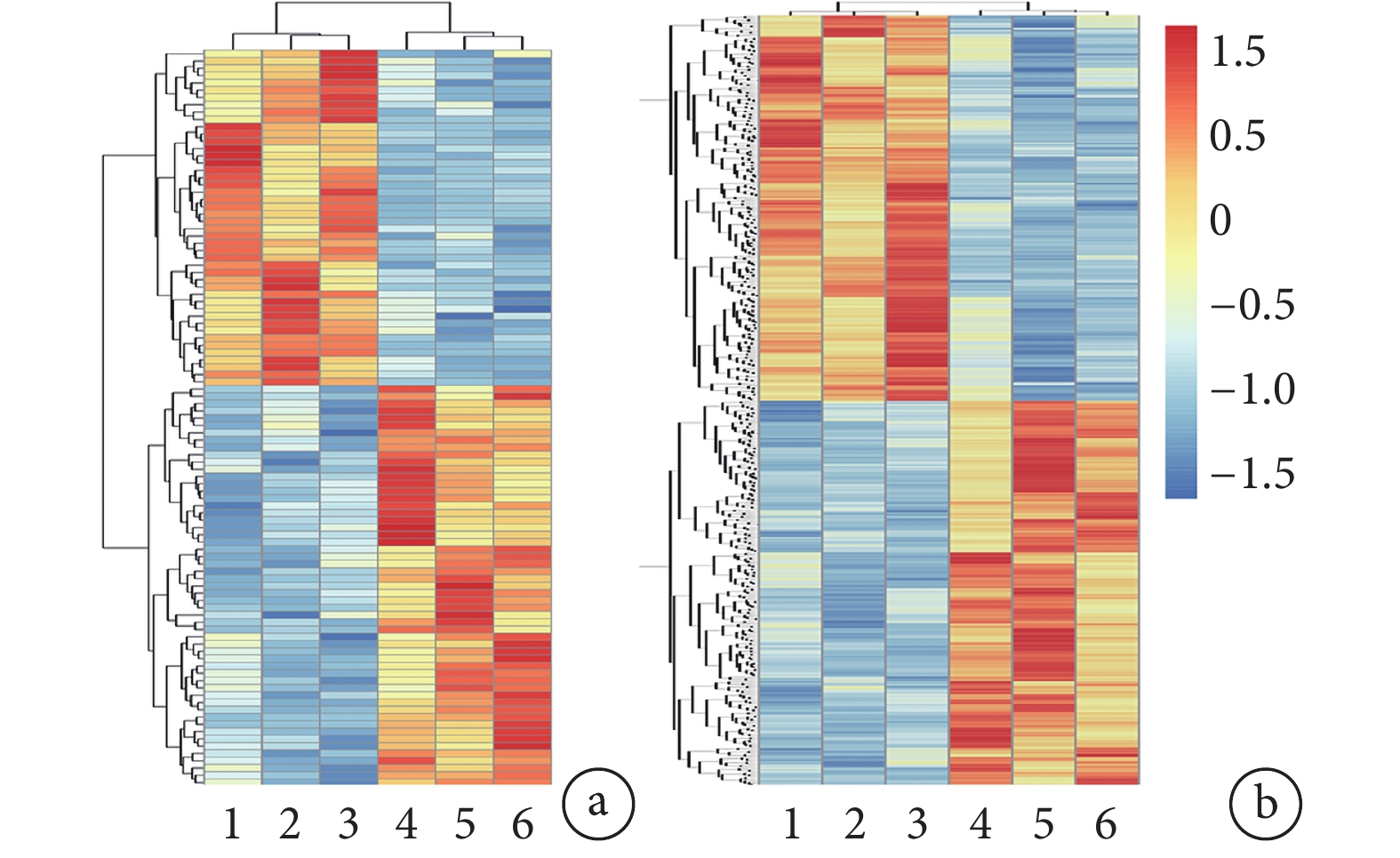
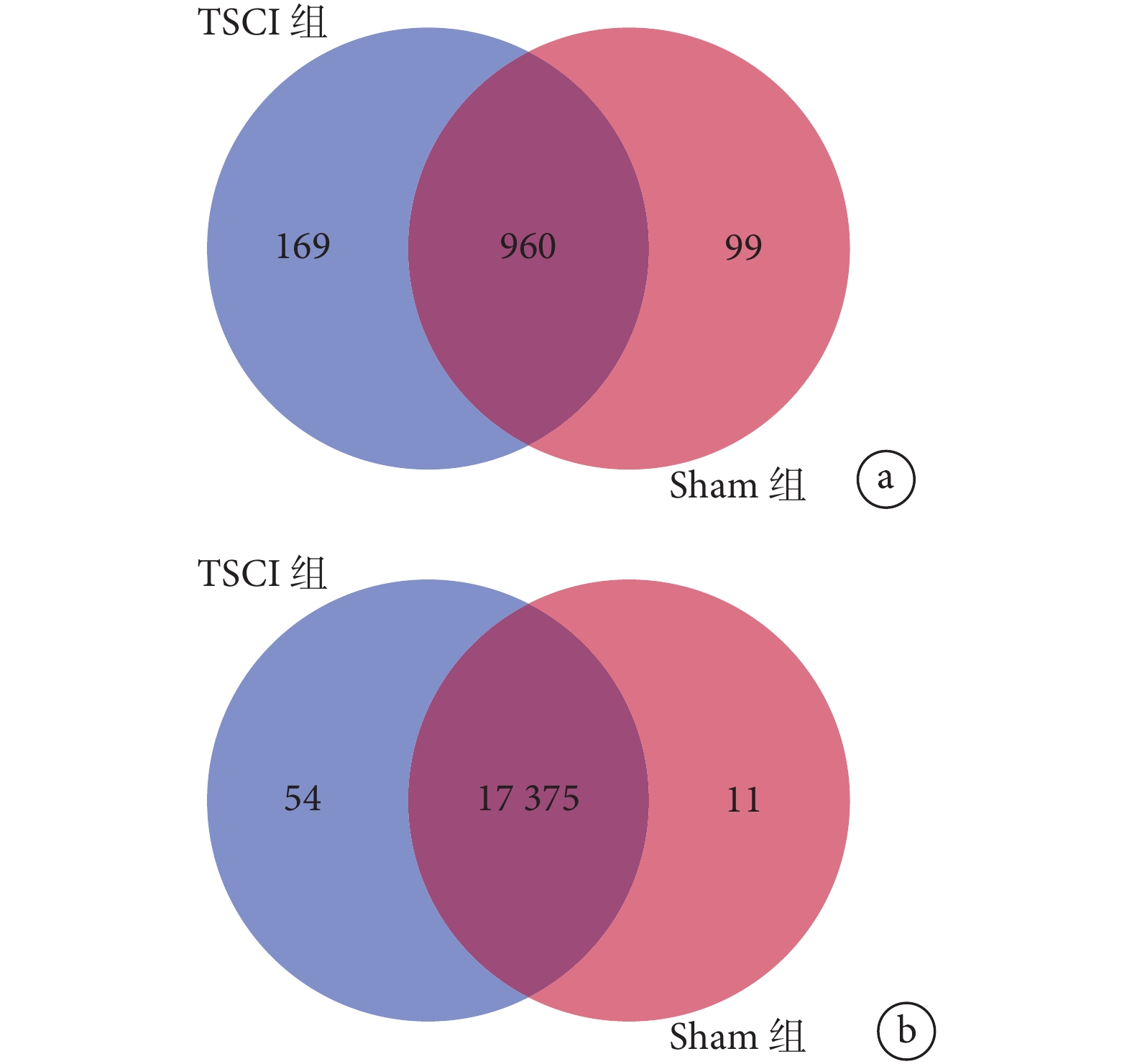
聚類圖系統顯示與 Sham 組相比 TSCI 組中各 miRNA 和 circRNA 變化情況(圖 2),韋恩圖可以直觀顯示 TSCI 組與 Sham 組共同重疊和特征表達的 miRNA/circRNA(圖 3)。
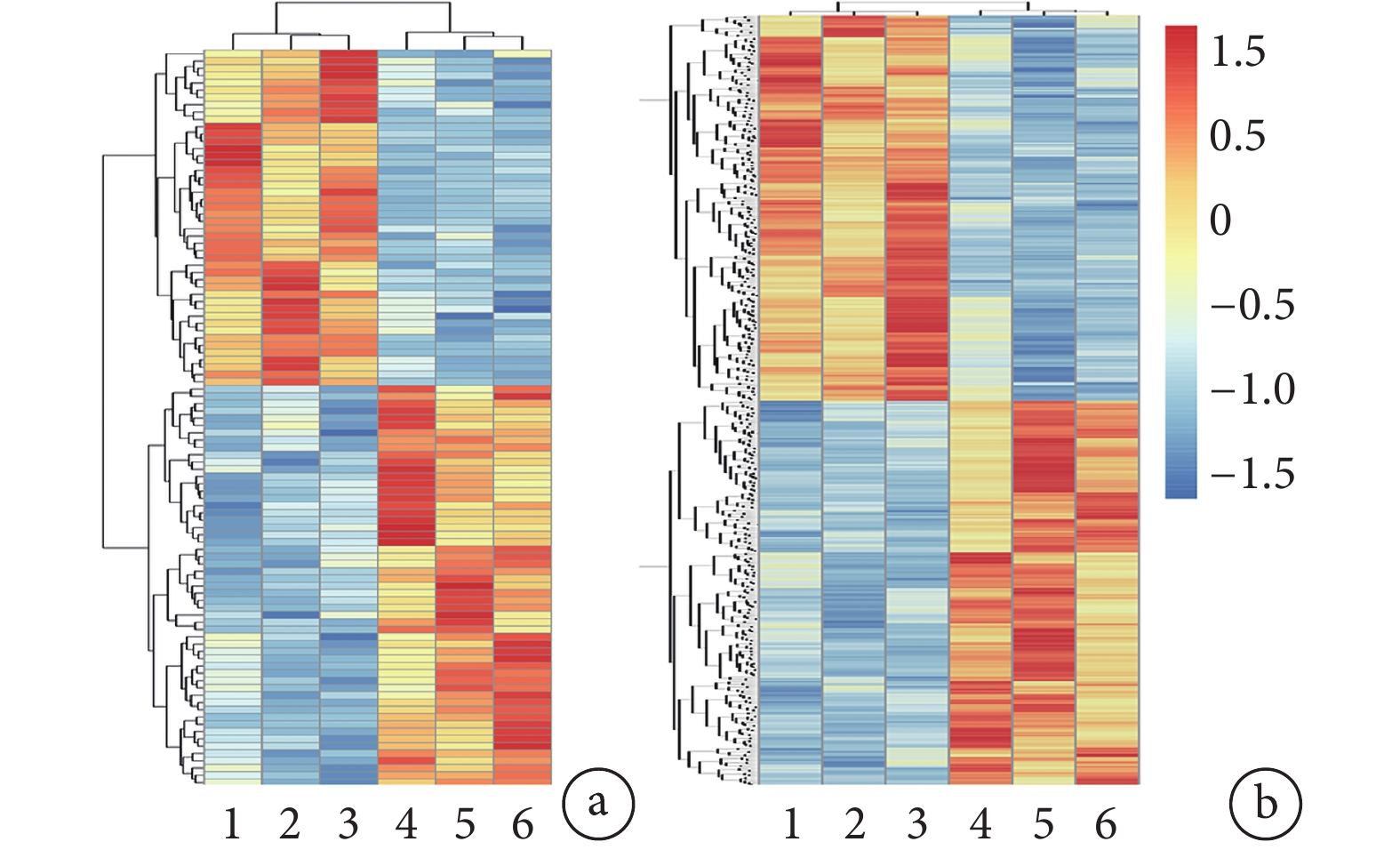 圖2
TSCI 組與 Sham 組差異表達 miRNA 與 circRNA 聚類分析
圖2
TSCI 組與 Sham 組差異表達 miRNA 與 circRNA 聚類分析
1~3: TSCI 組,4~6: Sham 組 a. miRNA;b. circRNA
Figure2. Cluster analysis of differentially expressed miRNA and circRNA in TSCI group and sham group1-3: TSCI group, 4-6: Sham group a. miRNA; b. circRNA
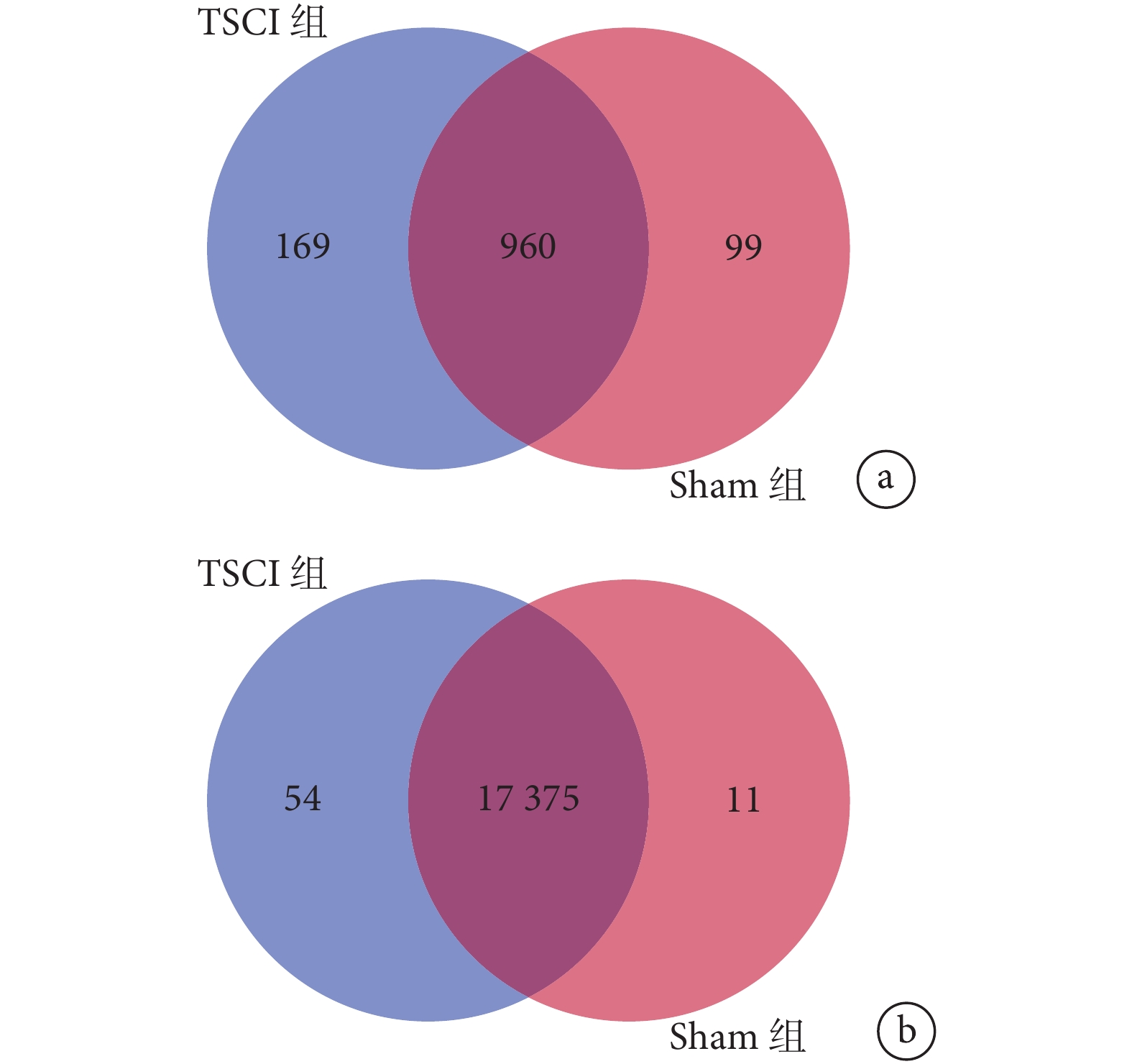 圖3
TSCI 組與 Sham 組表達 miRNA 與 circRNA 韋恩圖
圖3
TSCI 組與 Sham 組表達 miRNA 與 circRNA 韋恩圖
a. miRNA;b. circRNA
Figure3. Venn diagram of differentially expressed miRNA and circRNA in TSCI group and sham groupa. miRNA; b. circRNA
本研究共鑒定出 1 228 個 miRNA,其中 TSCI 組特征表達 169 個,Sham 組特征表達 99 個,兩組重合表達 960 個。進一步以 log2 差異倍數降序排列,前 10 位 miRNA 依次為 mmu-miR-21a-3p、mmu-miR-92a-1-5p、mmu-miR-18a-3p、mmu-miR-21a-5p、mmu-miR-27a-5p、mmu-miR-7688-5p、mmu-miR-351-3p、mmu-miR-1964-3p、mmu-miR-5121_L-1、mmu-miR-7689-3p,其中前 6 位 miRNA 滿足表達倍數≥2 的顯著差異表達要求。見表 1。
本研究共鑒定出 17 440 個 circRNA,其中 TSCI 組特征表達 54 個,Sham 組特征表達 11 個,兩組重合表達 17 375 個。進一步以 log2 差異表達倍數降序排列,前 10 位 circRNA 依次為 circRNA271、circRNA802、circRNA4206、circRNA4119、circRNA1374、circRNA4700、circRNA10712、circRNA7452、circRNA5004、circRNA172。見表 2。
2.3 差異表達 circRNA 的功能預測分析
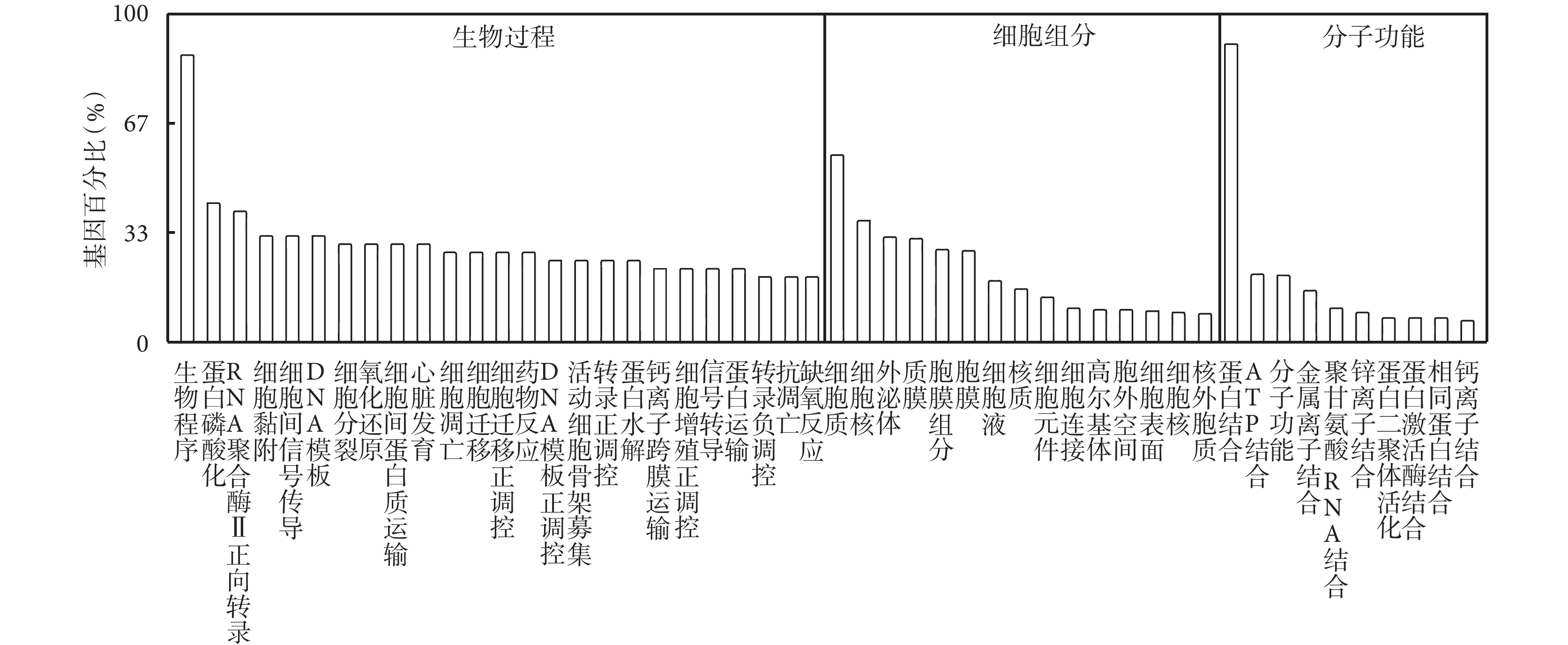
將差異表達 circRNA 的宿主基因導入 GO 分析,在細胞組分中差異基因主要富集在細胞質、細胞核、外泌體以及質膜中,在生物過程中差異基因主要富集在轉錄的正調控和蛋白磷酸化過程,在分子功能中差異基因主要富集在蛋白結合、三磷酸腺苷結合以及金屬離子結合。見圖 4。
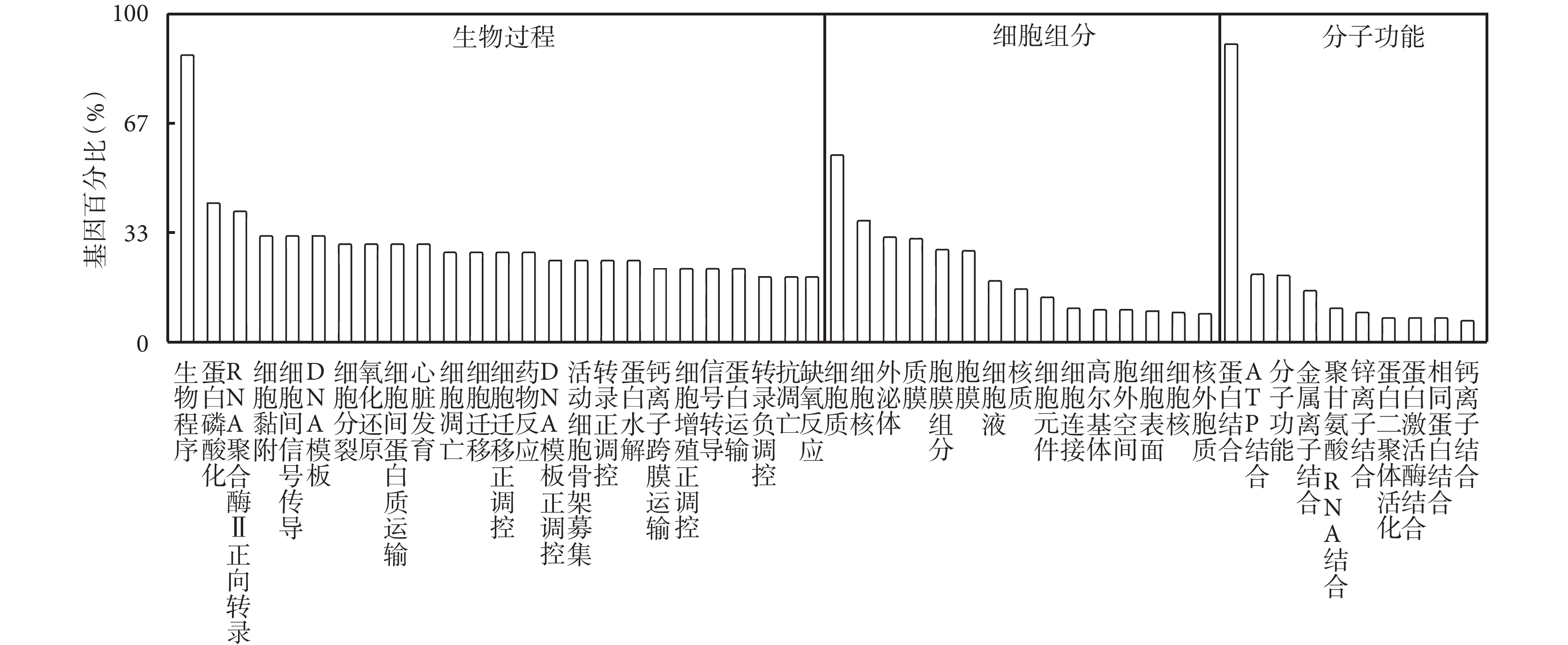 圖4
差異表達 circRNA 的 GO 分析
Figure4.
GO analysis of differentially expressed circRNA
圖4
差異表達 circRNA 的 GO 分析
Figure4.
GO analysis of differentially expressed circRNA
2.4 miRNA-circRNA 靶向互作預測分析
TSCI 后 mmu-miR-21a-5p 表達顯著上調,滿足表達倍數≥2 的顯著差異表達要求。結合前期研究結果[6-8],確定 mmu-miR-21a-5p 為 TSCI 后諸多病理生理過程的關鍵調控節點,進一步篩選可與其靶向結合的差異表達 circRNA。
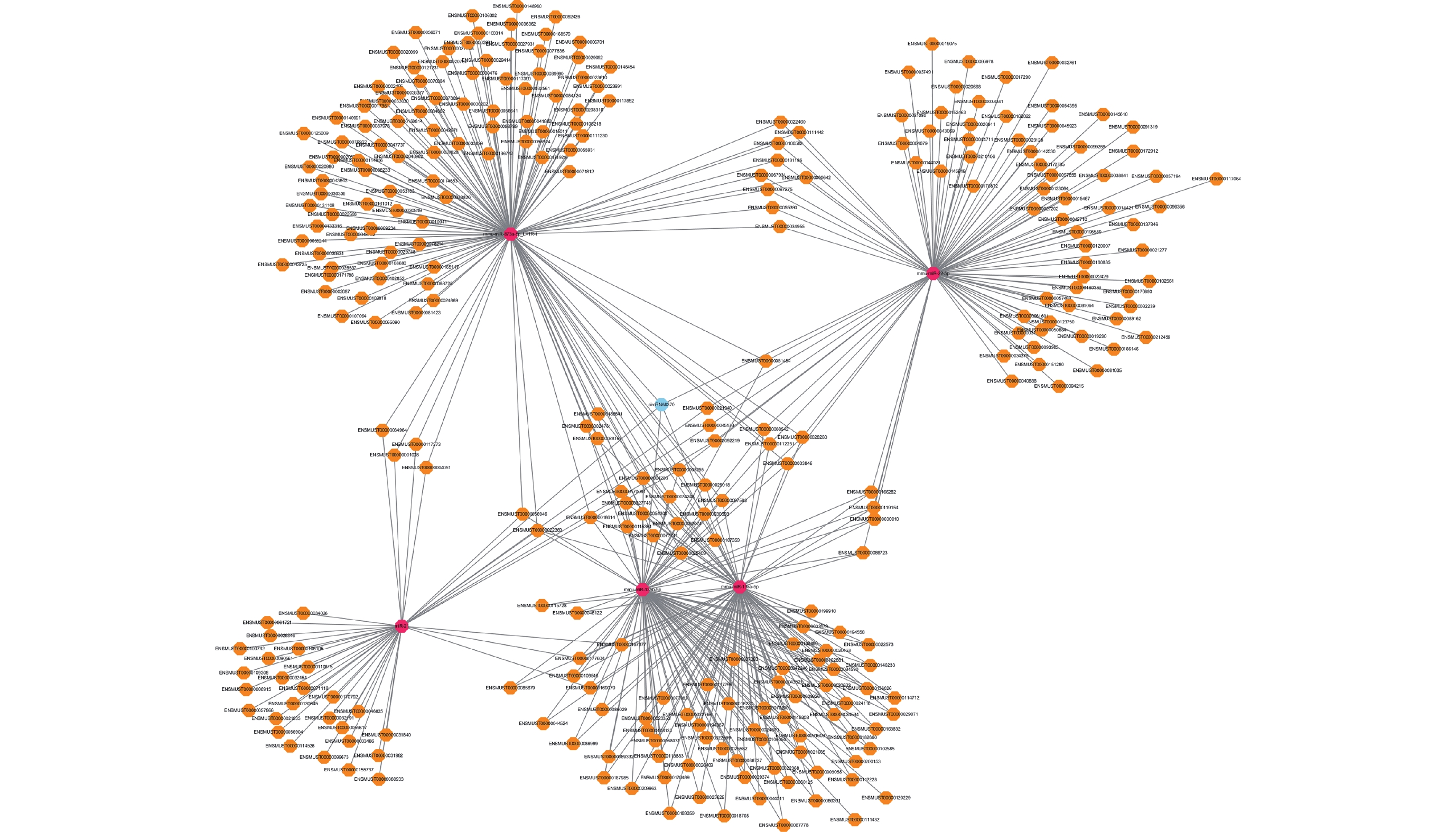
本研究共篩選出 8 個可能與 mmu-miR-21a-5p 靶向結合的差異表達 circRNA,即 circRNA6370、circRNA11033、circRNA222、circRNA6371、ciRNA295、circRNA13622、circRNA9429、circRNA3618(表 3)。綜合分析反剪切位點、TargetScan 以及 miRanda 評分,篩選出 circRNA6370 為潛在的與 mmu-miR-21a-5p 互作影響 TSCI 后病理生理進程的關鍵 circRNA。反向篩選可與 circRNA6370 靶向結合的差異表達 miRNA 分別為 mmu-miR-21a-5p、mmu-miR-873a-5p、mmu-miR-22-5p、mmu-miR-135a-5p 和 mmu-miR-135b-5p,并以 circRNA6370 為核心構建了 TSCI 后差異表達 circRNA- miRNA 互作網絡(圖 5)。
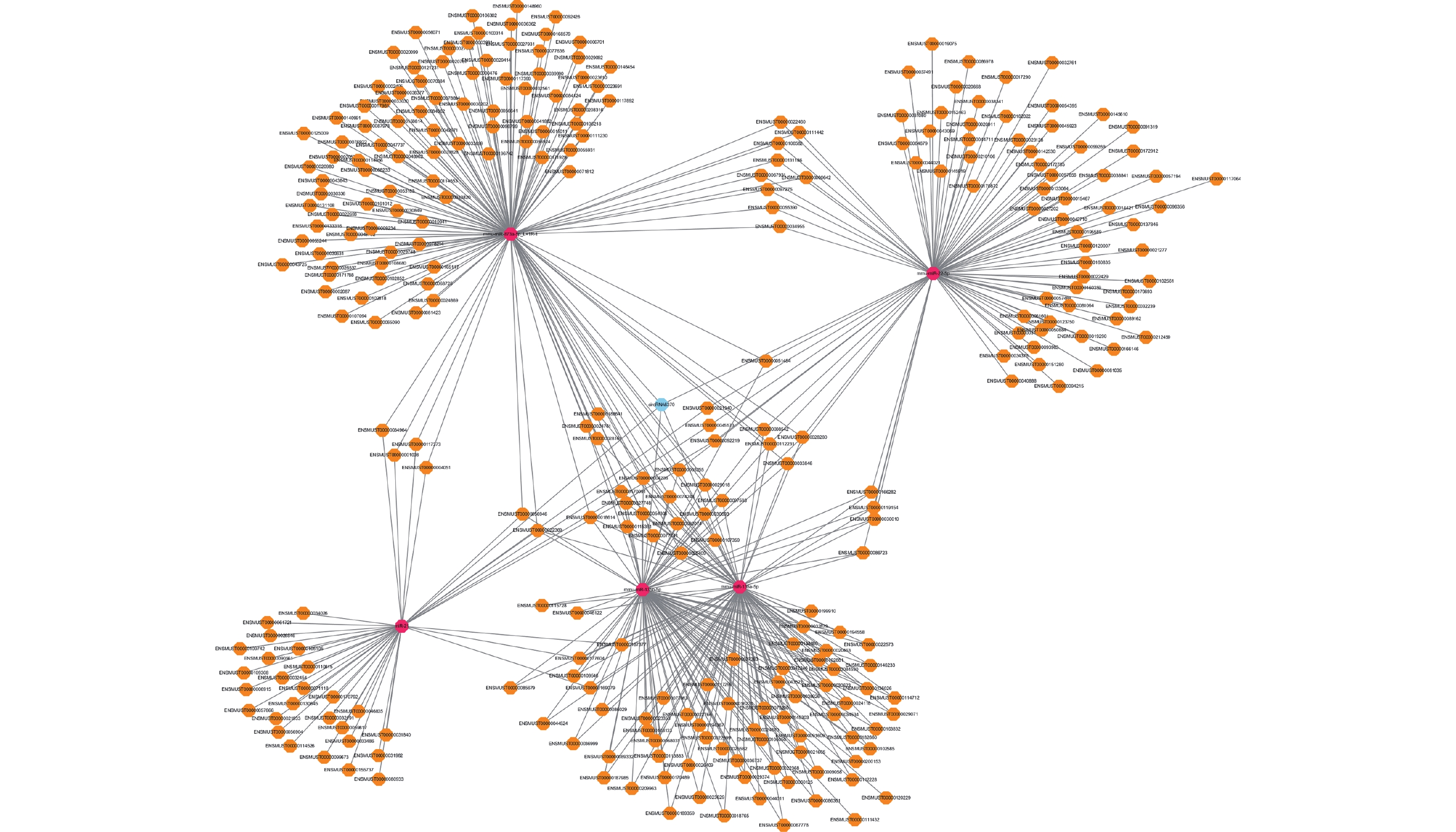 圖5
差異表達 circRNA-miRNA-mRNA 靶向互作圖
圖5
差異表達 circRNA-miRNA-mRNA 靶向互作圖
藍色:circRNA 紅色:miRNA 黃色:mRNA
Figure5. Differentially expressed circRNA-miRNA-mRNA networksBlue: circRNA; Red: miRNA; Yellow: mRNA
3 討論
TSCI 主要由交通事故和高處墜落造成,也可由血管病變、腫瘤和醫源性損傷造成,常導致患者癱瘓、無意識運動、大小便失禁和抑郁等[9]。創傷會導致神經細胞凋亡,破壞神經連接,從而使得上、下行傳導的神經興奮中斷[10]。TSCI 包括急性期、亞急性期和慢性期,許多分子共同參與損傷后的修復過程。目前有越來越多的證據表明非編碼 RNA 在脊髓損傷進展中起重要作用[5, 11]。70% 以上的人類基因被轉錄,但是只有不到 2% 的基因被翻譯成蛋白質,其余大部分的基因被轉錄成非編碼 RNA[12]。非編碼 RNA 按照內在功能可分為兩大類,一類是管家非編碼 RNA,包括核內小 RNA、核糖體 RNA 和搬運 RNA 等;另一類是調控性非編碼 RNA,包括 miRNA、circRNA 和長非編碼 RNA 等[13]。目前,調控性非編碼 RNA 中,對 miRNA 的研究開展最早且最全面。miRNA 廣泛存在于各種組織和體液中[14-15],尤其在神經系統中 miRNA 可作為調控因子,甚至類激素樣因子,通過自分泌或者旁分泌途徑影響靶細胞之間的交流和信息傳遞,從而調控神經退行性變和再生進程[5]。circRNA 是一類剛進入研究者視野的非編碼 RNA,不同于其他非編碼 RNA 的線性結構,circRNA 呈現出首尾相連的特殊環狀結構,由于沒有 5’ 端和 3’ 端,circRNA 對核酸酶不敏感,故比線性 RNA 更穩定。circRNA 從果蠅到人的各類生物組織中均有表達,在人體中 circRNA 源于 14.4% 的表達基因,約占人類總 RNA 的 1%[16]。circRNA 的表達存在時間、空間和組織特異性,大部分與對應的線性轉錄本相比表達偏低,但在一定情況下可以遠高于其對應的線性轉錄本,尤其在中樞神經系統中,circRNA 大量表達,參與神經的發育、退變、遞質釋放和軸突生長等過程[17-18]。目前認為 circRNA 最重要的作用是作為 miRNA 的吸附海綿來發揮轉錄后的調控功能,且已證實 Cyrano–Cdr1as-miR-7 這一 lncRNA-circRNA-miRNA 多 RNA 互作軸可調控退變相關的神經活動[5, 19-20]。
本研究分別對 TSCI 后差異表達的 circRNA 和 miRNA 進行高通量測序,分別獲得損傷急性期差異表達譜,并進行了相關宿主基因功能注釋的分析。mmu-miR-21a-5p 為損傷后大量表達且上調最明顯的 miRNA,測序中的差異表達趨勢與前期研究中 PCR 結果一致[6-7]。前期研究結果表明脊髓損傷后上調的 mmu-miR-21-5p,不僅能通過 PI3K-Akt-mTOR 通路調控星形膠質細胞的活化,也能通過 TGF-β-Smad 通路調控血管和脊膜成纖維細胞的活化[6-7]。而脊髓星形膠質細胞和成纖維細胞是形成瘢痕阻隔影響軸突再生的關鍵[21-22]。因此結合前期研究基礎,本研究中為篩選可與 mmu-miR-21-5p 靶向結合的差異表達 circRNA,默認設置的 circRNA 差異表達閾值是 log2 差異倍數≥1 且P≤ 0.05,進一步通過 TargetScan 和 miRanda 軟件預測 circRNA-miRNA 之間的靶向關系,TargetScan 設定閾值是≥50,該值越大結合率越高,miRanda 設置閾值 Max_Energy<?10,該值越小結合率越高。進而在所有能與 miR-21-5p 靶向結合的差異表達 circRNA 中,篩選出成環指數最高、結合率最高的 circRNA6370 進行軸向預測。根據 circRNA 與 miRNA 結合一對多的特征[19-20],構建了以 circRNA6370 為核心的 circRNA-miRNA 靶向互作網絡。
在后續研究中,我們將從體外、體內方向共同驗證和完善本研究預測的 TSCI 后 circRNA-miRNA 靶向結合網絡,進一步探索其功能及通路,旨在探究 TSCI 后非編碼 RNA 調控網絡的病理生理作用及機制,尤其在急性期炎癥相關病理生理功能發掘與驗證。
作者貢獻:王文朝承擔實驗設計及文章撰寫,王善璽、張正東和李軍參與數據收集,謝偉、蘇延林和陳佳男參與動物實驗及統計分析,劉雷指導研究并對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經山東大學醫學/動物實驗倫理委員會批準,實驗動物使用許可證號:SYXK(魯)20150015。
創傷性脊髓損傷(traumatic spinal cord injury,TSCI)是一類具有高致死、高致殘特征的中樞神經損傷,常導致神經組織缺失和死亡,引起感覺和運動功能障礙[1-2]。目前對 TSCI 機制了解十分有限,尚無有效治療手段[3]。為了發掘軸突再生和功能恢復的新治療策略,需要對 TSCI 后細胞和分子病理生理機制進一步研究。
非編碼 RNA 是一類在諸多病理生理進程中調控遺傳編程、表觀遺傳和轉錄翻譯的關鍵因子[4],其中環狀非編碼 RNA(circular RNA,circRNA)-微小 RNA(microRNA,miRNA)調控軸已被證明在神經系統生長、成熟和退變等進程中發揮重要調控作用[5]。但是 circRNA-miRNA 調控軸在 TSCI 中的作用尚缺乏系統研究,為此我們使用 miRNA 與 circRNA 的高通量測序,篩選 miRNA 與 circRNA 差異表達譜,預測并構建 TSCI 后發揮潛在調控作用的 circRNA-miRNA 調控軸,為臨床診斷和治療 TSCI 奠定理論基礎。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
清潔級健康雄性 8 周齡 C57BL/6 小鼠 48 只,體質量 18~22 g,購于山東大學動物中心。戊巴比妥鈉(國藥集團化學試劑有限公司);HE 染色試劑盒(廣州凱秀貿易有限公司);Trizol 裂解液(Takara 公司,日本); Ribo-Zero 試劑盒、TruSeq Small RNA Sample Prep 試劑盒(Illumina 公司,美國)。
NanoDrop 微量分光光度計(Thermo Fisher 公司,美國);Agilent 2100 生物分析儀、Hiseq2000/2500 測序系統、HiSeq4000 測序系統(Agilent 公司,美國);ACGT101-miR 系統(LC Sciences 公司,美國)。標準 Allen’s 打擊器械由濟南市骨生物力學與骨代謝實驗室提供。
1.2 動物模型制備
將 48 只小鼠隨機分為 TSCI 組及假手術組(Sham 組),每組 24 只。兩組小鼠腹腔注射戊巴比妥鈉(30 mg /kg)麻醉后,背部逐層切開,暴露及定位 T8~10 節段,去除椎板暴露脊髓。TSCI 組采用標準 Allen’s 打擊器械以 6 g 重物于 6 cm 高度自由落下,對已暴露脊髓進行打擊[6],逐層縫合切口。Sham 組暴露脊髓后不作任何處理,直接縫合切口。
1.3 組織學觀察
術后 3 d 兩組各取 3 只小鼠脊髓損傷中心組織行 HE 染色觀察。小鼠同上法麻醉后,切開心包自左心室插入導管至主動脈,持續灌注生理鹽水,剪開右心耳待流出清亮液體后更換為 4% 多聚甲醛灌注至小鼠變硬。剝離損傷中心區域脊髓組織,置于 4% 多聚甲醛中過夜,脫水,石蠟包埋后切片,片厚 5 μm。常規 HE 染色后,光鏡下觀察脊髓損傷前后病理改變。
1.4 測序文庫構建與測序實驗
1.4.1 總 RNA 提取及檢測
術后 3 d,兩組剩余小鼠提取總 RNA。同上法麻醉后,按照原切口入路,剝離損傷中心區域脊髓組織,冰上研磨加入 Trizol 裂解后,加入氯仿,震蕩混勻;取中層,加入異丙醇,4℃,以 12 000×g 離心 15 min,棄上清;加入乙醇,4℃,以 7 500×g 離心 5 min,干燥沉淀;加無 RNA 酶水溶解。使用分光光度計檢測總 RNA 的純度,根據吸光度(A)260/280 比值評估其無污染及降解,且經生物分析儀檢測 RNA 完整度后構建測序文庫。
1.4.2 miRNA 建庫及測序
所有測序均按照美國 Illumina 公司提供的標準步驟執行。使用 T4 RNA 連接酶 2 將 1 個腺苷化單鏈 DNA 3’ 接頭和 5’ 接頭相繼連接到小 RNA 上,帶有 5’ 與 3’ 接頭的小 RNA 序列通過與 3’ 端互補的 RT 引物進行反轉錄反應,對反轉錄產生的 cDNA 序列進行 PCR 擴增。最后,對 140~160 bp 長度范圍的 PCR 產物進行 6% polyacrylamideTris-borate-EDTA 膠回收,完成建庫。設定測序讀長參數為單端 1×50 bp,對文庫進行測序。
1.4.3 circRNA 建庫及測序
去除總 RNA 核糖體 RNA,純化回收剩余 RNA,用片段化試劑隨機打斷成短片段,以片段化 circRNA 為模板,用六堿基隨機引物合成第 1 鏈 cDNA,進一步與脫氧核苷酸、核糖核酸酶和脫氧核糖核酸聚合酶進行第 2 鏈 cDNA 合成。使用核酸純化磁珠純化雙鏈產物,利用 T4 DNA 聚合酶和 Klenow DNA 聚合酶活性將 DNA 的黏性末端修復為平末端,3’ 端加堿基腺嘌呤(A)并加接頭,核酸純化磁珠進行片段選擇,之后用尿嘧啶-特異性切除試劑酶降解含有尿嘧啶(U)的 cDNA 第 2 鏈,最后進行 PCR 擴增即建立測序文庫。設定測序讀長參數為雙端 2×150 bp,對文庫進行測序。
1.5 表達譜數據分析及差異表達數據整理
1.5.1 miRNA 的表達鑒定與差異分析
將非典型 miRNA 序列以及 N 特征序列清理后,篩選長度為 18~26 nt 的序列,剩余序列與 mRNA、RFam 和重復序列數據庫中信息對比鑒定。篩選出的序列與 miRBase21.0 數據庫中對比,鑒定為已知 miRNA 并進行 RNA 二級結構預測,最后對 TSCI 組和 Sham 組樣本 miRNA 進行差異統計。通過 miRNA 檢出率統計 TSCI 組和 Sham 組 miRNA 表達的重合情況,利用獨立樣本 t 檢驗進行差異顯著性分析。為篩選具有高研究潛能的差異表達 miRNA,設定以下條件:排除組織中低表達的 miRNA,以 log2 差異倍數降序排列,其中表達倍數≥2 的 miRNA 設定為顯著差異表達。
1.5.2 circRNA 的表達鑒定與差異分析
RNA 成環分為外顯子環化和內含子環化,均有反向剪切位點,由反向剪切位點鑒定序列來自 circRNA 的可能,進一步使用 CIRCExplorer 對 circRNA 序列本身進行預測,并用 Tophat 比對結果。進一步通過 circRNA 位置關系分類進行注釋,統計樣本基因表達值分布,比較不同樣本間表達趨勢,確認樣本的生物學重復情況,最后對不同樣本組織之間的 circRNA 進行差異統計。通過韋恩圖分析 TSCI 組和 Sham 組 circRNA 表達的重合情況,進一步排除組織中低表達的 circRNA,利用獨立樣本 t 檢驗進行差異顯著性分析,選擇表達倍數≥1、P<0.05,并以差異表達倍數降序排列。
1.6 差異表達 circRNA 的功能預測分析
基因本體分析(gene ontology,GO)結果柱狀圖反映在生物過程、細胞組分和分子功能方面,富集的 GO 詞條上差異基因的數量分布情況,通過 GO 功能顯著性富集分析能確定差異表達基因行使的主要生物學功能。將差異表達 circRNA 的宿主基因導入 GO 分析。
circRNA 宿主基因的 GO 分析基本單位是詞條,每個詞條都對應 1 個屬性。GO 分析首先把所有顯著性差異表達基因向 GeneOntology 數據庫的各詞條映射,計算每個詞條的基因數目,應用超幾何檢驗后與整個基因組背景相比,并以 P≤0.05 為閾值篩選在顯著性差異表達基因中顯著富集的 GO 條目,進而預測差異表達基因行使的主要生物學功能。
1.7 miRNA-circRNA 靶向互作預測分析
分別使用 TargetScan、miRanda 軟件預測 miRNA 的靶基因,從而預測 miRNA-circRNA 的靶向互作。TargetScan 軟件通過種子區中種子匹配的方式預測序列完全互補信息;miRanda 軟件以堿基互補(A=U、G=C)構建打分矩陣預測靶點信息。TargetScan 分析設定閾值為≥50,miRanda 分析設定閾值為 Max_Energy<?10;兩種算法結果取交集,即為靶向互作預測分析的最終結果。進一步使用 Cytoscape 軟件繪制 miRNA-circRNA 互作圖,直觀闡明預測的互作網絡信息。
2 結果
2.1 組織學觀察
Sham 組小鼠脊髓結構清晰,脊膜完整無破裂,中央管居中,無出血,未見損傷痕跡(圖 1a)。TSCI 組小鼠脊髓有明顯損傷破裂,脊膜缺損,中央管破裂或偏于一側,可見血管破裂引起的紅細胞廣泛彌散和炎性細胞浸潤(圖 1b)。
 圖1
兩組小鼠脊髓組織 HE 染色觀察(×100)
圖1
兩組小鼠脊髓組織 HE 染色觀察(×100)
a. TSCI 組;b. Sham 組
Figure1. HE staining of spinal cord tissue in two groups (×100)a. TSCI group; b. Sham group2.2 miRNA/circRNA 表達譜及差異表達分析
聚類圖系統顯示與 Sham 組相比 TSCI 組中各 miRNA 和 circRNA 變化情況(圖 2),韋恩圖可以直觀顯示 TSCI 組與 Sham 組共同重疊和特征表達的 miRNA/circRNA(圖 3)。
 圖2
TSCI 組與 Sham 組差異表達 miRNA 與 circRNA 聚類分析
圖2
TSCI 組與 Sham 組差異表達 miRNA 與 circRNA 聚類分析
1~3: TSCI 組,4~6: Sham 組 a. miRNA;b. circRNA
Figure2. Cluster analysis of differentially expressed miRNA and circRNA in TSCI group and sham group1-3: TSCI group, 4-6: Sham group a. miRNA; b. circRNA
 圖3
TSCI 組與 Sham 組表達 miRNA 與 circRNA 韋恩圖
圖3
TSCI 組與 Sham 組表達 miRNA 與 circRNA 韋恩圖
a. miRNA;b. circRNA
Figure3. Venn diagram of differentially expressed miRNA and circRNA in TSCI group and sham groupa. miRNA; b. circRNA
本研究共鑒定出 1 228 個 miRNA,其中 TSCI 組特征表達 169 個,Sham 組特征表達 99 個,兩組重合表達 960 個。進一步以 log2 差異倍數降序排列,前 10 位 miRNA 依次為 mmu-miR-21a-3p、mmu-miR-92a-1-5p、mmu-miR-18a-3p、mmu-miR-21a-5p、mmu-miR-27a-5p、mmu-miR-7688-5p、mmu-miR-351-3p、mmu-miR-1964-3p、mmu-miR-5121_L-1、mmu-miR-7689-3p,其中前 6 位 miRNA 滿足表達倍數≥2 的顯著差異表達要求。見表 1。
本研究共鑒定出 17 440 個 circRNA,其中 TSCI 組特征表達 54 個,Sham 組特征表達 11 個,兩組重合表達 17 375 個。進一步以 log2 差異表達倍數降序排列,前 10 位 circRNA 依次為 circRNA271、circRNA802、circRNA4206、circRNA4119、circRNA1374、circRNA4700、circRNA10712、circRNA7452、circRNA5004、circRNA172。見表 2。
2.3 差異表達 circRNA 的功能預測分析
將差異表達 circRNA 的宿主基因導入 GO 分析,在細胞組分中差異基因主要富集在細胞質、細胞核、外泌體以及質膜中,在生物過程中差異基因主要富集在轉錄的正調控和蛋白磷酸化過程,在分子功能中差異基因主要富集在蛋白結合、三磷酸腺苷結合以及金屬離子結合。見圖 4。
 圖4
差異表達 circRNA 的 GO 分析
Figure4.
GO analysis of differentially expressed circRNA
圖4
差異表達 circRNA 的 GO 分析
Figure4.
GO analysis of differentially expressed circRNA
2.4 miRNA-circRNA 靶向互作預測分析
TSCI 后 mmu-miR-21a-5p 表達顯著上調,滿足表達倍數≥2 的顯著差異表達要求。結合前期研究結果[6-8],確定 mmu-miR-21a-5p 為 TSCI 后諸多病理生理過程的關鍵調控節點,進一步篩選可與其靶向結合的差異表達 circRNA。
本研究共篩選出 8 個可能與 mmu-miR-21a-5p 靶向結合的差異表達 circRNA,即 circRNA6370、circRNA11033、circRNA222、circRNA6371、ciRNA295、circRNA13622、circRNA9429、circRNA3618(表 3)。綜合分析反剪切位點、TargetScan 以及 miRanda 評分,篩選出 circRNA6370 為潛在的與 mmu-miR-21a-5p 互作影響 TSCI 后病理生理進程的關鍵 circRNA。反向篩選可與 circRNA6370 靶向結合的差異表達 miRNA 分別為 mmu-miR-21a-5p、mmu-miR-873a-5p、mmu-miR-22-5p、mmu-miR-135a-5p 和 mmu-miR-135b-5p,并以 circRNA6370 為核心構建了 TSCI 后差異表達 circRNA- miRNA 互作網絡(圖 5)。
 圖5
差異表達 circRNA-miRNA-mRNA 靶向互作圖
圖5
差異表達 circRNA-miRNA-mRNA 靶向互作圖
藍色:circRNA 紅色:miRNA 黃色:mRNA
Figure5. Differentially expressed circRNA-miRNA-mRNA networksBlue: circRNA; Red: miRNA; Yellow: mRNA
3 討論
TSCI 主要由交通事故和高處墜落造成,也可由血管病變、腫瘤和醫源性損傷造成,常導致患者癱瘓、無意識運動、大小便失禁和抑郁等[9]。創傷會導致神經細胞凋亡,破壞神經連接,從而使得上、下行傳導的神經興奮中斷[10]。TSCI 包括急性期、亞急性期和慢性期,許多分子共同參與損傷后的修復過程。目前有越來越多的證據表明非編碼 RNA 在脊髓損傷進展中起重要作用[5, 11]。70% 以上的人類基因被轉錄,但是只有不到 2% 的基因被翻譯成蛋白質,其余大部分的基因被轉錄成非編碼 RNA[12]。非編碼 RNA 按照內在功能可分為兩大類,一類是管家非編碼 RNA,包括核內小 RNA、核糖體 RNA 和搬運 RNA 等;另一類是調控性非編碼 RNA,包括 miRNA、circRNA 和長非編碼 RNA 等[13]。目前,調控性非編碼 RNA 中,對 miRNA 的研究開展最早且最全面。miRNA 廣泛存在于各種組織和體液中[14-15],尤其在神經系統中 miRNA 可作為調控因子,甚至類激素樣因子,通過自分泌或者旁分泌途徑影響靶細胞之間的交流和信息傳遞,從而調控神經退行性變和再生進程[5]。circRNA 是一類剛進入研究者視野的非編碼 RNA,不同于其他非編碼 RNA 的線性結構,circRNA 呈現出首尾相連的特殊環狀結構,由于沒有 5’ 端和 3’ 端,circRNA 對核酸酶不敏感,故比線性 RNA 更穩定。circRNA 從果蠅到人的各類生物組織中均有表達,在人體中 circRNA 源于 14.4% 的表達基因,約占人類總 RNA 的 1%[16]。circRNA 的表達存在時間、空間和組織特異性,大部分與對應的線性轉錄本相比表達偏低,但在一定情況下可以遠高于其對應的線性轉錄本,尤其在中樞神經系統中,circRNA 大量表達,參與神經的發育、退變、遞質釋放和軸突生長等過程[17-18]。目前認為 circRNA 最重要的作用是作為 miRNA 的吸附海綿來發揮轉錄后的調控功能,且已證實 Cyrano–Cdr1as-miR-7 這一 lncRNA-circRNA-miRNA 多 RNA 互作軸可調控退變相關的神經活動[5, 19-20]。
本研究分別對 TSCI 后差異表達的 circRNA 和 miRNA 進行高通量測序,分別獲得損傷急性期差異表達譜,并進行了相關宿主基因功能注釋的分析。mmu-miR-21a-5p 為損傷后大量表達且上調最明顯的 miRNA,測序中的差異表達趨勢與前期研究中 PCR 結果一致[6-7]。前期研究結果表明脊髓損傷后上調的 mmu-miR-21-5p,不僅能通過 PI3K-Akt-mTOR 通路調控星形膠質細胞的活化,也能通過 TGF-β-Smad 通路調控血管和脊膜成纖維細胞的活化[6-7]。而脊髓星形膠質細胞和成纖維細胞是形成瘢痕阻隔影響軸突再生的關鍵[21-22]。因此結合前期研究基礎,本研究中為篩選可與 mmu-miR-21-5p 靶向結合的差異表達 circRNA,默認設置的 circRNA 差異表達閾值是 log2 差異倍數≥1 且P≤ 0.05,進一步通過 TargetScan 和 miRanda 軟件預測 circRNA-miRNA 之間的靶向關系,TargetScan 設定閾值是≥50,該值越大結合率越高,miRanda 設置閾值 Max_Energy<?10,該值越小結合率越高。進而在所有能與 miR-21-5p 靶向結合的差異表達 circRNA 中,篩選出成環指數最高、結合率最高的 circRNA6370 進行軸向預測。根據 circRNA 與 miRNA 結合一對多的特征[19-20],構建了以 circRNA6370 為核心的 circRNA-miRNA 靶向互作網絡。
在后續研究中,我們將從體外、體內方向共同驗證和完善本研究預測的 TSCI 后 circRNA-miRNA 靶向結合網絡,進一步探索其功能及通路,旨在探究 TSCI 后非編碼 RNA 調控網絡的病理生理作用及機制,尤其在急性期炎癥相關病理生理功能發掘與驗證。
作者貢獻:王文朝承擔實驗設計及文章撰寫,王善璽、張正東和李軍參與數據收集,謝偉、蘇延林和陳佳男參與動物實驗及統計分析,劉雷指導研究并對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經山東大學醫學/動物實驗倫理委員會批準,實驗動物使用許可證號:SYXK(魯)20150015。