引用本文: 馮瑋, 涂小林. 全反式維甲酸與 VEGF 聯合應用誘導小鼠胚胎成纖維細胞定向成骨分化. 中國修復重建外科雜志, 2020, 34(2): 246-255. doi: 10.7507/1002-1892.201906099 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
骨骼損傷后的修復離不開多種生物因子的參與,研究因子間相互作用對于骨修復重建具有重要臨床價值。大量研究表明,構建組織工程骨是治療骨折、骨缺損的理想方法,其三大要素包括種子細胞、生長因子及生物相容性優良的支架材料[1-2]。MSCs 是來源于中胚層的一類多能干細胞,可以成骨、成軟骨、成脂肪細胞分化,是組織工程骨理想的種子細胞。如何利用生物因子有效促進 MSCs 成骨分化、誘導新骨形成并加速骨組織改建,是目前該領域的研究熱點[3-4]。
小鼠胚胎成纖維細胞(mouse embryonic fibroblasts,MEFs)是來源于胚胎的 MSCs,具有多向分化潛能,因其具有自我更新和復制能力強、培養過程中細胞增殖與形態維持能力強的優點,更適合用于 MSCs 定向分化研究。全反式維甲酸(all-trans retinoic acid,ATRA )是維生素 A 的活性代謝產物,能夠通過影響成骨細胞與破骨細胞的活性,從而影響骨形成與骨吸收。而 VEGF 是目前發現的作用最強的誘導血管生成的細胞因子,對于成骨細胞與破骨細胞的增殖、分化及功能活性具有重要調節作用,參與骨骼發育與骨骼形成。研究表明[5-6],ATRA 的應用促進了骨髓基質細胞的成骨分化,也刺激了骨髓基質細胞及 MSCs 中 VEGF 等成血管相關因子的表達。因此,ATRA 和 VEGF 聯合應用可能對 MEFs 定向成骨分化有調節作用。本研究擬通過體外及體內實驗,探討 ATRA 與 VEGF 聯合應用誘導 MEFs 定向成骨分化的效果。報告如下。
1 材料與方法
1.1 實驗動物、細胞及腺病毒
NIH 孕鼠(孕 12~15 d)1只,購自重慶醫科大學實驗動物中心;4~6 周齡無胸腺雌性裸鼠 15 只,購自北京實驗動物研究中心,于重慶醫科大學實驗動物中心飼養。HEK-293 細胞購自中國科學院上海細胞庫;提取的 MEFs 以及重組腺病毒紅色熒光蛋白(recombinant adenovirus-red fluorescent protein,Ad-RFP)、Ad-VEGF 由美國芝加哥大學醫學中心分子腫瘤實驗室 TC He 教授提供。
1.2 主要試劑及儀器
ATRA(采用 DMSO 為溶劑)、茜素紅 S 染色液、地塞米松、β 磷酸甘油二鈉、DMSO(北京索萊寶科技有限公司);BCIP/NBT ALP 顯色試劑盒、ALP 檢測試劑盒(上海碧云天生物技術有限公司);逆轉錄試劑盒、實時熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)試劑盒、Trizol(Takara 公司,日本);骨橋蛋白(osteopontin,OPN)、VEGF 一抗(武漢三鷹生物技術有限公司)。CO2 培養箱、臺式低溫離心機(Thermo 公司,美國);熒光倒置顯微鏡(Nikon 公司,日本);倒置顯微鏡(Olympus 公司,日本);qRT-PCR 儀(Bio-Rad 公司,美國)。
1.3 MEFs 分離培養
取 NIH 孕鼠以脫頸法處死,開腹后將子宮取出轉移至無菌培養皿,PBS 反復沖洗 3 遍。將子宮剪開,暴露每一個胚胎,打開卵黃囊分出整個胎鼠,切去鼠頭、心、肝等器官后,PBS 反復沖洗并轉移至新的無菌培養皿中。將剩余組織剪碎,加入 0.25% 胰蛋白酶 2~3 mL,37℃ 消化約 30 min 至肉眼觀察不到組織碎片,加入 2 倍體積含 10%FBS 的 DMEM 培養基以終止消化。將細胞以 1.5×108 個/L 密度接種于 100 mm 培養皿,37℃ 培養 2~3 d。于 37℃、5% CO2 條件下,用含 10% FBS、100 U/mL 青霉素及 100 μg/mL 鏈霉素的 H-DMEM 培養基培養 MEFs 并傳代,取第 3~4 代細胞備用。根據文獻[7]方法鑒定分離培養的細胞為 MEFs。
1.4 Ad-RFP、Ad-VEGF 擴增及轉染 MEFs
取 HEK-293 細胞于 37℃、5%CO2 條件下,用含 10%FBS、100 U/mL 青霉素及 100 μg/mL 鏈霉素的 H-DMEM 培養基培養并傳代,取第 3~4 代細胞擴增腺病毒。當 HEK-293 細胞生長至約 70% 融合時,在 100 mm 培養皿中加入 10 mL 完全培養基與解凍后的 Ad-RFP、Ad-VEGF (0.5 μL/皿)。36 h 后熒光倒置顯微鏡下觀察,可見 HEK-293 細胞表達大量紅色熒光。當鏡下可見 1/3~1/2 HEK-293 細胞開始脫落并見大量熒光時,輕輕吹打貼壁細胞使其完全脫落,移入 15 mL 離心管中,以離心半徑 10 cm、800 r/min 離心 5 min,棄上清,在液氮及 37℃ 水浴中快速來回凍融細胞 5 次,提取上清液即為有效病毒,?80℃ 分裝保存。
取第 3~4 代 MEFs,以 3×104 個/孔密度接種于 24 孔板,每孔加入 1 mL 完全培養基和 1 μL Ad-RFP 或 1 μL Ad-VEGF,24 h 后在熒光倒置顯微鏡下觀察 Ad-RFP 和 Ad-VEGF 熒光表達情況;于放大 400 倍下隨機選取 5~7 個視野,計數陽性細胞和總細胞,按以下公式計算轉染效率:陽性細胞數/總細胞數×100%。
1.5 ATRA 和 VEGF 對 MEFs 成骨分化的影響
1.5.1 ALP 活性檢測
將 MEFs 以 3×104 個/孔密度接種于 24 孔板,首先檢測單獨 ATRA 或 VEGF 對 MEFs 成骨分化后 ALP 活性的影響。取 6 孔 MEFs,每孔中分別加入 DMSO(a 組)及 0.1、0.2、0.4、0.8、1.6 μmol/L ATRA(分別設為 b、c、d、e、f 組);再取 6 孔 MEFs,每孔中分別加入 DMSO(a1 組)及 0.1、0.5、1.0、1.5、2.0 μL Ad-VEGF(分別設為 b1、c1、d1、e1、f1 組)。各組于處理第 3、5 天按 BCIP/NBT ALP 顯色試劑盒說明書進行 ALP 染色,并使用 ALP 檢測試劑盒定量檢測 ALP 活性。每組重復 3 次,取均值。
然后檢測 ATRA 和 Ad-VEGF 聯合應用是否有協同增強 ALP 活性的功能。取 5 孔 MEFs,每孔中分別加入 DMSO(a2 組)、1.6 μmol/L ATRA(b2 組)、1.6 μmol/L ATRA+0.5 μL Ad-VEGF(c2 組)、1.6 μmol/L ATRA+1.0 μL Ad-VEGF(d2 組)、1.6 μmol/L ATRA+1.5 μL Ad-VEGF(e2 組);再取 5 孔 MEFs,每孔中分別加入 DMSO(a3 組)、1.0 μL Ad-VEGF(b3 組)、1.0 μL Ad-VEGF+0.4 μmol/L ATRA(c3 組)、1.0 μL Ad-VEGF+0.8 μmol/L ATRA(d3 組)、1.0 μL Ad-VEGF+1.6 μmol/L ATRA(e3 組)。培養第 3、5 天時,同上法檢測各組 ALP 活性。
1.5.2 后續實驗分組
根據聯合應用后 ALP 活性檢測結果,選擇最佳劑量濃度組合進行后續實驗。將 MEFs 以 3×104 個/孔密度接種于 24 孔板。實驗分為 4 組,A 組加入 DMSO+Ad-RFP,B 組加入 ATRA,C 組加入 Ad-VEGF,D 組加入 ATRA+Ad-VEGF。其中,ATRA 濃度為 1.6 μmol/L,Ad-RFP 及 Ad-VEGF 用量為 1 μL/孔,DMSO 用量為 10 μL/孔。
1.5.3 qRT-PCR 檢測
各組于處理第 3、7 天使用 Trizol 提取總 RNA,按照逆轉錄試劑盒說明書將各組 RNA 逆轉錄為 cDNA,反應液稀釋 5 倍后作為 qRT-PCR 模板,進行 qPCR 檢測。反應條件:95℃、30 min,95℃、5 min,60℃、30 min,39 個循環;融解曲線分析:溫度 65~95℃。用 2?ΔCt法計算各組成骨相關基因 ALP、Ⅰ 型膠原、OPN、骨鈣素(osteocalcin,OCN)及成血管相關基因 VEGF、血管生成素 1(angiopoietin 1,ANGPT1)、內皮黏蛋白(endomucin,EMCN)的 mRNA 相對表達量。每組重復 3 次,取平均值。各基因引物序列見表 1。
1.5.4 免疫組織化學染色觀察
各組細胞處理第 3、5、7 天時,于 37℃、4% 多聚甲醛固定 15 min,PBS 洗滌 3 遍,然后用 0.5%Triton X-100 于室溫下通透,并用山羊血清封閉 30 min。在培養板中添加 1∶500 稀釋的 OPN、VEGF 一抗,4℃ 孵育過夜;次日添加與一抗對應的辣根過氧化物酶標記二抗溫育 20 min;最后用 DAB 染色液染色 5 min,蘇木素復染細胞核,倒置顯微鏡下觀察。
1.5.5 茜素紅染色觀察
將 MEFs 鋪于 24 孔板,待細胞貼壁后按分組相應處理細胞,然后用成骨誘導培養基(含 10%FBS、100 U/mL 青霉素及 100 μg/mL 鏈霉素、50 mg/L 維生素 C、0.1 μmol/L 地塞米松、10 mmol/L β 磷酸甘油二鈉的 DMEM 培養基)培養,于 14、21 d 時常規行茜素紅染色,檢測鈣鹽沉積。每組實驗重復 3 次。
1.6 ATRA 和 Ad-VEGF 對裸鼠體內異位成骨的影響
1.6.1 實驗分組
將 15 只無胸腺雌性裸鼠隨機分為 3 組,即 ATRA 組、Ad-VEGF 組及 ATRA+Ad-VEGF 組,每組 5 只。取第 3~4 代 MEFs,分別加入 1.6 μmol/L ATRA、1 μL/孔 Ad-VEGF(轉染效率 20% 以上)和 1.6 μmol/L ATRA+1 μL/孔 Ad-VEGF。培養 24 h 觀察到 MEFs 表達紅色熒光后,繼續培養 24 h 讓 ATRA 充分作用細胞。收獲各組細胞并用 PBS 重懸,乙醇消毒后按分組分別注射至無胸腺裸鼠的背側與腹側,每個部位注射 200 μL 細胞(密度為 1×107 個/mL)。
1.6.2 觀測指標
① X 線片觀察:細胞植入后 5 周,乙醚吸入麻醉法處死裸鼠, X 線片觀察各組裸鼠皮下成骨包塊。② 大體觀察:將裸鼠植入部位骨塊取出,比較大小。③ 組織學觀察:取各組骨塊,EDTA-Na2 液脫鈣、10% 甲醛固定并包埋于石蠟中;脫石蠟及再水化后,常規行 HE、Masson 及番紅 O-固綠染色觀察。
1.7 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 Bonferroni t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 Ad-RFP 和 Ad-VEGF 轉染 MEFs 的熒光表達
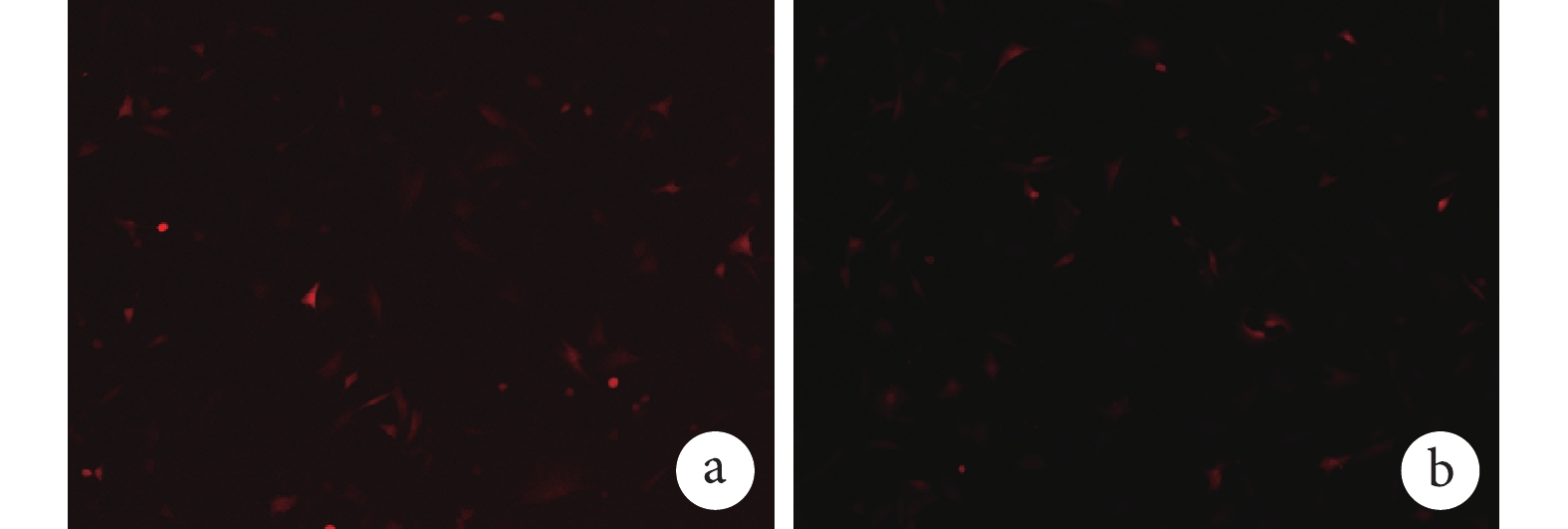
將擴增后的 Ad-RFP 或 Ad-VEGF 轉染 MEFs 24 h 后熒光倒置顯微鏡觀察示,MEFs 發出紅色熒光,分布均勻。Ad-RFP 和 Ad-VEGF 的轉染效率分別約 50% 和 20%,表明已擴增的 Ad-RFP 和 Ad-VEGF 可以有效轉染 MEFs。見圖 1。
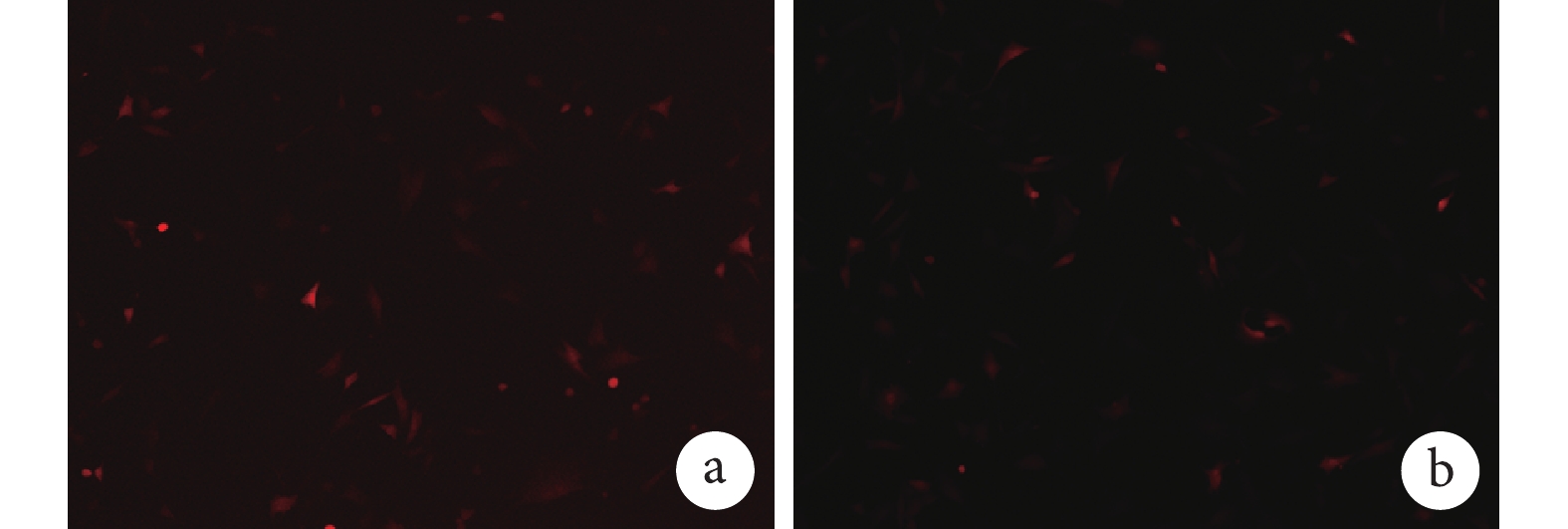 圖1
Ad-RFP 及 Ad-VEGF 轉染 MEFs 的熒光表達(熒光倒置顯微鏡×100)
圖1
Ad-RFP 及 Ad-VEGF 轉染 MEFs 的熒光表達(熒光倒置顯微鏡×100)
a. Ad-RFP 轉染的 MEFs;b. Ad-VEGF 轉染的 MEFs
Figure1. Fluorescence expression of MEFs transfected with Ad-RFP or Ad-VEGF (Fluorescence inverted microscope×100)a. Ad-RFP transfected MEFs; b. Ad-VEGF transfected MEFs
2.2 ATRA 和 Ad-VEGF 聯合應用對 MEFs 成骨分化的影響
2.2.1 ALP 活性檢測
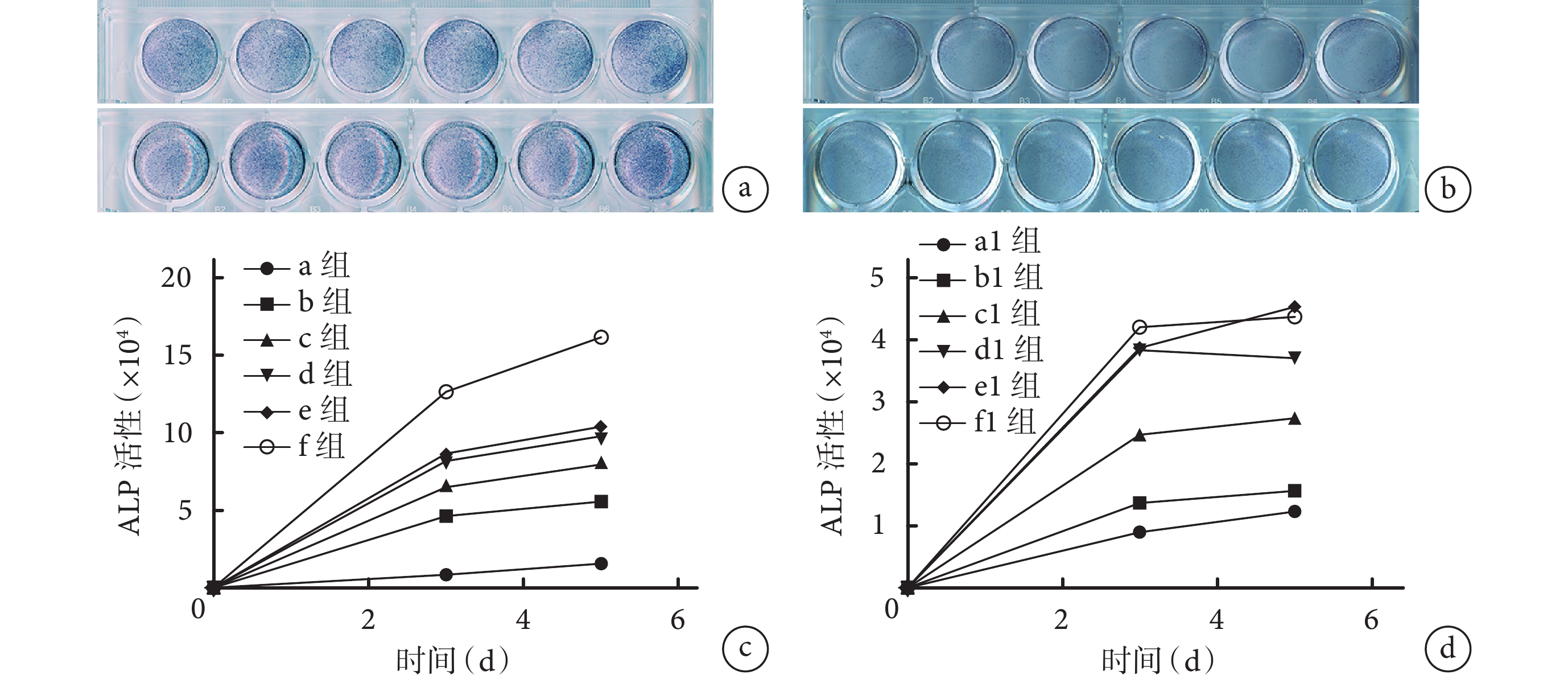
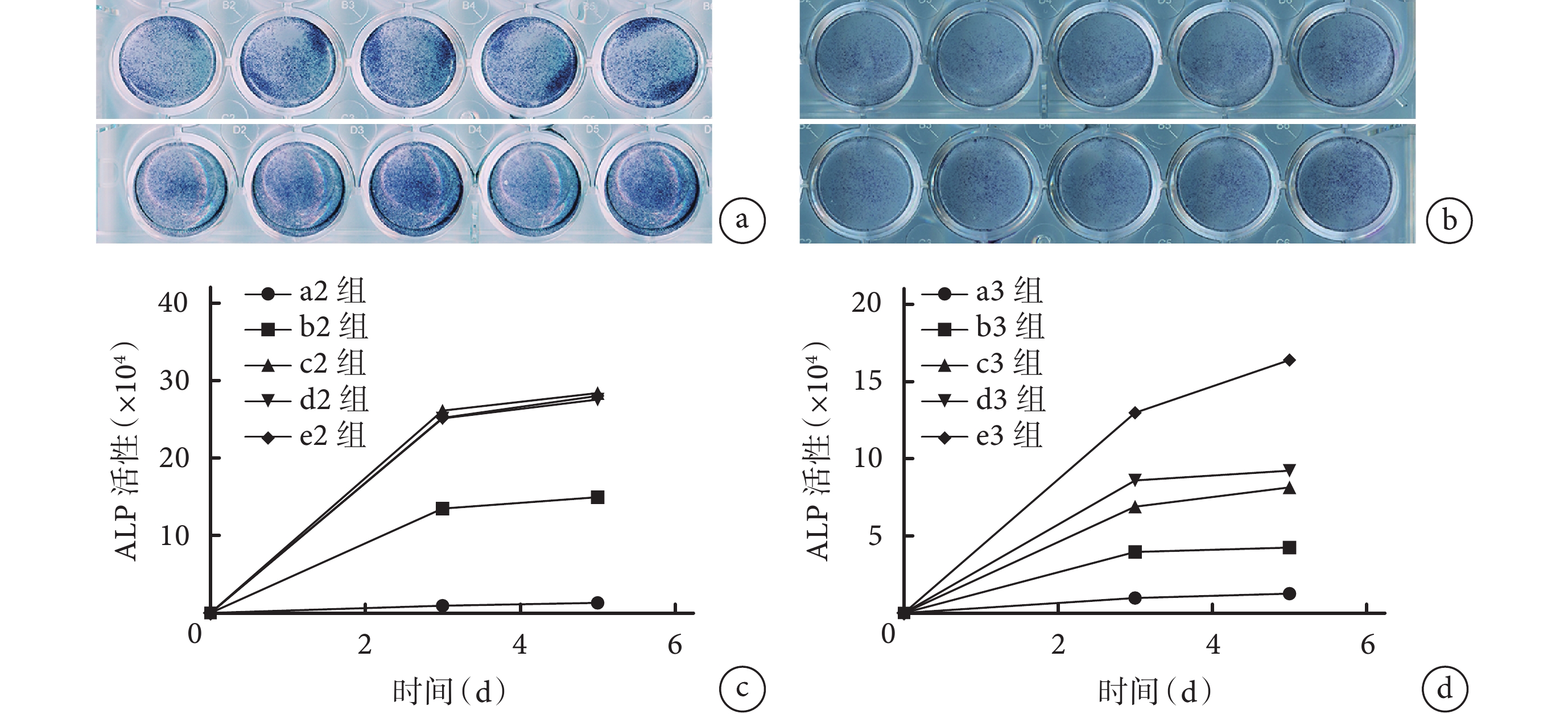
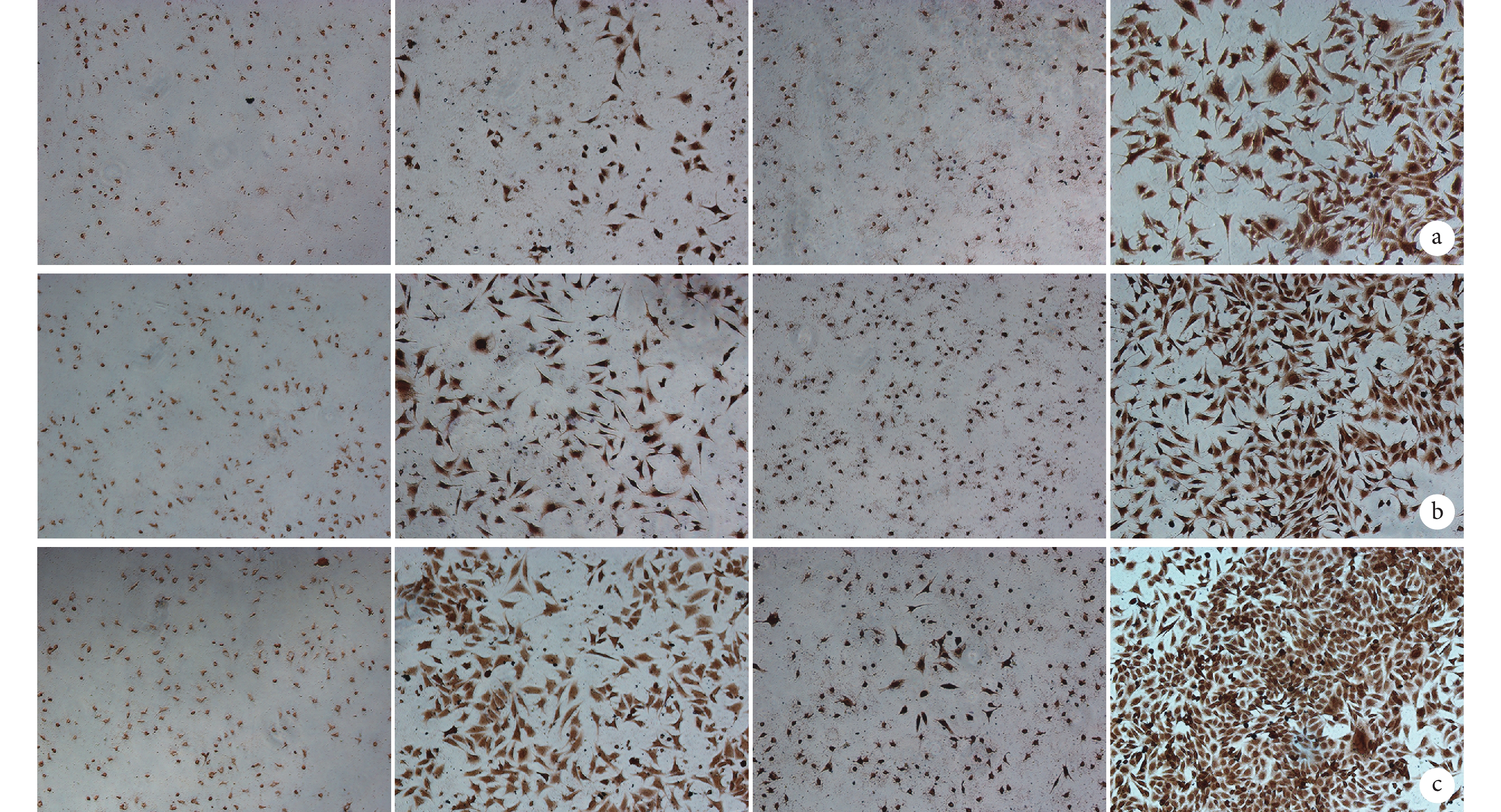
① 培養第 3、5 天,ATRA 和 Ad-VEGF 均呈濃度或劑量依賴性增強 MEFs 中 ALP 活性,其中 ATRA 作用更強;與 a、a1 組相比,即使最小濃度 ATRA(0.1 μmol/L)也具有顯著 ALP 活性促進作用,0.5 μL 以上 Ad-VEGF 劑量也有 ALP 活性促進作用,差異均有統計學意義(P<0.05)。但是當 Ad-VEGF 使用劑量在 1.0 μL 以上時,d1、e1、f1 組間差異無統計學意義(P>0.05)。見圖 2。②ATRA 和 Ad-VEGF 聯合應用時,Ad-VEGF 可明顯促進 ATRA 誘導的 ALP 活性,c2、d2、e2 組 ALP 活性顯著高于 a2、b2 組(P<0.05),c2、d2、e2 組間差異無統計學意義(P>0.05)。ATRA 也可促進 Ad-VEGF 誘導的 ALP 活性,隨著 ATRA 濃度增加 ALP 活性也逐漸增強,e3 組 ATRA 濃度為 1.6 μmol/L 時顯示出最強的 ALP 活性,與其余各組比較差異均有統計學意義(P<0.05)。見圖 3。表明 ATRA 和 Ad-VEGF 聯合應用可能具有促進 MEFs 成骨分化的功能。因此,本研究選擇 1.6 μmol/L ATRA 和 1.0 μL Ad-VEGF 進行后續實驗。
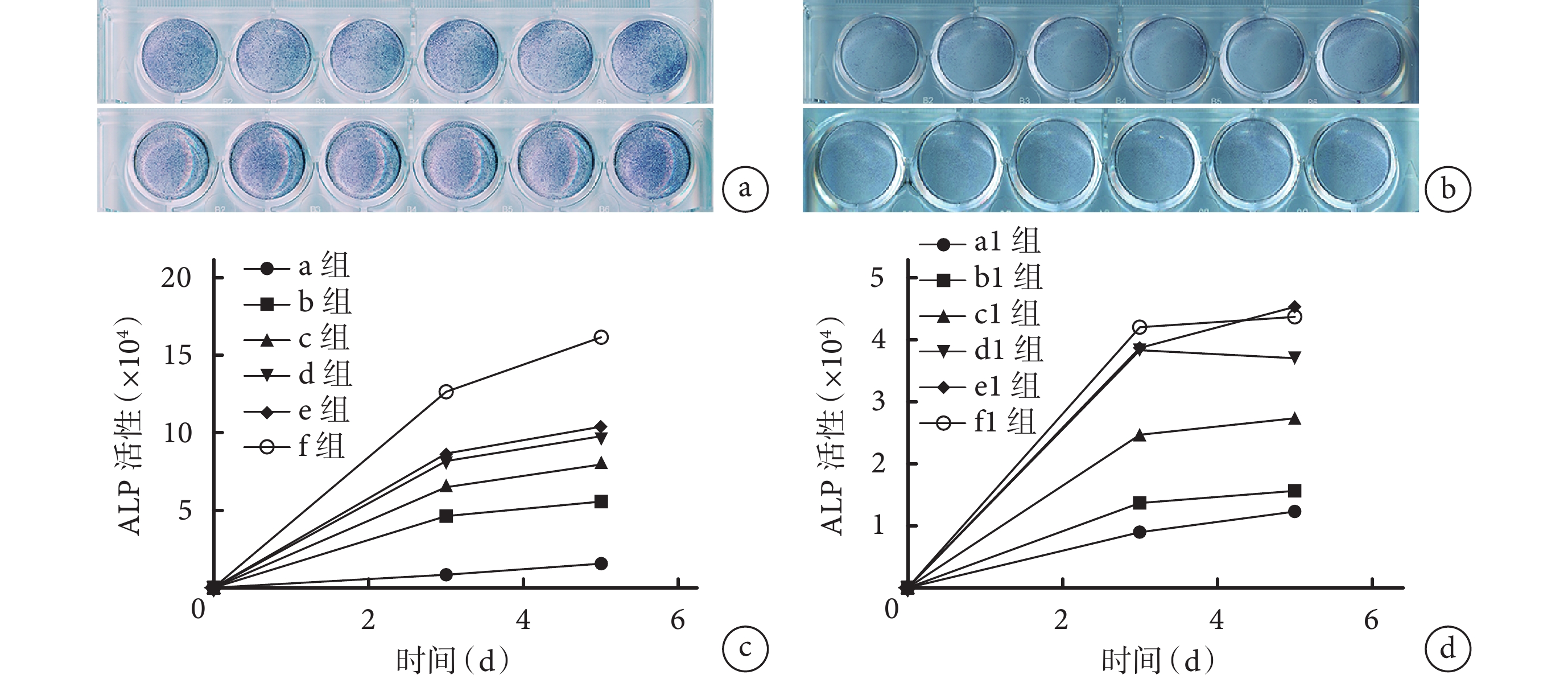 圖2
ATRA 和 Ad-VEGF 單獨應用促進 ALP 活性觀察
圖2
ATRA 和 Ad-VEGF 單獨應用促進 ALP 活性觀察
a. ATRA 從左至右依次為 a、b、c、d、e、f 組,上下 2 排分別為培養 3、5 d;b. Ad-VEGF 從左至右依次為 a1、b1、c1、d1、e1、f1 組,上下 2 排分別為培養 3、5 d;c. ATRA 促進 ALP 活性定量檢測;d. Ad-VEGF 促進 ALP 活性定量檢測
Figure2. ATRA and Ad-VEGF applied alone to promote ALP activitya. ATRA From left to right for groups a, b, c, d, e, and f, respectively; and the upper and the lower rows were cultured for 3 or 5 days, respectively; b. Ad-VEGF From left to right for groups a1, b1, c1, d1, e1, and f1, respectively; and the upper and lower rows were cultured for 3 or 5 days, respectively; c. Quantitative detection of ALP activity after cultured with ATRA; d. Quantitative detection of ALP activity after cultured with Ad-VEGF
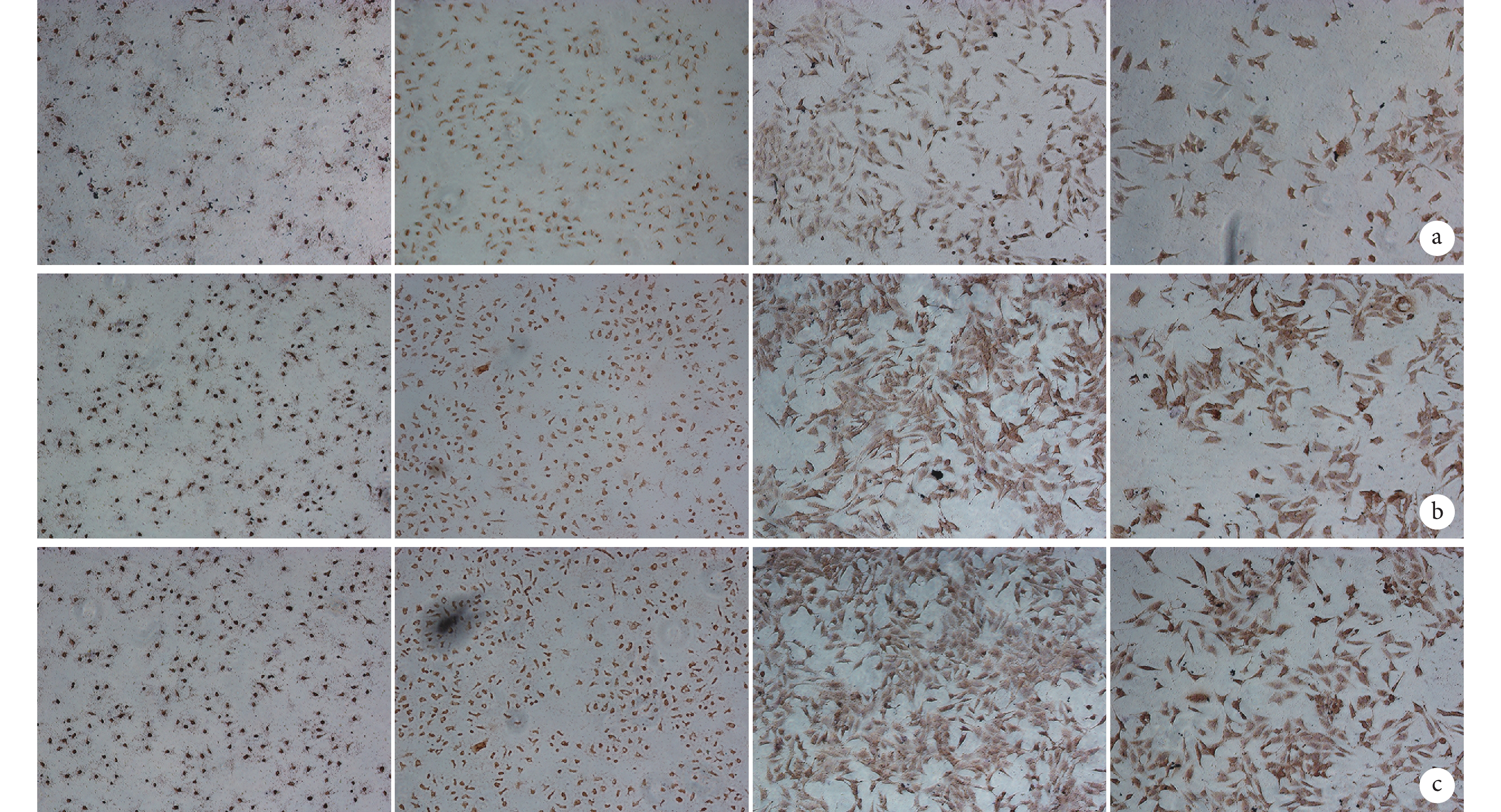
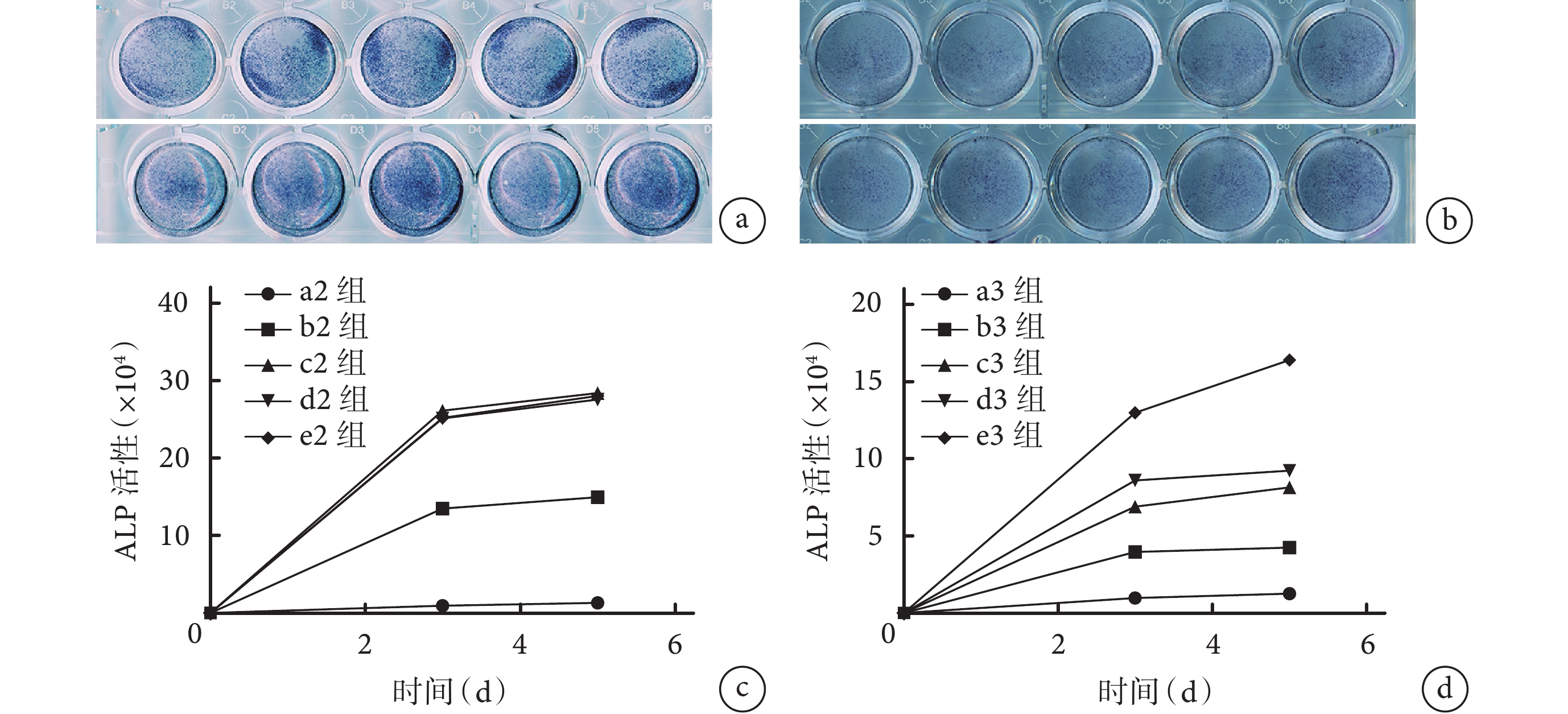 圖3
ATRA 和 Ad-VEGF 聯合應用促進 ALP 活性觀察
圖3
ATRA 和 Ad-VEGF 聯合應用促進 ALP 活性觀察
a. 1.6 μmol/L ATRA 聯合不同劑量 Ad-VEGF 從左至右依次為 a2、b2、c2、d2、e2 組,上下 2 排分別為培養 3、5 d;b. 1.0 μL Ad-VEGF 聯合不同濃度 ATRA 從左至右依次為 a3、b3、c3、d3、e3 組,上下 2 排分別為培養 3、5 d;c. 1.6 μmol/L ATRA 聯合不同劑量 Ad-VEGF 促進 ALP 活性定量檢測;d. 1.0 μL Ad-VEGF 聯合不同濃度 ATRA 促進 ALP 活性定量檢測
Figure3. ATRA and Ad-VEGF were combined to promote ALP activitya. 1.6 μmol/L ATRA combined with different doses of Ad-VEGF From left to right for groups a2, b2, c2, d2, and e2, respectively; and the upper and the lower rows were cultured for 3 or 5 days,respectively; b. 1.0 μL Ad-VEGF combined with different concentrations of ATRA From left to right for groups a3, b3, c3, d3, and e3, respectively; and the upper and the lower rows were cultured for 3 or 5 days, respectively; c. Quantitative detection of ALP activity after cultured with 1.6 μmol/L ATRA and different doses of Ad-VEGF; d. Quantitative detection of ALP activity after cultured with 1.0 μL Ad-VEGF and different concentrations of ATRA
2.2.2 qRT-PCR 檢測
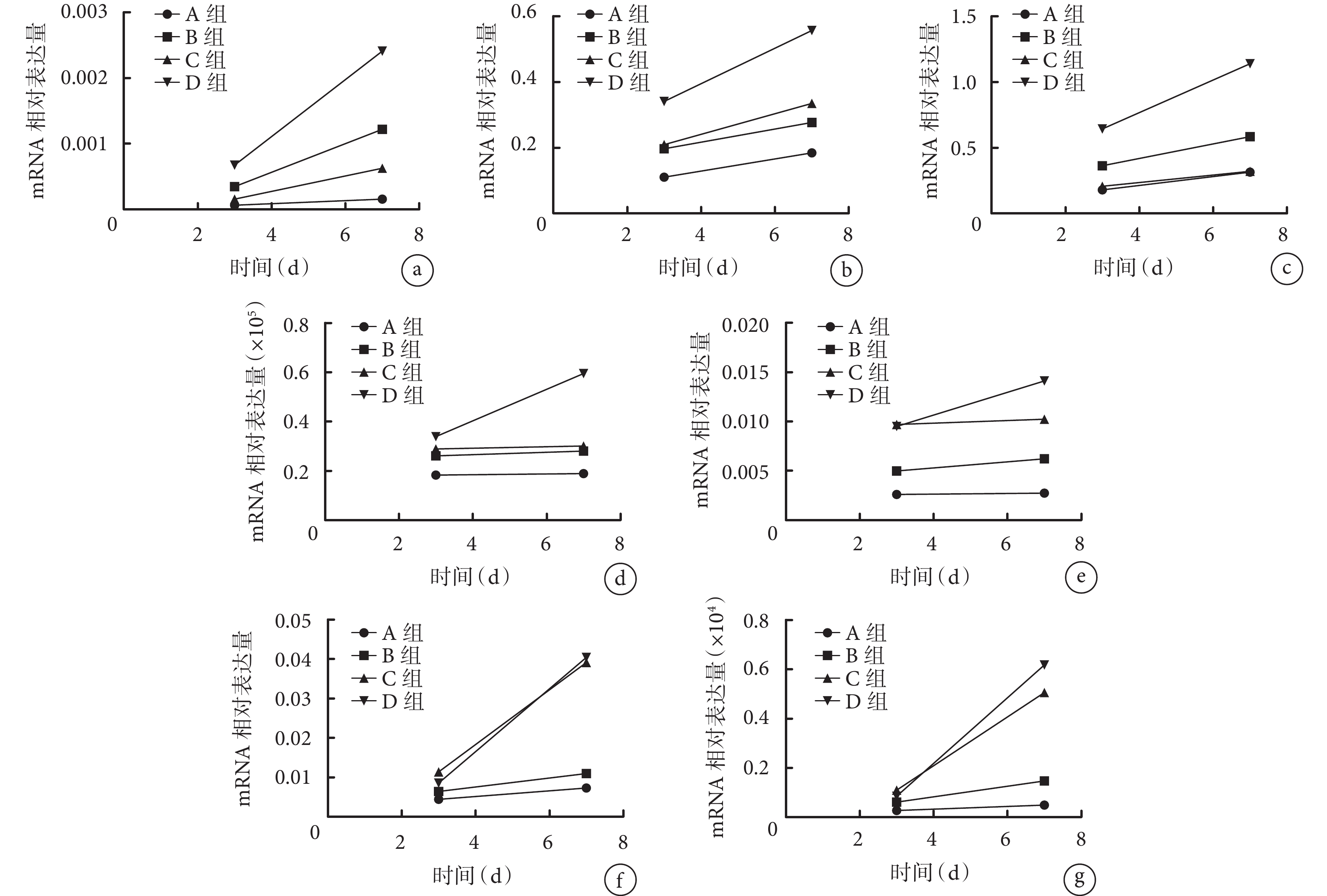
處理第 3、7 天,D 組早期成骨相關標志物 ALP、Ⅰ 型膠原、OPN mRNA 相對表達量均顯著高于 A、B、C 組,且 D 組 7 d 時顯著高于 3 d 時,差異均有統計學意義(P<0.05)。但各組晚期成骨相關標志物 OCN mRNA 均呈低表達,D 組 7 d 時 OCN mRNA 相對表達量顯著高于其余 3 組且高于 D 組 3 d 時,差異均有統計學意義(P<0.05)。處理 3、7 d,C、D 組成血管相關標志物 VEGF、EMCN、ANGPT1 mRNA 均呈高表達,D 組 7 d 時 VEGF、EMCN mRNA 相對表達量顯著高于 C 組,且 D 組 7 d 各成血管相關標志物 mRNA 相對表達量高于 3 d 時,差異均有統計學意義(P<0.05)。見圖 4。
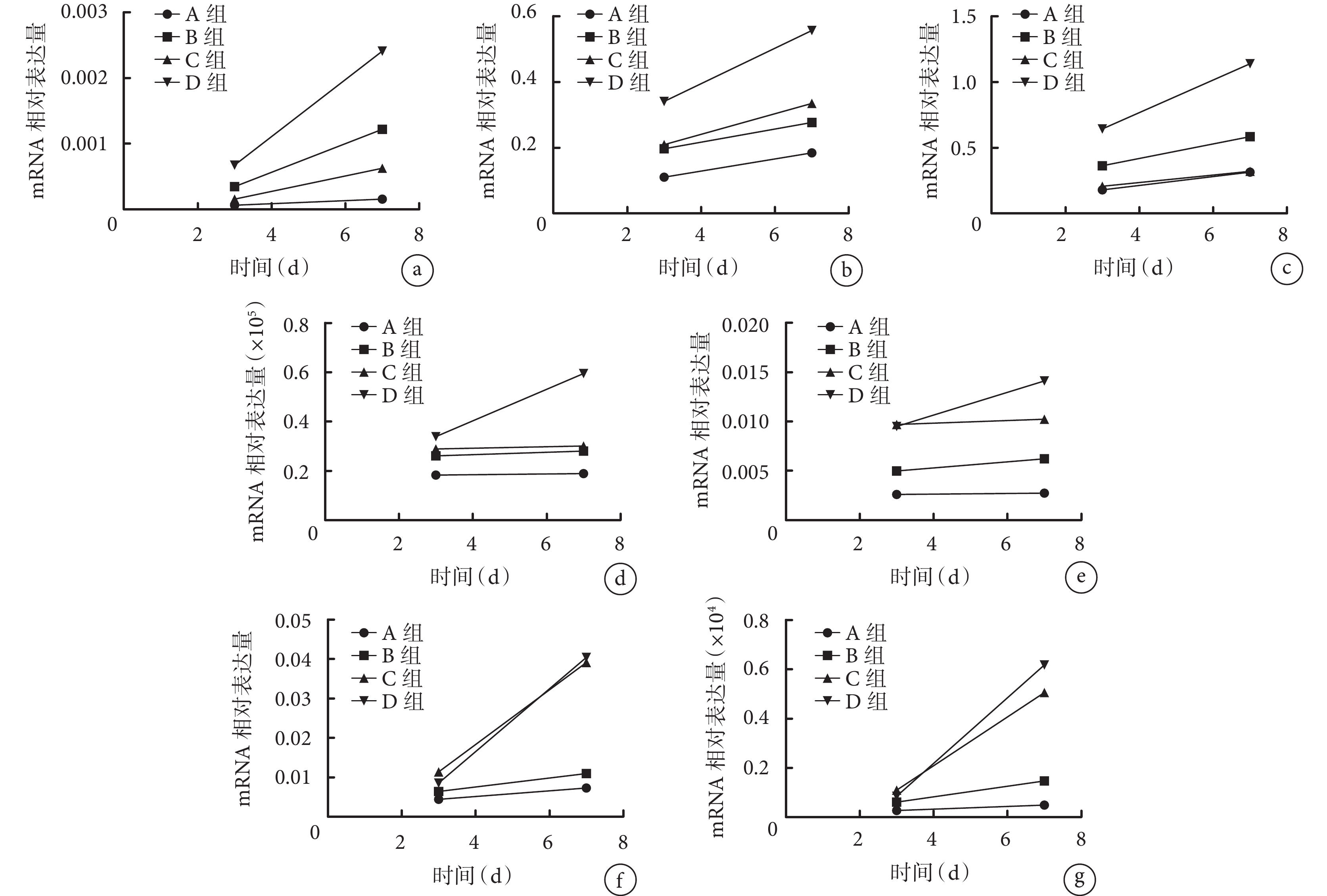 圖4
qRT-PCR 檢測各組成骨或成血管相關標志物 mRNA 相對表達量
圖4
qRT-PCR 檢測各組成骨或成血管相關標志物 mRNA 相對表達量
a. ALP;b. Ⅰ 型膠原;c. OPN;d. OCN;e. VEGF;f. ANGPT1;g. EMCN
Figure4. The relative mRNA expressions of osteogenesis- and angiogenesis-related markers detected by qRT-PCR in each groupa. ALP; b. Collagen typeⅠ; c. OPN; d. OCN; e. VEGF; f. ANGPT1; g. EMCN
2.2.3 免疫組織化學染色觀察
隨時間延長,各組 OPN 蛋白和 VEGF 蛋白表達均逐漸增加。各時間點 D 組 OPN 蛋白表達均顯著強于其余各組;C 組 VEGF 蛋白表達顯著強于其余各組,但 D 組也有較高 VEGF 蛋白表達。見圖 5、6。
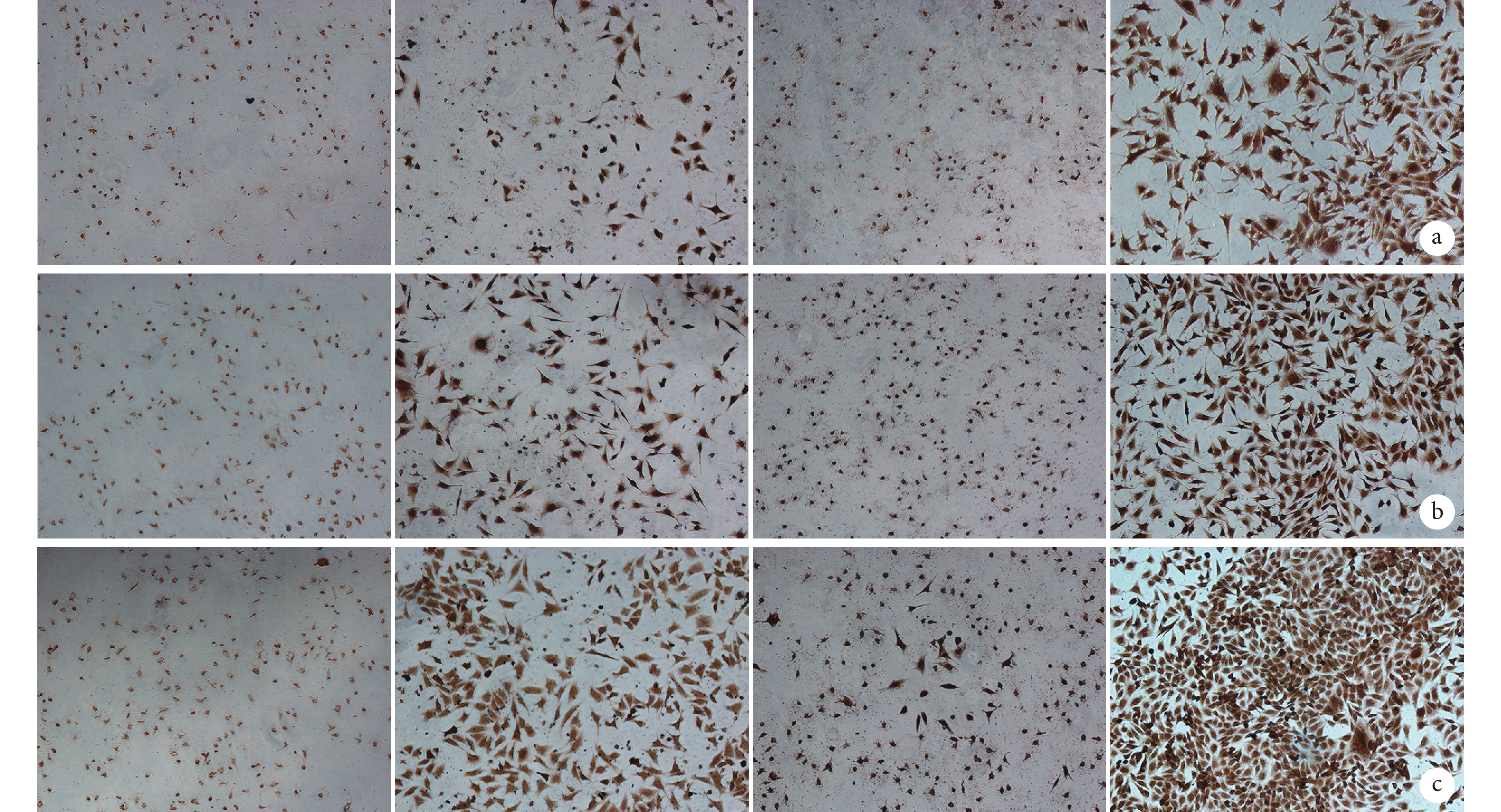 圖5
免疫組織化學染色觀察各組 OPN 蛋白表達(倒置顯微鏡×100)
圖5
免疫組織化學染色觀察各組 OPN 蛋白表達(倒置顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 3 d;b. 5 d;c. 7 d
Figure5. The expression of OPN protein in each group by immunohistochemical staining (Inverted microscope×100)From left to right for groups A, B, C, and D, respectively a. At 3 days; b. At 5 days; c. At 7 days
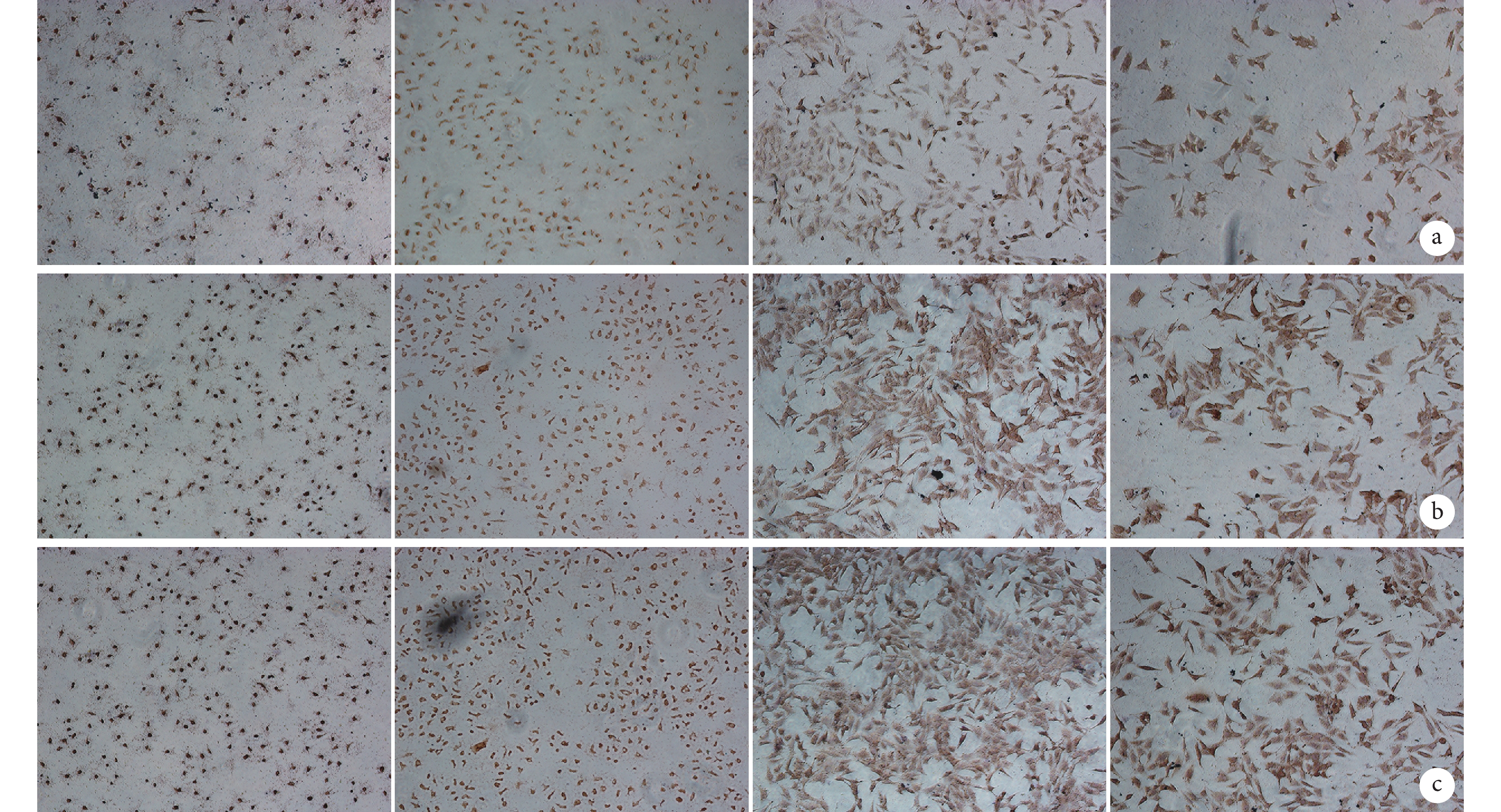 圖6
免疫組織化學染色觀察各組 VEGF 蛋白表達(倒置顯微鏡×100)
圖6
免疫組織化學染色觀察各組 VEGF 蛋白表達(倒置顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 3 d;b. 5 d;c. 7 d
Figure6. The expression of VEGF protein in each group by immunohistochemical staining (Inverted microscope×100)From left to right for groups A, B, C, and D, respectively a. At 3 days; b. At 5 days; c. At 7 days
2.2.4 茜素紅染色觀察
成骨誘導培養 14、21 d 茜素紅染色示,D 組鈣鹽沉積效果明顯強于其余各組,且 21 d 時鈣鹽沉積效果更強;B、C 組均未出現明顯的鈣鹽沉積。見圖 7。
 圖7
成骨誘導各時間點茜素紅染色觀察各組鈣鹽沉積(倒置顯微鏡×100)
圖7
成骨誘導各時間點茜素紅染色觀察各組鈣鹽沉積(倒置顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 14 d;b. 21 d
Figure7. Observation of calcium deposition by alizarin red staining at each time point after osteogenesis induction (Inverted microscope×100)From left to right for groups A, B, C, and D, respectively a. At 14 days; b. At 21 days
2.3 ATRA 和 Ad-VEGF 對裸鼠體內異位成骨的影響
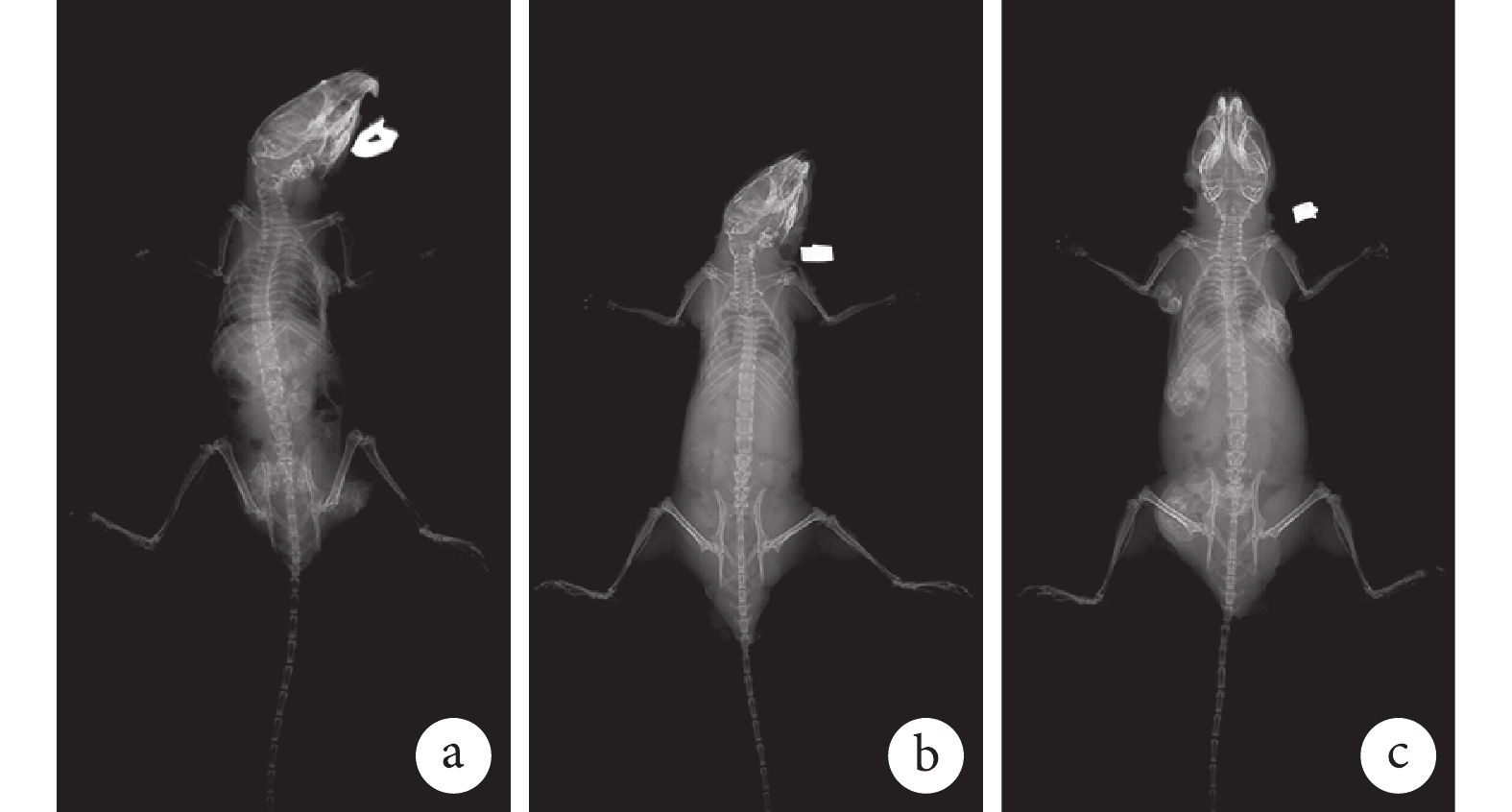
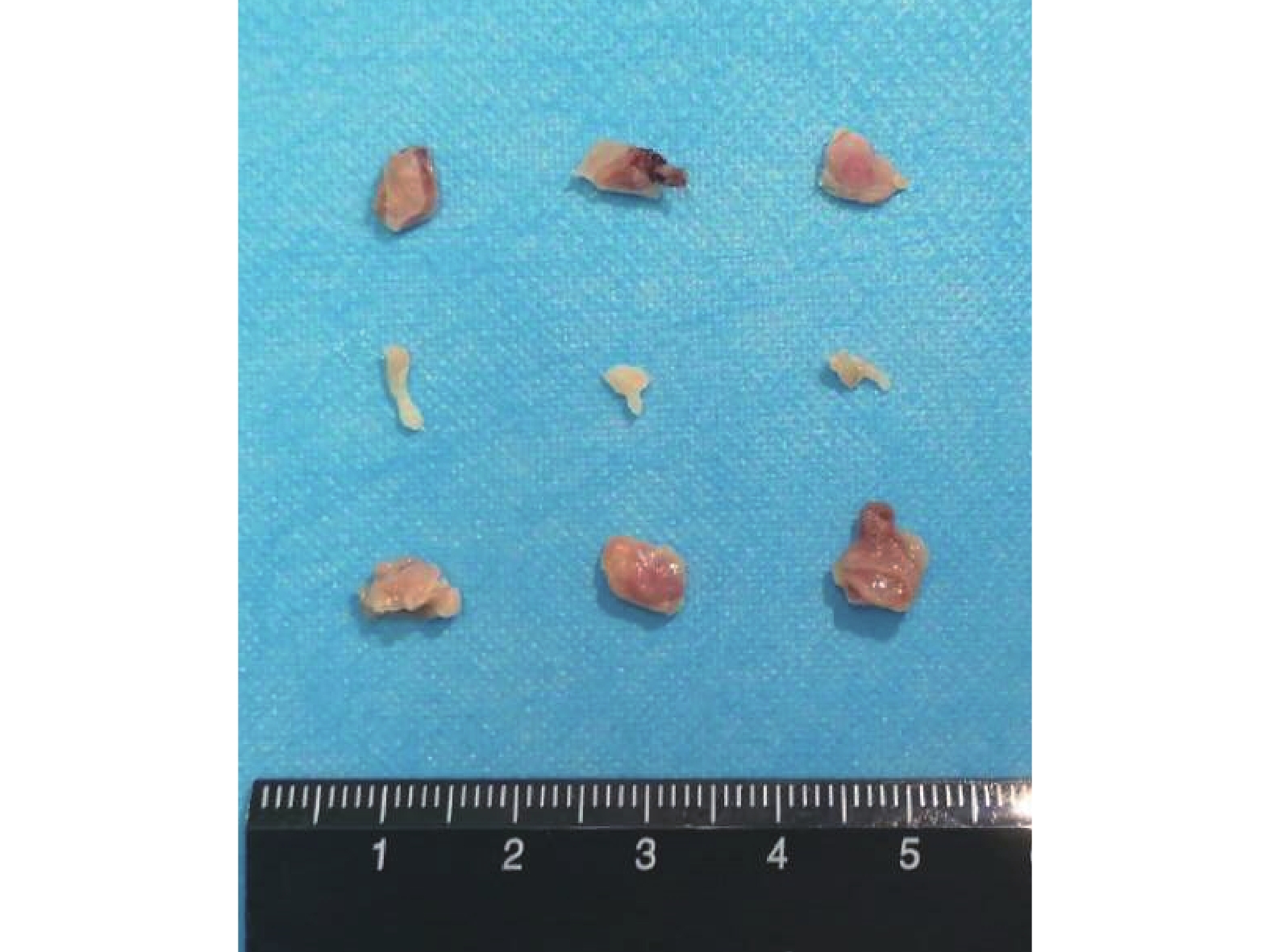
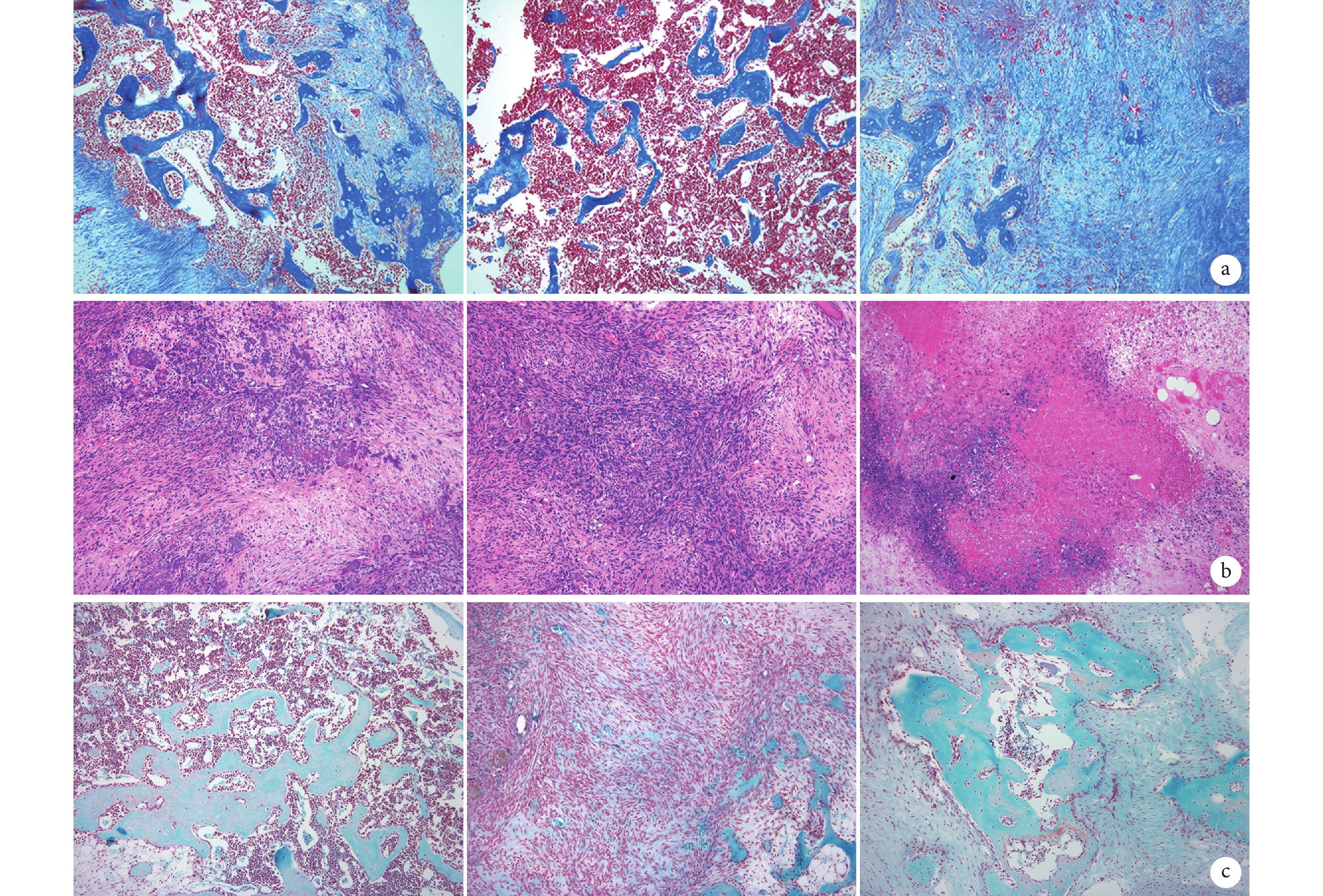
① X 線片觀察:ATRA+Ad-VEGF 組裸鼠植入部位存在明顯骨塊,而 ATRA 組僅可見較小骨塊,Ad-VEGF 組未見明顯骨塊。見圖 8。② 大體觀察:ATRA+Ad-VEGF 組骨塊明顯大于 ATRA 組和 Ad-VEGF 組。見圖 9。③ 組織學觀察:HE、Masson 和番紅 O-固綠染色示,ATRA+Ad-VEGF 組可見大量藍染膠原及成熟骨小梁、骨基質形成以及灰綠色膠原骨組織;ATRA 組可見較多藍染膠原及骨小梁、部分骨基質形成及部分灰綠色的膠原骨組織;而 Ad-VEGF 組僅見少量藍染膠原、大量未成熟前成骨細胞及未成熟骨基質,以及少量灰綠色膠原骨組織。見圖 10。
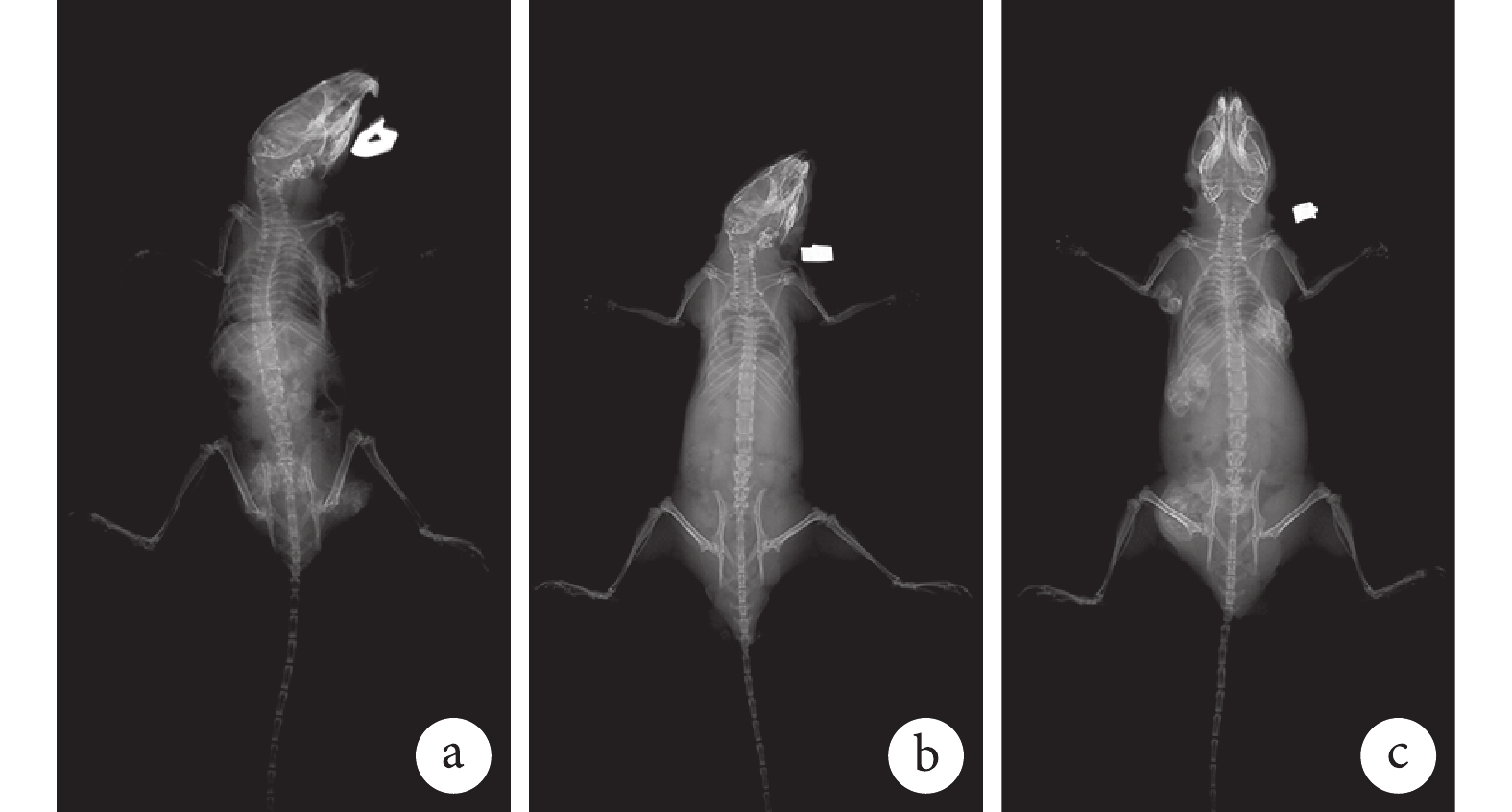 圖8
裸鼠體內植入后 5 周 X 線片觀察
圖8
裸鼠體內植入后 5 周 X 線片觀察
a. ATRA 組;b. Ad-VEGF 組;c. ATRA+Ad-VEGF 組
Figure8. X-ray films of nude mice at 5 weeks after implantationa. ATRA group; b. Ad-VEGF group; c. ATRA+Ad-VEGF group
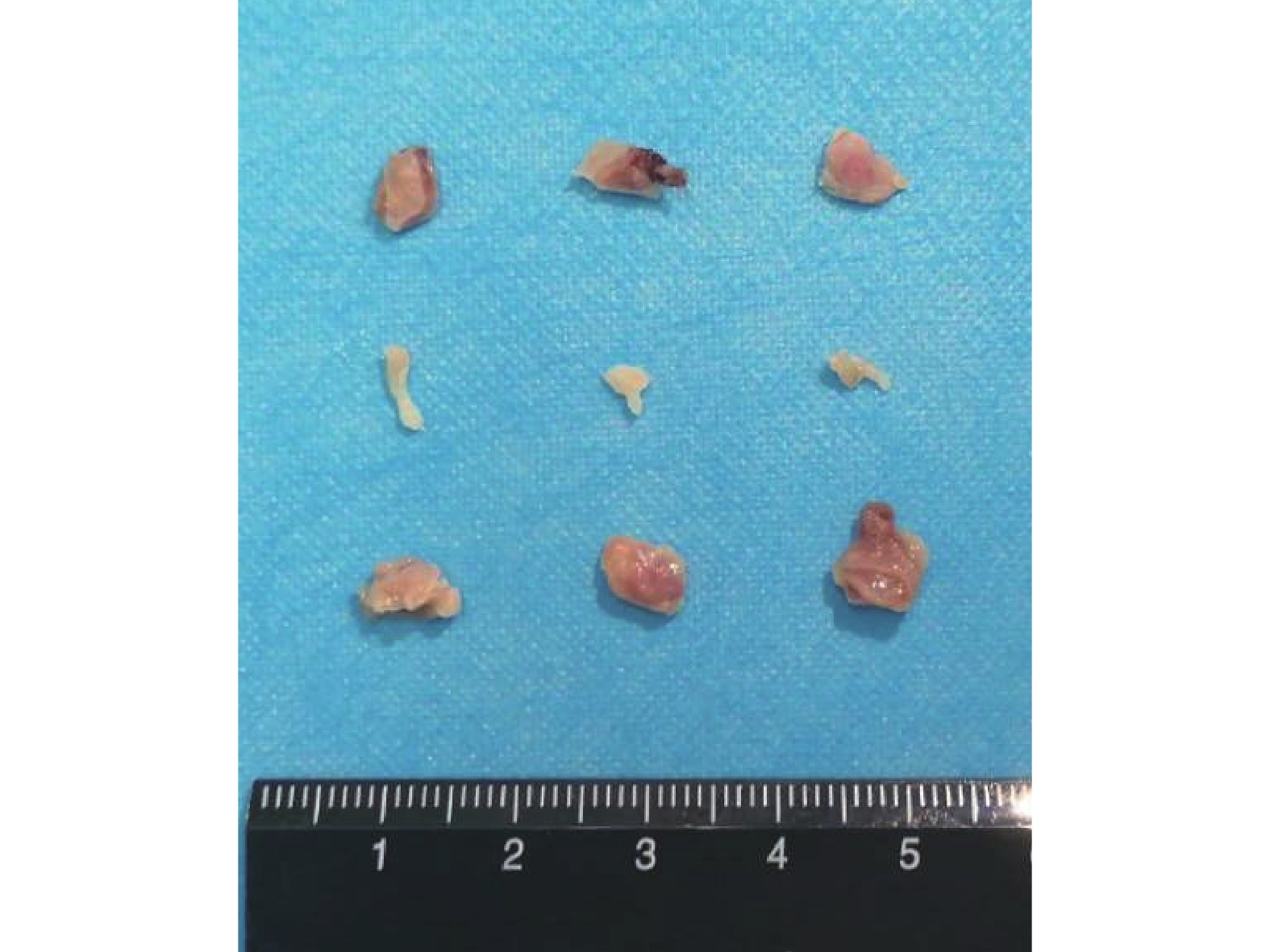 圖9
裸鼠體內植入后 5 周大體觀察
圖9
裸鼠體內植入后 5 周大體觀察
從上至下依次為 ARTA 組、Ad-VEGF 組、ARTA+Ad-VEGF 組
Figure9. Gross observation of bone at 5 weeks after implantation in nude miceFrom the top to bottom for ATRA, Ad-VEGF, and ATRA+Ad-VEGF groups, respectively
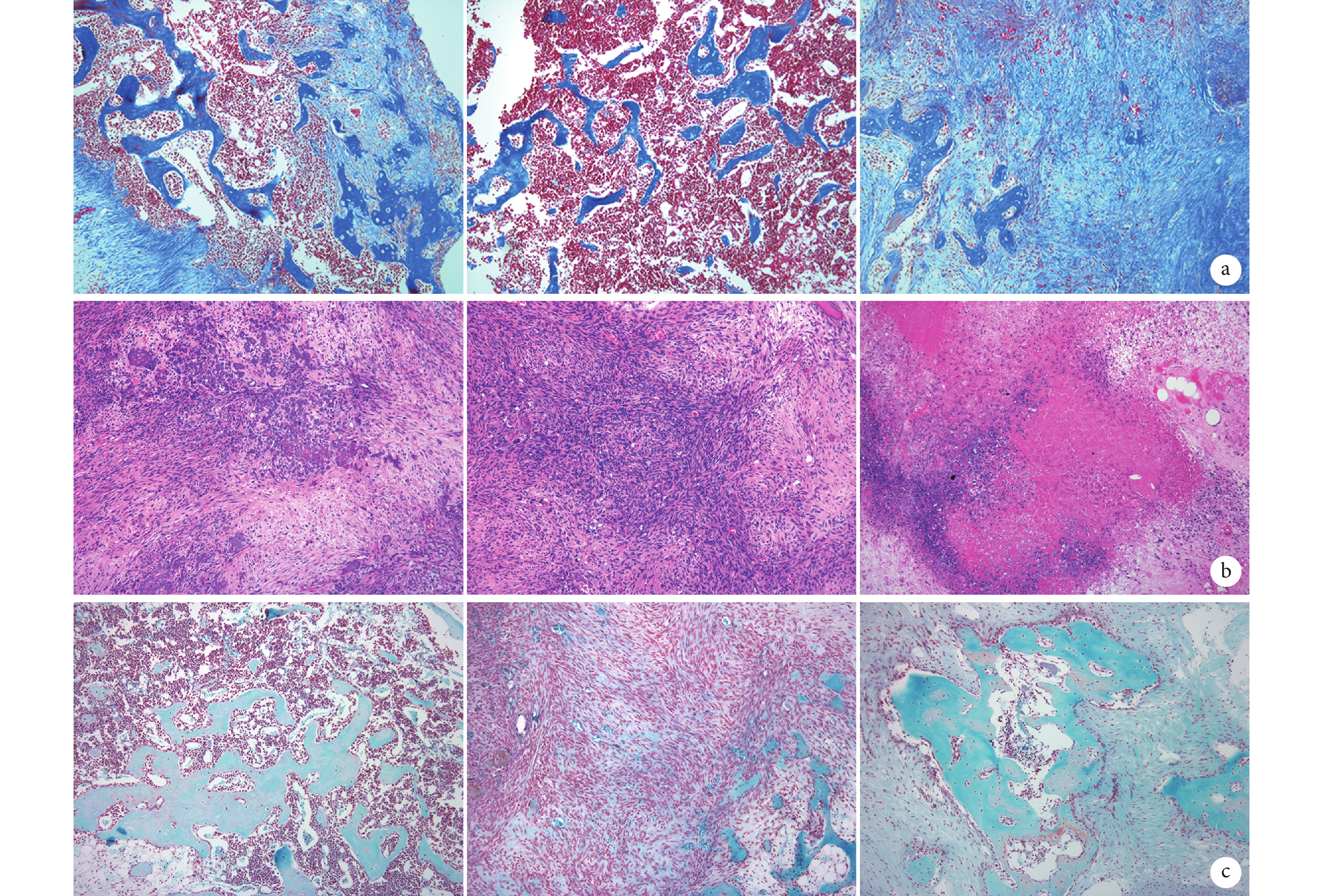 圖10
裸鼠體內植入后 5 周組織學觀察(倒置顯微鏡×100)
圖10
裸鼠體內植入后 5 周組織學觀察(倒置顯微鏡×100)
從左至右依次為 ATRA 組、Ad-VEGF 組、ATRA+Ad-VEGF 組 a. Masson 染色;b. HE 染色;c. 番紅 O-固綠染色
Figure10. Histological observation at 5 weeks after implantation (Inverted microscope×100)From left to right for groups ATRA, Ad-VEGF, and ATRA+Ad-VEGF, respectively a. Masson staining; b. HE staining; c. Saffranin O-fast green staining
3 討論
3.1 ATRA 在成骨分化中的作用
ATRA 作為維生素 A 的活性代謝產物,承擔維生素 A 大部分生物學作用。目前臨床上主要用于治療急性早幼粒細胞白血病、骨髓異常增生[8]。但同時,ATRA 對脊椎動物的生長發育和生理活動有非常重要作用,不僅可以調節神經細胞[9]、足細胞[10]等多種細胞的分化和成熟,對骨骼也有一定調節作用。研究表明,ATRA 在 MSCs、骨肉瘤細胞 143B/MG63、人脂肪來源基質細胞中上調多種成骨相關基因的表達,促進骨形成,并促進基質礦化[11-13]。另外,還有研究表明,適當劑量的 ATRA 能夠刺激骨生長,促進成骨分化[14-15];而高濃度的 ATRA 則會強烈抑制骨生長和形成[15]。流行病學研究表明,維生素 A 通過增加破骨細胞形成和減少皮質骨量來增加骨骼脆性,與骨量減少及骨折風險息息相關[16-17]。以上研究表明 ATRA 對骨形成和骨吸收都產生影響,而骨形成和骨吸收主要是基于成骨細胞與破骨細胞的活性,表明 ATRA 對成骨細胞和破骨細胞均產生影響。
關于 ATRA 在成骨細胞分化中的作用,不僅與研究時使用的細胞類型和品系相關,一定程度上還取決于 ATRA 濃度。研究發現,在 nmol/L 濃度 ATRA 能抑制成骨細胞分化[18],而在 μmol/L 濃度其具有促進成骨分化作用[19-20]。本研究也表明,當 ATRA 濃度為 1.6 μmol/L 時能夠有效刺激 MEFs 成骨分化,即使單獨使用 ATRA 也有成骨作用。因此,適當濃度的 ATRA 能夠刺激骨生長,促進骨形成。
同時,ATRA 在促進成骨分化的過程中上調了成骨相關基因以及蛋白的表達。在本實驗中,ATRA 和 Ad-VEGF 促進了早期成骨標志物 ALP、OPN、Ⅰ 型膠原基因表達,晚期成骨標志物 OCN 基因表達在第 7 天上升。Wan 等[21]在人脂肪來源成體基質細胞中添加 ATRA 后,不僅促進了鼠抗人骨 γ 羧基谷氨酸蛋白(BGLAP)、ALP mRNA 表達,還增強了 Runx2 的轉錄活性,導致礦化結節形成增強,同時抑制基質細胞向脂肪細胞分化。
3.2 VEGF 在成骨分化中的作用
VEGF 由 Senger 發現于 20 世紀 80 年代早期,能夠特異性刺激血管內皮細胞增殖、分裂并誘導血管形成,是目前發現的作用最強的誘導血管生成的細胞因子[22]。眾多研究表明,VEGF 不僅能夠促進血管生長,在骨骼組織中也發揮重要作用。早期在建立小鼠股骨骨折實驗模型時發現,給予外源性 VEGF 能促進血管形成、骨化以及新骨形成[23]。而 Liu 等[24]在 MSCs 中敲減 VEGF,則發現成骨分化降低、成脂分化增加;而敲減 VEGF 受體 1/2 出現同樣現象;當重新加入 VEGF 時,成骨分化卻不受影響。表明 VEGF 以細胞-細胞相互接觸的方式促進成骨分化并抑制成脂分化。Chung 等[25]在對大鼠骨折模型進行修復時發現,缺乏 VEGF 時血管形成數量減少,骨小梁數量和松質骨量明顯降低,間接證明 VEGF 在促進血管形成的同時,也促進了骨生長。表明 VEGF 在骨修復與重塑過程中是不可或缺的細胞因子。本研究中,雖然單獨使用 Ad-VEGF 對成骨分化影響不大,但是 Ad-VEGF 能夠明顯促進 ATRA 的促骨形成作用,二者聯合應用明顯增強了 MSCs 成骨分化能力,ALP 活性以及 ALP、OPN 等成骨相關標志物基因表達均明顯增加。因此,本研究結果表明 ATRA 和 Ad-VEGF 聯合應用可以誘導 MSCs 成骨分化。
在研究 ATRA 和 Ad-VEGF 誘導 MEFs 成骨分化的同時,我們發現二者有促血管形成的趨勢。qRT-PCR 檢測到在早期成骨分化較晚的時間點(即第 7 天),成血管相關標志物基因表達有所升高;同時第 7 天免疫組織化學染色也顯示 VEGF 蛋白弱表達,提示 ATRA 和 Ad-VEGF 可能具有促血管生成作用。而 Weng 等[5]在大鼠牽張成骨模型中給予 ATRA 后,發現 ATRA 不僅增強了成骨分化,而且增強了 VEGF 等成血管相關因子的表達,與本研究結果一致。另外,本研究中我們通過對裸鼠皮下注射經 ATRA、Ad-VEGF 以及二者聯合處理的 MEFs,發現 ATRA 和 Ad-VEGF 聯合處理組形成的骨塊最大,X 線片、大體觀察和組織學染色結果也表明二者聯合應用對成骨分化促進作用最強。
綜上述,本研究體外和小鼠體內異位成骨實驗均表明 ATRA 和 VEGF 能夠促進 MEFs 成骨分化。至于 ATRA 和 VEGF 是直接調節骨形成,還是通過調節血管生成影響骨形成,或者通過其他機制發揮作用,我們將繼續探索,以期為組織工程骨構建提供實驗及理論依據。
作者貢獻:馮瑋負責實驗實施、數據收集整理及文章撰寫;涂小林負責科研課題設計及數據收集整理。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:所有動物實驗均經重慶醫科大學(中國重慶)機構動物護理和使用委員會(IACUC)批準。實驗動物使用許可證號:SYXK(渝)2018-0003。
骨骼損傷后的修復離不開多種生物因子的參與,研究因子間相互作用對于骨修復重建具有重要臨床價值。大量研究表明,構建組織工程骨是治療骨折、骨缺損的理想方法,其三大要素包括種子細胞、生長因子及生物相容性優良的支架材料[1-2]。MSCs 是來源于中胚層的一類多能干細胞,可以成骨、成軟骨、成脂肪細胞分化,是組織工程骨理想的種子細胞。如何利用生物因子有效促進 MSCs 成骨分化、誘導新骨形成并加速骨組織改建,是目前該領域的研究熱點[3-4]。
小鼠胚胎成纖維細胞(mouse embryonic fibroblasts,MEFs)是來源于胚胎的 MSCs,具有多向分化潛能,因其具有自我更新和復制能力強、培養過程中細胞增殖與形態維持能力強的優點,更適合用于 MSCs 定向分化研究。全反式維甲酸(all-trans retinoic acid,ATRA )是維生素 A 的活性代謝產物,能夠通過影響成骨細胞與破骨細胞的活性,從而影響骨形成與骨吸收。而 VEGF 是目前發現的作用最強的誘導血管生成的細胞因子,對于成骨細胞與破骨細胞的增殖、分化及功能活性具有重要調節作用,參與骨骼發育與骨骼形成。研究表明[5-6],ATRA 的應用促進了骨髓基質細胞的成骨分化,也刺激了骨髓基質細胞及 MSCs 中 VEGF 等成血管相關因子的表達。因此,ATRA 和 VEGF 聯合應用可能對 MEFs 定向成骨分化有調節作用。本研究擬通過體外及體內實驗,探討 ATRA 與 VEGF 聯合應用誘導 MEFs 定向成骨分化的效果。報告如下。
1 材料與方法
1.1 實驗動物、細胞及腺病毒
NIH 孕鼠(孕 12~15 d)1只,購自重慶醫科大學實驗動物中心;4~6 周齡無胸腺雌性裸鼠 15 只,購自北京實驗動物研究中心,于重慶醫科大學實驗動物中心飼養。HEK-293 細胞購自中國科學院上海細胞庫;提取的 MEFs 以及重組腺病毒紅色熒光蛋白(recombinant adenovirus-red fluorescent protein,Ad-RFP)、Ad-VEGF 由美國芝加哥大學醫學中心分子腫瘤實驗室 TC He 教授提供。
1.2 主要試劑及儀器
ATRA(采用 DMSO 為溶劑)、茜素紅 S 染色液、地塞米松、β 磷酸甘油二鈉、DMSO(北京索萊寶科技有限公司);BCIP/NBT ALP 顯色試劑盒、ALP 檢測試劑盒(上海碧云天生物技術有限公司);逆轉錄試劑盒、實時熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)試劑盒、Trizol(Takara 公司,日本);骨橋蛋白(osteopontin,OPN)、VEGF 一抗(武漢三鷹生物技術有限公司)。CO2 培養箱、臺式低溫離心機(Thermo 公司,美國);熒光倒置顯微鏡(Nikon 公司,日本);倒置顯微鏡(Olympus 公司,日本);qRT-PCR 儀(Bio-Rad 公司,美國)。
1.3 MEFs 分離培養
取 NIH 孕鼠以脫頸法處死,開腹后將子宮取出轉移至無菌培養皿,PBS 反復沖洗 3 遍。將子宮剪開,暴露每一個胚胎,打開卵黃囊分出整個胎鼠,切去鼠頭、心、肝等器官后,PBS 反復沖洗并轉移至新的無菌培養皿中。將剩余組織剪碎,加入 0.25% 胰蛋白酶 2~3 mL,37℃ 消化約 30 min 至肉眼觀察不到組織碎片,加入 2 倍體積含 10%FBS 的 DMEM 培養基以終止消化。將細胞以 1.5×108 個/L 密度接種于 100 mm 培養皿,37℃ 培養 2~3 d。于 37℃、5% CO2 條件下,用含 10% FBS、100 U/mL 青霉素及 100 μg/mL 鏈霉素的 H-DMEM 培養基培養 MEFs 并傳代,取第 3~4 代細胞備用。根據文獻[7]方法鑒定分離培養的細胞為 MEFs。
1.4 Ad-RFP、Ad-VEGF 擴增及轉染 MEFs
取 HEK-293 細胞于 37℃、5%CO2 條件下,用含 10%FBS、100 U/mL 青霉素及 100 μg/mL 鏈霉素的 H-DMEM 培養基培養并傳代,取第 3~4 代細胞擴增腺病毒。當 HEK-293 細胞生長至約 70% 融合時,在 100 mm 培養皿中加入 10 mL 完全培養基與解凍后的 Ad-RFP、Ad-VEGF (0.5 μL/皿)。36 h 后熒光倒置顯微鏡下觀察,可見 HEK-293 細胞表達大量紅色熒光。當鏡下可見 1/3~1/2 HEK-293 細胞開始脫落并見大量熒光時,輕輕吹打貼壁細胞使其完全脫落,移入 15 mL 離心管中,以離心半徑 10 cm、800 r/min 離心 5 min,棄上清,在液氮及 37℃ 水浴中快速來回凍融細胞 5 次,提取上清液即為有效病毒,?80℃ 分裝保存。
取第 3~4 代 MEFs,以 3×104 個/孔密度接種于 24 孔板,每孔加入 1 mL 完全培養基和 1 μL Ad-RFP 或 1 μL Ad-VEGF,24 h 后在熒光倒置顯微鏡下觀察 Ad-RFP 和 Ad-VEGF 熒光表達情況;于放大 400 倍下隨機選取 5~7 個視野,計數陽性細胞和總細胞,按以下公式計算轉染效率:陽性細胞數/總細胞數×100%。
1.5 ATRA 和 VEGF 對 MEFs 成骨分化的影響
1.5.1 ALP 活性檢測
將 MEFs 以 3×104 個/孔密度接種于 24 孔板,首先檢測單獨 ATRA 或 VEGF 對 MEFs 成骨分化后 ALP 活性的影響。取 6 孔 MEFs,每孔中分別加入 DMSO(a 組)及 0.1、0.2、0.4、0.8、1.6 μmol/L ATRA(分別設為 b、c、d、e、f 組);再取 6 孔 MEFs,每孔中分別加入 DMSO(a1 組)及 0.1、0.5、1.0、1.5、2.0 μL Ad-VEGF(分別設為 b1、c1、d1、e1、f1 組)。各組于處理第 3、5 天按 BCIP/NBT ALP 顯色試劑盒說明書進行 ALP 染色,并使用 ALP 檢測試劑盒定量檢測 ALP 活性。每組重復 3 次,取均值。
然后檢測 ATRA 和 Ad-VEGF 聯合應用是否有協同增強 ALP 活性的功能。取 5 孔 MEFs,每孔中分別加入 DMSO(a2 組)、1.6 μmol/L ATRA(b2 組)、1.6 μmol/L ATRA+0.5 μL Ad-VEGF(c2 組)、1.6 μmol/L ATRA+1.0 μL Ad-VEGF(d2 組)、1.6 μmol/L ATRA+1.5 μL Ad-VEGF(e2 組);再取 5 孔 MEFs,每孔中分別加入 DMSO(a3 組)、1.0 μL Ad-VEGF(b3 組)、1.0 μL Ad-VEGF+0.4 μmol/L ATRA(c3 組)、1.0 μL Ad-VEGF+0.8 μmol/L ATRA(d3 組)、1.0 μL Ad-VEGF+1.6 μmol/L ATRA(e3 組)。培養第 3、5 天時,同上法檢測各組 ALP 活性。
1.5.2 后續實驗分組
根據聯合應用后 ALP 活性檢測結果,選擇最佳劑量濃度組合進行后續實驗。將 MEFs 以 3×104 個/孔密度接種于 24 孔板。實驗分為 4 組,A 組加入 DMSO+Ad-RFP,B 組加入 ATRA,C 組加入 Ad-VEGF,D 組加入 ATRA+Ad-VEGF。其中,ATRA 濃度為 1.6 μmol/L,Ad-RFP 及 Ad-VEGF 用量為 1 μL/孔,DMSO 用量為 10 μL/孔。
1.5.3 qRT-PCR 檢測
各組于處理第 3、7 天使用 Trizol 提取總 RNA,按照逆轉錄試劑盒說明書將各組 RNA 逆轉錄為 cDNA,反應液稀釋 5 倍后作為 qRT-PCR 模板,進行 qPCR 檢測。反應條件:95℃、30 min,95℃、5 min,60℃、30 min,39 個循環;融解曲線分析:溫度 65~95℃。用 2?ΔCt法計算各組成骨相關基因 ALP、Ⅰ 型膠原、OPN、骨鈣素(osteocalcin,OCN)及成血管相關基因 VEGF、血管生成素 1(angiopoietin 1,ANGPT1)、內皮黏蛋白(endomucin,EMCN)的 mRNA 相對表達量。每組重復 3 次,取平均值。各基因引物序列見表 1。
1.5.4 免疫組織化學染色觀察
各組細胞處理第 3、5、7 天時,于 37℃、4% 多聚甲醛固定 15 min,PBS 洗滌 3 遍,然后用 0.5%Triton X-100 于室溫下通透,并用山羊血清封閉 30 min。在培養板中添加 1∶500 稀釋的 OPN、VEGF 一抗,4℃ 孵育過夜;次日添加與一抗對應的辣根過氧化物酶標記二抗溫育 20 min;最后用 DAB 染色液染色 5 min,蘇木素復染細胞核,倒置顯微鏡下觀察。
1.5.5 茜素紅染色觀察
將 MEFs 鋪于 24 孔板,待細胞貼壁后按分組相應處理細胞,然后用成骨誘導培養基(含 10%FBS、100 U/mL 青霉素及 100 μg/mL 鏈霉素、50 mg/L 維生素 C、0.1 μmol/L 地塞米松、10 mmol/L β 磷酸甘油二鈉的 DMEM 培養基)培養,于 14、21 d 時常規行茜素紅染色,檢測鈣鹽沉積。每組實驗重復 3 次。
1.6 ATRA 和 Ad-VEGF 對裸鼠體內異位成骨的影響
1.6.1 實驗分組
將 15 只無胸腺雌性裸鼠隨機分為 3 組,即 ATRA 組、Ad-VEGF 組及 ATRA+Ad-VEGF 組,每組 5 只。取第 3~4 代 MEFs,分別加入 1.6 μmol/L ATRA、1 μL/孔 Ad-VEGF(轉染效率 20% 以上)和 1.6 μmol/L ATRA+1 μL/孔 Ad-VEGF。培養 24 h 觀察到 MEFs 表達紅色熒光后,繼續培養 24 h 讓 ATRA 充分作用細胞。收獲各組細胞并用 PBS 重懸,乙醇消毒后按分組分別注射至無胸腺裸鼠的背側與腹側,每個部位注射 200 μL 細胞(密度為 1×107 個/mL)。
1.6.2 觀測指標
① X 線片觀察:細胞植入后 5 周,乙醚吸入麻醉法處死裸鼠, X 線片觀察各組裸鼠皮下成骨包塊。② 大體觀察:將裸鼠植入部位骨塊取出,比較大小。③ 組織學觀察:取各組骨塊,EDTA-Na2 液脫鈣、10% 甲醛固定并包埋于石蠟中;脫石蠟及再水化后,常規行 HE、Masson 及番紅 O-固綠染色觀察。
1.7 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 Bonferroni t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 Ad-RFP 和 Ad-VEGF 轉染 MEFs 的熒光表達
將擴增后的 Ad-RFP 或 Ad-VEGF 轉染 MEFs 24 h 后熒光倒置顯微鏡觀察示,MEFs 發出紅色熒光,分布均勻。Ad-RFP 和 Ad-VEGF 的轉染效率分別約 50% 和 20%,表明已擴增的 Ad-RFP 和 Ad-VEGF 可以有效轉染 MEFs。見圖 1。
 圖1
Ad-RFP 及 Ad-VEGF 轉染 MEFs 的熒光表達(熒光倒置顯微鏡×100)
圖1
Ad-RFP 及 Ad-VEGF 轉染 MEFs 的熒光表達(熒光倒置顯微鏡×100)
a. Ad-RFP 轉染的 MEFs;b. Ad-VEGF 轉染的 MEFs
Figure1. Fluorescence expression of MEFs transfected with Ad-RFP or Ad-VEGF (Fluorescence inverted microscope×100)a. Ad-RFP transfected MEFs; b. Ad-VEGF transfected MEFs
2.2 ATRA 和 Ad-VEGF 聯合應用對 MEFs 成骨分化的影響
2.2.1 ALP 活性檢測
① 培養第 3、5 天,ATRA 和 Ad-VEGF 均呈濃度或劑量依賴性增強 MEFs 中 ALP 活性,其中 ATRA 作用更強;與 a、a1 組相比,即使最小濃度 ATRA(0.1 μmol/L)也具有顯著 ALP 活性促進作用,0.5 μL 以上 Ad-VEGF 劑量也有 ALP 活性促進作用,差異均有統計學意義(P<0.05)。但是當 Ad-VEGF 使用劑量在 1.0 μL 以上時,d1、e1、f1 組間差異無統計學意義(P>0.05)。見圖 2。②ATRA 和 Ad-VEGF 聯合應用時,Ad-VEGF 可明顯促進 ATRA 誘導的 ALP 活性,c2、d2、e2 組 ALP 活性顯著高于 a2、b2 組(P<0.05),c2、d2、e2 組間差異無統計學意義(P>0.05)。ATRA 也可促進 Ad-VEGF 誘導的 ALP 活性,隨著 ATRA 濃度增加 ALP 活性也逐漸增強,e3 組 ATRA 濃度為 1.6 μmol/L 時顯示出最強的 ALP 活性,與其余各組比較差異均有統計學意義(P<0.05)。見圖 3。表明 ATRA 和 Ad-VEGF 聯合應用可能具有促進 MEFs 成骨分化的功能。因此,本研究選擇 1.6 μmol/L ATRA 和 1.0 μL Ad-VEGF 進行后續實驗。
 圖2
ATRA 和 Ad-VEGF 單獨應用促進 ALP 活性觀察
圖2
ATRA 和 Ad-VEGF 單獨應用促進 ALP 活性觀察
a. ATRA 從左至右依次為 a、b、c、d、e、f 組,上下 2 排分別為培養 3、5 d;b. Ad-VEGF 從左至右依次為 a1、b1、c1、d1、e1、f1 組,上下 2 排分別為培養 3、5 d;c. ATRA 促進 ALP 活性定量檢測;d. Ad-VEGF 促進 ALP 活性定量檢測
Figure2. ATRA and Ad-VEGF applied alone to promote ALP activitya. ATRA From left to right for groups a, b, c, d, e, and f, respectively; and the upper and the lower rows were cultured for 3 or 5 days, respectively; b. Ad-VEGF From left to right for groups a1, b1, c1, d1, e1, and f1, respectively; and the upper and lower rows were cultured for 3 or 5 days, respectively; c. Quantitative detection of ALP activity after cultured with ATRA; d. Quantitative detection of ALP activity after cultured with Ad-VEGF
 圖3
ATRA 和 Ad-VEGF 聯合應用促進 ALP 活性觀察
圖3
ATRA 和 Ad-VEGF 聯合應用促進 ALP 活性觀察
a. 1.6 μmol/L ATRA 聯合不同劑量 Ad-VEGF 從左至右依次為 a2、b2、c2、d2、e2 組,上下 2 排分別為培養 3、5 d;b. 1.0 μL Ad-VEGF 聯合不同濃度 ATRA 從左至右依次為 a3、b3、c3、d3、e3 組,上下 2 排分別為培養 3、5 d;c. 1.6 μmol/L ATRA 聯合不同劑量 Ad-VEGF 促進 ALP 活性定量檢測;d. 1.0 μL Ad-VEGF 聯合不同濃度 ATRA 促進 ALP 活性定量檢測
Figure3. ATRA and Ad-VEGF were combined to promote ALP activitya. 1.6 μmol/L ATRA combined with different doses of Ad-VEGF From left to right for groups a2, b2, c2, d2, and e2, respectively; and the upper and the lower rows were cultured for 3 or 5 days,respectively; b. 1.0 μL Ad-VEGF combined with different concentrations of ATRA From left to right for groups a3, b3, c3, d3, and e3, respectively; and the upper and the lower rows were cultured for 3 or 5 days, respectively; c. Quantitative detection of ALP activity after cultured with 1.6 μmol/L ATRA and different doses of Ad-VEGF; d. Quantitative detection of ALP activity after cultured with 1.0 μL Ad-VEGF and different concentrations of ATRA
2.2.2 qRT-PCR 檢測
處理第 3、7 天,D 組早期成骨相關標志物 ALP、Ⅰ 型膠原、OPN mRNA 相對表達量均顯著高于 A、B、C 組,且 D 組 7 d 時顯著高于 3 d 時,差異均有統計學意義(P<0.05)。但各組晚期成骨相關標志物 OCN mRNA 均呈低表達,D 組 7 d 時 OCN mRNA 相對表達量顯著高于其余 3 組且高于 D 組 3 d 時,差異均有統計學意義(P<0.05)。處理 3、7 d,C、D 組成血管相關標志物 VEGF、EMCN、ANGPT1 mRNA 均呈高表達,D 組 7 d 時 VEGF、EMCN mRNA 相對表達量顯著高于 C 組,且 D 組 7 d 各成血管相關標志物 mRNA 相對表達量高于 3 d 時,差異均有統計學意義(P<0.05)。見圖 4。
 圖4
qRT-PCR 檢測各組成骨或成血管相關標志物 mRNA 相對表達量
圖4
qRT-PCR 檢測各組成骨或成血管相關標志物 mRNA 相對表達量
a. ALP;b. Ⅰ 型膠原;c. OPN;d. OCN;e. VEGF;f. ANGPT1;g. EMCN
Figure4. The relative mRNA expressions of osteogenesis- and angiogenesis-related markers detected by qRT-PCR in each groupa. ALP; b. Collagen typeⅠ; c. OPN; d. OCN; e. VEGF; f. ANGPT1; g. EMCN
2.2.3 免疫組織化學染色觀察
隨時間延長,各組 OPN 蛋白和 VEGF 蛋白表達均逐漸增加。各時間點 D 組 OPN 蛋白表達均顯著強于其余各組;C 組 VEGF 蛋白表達顯著強于其余各組,但 D 組也有較高 VEGF 蛋白表達。見圖 5、6。
 圖5
免疫組織化學染色觀察各組 OPN 蛋白表達(倒置顯微鏡×100)
圖5
免疫組織化學染色觀察各組 OPN 蛋白表達(倒置顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 3 d;b. 5 d;c. 7 d
Figure5. The expression of OPN protein in each group by immunohistochemical staining (Inverted microscope×100)From left to right for groups A, B, C, and D, respectively a. At 3 days; b. At 5 days; c. At 7 days
 圖6
免疫組織化學染色觀察各組 VEGF 蛋白表達(倒置顯微鏡×100)
圖6
免疫組織化學染色觀察各組 VEGF 蛋白表達(倒置顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 3 d;b. 5 d;c. 7 d
Figure6. The expression of VEGF protein in each group by immunohistochemical staining (Inverted microscope×100)From left to right for groups A, B, C, and D, respectively a. At 3 days; b. At 5 days; c. At 7 days
2.2.4 茜素紅染色觀察
成骨誘導培養 14、21 d 茜素紅染色示,D 組鈣鹽沉積效果明顯強于其余各組,且 21 d 時鈣鹽沉積效果更強;B、C 組均未出現明顯的鈣鹽沉積。見圖 7。
 圖7
成骨誘導各時間點茜素紅染色觀察各組鈣鹽沉積(倒置顯微鏡×100)
圖7
成骨誘導各時間點茜素紅染色觀察各組鈣鹽沉積(倒置顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 14 d;b. 21 d
Figure7. Observation of calcium deposition by alizarin red staining at each time point after osteogenesis induction (Inverted microscope×100)From left to right for groups A, B, C, and D, respectively a. At 14 days; b. At 21 days
2.3 ATRA 和 Ad-VEGF 對裸鼠體內異位成骨的影響
① X 線片觀察:ATRA+Ad-VEGF 組裸鼠植入部位存在明顯骨塊,而 ATRA 組僅可見較小骨塊,Ad-VEGF 組未見明顯骨塊。見圖 8。② 大體觀察:ATRA+Ad-VEGF 組骨塊明顯大于 ATRA 組和 Ad-VEGF 組。見圖 9。③ 組織學觀察:HE、Masson 和番紅 O-固綠染色示,ATRA+Ad-VEGF 組可見大量藍染膠原及成熟骨小梁、骨基質形成以及灰綠色膠原骨組織;ATRA 組可見較多藍染膠原及骨小梁、部分骨基質形成及部分灰綠色的膠原骨組織;而 Ad-VEGF 組僅見少量藍染膠原、大量未成熟前成骨細胞及未成熟骨基質,以及少量灰綠色膠原骨組織。見圖 10。
 圖8
裸鼠體內植入后 5 周 X 線片觀察
圖8
裸鼠體內植入后 5 周 X 線片觀察
a. ATRA 組;b. Ad-VEGF 組;c. ATRA+Ad-VEGF 組
Figure8. X-ray films of nude mice at 5 weeks after implantationa. ATRA group; b. Ad-VEGF group; c. ATRA+Ad-VEGF group
 圖9
裸鼠體內植入后 5 周大體觀察
圖9
裸鼠體內植入后 5 周大體觀察
從上至下依次為 ARTA 組、Ad-VEGF 組、ARTA+Ad-VEGF 組
Figure9. Gross observation of bone at 5 weeks after implantation in nude miceFrom the top to bottom for ATRA, Ad-VEGF, and ATRA+Ad-VEGF groups, respectively
 圖10
裸鼠體內植入后 5 周組織學觀察(倒置顯微鏡×100)
圖10
裸鼠體內植入后 5 周組織學觀察(倒置顯微鏡×100)
從左至右依次為 ATRA 組、Ad-VEGF 組、ATRA+Ad-VEGF 組 a. Masson 染色;b. HE 染色;c. 番紅 O-固綠染色
Figure10. Histological observation at 5 weeks after implantation (Inverted microscope×100)From left to right for groups ATRA, Ad-VEGF, and ATRA+Ad-VEGF, respectively a. Masson staining; b. HE staining; c. Saffranin O-fast green staining
3 討論
3.1 ATRA 在成骨分化中的作用
ATRA 作為維生素 A 的活性代謝產物,承擔維生素 A 大部分生物學作用。目前臨床上主要用于治療急性早幼粒細胞白血病、骨髓異常增生[8]。但同時,ATRA 對脊椎動物的生長發育和生理活動有非常重要作用,不僅可以調節神經細胞[9]、足細胞[10]等多種細胞的分化和成熟,對骨骼也有一定調節作用。研究表明,ATRA 在 MSCs、骨肉瘤細胞 143B/MG63、人脂肪來源基質細胞中上調多種成骨相關基因的表達,促進骨形成,并促進基質礦化[11-13]。另外,還有研究表明,適當劑量的 ATRA 能夠刺激骨生長,促進成骨分化[14-15];而高濃度的 ATRA 則會強烈抑制骨生長和形成[15]。流行病學研究表明,維生素 A 通過增加破骨細胞形成和減少皮質骨量來增加骨骼脆性,與骨量減少及骨折風險息息相關[16-17]。以上研究表明 ATRA 對骨形成和骨吸收都產生影響,而骨形成和骨吸收主要是基于成骨細胞與破骨細胞的活性,表明 ATRA 對成骨細胞和破骨細胞均產生影響。
關于 ATRA 在成骨細胞分化中的作用,不僅與研究時使用的細胞類型和品系相關,一定程度上還取決于 ATRA 濃度。研究發現,在 nmol/L 濃度 ATRA 能抑制成骨細胞分化[18],而在 μmol/L 濃度其具有促進成骨分化作用[19-20]。本研究也表明,當 ATRA 濃度為 1.6 μmol/L 時能夠有效刺激 MEFs 成骨分化,即使單獨使用 ATRA 也有成骨作用。因此,適當濃度的 ATRA 能夠刺激骨生長,促進骨形成。
同時,ATRA 在促進成骨分化的過程中上調了成骨相關基因以及蛋白的表達。在本實驗中,ATRA 和 Ad-VEGF 促進了早期成骨標志物 ALP、OPN、Ⅰ 型膠原基因表達,晚期成骨標志物 OCN 基因表達在第 7 天上升。Wan 等[21]在人脂肪來源成體基質細胞中添加 ATRA 后,不僅促進了鼠抗人骨 γ 羧基谷氨酸蛋白(BGLAP)、ALP mRNA 表達,還增強了 Runx2 的轉錄活性,導致礦化結節形成增強,同時抑制基質細胞向脂肪細胞分化。
3.2 VEGF 在成骨分化中的作用
VEGF 由 Senger 發現于 20 世紀 80 年代早期,能夠特異性刺激血管內皮細胞增殖、分裂并誘導血管形成,是目前發現的作用最強的誘導血管生成的細胞因子[22]。眾多研究表明,VEGF 不僅能夠促進血管生長,在骨骼組織中也發揮重要作用。早期在建立小鼠股骨骨折實驗模型時發現,給予外源性 VEGF 能促進血管形成、骨化以及新骨形成[23]。而 Liu 等[24]在 MSCs 中敲減 VEGF,則發現成骨分化降低、成脂分化增加;而敲減 VEGF 受體 1/2 出現同樣現象;當重新加入 VEGF 時,成骨分化卻不受影響。表明 VEGF 以細胞-細胞相互接觸的方式促進成骨分化并抑制成脂分化。Chung 等[25]在對大鼠骨折模型進行修復時發現,缺乏 VEGF 時血管形成數量減少,骨小梁數量和松質骨量明顯降低,間接證明 VEGF 在促進血管形成的同時,也促進了骨生長。表明 VEGF 在骨修復與重塑過程中是不可或缺的細胞因子。本研究中,雖然單獨使用 Ad-VEGF 對成骨分化影響不大,但是 Ad-VEGF 能夠明顯促進 ATRA 的促骨形成作用,二者聯合應用明顯增強了 MSCs 成骨分化能力,ALP 活性以及 ALP、OPN 等成骨相關標志物基因表達均明顯增加。因此,本研究結果表明 ATRA 和 Ad-VEGF 聯合應用可以誘導 MSCs 成骨分化。
在研究 ATRA 和 Ad-VEGF 誘導 MEFs 成骨分化的同時,我們發現二者有促血管形成的趨勢。qRT-PCR 檢測到在早期成骨分化較晚的時間點(即第 7 天),成血管相關標志物基因表達有所升高;同時第 7 天免疫組織化學染色也顯示 VEGF 蛋白弱表達,提示 ATRA 和 Ad-VEGF 可能具有促血管生成作用。而 Weng 等[5]在大鼠牽張成骨模型中給予 ATRA 后,發現 ATRA 不僅增強了成骨分化,而且增強了 VEGF 等成血管相關因子的表達,與本研究結果一致。另外,本研究中我們通過對裸鼠皮下注射經 ATRA、Ad-VEGF 以及二者聯合處理的 MEFs,發現 ATRA 和 Ad-VEGF 聯合處理組形成的骨塊最大,X 線片、大體觀察和組織學染色結果也表明二者聯合應用對成骨分化促進作用最強。
綜上述,本研究體外和小鼠體內異位成骨實驗均表明 ATRA 和 VEGF 能夠促進 MEFs 成骨分化。至于 ATRA 和 VEGF 是直接調節骨形成,還是通過調節血管生成影響骨形成,或者通過其他機制發揮作用,我們將繼續探索,以期為組織工程骨構建提供實驗及理論依據。
作者貢獻:馮瑋負責實驗實施、數據收集整理及文章撰寫;涂小林負責科研課題設計及數據收集整理。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:所有動物實驗均經重慶醫科大學(中國重慶)機構動物護理和使用委員會(IACUC)批準。實驗動物使用許可證號:SYXK(渝)2018-0003。