引用本文: 高海明, 王波, 曹家全, 李秀軍, 黃陳翼, 吳佳奇, 劉宗超. 自體注射型富血小板纖維蛋白聯合 BMSCs 治療大鼠坐骨神經損傷的實驗研究. 中國修復重建外科雜志, 2020, 34(5): 637-642. doi: 10.7507/1002-1892.201909061 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
周圍神經損傷后病理過程極其復雜,神經細胞再生速度緩慢、再生神經與周圍組織粘連、神經肌肉萎縮及運動終板退化變性等因素均制約著損傷神經組織的恢復,是顯微外科面臨的臨床難題之一[1]。干細胞移植目前已成為一種新的治療神經系統疾病途徑,其中 BMSCs 作為種子細胞之一,在周圍神經損傷修復中起重要作用[2-3]。但其仍存在很多不足,如體外培養的 MSCs 歸巢能力下降,移植后細胞生存能力不足等。隨著血小板濃縮生物材料的發展,注射型富血小板纖維蛋白(injectable platelet rich fibrin,i-PRF)被研發并應用于臨床[4]。與富血小板血漿相比,i-PRF 能釋放更多的細胞因子,如 TGF-β1、VEGF、bFGF 等,誘導 MSCs 及成纖維細胞分化的潛力更大[5]。本研究擬分析 i-PRF 與 BMSCs 聯合使用修復大鼠坐骨神經損傷的療效,以期為臨床治療周圍神經損傷提供理論依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
10~15 日齡 SD 乳鼠 6 只,體質量(30±5)g;2 月齡 SD 大鼠 24 只,體質量(210±15)g;雌雄不限,均購自西南醫科大學動物實驗中心。
DMEM 培養基(HyClone 公司,美國);FBS(BI 公司,以色列);PBS 緩沖液、TBS 緩沖液、BCA 蛋白濃度檢測試劑盒、RIPA 裂解液、蛋白酶抑制劑、SDS-PAGE 配膠試劑盒(上海碧云天生物技術有限公司);小鼠抗人 β-catenin、N-cadherin、巢蛋白(Nestin)、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)單克隆抗體(Abcam 公司,英國);山羊抗小鼠 Dylight 488 二抗(BD 公司,美國);聚偏氟乙烯膜(Millipore 公司,美國)。倒置相差顯微鏡(Olympus 公司,日本);酶標儀(Hach 公司,美國);電泳儀、電轉儀、凝膠成像儀(Bio-Rad 公司,美國);透射電鏡(Hitachi 公司,日本)。
1.2 大鼠 BMSCs 分離、培養及傳代
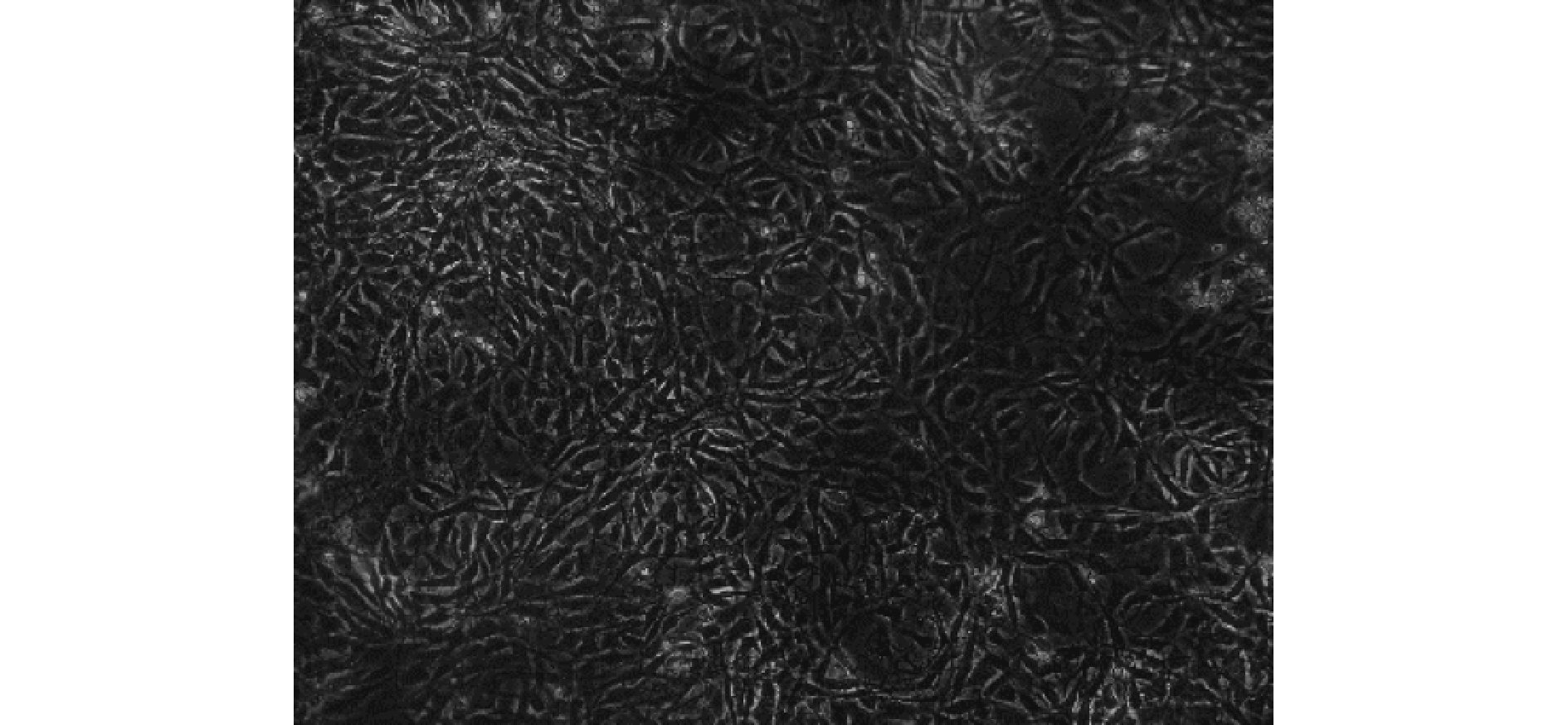
取 6 只乳鼠脫頸法處死后暴露出雙側脛骨骨髓腔,用 1 mL 注射器吸取 DMEM 培養基從干骺端進針沖洗骨髓,于離心管中反復吹打成細胞懸液。按照本課題組既往使用的密度梯度離心法[6]進行細胞分離、培養及傳代。培養后 3 周可獲得純化的第 4 代 BMSCs 群。見圖 1。
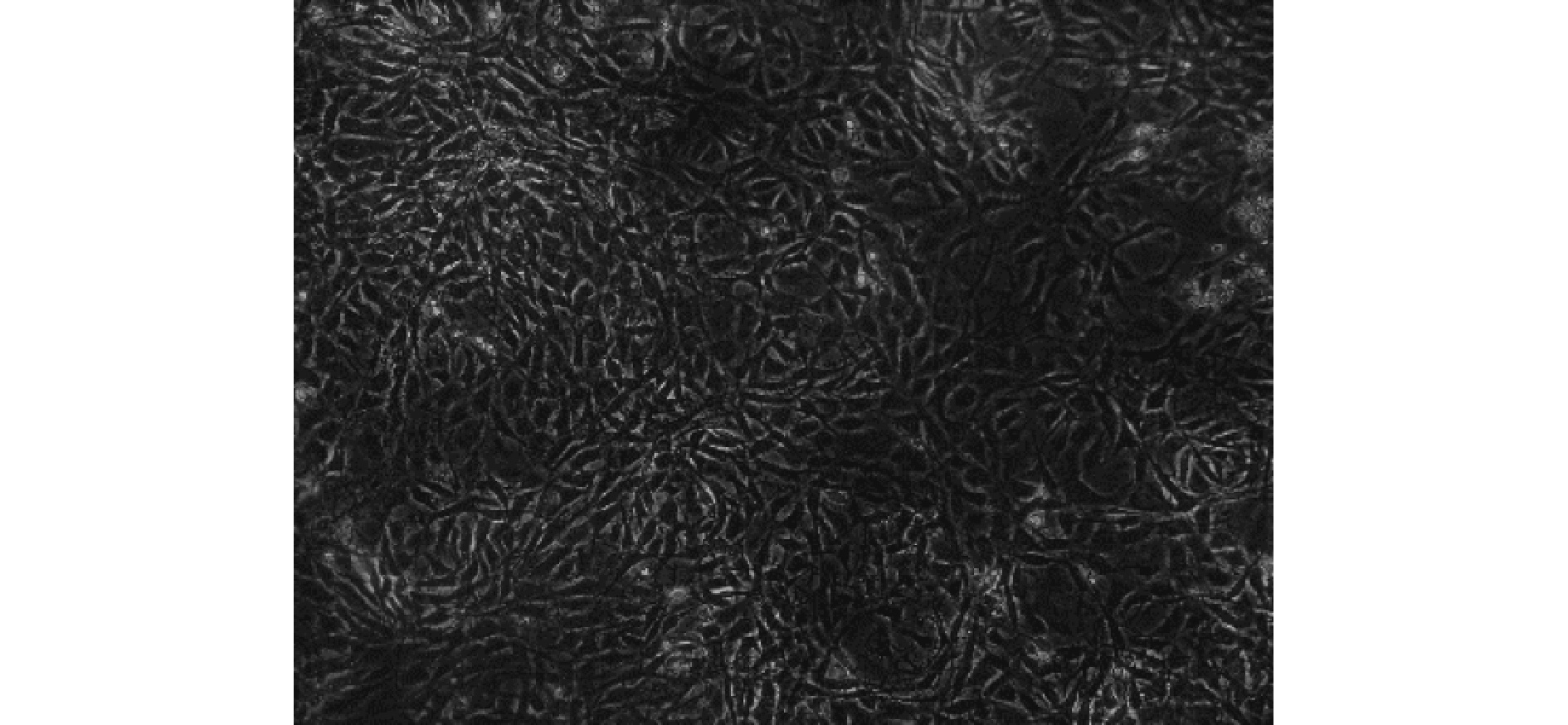 圖1
第 4 代 BMSCs 形態學觀察(倒置相差顯微鏡×100)
Figure1.
Morphology observation of the 4th generation BMSCs (Inverted phase contrast microscope×100)
圖1
第 4 代 BMSCs 形態學觀察(倒置相差顯微鏡×100)
Figure1.
Morphology observation of the 4th generation BMSCs (Inverted phase contrast microscope×100)
1.3 i-PRF 的制備
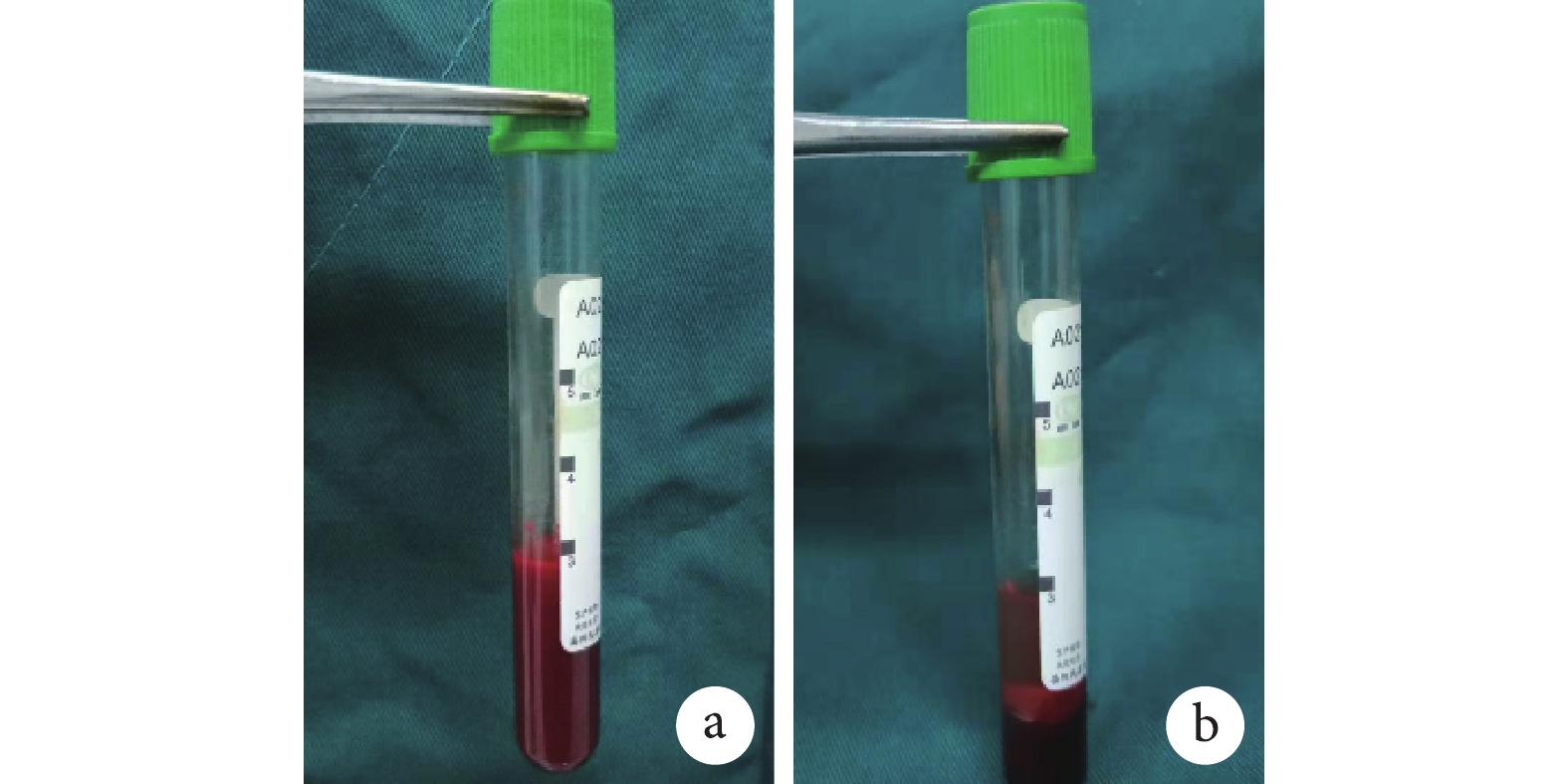
按照文獻[7-8]報道的改良低速離心法制備 i-PRF。操作步驟:用眼眶采血法采集 24 只 2 月齡 SD 大鼠靜脈血 3 mL/只于無抗凝劑的專用真空管,低速(60×g)離心 3 min 得到介于頂部漿液層和底部紅細胞層之間的 i-PRF。由于離心管內不含二氧化硅促凝成分,離心后是液體形式的血小板產物,i-PRF 不必使用抗凝血劑,因此必須在纖維蛋白凝塊形成之前 15 min 內使用。見圖 2。
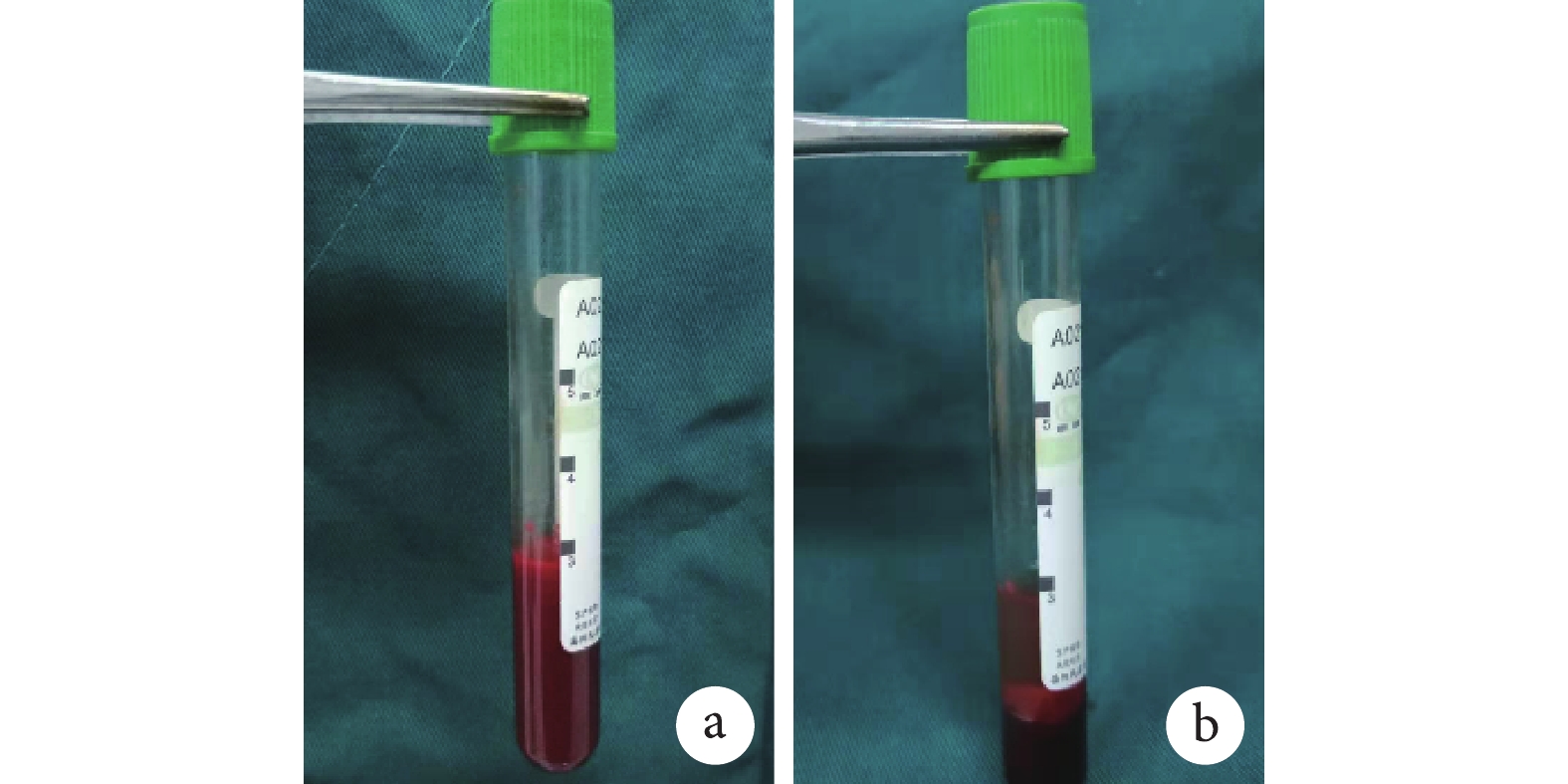 圖2
改良低速離心法制備 i-PRF
圖2
改良低速離心法制備 i-PRF
a. 離心前;b. 離心后
Figure2. Preparation of i-PRF by improved low-speed centrifugationa. Before centrifugation; b. After centrifugation
1.4 實驗分組及方法
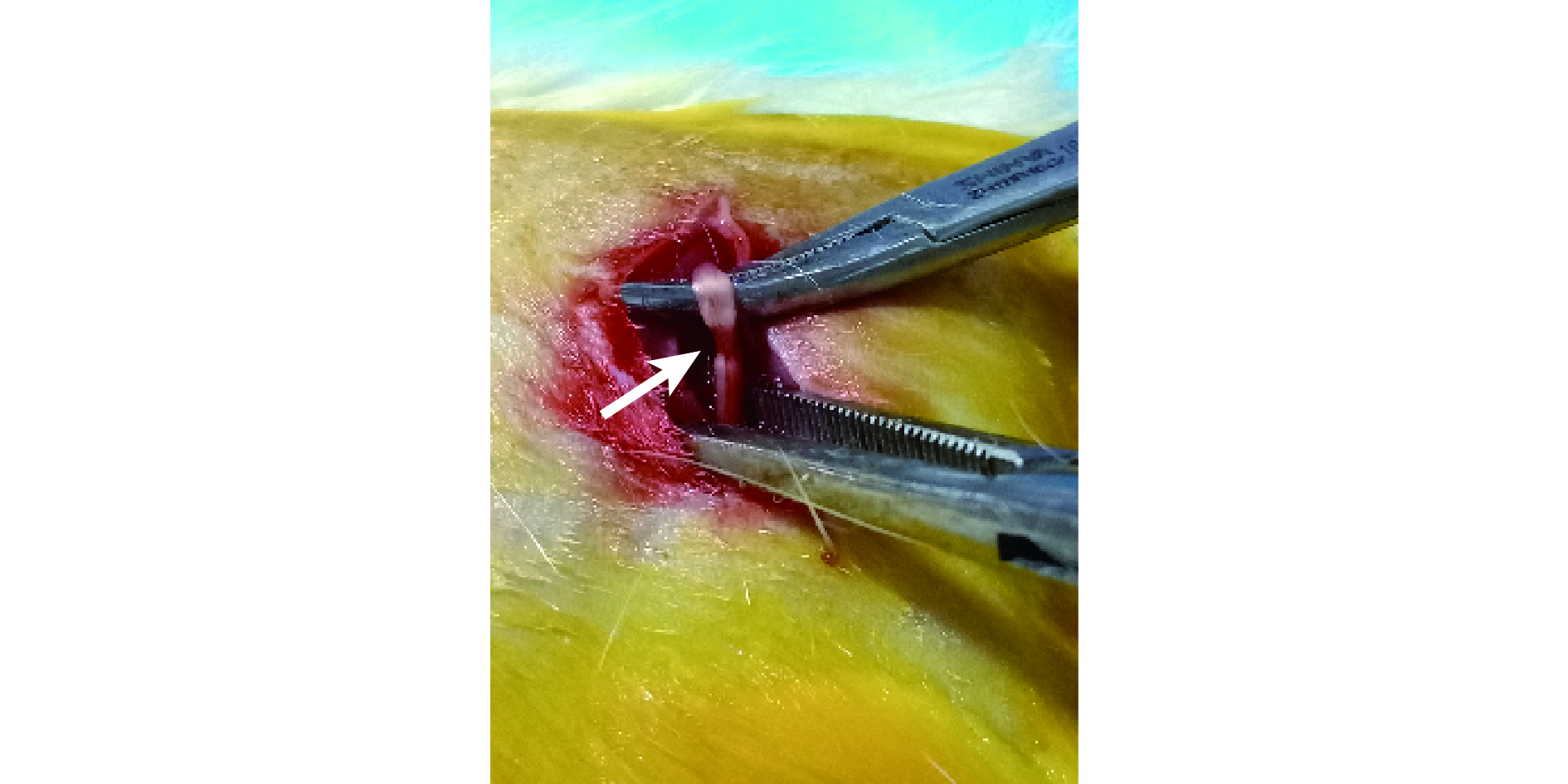
將上述 24 只 2 月齡 SD 大鼠隨機分為 A、B、C、D 4 組,每組 6 只。采用 Gigo-Benato 等[9]的改良擠壓損傷法制作大鼠坐骨神經Ⅲ度損傷模型。具體方法:以 3% 戊巴比妥(1 mL/100 g)腹腔注射麻醉大鼠,隨機選取一側后肢后側以 4% 硫化鈉脫毛,無菌操作下將術側坐骨神經暴露于分叉點處,止血鉗于第 2 個齒痕上擠壓約 45 s,造成寬度為 2 mm 的擠壓傷,患處神經形態呈扁薄狀。見圖 3。造模成功后,A、B、C、D 組分別于損傷部位鞘膜內注射 BMSCs 懸液+自體 i-PRF、自體 i-PRF、BMSCs 懸液、生理鹽水各 500 μL,其中 BMSCs 懸液濃度為(1.0~2.0)×105 個/100 μL。常規縫合切口及預防感染處理,術后觀察大鼠健康狀態及排斥反應。
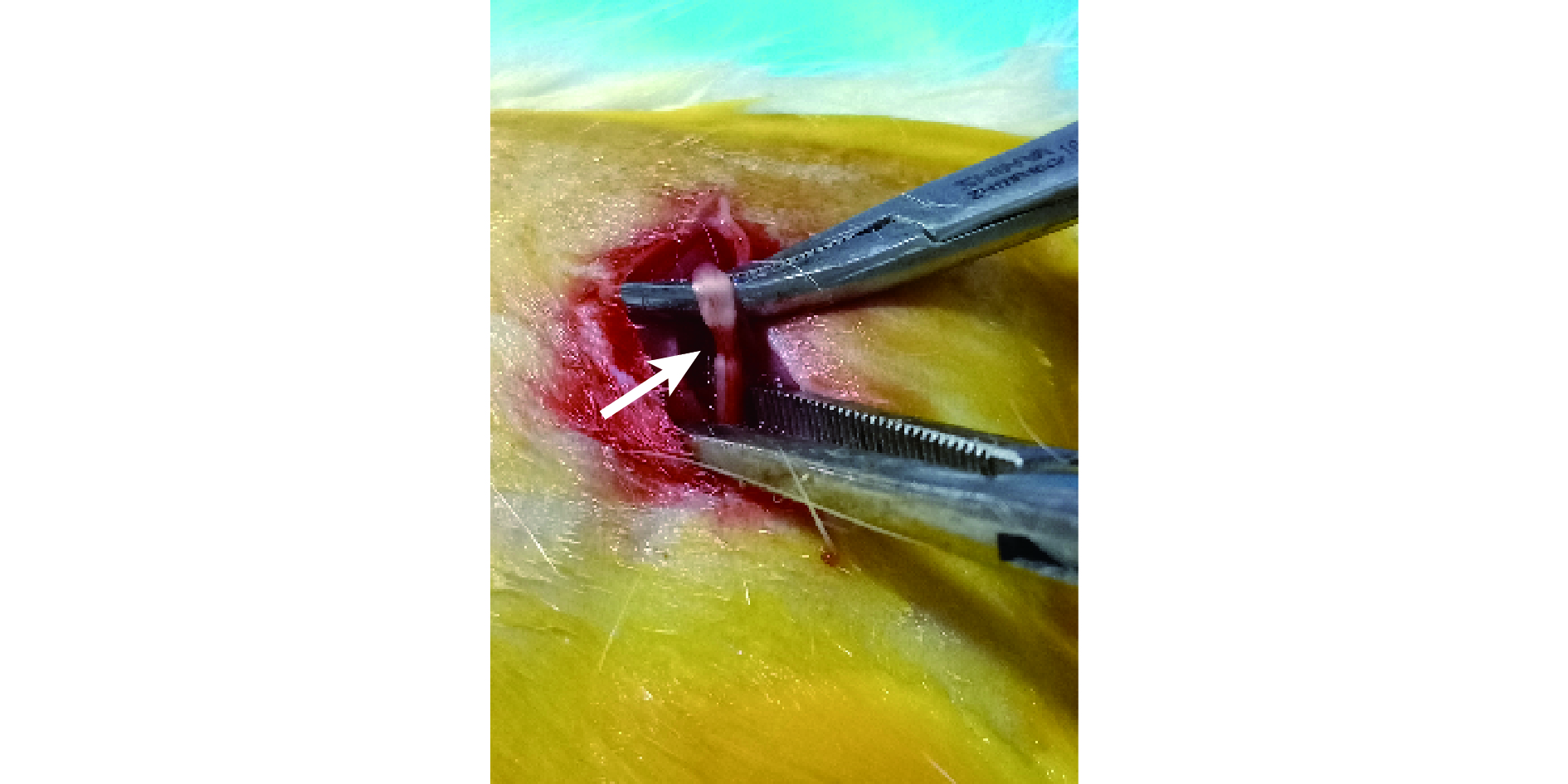 圖3
改良擠壓損傷法制備大鼠坐骨神經損傷模型
圖3
改良擠壓損傷法制備大鼠坐骨神經損傷模型
箭頭示寬度約 2 mm 的扁狀擠壓傷
Figure3. Sciatic nerve injury model established by improved crush injury methodArrow indicated a flat crush injury with a width of about 2 mm
1.5 觀測指標
1.5.1 大鼠神經功能評估
術后 1~8 周每周采用 BBB 評分法[10]評價大鼠患肢神經功能恢復情況。
1.5.2 HE 染色觀察
術后 2 個月以脫頸法處死各組大鼠,獲取術側坐骨神經組織,以 10% 多聚甲醛室溫下固定標本 24 h,梯度乙醇脫水,石蠟包埋切片,二甲苯脫蠟后 HE 染色觀察各組大鼠坐骨神經組織結構變化。
1.5.3 透射電鏡觀察
取上述部分坐骨神經組織,經 3% 戊二醛預固定、1% 四氧化鋨再固定、丙酮逐級脫水后,先后經脫水劑和環氧樹脂(型號為 Epon812)滲透液滲透,比例分別為 3∶1、1∶1、1∶3,每步 30~60 min。將滲透好的樣品塊置入適當模具中,包埋后超薄切片機切片(片厚 50 nm),醋酸鈾、枸櫞酸鉛依次染色 15~20 min,透射電鏡觀察各組大鼠坐骨神經組織神經纖維、髓鞘、細胞核等細微結構改變。
1.5.4 Western blot 檢測相關蛋白表達
將各組坐骨神經組織以 PBS 緩沖液漂洗后剪碎,加入配制好的 RIPA 裂解液,勻漿器勻漿收集于離心管中,冰上震蕩 30 min;然后于 4℃ 下以 12 000×g 離心 10 min,取上清液經 BCA 法測定蛋白含量并計算上樣量;配制 SDS-PAGE 凝膠后上樣進行電泳,電泳結束后轉膜,隨后脫脂奶粉封閉 2 h。分別加入小鼠抗人 β-catenin(1∶2 000)、N-cadherin(1∶1 000)、Nestin(1∶1 000)、GFAP(1∶1 000)單克隆抗體,4℃ 凍庫中孵育過夜;TBST 漂洗 10 min×3 次;加入辣根過氧化物酶標記的二抗(1∶3 000),置于脫色搖床上低速震蕩孵育 2 h;TBST 漂洗 10 min×3 次。用凝膠成像系統檢測各蛋白及內參 β-actin 表達條帶的灰度值,以各蛋白條帶灰度值與內參條帶灰度值的比值作為各蛋白的相對表達量。
1.6 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,以 Levene 法行方差齊性檢驗,組間比較采用單因素方差分析,兩兩比較采用 Bonferroni 法;檢驗水準 α=0.05。
2 結果
2.1 術后大體觀察
術后 1 d 各組大鼠均出現患肢活動困難、進食減少、精神欠佳等癥狀;術后 2 d 各組大鼠開始正常進食、進水,精神正常,對各種刺激反應靈敏,傷口未見明顯紅腫、滲液。實驗期間未出現大鼠死亡情況。
2.2 大鼠神經功能評估
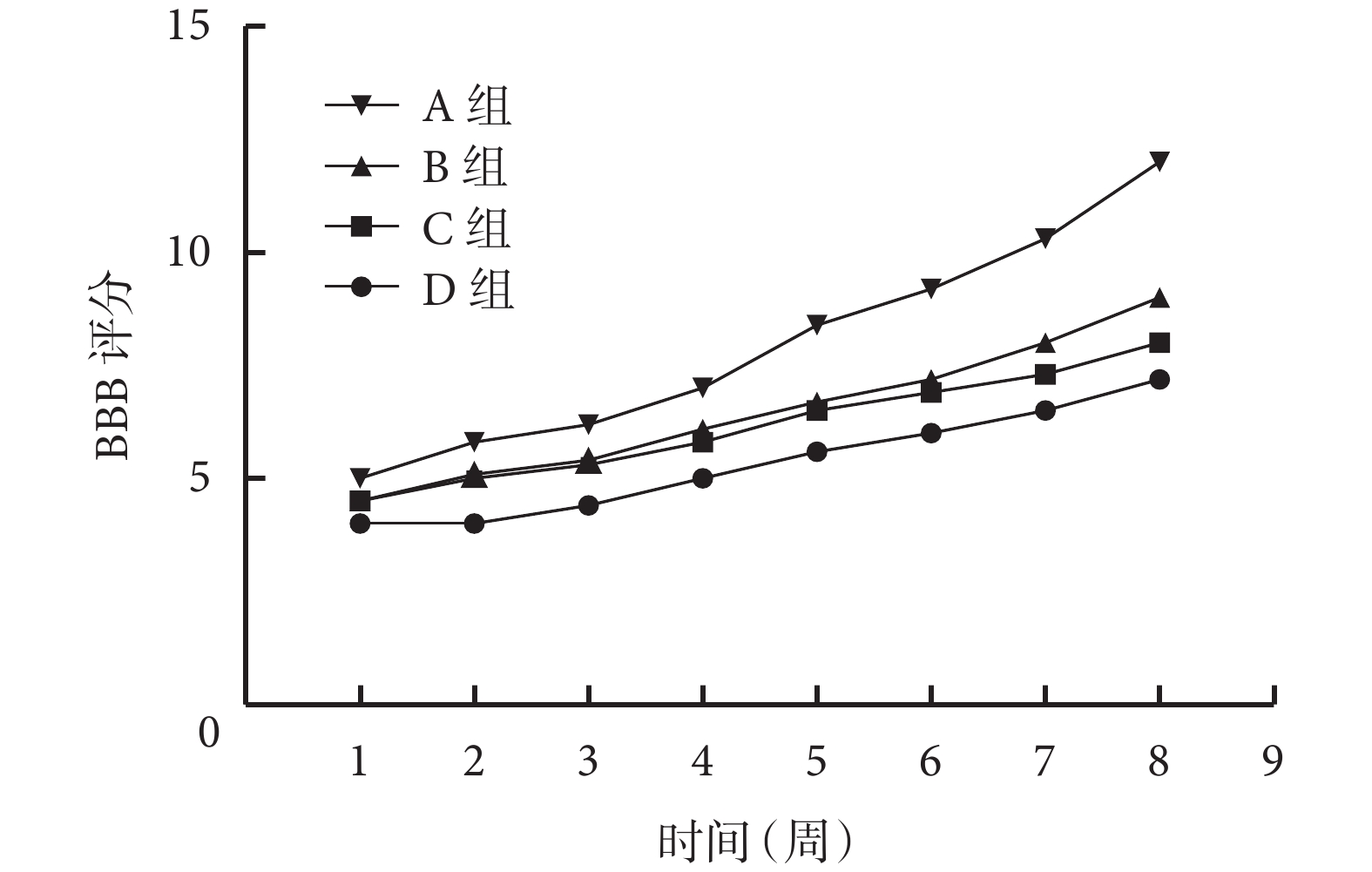
術后 1 周各組大鼠 BBB 評分比較差異無統計學意義(P>0.05);隨著時間推移,各組 BBB 評分均呈上升趨勢,其中 A 組上升趨勢最明顯,B、C 組次之,D 組最不明顯。術后 2~8 周,A 組 BBB 評分顯著高于 B、C、D 組,B、C 組顯著高于 D 組,差異均有統計學意義(P<0.05);B、C 組間差異無統計學意義(P>0.05)。見圖 4。
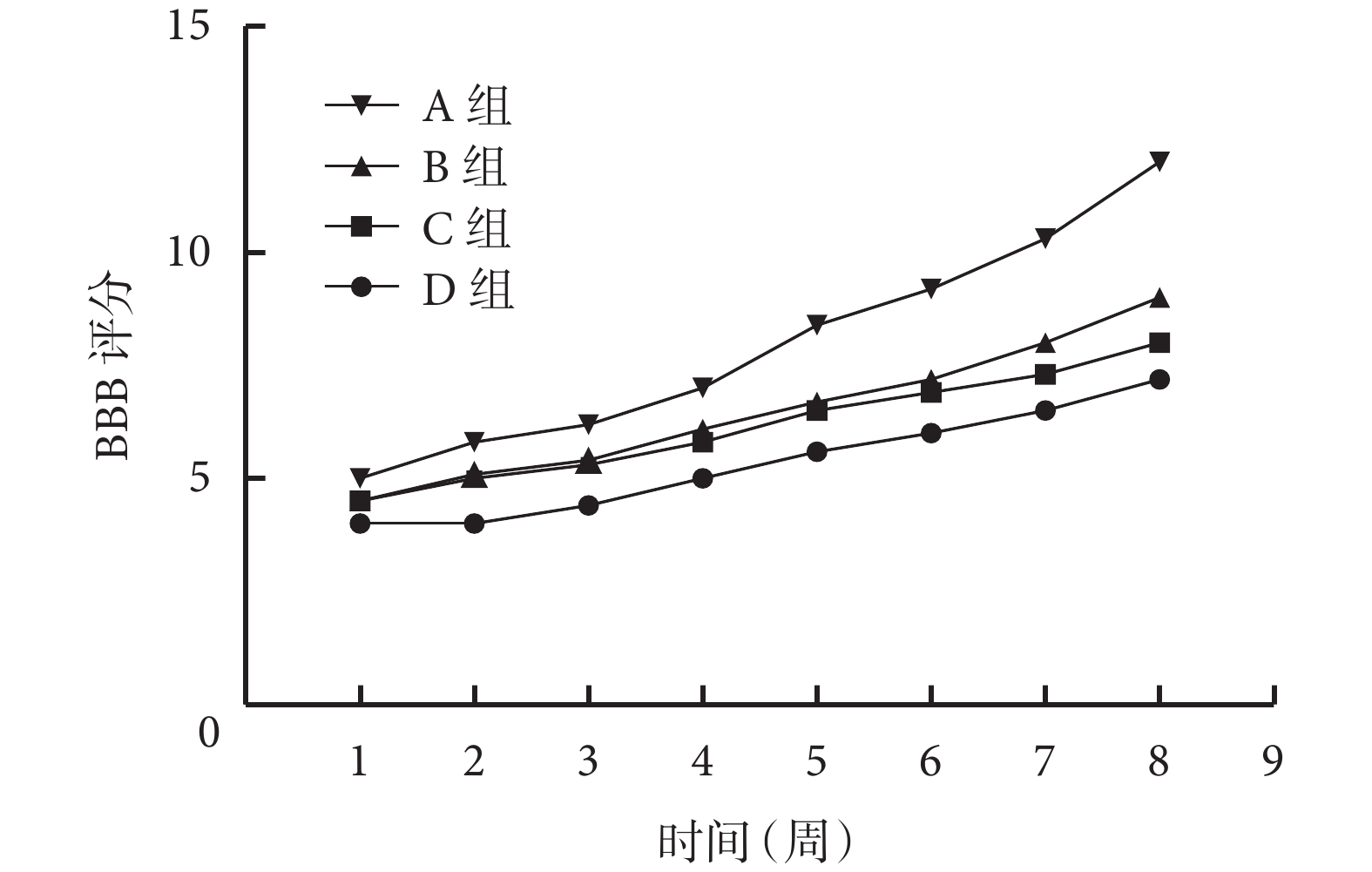 圖4
術后各時間點各組 BBB 評分
Figure4.
BBB scores of each group at different time points after operation
圖4
術后各時間點各組 BBB 評分
Figure4.
BBB scores of each group at different time points after operation
2.3 HE 染色觀察
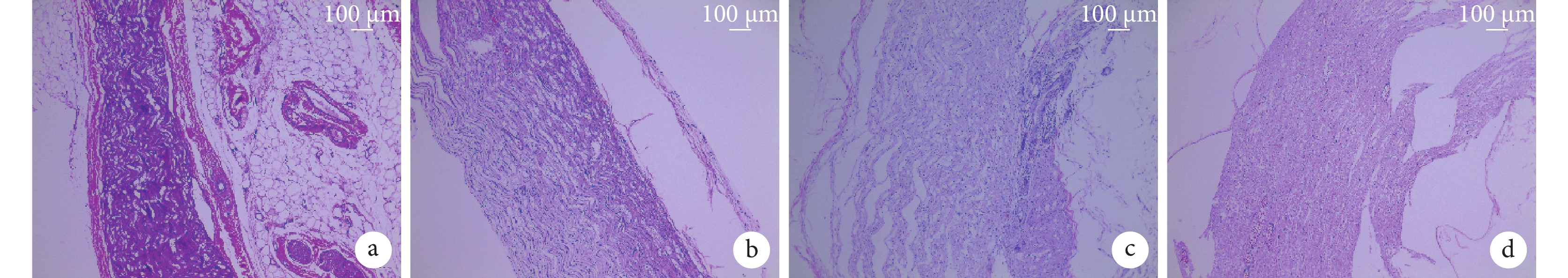
HE 染色示,A 組神經纖維排列整齊,無缺損及脫髓鞘改變;B 組神經纖維結構欠清晰,輕度腫脹;C 組神經纖維部分結構紊亂,局部脫髓鞘改變;D 組神經纖維連續性欠佳,明顯脫髓鞘改變,神經外膜部分缺損。見圖 5。
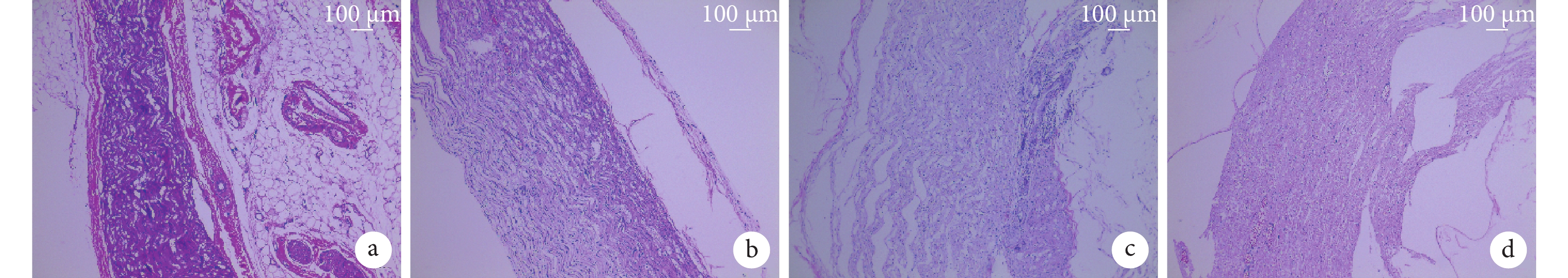 圖5
術后 2 個月各組 HE 染色觀察(×200)
圖5
術后 2 個月各組 HE 染色觀察(×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure5. HE staining observation of each group at 2 months after operation (×200)a. Group A; b. Group B; c. Group C; d. Group D
2.4 透射電鏡觀察
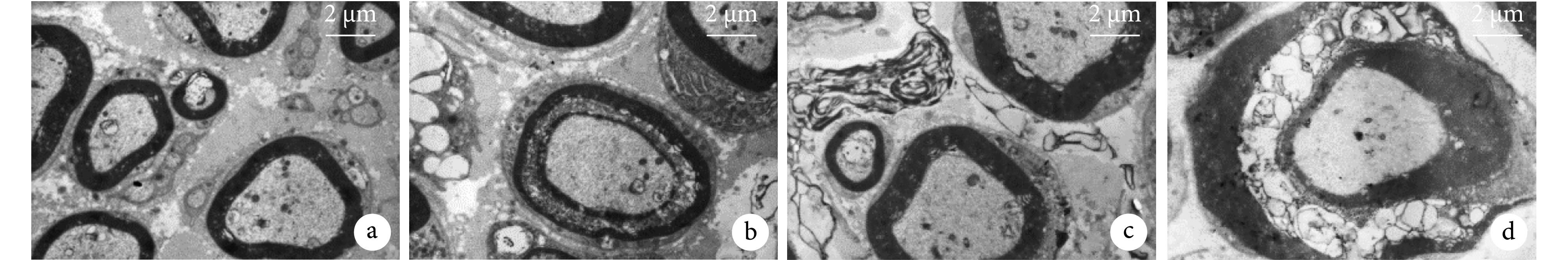
A 組神經纖維結構清晰,髓鞘完整,細胞核致密;B 組結構較 A 組模糊;C 組神經纖維結構明顯模糊,有脫髓鞘改變;D 組神經纖維結構紊亂,有脫髓鞘改變,神經外膜連續性中斷。見圖 6。
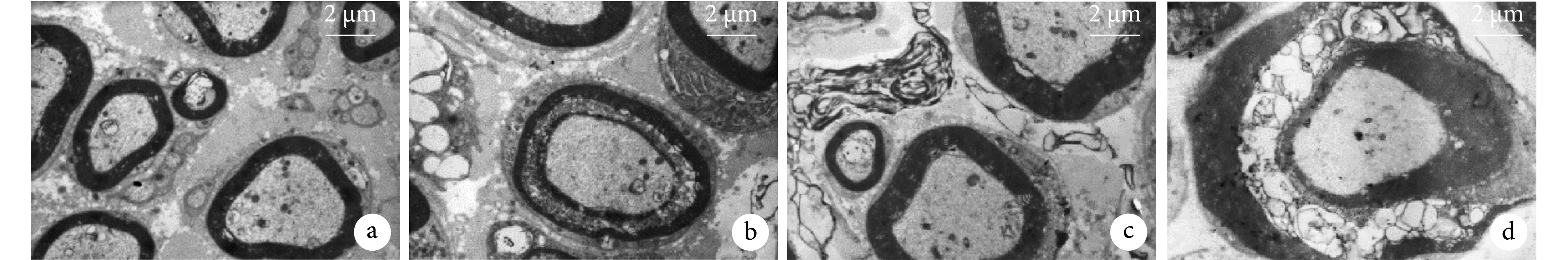 圖6
術后 2 個月各組透射電鏡觀察(×5 000)
圖6
術后 2 個月各組透射電鏡觀察(×5 000)
a. A 組;b. B 組;c. C 組;d. D 組
Figure6. Transmission electron microscope observation of each group at 2 months after operation (×5 000)a. Group A; b. Group B; c. Group C; d. Group D
2.5 Western blot 檢測相關蛋白表達
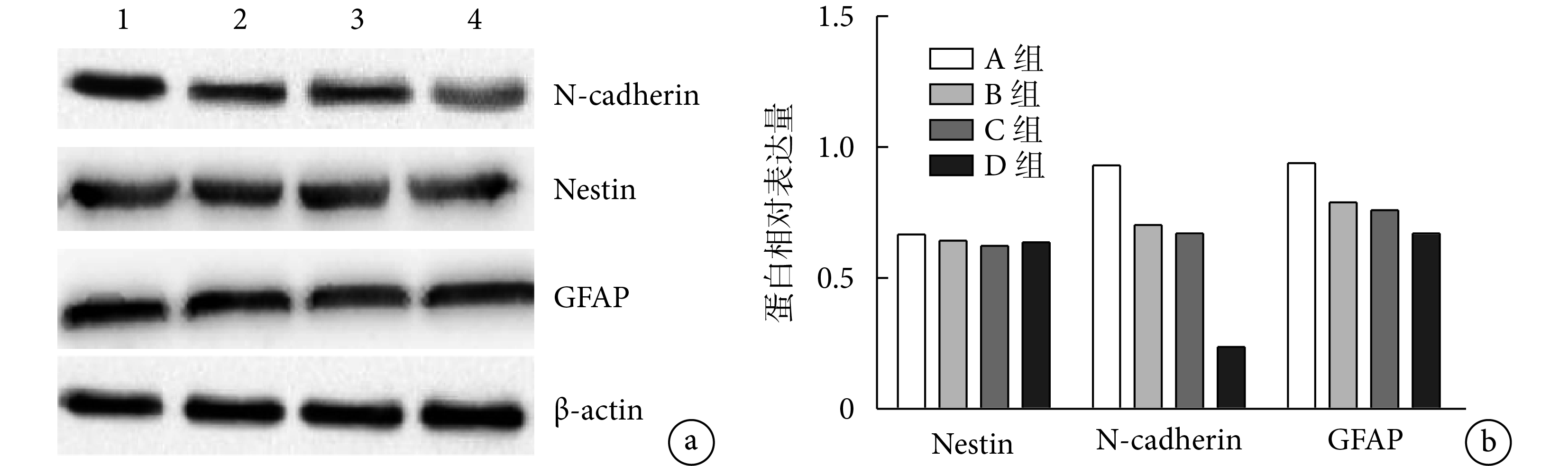
各組 Nestin 蛋白相對表達量比較差異均無統計學意義(P>0.05)。B、C、D 組 N-cadherin 蛋白相對表達量顯著低于 A 組,C、D 組顯著低于 B 組,D 組低于 C 組,差異均有統計學意義(P<0.05)。B、C、D 組 GFAP 蛋白相對表達量顯著低于 A 組,D 組顯著低于 B、C 組,差異有統計學意義(P<0.05);B、C 組間差異無統計學意義(P>0.05)。見圖 7。
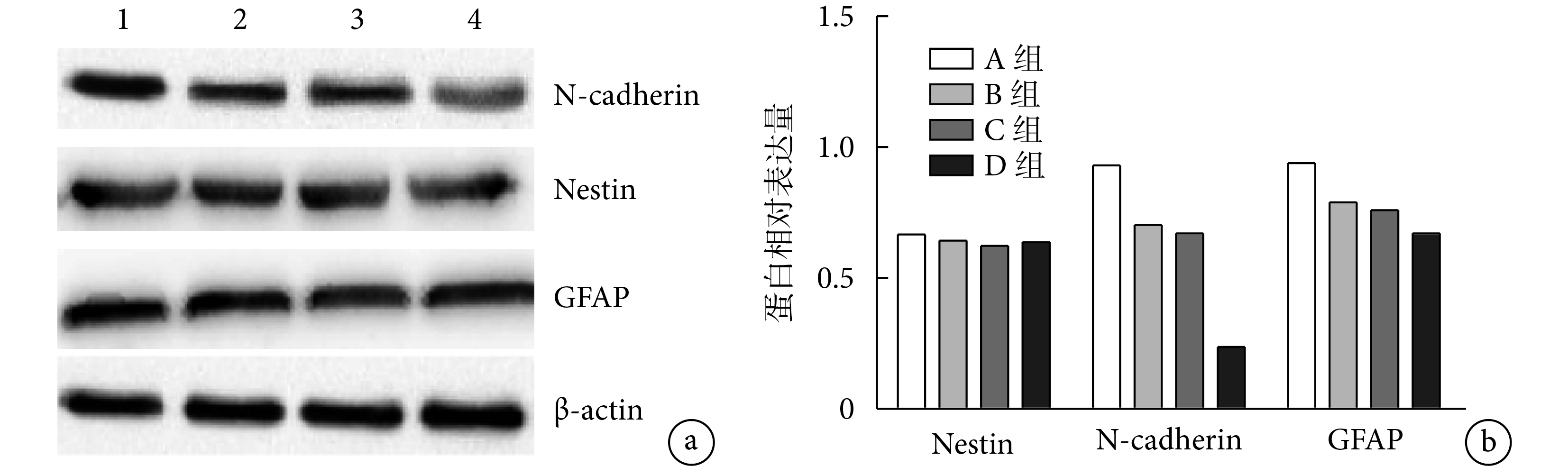 圖7
術后 2 個月各組 Western blot 檢測
圖7
術后 2 個月各組 Western blot 檢測
a. 電泳圖 1:A 組 2:B 組 3:C 組 4:D 組;b. 各蛋白相對表達量
Figure7. Western blot detection of each group at 2 months after operationa. Electrophoregram 1: Group A 2: Group B 3: Group C 4: Group D; b. Relative expressions of each protein
3 討論
由于神經損傷后組織重塑,微環境發生不可逆變化,神經組織修復和/或再生的固有能力受到抑制,因此外周神經損傷治療成為臨床難題[11]。雖然國內外學者利用電刺激、NGF 等方式對周圍神經損傷進行治療獲得一定療效,但總體效果仍不滿意[12-13]。近年來,以神經支架、種子細胞(如 MSCs)和神經營養因子作為三大要素的神經組織工程的發展,為周圍神經損傷治療帶來了新突破。細胞療法是組織工程最重要的分支之一,其中將細胞材料注射到患者體內以啟動再生過程是常用的治療手段[14]。BMSCs 是一種具有自我更新、多向分化及分泌效應的多能干細胞,其可通過旁分泌集落刺激因子、干細胞生長因子、內皮細胞生長因子及多種 IL 等,調控炎癥反應,抑制細胞凋亡,促進血管形成,招募內源性干細胞,促進組織修復[15-16]。近年研究還發現,多種干細胞均可分泌外泌體,以促進神經再生修復[17-18]。但由于周圍神經再生的局部微環境和血供特點不能為 MSCs 提供長效的營養支持[19],尚不能體現上述干細胞的優越性。
前期對富血小板血漿的研究中,我們發現其富含的大量生長因子可為組織修復重建提供充足營養支持,但其為凝膠狀態,在損傷組織中的流動性較差,在組織損傷處不能全面均勻分布,限制了其組織修復能力[20]。為此本實驗選用流體狀態的第 2 代血小板濃縮生物制劑 i-PRF 與 BMSCs 聯合使用,于損傷神經組織處鞘膜內注射,術后 2 個月大鼠神經功能學、組織學觀察以及Western blot 檢測結果均優于其余各對照組,與實驗預期一致。我們認為其機制可能與 i-PRF 釋放 bFGF、TGF-β、VEGF 等生長因子和一定量干細胞有關。其中 bFGF 作為一種高效的有絲分裂原,能促進 BMSCs 快速增殖及向成纖維樣細胞遷移分化[21];TGF-β 可以調節細胞增殖、黏附、遷移及分化,并能增加細胞外基質如Ⅱ型膠原蛋白的表達[22];VEGF 介導內皮細胞與細胞外基質的相互作用,可誘導 BMSCs 分化為血管平滑肌細胞,參與血管生成,促進血管重塑、成熟[23],促進受損神經組織血供恢復。以上各生長因子相互交叉,相互協同,一方面促進 BMSCs 成神經細胞分化,另一方面為神經組織修復提供有利的局部環境。我們的研究結果也顯示,BMSCs 組對神經組織的修復差于 i-PRF 組,在一定程度上佐證了在周圍神經組織缺乏血供及營養支持環境下,i-PRF對 BMSCs 提供生長因子及營養支持的必要性,但其具體作用機制仍需進一步研究闡明。
本研究聯合使用大鼠自體 i-PRF 與 BMSCs 修復損傷坐骨神經,不僅可以減少免疫排斥反應,而且相對于其他誘導劑,i-PRF 不僅制備過程簡便、快捷、利于臨床推廣,還在促進 BMSCs 成神經細胞分化的同時改善損傷神經組織局部微環境,促進神經組織快速修復,是本研究一大創新點。但值得注意的是,i-PRF 富含多種生長因子,不同生長因子對誘導 BMSCs 分化方向不同且具有劑量依賴性[24-25]。本研究中為避免再次傷害及增加感染風險,未進行 i-PRF 劑量調整,但結果仍與預期一致。我們認為一方面可能與神經組織內富含大量神經生長因子有關,神經組織中的生長因子與 i-PRF 中誘導 BMSCs 成神經細胞分化的相關因子(如 bFGF)在數量上占優勢,故能引導分化方向,實現對損傷神經組織的修復;另一方面,BMSCs 對損傷灶的趨化性也可能發揮了協同作用[26-27]。
綜上述,i-PRF 與 BMSCs 兩者聯合使用能發揮協同效應,進一步提高對大鼠周圍神經組織的修復效果,但具體機制有待進一步研究明確。
作者貢獻:高海明直接參與實驗設計、實施,數據收集及統計分析,文章撰寫;王波直接參與實驗實施、數據收集及統計分析;曹家全直接參與實驗實施及數據收集;李秀軍參與數據統計分析;黃陳翼參與實驗指導;劉宗超、吳佳奇設計實驗,并對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:本研究方案獲西南醫科大學倫理委員會批準(2020-071)。實驗動物使用許可證號:SYXK(川)2013-065。
周圍神經損傷后病理過程極其復雜,神經細胞再生速度緩慢、再生神經與周圍組織粘連、神經肌肉萎縮及運動終板退化變性等因素均制約著損傷神經組織的恢復,是顯微外科面臨的臨床難題之一[1]。干細胞移植目前已成為一種新的治療神經系統疾病途徑,其中 BMSCs 作為種子細胞之一,在周圍神經損傷修復中起重要作用[2-3]。但其仍存在很多不足,如體外培養的 MSCs 歸巢能力下降,移植后細胞生存能力不足等。隨著血小板濃縮生物材料的發展,注射型富血小板纖維蛋白(injectable platelet rich fibrin,i-PRF)被研發并應用于臨床[4]。與富血小板血漿相比,i-PRF 能釋放更多的細胞因子,如 TGF-β1、VEGF、bFGF 等,誘導 MSCs 及成纖維細胞分化的潛力更大[5]。本研究擬分析 i-PRF 與 BMSCs 聯合使用修復大鼠坐骨神經損傷的療效,以期為臨床治療周圍神經損傷提供理論依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
10~15 日齡 SD 乳鼠 6 只,體質量(30±5)g;2 月齡 SD 大鼠 24 只,體質量(210±15)g;雌雄不限,均購自西南醫科大學動物實驗中心。
DMEM 培養基(HyClone 公司,美國);FBS(BI 公司,以色列);PBS 緩沖液、TBS 緩沖液、BCA 蛋白濃度檢測試劑盒、RIPA 裂解液、蛋白酶抑制劑、SDS-PAGE 配膠試劑盒(上海碧云天生物技術有限公司);小鼠抗人 β-catenin、N-cadherin、巢蛋白(Nestin)、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)單克隆抗體(Abcam 公司,英國);山羊抗小鼠 Dylight 488 二抗(BD 公司,美國);聚偏氟乙烯膜(Millipore 公司,美國)。倒置相差顯微鏡(Olympus 公司,日本);酶標儀(Hach 公司,美國);電泳儀、電轉儀、凝膠成像儀(Bio-Rad 公司,美國);透射電鏡(Hitachi 公司,日本)。
1.2 大鼠 BMSCs 分離、培養及傳代
取 6 只乳鼠脫頸法處死后暴露出雙側脛骨骨髓腔,用 1 mL 注射器吸取 DMEM 培養基從干骺端進針沖洗骨髓,于離心管中反復吹打成細胞懸液。按照本課題組既往使用的密度梯度離心法[6]進行細胞分離、培養及傳代。培養后 3 周可獲得純化的第 4 代 BMSCs 群。見圖 1。
 圖1
第 4 代 BMSCs 形態學觀察(倒置相差顯微鏡×100)
Figure1.
Morphology observation of the 4th generation BMSCs (Inverted phase contrast microscope×100)
圖1
第 4 代 BMSCs 形態學觀察(倒置相差顯微鏡×100)
Figure1.
Morphology observation of the 4th generation BMSCs (Inverted phase contrast microscope×100)
1.3 i-PRF 的制備
按照文獻[7-8]報道的改良低速離心法制備 i-PRF。操作步驟:用眼眶采血法采集 24 只 2 月齡 SD 大鼠靜脈血 3 mL/只于無抗凝劑的專用真空管,低速(60×g)離心 3 min 得到介于頂部漿液層和底部紅細胞層之間的 i-PRF。由于離心管內不含二氧化硅促凝成分,離心后是液體形式的血小板產物,i-PRF 不必使用抗凝血劑,因此必須在纖維蛋白凝塊形成之前 15 min 內使用。見圖 2。
 圖2
改良低速離心法制備 i-PRF
圖2
改良低速離心法制備 i-PRF
a. 離心前;b. 離心后
Figure2. Preparation of i-PRF by improved low-speed centrifugationa. Before centrifugation; b. After centrifugation
1.4 實驗分組及方法
將上述 24 只 2 月齡 SD 大鼠隨機分為 A、B、C、D 4 組,每組 6 只。采用 Gigo-Benato 等[9]的改良擠壓損傷法制作大鼠坐骨神經Ⅲ度損傷模型。具體方法:以 3% 戊巴比妥(1 mL/100 g)腹腔注射麻醉大鼠,隨機選取一側后肢后側以 4% 硫化鈉脫毛,無菌操作下將術側坐骨神經暴露于分叉點處,止血鉗于第 2 個齒痕上擠壓約 45 s,造成寬度為 2 mm 的擠壓傷,患處神經形態呈扁薄狀。見圖 3。造模成功后,A、B、C、D 組分別于損傷部位鞘膜內注射 BMSCs 懸液+自體 i-PRF、自體 i-PRF、BMSCs 懸液、生理鹽水各 500 μL,其中 BMSCs 懸液濃度為(1.0~2.0)×105 個/100 μL。常規縫合切口及預防感染處理,術后觀察大鼠健康狀態及排斥反應。
 圖3
改良擠壓損傷法制備大鼠坐骨神經損傷模型
圖3
改良擠壓損傷法制備大鼠坐骨神經損傷模型
箭頭示寬度約 2 mm 的扁狀擠壓傷
Figure3. Sciatic nerve injury model established by improved crush injury methodArrow indicated a flat crush injury with a width of about 2 mm
1.5 觀測指標
1.5.1 大鼠神經功能評估
術后 1~8 周每周采用 BBB 評分法[10]評價大鼠患肢神經功能恢復情況。
1.5.2 HE 染色觀察
術后 2 個月以脫頸法處死各組大鼠,獲取術側坐骨神經組織,以 10% 多聚甲醛室溫下固定標本 24 h,梯度乙醇脫水,石蠟包埋切片,二甲苯脫蠟后 HE 染色觀察各組大鼠坐骨神經組織結構變化。
1.5.3 透射電鏡觀察
取上述部分坐骨神經組織,經 3% 戊二醛預固定、1% 四氧化鋨再固定、丙酮逐級脫水后,先后經脫水劑和環氧樹脂(型號為 Epon812)滲透液滲透,比例分別為 3∶1、1∶1、1∶3,每步 30~60 min。將滲透好的樣品塊置入適當模具中,包埋后超薄切片機切片(片厚 50 nm),醋酸鈾、枸櫞酸鉛依次染色 15~20 min,透射電鏡觀察各組大鼠坐骨神經組織神經纖維、髓鞘、細胞核等細微結構改變。
1.5.4 Western blot 檢測相關蛋白表達
將各組坐骨神經組織以 PBS 緩沖液漂洗后剪碎,加入配制好的 RIPA 裂解液,勻漿器勻漿收集于離心管中,冰上震蕩 30 min;然后于 4℃ 下以 12 000×g 離心 10 min,取上清液經 BCA 法測定蛋白含量并計算上樣量;配制 SDS-PAGE 凝膠后上樣進行電泳,電泳結束后轉膜,隨后脫脂奶粉封閉 2 h。分別加入小鼠抗人 β-catenin(1∶2 000)、N-cadherin(1∶1 000)、Nestin(1∶1 000)、GFAP(1∶1 000)單克隆抗體,4℃ 凍庫中孵育過夜;TBST 漂洗 10 min×3 次;加入辣根過氧化物酶標記的二抗(1∶3 000),置于脫色搖床上低速震蕩孵育 2 h;TBST 漂洗 10 min×3 次。用凝膠成像系統檢測各蛋白及內參 β-actin 表達條帶的灰度值,以各蛋白條帶灰度值與內參條帶灰度值的比值作為各蛋白的相對表達量。
1.6 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,以 Levene 法行方差齊性檢驗,組間比較采用單因素方差分析,兩兩比較采用 Bonferroni 法;檢驗水準 α=0.05。
2 結果
2.1 術后大體觀察
術后 1 d 各組大鼠均出現患肢活動困難、進食減少、精神欠佳等癥狀;術后 2 d 各組大鼠開始正常進食、進水,精神正常,對各種刺激反應靈敏,傷口未見明顯紅腫、滲液。實驗期間未出現大鼠死亡情況。
2.2 大鼠神經功能評估
術后 1 周各組大鼠 BBB 評分比較差異無統計學意義(P>0.05);隨著時間推移,各組 BBB 評分均呈上升趨勢,其中 A 組上升趨勢最明顯,B、C 組次之,D 組最不明顯。術后 2~8 周,A 組 BBB 評分顯著高于 B、C、D 組,B、C 組顯著高于 D 組,差異均有統計學意義(P<0.05);B、C 組間差異無統計學意義(P>0.05)。見圖 4。
 圖4
術后各時間點各組 BBB 評分
Figure4.
BBB scores of each group at different time points after operation
圖4
術后各時間點各組 BBB 評分
Figure4.
BBB scores of each group at different time points after operation
2.3 HE 染色觀察
HE 染色示,A 組神經纖維排列整齊,無缺損及脫髓鞘改變;B 組神經纖維結構欠清晰,輕度腫脹;C 組神經纖維部分結構紊亂,局部脫髓鞘改變;D 組神經纖維連續性欠佳,明顯脫髓鞘改變,神經外膜部分缺損。見圖 5。
 圖5
術后 2 個月各組 HE 染色觀察(×200)
圖5
術后 2 個月各組 HE 染色觀察(×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure5. HE staining observation of each group at 2 months after operation (×200)a. Group A; b. Group B; c. Group C; d. Group D
2.4 透射電鏡觀察
A 組神經纖維結構清晰,髓鞘完整,細胞核致密;B 組結構較 A 組模糊;C 組神經纖維結構明顯模糊,有脫髓鞘改變;D 組神經纖維結構紊亂,有脫髓鞘改變,神經外膜連續性中斷。見圖 6。
 圖6
術后 2 個月各組透射電鏡觀察(×5 000)
圖6
術后 2 個月各組透射電鏡觀察(×5 000)
a. A 組;b. B 組;c. C 組;d. D 組
Figure6. Transmission electron microscope observation of each group at 2 months after operation (×5 000)a. Group A; b. Group B; c. Group C; d. Group D
2.5 Western blot 檢測相關蛋白表達
各組 Nestin 蛋白相對表達量比較差異均無統計學意義(P>0.05)。B、C、D 組 N-cadherin 蛋白相對表達量顯著低于 A 組,C、D 組顯著低于 B 組,D 組低于 C 組,差異均有統計學意義(P<0.05)。B、C、D 組 GFAP 蛋白相對表達量顯著低于 A 組,D 組顯著低于 B、C 組,差異有統計學意義(P<0.05);B、C 組間差異無統計學意義(P>0.05)。見圖 7。
 圖7
術后 2 個月各組 Western blot 檢測
圖7
術后 2 個月各組 Western blot 檢測
a. 電泳圖 1:A 組 2:B 組 3:C 組 4:D 組;b. 各蛋白相對表達量
Figure7. Western blot detection of each group at 2 months after operationa. Electrophoregram 1: Group A 2: Group B 3: Group C 4: Group D; b. Relative expressions of each protein
3 討論
由于神經損傷后組織重塑,微環境發生不可逆變化,神經組織修復和/或再生的固有能力受到抑制,因此外周神經損傷治療成為臨床難題[11]。雖然國內外學者利用電刺激、NGF 等方式對周圍神經損傷進行治療獲得一定療效,但總體效果仍不滿意[12-13]。近年來,以神經支架、種子細胞(如 MSCs)和神經營養因子作為三大要素的神經組織工程的發展,為周圍神經損傷治療帶來了新突破。細胞療法是組織工程最重要的分支之一,其中將細胞材料注射到患者體內以啟動再生過程是常用的治療手段[14]。BMSCs 是一種具有自我更新、多向分化及分泌效應的多能干細胞,其可通過旁分泌集落刺激因子、干細胞生長因子、內皮細胞生長因子及多種 IL 等,調控炎癥反應,抑制細胞凋亡,促進血管形成,招募內源性干細胞,促進組織修復[15-16]。近年研究還發現,多種干細胞均可分泌外泌體,以促進神經再生修復[17-18]。但由于周圍神經再生的局部微環境和血供特點不能為 MSCs 提供長效的營養支持[19],尚不能體現上述干細胞的優越性。
前期對富血小板血漿的研究中,我們發現其富含的大量生長因子可為組織修復重建提供充足營養支持,但其為凝膠狀態,在損傷組織中的流動性較差,在組織損傷處不能全面均勻分布,限制了其組織修復能力[20]。為此本實驗選用流體狀態的第 2 代血小板濃縮生物制劑 i-PRF 與 BMSCs 聯合使用,于損傷神經組織處鞘膜內注射,術后 2 個月大鼠神經功能學、組織學觀察以及Western blot 檢測結果均優于其余各對照組,與實驗預期一致。我們認為其機制可能與 i-PRF 釋放 bFGF、TGF-β、VEGF 等生長因子和一定量干細胞有關。其中 bFGF 作為一種高效的有絲分裂原,能促進 BMSCs 快速增殖及向成纖維樣細胞遷移分化[21];TGF-β 可以調節細胞增殖、黏附、遷移及分化,并能增加細胞外基質如Ⅱ型膠原蛋白的表達[22];VEGF 介導內皮細胞與細胞外基質的相互作用,可誘導 BMSCs 分化為血管平滑肌細胞,參與血管生成,促進血管重塑、成熟[23],促進受損神經組織血供恢復。以上各生長因子相互交叉,相互協同,一方面促進 BMSCs 成神經細胞分化,另一方面為神經組織修復提供有利的局部環境。我們的研究結果也顯示,BMSCs 組對神經組織的修復差于 i-PRF 組,在一定程度上佐證了在周圍神經組織缺乏血供及營養支持環境下,i-PRF對 BMSCs 提供生長因子及營養支持的必要性,但其具體作用機制仍需進一步研究闡明。
本研究聯合使用大鼠自體 i-PRF 與 BMSCs 修復損傷坐骨神經,不僅可以減少免疫排斥反應,而且相對于其他誘導劑,i-PRF 不僅制備過程簡便、快捷、利于臨床推廣,還在促進 BMSCs 成神經細胞分化的同時改善損傷神經組織局部微環境,促進神經組織快速修復,是本研究一大創新點。但值得注意的是,i-PRF 富含多種生長因子,不同生長因子對誘導 BMSCs 分化方向不同且具有劑量依賴性[24-25]。本研究中為避免再次傷害及增加感染風險,未進行 i-PRF 劑量調整,但結果仍與預期一致。我們認為一方面可能與神經組織內富含大量神經生長因子有關,神經組織中的生長因子與 i-PRF 中誘導 BMSCs 成神經細胞分化的相關因子(如 bFGF)在數量上占優勢,故能引導分化方向,實現對損傷神經組織的修復;另一方面,BMSCs 對損傷灶的趨化性也可能發揮了協同作用[26-27]。
綜上述,i-PRF 與 BMSCs 兩者聯合使用能發揮協同效應,進一步提高對大鼠周圍神經組織的修復效果,但具體機制有待進一步研究明確。
作者貢獻:高海明直接參與實驗設計、實施,數據收集及統計分析,文章撰寫;王波直接參與實驗實施、數據收集及統計分析;曹家全直接參與實驗實施及數據收集;李秀軍參與數據統計分析;黃陳翼參與實驗指導;劉宗超、吳佳奇設計實驗,并對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:本研究方案獲西南醫科大學倫理委員會批準(2020-071)。實驗動物使用許可證號:SYXK(川)2013-065。