引用本文: 陳俊毅, 王寧, 張衡, 張賢平, 趙利民, 朱倫井, 黎智君, 貝朝涌. 慢病毒介導沉默 P75 神經營養蛋白受體聯合 NGF 過表達轉染 BMSCs 復合脫鈣骨基質異位成骨的實驗研究. 中國修復重建外科雜志, 2020, 34(11): 1438-1445. doi: 10.7507/1002-1892.202003166 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
骨折不愈合發生率為 5%~10%,其危險因素包括年齡、飲酒、吸煙、非甾體類抗炎藥、糖尿病以及骨折類型、部位、軟組織損傷嚴重程度和感染等[1-3]。骨組織工程的發展大大提高了骨折不愈合治療率,良好的種子細胞、分泌一定功能的神經因子以及性能良好的支架材料是骨組織工程的 3 個基本要素。BMSCs 具有多向分化和自我更新能力,是一種良好的種子細胞[4]。脫鈣骨基質(demineralized bone matrix,DBM)是一種常見的骨組織工程支架材料,具有一定的骨傳導性、骨誘導性、黏附性和降解性等[5-6]。血管形成和纖維蛋白降解是骨折愈合的重要因素,NGF 有促進血管生成作用,能夠促進骨折愈合[7]。
P75 神經營養蛋白受體(P75 neurotrophin receptor,P75NTR)是一種相對分子質量為 75×103的跨膜蛋白,屬于 TNF 受體超家族成員,具有廣泛的生物學功能,包括細胞生長、增殖、凋亡、神經發育和信號轉導。NGF 與低親和性受體 P75NTR 結合可介導細胞凋亡,但在有足夠 NGF 的情況下,可以關閉 P75NTR 細胞凋亡通道。因此,沉默 P75NTR 聯合 NGF 過表達雙基因轉染 BMSCs,理論上可以增加 BMSCs 的活性和促進骨折愈合。因此,本研究通過慢病毒介導沉默 P75NTR 聯合 NGF 過表達雙基因轉染 BMSCs,檢測細胞活性,并進一步復合 DBM 構建一種新的組織工程骨,探究其異位成骨能力,為用于治療骨缺損提供理論依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8 周齡 SD 大鼠 25 只,雌雄不限,體質量(200±10)g,由桂林醫學院實驗動物中心提供。
L-DMEM 培養基、FBS、彩虹 Marker(GIBCO 公司,美國);PBS、青鏈霉素、胰蛋白酶、RIPA 裂解液、戊二醛固定液、蘇木素-伊紅染液、中性樹膠、ALP 試劑盒(北京索萊寶科技有限公司);二抗 FITC 標記(上海生工生物工程股份有限公司);沉默 P75NTR 慢病毒載體、NGF 過表達慢病毒載體(上海吉凱基因醫學科技股份有限公司);DBM(3 mm×3 mm×2 mm;Wright 公司,美國);BCA 蛋白測量試劑盒(上海碧云天生物技術有限公司);CD14、CD29、CD34、CD44 和 CD45 流式一抗,兔抗 P75NTR 單克隆抗體、NGF 抗體(Abcam 公司,英國);GAPDH、辣根過氧化物酶標記山羊抗小鼠 IgG(北京中杉金橋生物技術有限公司);細胞計數試劑盒 8(cell counting kit 8,CCK-8;同仁公司,日本);成骨誘導液(廣州賽業生物科技有限公司);水合氯醛、二甲苯(上海阿拉丁生化科技股份有限公司)。?80℃ 冰箱(海爾公司);SW-CJ-2F 型超凈工作臺(蘇州凈化設備有限公司);恒溫培養箱、普通離心機、冷凍高速離心機(Thermo Scien-tific 公司,美國);流式細胞儀、MLDEL680 型酶標儀(Bio-Rad 公司,美國);倒置相差顯微鏡(Olympus 公司,美國);JSM-6390A 型掃描電鏡(JEOL 公司,美國)。
1.2 沉默 P75NTR 聯合 NGF 過表達雙基因轉染大鼠 BMSCs 觀測
1.2.1 BMSCs 培養及鑒定
取 1 只 SD 大鼠腹腔注射 10% 水合氯醛 1 mL 麻醉后,完整取出雙側股骨,按照常規貼壁培養法培養大鼠 BMSCs 并傳代。經細胞形態學觀察及 CD14、CD29、CD34、CD44、CD45 流式細胞儀鑒定,所培養細胞為 BMSCs。取第 3 代細胞用于以下實驗研究。
1.2.2 基因轉染大鼠 BMSCs 熒光表達檢測
取第 3 代 BMSCs,待細胞增殖至融合度為 70% 左右時分為 4 組,A 組為未轉染組,B 組為沉默 P75NTR 基因轉染組,C 組為 NGF 過表達基因轉染組,D 組為沉默 P75NTR 和 NGF 過表達雙基因轉染組。按照轉染復數為 50、總體積 2.5 mL,B、C、D 組分別添加對應慢病毒 50 μL,48 h 后更換新鮮 L-DMEM 培養液繼續培養,隔日換液。7 d 后熒光顯微鏡觀察目的基因熒光蛋白表達情況。
1.2.3 Western blot 檢測 P75NTR 和 NGF 蛋白表達
BMSCs 同 1.2.2 方法分組處理,慢病毒轉染后 7 d 加入 RIPA 裂解液裂解,4℃ 以 12 000 r/min 離心 30 min;取上清液蛋白,按照 BCA 蛋白定量法測量蛋白,然后經電泳、轉膜、牛奶孵育;加入 P75NTR、NGF 一抗工作液(1∶1 000),4℃ 封閉過夜;加入對應二抗工作液(1∶8 000),以 GAPDH 為內參。以各條帶灰度值與 GAPDH 灰度值的比值表示各蛋白相對表達量。
1.2.4 CCK-8 法檢測基因轉染對 BMSCs 增殖活性的影響
BMSCs 同 1.2.2 方法分組并轉染后,于 37℃、5%CO2 恒溫培養箱繼續培養。每天每組加入 CCK-8 培養 4 h 后,酶標儀測量 490 nm 處細胞吸光度(A)值。連續測量 8 d,繪制細胞生長曲線。
1.3 組織工程骨的構建及體內外檢測
1.3.1 雙基因轉染 BMSCs 種植 DBM 的體外觀察
取第 3 代 BMSCs,調整細胞濃度為 1×105 個/mL,參照 1.2.2 中轉染條件,以沉默 P75NTR 和 NGF 過表達雙基因轉染細胞;無菌條件下取出 DBM,L-DMEM 培養液浸泡后轉至上述細胞培養液中,培養液剛浸過 DBM 為宜,37℃、5%CO2 恒溫培養箱繼續培養。培養 7 d 取 DBM,倒置相差顯微鏡觀察細胞黏附情況;DBM 以 PBS 清洗 2 遍,戊二醛固定 4 h,PBS 沖洗 30 min,梯度乙醇依次脫水 10 min,60℃ 烘干 2 h,噴金鍍膜,掃描電鏡觀察雙基因轉染后 BMSCs 的形態和黏附情況,以空白 DBM 作為對照。
1.3.2 組織工程骨構建
BMSCs 按 1.2.2 方法分組并轉染 3 d 后,將各組培養液換為成骨誘導液繼續培養 7 d。各組分別與 DBM 復合培養構建組織工程骨,A 組為未轉染 BMSCs-DBM,B 組為沉默 P75NTR 基因轉染 BMSCs-DBM,C 組為 NGF 過表達基因轉染 BMSCs-DBM,D 組為沉默 P75NTR 和 NGF 過表達雙基因轉染 BMSCs-DBM。
1.3.3 動物皮下異位成骨模型構建
取 24 只 SD 大鼠分為 4 組,每組 6 只,腹腔注射 10% 水合氯醛 1 mL 麻醉后,備皮,聚維酮碘溶液消毒 3 遍后,切開皮膚,取上述 A~D 組組織工程骨分別置于大鼠背側皮下組織,每只皮下埋植 2 個組織工程骨,縫合皮膚,術后每天密切觀察背部切口愈合情況和組織工程骨的硬度。
1.3.4 HE 染色觀察
術后 4、8 周各組各取 3 只大鼠的組織工程骨,常規石蠟切片,部分切片行 HE 染色,倒置相差顯微鏡觀察。
1.3.5 ALP 染色觀察
取各組術后 8 周部分切片,按照 ALP 試劑盒說明書,采用改良鈣鈷法[8-9]進行 ALP 染色,倒置相差顯微鏡觀察。ALP 染色陽性表達呈棕黑色,顏色越深,表示酶的活性越高。
1.3.6 實時熒光定量 PCR 檢測成骨相關基因表達
術后 8 周各組取 6 個組織工程骨,迅速置于經液氮預冷的研缽中,反復研磨至粉末狀,再將其移動至預冷的勻漿器內,按照 Trizol 法提取細胞總 RNA,隨后將 RNA 反轉錄為 cDNA。行成骨相關基因 Runt 相關轉錄因子 2(Runt-related transcription factor 2,Runx2)、ALP 和骨鈣素(osteocalcin,OCN)表達檢測。引物序列見表 1。反應條件:95℃、10 min;95℃、10 s,60℃、30 s,30 個循環。進行熔解曲線分析和數據收集,采用 2-ΔΔCt法計算各基因相對表達量。
1.4 統計學方法
采用 SPSS20.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 沉默 P75NTR 聯合 NGF 過表達雙基因轉染大鼠 BMSCs 觀測
2.1.1 基因轉染大鼠 BMSCs 熒光表達檢測
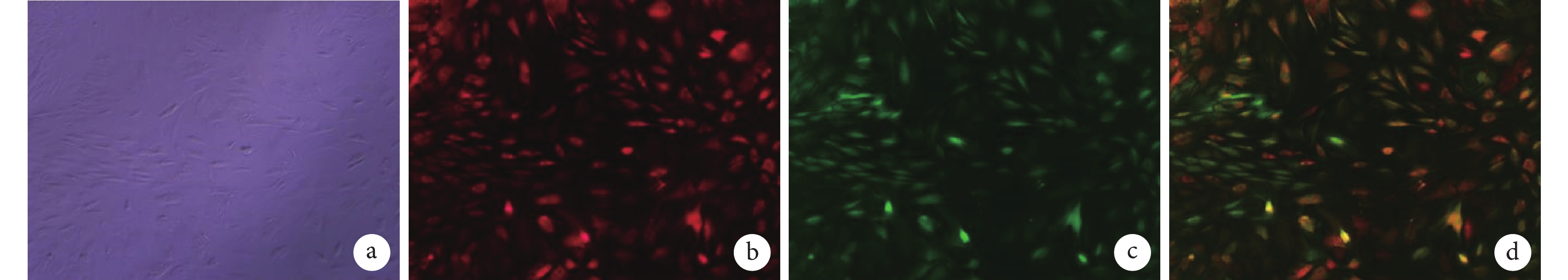
轉染 7 d 熒光顯微鏡觀察示,A 組未見熒光表達。B 組呈紅色熒光表達,C 組呈綠色熒光表達,D 組呈紅綠色復合熒光表達;B、C、D 組細胞形態良好,目的基因熒光表達率可達 70% 左右。見圖 1。
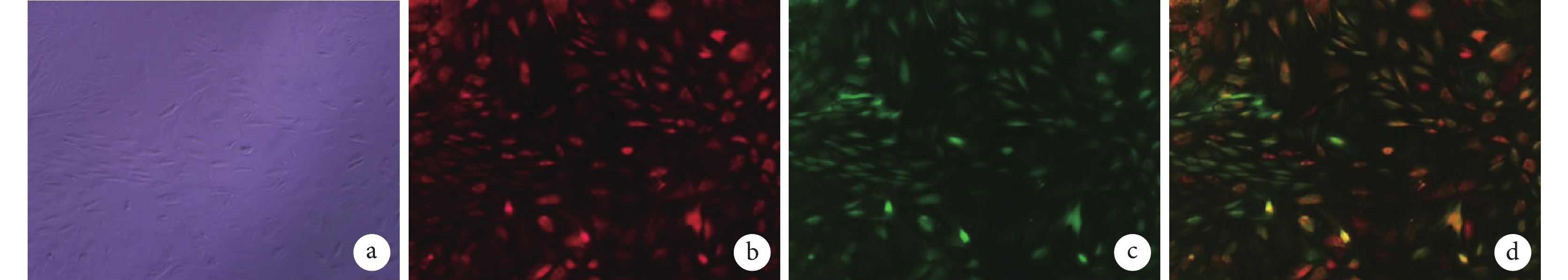 圖1
慢病毒轉染 7 d 熒光表達觀察(熒光顯微鏡×100)
圖1
慢病毒轉染 7 d 熒光表達觀察(熒光顯微鏡×100)
a. A 組;b. B 組;c. C 組;d. D 組
Figure1. Observation on fluorescence expression of lentivirus transfection for 7 days (Fluorescence microscope×100)a. Group A; b. Group B; c. Group C; d. Group D
2.1.2 Western blot 檢測 P75NTR 和 NGF 蛋白表達
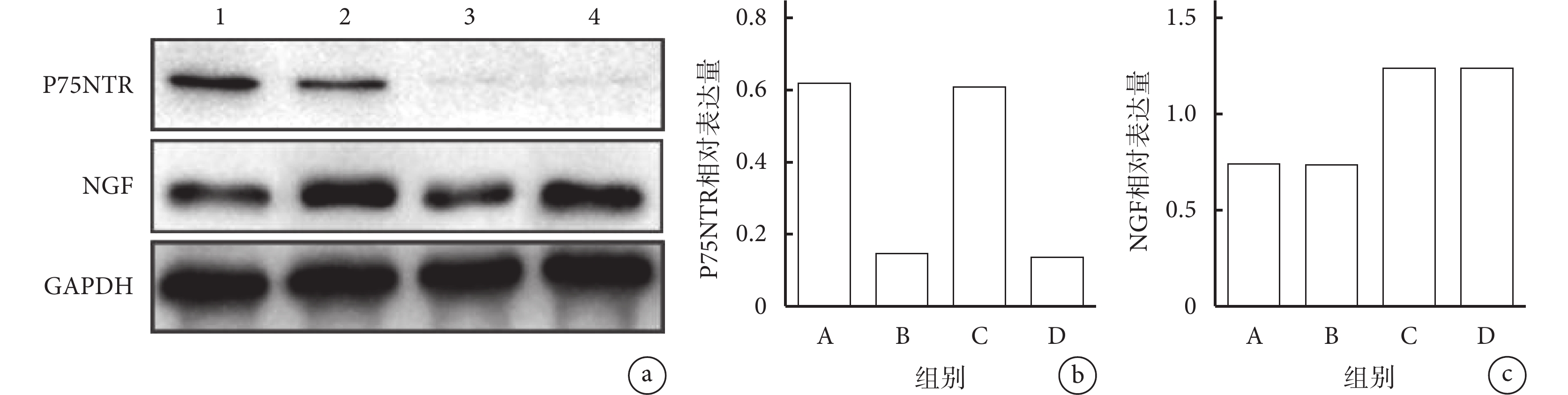
轉染后 7 d,A、C 組 P75NTR 蛋白相對表達量顯著高于 B、D 組,差異有統計學意義(P<0.05);A、C 組間及 B、D 組間差異均無統計學意義(P>0.05)。C、D 組 NGF 蛋白相對表達量顯著高于 A、B 組,差異有統計學意義(P<0.05);A、B 組間及 C、D 組間差異均無統計學意義(P>0.05)。見圖 2。
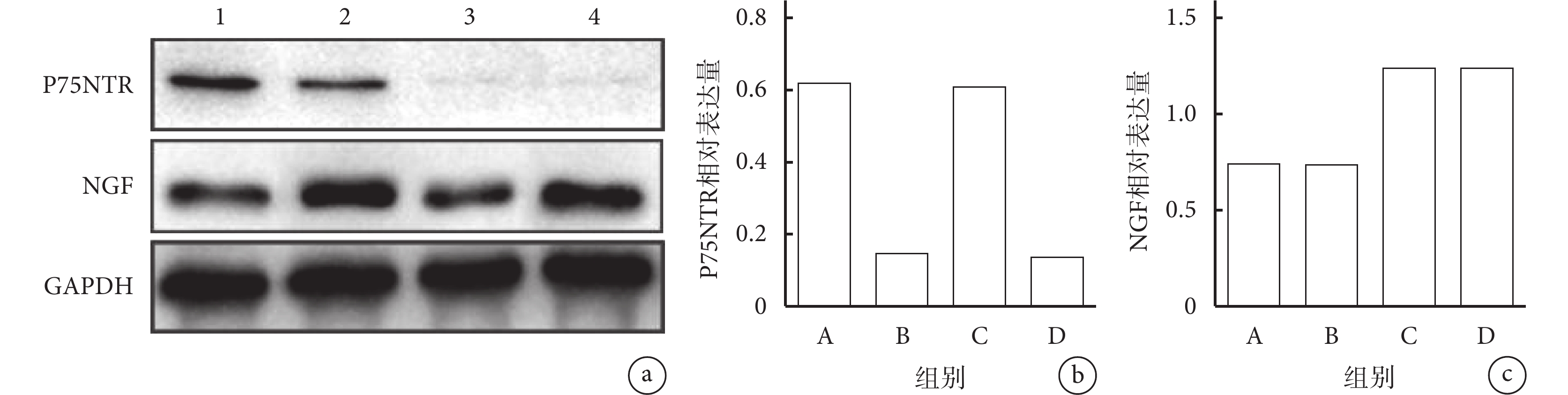 圖2
Western blot 檢測慢病毒轉染后 7 d 各組細胞 P75NTR 和 NGF 蛋白表達
圖2
Western blot 檢測慢病毒轉染后 7 d 各組細胞 P75NTR 和 NGF 蛋白表達
a. 電泳圖 1:A 組 2:C 組 3:B 組 4:D 組;b. 各組 P75NTR 蛋白相對表達量;c. 各組 NGF 蛋白相對表達量
Figure2. The expressions of P75NTR and NGF proteins detected by Western blot at 7 days after lentivirus transfectiona. Electrophoretic map1: Group A 2: Group C 3: Group B 4: Group D; b. Relative expression of P75NTR protein in each group; c. Relative expression of NGF protein in each group
2.1.3 CCK-8 法檢測基因轉染對 BMSCs 增殖活性的影響
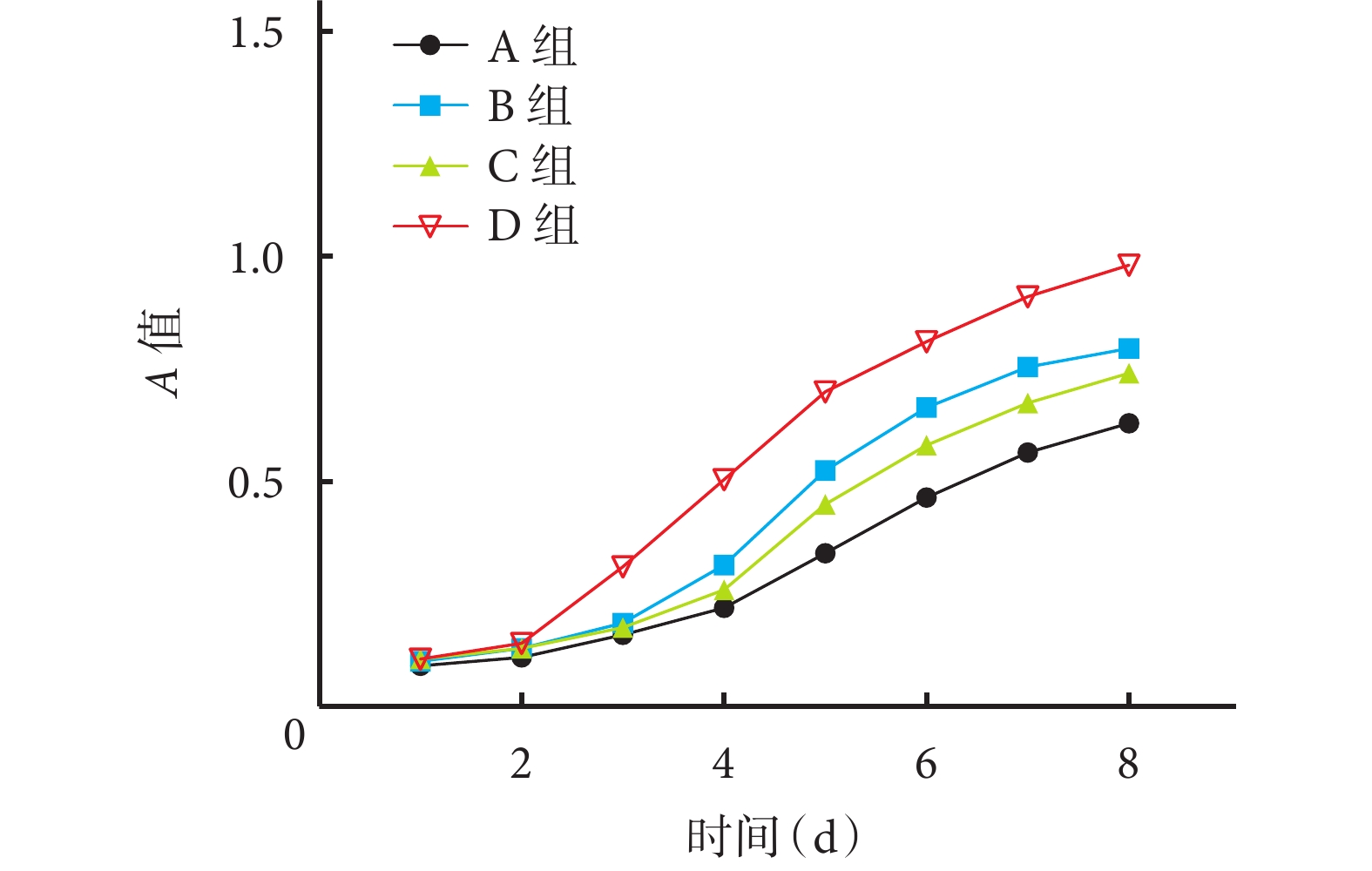
隨時間推移,各組細胞增殖活性均上升,其中 D 組上升最明顯,3~8 d 細胞活性明顯高于 A 組,差異有統計學意義(P<0.05);B、C 組 5~8 d 細胞活性明顯高于 A 組,差異有統計學意義(P<0.05)。見圖 3。
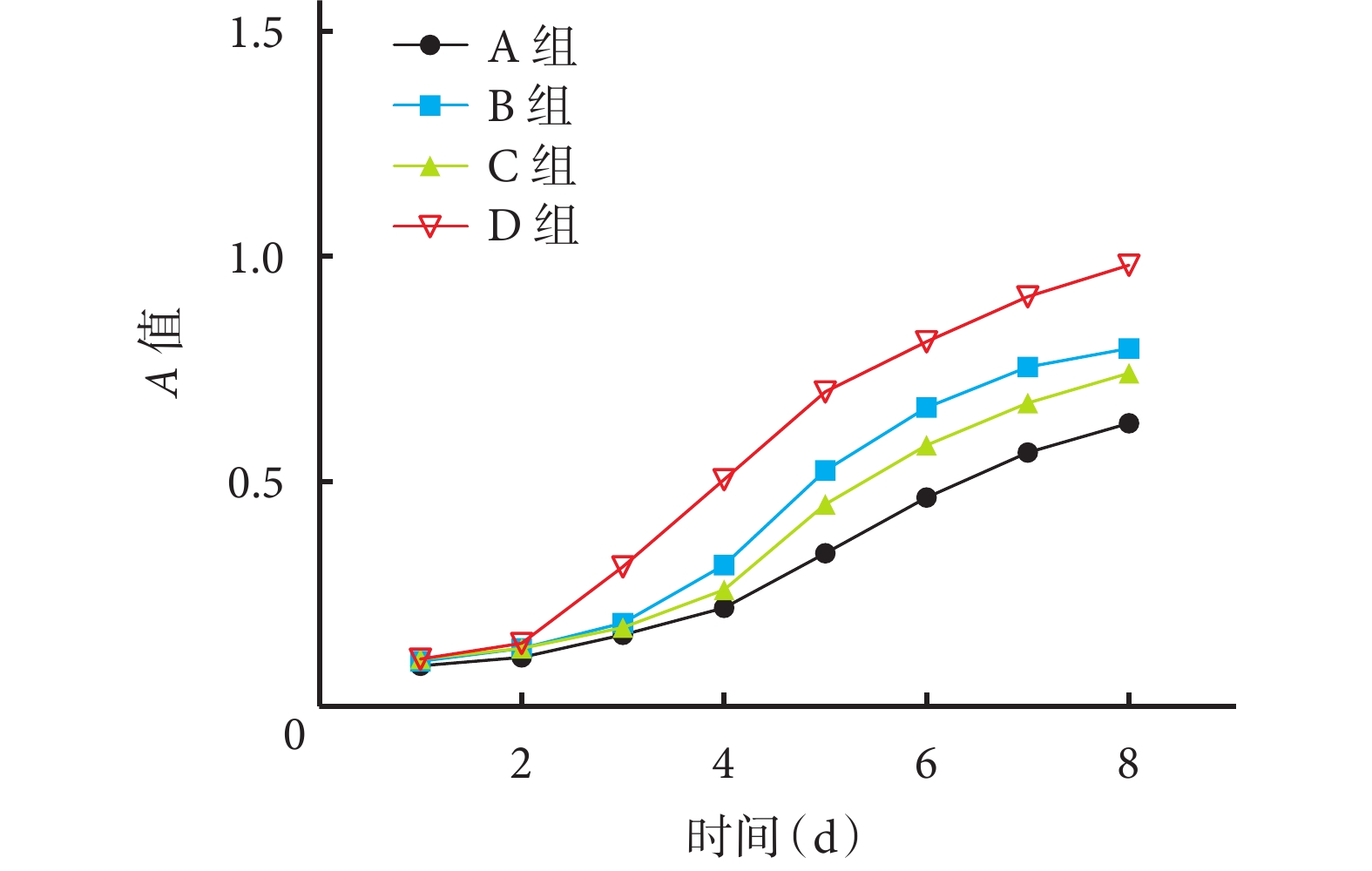 圖3
CCK-8 法檢測基因轉染對各組 BMSCs 增殖活性的影響
Figure3.
Effect of gene transfection on proliferation of BMSCs in each group detected by CCK-8 method
圖3
CCK-8 法檢測基因轉染對各組 BMSCs 增殖活性的影響
Figure3.
Effect of gene transfection on proliferation of BMSCs in each group detected by CCK-8 method
2.2 組織工程骨的構建及體內外檢測
2.2.1 雙基因轉染 BMSCs 種植 DBM 的體外觀察
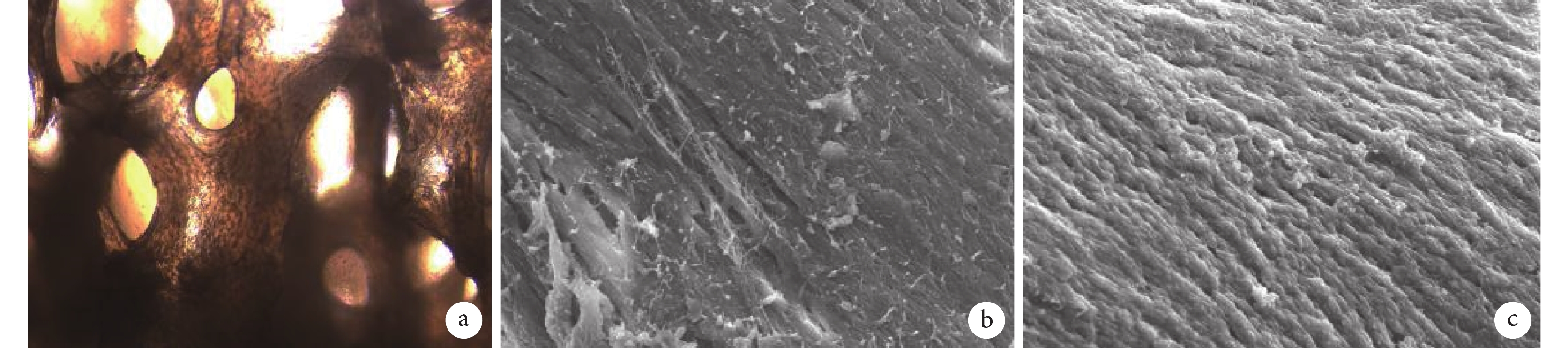
倒置相差顯微鏡觀察示 BMSCs 黏附于 DBM 上。進一步掃描電鏡觀察示,對比空白 DBM,雙基因轉染組 DBM 可觀察到細胞無規則聚集在 DBM 支架孔隙間,細胞之間可互相重疊。見圖 4。
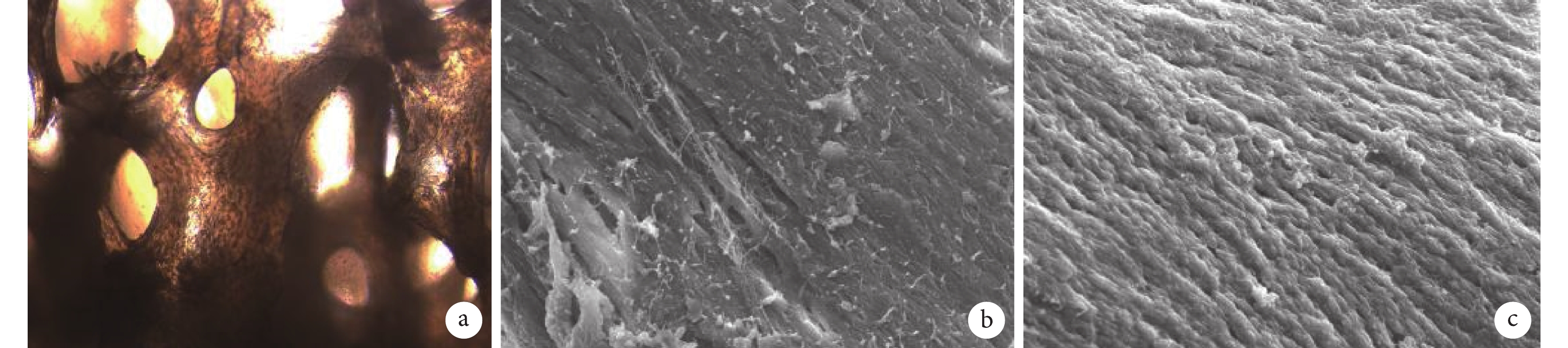 圖4
雙基因轉染 BMSCs 種植 DBM 的體外觀察
圖4
雙基因轉染 BMSCs 種植 DBM 的體外觀察
a. 倒置相差顯微鏡觀察(×100);b. 空白 DBM 掃描電鏡觀察(×2 000);c. 雙基因轉染組 DBM 掃描電鏡觀察(×2 000)
Figure4. In vitro observation of double genes transfected BMSCs implanted with DBMa. Inverted phase contrast microscope observation (×100); b. Scanning electron microscope observation of blank DBM (×2 000); c. Scanning electron microscope observation of DBM in double gene transfection group (×2 000)
2.2.2 HE 染色觀察
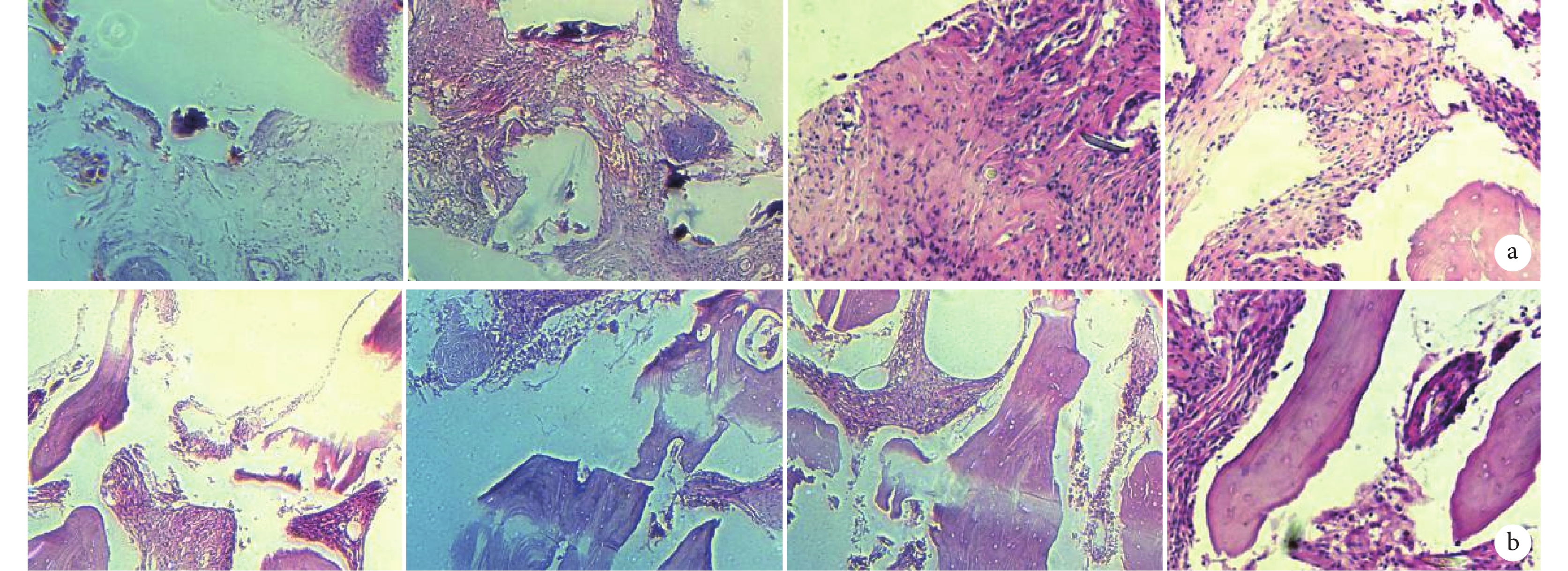
術后 4 周,各組均可見纖維組織和纖維細胞成束排列,伴有較多炎癥細胞浸潤,主要為淋巴細胞,部分伴結締組織壞死、組織充血,可見較多紅細胞。與 A、B、C 組比較,D 組可見少量新骨組織形成,A、B、C 組間無明顯差異。術后 8 周,各組均可見新骨組織形成,其中 D 組新骨組織形成最多、最明顯,可見骨陷窩;B、C 組相較于 A 組皆可見較多新骨組織形成。各組炎癥細胞較 4 周時吸收減少。見圖 5。
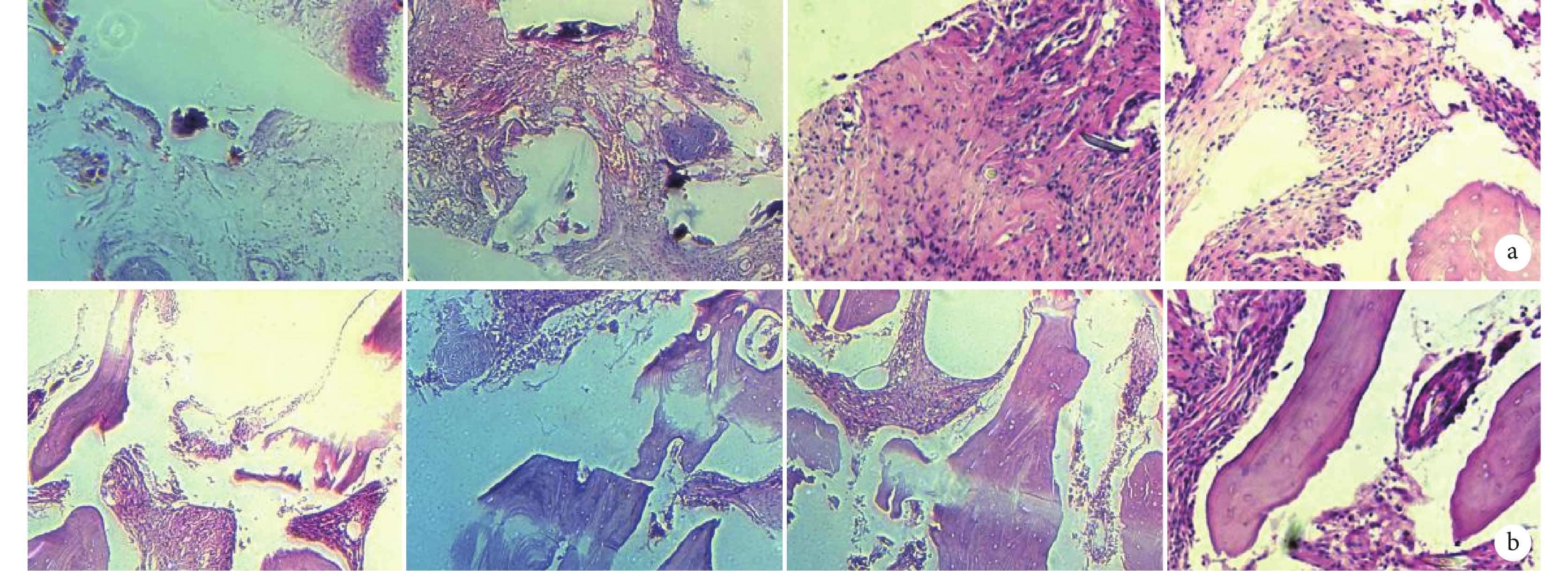 圖5
各組皮下異位成骨 HE 染色觀察(倒置相差顯微鏡×100)
圖5
各組皮下異位成骨 HE 染色觀察(倒置相差顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 術后 4 周;b. 術后 8 周
Figure5. HE staining observation of subcutaneous ectopic osteogenesis in each group (Inverted phase contrast microscope×100)From left to right for groups A, B, C, and D, respectively a. At 4 weeks after operation; b. At 8 weeks after operation
2.2.3 ALP 染色觀察
術后 8 周,各組均可見顏色深淺不一的鈣結節,D 組呈深棕色和深黑色,B、C 組呈大量棕色,A 組鈣結節較少、呈較淺棕色。表明 D 組 ALP 活性最高,有更好的成骨表達。見圖 6。
 圖6
各組皮下異位成骨 ALP 染色觀察(倒置相差顯微鏡×100)
圖6
各組皮下異位成骨 ALP 染色觀察(倒置相差顯微鏡×100)
a. A 組;b. B 組;c. C 組;d. D 組
Figure6. ALP staining of subcutaneous ectopic osteogenesis in each group (Inverted phase contrast microscope×100)a. Group A; b. Group B; c. Group C; d. Group D
2.2.4 實時熒光定量 PCR 檢測成骨相關基因表達
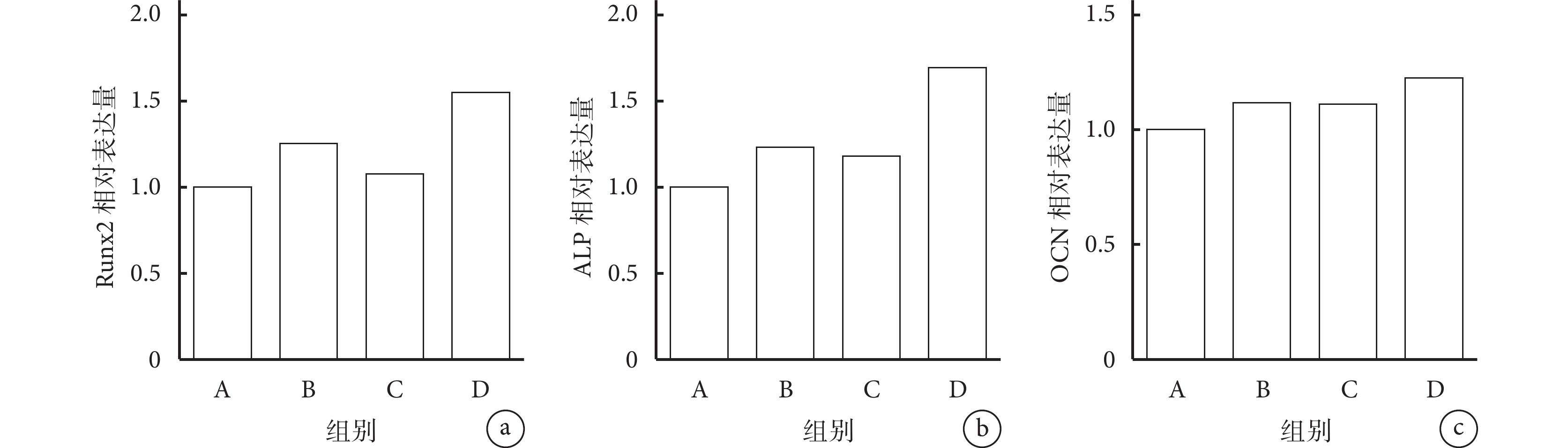
與 A 組比較,B、D 組 Runx2 mRNA 相對表達量顯著升高,B、C、D 組 ALP mRNA 相對表達量顯著升高,D 組 OCN mRNA 相對表達量顯著升高,差異均有統計學意義(P<0.05);其余各組間比較各基因相對表達量差異均無統計學意義(P>0.05)。見圖 7。
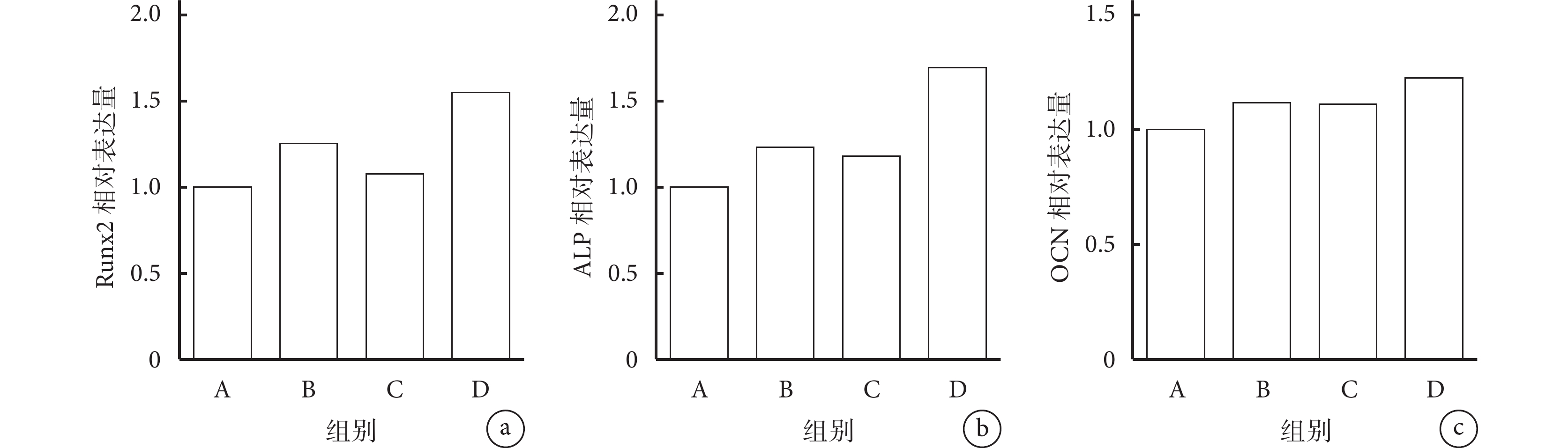 圖7
實時熒光定量 PCR 檢測各組成骨相關基因表達
圖7
實時熒光定量 PCR 檢測各組成骨相關基因表達
a. Runx2;b. ALP;c. OCN
Figure7. The expression of osteogenesis related genes detected by real-time fluorescent quantitative PCRa. Runx2; b. ALP; c. OCN
3 討論
組織工程骨的構建是骨組織工程最基礎的研究。通過皮下異位成骨的實驗研究,初步探討組織工程骨的成骨能力,可為其用于臨床治療骨缺損提供理論依據[10]。BMSCs 具有來源豐富、取材方便、多向分化、免疫原性低以及強大的自我更新能力,在一定條件下可以分化為成骨細胞、軟骨細胞、脂肪細胞、神經細胞等,目前主要用于抗炎修復、細胞移植、基因治療和骨組織工程等方面。近年文獻報道,神經因子對骨折愈合起著重要作用,神經因子可影響機體反應,從而調節細胞的增殖、遷移、分化以及凋亡。NGF 是一種常見的神經營養因子,具有促進骨痂生成和骨折愈合的作用,NGF 通過促進突觸發育,在骨折局部營養神經的再生,以及調節多種神經肽類的釋放,增強局部血供,從而促進成骨作用[7, 11]。
P75NTR 抑制骨組織修復的表現在于,首先,P75NTR 表達升高能抑制四肢血管、肺血管和視網膜血管的再生,從而影響骨折愈合[12-14]。其次,骨折不愈合局部 P75NTR 表達升高,可通過下調絲氨酸蛋白酶、組織型纖溶酶原激活物和上調纖溶酶原激活物抑制劑 1 限制纖維蛋白的降解,阻礙骨折愈合[15-16]。同樣,本課題組前期研究發現,在骨折不愈合處 P75NTR 處于一種高表達狀態,分析 P75NTR 與骨折不愈合相關[17]。慢病毒構建過表達 P75NTR 轉染 BMSCs 的體外成骨分化實驗研究發現,過表達 P75NTR 可抑制 BMSCs 成骨分化,具有成骨抑制作用[18]。因此,P75NTR 通過抑制纖維蛋白的降解和新生血管的生成,從而起到抑制成骨作用,導致骨折不愈合[19-21]。P75NTR 發揮該作用的機制主要與 P75NTR 介導的細胞凋亡有關,P75NTR 通過 NF-κB、JNK-p53-Bax 及神經酰胺 3 條通路介導細胞凋亡[22-24]。因此,理論上 P75NTR 可以誘導靶細胞死亡,抑制 P75NTR 可以有效減少細胞凋亡,提高細胞的活性,使其更好地向成骨定向分化。
本研究首先通過慢病毒介導沉默 P75NTR 基因、NGF 過表達基因、沉默 P75NTR 和 NGF 過表達雙基因轉染 BMSCs,熒光顯微鏡和 Western blot 初步檢測了相關目的基因熒光度和蛋白的表達;CCK-8 法檢測轉染后細胞活性變化,顯示雙基因轉染后可顯著促進細胞增殖能力。ALP 是一種成骨標志物,廣泛存在于機體各種組織細胞中,如肝臟、血管、卵巢等處,改良鈣鈷法可根據沉淀顏色評價酶活性,隨著成骨分化作用的增強,硫化鈷沉淀顏色越深,其酶活性也越高[8-9]。本研究通過 HE 染色及 ALP 染色發現,雙基因轉染組在局部有更多新骨組織表達和鈣結節沉積。最后,通過實時熒光定量 PCR 檢測示,雙基因轉染組成骨相關基因 Runx2、ALP 和 OCN mRNA 相對表達量均明顯高于未轉染組。從上述結果分析,雙基因轉染比未轉染組具有更強的促成骨能力。
綜上述,沉默 P75NTR 聯合 NGF 過表達雙基因共轉染 BMSCs 復合 DBM 構建組織工程骨,具有良好的異位成骨能力,通過提高 NGF 的水平、關閉 P75NTR 凋亡通道,不僅可以提高細胞活性,還能更好促進骨組織再生。P75NTR 和 NGF 雙基因促進成骨的效果對比單基因更為明顯,二者可以形成一種良好的復合因子,有助于提高細胞活性,具有良好的成骨作用,為骨組織工程治療骨缺損提供了新思路和理論依據。
作者貢獻:貝朝涌負責實驗設計;陳俊毅負責實驗實施、實驗結果統計分析及文章撰寫;王寧、張衡負責文獻查詢及實驗評價;張賢平、趙利民、朱倫井、黎智君負責實驗結果收集整理。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經桂林醫學院動物實驗倫理委員會批準(GLMC201805018)。實驗動物使用許可證號:SYXK(湘)2016-0002。
骨折不愈合發生率為 5%~10%,其危險因素包括年齡、飲酒、吸煙、非甾體類抗炎藥、糖尿病以及骨折類型、部位、軟組織損傷嚴重程度和感染等[1-3]。骨組織工程的發展大大提高了骨折不愈合治療率,良好的種子細胞、分泌一定功能的神經因子以及性能良好的支架材料是骨組織工程的 3 個基本要素。BMSCs 具有多向分化和自我更新能力,是一種良好的種子細胞[4]。脫鈣骨基質(demineralized bone matrix,DBM)是一種常見的骨組織工程支架材料,具有一定的骨傳導性、骨誘導性、黏附性和降解性等[5-6]。血管形成和纖維蛋白降解是骨折愈合的重要因素,NGF 有促進血管生成作用,能夠促進骨折愈合[7]。
P75 神經營養蛋白受體(P75 neurotrophin receptor,P75NTR)是一種相對分子質量為 75×103的跨膜蛋白,屬于 TNF 受體超家族成員,具有廣泛的生物學功能,包括細胞生長、增殖、凋亡、神經發育和信號轉導。NGF 與低親和性受體 P75NTR 結合可介導細胞凋亡,但在有足夠 NGF 的情況下,可以關閉 P75NTR 細胞凋亡通道。因此,沉默 P75NTR 聯合 NGF 過表達雙基因轉染 BMSCs,理論上可以增加 BMSCs 的活性和促進骨折愈合。因此,本研究通過慢病毒介導沉默 P75NTR 聯合 NGF 過表達雙基因轉染 BMSCs,檢測細胞活性,并進一步復合 DBM 構建一種新的組織工程骨,探究其異位成骨能力,為用于治療骨缺損提供理論依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8 周齡 SD 大鼠 25 只,雌雄不限,體質量(200±10)g,由桂林醫學院實驗動物中心提供。
L-DMEM 培養基、FBS、彩虹 Marker(GIBCO 公司,美國);PBS、青鏈霉素、胰蛋白酶、RIPA 裂解液、戊二醛固定液、蘇木素-伊紅染液、中性樹膠、ALP 試劑盒(北京索萊寶科技有限公司);二抗 FITC 標記(上海生工生物工程股份有限公司);沉默 P75NTR 慢病毒載體、NGF 過表達慢病毒載體(上海吉凱基因醫學科技股份有限公司);DBM(3 mm×3 mm×2 mm;Wright 公司,美國);BCA 蛋白測量試劑盒(上海碧云天生物技術有限公司);CD14、CD29、CD34、CD44 和 CD45 流式一抗,兔抗 P75NTR 單克隆抗體、NGF 抗體(Abcam 公司,英國);GAPDH、辣根過氧化物酶標記山羊抗小鼠 IgG(北京中杉金橋生物技術有限公司);細胞計數試劑盒 8(cell counting kit 8,CCK-8;同仁公司,日本);成骨誘導液(廣州賽業生物科技有限公司);水合氯醛、二甲苯(上海阿拉丁生化科技股份有限公司)。?80℃ 冰箱(海爾公司);SW-CJ-2F 型超凈工作臺(蘇州凈化設備有限公司);恒溫培養箱、普通離心機、冷凍高速離心機(Thermo Scien-tific 公司,美國);流式細胞儀、MLDEL680 型酶標儀(Bio-Rad 公司,美國);倒置相差顯微鏡(Olympus 公司,美國);JSM-6390A 型掃描電鏡(JEOL 公司,美國)。
1.2 沉默 P75NTR 聯合 NGF 過表達雙基因轉染大鼠 BMSCs 觀測
1.2.1 BMSCs 培養及鑒定
取 1 只 SD 大鼠腹腔注射 10% 水合氯醛 1 mL 麻醉后,完整取出雙側股骨,按照常規貼壁培養法培養大鼠 BMSCs 并傳代。經細胞形態學觀察及 CD14、CD29、CD34、CD44、CD45 流式細胞儀鑒定,所培養細胞為 BMSCs。取第 3 代細胞用于以下實驗研究。
1.2.2 基因轉染大鼠 BMSCs 熒光表達檢測
取第 3 代 BMSCs,待細胞增殖至融合度為 70% 左右時分為 4 組,A 組為未轉染組,B 組為沉默 P75NTR 基因轉染組,C 組為 NGF 過表達基因轉染組,D 組為沉默 P75NTR 和 NGF 過表達雙基因轉染組。按照轉染復數為 50、總體積 2.5 mL,B、C、D 組分別添加對應慢病毒 50 μL,48 h 后更換新鮮 L-DMEM 培養液繼續培養,隔日換液。7 d 后熒光顯微鏡觀察目的基因熒光蛋白表達情況。
1.2.3 Western blot 檢測 P75NTR 和 NGF 蛋白表達
BMSCs 同 1.2.2 方法分組處理,慢病毒轉染后 7 d 加入 RIPA 裂解液裂解,4℃ 以 12 000 r/min 離心 30 min;取上清液蛋白,按照 BCA 蛋白定量法測量蛋白,然后經電泳、轉膜、牛奶孵育;加入 P75NTR、NGF 一抗工作液(1∶1 000),4℃ 封閉過夜;加入對應二抗工作液(1∶8 000),以 GAPDH 為內參。以各條帶灰度值與 GAPDH 灰度值的比值表示各蛋白相對表達量。
1.2.4 CCK-8 法檢測基因轉染對 BMSCs 增殖活性的影響
BMSCs 同 1.2.2 方法分組并轉染后,于 37℃、5%CO2 恒溫培養箱繼續培養。每天每組加入 CCK-8 培養 4 h 后,酶標儀測量 490 nm 處細胞吸光度(A)值。連續測量 8 d,繪制細胞生長曲線。
1.3 組織工程骨的構建及體內外檢測
1.3.1 雙基因轉染 BMSCs 種植 DBM 的體外觀察
取第 3 代 BMSCs,調整細胞濃度為 1×105 個/mL,參照 1.2.2 中轉染條件,以沉默 P75NTR 和 NGF 過表達雙基因轉染細胞;無菌條件下取出 DBM,L-DMEM 培養液浸泡后轉至上述細胞培養液中,培養液剛浸過 DBM 為宜,37℃、5%CO2 恒溫培養箱繼續培養。培養 7 d 取 DBM,倒置相差顯微鏡觀察細胞黏附情況;DBM 以 PBS 清洗 2 遍,戊二醛固定 4 h,PBS 沖洗 30 min,梯度乙醇依次脫水 10 min,60℃ 烘干 2 h,噴金鍍膜,掃描電鏡觀察雙基因轉染后 BMSCs 的形態和黏附情況,以空白 DBM 作為對照。
1.3.2 組織工程骨構建
BMSCs 按 1.2.2 方法分組并轉染 3 d 后,將各組培養液換為成骨誘導液繼續培養 7 d。各組分別與 DBM 復合培養構建組織工程骨,A 組為未轉染 BMSCs-DBM,B 組為沉默 P75NTR 基因轉染 BMSCs-DBM,C 組為 NGF 過表達基因轉染 BMSCs-DBM,D 組為沉默 P75NTR 和 NGF 過表達雙基因轉染 BMSCs-DBM。
1.3.3 動物皮下異位成骨模型構建
取 24 只 SD 大鼠分為 4 組,每組 6 只,腹腔注射 10% 水合氯醛 1 mL 麻醉后,備皮,聚維酮碘溶液消毒 3 遍后,切開皮膚,取上述 A~D 組組織工程骨分別置于大鼠背側皮下組織,每只皮下埋植 2 個組織工程骨,縫合皮膚,術后每天密切觀察背部切口愈合情況和組織工程骨的硬度。
1.3.4 HE 染色觀察
術后 4、8 周各組各取 3 只大鼠的組織工程骨,常規石蠟切片,部分切片行 HE 染色,倒置相差顯微鏡觀察。
1.3.5 ALP 染色觀察
取各組術后 8 周部分切片,按照 ALP 試劑盒說明書,采用改良鈣鈷法[8-9]進行 ALP 染色,倒置相差顯微鏡觀察。ALP 染色陽性表達呈棕黑色,顏色越深,表示酶的活性越高。
1.3.6 實時熒光定量 PCR 檢測成骨相關基因表達
術后 8 周各組取 6 個組織工程骨,迅速置于經液氮預冷的研缽中,反復研磨至粉末狀,再將其移動至預冷的勻漿器內,按照 Trizol 法提取細胞總 RNA,隨后將 RNA 反轉錄為 cDNA。行成骨相關基因 Runt 相關轉錄因子 2(Runt-related transcription factor 2,Runx2)、ALP 和骨鈣素(osteocalcin,OCN)表達檢測。引物序列見表 1。反應條件:95℃、10 min;95℃、10 s,60℃、30 s,30 個循環。進行熔解曲線分析和數據收集,采用 2-ΔΔCt法計算各基因相對表達量。
1.4 統計學方法
采用 SPSS20.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 沉默 P75NTR 聯合 NGF 過表達雙基因轉染大鼠 BMSCs 觀測
2.1.1 基因轉染大鼠 BMSCs 熒光表達檢測
轉染 7 d 熒光顯微鏡觀察示,A 組未見熒光表達。B 組呈紅色熒光表達,C 組呈綠色熒光表達,D 組呈紅綠色復合熒光表達;B、C、D 組細胞形態良好,目的基因熒光表達率可達 70% 左右。見圖 1。
 圖1
慢病毒轉染 7 d 熒光表達觀察(熒光顯微鏡×100)
圖1
慢病毒轉染 7 d 熒光表達觀察(熒光顯微鏡×100)
a. A 組;b. B 組;c. C 組;d. D 組
Figure1. Observation on fluorescence expression of lentivirus transfection for 7 days (Fluorescence microscope×100)a. Group A; b. Group B; c. Group C; d. Group D
2.1.2 Western blot 檢測 P75NTR 和 NGF 蛋白表達
轉染后 7 d,A、C 組 P75NTR 蛋白相對表達量顯著高于 B、D 組,差異有統計學意義(P<0.05);A、C 組間及 B、D 組間差異均無統計學意義(P>0.05)。C、D 組 NGF 蛋白相對表達量顯著高于 A、B 組,差異有統計學意義(P<0.05);A、B 組間及 C、D 組間差異均無統計學意義(P>0.05)。見圖 2。
 圖2
Western blot 檢測慢病毒轉染后 7 d 各組細胞 P75NTR 和 NGF 蛋白表達
圖2
Western blot 檢測慢病毒轉染后 7 d 各組細胞 P75NTR 和 NGF 蛋白表達
a. 電泳圖 1:A 組 2:C 組 3:B 組 4:D 組;b. 各組 P75NTR 蛋白相對表達量;c. 各組 NGF 蛋白相對表達量
Figure2. The expressions of P75NTR and NGF proteins detected by Western blot at 7 days after lentivirus transfectiona. Electrophoretic map1: Group A 2: Group C 3: Group B 4: Group D; b. Relative expression of P75NTR protein in each group; c. Relative expression of NGF protein in each group
2.1.3 CCK-8 法檢測基因轉染對 BMSCs 增殖活性的影響
隨時間推移,各組細胞增殖活性均上升,其中 D 組上升最明顯,3~8 d 細胞活性明顯高于 A 組,差異有統計學意義(P<0.05);B、C 組 5~8 d 細胞活性明顯高于 A 組,差異有統計學意義(P<0.05)。見圖 3。
 圖3
CCK-8 法檢測基因轉染對各組 BMSCs 增殖活性的影響
Figure3.
Effect of gene transfection on proliferation of BMSCs in each group detected by CCK-8 method
圖3
CCK-8 法檢測基因轉染對各組 BMSCs 增殖活性的影響
Figure3.
Effect of gene transfection on proliferation of BMSCs in each group detected by CCK-8 method
2.2 組織工程骨的構建及體內外檢測
2.2.1 雙基因轉染 BMSCs 種植 DBM 的體外觀察
倒置相差顯微鏡觀察示 BMSCs 黏附于 DBM 上。進一步掃描電鏡觀察示,對比空白 DBM,雙基因轉染組 DBM 可觀察到細胞無規則聚集在 DBM 支架孔隙間,細胞之間可互相重疊。見圖 4。
 圖4
雙基因轉染 BMSCs 種植 DBM 的體外觀察
圖4
雙基因轉染 BMSCs 種植 DBM 的體外觀察
a. 倒置相差顯微鏡觀察(×100);b. 空白 DBM 掃描電鏡觀察(×2 000);c. 雙基因轉染組 DBM 掃描電鏡觀察(×2 000)
Figure4. In vitro observation of double genes transfected BMSCs implanted with DBMa. Inverted phase contrast microscope observation (×100); b. Scanning electron microscope observation of blank DBM (×2 000); c. Scanning electron microscope observation of DBM in double gene transfection group (×2 000)
2.2.2 HE 染色觀察
術后 4 周,各組均可見纖維組織和纖維細胞成束排列,伴有較多炎癥細胞浸潤,主要為淋巴細胞,部分伴結締組織壞死、組織充血,可見較多紅細胞。與 A、B、C 組比較,D 組可見少量新骨組織形成,A、B、C 組間無明顯差異。術后 8 周,各組均可見新骨組織形成,其中 D 組新骨組織形成最多、最明顯,可見骨陷窩;B、C 組相較于 A 組皆可見較多新骨組織形成。各組炎癥細胞較 4 周時吸收減少。見圖 5。
 圖5
各組皮下異位成骨 HE 染色觀察(倒置相差顯微鏡×100)
圖5
各組皮下異位成骨 HE 染色觀察(倒置相差顯微鏡×100)
從左至右依次為 A、B、C、D 組 a. 術后 4 周;b. 術后 8 周
Figure5. HE staining observation of subcutaneous ectopic osteogenesis in each group (Inverted phase contrast microscope×100)From left to right for groups A, B, C, and D, respectively a. At 4 weeks after operation; b. At 8 weeks after operation
2.2.3 ALP 染色觀察
術后 8 周,各組均可見顏色深淺不一的鈣結節,D 組呈深棕色和深黑色,B、C 組呈大量棕色,A 組鈣結節較少、呈較淺棕色。表明 D 組 ALP 活性最高,有更好的成骨表達。見圖 6。
 圖6
各組皮下異位成骨 ALP 染色觀察(倒置相差顯微鏡×100)
圖6
各組皮下異位成骨 ALP 染色觀察(倒置相差顯微鏡×100)
a. A 組;b. B 組;c. C 組;d. D 組
Figure6. ALP staining of subcutaneous ectopic osteogenesis in each group (Inverted phase contrast microscope×100)a. Group A; b. Group B; c. Group C; d. Group D
2.2.4 實時熒光定量 PCR 檢測成骨相關基因表達
與 A 組比較,B、D 組 Runx2 mRNA 相對表達量顯著升高,B、C、D 組 ALP mRNA 相對表達量顯著升高,D 組 OCN mRNA 相對表達量顯著升高,差異均有統計學意義(P<0.05);其余各組間比較各基因相對表達量差異均無統計學意義(P>0.05)。見圖 7。
 圖7
實時熒光定量 PCR 檢測各組成骨相關基因表達
圖7
實時熒光定量 PCR 檢測各組成骨相關基因表達
a. Runx2;b. ALP;c. OCN
Figure7. The expression of osteogenesis related genes detected by real-time fluorescent quantitative PCRa. Runx2; b. ALP; c. OCN
3 討論
組織工程骨的構建是骨組織工程最基礎的研究。通過皮下異位成骨的實驗研究,初步探討組織工程骨的成骨能力,可為其用于臨床治療骨缺損提供理論依據[10]。BMSCs 具有來源豐富、取材方便、多向分化、免疫原性低以及強大的自我更新能力,在一定條件下可以分化為成骨細胞、軟骨細胞、脂肪細胞、神經細胞等,目前主要用于抗炎修復、細胞移植、基因治療和骨組織工程等方面。近年文獻報道,神經因子對骨折愈合起著重要作用,神經因子可影響機體反應,從而調節細胞的增殖、遷移、分化以及凋亡。NGF 是一種常見的神經營養因子,具有促進骨痂生成和骨折愈合的作用,NGF 通過促進突觸發育,在骨折局部營養神經的再生,以及調節多種神經肽類的釋放,增強局部血供,從而促進成骨作用[7, 11]。
P75NTR 抑制骨組織修復的表現在于,首先,P75NTR 表達升高能抑制四肢血管、肺血管和視網膜血管的再生,從而影響骨折愈合[12-14]。其次,骨折不愈合局部 P75NTR 表達升高,可通過下調絲氨酸蛋白酶、組織型纖溶酶原激活物和上調纖溶酶原激活物抑制劑 1 限制纖維蛋白的降解,阻礙骨折愈合[15-16]。同樣,本課題組前期研究發現,在骨折不愈合處 P75NTR 處于一種高表達狀態,分析 P75NTR 與骨折不愈合相關[17]。慢病毒構建過表達 P75NTR 轉染 BMSCs 的體外成骨分化實驗研究發現,過表達 P75NTR 可抑制 BMSCs 成骨分化,具有成骨抑制作用[18]。因此,P75NTR 通過抑制纖維蛋白的降解和新生血管的生成,從而起到抑制成骨作用,導致骨折不愈合[19-21]。P75NTR 發揮該作用的機制主要與 P75NTR 介導的細胞凋亡有關,P75NTR 通過 NF-κB、JNK-p53-Bax 及神經酰胺 3 條通路介導細胞凋亡[22-24]。因此,理論上 P75NTR 可以誘導靶細胞死亡,抑制 P75NTR 可以有效減少細胞凋亡,提高細胞的活性,使其更好地向成骨定向分化。
本研究首先通過慢病毒介導沉默 P75NTR 基因、NGF 過表達基因、沉默 P75NTR 和 NGF 過表達雙基因轉染 BMSCs,熒光顯微鏡和 Western blot 初步檢測了相關目的基因熒光度和蛋白的表達;CCK-8 法檢測轉染后細胞活性變化,顯示雙基因轉染后可顯著促進細胞增殖能力。ALP 是一種成骨標志物,廣泛存在于機體各種組織細胞中,如肝臟、血管、卵巢等處,改良鈣鈷法可根據沉淀顏色評價酶活性,隨著成骨分化作用的增強,硫化鈷沉淀顏色越深,其酶活性也越高[8-9]。本研究通過 HE 染色及 ALP 染色發現,雙基因轉染組在局部有更多新骨組織表達和鈣結節沉積。最后,通過實時熒光定量 PCR 檢測示,雙基因轉染組成骨相關基因 Runx2、ALP 和 OCN mRNA 相對表達量均明顯高于未轉染組。從上述結果分析,雙基因轉染比未轉染組具有更強的促成骨能力。
綜上述,沉默 P75NTR 聯合 NGF 過表達雙基因共轉染 BMSCs 復合 DBM 構建組織工程骨,具有良好的異位成骨能力,通過提高 NGF 的水平、關閉 P75NTR 凋亡通道,不僅可以提高細胞活性,還能更好促進骨組織再生。P75NTR 和 NGF 雙基因促進成骨的效果對比單基因更為明顯,二者可以形成一種良好的復合因子,有助于提高細胞活性,具有良好的成骨作用,為骨組織工程治療骨缺損提供了新思路和理論依據。
作者貢獻:貝朝涌負責實驗設計;陳俊毅負責實驗實施、實驗結果統計分析及文章撰寫;王寧、張衡負責文獻查詢及實驗評價;張賢平、趙利民、朱倫井、黎智君負責實驗結果收集整理。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經桂林醫學院動物實驗倫理委員會批準(GLMC201805018)。實驗動物使用許可證號:SYXK(湘)2016-0002。