引用本文: 陳秋竹, 李嶺, 解慧琪. 不同類型干細胞在缺血性腦卒中治療中的應用研究進展. 中國修復重建外科雜志, 2021, 35(1): 111-117. doi: 10.7507/1002-1892.202004160 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
腦卒中是指由各種病因引起的局灶性神經缺陷和血管性中樞系統損傷[1],通常發生在大腦局部血液供應突然中斷或大腦血管破裂、使血液溢出到腦細胞周圍空間時,同時可伴有血腦屏障(blood-brain barrier,BBB)功能障礙。腦卒中通常分為 3 種類型:出血性腦卒中(約占 10%)、缺血性腦卒中(約占 87%)和蛛網膜下腔出血(約占 3%),是造成殘疾和死亡的主要原因之一[2]。根據 2018 年《中國腦卒中防治報告》,以 2016 年綜合標化患病率測算,我國 40 歲以上人群現患和曾患腦卒中者1 242 萬,發病具有明顯年輕化趨勢,病后存活人群中 70% 遺留不同程度殘疾。其中,由于 BBB 被破壞導致的血管性水腫和出血性轉化是缺血性腦卒中較為嚴重的后遺癥,導致臨床預后較差。
缺血性腦卒中的治療旨在恢復腦組織的血流灌注、改善循環,使用溶栓藥物溶栓治療以及血管內介入治療是臨床常用的兩種治療方法[3]。但溶栓治療存在治療時間窗狹窄和發生嚴重出血性并發癥的問題。血管內介入治療對術者急診操作專業知識要求較高,且存在遠端血栓、腦過度灌注損傷等一系列并發癥[4],限制了該治療方法的臨床應用。研究表明,干細胞移植治療缺血性腦卒中具有廣泛的應用前景,可實現細胞替代、功能重建以及神經修復等目的[5]。本文就近年來不同類型干細胞用于缺血性腦卒中治療研究進展進行簡要綜述。
1 研究文獻與方法
1.1 文獻來源
選取 PubMed 數據庫作為文獻數據的主要來源,以“neural stem cells”、“embryonic stem cells”、“mesenchymal stem cells”分別和“ischemic stroke”、“therapy”作為關鍵詞,運用 PubMed 中的 MeSH Terms 拓展關鍵詞(檢索時間為 2020 年 3 月 29 日),出版年份限定為 2000 年—2020 年。
1.2 文獻分析
采用計量法對篩選的文獻數據進行分析,去除重復文獻及相關度較小的文獻,綜合文獻內容以及目前國內外有關干細胞療法治療缺血性腦卒中的研究熱點及進程,總結不同類型干細胞對于缺血性腦卒中的治療作用。
2 研究結果
2.1 針對缺血性腦卒中的干細胞療法研究分析
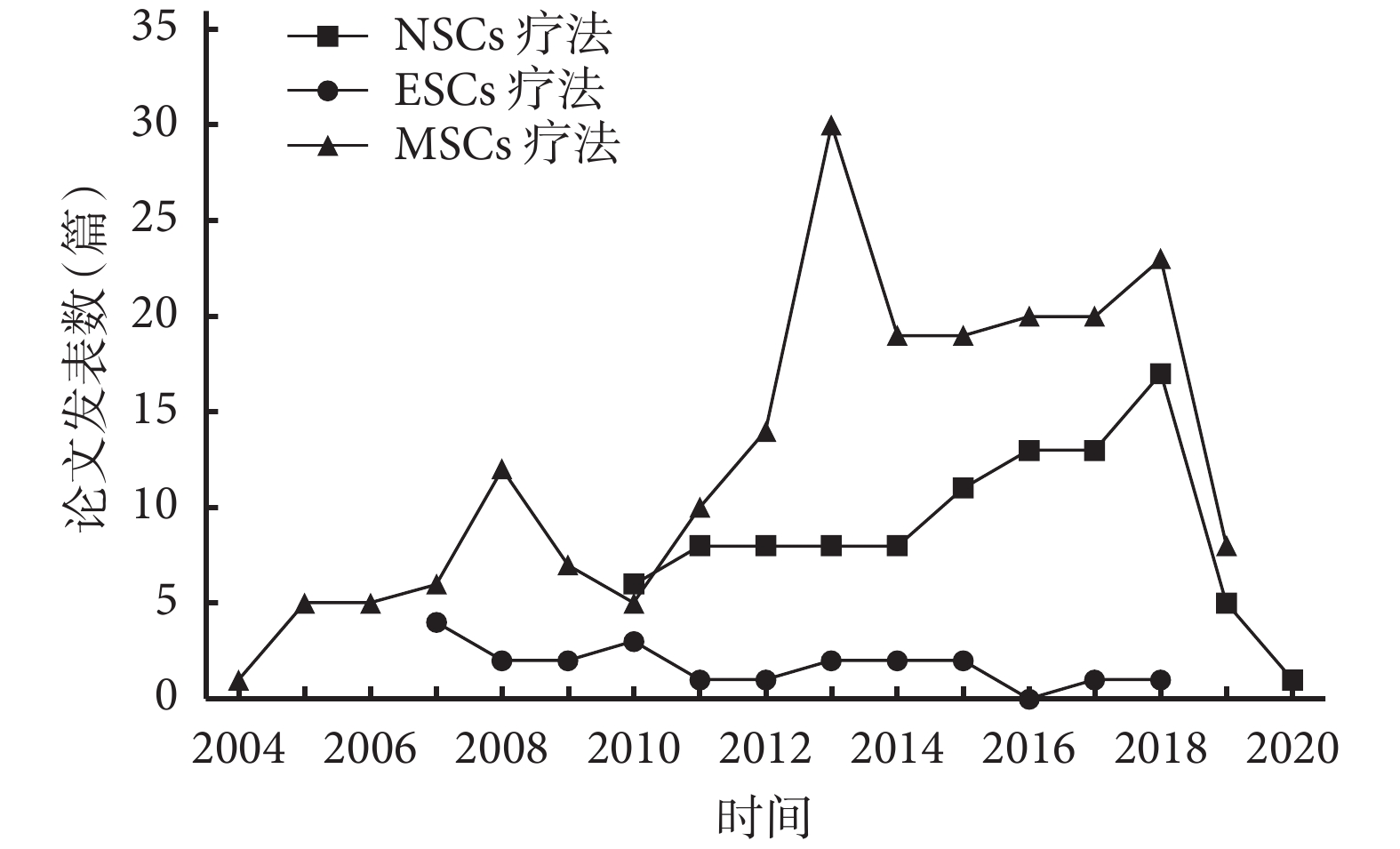
在過去的 20 年中,有關缺血性腦卒中的干細胞療法研究主要集中于胚胎干細胞(embryonic stem cells,ESCs)、神經干細胞(neural stem cells,NSCs)和 MSCs(以發表論文數量為依據,排除綜述和薈萃分析)。見表 1 及圖 1。
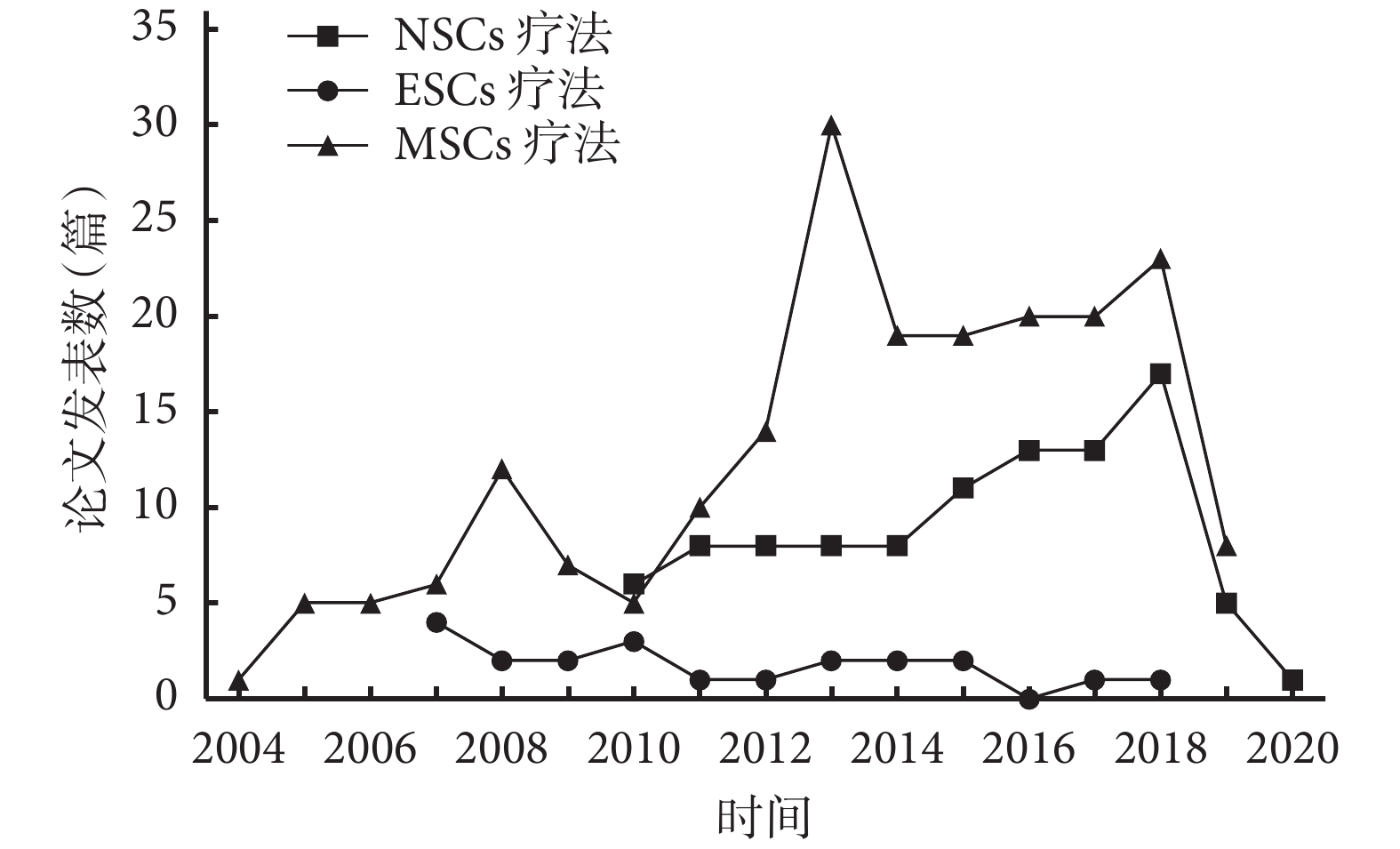 圖1
不同類型干細胞療法歷年研究情況
Figure1.
Research status of different types of stem cell therapy over recent years
圖1
不同類型干細胞療法歷年研究情況
Figure1.
Research status of different types of stem cell therapy over recent years
2.2 干細胞療法治療缺血性腦卒中的機制
因具有高度分化的特性,神經細胞死亡后不可再生,即具有不可逆性,相應區域會出現功能障礙。缺血性腦卒中可誘導代償性神經發生,但這種內源性修復的效果并不理想[6],神經細胞無法在損傷區域進行細胞替代、補充[7-9]。干細胞治療缺血性腦卒中的機制主要包括兩方面:① 旁分泌作用:由于腦內血管和神經纖維以較為有序方式伴行[10],移植的干細胞可沿血管遷移至缺血區,分泌相關的細胞因子來增強內源性修復。目前發現趨化因子基質細胞衍生因子 1 和單核細胞趨化蛋白 1,是與干細胞遷移和歸巢至缺血區相關的關鍵因子[11-12]。移植的干細胞誘導生成的 VEGF 可促進新血管形成,還具有一定抗炎作用[8]。② 細胞替代:通過向腦內移植外源性和內源性 NSCs,可刺激神經再生,替換、補充受損神經細胞,起到重建或修復受損腦神經網絡的作用[13]。干細胞治療缺血性腦卒中的廣泛作用機制,表明缺血性腦卒中患者腦部神經網絡的功能重建和修復是由多種機制介導的[14]。由于移植的干細胞存活率較低,干細胞療法主要通過有時限的旁分泌機制來發揮作用[15]。
2.3 干細胞療法在缺血性腦卒中治療中的應用
干細胞療法已成為缺血性腦卒中的一種實驗性治療方法[16]。越來越多證據表明,該療法可延長缺血性腦卒中患者的藥物干預時間窗、改善神經功能、減少梗死體積、促進神經細胞再生、改善患者預后[17]。目前主要有 4 種移植方法[18-20],詳見表 2。
2.3.1 NSCs
大量研究證明,成年哺乳動物體內仍存在神經發生。哺乳動物發育中的大腦內存在 NSCs,主要分布于腦室管膜室下區和海馬齒狀回的顆粒層下區,這些細胞具有自我更新、增殖和多向分化(分化為神經細胞、星形膠質細胞和少突膠質細胞等)的能力[21]。缺血性腦卒中發生后,休眠的內源性 NSCs 被激活,觸發腦室管膜室下區和腦室周圍器官的膠質形成和神經發生[22],介導缺血性腦損傷修復過程。但僅靠內源性 NSCs 誘導的神經發生在神經細胞替換修復中作用有限。為克服這一不足,研究者探索了用外源性 NSCs 介導缺血性腦損傷的修復[23]。內源性和外源性 NSCs 治療缺血性腦卒中的優缺點[9, 13]詳見表 3。
盡管 NSCs 對于治療缺血性腦卒中具有較大的潛力,但其在富含活性氧、炎癥因子和興奮性氨基酸的缺血區域微環境中療效有限[24],從而影響了干細胞移植治療的整體效果,因此單純 NSCs 移植已不能滿足臨床治療需要。研究發現,對 NSCs 進行基因修飾可誘導腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)過表達,進而調節神經細胞的存活和遷移來重建或改善神經網絡[24]。在閉塞右腦中動脈(occluding the right middle cerebral artery,MCAO)2 h 的腦缺血大鼠模型中,外源性 BDNF 上調了抗炎癥細胞因子 IL-10 及其 mRNA 的表達,同時下調了促炎癥細胞因子 TNF-α 及其 mRNA 的表達,還增加了 NF-κB 的 DNA 結合活性[25]。因此,通過基因修飾使 NSCs 過表達 BDNF 可有效促進缺血性腦卒中動物模型功能的恢復,改善預后[26]。然而,由于缺乏安全有效的 NSCs 基因載體,該類干細胞療法用于臨床前仍需進一步研究[24]。此外,由于需要從正常神經組織中提取自體 NSCs,為保證能夠提取到足量 NSCs,可能會對患者腦組織造成重大創傷,限制了 NSCs 的應用。
2.3.2 MSCs
MSCs 是一類來源于中胚層和神經層、不表達造血系相關標志、具有多向分化潛能的干細胞,可從骨髓、外周血、臍帶、胎盤、脂肪組織中提取分離[27],具有易獲取大量細胞的優點,因而被用于缺血性腦卒中治療研究中。
MSCs 治療缺血性腦卒中的作用機制表現在兩個方面:① 免疫調節和減輕腦卒中后炎癥;② 定向分化為神經細胞和星形膠質細胞等,補充、替代因缺血受損的細胞[22]。體外缺氧性腦卒中神經細胞和缺血性腦卒中動物模型研究表明,MSCs 可通過 VEGF 和 IL-6 信號通路降低 TNF-α 和 NF-κB 的表達[28]。研究表明,NF-κB 表達量降低與 MSCs 的抗炎和抗凋亡作用有關[29]。在缺血性腦卒中小鼠模型中,MSCs 可刺激星形膠質細胞釋放 IGF-1、VEGF、EGF、bFGF 等神經營養因子和生長因子[30]。最近,研究者還發現 MSCs 移植治療缺血性腦卒中,不僅通過旁分泌或轉分化機制,還依賴于線粒體轉移來挽救受損的腦微血管[31]。將星形膠質細胞的線粒體轉移至神經細胞中,可支持卒中后神經細胞的存活和恢復[32]。此外,微血管密度與梗死區 MSCs 的數量無明顯相關性,提示通過轉分化或細胞融合方式替代丟失的腦血管細胞,可能不是 MSCs 療法的主要作用機制[25]。
研究表明,MSCs 與周圍細胞、星形膠質細胞以及神經細胞的相互作用,可以促進和維持 BBB 完整性,恢復腦神經血管單位[33]。在缺血性腦卒中小鼠模型中,顱內注射 MSCs 可縮小梗死體積并改善小鼠行為。有研究表明,MSCs 可通過旁分泌作用影響嗜中性粒細胞的黏附和轉運,從而減弱基質金屬蛋白酶 9 從嗜中性粒細胞和駐留細胞中濾出的趨勢,這可能有助于減輕短暫 MCAO 后 BBB 的破壞[34],對于恢復缺血性腦卒中患者的腦神經血管單位以及血管的定向生成具有重要價值[28]。
2.3.3 ESCs
ESCs 是從早期胚胎或原始性腺中分離出來的一類細胞,具有持久或終生更新能力,能夠分化為幾乎所有的人類組織和器官;在特定體外培養條件下,可以誘導分化為神經系細胞[35]。2005 年,研究者首次將小鼠 ESCs 移植到嚴重局灶性缺血的大鼠大腦皮層,結果在病變腔中發現了 ESCs 衍生的神經細胞、星形膠質細胞、少突膠質細胞和內皮細胞的細胞表面標志物,并觀察到大鼠受損的大腦皮層結構修復和功能改善[36]。
將 ESCs 用于治療缺血性腦卒中的研究較少。有研究者將衍生自人類 ESCs 的神經前體細胞應用于小鼠缺血性腦卒中模型中,采用高效小分子 SMAD 抑制方案誘導的人 ESCs 源性神經前體細胞,在體外可分化為電生理功能神經細胞,移植到小鼠模型腦缺血區域后也能向神經細胞分化,增強神經細胞再生活動[37]。另外,人胚胎源性 NSCs 經 BDNF 預處理后,可提高缺氧缺血性腦卒中細胞移植的存活率和功能恢復[38]。然而,由于制備 ESCs 涉及破壞胚胎,其應用存在倫理問題。
2.4 BBB 對干細胞移植的影響
2.4.1 BBB 的生物學結構特征與生理學特性
BBB 是由腦部毛細血管內皮細胞、包裹毛細血管的星形膠質細胞末端和嵌入毛細血管基底膜的周細胞形成[39-40],是內皮細胞的高度選擇性半透膜邊界,可防止循環血液中溶質非選擇性地進入神經細胞所在的中樞神經系統(central nervous system,CNS)的細胞外液[41]。BBB 由高密度細胞組成,包含了腦毛細血管內皮細胞、基底膜和膠質細胞軸突,毛細血管內皮細胞之間通過鈣黏蛋白、連接黏附分子、閉合蛋白以及緊密連接蛋白相連[42]。這種緊密連接結構限制了細胞因子、藥物、細胞等直接通過 BBB 進行轉運。
2.4.2 BBB 在不同干細胞移植方式中對干細胞遷移的影響
干細胞的腦內移植是向大腦輸注干細胞的最常用方法,經腦脊液注射和腦實質立體定向移植的干細胞可直接到達腦部病損區域,不受 BBB 的影響,但這種侵入性方法存在手術風險高、直接的組織創傷引起炎癥以及免疫反應引起移植排斥等缺陷。與腦實質立體定向移植法相比,經外周血循環移植法具有微創和方便的特點,手術風險較低[43],其中靜脈移植法因在給藥過程中并發癥較少而應用較為廣泛。但 BBB 會顯著限制干細胞的輸送,進而影響經外周血循環移植干細胞的生物分布及有效性[44-45]。經鼻腔移植干細胞可繞過 BBB,直接到達 CNS 發揮靶向作用[46]。干細胞從鼻腔到腦部受損區域的遷移途徑可分為兩段,即從鼻黏膜到大腦和腦內遷移通路[47]。從鼻黏膜到大腦的其中一條潛在通路是嗅神經通路,移植的干細胞經細胞內嗅神經通路遷移首先需內化在嗅神經細胞中,然后通過軸突流進行轉運;干細胞經細胞外嗅神經通路轉運可更快進入腦脊液。經鼻腔注射后,可在蛛網膜下腔、嗅球不同層、丘腦和大腦皮層檢測到干細胞,且經鼻腔移植的干細胞可能會避開免疫系統防御[48]。
2.4.3 干細胞穿透 BBB 的分子機制
脈管系統中的白細胞穿透 BBB 主要依靠多步滾動、黏附及轉運來穿過 BBB 的內皮細胞,然后通過基質金屬蛋白酶介導的細胞外基質降解產生的間隙穿透內皮基底膜和周細胞[49]。而 MSCs 可以利用白細胞樣的多步歸巢級聯反應與內皮細胞結合。BMSCs 可表達多種白細胞歸巢因子,包括趨化因子受體(如 CXCR4、CCR2)和細胞黏附分子(如 CD44、整合素 α4 和 β1、CD99),但缺少一些關鍵的歸巢標記分子[50]。研究發現,在單層內皮細胞與 MSCs 的體外共培養體系中,內皮細胞之間的緊密連接被破壞,MSCs 與內皮細胞的相互作用伴隨著緊密的細胞接觸[51]。MSCs 通過血管細胞黏附分子 1、極晚期抗原 4 等黏附分子遷移穿過內皮屏障[52]。另外,研究者在 MCAO 模型中經動脈移植法注射了小鼠 BMSCs,結果發現缺血性腦卒中發生后腦血管內皮細胞呈現前黏附,有利于 MSCs 的募集,MSCs 上的 CD44 與內皮細胞上的 P-選擇素和 E-選擇素相互作用介導了 MSCs 的募集[53]。
2.4.4 移植干細胞穿透 BBB 的策略
在進行干細胞移植時,為提高干細胞從血液非侵入性輸送到大腦的移植率與生物分布,重點是能夠控制 BBB 的調節,以便讓更多數量干細胞到達大腦中特定區域[54]。動脈內輸注甘露醇可有效破壞 BBB[55],通過改變 BBB 兩側滲透壓使內皮細胞收縮,以暫時增大 BBB 中緊密連接的間隙[56],最終使干細胞進入大腦。但是,高滲溶液會使血液中潛在細胞毒性化合物直接進入 CNS 或導致腦部水腫[57]。目前腦部藥物、基因與干細胞遞送研究中,運用較多的在特定大腦區域打開 BBB 的方法是經 MRI 引導下聚焦超聲法[58],該方法可作為一種通過暫時打開 BBB 將干細胞從血液遞送到腦內目標區域的新策略,也有望作為干細胞移植的有創顱內手術的有效替代方法。目前研究已表明,經 MRI 引導下聚焦超聲法誘導 BBB 破壞后,NSCs 順利從血液進入腦組織[58-59]。
在病理狀態下,CNS 受到損傷后,內皮細胞、星形膠質細胞等相關細胞激活可導致該緊密連接的完整性降低,并形成跨內皮細胞通道[60],使干細胞進入大腦內部。
2.5 缺血性腦卒中干細胞療法的臨床研究進展
大量研究均證實,干細胞移植治療缺血性腦卒中能明顯改善患者的神經功能,越來越多干細胞療法進入臨床研究。目前已有 50 項針對缺血性腦卒中的干細胞療法在 ClinicalTrials.gov 注冊進入臨床研究,其中 16 項(截至 2020 年 4 月 10 日)已完成了階段性臨床試驗(表 4)。
其中較為典型的病例是 Lancet Neurology 2017 年發表的采用同種異體 BMSCs 產品 MultiStem 治療中重度缺血性腦卒中的Ⅱ期臨床試驗結果[65],結果顯示腦卒中患者靜脈輸注 MultiStem 后耐受較好,不會產生嚴重副作用,治療后炎癥細胞因子顯著減少,可加速恢復,且 MultiStem 的移植治療無需組織配型或免疫抑制。目前 MultiStem 正在進行Ⅲ期臨床試驗。
我國 2018 年國家重點研發計劃資助項目“神經干細胞腦內精準移植治療腦卒中的臨床研究”在多家臨床研究中心開展。2019 年,上海交通大學附屬仁濟醫院也完成了“人源神經干細胞治療缺血性卒中的單中心隨機對照研究”項目備案。2019 年,解放軍總醫院干細胞臨床研究團隊在 Stem Cell Translational Medicine 上發表了用 NSCs 治療缺血性腦卒中的Ⅰ期臨床研究結果,表明人源性 NSCs(NSI-566)對于偏癱性卒中患者運動功能恢復的治療潛力[67]。
3 總結與展望
由于神經損傷具有不可逆性,藥物和手術治療缺血性腦卒中無法獲得滿意結果,干細胞移植技術是具有前景的治療策略。近年來,基于 NSCs 的腦卒中治療策略的臨床研究取得了一定成果,但不同的細胞類型、移植途徑、注射劑量、梗死灶大小以及患者合并的基礎疾病,均可能造成療效差異,因此還需要大量研究尋找最佳治療策略和移植方案。此外,目前有關缺血性腦卒中的干細胞療法大多聚焦于動物實驗和體外模型,與患者實際情況存在差異。因此,在針對缺血性腦卒中開發出新型、更準確的模型和更有效的治療方法方面仍面臨巨大挑戰。
作者貢獻:陳秋竹負責綜述構思、查閱文獻及撰寫論文;解慧琪、李嶺負責設計文章整體框架,把握內容準確、科學,修改并審核全文。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點。
腦卒中是指由各種病因引起的局灶性神經缺陷和血管性中樞系統損傷[1],通常發生在大腦局部血液供應突然中斷或大腦血管破裂、使血液溢出到腦細胞周圍空間時,同時可伴有血腦屏障(blood-brain barrier,BBB)功能障礙。腦卒中通常分為 3 種類型:出血性腦卒中(約占 10%)、缺血性腦卒中(約占 87%)和蛛網膜下腔出血(約占 3%),是造成殘疾和死亡的主要原因之一[2]。根據 2018 年《中國腦卒中防治報告》,以 2016 年綜合標化患病率測算,我國 40 歲以上人群現患和曾患腦卒中者1 242 萬,發病具有明顯年輕化趨勢,病后存活人群中 70% 遺留不同程度殘疾。其中,由于 BBB 被破壞導致的血管性水腫和出血性轉化是缺血性腦卒中較為嚴重的后遺癥,導致臨床預后較差。
缺血性腦卒中的治療旨在恢復腦組織的血流灌注、改善循環,使用溶栓藥物溶栓治療以及血管內介入治療是臨床常用的兩種治療方法[3]。但溶栓治療存在治療時間窗狹窄和發生嚴重出血性并發癥的問題。血管內介入治療對術者急診操作專業知識要求較高,且存在遠端血栓、腦過度灌注損傷等一系列并發癥[4],限制了該治療方法的臨床應用。研究表明,干細胞移植治療缺血性腦卒中具有廣泛的應用前景,可實現細胞替代、功能重建以及神經修復等目的[5]。本文就近年來不同類型干細胞用于缺血性腦卒中治療研究進展進行簡要綜述。
1 研究文獻與方法
1.1 文獻來源
選取 PubMed 數據庫作為文獻數據的主要來源,以“neural stem cells”、“embryonic stem cells”、“mesenchymal stem cells”分別和“ischemic stroke”、“therapy”作為關鍵詞,運用 PubMed 中的 MeSH Terms 拓展關鍵詞(檢索時間為 2020 年 3 月 29 日),出版年份限定為 2000 年—2020 年。
1.2 文獻分析
采用計量法對篩選的文獻數據進行分析,去除重復文獻及相關度較小的文獻,綜合文獻內容以及目前國內外有關干細胞療法治療缺血性腦卒中的研究熱點及進程,總結不同類型干細胞對于缺血性腦卒中的治療作用。
2 研究結果
2.1 針對缺血性腦卒中的干細胞療法研究分析
在過去的 20 年中,有關缺血性腦卒中的干細胞療法研究主要集中于胚胎干細胞(embryonic stem cells,ESCs)、神經干細胞(neural stem cells,NSCs)和 MSCs(以發表論文數量為依據,排除綜述和薈萃分析)。見表 1 及圖 1。
 圖1
不同類型干細胞療法歷年研究情況
Figure1.
Research status of different types of stem cell therapy over recent years
圖1
不同類型干細胞療法歷年研究情況
Figure1.
Research status of different types of stem cell therapy over recent years
2.2 干細胞療法治療缺血性腦卒中的機制
因具有高度分化的特性,神經細胞死亡后不可再生,即具有不可逆性,相應區域會出現功能障礙。缺血性腦卒中可誘導代償性神經發生,但這種內源性修復的效果并不理想[6],神經細胞無法在損傷區域進行細胞替代、補充[7-9]。干細胞治療缺血性腦卒中的機制主要包括兩方面:① 旁分泌作用:由于腦內血管和神經纖維以較為有序方式伴行[10],移植的干細胞可沿血管遷移至缺血區,分泌相關的細胞因子來增強內源性修復。目前發現趨化因子基質細胞衍生因子 1 和單核細胞趨化蛋白 1,是與干細胞遷移和歸巢至缺血區相關的關鍵因子[11-12]。移植的干細胞誘導生成的 VEGF 可促進新血管形成,還具有一定抗炎作用[8]。② 細胞替代:通過向腦內移植外源性和內源性 NSCs,可刺激神經再生,替換、補充受損神經細胞,起到重建或修復受損腦神經網絡的作用[13]。干細胞治療缺血性腦卒中的廣泛作用機制,表明缺血性腦卒中患者腦部神經網絡的功能重建和修復是由多種機制介導的[14]。由于移植的干細胞存活率較低,干細胞療法主要通過有時限的旁分泌機制來發揮作用[15]。
2.3 干細胞療法在缺血性腦卒中治療中的應用
干細胞療法已成為缺血性腦卒中的一種實驗性治療方法[16]。越來越多證據表明,該療法可延長缺血性腦卒中患者的藥物干預時間窗、改善神經功能、減少梗死體積、促進神經細胞再生、改善患者預后[17]。目前主要有 4 種移植方法[18-20],詳見表 2。
2.3.1 NSCs
大量研究證明,成年哺乳動物體內仍存在神經發生。哺乳動物發育中的大腦內存在 NSCs,主要分布于腦室管膜室下區和海馬齒狀回的顆粒層下區,這些細胞具有自我更新、增殖和多向分化(分化為神經細胞、星形膠質細胞和少突膠質細胞等)的能力[21]。缺血性腦卒中發生后,休眠的內源性 NSCs 被激活,觸發腦室管膜室下區和腦室周圍器官的膠質形成和神經發生[22],介導缺血性腦損傷修復過程。但僅靠內源性 NSCs 誘導的神經發生在神經細胞替換修復中作用有限。為克服這一不足,研究者探索了用外源性 NSCs 介導缺血性腦損傷的修復[23]。內源性和外源性 NSCs 治療缺血性腦卒中的優缺點[9, 13]詳見表 3。
盡管 NSCs 對于治療缺血性腦卒中具有較大的潛力,但其在富含活性氧、炎癥因子和興奮性氨基酸的缺血區域微環境中療效有限[24],從而影響了干細胞移植治療的整體效果,因此單純 NSCs 移植已不能滿足臨床治療需要。研究發現,對 NSCs 進行基因修飾可誘導腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)過表達,進而調節神經細胞的存活和遷移來重建或改善神經網絡[24]。在閉塞右腦中動脈(occluding the right middle cerebral artery,MCAO)2 h 的腦缺血大鼠模型中,外源性 BDNF 上調了抗炎癥細胞因子 IL-10 及其 mRNA 的表達,同時下調了促炎癥細胞因子 TNF-α 及其 mRNA 的表達,還增加了 NF-κB 的 DNA 結合活性[25]。因此,通過基因修飾使 NSCs 過表達 BDNF 可有效促進缺血性腦卒中動物模型功能的恢復,改善預后[26]。然而,由于缺乏安全有效的 NSCs 基因載體,該類干細胞療法用于臨床前仍需進一步研究[24]。此外,由于需要從正常神經組織中提取自體 NSCs,為保證能夠提取到足量 NSCs,可能會對患者腦組織造成重大創傷,限制了 NSCs 的應用。
2.3.2 MSCs
MSCs 是一類來源于中胚層和神經層、不表達造血系相關標志、具有多向分化潛能的干細胞,可從骨髓、外周血、臍帶、胎盤、脂肪組織中提取分離[27],具有易獲取大量細胞的優點,因而被用于缺血性腦卒中治療研究中。
MSCs 治療缺血性腦卒中的作用機制表現在兩個方面:① 免疫調節和減輕腦卒中后炎癥;② 定向分化為神經細胞和星形膠質細胞等,補充、替代因缺血受損的細胞[22]。體外缺氧性腦卒中神經細胞和缺血性腦卒中動物模型研究表明,MSCs 可通過 VEGF 和 IL-6 信號通路降低 TNF-α 和 NF-κB 的表達[28]。研究表明,NF-κB 表達量降低與 MSCs 的抗炎和抗凋亡作用有關[29]。在缺血性腦卒中小鼠模型中,MSCs 可刺激星形膠質細胞釋放 IGF-1、VEGF、EGF、bFGF 等神經營養因子和生長因子[30]。最近,研究者還發現 MSCs 移植治療缺血性腦卒中,不僅通過旁分泌或轉分化機制,還依賴于線粒體轉移來挽救受損的腦微血管[31]。將星形膠質細胞的線粒體轉移至神經細胞中,可支持卒中后神經細胞的存活和恢復[32]。此外,微血管密度與梗死區 MSCs 的數量無明顯相關性,提示通過轉分化或細胞融合方式替代丟失的腦血管細胞,可能不是 MSCs 療法的主要作用機制[25]。
研究表明,MSCs 與周圍細胞、星形膠質細胞以及神經細胞的相互作用,可以促進和維持 BBB 完整性,恢復腦神經血管單位[33]。在缺血性腦卒中小鼠模型中,顱內注射 MSCs 可縮小梗死體積并改善小鼠行為。有研究表明,MSCs 可通過旁分泌作用影響嗜中性粒細胞的黏附和轉運,從而減弱基質金屬蛋白酶 9 從嗜中性粒細胞和駐留細胞中濾出的趨勢,這可能有助于減輕短暫 MCAO 后 BBB 的破壞[34],對于恢復缺血性腦卒中患者的腦神經血管單位以及血管的定向生成具有重要價值[28]。
2.3.3 ESCs
ESCs 是從早期胚胎或原始性腺中分離出來的一類細胞,具有持久或終生更新能力,能夠分化為幾乎所有的人類組織和器官;在特定體外培養條件下,可以誘導分化為神經系細胞[35]。2005 年,研究者首次將小鼠 ESCs 移植到嚴重局灶性缺血的大鼠大腦皮層,結果在病變腔中發現了 ESCs 衍生的神經細胞、星形膠質細胞、少突膠質細胞和內皮細胞的細胞表面標志物,并觀察到大鼠受損的大腦皮層結構修復和功能改善[36]。
將 ESCs 用于治療缺血性腦卒中的研究較少。有研究者將衍生自人類 ESCs 的神經前體細胞應用于小鼠缺血性腦卒中模型中,采用高效小分子 SMAD 抑制方案誘導的人 ESCs 源性神經前體細胞,在體外可分化為電生理功能神經細胞,移植到小鼠模型腦缺血區域后也能向神經細胞分化,增強神經細胞再生活動[37]。另外,人胚胎源性 NSCs 經 BDNF 預處理后,可提高缺氧缺血性腦卒中細胞移植的存活率和功能恢復[38]。然而,由于制備 ESCs 涉及破壞胚胎,其應用存在倫理問題。
2.4 BBB 對干細胞移植的影響
2.4.1 BBB 的生物學結構特征與生理學特性
BBB 是由腦部毛細血管內皮細胞、包裹毛細血管的星形膠質細胞末端和嵌入毛細血管基底膜的周細胞形成[39-40],是內皮細胞的高度選擇性半透膜邊界,可防止循環血液中溶質非選擇性地進入神經細胞所在的中樞神經系統(central nervous system,CNS)的細胞外液[41]。BBB 由高密度細胞組成,包含了腦毛細血管內皮細胞、基底膜和膠質細胞軸突,毛細血管內皮細胞之間通過鈣黏蛋白、連接黏附分子、閉合蛋白以及緊密連接蛋白相連[42]。這種緊密連接結構限制了細胞因子、藥物、細胞等直接通過 BBB 進行轉運。
2.4.2 BBB 在不同干細胞移植方式中對干細胞遷移的影響
干細胞的腦內移植是向大腦輸注干細胞的最常用方法,經腦脊液注射和腦實質立體定向移植的干細胞可直接到達腦部病損區域,不受 BBB 的影響,但這種侵入性方法存在手術風險高、直接的組織創傷引起炎癥以及免疫反應引起移植排斥等缺陷。與腦實質立體定向移植法相比,經外周血循環移植法具有微創和方便的特點,手術風險較低[43],其中靜脈移植法因在給藥過程中并發癥較少而應用較為廣泛。但 BBB 會顯著限制干細胞的輸送,進而影響經外周血循環移植干細胞的生物分布及有效性[44-45]。經鼻腔移植干細胞可繞過 BBB,直接到達 CNS 發揮靶向作用[46]。干細胞從鼻腔到腦部受損區域的遷移途徑可分為兩段,即從鼻黏膜到大腦和腦內遷移通路[47]。從鼻黏膜到大腦的其中一條潛在通路是嗅神經通路,移植的干細胞經細胞內嗅神經通路遷移首先需內化在嗅神經細胞中,然后通過軸突流進行轉運;干細胞經細胞外嗅神經通路轉運可更快進入腦脊液。經鼻腔注射后,可在蛛網膜下腔、嗅球不同層、丘腦和大腦皮層檢測到干細胞,且經鼻腔移植的干細胞可能會避開免疫系統防御[48]。
2.4.3 干細胞穿透 BBB 的分子機制
脈管系統中的白細胞穿透 BBB 主要依靠多步滾動、黏附及轉運來穿過 BBB 的內皮細胞,然后通過基質金屬蛋白酶介導的細胞外基質降解產生的間隙穿透內皮基底膜和周細胞[49]。而 MSCs 可以利用白細胞樣的多步歸巢級聯反應與內皮細胞結合。BMSCs 可表達多種白細胞歸巢因子,包括趨化因子受體(如 CXCR4、CCR2)和細胞黏附分子(如 CD44、整合素 α4 和 β1、CD99),但缺少一些關鍵的歸巢標記分子[50]。研究發現,在單層內皮細胞與 MSCs 的體外共培養體系中,內皮細胞之間的緊密連接被破壞,MSCs 與內皮細胞的相互作用伴隨著緊密的細胞接觸[51]。MSCs 通過血管細胞黏附分子 1、極晚期抗原 4 等黏附分子遷移穿過內皮屏障[52]。另外,研究者在 MCAO 模型中經動脈移植法注射了小鼠 BMSCs,結果發現缺血性腦卒中發生后腦血管內皮細胞呈現前黏附,有利于 MSCs 的募集,MSCs 上的 CD44 與內皮細胞上的 P-選擇素和 E-選擇素相互作用介導了 MSCs 的募集[53]。
2.4.4 移植干細胞穿透 BBB 的策略
在進行干細胞移植時,為提高干細胞從血液非侵入性輸送到大腦的移植率與生物分布,重點是能夠控制 BBB 的調節,以便讓更多數量干細胞到達大腦中特定區域[54]。動脈內輸注甘露醇可有效破壞 BBB[55],通過改變 BBB 兩側滲透壓使內皮細胞收縮,以暫時增大 BBB 中緊密連接的間隙[56],最終使干細胞進入大腦。但是,高滲溶液會使血液中潛在細胞毒性化合物直接進入 CNS 或導致腦部水腫[57]。目前腦部藥物、基因與干細胞遞送研究中,運用較多的在特定大腦區域打開 BBB 的方法是經 MRI 引導下聚焦超聲法[58],該方法可作為一種通過暫時打開 BBB 將干細胞從血液遞送到腦內目標區域的新策略,也有望作為干細胞移植的有創顱內手術的有效替代方法。目前研究已表明,經 MRI 引導下聚焦超聲法誘導 BBB 破壞后,NSCs 順利從血液進入腦組織[58-59]。
在病理狀態下,CNS 受到損傷后,內皮細胞、星形膠質細胞等相關細胞激活可導致該緊密連接的完整性降低,并形成跨內皮細胞通道[60],使干細胞進入大腦內部。
2.5 缺血性腦卒中干細胞療法的臨床研究進展
大量研究均證實,干細胞移植治療缺血性腦卒中能明顯改善患者的神經功能,越來越多干細胞療法進入臨床研究。目前已有 50 項針對缺血性腦卒中的干細胞療法在 ClinicalTrials.gov 注冊進入臨床研究,其中 16 項(截至 2020 年 4 月 10 日)已完成了階段性臨床試驗(表 4)。
其中較為典型的病例是 Lancet Neurology 2017 年發表的采用同種異體 BMSCs 產品 MultiStem 治療中重度缺血性腦卒中的Ⅱ期臨床試驗結果[65],結果顯示腦卒中患者靜脈輸注 MultiStem 后耐受較好,不會產生嚴重副作用,治療后炎癥細胞因子顯著減少,可加速恢復,且 MultiStem 的移植治療無需組織配型或免疫抑制。目前 MultiStem 正在進行Ⅲ期臨床試驗。
我國 2018 年國家重點研發計劃資助項目“神經干細胞腦內精準移植治療腦卒中的臨床研究”在多家臨床研究中心開展。2019 年,上海交通大學附屬仁濟醫院也完成了“人源神經干細胞治療缺血性卒中的單中心隨機對照研究”項目備案。2019 年,解放軍總醫院干細胞臨床研究團隊在 Stem Cell Translational Medicine 上發表了用 NSCs 治療缺血性腦卒中的Ⅰ期臨床研究結果,表明人源性 NSCs(NSI-566)對于偏癱性卒中患者運動功能恢復的治療潛力[67]。
3 總結與展望
由于神經損傷具有不可逆性,藥物和手術治療缺血性腦卒中無法獲得滿意結果,干細胞移植技術是具有前景的治療策略。近年來,基于 NSCs 的腦卒中治療策略的臨床研究取得了一定成果,但不同的細胞類型、移植途徑、注射劑量、梗死灶大小以及患者合并的基礎疾病,均可能造成療效差異,因此還需要大量研究尋找最佳治療策略和移植方案。此外,目前有關缺血性腦卒中的干細胞療法大多聚焦于動物實驗和體外模型,與患者實際情況存在差異。因此,在針對缺血性腦卒中開發出新型、更準確的模型和更有效的治療方法方面仍面臨巨大挑戰。
作者貢獻:陳秋竹負責綜述構思、查閱文獻及撰寫論文;解慧琪、李嶺負責設計文章整體框架,把握內容準確、科學,修改并審核全文。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點。