引用本文: 張棟, 宗憲磊, 郭小雙, 杜宏, 宋國棟, 靳小雷. 不同燒結溫度對雙相鈣磷陶瓷顆粒材料介孔結構及其成骨性能的影響. 中國修復重建外科雜志, 2021, 35(1): 95-103. doi: 10.7507/1002-1892.202007074 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
由外傷、腫瘤、先天性畸形、手術等多種因素導致的骨缺損和骨不連臨床較常見,治療方案包括自體骨移植、同種異體骨移植、異種異體骨移植、人工合成生物材料植入等。其中自體骨移植被認為是治療骨缺損的“金標準”[1-2],但存在供骨量有限、供區損傷及感染等缺陷;同種及異種異體骨移植也存在潛在疾病傳染、血管化程度差、免疫排斥等風險。因此,使用優質人工合成生物材料逐漸成為治療骨缺損的熱點。
磷酸鈣(cacium phosphate,CaP)類材料主要包括羥基磷灰石(hydroxyapatite,HA)、β-磷酸三鈣(β-tricalcium phosphate,β-TCP)、雙相鈣磷陶瓷(biphasic calcium phosphate,BCP)和磷酸鈣類骨水泥等[3]。因其與人體自身骨組織的無機成分磷灰石相似,具備不同程度的生物相容性、骨傳導性和骨誘導性,成為頜面外科骨缺損和骨修復的研究熱點[4-5]。但是目前人工合成的 CaP 類材料組分和微結構往往與人骨磷灰石存在差異,不同 CaP 材料的成骨能力差異顯著。其中將兩種 CaP 材料按不同比例混合制備的 BCP 材料,能有效避免單一材料強度低、降解變異大的缺陷,實現更為優異的骨傳導性、骨誘導性[4, 6-7],具備巨大臨床應用潛力[8-10]。
BMSCs 是一種在骨髓基質中廣泛存在且具有多向分化潛能的細胞,在不同條件下經誘導可分化為成骨細胞、軟骨細胞及脂肪細胞等不同細胞系。既往研究利用動物機體作為生物反應器構建人工骨,通過將 BCP 材料植入比格犬背部,證實 BMSCs 作為干細胞參與了 BCP 材料的異位誘導成骨[6]。本課題組前期研究[8]在體外將 BMSCs 與 BCP 材料共培養,ALP 分泌顯著升高,提示 BCP 材料能夠顯著提高 BMSCs 的成骨分化潛能。實時熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)檢測結果顯示,隨著共培養時間延長,成骨相關基因骨橋蛋白(osteopontin,OPN)、Ⅰ 型膠原蛋白、Runx2 表達水平逐步上升;而加入了成骨信號通路抑制劑(RO4929097)的組別,成骨相關基因表達水平均明顯下降。證實將 BMSCs 與 BCP 材料共培養,在早期可上調成骨信號通路相關基因表達,從而促進其骨向分化。同時,大量研究證實 BCP 材料的配比和宏觀結構不同,會導致成骨效果差異顯著[4-5];但微觀結構,尤其是介孔直徑等具體參數對成骨效果的影響,目前研究尚無明確結論。
BCP 材料在不同溫度下燒結,會形成不同的微觀結構,其中介孔直徑會隨溫度不同而產生差異[11]。基于此,本研究設計在 3 種溫度下燒制 3 種不同介孔直徑的顆粒狀 BCP 材料,通過體內外實驗檢測其成骨能力的差異。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
4 周齡雌性 SD 大鼠 5 只,體質量 180~230 g;1 歲齡比格犬 9 只,雌雄不限,體質量 12~14 kg;由中國醫學科學院北京協和醫學院整形外科醫院提供。
α-MEM 培養基、FBS(GIBCO 公司,美國);細胞計數試劑盒 8(cell counting kit 8,CCK-8),Masson、番紅固綠及 HE 染色試劑(上海碧云天生物技術有限公司);RNA 提取試劑盒(Qiagen 公司,德國);逆轉錄試劑盒(北京全式金生物技術有限公司)。掃描電鏡(FEI 公司,美國);轉盤式激光共聚焦顯微鏡(Olympus 公司,日本)。
1.2 材料的生物相容性評價
1.2.1 BCP 的制備及評估
將 HA 與 β-TCP 以 8∶2 比例混合,分別在 1 050、1 150 及 1 250℃ 下燒制 3 h 制備 3 種 BCP 材料(分別設為材料 1、2、3),材料孔隙率設計為 60%~70%。將 3 種材料打磨成直徑 2 mm 的細顆粒。采用比表面積測試法(Brunauer-Emmett-Teller test,BET)測量材料顆粒內部孔隙率及介孔直徑、體積、面積,X 線衍射(X-ray diffraction、XRD)評估材料組成成分,掃描電鏡觀察材料微觀表面形態。每種材料送檢樣本約 1 g,BET 檢測數據為整體樣本的均數。材料的制備及評估均于四川大學生物材料工程研究中心完成。
1.2.2 材料與大鼠 BMSCs 共培養
取 4 周齡 SD 大鼠斷頸處死后獲取股骨,針管抽取 5 mL 含 10%FBS 的 α-MEM 培養基將骨髓沖出并接種于 10 cm 培養皿,靜置 48 h 后換液;將獲得的貼壁細胞每 3~5 天傳代,培養至第 3 代備用。將 BCP 材料 1、2、3 置于 24 孔板底,分別設為 A、B、C 組,每組 4 孔,覆蓋 75% 孔底部面積,先后以 PBS 液、無血清 α-MEM 培養基、含 10%FBS 的 α-MEM 培養基反復浸泡各 24 h;然后與第 3 代 BMSCs(1×105個/mL)共培養。
1.2.3 觀測指標
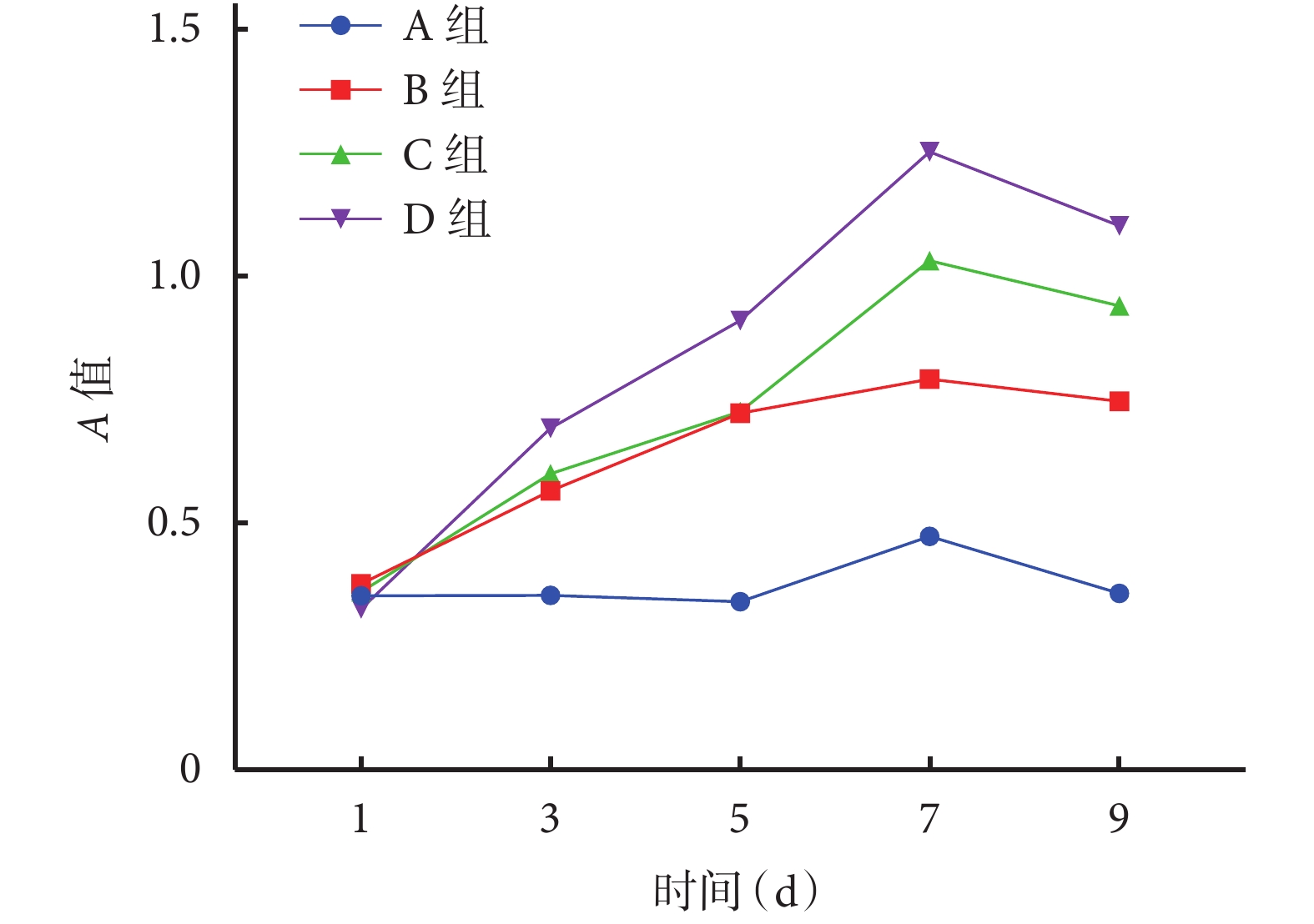
① 掃描電鏡觀察:材料與 BMSCs 共培養 7 d 后,加 2% 戊二醛固定 24~48 h,梯度乙醇脫水后乙酸異戊酯置換 2 次,常規 CO2 臨界干燥器干燥、真空條件下噴濺鉑金離子,掃描電鏡觀察細胞黏附情況。② 鬼筆環肽染色:采用 24 孔板進行實驗,3 種 BCP 材料分別與 BMSCs 共培養 7 d 后,進行鬼筆環肽染色,使用轉盤式激光共聚焦顯微鏡觀察 BMSCs 貼附于材料表面后的形態。③ CCK-8 法檢測細胞增殖活性:采用 96 孔板進行實驗,同上法將 BMSCs 分別接種于 3 組 BCP 材料(A、B、C 組),另設單純 BMSCs 作為空白對照組(D 組),每組 5 個復孔。培養 1、3、5、7、9 d 采用 CCK-8 法測量 450 nm 波長下吸光度(A)值。
1.3 動物體內實驗評價材料成骨能力
1.3.1 比格犬異位成骨分組及模型構建
取 9 只 1 歲齡比格犬,肌肉注射舒泰(0.50~0.55 mg/kg)、阿托品 1 mL、速眠新 0.5 mL 麻醉后,常規備皮消毒,于背部正中切開長約 10 cm 切口,在每只犬雙側豎脊肌內均勻制作 9 個直徑約 2 cm、深度約 3 cm 的肌袋。將 9 個肌袋隨機分為 3 組,每組 3 個肌袋,A、B、C 組肌袋內分別置入 1 g 材料 1、2、3,然后逐層關閉切口。術中及術后 3 d 每日予以青霉素 80 萬 U 肌肉注射預防感染。
1.3.2 HE、Masson 及番紅固綠染色
分別于術后 1、2、3 個月隨機同上法麻醉 3 只比格犬,切取肌袋內包埋的材料,觀察大體形態;每組每時間點共 9 個標本,隨機選取其中 4 個標本,經 4% 多聚甲醛固定后常規制備 4 μm 厚切片,行 HE、Masson 及番紅固綠染色觀察。于放大 10 倍的 Masson 染色切片中每張隨機取 3 個視野,采用 Image J 軟件測量并按以下公式計算 BCP 間隙中的成骨面積比,成骨面積比=BCP 間隙骨組織面積/BCP 間隙面積×100%。
1.3.3 qRT-PCR 檢測
分別于術后 1、2、3 個月同上法取材,根據 RNA 提取試劑盒說明提取材料中心位置區域的 RNA,取 1 000 ng RNA 按逆轉錄試劑盒說明逆轉錄為 cDNA。使用 Primer 6 軟件設計引物序列(表 1),由北京擎科生物科技有限公司合成。通過 Roche 480 系統完成 qRT-PCR 檢測,采用 2?ΔΔCt 法計算各成骨相關基因[ALP、OPN、骨鈣素(osteocalcin,OC)]mRNA 相對表達量。
1.4 統計學方法
采用 SPSS23.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準取雙側 α=0.05。
2 結果
2.1 材料的生物相容性評價
2.1.1 BCP 材料評估
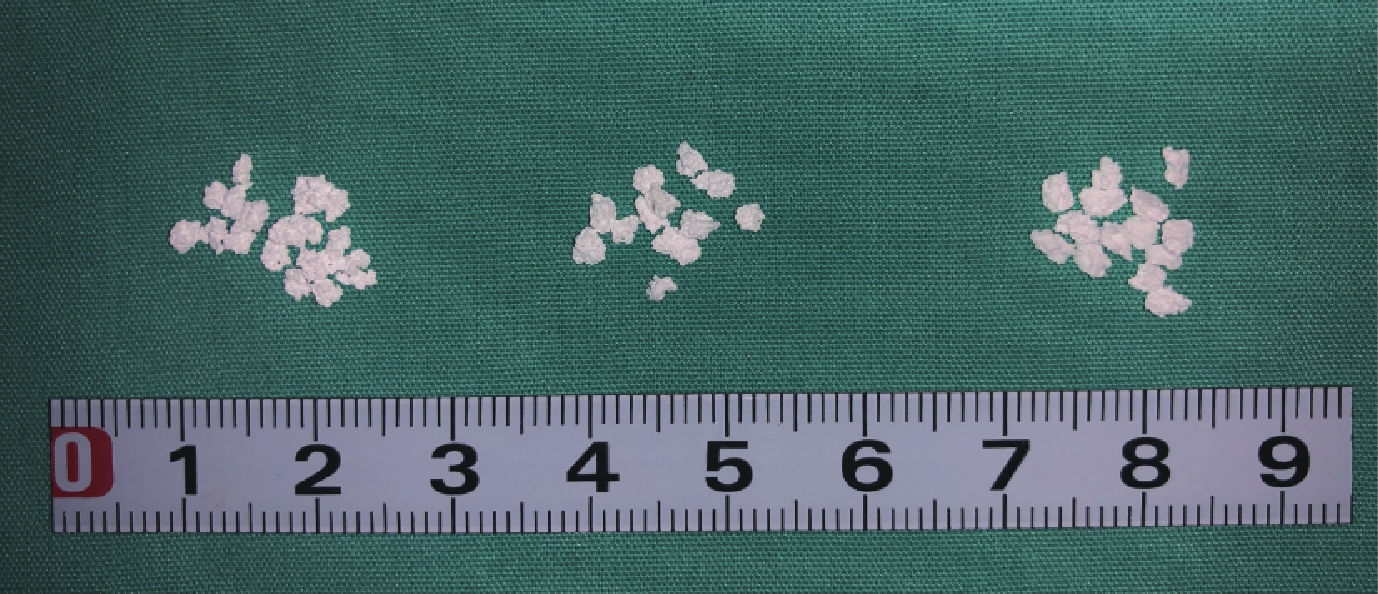
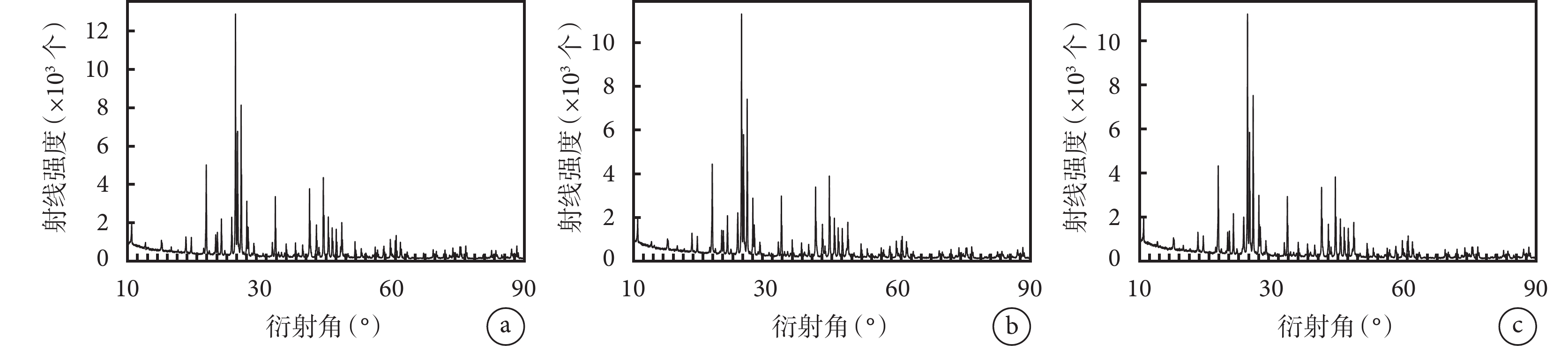
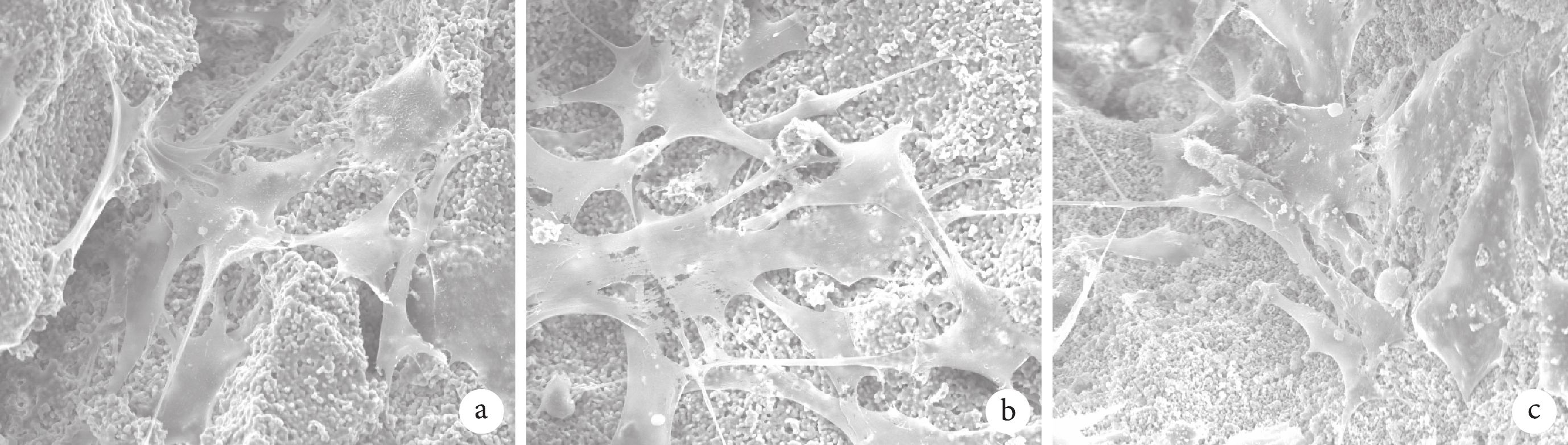
① 大體觀察:3 種材料均為直徑約 2 mm 的白色顆粒,隨燒結溫度增加,材料直徑無區別,顏色均勻一致。見圖 1。② BET 檢測:隨燒結溫度增加,顆粒內部孔隙率無明顯變化,但介孔直徑、體積及面積逐漸減小。見表 2。③ XRD 檢測:3 種材料均可見 HA 及 β-TCP 兩種 X 線衍射波。見圖 2。④ 掃描電鏡觀察:BCP 表面廣泛分布微孔,3 種材料的微孔直徑較為相近,材料表面及內部的微孔之間均可見孔徑不一的連通孔道,孔壁粗糙不平,3 種材料間無明顯差異。見圖 3。
 圖1
3 種 BCP 材料大體觀察
圖1
3 種 BCP 材料大體觀察
從左至右分別為材料 1、2、3
Figure1. General observation of 3 kinds of BCPsFrom left to right for materials 1, 2, and 3, respectively
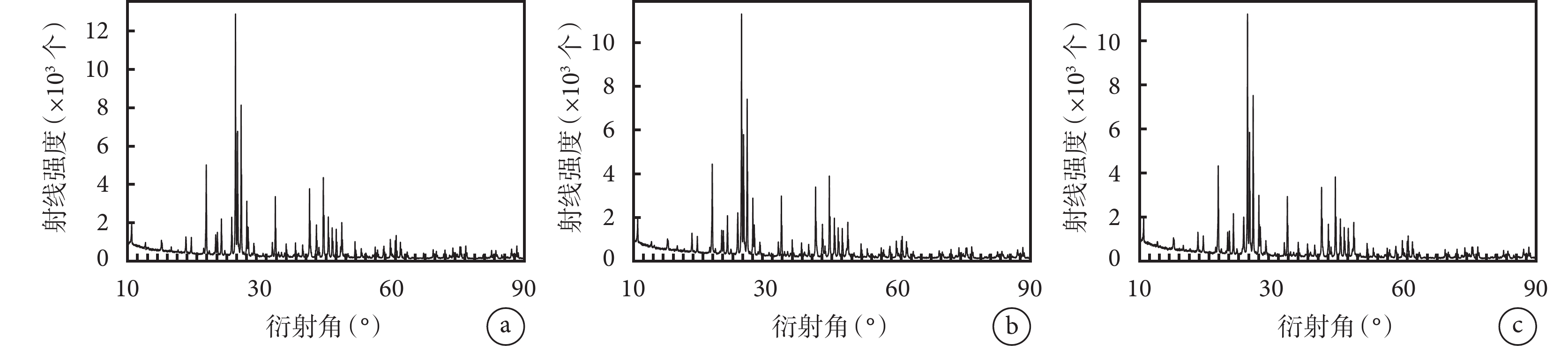 圖2
3 種 BCP 材料 XRD 檢測
圖2
3 種 BCP 材料 XRD 檢測
a. 材料 1;b. 材料 2;c. 材料 3
Figure2. XRD detection of 3 BCPsa. Material 1; b. Material 2; c. Material 3
 圖3
3 種 BCP 材料掃描電鏡觀察(×300)
圖3
3 種 BCP 材料掃描電鏡觀察(×300)
黑箭頭示微孔,紅箭頭示孔間相連的孔道 a. 材料 1;b. 材料 2;c. 材料 3
Figure3. SEM observation of 3 kinds of BCPs (×300)Black arrow indicated macropores, red arrow indicated pores connecting holes a. Material 1; b. Material 2; c. Material 3
2.1.2 材料生物相容性評價
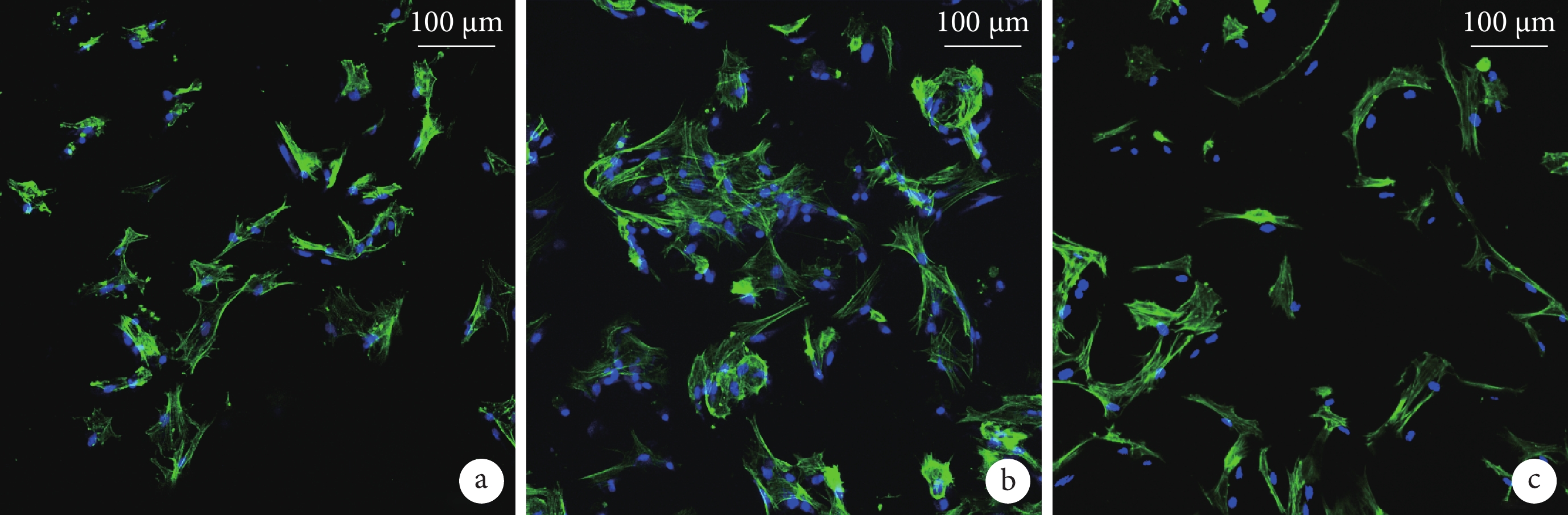
① 掃描電鏡觀察:BMSCs 與 BCP 材料共培養 7 d 后,可見細胞大量貼附于孔壁上,多伸出偽足,形態不規則,3 種材料間無明顯區別。見圖 4。② 鬼筆環肽染色:轉盤式激光共聚焦顯微鏡觀察示,3 組均有大量細胞貼敷于 BCP 材料表面的孔壁,細胞形態因材料表面不平整而變化多樣,3 種材料間無明顯區別。見圖 5。③ CCK-8 法檢測細胞增殖活性:隨著共培養時間延長,各組細胞增殖活性均逐漸增加,于 7 d 時達峰值,后逐漸下降。培養 3、5、7、9 d,D 組 A 值顯著高于其余各組,A 組 A 值顯著低于其余各組,差異均有統計學意義(P<0.05);7、9 d 時 C 組 A 值顯著高于 B 組,差異有統計學意義(P< 0.05)。見圖 6。
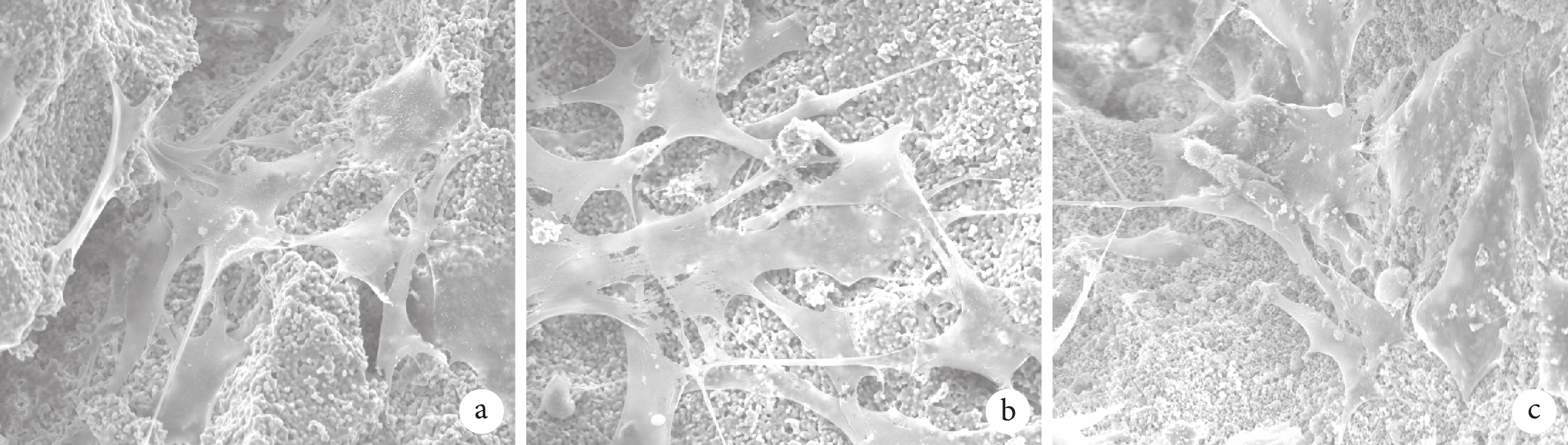 圖4
BMSCs 與 BCP 材料共培養 7 d 后掃描電鏡觀察(×2 000)
圖4
BMSCs 與 BCP 材料共培養 7 d 后掃描電鏡觀察(×2 000)
a. A 組;b. B 組;c. C 組
Figure4. SEM observation of BMSCs and BCPs at 7 days after co-culture (×2 000)a. Group A; b. Group B; c. Group C
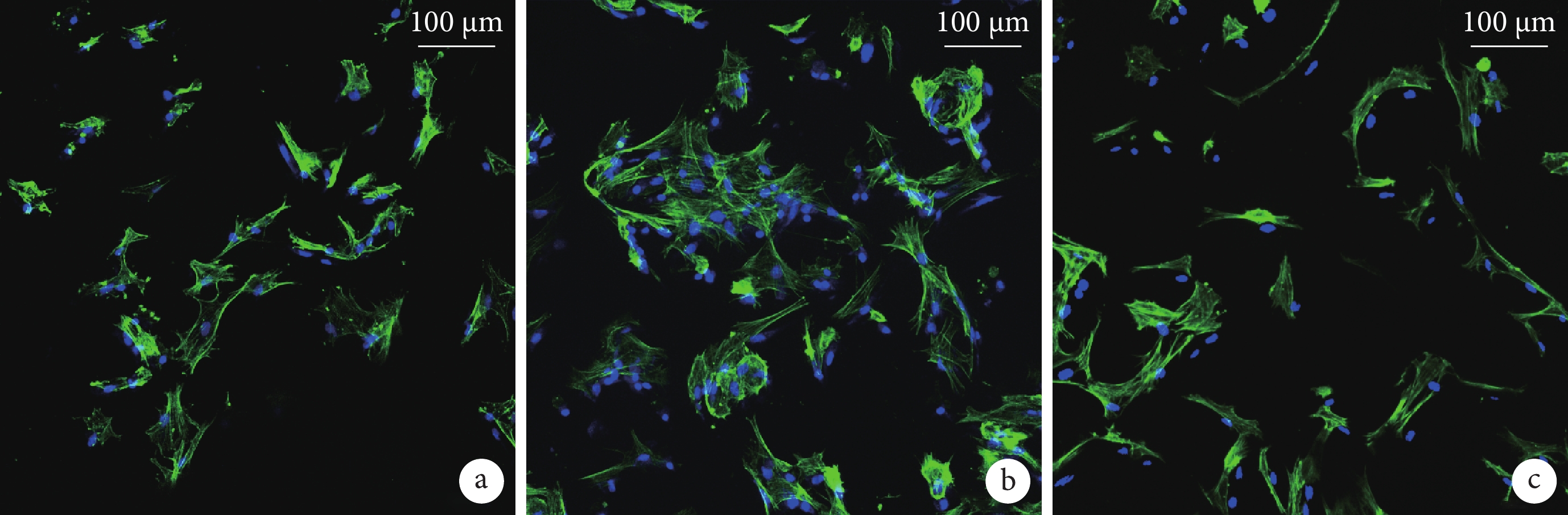 圖5
BMSCs 與 BCP 材料共培養 7 d 后鬼筆環肽及 DAPI 染色觀察(轉盤式激光共聚焦顯微鏡×200)
圖5
BMSCs 與 BCP 材料共培養 7 d 后鬼筆環肽及 DAPI 染色觀察(轉盤式激光共聚焦顯微鏡×200)
綠色示肌動蛋白,藍色示細胞核a. A 組;b. B 組;c. C 組
Figure5. Phalloidin and DAPI staining of BMSCs and BCPs at 7 days after co-culture (Rotary confocal laser microscope×200)Green staining indicated the actin, blue staining indicated the nuclei a. Group A; b. Group B; c. Group C
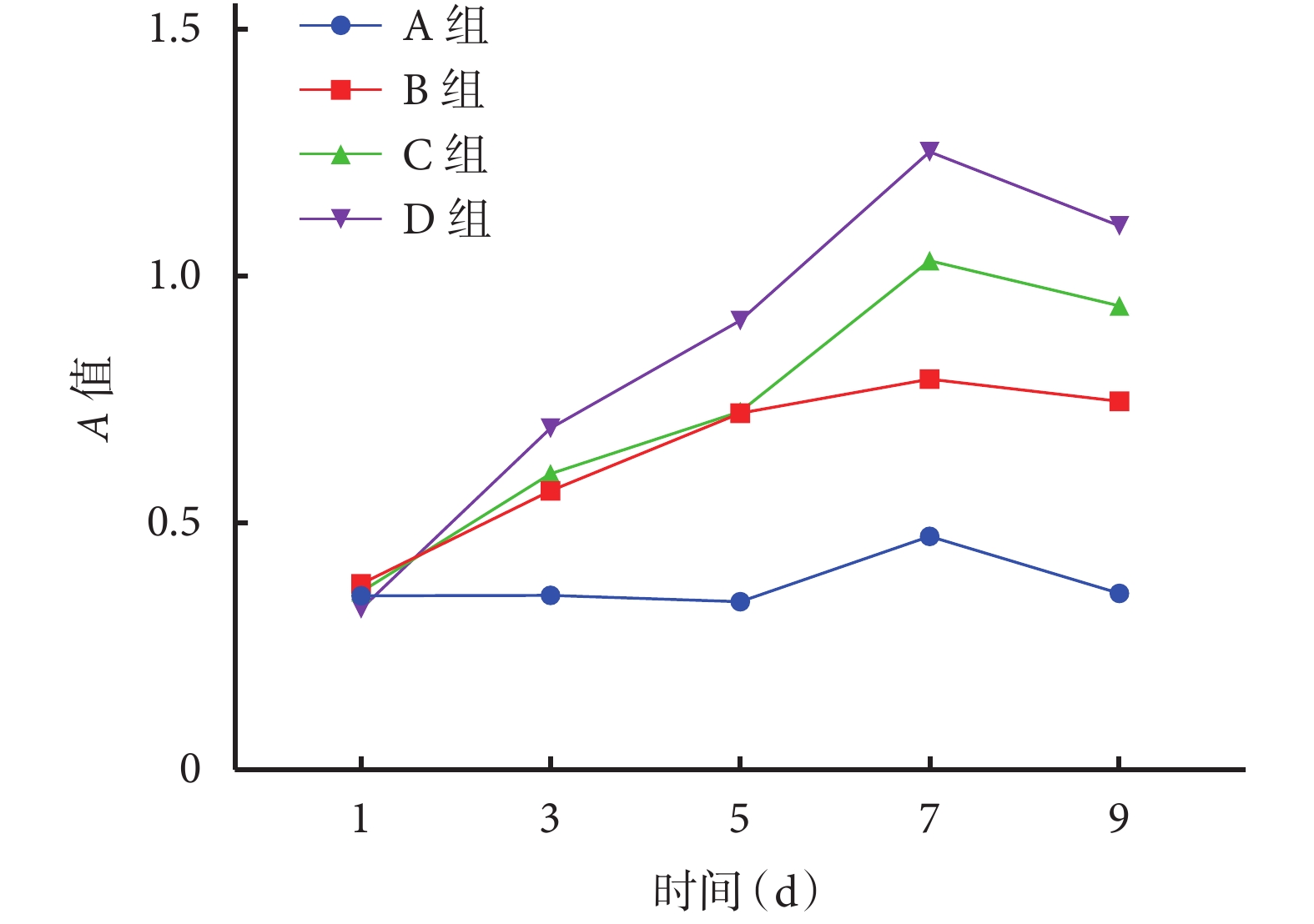 圖6
CCK-8 法檢測細胞增殖活性
Figure6.
Cell proliferation detected by CCK-8 assay
圖6
CCK-8 法檢測細胞增殖活性
Figure6.
Cell proliferation detected by CCK-8 assay
2.2 動物體內實驗評價材料成骨能力
2.2.1 大體觀察
術后 1、2、3 個月各組取材大體觀察顯示形態相似,材料植入后在肌肉擠壓作用下呈現扁團狀,被多層纖維組織包膜緊密包裹。見圖 7。
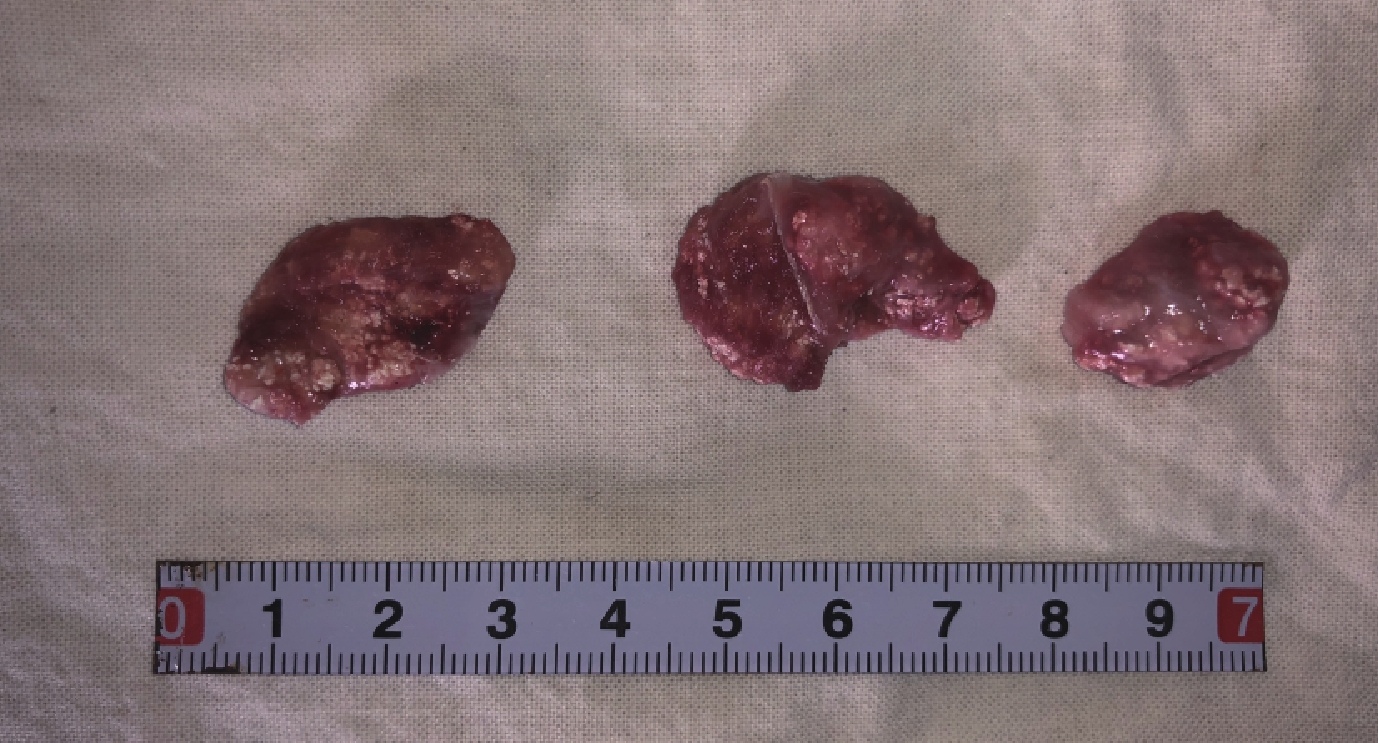 圖7
B 組術后異位成骨材料大體觀察
圖7
B 組術后異位成骨材料大體觀察
從左至右分別為術后 1、2、3 個月
Figure7. General observation of ectopic osteogenesis of group BFrom left to right for 1, 2, and 3 months after implantation, respectively2.2.2 HE、Masson 及番紅固綠染色
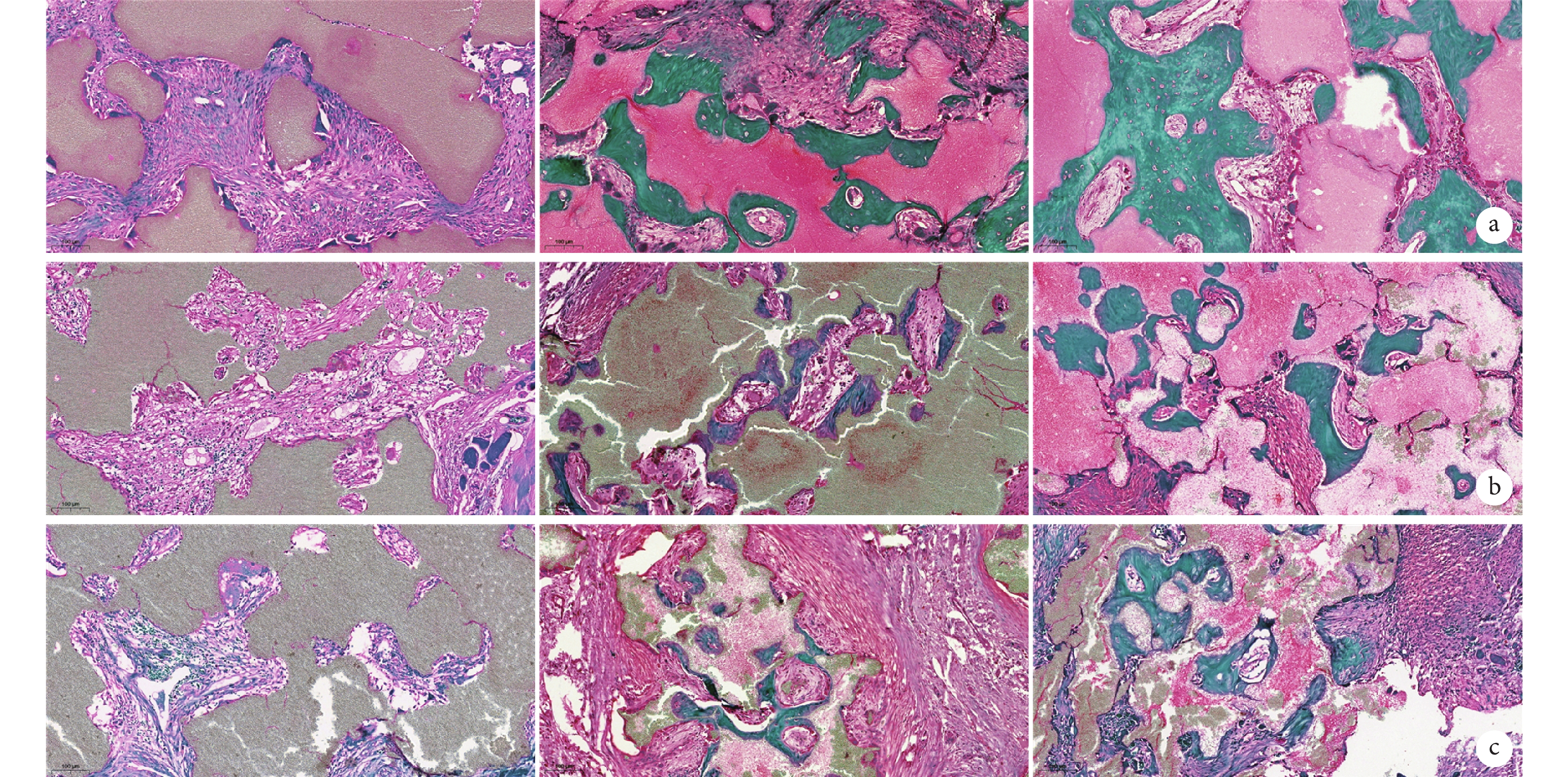
術后 1 個月,纖維組織及血管樣組織開始逐步沉積于顆粒材料的間隙,此時新生骨樣組織較少;術后 2 個月,在 3 組 BCP 材料邊緣區域均可見明顯的骨樣組織沉積,材料之間縫隙的中心區域可見纖維組織及新生血管;術后 3 個月,顆粒間隙內可見廣泛新生骨樣組織。見圖 8~10。
 圖8
術后各時間點各組 HE 染色觀察(×10)
圖8
術后各時間點各組 HE 染色觀察(×10)
從左至右分別為術后 1、2、3 個月 a. A 組;b. B 組;c. C 組
Figure8. HE staining of each group at each time point after implantation (×10)From left to right for 1, 2, and 3 months after implantation, respectively a. Group A; b. Group B; c. Group C
 圖9
術后各時間點各組 Masson 染色觀察(×10)
圖9
術后各時間點各組 Masson 染色觀察(×10)
從左至右分別為術后 1、2、3 個月 a. A 組;b. B 組;c. C 組
Figure9. Masson staining of each group at each time point after implantation (×10)From left to right for 1, 2, and 3 months after implantation, respectively a. Group A; b. Group B; c. Group C
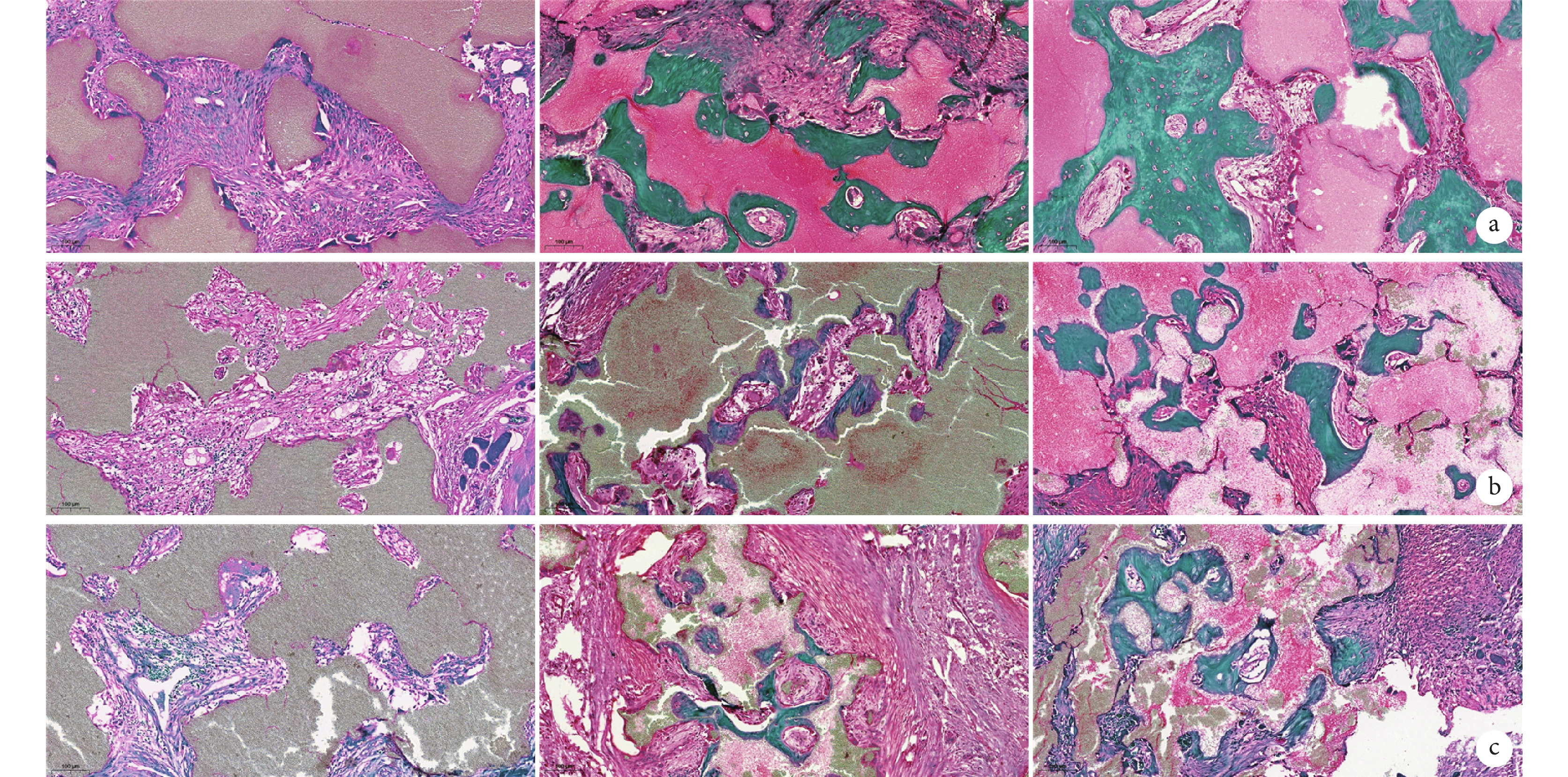 圖10
術后各時間點各組番紅固綠染色觀察(×10)
圖10
術后各時間點各組番紅固綠染色觀察(×10)
從左至右分別為術后 1、2、3 個月 a. A 組;b. B 組;c. C 組
Figure10. Safranin green staining of each group at each time point after implantation (×10)From left to right for 1, 2, and 3 months after implantation, respectively a. Group A; b. Group B; c. Group C
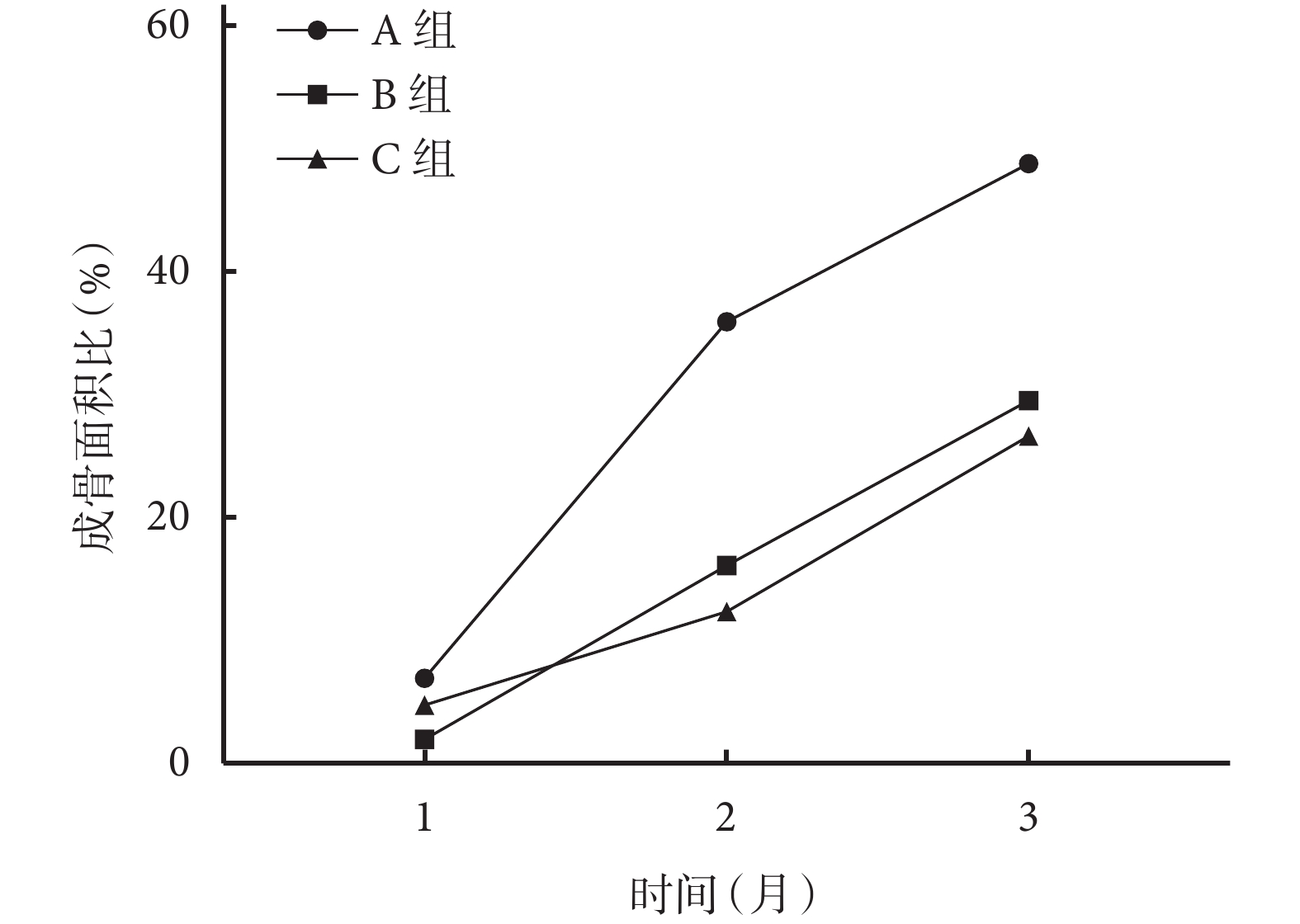
術后隨時間延長,各組成骨面積比均呈逐漸上升趨勢。術后 2、3 個月 A 組成骨面積比顯著高于 B、C 組,1 個月時顯著高于 B 組,差異均有統計學意義(P<0.05);術后各時間點 B、C 組間比較成骨面積比,差異均無統計學意義(P>0.05)。見圖 11。
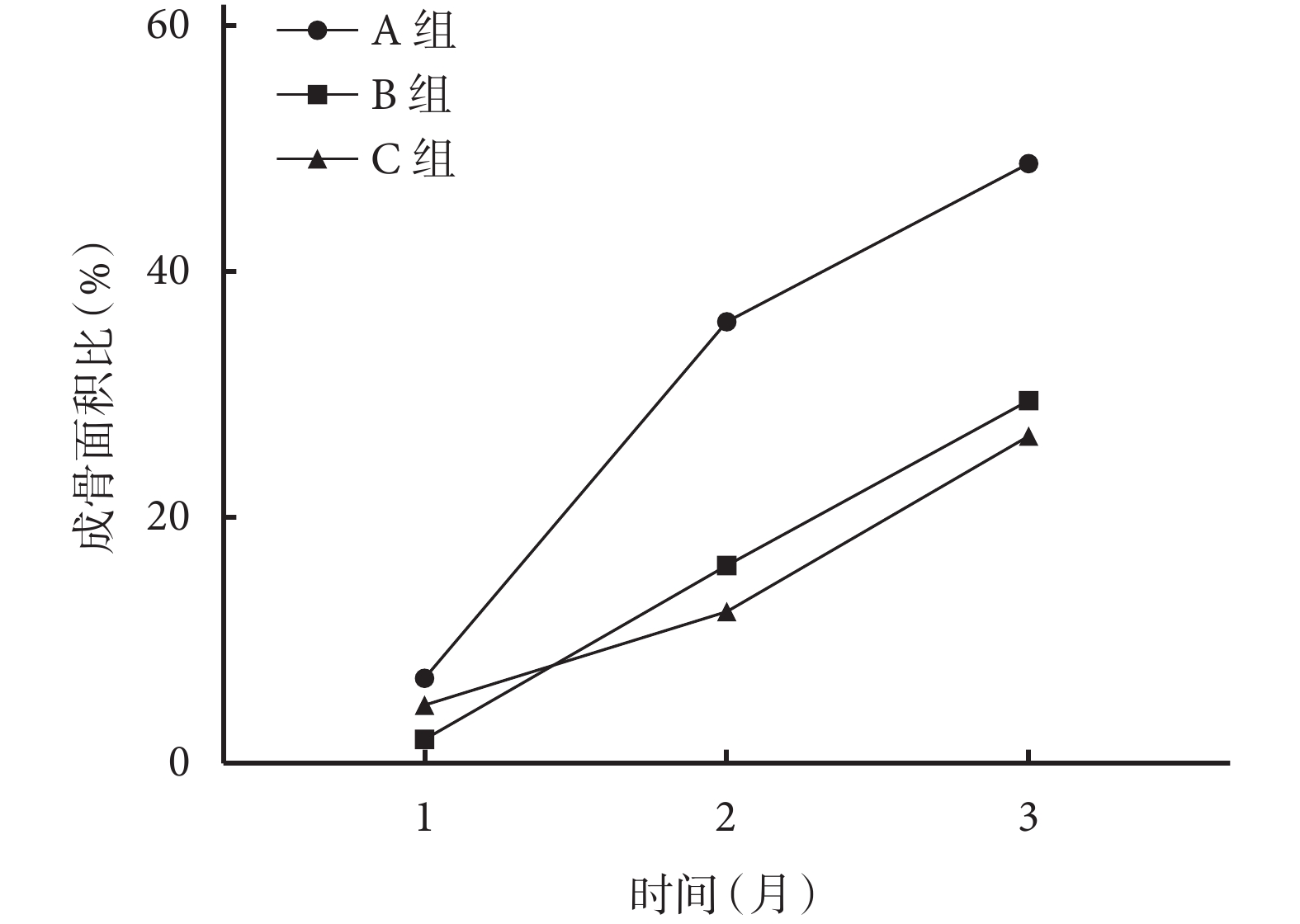 圖11
術后各時間點各組成骨面積比比較
Figure11.
Comparison of the bone formation area ratio of each group at each time point after operation
圖11
術后各時間點各組成骨面積比比較
Figure11.
Comparison of the bone formation area ratio of each group at each time point after operation
2.2.3 qRT-PCR 檢測
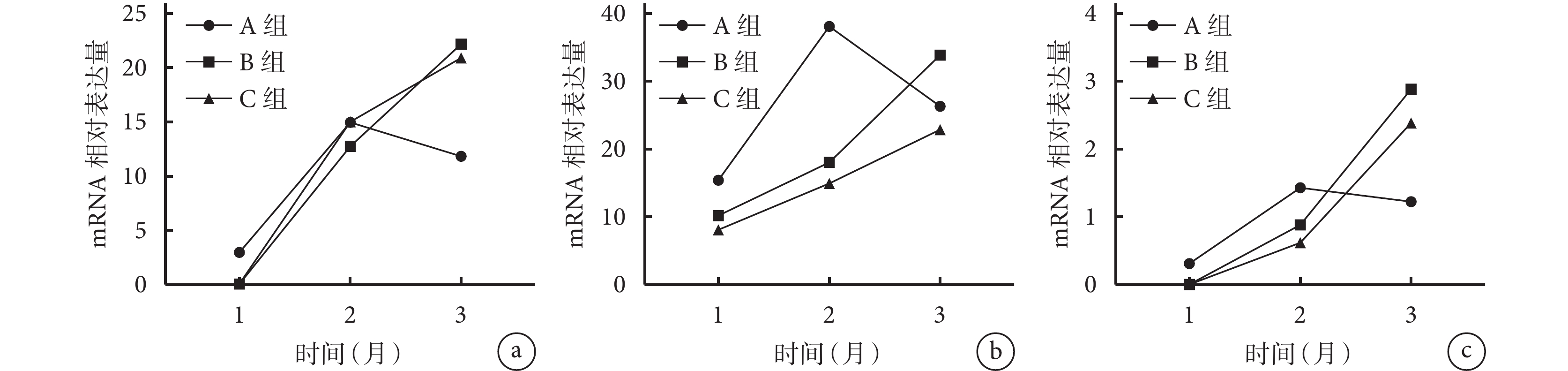
隨術后時間延長,A 組各基因 mRNA 相對表達量呈先增高后下降趨勢,于 2 個月時達峰值;B、C 組各基因 mRNA 相對表達量均逐漸增高。術后 1 個月 A 組 ALP 和 OPN mRNA 相對表達量顯著高于 B、C 組,術后 2 個月 A 組 OC mRNA 相對表達量顯著高于 B、C 組,術后 3 個月 B、C 組 ALP mRNA 相對表達量及 B 組 OPN mRNA 相對表達量顯著高于 A 組,差異有統計學意義(P<0.05);其余各時間點各組間比較各基因 mRNA 相對表達量差異均無統計學意義(P>0.05)。見圖 12。
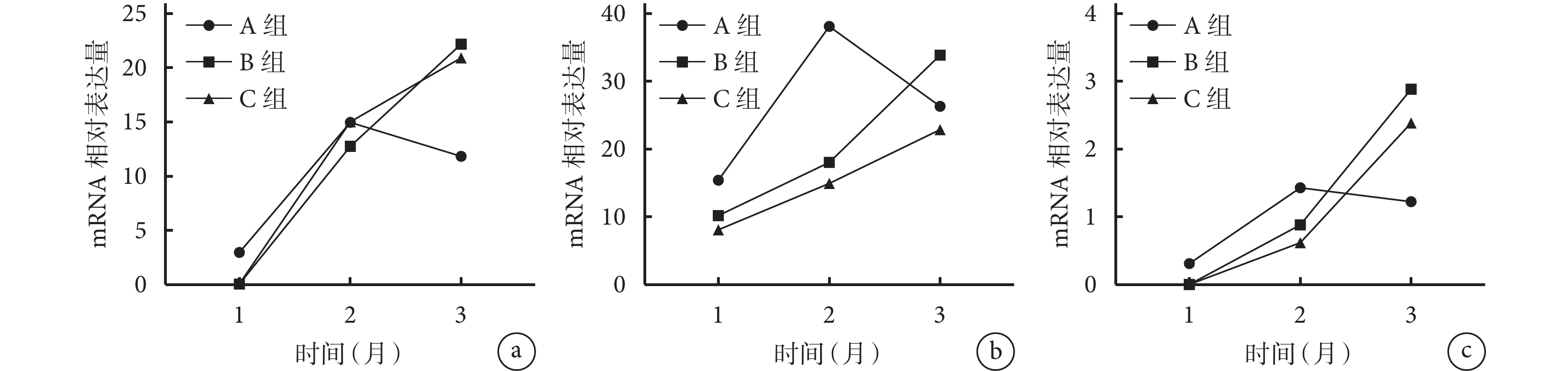 圖12
術后各時間點各組 qRT-PCR 檢測各成骨相關基因 mRNA 相對表達量比較
圖12
術后各時間點各組 qRT-PCR 檢測各成骨相關基因 mRNA 相對表達量比較
a. ALP;b. OC;c. OPN
Figure12. Comparison of the relative expressions of osteogenic related genes detected by qRT-PCR in each group at each time point after implantationa. ALP; b. OC; c. OPN
3 討論
顱頜面部的骨缺損不僅導致患者面部不對稱、偏頜、局部嚴重凹陷、顳下頜運動受限及咀嚼功能喪失等形態和功能障礙[12],還會影響患者心理狀態,給日常生活和社交帶來不利影響[13]。應用手術進行局部骨的自體骨移植和生物相容性材料填充,是目前主要治療方案[14-15]。BCP 是顱頜面外科目前最常用的修復材料,將 HA 及 β-TCP 以不同比例混合燒制的 BCP,可以融合 HA 及 β-TCP 的骨傳導性、骨誘導性、生物相容性、降解性可控等優點,改善單一材料機械強度低、降解性不合理的缺點,成骨效果顯著,得到了廣泛認可[5]。但 BCP 材料介導產生的新骨大多難以充分地填充植入材料與自體骨組織之間的空隙[3],導致 BCP 材料應用受到極大限制。因此,對 BCP 材料的宏觀和微觀結構進行研究和改進,成為當前研究熱點。
目前在宏觀結構方面,關于 HA/β-TCP 的最優比例尚無統一結論[16]。研究表明,BCP 的物理化學特性,如 HA/β-TCP 比例、材料大體直徑、孔隙率和孔隙直徑等因素,顯著影響材料的成骨能力、生物相容性及材料降解性[17]。為了增加材料植入后與周圍組織的接觸面積,對材料與自體骨之間的間隙充分利用[3],我們設計了直徑均為 2 mm 的顆粒狀材料,可以靈活應用于復雜及形態不規則骨缺損空間。微觀結構方面,研究表明,基于不同燒結溫度能夠制備不同介孔結構的 BCP 材料[11]。本研究在 1 050、1 150 及 1 250℃ 3 種溫度下燒結制作了 3 種 HA/β-TCP 比例一致(8∶2)、材料微孔直徑相近、具備不同介孔直徑的 BCP 材料。CCK-8 法細胞增殖實驗顯示,不同介孔直徑的 BCP 材料與 BMSCs 的生物相容性差異巨大,介孔直徑 12.57 nm 的材料 1 對細胞增殖造成了明顯抑制;盡管如此,掃描電鏡依然可以觀察到 BMSCs 均能在 3 種 BCP 材料表面良好地貼敷和生長,并且呈多邊不規則形,伸展出可牢固貼附的偽足。
3 種 BCP 顆粒材料包埋于比格犬豎脊肌肌袋 2 個月后,材料縫隙間可見明顯骨樣組織沉積,此時開始出現成骨差異,在體外實驗中生物相容性表現最差的 A 組材料,成骨面積比卻顯著高于其余兩組;盡管 3 個月時 B、C 組成骨面積比有所增加,但仍顯著低于 A 組。3 種材料隨著置入時間延長,成骨面積比均穩步升高,從整體趨勢看,成骨是一個緩慢持續且較為穩定的過程,介孔直徑更大的材料其成骨性能在異位成骨模型中表現更好。qRT-PCR 檢測示,A 組 ALP、OC 及 OPN 基因表達在2 個月時達高峰,之后平穩回落;B 組 3 種成骨相關基因表達整體上略高于 C 組,但兩組間差異并無統計學意義。盡管隨時間推移 3 組材料的基因表達水平均較植入初期明顯升高,但 A 組基因上調時間最早,達到基因表達高峰的時間最短,這與組織學檢測得出的成骨面積比表達規律一致。
本研究結果提示:1 050℃ 溫度燒結的 BCP 材料成骨效果優于其余兩組可能是暫時的,因為其余兩組成骨相關基因的表達仍在持續上調,其成骨效率尚未達到峰值,因此還需要更長時間觀測以評估各材料的整體成骨性能。1 050℃ 溫度燒結的 BCP 材料生物相容性最差,但成骨性能最佳,是因為體內環境充足的血供和細胞來源為 BCP 的成骨提供了良好基礎,提示我們在后期臨床應用中,應充分考慮材料植入區域的血供條件。介孔直徑對材料成骨效果產生的諸多影響,其機制目前尚不明確,并不是所有 BCP 材料都能展現出明顯的異位成骨能力。有研究證實介孔直徑小、比表面積很低的材料甚至不會有成骨發生[18],還有研究證實孔隙率約為 60% 的材料能夠為骨組織提供充分的生長空間[19],并認為在充足的孔隙內保持穩定新陳代謝的原因是植入物內充足的體液浸潤[18, 20]。在此基礎上,介孔的存在為局部環境提供了豐富的鈣、磷離子[21],當濃度達到了過飽和水平,豐富的鈣、磷離子足以形成生物磷灰石層,進一步產生了成骨現象[22]。因此可以推測,本研究中的 3 種 BCP 材料在其整體結構能夠提供一可靠空間支撐的前提下,不同介孔直徑導致材料表層產生了不同程度的鈣、磷離子,該過程不會太快,但穩定而持續,所以成骨面積比隨時間延長逐步升高。介孔直徑作為一個重要參數,可調節局部鈣、磷離子水平,維持生物磷灰石層穩定。在一定介孔直徑范圍內,直徑較大的材料能夠生成更穩定的生物磷灰石層,具備更早、更快成骨的能力。
綜上述,本研究成功制備了 3 種不同介孔直徑的 BCP 材料,盡管其生物相容性存在顯著差異,但是 BMSCs 均可在材料表面貼附和增殖;動物體內實驗表明在充足血供和良好成骨環境中,介孔直徑較大的 BCP 材料能夠展現出更強的成骨能力。介孔直徑作為一個可以調控的指標,可在 BCP 制備過程中作為有效參數,實現 BCP 材料的優化和升級。
志謝:感謝四川大學生物材料工程研究中心提供制作 3 種 BCP 顆粒材料的技術支持。
作者貢獻:張棟負責實驗設計及實施、數據收集整理、統計分析以及論文撰寫;宗憲磊對文章的知識性內容作批評性審閱;郭小雙、杜宏參與實驗實施,包括動物的體內實驗、標本取材及檢測;宋國棟、靳小雷參與文章科研設計及討論部分的分析,對文章整體的知識性內容作批評性審閱及支持性貢獻。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:本研究經中國醫學科學院整形外科醫院實驗動物倫理委員會批準[(2014)注冊第(10)號]。實驗動物使用許可證號 :SYXK(京)2020-0018。
由外傷、腫瘤、先天性畸形、手術等多種因素導致的骨缺損和骨不連臨床較常見,治療方案包括自體骨移植、同種異體骨移植、異種異體骨移植、人工合成生物材料植入等。其中自體骨移植被認為是治療骨缺損的“金標準”[1-2],但存在供骨量有限、供區損傷及感染等缺陷;同種及異種異體骨移植也存在潛在疾病傳染、血管化程度差、免疫排斥等風險。因此,使用優質人工合成生物材料逐漸成為治療骨缺損的熱點。
磷酸鈣(cacium phosphate,CaP)類材料主要包括羥基磷灰石(hydroxyapatite,HA)、β-磷酸三鈣(β-tricalcium phosphate,β-TCP)、雙相鈣磷陶瓷(biphasic calcium phosphate,BCP)和磷酸鈣類骨水泥等[3]。因其與人體自身骨組織的無機成分磷灰石相似,具備不同程度的生物相容性、骨傳導性和骨誘導性,成為頜面外科骨缺損和骨修復的研究熱點[4-5]。但是目前人工合成的 CaP 類材料組分和微結構往往與人骨磷灰石存在差異,不同 CaP 材料的成骨能力差異顯著。其中將兩種 CaP 材料按不同比例混合制備的 BCP 材料,能有效避免單一材料強度低、降解變異大的缺陷,實現更為優異的骨傳導性、骨誘導性[4, 6-7],具備巨大臨床應用潛力[8-10]。
BMSCs 是一種在骨髓基質中廣泛存在且具有多向分化潛能的細胞,在不同條件下經誘導可分化為成骨細胞、軟骨細胞及脂肪細胞等不同細胞系。既往研究利用動物機體作為生物反應器構建人工骨,通過將 BCP 材料植入比格犬背部,證實 BMSCs 作為干細胞參與了 BCP 材料的異位誘導成骨[6]。本課題組前期研究[8]在體外將 BMSCs 與 BCP 材料共培養,ALP 分泌顯著升高,提示 BCP 材料能夠顯著提高 BMSCs 的成骨分化潛能。實時熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)檢測結果顯示,隨著共培養時間延長,成骨相關基因骨橋蛋白(osteopontin,OPN)、Ⅰ 型膠原蛋白、Runx2 表達水平逐步上升;而加入了成骨信號通路抑制劑(RO4929097)的組別,成骨相關基因表達水平均明顯下降。證實將 BMSCs 與 BCP 材料共培養,在早期可上調成骨信號通路相關基因表達,從而促進其骨向分化。同時,大量研究證實 BCP 材料的配比和宏觀結構不同,會導致成骨效果差異顯著[4-5];但微觀結構,尤其是介孔直徑等具體參數對成骨效果的影響,目前研究尚無明確結論。
BCP 材料在不同溫度下燒結,會形成不同的微觀結構,其中介孔直徑會隨溫度不同而產生差異[11]。基于此,本研究設計在 3 種溫度下燒制 3 種不同介孔直徑的顆粒狀 BCP 材料,通過體內外實驗檢測其成骨能力的差異。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
4 周齡雌性 SD 大鼠 5 只,體質量 180~230 g;1 歲齡比格犬 9 只,雌雄不限,體質量 12~14 kg;由中國醫學科學院北京協和醫學院整形外科醫院提供。
α-MEM 培養基、FBS(GIBCO 公司,美國);細胞計數試劑盒 8(cell counting kit 8,CCK-8),Masson、番紅固綠及 HE 染色試劑(上海碧云天生物技術有限公司);RNA 提取試劑盒(Qiagen 公司,德國);逆轉錄試劑盒(北京全式金生物技術有限公司)。掃描電鏡(FEI 公司,美國);轉盤式激光共聚焦顯微鏡(Olympus 公司,日本)。
1.2 材料的生物相容性評價
1.2.1 BCP 的制備及評估
將 HA 與 β-TCP 以 8∶2 比例混合,分別在 1 050、1 150 及 1 250℃ 下燒制 3 h 制備 3 種 BCP 材料(分別設為材料 1、2、3),材料孔隙率設計為 60%~70%。將 3 種材料打磨成直徑 2 mm 的細顆粒。采用比表面積測試法(Brunauer-Emmett-Teller test,BET)測量材料顆粒內部孔隙率及介孔直徑、體積、面積,X 線衍射(X-ray diffraction、XRD)評估材料組成成分,掃描電鏡觀察材料微觀表面形態。每種材料送檢樣本約 1 g,BET 檢測數據為整體樣本的均數。材料的制備及評估均于四川大學生物材料工程研究中心完成。
1.2.2 材料與大鼠 BMSCs 共培養
取 4 周齡 SD 大鼠斷頸處死后獲取股骨,針管抽取 5 mL 含 10%FBS 的 α-MEM 培養基將骨髓沖出并接種于 10 cm 培養皿,靜置 48 h 后換液;將獲得的貼壁細胞每 3~5 天傳代,培養至第 3 代備用。將 BCP 材料 1、2、3 置于 24 孔板底,分別設為 A、B、C 組,每組 4 孔,覆蓋 75% 孔底部面積,先后以 PBS 液、無血清 α-MEM 培養基、含 10%FBS 的 α-MEM 培養基反復浸泡各 24 h;然后與第 3 代 BMSCs(1×105個/mL)共培養。
1.2.3 觀測指標
① 掃描電鏡觀察:材料與 BMSCs 共培養 7 d 后,加 2% 戊二醛固定 24~48 h,梯度乙醇脫水后乙酸異戊酯置換 2 次,常規 CO2 臨界干燥器干燥、真空條件下噴濺鉑金離子,掃描電鏡觀察細胞黏附情況。② 鬼筆環肽染色:采用 24 孔板進行實驗,3 種 BCP 材料分別與 BMSCs 共培養 7 d 后,進行鬼筆環肽染色,使用轉盤式激光共聚焦顯微鏡觀察 BMSCs 貼附于材料表面后的形態。③ CCK-8 法檢測細胞增殖活性:采用 96 孔板進行實驗,同上法將 BMSCs 分別接種于 3 組 BCP 材料(A、B、C 組),另設單純 BMSCs 作為空白對照組(D 組),每組 5 個復孔。培養 1、3、5、7、9 d 采用 CCK-8 法測量 450 nm 波長下吸光度(A)值。
1.3 動物體內實驗評價材料成骨能力
1.3.1 比格犬異位成骨分組及模型構建
取 9 只 1 歲齡比格犬,肌肉注射舒泰(0.50~0.55 mg/kg)、阿托品 1 mL、速眠新 0.5 mL 麻醉后,常規備皮消毒,于背部正中切開長約 10 cm 切口,在每只犬雙側豎脊肌內均勻制作 9 個直徑約 2 cm、深度約 3 cm 的肌袋。將 9 個肌袋隨機分為 3 組,每組 3 個肌袋,A、B、C 組肌袋內分別置入 1 g 材料 1、2、3,然后逐層關閉切口。術中及術后 3 d 每日予以青霉素 80 萬 U 肌肉注射預防感染。
1.3.2 HE、Masson 及番紅固綠染色
分別于術后 1、2、3 個月隨機同上法麻醉 3 只比格犬,切取肌袋內包埋的材料,觀察大體形態;每組每時間點共 9 個標本,隨機選取其中 4 個標本,經 4% 多聚甲醛固定后常規制備 4 μm 厚切片,行 HE、Masson 及番紅固綠染色觀察。于放大 10 倍的 Masson 染色切片中每張隨機取 3 個視野,采用 Image J 軟件測量并按以下公式計算 BCP 間隙中的成骨面積比,成骨面積比=BCP 間隙骨組織面積/BCP 間隙面積×100%。
1.3.3 qRT-PCR 檢測
分別于術后 1、2、3 個月同上法取材,根據 RNA 提取試劑盒說明提取材料中心位置區域的 RNA,取 1 000 ng RNA 按逆轉錄試劑盒說明逆轉錄為 cDNA。使用 Primer 6 軟件設計引物序列(表 1),由北京擎科生物科技有限公司合成。通過 Roche 480 系統完成 qRT-PCR 檢測,采用 2?ΔΔCt 法計算各成骨相關基因[ALP、OPN、骨鈣素(osteocalcin,OC)]mRNA 相對表達量。
1.4 統計學方法
采用 SPSS23.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準取雙側 α=0.05。
2 結果
2.1 材料的生物相容性評價
2.1.1 BCP 材料評估
① 大體觀察:3 種材料均為直徑約 2 mm 的白色顆粒,隨燒結溫度增加,材料直徑無區別,顏色均勻一致。見圖 1。② BET 檢測:隨燒結溫度增加,顆粒內部孔隙率無明顯變化,但介孔直徑、體積及面積逐漸減小。見表 2。③ XRD 檢測:3 種材料均可見 HA 及 β-TCP 兩種 X 線衍射波。見圖 2。④ 掃描電鏡觀察:BCP 表面廣泛分布微孔,3 種材料的微孔直徑較為相近,材料表面及內部的微孔之間均可見孔徑不一的連通孔道,孔壁粗糙不平,3 種材料間無明顯差異。見圖 3。
 圖1
3 種 BCP 材料大體觀察
圖1
3 種 BCP 材料大體觀察
從左至右分別為材料 1、2、3
Figure1. General observation of 3 kinds of BCPsFrom left to right for materials 1, 2, and 3, respectively
 圖2
3 種 BCP 材料 XRD 檢測
圖2
3 種 BCP 材料 XRD 檢測
a. 材料 1;b. 材料 2;c. 材料 3
Figure2. XRD detection of 3 BCPsa. Material 1; b. Material 2; c. Material 3
 圖3
3 種 BCP 材料掃描電鏡觀察(×300)
圖3
3 種 BCP 材料掃描電鏡觀察(×300)
黑箭頭示微孔,紅箭頭示孔間相連的孔道 a. 材料 1;b. 材料 2;c. 材料 3
Figure3. SEM observation of 3 kinds of BCPs (×300)Black arrow indicated macropores, red arrow indicated pores connecting holes a. Material 1; b. Material 2; c. Material 3
2.1.2 材料生物相容性評價
① 掃描電鏡觀察:BMSCs 與 BCP 材料共培養 7 d 后,可見細胞大量貼附于孔壁上,多伸出偽足,形態不規則,3 種材料間無明顯區別。見圖 4。② 鬼筆環肽染色:轉盤式激光共聚焦顯微鏡觀察示,3 組均有大量細胞貼敷于 BCP 材料表面的孔壁,細胞形態因材料表面不平整而變化多樣,3 種材料間無明顯區別。見圖 5。③ CCK-8 法檢測細胞增殖活性:隨著共培養時間延長,各組細胞增殖活性均逐漸增加,于 7 d 時達峰值,后逐漸下降。培養 3、5、7、9 d,D 組 A 值顯著高于其余各組,A 組 A 值顯著低于其余各組,差異均有統計學意義(P<0.05);7、9 d 時 C 組 A 值顯著高于 B 組,差異有統計學意義(P< 0.05)。見圖 6。
 圖4
BMSCs 與 BCP 材料共培養 7 d 后掃描電鏡觀察(×2 000)
圖4
BMSCs 與 BCP 材料共培養 7 d 后掃描電鏡觀察(×2 000)
a. A 組;b. B 組;c. C 組
Figure4. SEM observation of BMSCs and BCPs at 7 days after co-culture (×2 000)a. Group A; b. Group B; c. Group C
 圖5
BMSCs 與 BCP 材料共培養 7 d 后鬼筆環肽及 DAPI 染色觀察(轉盤式激光共聚焦顯微鏡×200)
圖5
BMSCs 與 BCP 材料共培養 7 d 后鬼筆環肽及 DAPI 染色觀察(轉盤式激光共聚焦顯微鏡×200)
綠色示肌動蛋白,藍色示細胞核a. A 組;b. B 組;c. C 組
Figure5. Phalloidin and DAPI staining of BMSCs and BCPs at 7 days after co-culture (Rotary confocal laser microscope×200)Green staining indicated the actin, blue staining indicated the nuclei a. Group A; b. Group B; c. Group C
 圖6
CCK-8 法檢測細胞增殖活性
Figure6.
Cell proliferation detected by CCK-8 assay
圖6
CCK-8 法檢測細胞增殖活性
Figure6.
Cell proliferation detected by CCK-8 assay
2.2 動物體內實驗評價材料成骨能力
2.2.1 大體觀察
術后 1、2、3 個月各組取材大體觀察顯示形態相似,材料植入后在肌肉擠壓作用下呈現扁團狀,被多層纖維組織包膜緊密包裹。見圖 7。
 圖7
B 組術后異位成骨材料大體觀察
圖7
B 組術后異位成骨材料大體觀察
從左至右分別為術后 1、2、3 個月
Figure7. General observation of ectopic osteogenesis of group BFrom left to right for 1, 2, and 3 months after implantation, respectively2.2.2 HE、Masson 及番紅固綠染色
術后 1 個月,纖維組織及血管樣組織開始逐步沉積于顆粒材料的間隙,此時新生骨樣組織較少;術后 2 個月,在 3 組 BCP 材料邊緣區域均可見明顯的骨樣組織沉積,材料之間縫隙的中心區域可見纖維組織及新生血管;術后 3 個月,顆粒間隙內可見廣泛新生骨樣組織。見圖 8~10。
 圖8
術后各時間點各組 HE 染色觀察(×10)
圖8
術后各時間點各組 HE 染色觀察(×10)
從左至右分別為術后 1、2、3 個月 a. A 組;b. B 組;c. C 組
Figure8. HE staining of each group at each time point after implantation (×10)From left to right for 1, 2, and 3 months after implantation, respectively a. Group A; b. Group B; c. Group C
 圖9
術后各時間點各組 Masson 染色觀察(×10)
圖9
術后各時間點各組 Masson 染色觀察(×10)
從左至右分別為術后 1、2、3 個月 a. A 組;b. B 組;c. C 組
Figure9. Masson staining of each group at each time point after implantation (×10)From left to right for 1, 2, and 3 months after implantation, respectively a. Group A; b. Group B; c. Group C
 圖10
術后各時間點各組番紅固綠染色觀察(×10)
圖10
術后各時間點各組番紅固綠染色觀察(×10)
從左至右分別為術后 1、2、3 個月 a. A 組;b. B 組;c. C 組
Figure10. Safranin green staining of each group at each time point after implantation (×10)From left to right for 1, 2, and 3 months after implantation, respectively a. Group A; b. Group B; c. Group C
術后隨時間延長,各組成骨面積比均呈逐漸上升趨勢。術后 2、3 個月 A 組成骨面積比顯著高于 B、C 組,1 個月時顯著高于 B 組,差異均有統計學意義(P<0.05);術后各時間點 B、C 組間比較成骨面積比,差異均無統計學意義(P>0.05)。見圖 11。
 圖11
術后各時間點各組成骨面積比比較
Figure11.
Comparison of the bone formation area ratio of each group at each time point after operation
圖11
術后各時間點各組成骨面積比比較
Figure11.
Comparison of the bone formation area ratio of each group at each time point after operation
2.2.3 qRT-PCR 檢測
隨術后時間延長,A 組各基因 mRNA 相對表達量呈先增高后下降趨勢,于 2 個月時達峰值;B、C 組各基因 mRNA 相對表達量均逐漸增高。術后 1 個月 A 組 ALP 和 OPN mRNA 相對表達量顯著高于 B、C 組,術后 2 個月 A 組 OC mRNA 相對表達量顯著高于 B、C 組,術后 3 個月 B、C 組 ALP mRNA 相對表達量及 B 組 OPN mRNA 相對表達量顯著高于 A 組,差異有統計學意義(P<0.05);其余各時間點各組間比較各基因 mRNA 相對表達量差異均無統計學意義(P>0.05)。見圖 12。
 圖12
術后各時間點各組 qRT-PCR 檢測各成骨相關基因 mRNA 相對表達量比較
圖12
術后各時間點各組 qRT-PCR 檢測各成骨相關基因 mRNA 相對表達量比較
a. ALP;b. OC;c. OPN
Figure12. Comparison of the relative expressions of osteogenic related genes detected by qRT-PCR in each group at each time point after implantationa. ALP; b. OC; c. OPN
3 討論
顱頜面部的骨缺損不僅導致患者面部不對稱、偏頜、局部嚴重凹陷、顳下頜運動受限及咀嚼功能喪失等形態和功能障礙[12],還會影響患者心理狀態,給日常生活和社交帶來不利影響[13]。應用手術進行局部骨的自體骨移植和生物相容性材料填充,是目前主要治療方案[14-15]。BCP 是顱頜面外科目前最常用的修復材料,將 HA 及 β-TCP 以不同比例混合燒制的 BCP,可以融合 HA 及 β-TCP 的骨傳導性、骨誘導性、生物相容性、降解性可控等優點,改善單一材料機械強度低、降解性不合理的缺點,成骨效果顯著,得到了廣泛認可[5]。但 BCP 材料介導產生的新骨大多難以充分地填充植入材料與自體骨組織之間的空隙[3],導致 BCP 材料應用受到極大限制。因此,對 BCP 材料的宏觀和微觀結構進行研究和改進,成為當前研究熱點。
目前在宏觀結構方面,關于 HA/β-TCP 的最優比例尚無統一結論[16]。研究表明,BCP 的物理化學特性,如 HA/β-TCP 比例、材料大體直徑、孔隙率和孔隙直徑等因素,顯著影響材料的成骨能力、生物相容性及材料降解性[17]。為了增加材料植入后與周圍組織的接觸面積,對材料與自體骨之間的間隙充分利用[3],我們設計了直徑均為 2 mm 的顆粒狀材料,可以靈活應用于復雜及形態不規則骨缺損空間。微觀結構方面,研究表明,基于不同燒結溫度能夠制備不同介孔結構的 BCP 材料[11]。本研究在 1 050、1 150 及 1 250℃ 3 種溫度下燒結制作了 3 種 HA/β-TCP 比例一致(8∶2)、材料微孔直徑相近、具備不同介孔直徑的 BCP 材料。CCK-8 法細胞增殖實驗顯示,不同介孔直徑的 BCP 材料與 BMSCs 的生物相容性差異巨大,介孔直徑 12.57 nm 的材料 1 對細胞增殖造成了明顯抑制;盡管如此,掃描電鏡依然可以觀察到 BMSCs 均能在 3 種 BCP 材料表面良好地貼敷和生長,并且呈多邊不規則形,伸展出可牢固貼附的偽足。
3 種 BCP 顆粒材料包埋于比格犬豎脊肌肌袋 2 個月后,材料縫隙間可見明顯骨樣組織沉積,此時開始出現成骨差異,在體外實驗中生物相容性表現最差的 A 組材料,成骨面積比卻顯著高于其余兩組;盡管 3 個月時 B、C 組成骨面積比有所增加,但仍顯著低于 A 組。3 種材料隨著置入時間延長,成骨面積比均穩步升高,從整體趨勢看,成骨是一個緩慢持續且較為穩定的過程,介孔直徑更大的材料其成骨性能在異位成骨模型中表現更好。qRT-PCR 檢測示,A 組 ALP、OC 及 OPN 基因表達在2 個月時達高峰,之后平穩回落;B 組 3 種成骨相關基因表達整體上略高于 C 組,但兩組間差異并無統計學意義。盡管隨時間推移 3 組材料的基因表達水平均較植入初期明顯升高,但 A 組基因上調時間最早,達到基因表達高峰的時間最短,這與組織學檢測得出的成骨面積比表達規律一致。
本研究結果提示:1 050℃ 溫度燒結的 BCP 材料成骨效果優于其余兩組可能是暫時的,因為其余兩組成骨相關基因的表達仍在持續上調,其成骨效率尚未達到峰值,因此還需要更長時間觀測以評估各材料的整體成骨性能。1 050℃ 溫度燒結的 BCP 材料生物相容性最差,但成骨性能最佳,是因為體內環境充足的血供和細胞來源為 BCP 的成骨提供了良好基礎,提示我們在后期臨床應用中,應充分考慮材料植入區域的血供條件。介孔直徑對材料成骨效果產生的諸多影響,其機制目前尚不明確,并不是所有 BCP 材料都能展現出明顯的異位成骨能力。有研究證實介孔直徑小、比表面積很低的材料甚至不會有成骨發生[18],還有研究證實孔隙率約為 60% 的材料能夠為骨組織提供充分的生長空間[19],并認為在充足的孔隙內保持穩定新陳代謝的原因是植入物內充足的體液浸潤[18, 20]。在此基礎上,介孔的存在為局部環境提供了豐富的鈣、磷離子[21],當濃度達到了過飽和水平,豐富的鈣、磷離子足以形成生物磷灰石層,進一步產生了成骨現象[22]。因此可以推測,本研究中的 3 種 BCP 材料在其整體結構能夠提供一可靠空間支撐的前提下,不同介孔直徑導致材料表層產生了不同程度的鈣、磷離子,該過程不會太快,但穩定而持續,所以成骨面積比隨時間延長逐步升高。介孔直徑作為一個重要參數,可調節局部鈣、磷離子水平,維持生物磷灰石層穩定。在一定介孔直徑范圍內,直徑較大的材料能夠生成更穩定的生物磷灰石層,具備更早、更快成骨的能力。
綜上述,本研究成功制備了 3 種不同介孔直徑的 BCP 材料,盡管其生物相容性存在顯著差異,但是 BMSCs 均可在材料表面貼附和增殖;動物體內實驗表明在充足血供和良好成骨環境中,介孔直徑較大的 BCP 材料能夠展現出更強的成骨能力。介孔直徑作為一個可以調控的指標,可在 BCP 制備過程中作為有效參數,實現 BCP 材料的優化和升級。
志謝:感謝四川大學生物材料工程研究中心提供制作 3 種 BCP 顆粒材料的技術支持。
作者貢獻:張棟負責實驗設計及實施、數據收集整理、統計分析以及論文撰寫;宗憲磊對文章的知識性內容作批評性審閱;郭小雙、杜宏參與實驗實施,包括動物的體內實驗、標本取材及檢測;宋國棟、靳小雷參與文章科研設計及討論部分的分析,對文章整體的知識性內容作批評性審閱及支持性貢獻。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:本研究經中國醫學科學院整形外科醫院實驗動物倫理委員會批準[(2014)注冊第(10)號]。實驗動物使用許可證號 :SYXK(京)2020-0018。