引用本文: 林俊卿, 黃騰立, 高濤, 鄭憲友. 內皮祖細胞來源小細胞外囊泡促進小鼠脊髓損傷修復的實驗研究. 中國修復重建外科雜志, 2021, 35(4): 488-495. doi: 10.7507/1002-1892.202009130 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
脊髓損傷是指外傷、腫瘤等因素導致脊髓組織完整性被破壞,進而引起一系列運動、感覺及自主神經功能障礙的一種疾病[1]。脊髓損傷后自我修復能力有限,目前尚無有效治療方法,預后往往不佳,給患者及家庭帶來巨大負擔[2-3]。如何促進脊髓修復一直是臨床亟待解決的難題之一[4]。研究表明,血管新生在脊髓修復中具有重要意義,新生血管既可作為支架引導軸突再生,又可為損傷區域供血供氧,為修復提供必要的營養物質[5]。內皮祖細胞(endothelial progenitor cells,EPCs)是一種來源于骨髓且具有多向分化能力的細胞,作為血管來源祖細胞,在血管修復中起到關鍵作用[6]。研究發現,內皮損傷后 EPCs 能在缺血或梗死區域產生新生血管,并充當細胞循環池中一員替代功能異常的內皮細胞[7]。此外,缺血性腦卒中患者循環中的 EPCs 增加與腦卒中預后密切相關,進一步提示了 EPCs 促血管新生作用及其在脊髓損傷修復中的潛在能力[8]。
研究報道干細胞介導的血管新生及組織再生可能是通過旁分泌作用實現,其中小細胞外囊泡(small extracellular vesicles,sEVs)發揮了重要的橋接作用[9]。sEVs 是一類由細胞分泌且直徑<200 nm 的脂質雙層膜囊泡,它能夠選擇性包裹蛋白質、脂質、生長因子及編碼和非編碼 RNA 等多種生物活性物質,參與細胞間交流。由于本身體積較小,攜帶宿主抗原較少,并且不攜帶大量基因組 DNA,所以相比干細胞,sEVs 更適合用于臨床治療[10]。EPCs-sEVs 作為溝通血管內皮細胞與 EPCs 之間的重要橋梁,在促進內皮細胞新生中具有重要作用。目前 EPCs-sEVs 多用于心血管系統相關疾病治療中,罕見用于脊髓損傷的治療。為此,本研究將 EPCs-sEVs 用于干預脊髓損傷小鼠,明確其治療脊髓損傷的療效,初步探索治療可能機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
4 周齡 SPF 級 C57BL/6 雄性小鼠 20 只,體質量 15~20 g,用于 EPCs 的提取。10 周齡 SPF 級 C57BL/6 雌性小鼠 43 只,體質量 30~35 g,用于脊髓損傷模型制備。實驗動物均由上海交通大學附屬第六人民醫院提供。
EPCs 培養基(Lonza 公司,瑞士);纖維連接蛋白、Dil 標記的乙酰化低密度脂蛋白(Dil labeled acetylated low density lipoprotein,Dil-AcLDL;北京索萊寶生物技術有限公司);FITC 標記的凝集素 1(FITC labeled Ulex europaeus agglutinin 1,FITC-UEA-1;Sigma 公司,美國);CD133、CD34 及 VEGF 受體 2(VEGF receptor 2,VEGFR2)流式抗體(Biolengend 公司,美國);FBS、雙抗、EDTA-胰蛋白酶(GIBCO 公司,美國);CD31、CD9、CD63 及 gm130 抗體(Abcam 公司,英國)。
微量注射器(Hamilton 公司,美國);激光共聚焦顯微鏡、倒置相差顯微鏡(Leica 公司,德國);超速離心管、超速離心機(Beckman 公司,美國);Western 電泳系統(Bio-Rad 公司,美國);納米流式檢測儀(廈門福流生物科技有限公司);透射電鏡(JEOL 公司,日本);流式檢測儀(BD 公司,美國);活體成像儀(上海天能科技有限公司);電子 Von Frey 測痛儀(Bioseb 公司,法國);Image J 軟件(美國國立衛生研究院)。
1.2 EPCs 分離培養及鑒定
1.2.1 EPCs 分離培養
根據文獻[11]報道方案分離培養小鼠 EPCs。將 20 只小鼠給予過量麻醉藥物處死,置于 75% 乙醇中浸泡 30 min 后,取股骨及脛骨并清除周圍組織肌肉;使用針筒在 EPCs 完全培養基中沖洗骨髓腔 10 次,收集沖洗液;以 300×g 離心 5 min,棄上清,使用 EPCs 培養基重懸,并將細胞接種于已預鋪纖維連接蛋白的培養皿中,置于 37℃、5%CO2 培養箱中培養。培養 3 d 后取出培養皿,使用 PBS 沖洗未貼壁細胞及紅細胞碎片,加入新的 EPCs 完全培養基,置于培養箱中繼續培養 7~10 d,倒置相差顯微鏡下觀察細胞形態;待細胞融合達 80% 時進行傳代。
1.2.2 EPCs 鑒定
參照文獻[12]方法對 EPCs 進行鑒定。① 流式細胞術:取 P2 代貼壁 EPCs,以 0.25% EDTA-胰蛋白酶消化后制備成細胞懸液;使用 CD133、CD34 及 VEGFR2 流式抗體孵育 20 min,PBS 清洗 3 次,納米流式檢測儀檢測。② 雙熒光染色觀察:取 P2 代 EPCs,按照 1∶3 細胞傳代比例接種至帶有細胞爬片的 24 孔板中;待培養 24 h 細胞貼壁后,Dil-AcLDL 避光孵育 4 h,PBST 清洗孔板 3 次,4% 多聚甲醛固定 15 min,FITC-UEA-1 孵育 1 h,DAPI 孵育 5 min,PBST 清洗孔板 3 次,取細胞爬片于激光共聚焦顯微鏡觀察,Dil-AcLDL 呈紅色熒光染色,FITC-UEA-1 呈綠色熒光染色,DAPI 呈藍色熒光染色。
1.3 EPCs-sEVs 的提取與鑒定
1.3.1 EPCs-sEVs 的提取及標記
EPCs 培養至 P4 代,期間收集 P2~P4 代培養上清。將細胞上清置于離心管中,以 300×g 離心 10 min、2 000×g 離心 30 min、10 000×g 離心 30 min,棄沉淀。將上清轉移至超速離心管中,以 100 000×g 離心 70 min,棄上清,加入 PBS 重懸;再次以 100 000×g 離心 70 min,棄上清,PBS 重懸后底部沉淀即為 EPCs-sEVs。
取部分 EPCs-sEVs 室溫下使用 DiR 標記,加入 PBS 重懸,以 100 000×g 離心 70 min,棄上清,同上法加入 PBS 重懸并以 100 000×g 離心 70 min,重復 3 次,以清除殘余染液。
1.3.2 EPCs-sEVs 的鑒定
① 透射電鏡觀察 EPCs-sEVs 的形態;② 納米流式檢測儀檢測 EPCs-sEVs 的粒徑分布及濃度;③ 將 EPCs-sEVs 以及 EPCs 使用 RIAP 裂解后,使用 4×Loading buffer 進行稀釋,提取蛋白行 Western blot 檢測(CD9、CD63 及 gm130),以確定 EPCs-sECs 的表面標志物。
1.4 實驗分組及方法
取 40 只雌性小鼠隨機分為 4 組,分別為假手術組、模型組、低濃度干預組及高濃度干預組,每組 10 只。
各組小鼠經吸入異氟烷麻醉后,作背部正中切口,去除 T10 椎板,暴露脊髓;假手術組直接關閉切口,其余各組制備脊髓損傷模型。具體方法:采用改良 Allen 脊髓損傷打擊器,按照高度 1 cm、打擊棒質量 10 g 的打擊條件對脊髓組織進行打擊。打擊后小鼠雙下肢出現抽動并甩尾,麻醉蘇醒后小鼠雙下肢癱瘓,打擊位點出現暗紅色血液提示模型制備成功[13]。
模型制備后,模型組不作其他處理,低、高濃度干預組分別于模型制備后 30 min、3 d 及 7 d 經尾靜脈對應注射濃度為 1×109、1×1010 個/mL 的 EPCs-sEVs,每只注射 50 μL。術后小鼠每日人工排便、排尿直至恢復自主排便、排尿反射。
1.5 觀測指標
1.5.1 小鼠脊髓活體成像觀察
取 3 只雌性小鼠參照 1.4 方法制備脊髓損傷模型后,于尾靜脈注射 DiR 標記的 EPCs-sEVs,30 min 后給予過量麻醉藥物處死后,按照原切口入路,取出胸段脊柱,切取包括損傷部位上、下 0.5 cm 范圍的脊髓組織,置于活體成像儀中觀察損傷部位熒光信號,以觀察注射的 EPCs-sEVs 是否到達脊髓損傷部位。
1.5.2 小鼠行為學檢測
① BMS 評分:術后 1、3 d 及 1、2、3、4 周觀察各組小鼠后肢運動功能恢復情況,根據 BMS 評分量表[13]進行評分,0 分表示完全癱瘓,9 分表示完全正常。② 斜板實驗:術后 1、2、3、4 周將小鼠放置于自制斜板上,記錄其在斜板上能夠停留至少 5 s 的最大角度。③ Von Frey 實驗:術后 4 周采用電子 Von Frey 測痛儀測量機械痛閾值。將傳感器尖端對準小鼠足底中央區,逐漸增加針刺強度,小鼠出現縮足、甩腿、舔舐及抬腿等疼痛相關行為反應記為陽性反應,出現 3 次陽性反應的最低刺激強度(g)即為小鼠機械痛閾值。
1.5.3 組織學觀察
① HE 染色:術后 4 周行為學檢測后,給予過量麻醉藥物處死全部小鼠,切取包括損傷部位上、下 0.5 cm 范圍的脊髓組織。大體觀察組織損傷情況后,以蔗糖密度梯度脫水,取部分脊髓組織冰凍切片,片厚 5 μm,常規 HE 染色,倒置相差顯微鏡下觀察。
② 免疫組織化學染色:取部分脊髓組織冰凍切片,片厚 25 μm,置于 0.01%Triton 破膜,牛血清白蛋白封閉,一抗 CD31(1∶200)孵育過夜后,滴加辣根過氧化物酶標記二抗孵育,DAB 顯色,蘇木素染核,封片,倒置相差顯微鏡下觀察。使用 Image J 軟件測量積分吸光度(IA)值,每組選擇至少 3 個視野進行統計分析。
1.6 統計學方法
采用 SPSS26.0 及 Prism8.0 軟件進行統計分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 Tukey 檢驗;檢驗水準 α=0.05。
2 結果
2.1 EPCs 分離培養及鑒定
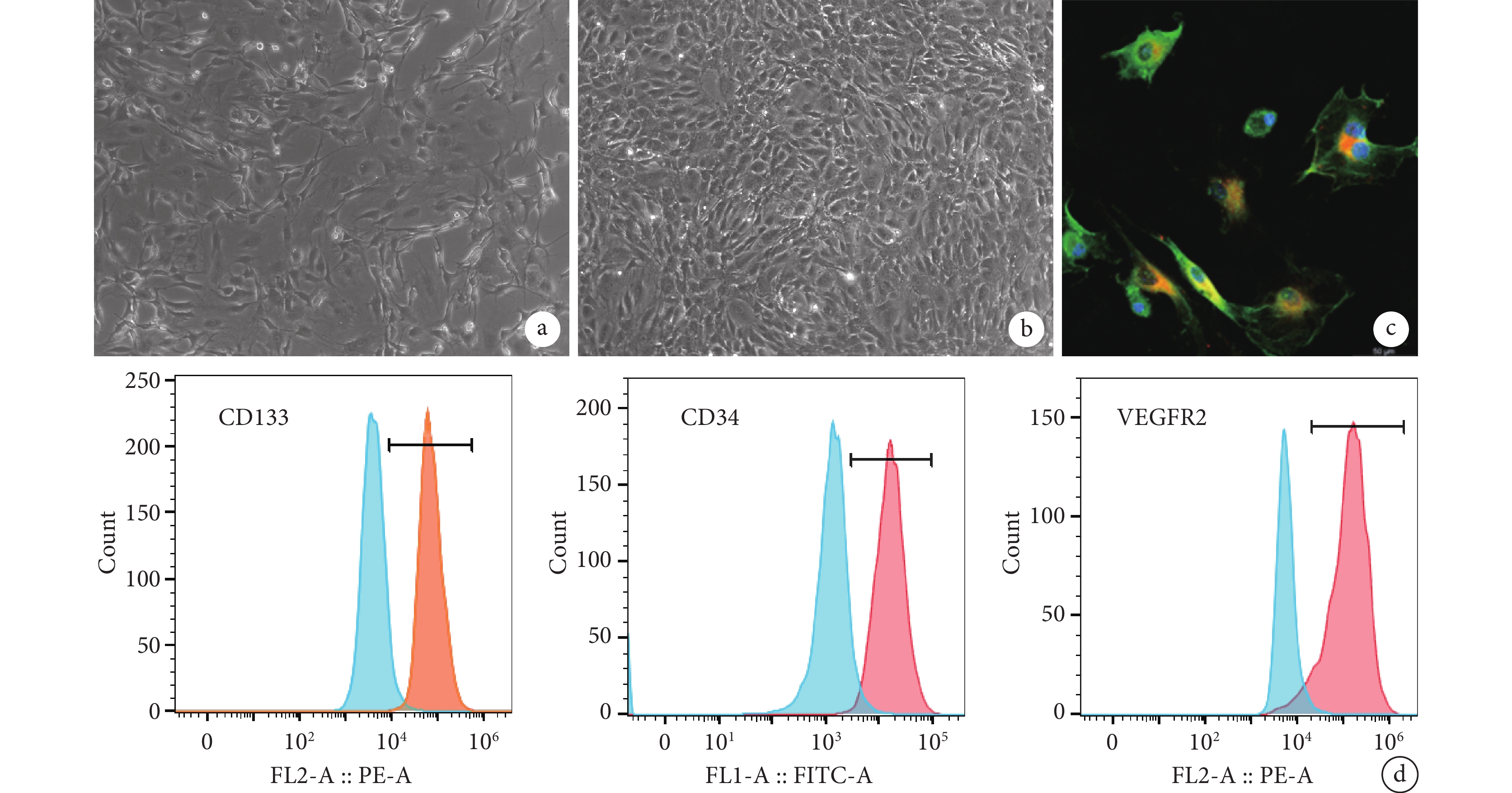
培養 7 d 后倒置相差顯微鏡下可見 EPCs 呈鋪路石樣排列生長于培養皿中,傳代后細胞形態與傳代前一致。流式細胞術檢測顯示,CD133、CD34 及 VEGFR2 陽性細胞分別占 99.3%、99.1%、93.9%。Dil-AcLDL 及 FITC-UEA-1 雙熒光染色觀察示,細胞具有吞噬 Dil-AcLDL 能力且能被 FITC-UEA-1 結合。經鑒定,分離培養細胞為 EPCs。見圖 1。
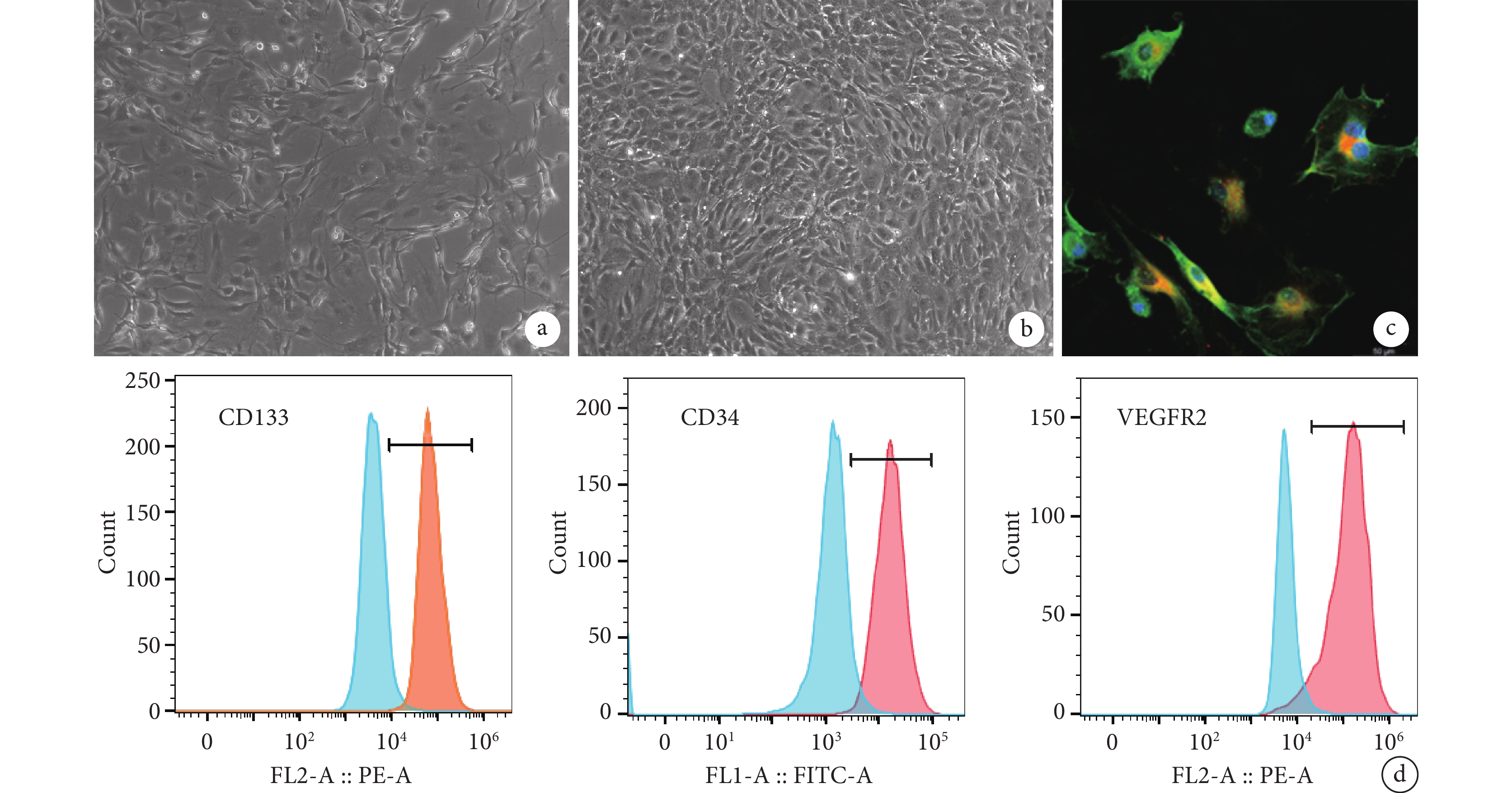 圖1
EPCs 細胞形態觀察及鑒定
圖1
EPCs 細胞形態觀察及鑒定
a. 培養 7 d 細胞形態(倒置相差顯微鏡×100);b. P2 代細胞形態(倒置相差顯微鏡×100);c. Dil-Ac-LDL 和 FITC-UEA-1 雙熒光染色觀察(激光共聚焦顯微鏡×400);d. 流式細胞術鑒定
Figure1. Cell morphology observation and identification of EPCsa. Cell morphology after 7 days of culture (Inverted phase contrast microscope×100); b. The morphology of the P2 generation cells (Inverted phase contrast microscope×100); c. Double fluorescence staining of Dil-Ac-LDL and FITC-UEA-1 (Laser scanning confocal microscope×400); d. Flow cytometry identification
2.2 EPCs-sEVs 的鑒定
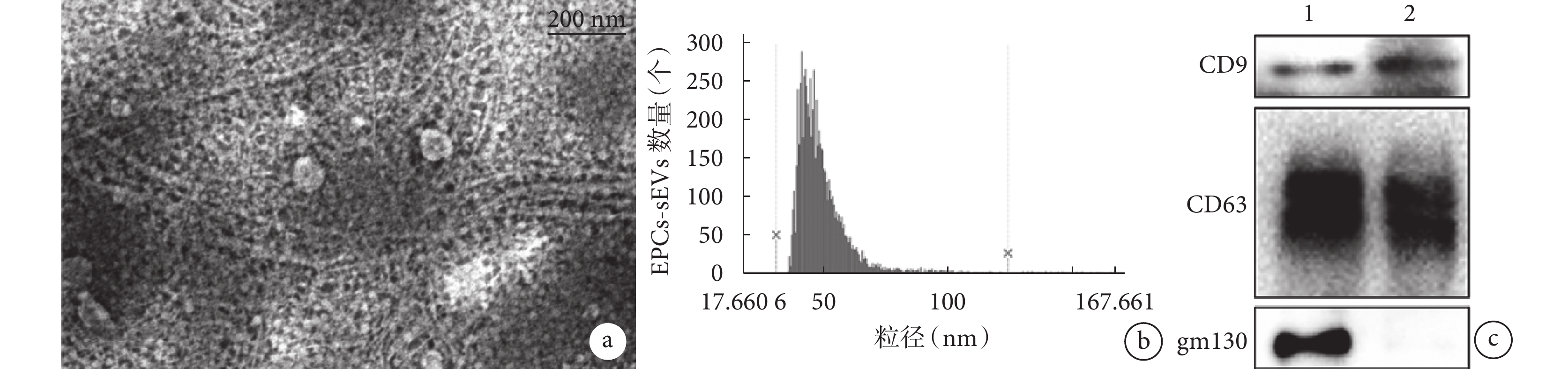
透射電鏡觀察見 EPCs-sEVs 具有典型的脂質雙分子層結構,呈杯狀,大小介于 30~150 nm。納米流式檢測儀檢測示 EPCs-sEVs 粒徑均<200 nm,多數介于 30~150 nm;濃度在 5×109~1×1010 個/mL 范圍內波動。Western blot 檢測顯示 EPCs-sEVs CD9 及 CD63 表達陽性、gm130 表達陰性,EPCs CD9、CD63 及 gm130 表達均為陽性。上述鑒定結果提示成功提取 EPCs-sEVs。見圖 2。
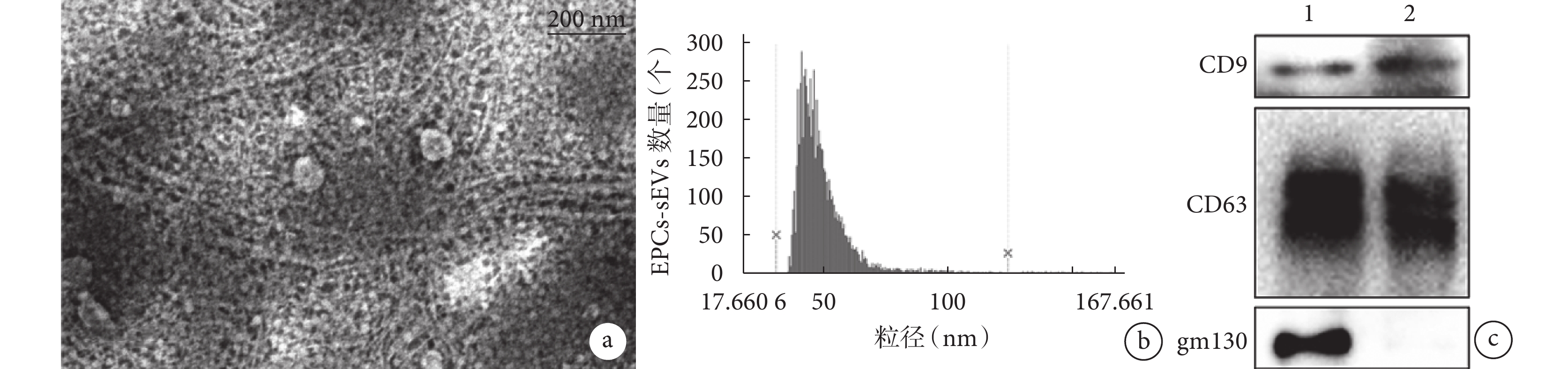 圖2
EPCs-sEVs 的鑒定
圖2
EPCs-sEVs 的鑒定
a. 透射電鏡觀察(×67 k);b. 納米流式檢測儀檢測 EPCs-sEVs 粒徑分布;c. Western blot 檢測 1:EPCs 2:EPCs-sEVs
Figure2. The identification of EPCs-sEVsa. Transmission electron microscope observation (×67 k); b. Nanoflow cytometry detection of EPCs-sEVs particle size distribution; c. Western blot detection 1: EPCs 2: EPCs-sEVs
2.3 動物實驗觀察
2.3.1 小鼠脊髓活體成像觀察
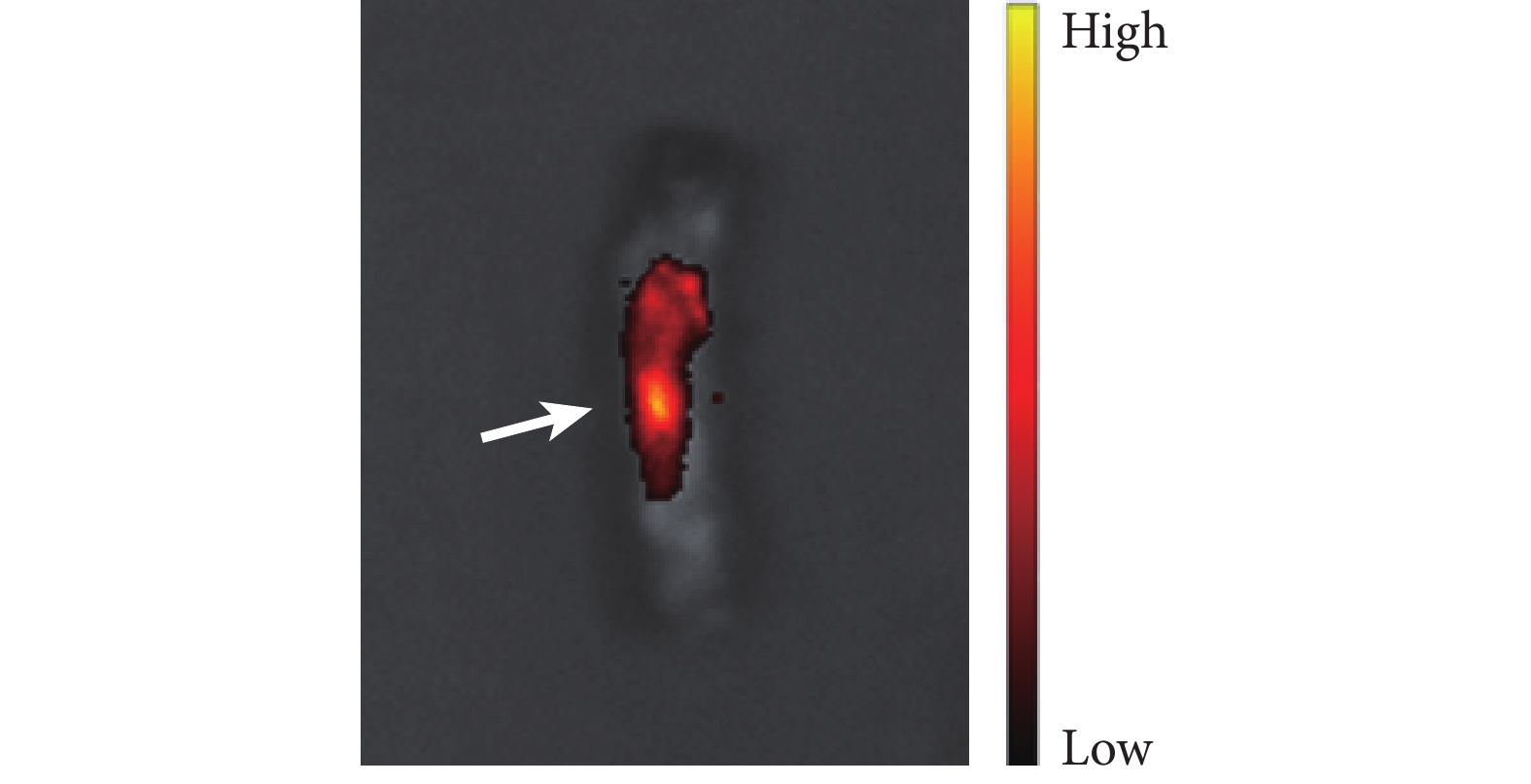
活體成像儀觀察顯示 DiR 標記的 EPCs-sEVs 在注射后 30 min 內募集至脊髓損傷區域。見圖 3。
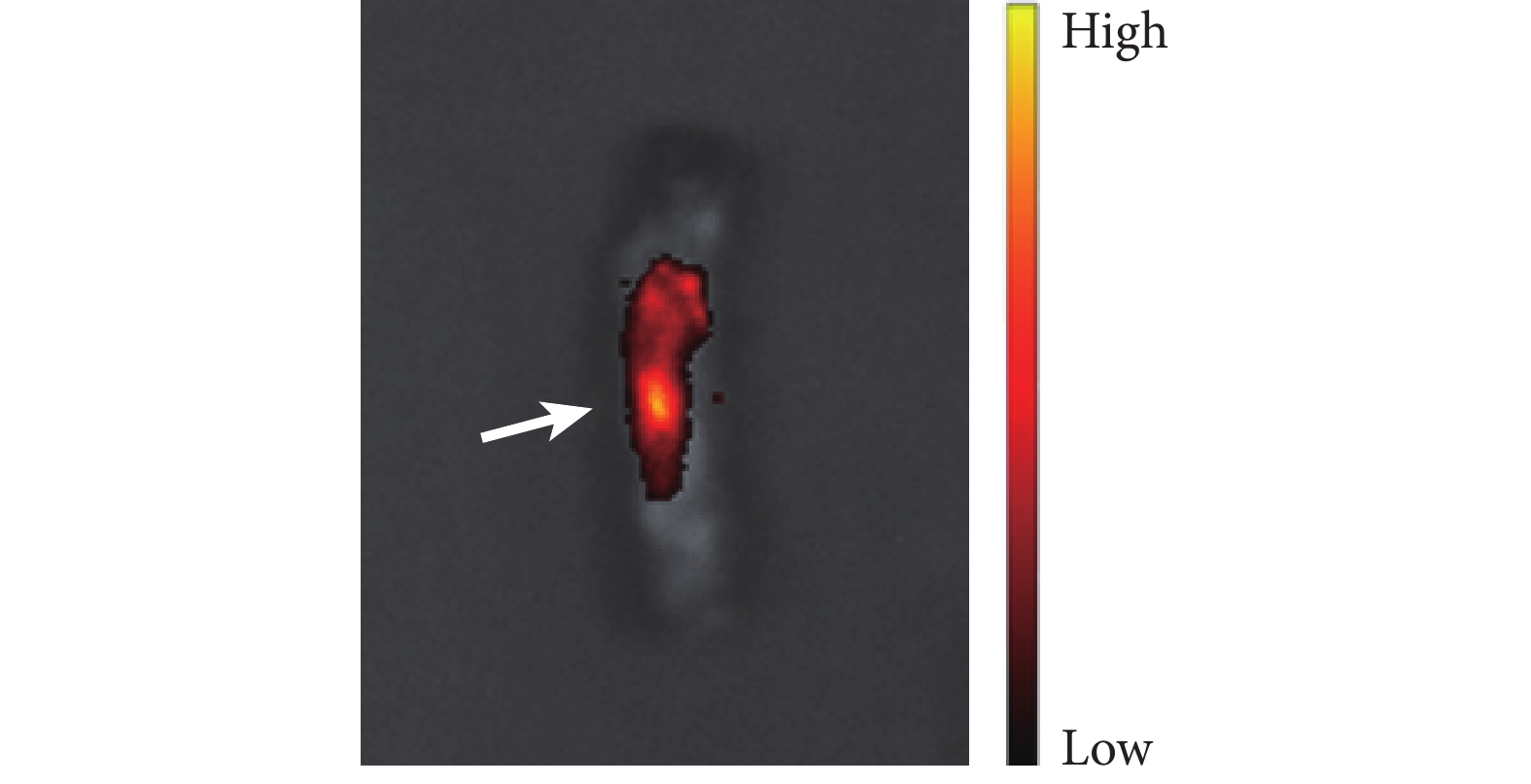 圖3
活體成像儀觀察
圖3
活體成像儀觀察
箭頭示 EPCs-sEVs 募集至脊髓損傷部位
Figure3. In vivo imaging of the spinal cordArrow indicated the recruitment of EPCs-sEVs to the spinal cord injury site
2.3.2 小鼠行為學檢測
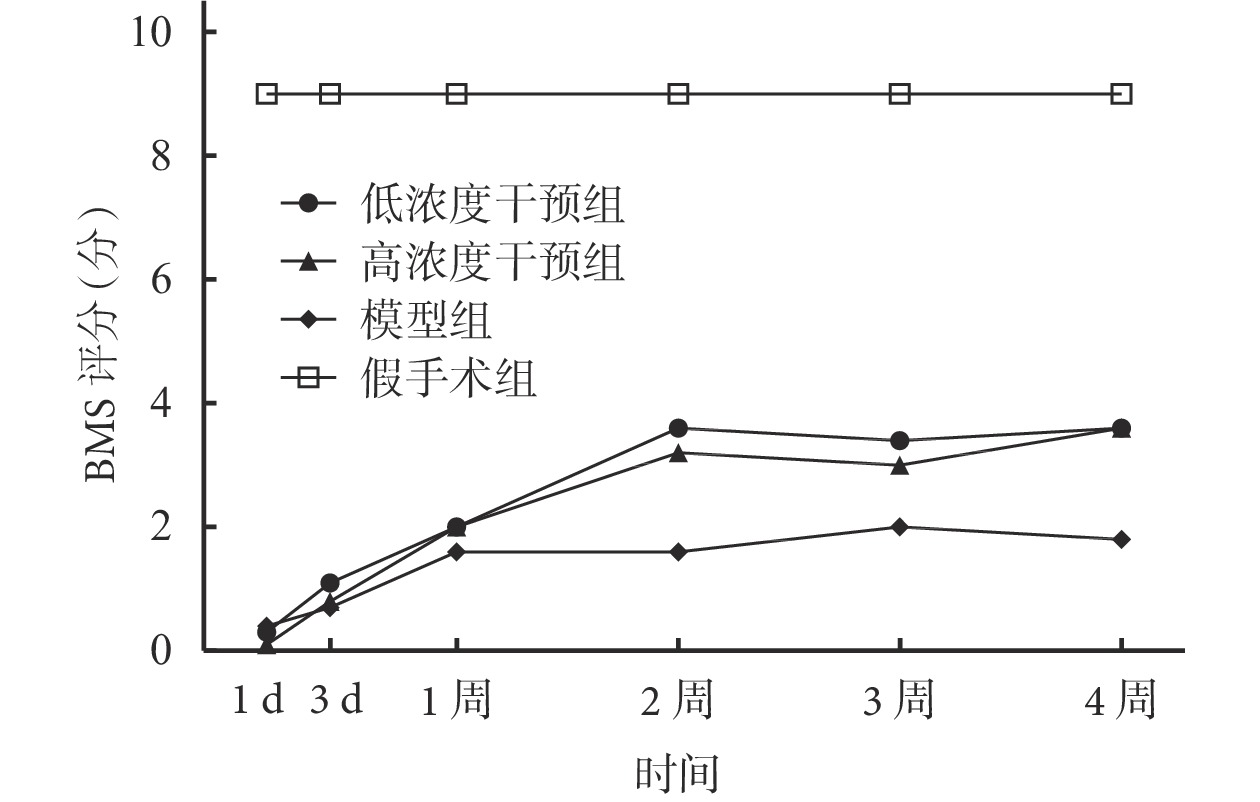
① BMS 評分:各時間點,假手術組 BMS 評分均明顯高于其他組,差異有統計學意義(P<0.05)。術后 1、3 d 及 1 周,兩干預組 BMS 評分與模型組比較差異均無統計學意義(P>0.05);2、3、4 周明顯高于模型組,差異有統計學意義(P<0.05)。各時間點兩干預組間差異均無統計學意義(P>0.05)。兩干預組及模型組小鼠術后 2 周后 BMS 評分進入平臺期。見圖 4。
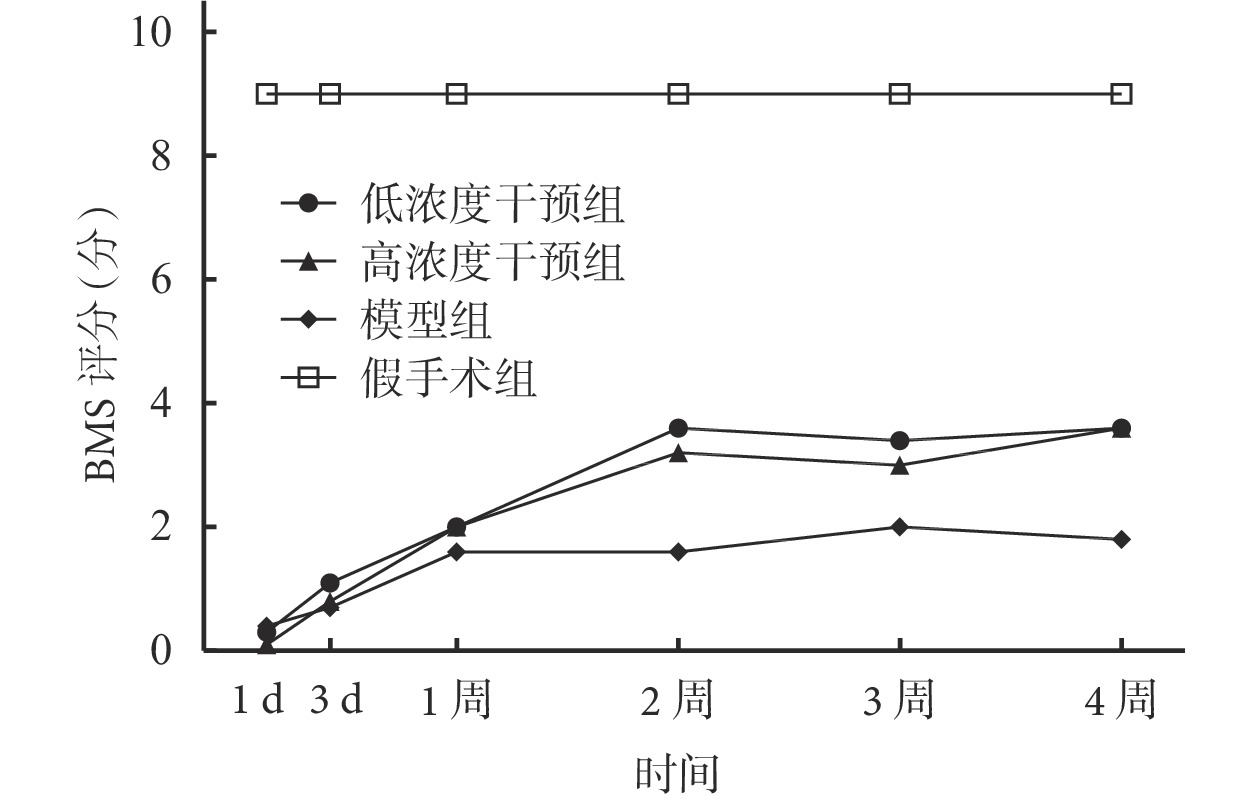 圖4
術后各時間點各組小鼠 BMS 評分
Figure4.
BMS score of each group at each time point
圖4
術后各時間點各組小鼠 BMS 評分
Figure4.
BMS score of each group at each time point
② 斜板實驗:各時間點,假手術組最大角度均明顯大于其他組,差異有統計學意義(P<0.05)。術后 1 周,兩干預組最大角度與模型組比較差異均無統計學意義(P>0.05);2、3、4 周明顯大于模型組,差異有統計學意義(P<0.05)。各時間點,兩干預組間差異均無統計學意義(P>0.05)。見表 1。
 ,°)
Table1.
The maxium angles of inclined plant test at different time points (n=5,
,°)
Table1.
The maxium angles of inclined plant test at different time points (n=5,  , °)
, °)
③ Von Frey 實驗:術后 4 周,假手術組、模型組以及低、高濃度干預組小鼠機械痛閾值分別為 1.00±0.06、0.16±0.04、0.33±0.06、0.34±0.05。兩干預組機械痛閾值明顯高于模型組、低于假手術組,差異均有統計學意義(P<0.05),但兩干預組間比較差異無統計學意義(P>0.05)。
2.4 組織學觀察
2.4.1 HE 染色
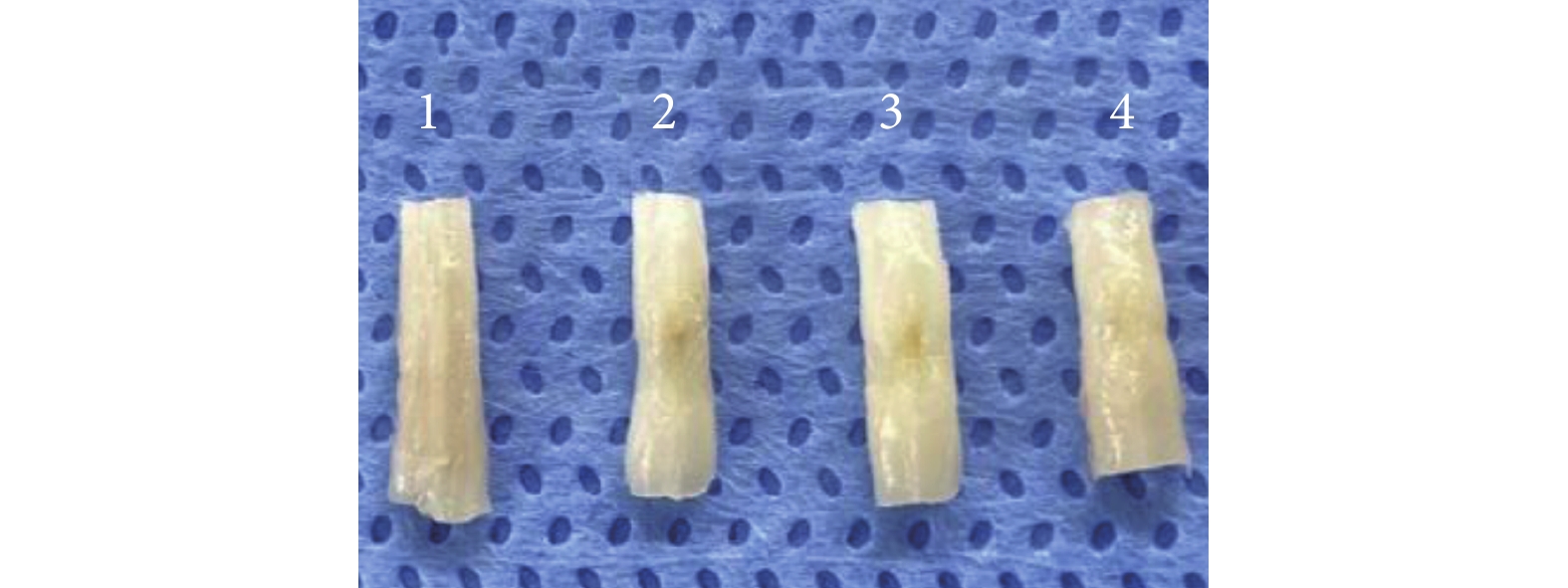
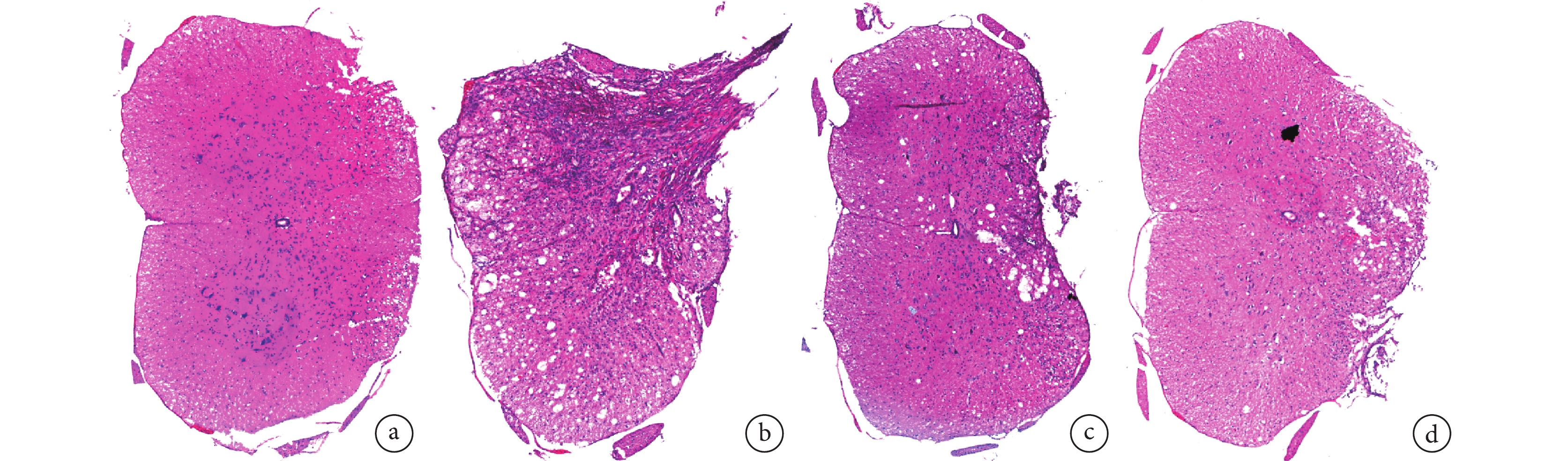
術后 4 周取材時可見模型組損傷節段脊髓組織缺損明顯大于兩干預組,兩干預組大體觀察無明顯差異(圖 5)。HE 染色鏡下觀察,假手術組為正常脊髓組織結構;模型組可見大量組織壞死、單個核細胞浸潤,組織形態結構紊亂;兩干預組損傷脊髓組織壞死程度明顯輕于模型組,單個核細胞浸潤明顯減少,兩干預組間無明顯差異。見圖 6。
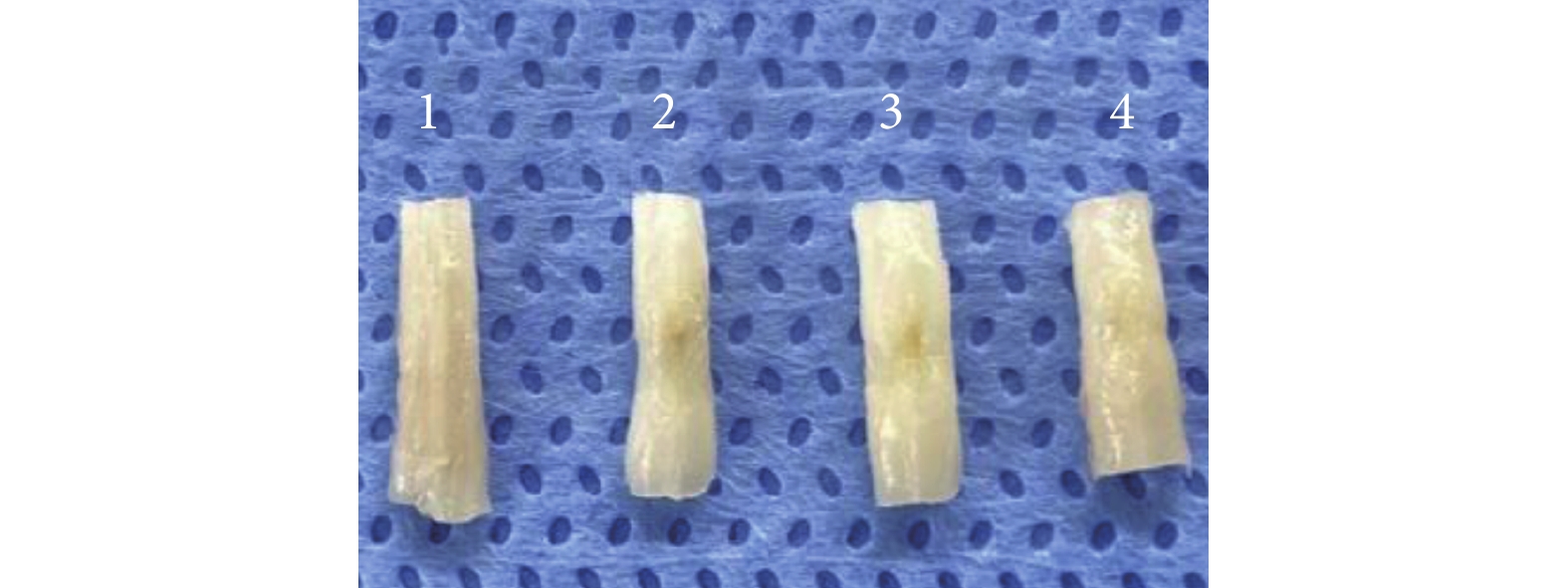 圖5
術后 4 周各組脊髓組織大體觀察
圖5
術后 4 周各組脊髓組織大體觀察
1~4 分別為假手術組、模型組、低濃度干預組、高濃度干預組
Figure5. The gross observation of spinal cord tissue in each group at 4 weeks after operation1-4 for the sham group, model group, low concentration intervention group, and high concentration intervention group, respectively
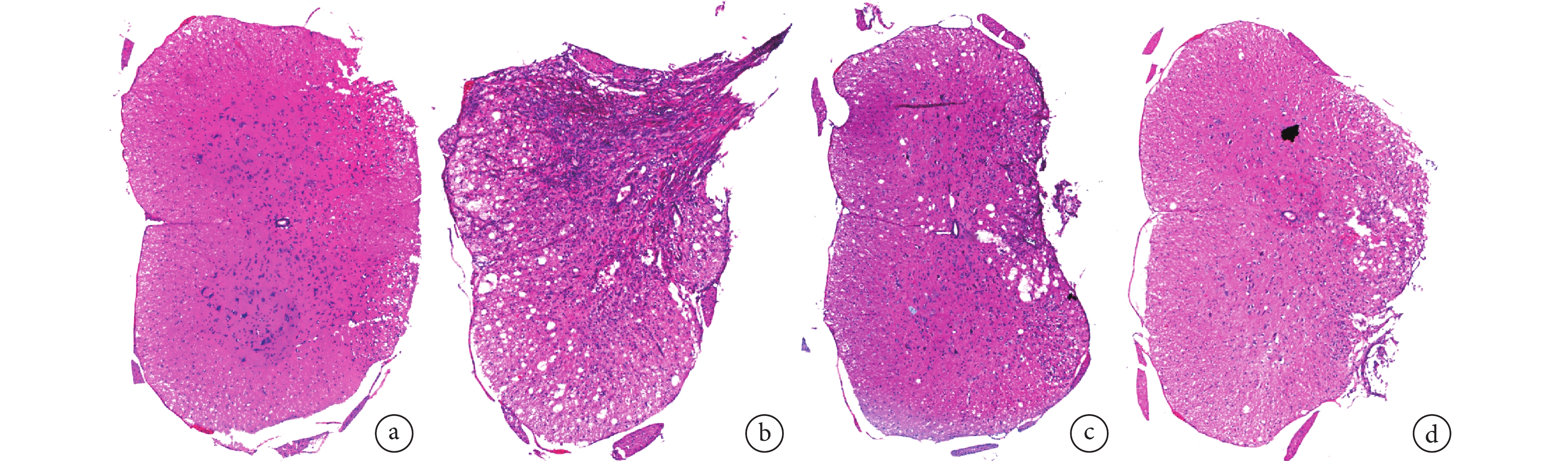 圖6
術后 4 周各組 HE 染色觀察(倒置相差顯微鏡×100)
圖6
術后 4 周各組 HE 染色觀察(倒置相差顯微鏡×100)
a. 假手術組;b. 模型組;c. 低濃度干預組;d. 高濃度干預組
Figure6. HE staining of each group at 4 weeks after operation (Inverted phase contrast microscope×100)a. Sham group; b. Model group; c. Low concentration intervention group; d. High concentration intervention group
2.4.2 免疫組織化學染色
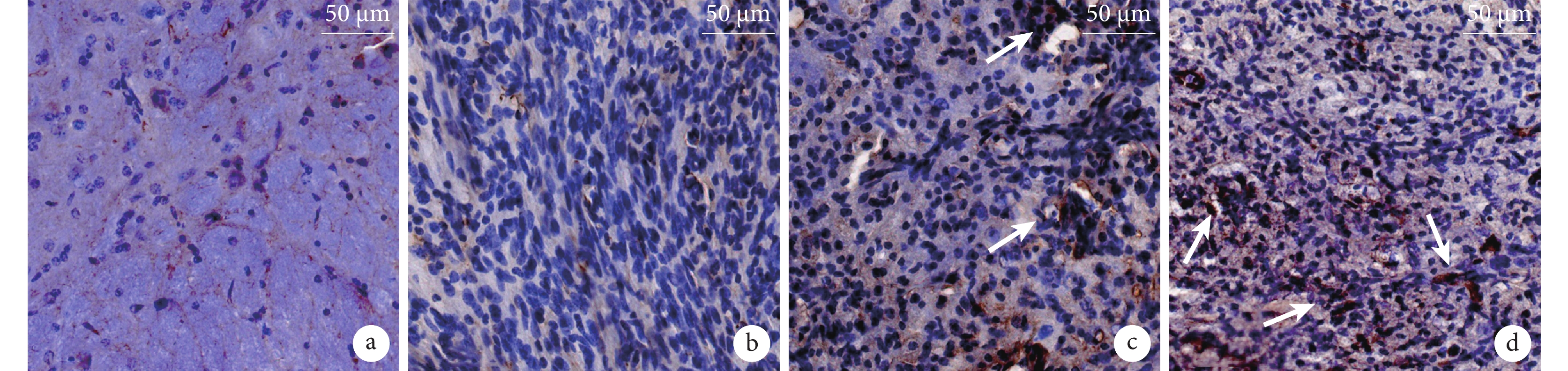
鏡下觀察見假手術組血管分布規則;兩干預組 CD31 血管染色較模型組更深,兩干預組間無明顯差異。見圖 7。定量分析顯示假手術組、模型組以及低、高濃度干預組 IA 值分別為 1.00±0.19、0.04±0.03、0.45±0.18、0.45±0.13。兩干預組 IA 值明顯高于模型組、低于假手術組,差異均有統計學意義(P<0.05),但兩干預組間比較差異無統計學意義(P>0.05)。
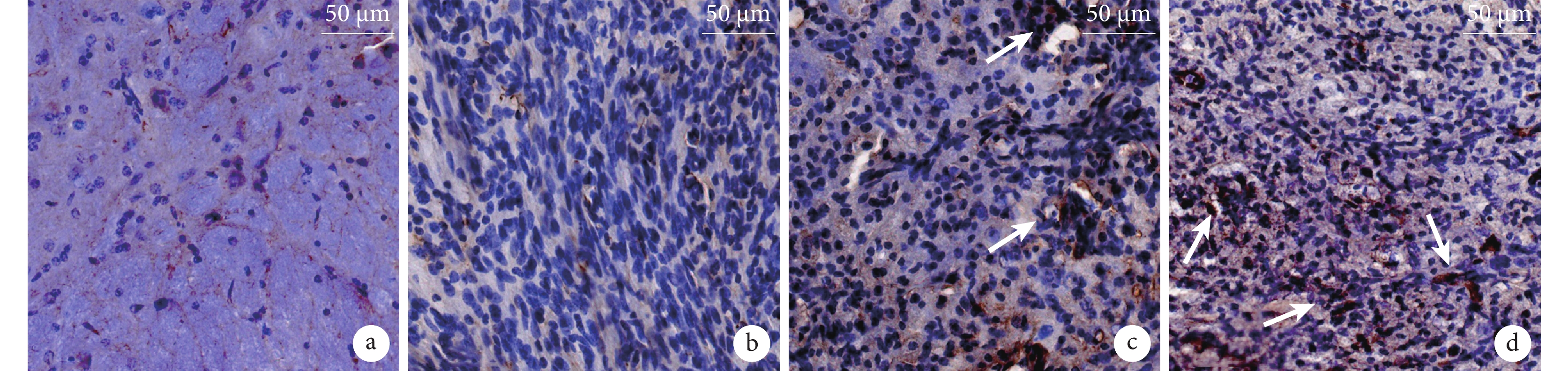 圖7
術后 4 周各組免疫組織化學染色觀察(倒置相差顯微鏡×200)
圖7
術后 4 周各組免疫組織化學染色觀察(倒置相差顯微鏡×200)
箭頭示新生血管 a. 假手術組;b. 模型組;c. 低濃度干預組;d. 高濃度干預組
Figure7. Immunohistochemical staining of each group at 4 weeks after operation (Inverted phase contrast microscope×200)Arrows showed the neovascularization a. Sham group; b. Model group; c. Low concentration intervention group; d. High concentration intervention group
3 討論
研究表明,干細胞用作移植物治療脊髓損傷時,能夠通過分泌生長因子、調節免疫反應,促進神經環路重建及使脫髓鞘神經再髓鞘化等途徑,促進損傷神經再生[14]。目前多選擇移植 MSCs 及神經干細胞,獲得了一定治療效果。但干細胞治療脊髓損傷存在安全性較低、免疫排斥反應、存儲條件嚴格、獲取來源有限等問題,在一定程度上限制了其臨床轉化[15]。而干細胞來源的 sEVs 由于不存在干細胞移植中所面臨的免疫排斥反應等問題,顯示出較好的臨床轉化前景,目前已在多種組織修復治療中獲得較好效果[16]。
目前,sEVs 用于中樞神經系統損傷的治療研究已較多。研究顯示 sEVs 可能通過以下 3 種機制促進中樞神經系統損傷修復。① 在創傷性中樞神經系統損傷模型中使用 sEVs 治療后,循環中的中性粒細胞及單核細胞減少,提示 sEVs 可能通過緩解炎癥反應促進中樞神經組織修復[16]。② Zhang 等[17]的研究使用來源于 MSCs 的 sEVs 干預創傷性腦損傷模型,發現損傷部位血管密度增加,提示 sEVs 可通過促進血管新生,進而促進中樞神經組織修復。③ sEVs 可直接刺激神經軸突的再生來促進中樞神經組織修復[16]。
本研究發現 EPCs-sEVs 能促進脊髓損傷后功能恢復,術后 1 周內兩干預組小鼠后肢功能與模型組無明顯差異,但 2 周后小鼠后肢運動功能及感覺評價明顯高于模型組;術后 4 周,組織學觀察顯示兩干預組組織學結構恢復程度亦優于模型組,且免疫組織化學染色示新生血管更多。上述研究結果提示 EPCs-sEVs 可促進小鼠脊髓損傷的修復,作用機制可能是通過促進脊髓損傷部位血管新生而實現。目前已有諸多研究證據支持 EPCs-sEVs 在血管新生方面有著與 EPCs 相同的效果[18-20]。Li 等[21]研究證實 EPCs-sEVs 可通過增加血管生成相關分子的表達來促進血管內皮修復。此外,研究還認為 EPCs-sEVs 可通過向周圍靶細胞傳遞 miRNA-214,促進內皮細胞的增殖及分化,減少內皮細胞衰老,從而促進血管新生[22]。早期血管損傷后,局部殘存的神經元缺血、缺氧,導致局部組織出現二次損傷[23]。此外,血管新生還能為神經生長鋪設一條快速通道,便于神經軸突再生,因此促進脊髓損傷部位血管新生具有重要意義[24]。
目前,EPCs-sEVs 中促進脊髓損傷部位血管新生的有效成分尚未明確,有待后續深入研究,以期發現有效的促進血管新生的分子或 miRNA,進而通過人工制作脂質體包裹有效分子或 miRNA 達到直接替代 sEVs 促進脊髓損傷部位血管新生的目的。此外,本研究僅以小鼠作為研究模型,后續還需進一步在大型動物水平驗證 EPCs-sEVs 在治療脊髓損傷中的作用,以期為臨床轉化提供臨床前研究證據。
志謝:上海交通大學附屬第六人民醫院四肢顯微外科研究所。
作者貢獻:林俊卿參與研究設計和實施,數據收集及撰寫文章;黃騰立參與研究實施及數據收集;高濤參與文章撰寫并作批評性審閱;鄭憲友參與研究設計及對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究及文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計學分析及其報道。
機構倫理問題:研究方案經上海交通大學附屬第六人民醫院醫學倫理委員會批準(DWSY2020-0605)。動物實驗程序及開展方案符合動物使用及管理委員會規定。實驗動物使用許可證號:SYXK(滬)2016-0020。
脊髓損傷是指外傷、腫瘤等因素導致脊髓組織完整性被破壞,進而引起一系列運動、感覺及自主神經功能障礙的一種疾病[1]。脊髓損傷后自我修復能力有限,目前尚無有效治療方法,預后往往不佳,給患者及家庭帶來巨大負擔[2-3]。如何促進脊髓修復一直是臨床亟待解決的難題之一[4]。研究表明,血管新生在脊髓修復中具有重要意義,新生血管既可作為支架引導軸突再生,又可為損傷區域供血供氧,為修復提供必要的營養物質[5]。內皮祖細胞(endothelial progenitor cells,EPCs)是一種來源于骨髓且具有多向分化能力的細胞,作為血管來源祖細胞,在血管修復中起到關鍵作用[6]。研究發現,內皮損傷后 EPCs 能在缺血或梗死區域產生新生血管,并充當細胞循環池中一員替代功能異常的內皮細胞[7]。此外,缺血性腦卒中患者循環中的 EPCs 增加與腦卒中預后密切相關,進一步提示了 EPCs 促血管新生作用及其在脊髓損傷修復中的潛在能力[8]。
研究報道干細胞介導的血管新生及組織再生可能是通過旁分泌作用實現,其中小細胞外囊泡(small extracellular vesicles,sEVs)發揮了重要的橋接作用[9]。sEVs 是一類由細胞分泌且直徑<200 nm 的脂質雙層膜囊泡,它能夠選擇性包裹蛋白質、脂質、生長因子及編碼和非編碼 RNA 等多種生物活性物質,參與細胞間交流。由于本身體積較小,攜帶宿主抗原較少,并且不攜帶大量基因組 DNA,所以相比干細胞,sEVs 更適合用于臨床治療[10]。EPCs-sEVs 作為溝通血管內皮細胞與 EPCs 之間的重要橋梁,在促進內皮細胞新生中具有重要作用。目前 EPCs-sEVs 多用于心血管系統相關疾病治療中,罕見用于脊髓損傷的治療。為此,本研究將 EPCs-sEVs 用于干預脊髓損傷小鼠,明確其治療脊髓損傷的療效,初步探索治療可能機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
4 周齡 SPF 級 C57BL/6 雄性小鼠 20 只,體質量 15~20 g,用于 EPCs 的提取。10 周齡 SPF 級 C57BL/6 雌性小鼠 43 只,體質量 30~35 g,用于脊髓損傷模型制備。實驗動物均由上海交通大學附屬第六人民醫院提供。
EPCs 培養基(Lonza 公司,瑞士);纖維連接蛋白、Dil 標記的乙酰化低密度脂蛋白(Dil labeled acetylated low density lipoprotein,Dil-AcLDL;北京索萊寶生物技術有限公司);FITC 標記的凝集素 1(FITC labeled Ulex europaeus agglutinin 1,FITC-UEA-1;Sigma 公司,美國);CD133、CD34 及 VEGF 受體 2(VEGF receptor 2,VEGFR2)流式抗體(Biolengend 公司,美國);FBS、雙抗、EDTA-胰蛋白酶(GIBCO 公司,美國);CD31、CD9、CD63 及 gm130 抗體(Abcam 公司,英國)。
微量注射器(Hamilton 公司,美國);激光共聚焦顯微鏡、倒置相差顯微鏡(Leica 公司,德國);超速離心管、超速離心機(Beckman 公司,美國);Western 電泳系統(Bio-Rad 公司,美國);納米流式檢測儀(廈門福流生物科技有限公司);透射電鏡(JEOL 公司,日本);流式檢測儀(BD 公司,美國);活體成像儀(上海天能科技有限公司);電子 Von Frey 測痛儀(Bioseb 公司,法國);Image J 軟件(美國國立衛生研究院)。
1.2 EPCs 分離培養及鑒定
1.2.1 EPCs 分離培養
根據文獻[11]報道方案分離培養小鼠 EPCs。將 20 只小鼠給予過量麻醉藥物處死,置于 75% 乙醇中浸泡 30 min 后,取股骨及脛骨并清除周圍組織肌肉;使用針筒在 EPCs 完全培養基中沖洗骨髓腔 10 次,收集沖洗液;以 300×g 離心 5 min,棄上清,使用 EPCs 培養基重懸,并將細胞接種于已預鋪纖維連接蛋白的培養皿中,置于 37℃、5%CO2 培養箱中培養。培養 3 d 后取出培養皿,使用 PBS 沖洗未貼壁細胞及紅細胞碎片,加入新的 EPCs 完全培養基,置于培養箱中繼續培養 7~10 d,倒置相差顯微鏡下觀察細胞形態;待細胞融合達 80% 時進行傳代。
1.2.2 EPCs 鑒定
參照文獻[12]方法對 EPCs 進行鑒定。① 流式細胞術:取 P2 代貼壁 EPCs,以 0.25% EDTA-胰蛋白酶消化后制備成細胞懸液;使用 CD133、CD34 及 VEGFR2 流式抗體孵育 20 min,PBS 清洗 3 次,納米流式檢測儀檢測。② 雙熒光染色觀察:取 P2 代 EPCs,按照 1∶3 細胞傳代比例接種至帶有細胞爬片的 24 孔板中;待培養 24 h 細胞貼壁后,Dil-AcLDL 避光孵育 4 h,PBST 清洗孔板 3 次,4% 多聚甲醛固定 15 min,FITC-UEA-1 孵育 1 h,DAPI 孵育 5 min,PBST 清洗孔板 3 次,取細胞爬片于激光共聚焦顯微鏡觀察,Dil-AcLDL 呈紅色熒光染色,FITC-UEA-1 呈綠色熒光染色,DAPI 呈藍色熒光染色。
1.3 EPCs-sEVs 的提取與鑒定
1.3.1 EPCs-sEVs 的提取及標記
EPCs 培養至 P4 代,期間收集 P2~P4 代培養上清。將細胞上清置于離心管中,以 300×g 離心 10 min、2 000×g 離心 30 min、10 000×g 離心 30 min,棄沉淀。將上清轉移至超速離心管中,以 100 000×g 離心 70 min,棄上清,加入 PBS 重懸;再次以 100 000×g 離心 70 min,棄上清,PBS 重懸后底部沉淀即為 EPCs-sEVs。
取部分 EPCs-sEVs 室溫下使用 DiR 標記,加入 PBS 重懸,以 100 000×g 離心 70 min,棄上清,同上法加入 PBS 重懸并以 100 000×g 離心 70 min,重復 3 次,以清除殘余染液。
1.3.2 EPCs-sEVs 的鑒定
① 透射電鏡觀察 EPCs-sEVs 的形態;② 納米流式檢測儀檢測 EPCs-sEVs 的粒徑分布及濃度;③ 將 EPCs-sEVs 以及 EPCs 使用 RIAP 裂解后,使用 4×Loading buffer 進行稀釋,提取蛋白行 Western blot 檢測(CD9、CD63 及 gm130),以確定 EPCs-sECs 的表面標志物。
1.4 實驗分組及方法
取 40 只雌性小鼠隨機分為 4 組,分別為假手術組、模型組、低濃度干預組及高濃度干預組,每組 10 只。
各組小鼠經吸入異氟烷麻醉后,作背部正中切口,去除 T10 椎板,暴露脊髓;假手術組直接關閉切口,其余各組制備脊髓損傷模型。具體方法:采用改良 Allen 脊髓損傷打擊器,按照高度 1 cm、打擊棒質量 10 g 的打擊條件對脊髓組織進行打擊。打擊后小鼠雙下肢出現抽動并甩尾,麻醉蘇醒后小鼠雙下肢癱瘓,打擊位點出現暗紅色血液提示模型制備成功[13]。
模型制備后,模型組不作其他處理,低、高濃度干預組分別于模型制備后 30 min、3 d 及 7 d 經尾靜脈對應注射濃度為 1×109、1×1010 個/mL 的 EPCs-sEVs,每只注射 50 μL。術后小鼠每日人工排便、排尿直至恢復自主排便、排尿反射。
1.5 觀測指標
1.5.1 小鼠脊髓活體成像觀察
取 3 只雌性小鼠參照 1.4 方法制備脊髓損傷模型后,于尾靜脈注射 DiR 標記的 EPCs-sEVs,30 min 后給予過量麻醉藥物處死后,按照原切口入路,取出胸段脊柱,切取包括損傷部位上、下 0.5 cm 范圍的脊髓組織,置于活體成像儀中觀察損傷部位熒光信號,以觀察注射的 EPCs-sEVs 是否到達脊髓損傷部位。
1.5.2 小鼠行為學檢測
① BMS 評分:術后 1、3 d 及 1、2、3、4 周觀察各組小鼠后肢運動功能恢復情況,根據 BMS 評分量表[13]進行評分,0 分表示完全癱瘓,9 分表示完全正常。② 斜板實驗:術后 1、2、3、4 周將小鼠放置于自制斜板上,記錄其在斜板上能夠停留至少 5 s 的最大角度。③ Von Frey 實驗:術后 4 周采用電子 Von Frey 測痛儀測量機械痛閾值。將傳感器尖端對準小鼠足底中央區,逐漸增加針刺強度,小鼠出現縮足、甩腿、舔舐及抬腿等疼痛相關行為反應記為陽性反應,出現 3 次陽性反應的最低刺激強度(g)即為小鼠機械痛閾值。
1.5.3 組織學觀察
① HE 染色:術后 4 周行為學檢測后,給予過量麻醉藥物處死全部小鼠,切取包括損傷部位上、下 0.5 cm 范圍的脊髓組織。大體觀察組織損傷情況后,以蔗糖密度梯度脫水,取部分脊髓組織冰凍切片,片厚 5 μm,常規 HE 染色,倒置相差顯微鏡下觀察。
② 免疫組織化學染色:取部分脊髓組織冰凍切片,片厚 25 μm,置于 0.01%Triton 破膜,牛血清白蛋白封閉,一抗 CD31(1∶200)孵育過夜后,滴加辣根過氧化物酶標記二抗孵育,DAB 顯色,蘇木素染核,封片,倒置相差顯微鏡下觀察。使用 Image J 軟件測量積分吸光度(IA)值,每組選擇至少 3 個視野進行統計分析。
1.6 統計學方法
采用 SPSS26.0 及 Prism8.0 軟件進行統計分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 Tukey 檢驗;檢驗水準 α=0.05。
2 結果
2.1 EPCs 分離培養及鑒定
培養 7 d 后倒置相差顯微鏡下可見 EPCs 呈鋪路石樣排列生長于培養皿中,傳代后細胞形態與傳代前一致。流式細胞術檢測顯示,CD133、CD34 及 VEGFR2 陽性細胞分別占 99.3%、99.1%、93.9%。Dil-AcLDL 及 FITC-UEA-1 雙熒光染色觀察示,細胞具有吞噬 Dil-AcLDL 能力且能被 FITC-UEA-1 結合。經鑒定,分離培養細胞為 EPCs。見圖 1。
 圖1
EPCs 細胞形態觀察及鑒定
圖1
EPCs 細胞形態觀察及鑒定
a. 培養 7 d 細胞形態(倒置相差顯微鏡×100);b. P2 代細胞形態(倒置相差顯微鏡×100);c. Dil-Ac-LDL 和 FITC-UEA-1 雙熒光染色觀察(激光共聚焦顯微鏡×400);d. 流式細胞術鑒定
Figure1. Cell morphology observation and identification of EPCsa. Cell morphology after 7 days of culture (Inverted phase contrast microscope×100); b. The morphology of the P2 generation cells (Inverted phase contrast microscope×100); c. Double fluorescence staining of Dil-Ac-LDL and FITC-UEA-1 (Laser scanning confocal microscope×400); d. Flow cytometry identification
2.2 EPCs-sEVs 的鑒定
透射電鏡觀察見 EPCs-sEVs 具有典型的脂質雙分子層結構,呈杯狀,大小介于 30~150 nm。納米流式檢測儀檢測示 EPCs-sEVs 粒徑均<200 nm,多數介于 30~150 nm;濃度在 5×109~1×1010 個/mL 范圍內波動。Western blot 檢測顯示 EPCs-sEVs CD9 及 CD63 表達陽性、gm130 表達陰性,EPCs CD9、CD63 及 gm130 表達均為陽性。上述鑒定結果提示成功提取 EPCs-sEVs。見圖 2。
 圖2
EPCs-sEVs 的鑒定
圖2
EPCs-sEVs 的鑒定
a. 透射電鏡觀察(×67 k);b. 納米流式檢測儀檢測 EPCs-sEVs 粒徑分布;c. Western blot 檢測 1:EPCs 2:EPCs-sEVs
Figure2. The identification of EPCs-sEVsa. Transmission electron microscope observation (×67 k); b. Nanoflow cytometry detection of EPCs-sEVs particle size distribution; c. Western blot detection 1: EPCs 2: EPCs-sEVs
2.3 動物實驗觀察
2.3.1 小鼠脊髓活體成像觀察
活體成像儀觀察顯示 DiR 標記的 EPCs-sEVs 在注射后 30 min 內募集至脊髓損傷區域。見圖 3。
 圖3
活體成像儀觀察
圖3
活體成像儀觀察
箭頭示 EPCs-sEVs 募集至脊髓損傷部位
Figure3. In vivo imaging of the spinal cordArrow indicated the recruitment of EPCs-sEVs to the spinal cord injury site
2.3.2 小鼠行為學檢測
① BMS 評分:各時間點,假手術組 BMS 評分均明顯高于其他組,差異有統計學意義(P<0.05)。術后 1、3 d 及 1 周,兩干預組 BMS 評分與模型組比較差異均無統計學意義(P>0.05);2、3、4 周明顯高于模型組,差異有統計學意義(P<0.05)。各時間點兩干預組間差異均無統計學意義(P>0.05)。兩干預組及模型組小鼠術后 2 周后 BMS 評分進入平臺期。見圖 4。
 圖4
術后各時間點各組小鼠 BMS 評分
Figure4.
BMS score of each group at each time point
圖4
術后各時間點各組小鼠 BMS 評分
Figure4.
BMS score of each group at each time point
② 斜板實驗:各時間點,假手術組最大角度均明顯大于其他組,差異有統計學意義(P<0.05)。術后 1 周,兩干預組最大角度與模型組比較差異均無統計學意義(P>0.05);2、3、4 周明顯大于模型組,差異有統計學意義(P<0.05)。各時間點,兩干預組間差異均無統計學意義(P>0.05)。見表 1。
 ,°)
Table1.
The maxium angles of inclined plant test at different time points (n=5,
,°)
Table1.
The maxium angles of inclined plant test at different time points (n=5,  , °)
, °)
③ Von Frey 實驗:術后 4 周,假手術組、模型組以及低、高濃度干預組小鼠機械痛閾值分別為 1.00±0.06、0.16±0.04、0.33±0.06、0.34±0.05。兩干預組機械痛閾值明顯高于模型組、低于假手術組,差異均有統計學意義(P<0.05),但兩干預組間比較差異無統計學意義(P>0.05)。
2.4 組織學觀察
2.4.1 HE 染色
術后 4 周取材時可見模型組損傷節段脊髓組織缺損明顯大于兩干預組,兩干預組大體觀察無明顯差異(圖 5)。HE 染色鏡下觀察,假手術組為正常脊髓組織結構;模型組可見大量組織壞死、單個核細胞浸潤,組織形態結構紊亂;兩干預組損傷脊髓組織壞死程度明顯輕于模型組,單個核細胞浸潤明顯減少,兩干預組間無明顯差異。見圖 6。
 圖5
術后 4 周各組脊髓組織大體觀察
圖5
術后 4 周各組脊髓組織大體觀察
1~4 分別為假手術組、模型組、低濃度干預組、高濃度干預組
Figure5. The gross observation of spinal cord tissue in each group at 4 weeks after operation1-4 for the sham group, model group, low concentration intervention group, and high concentration intervention group, respectively
 圖6
術后 4 周各組 HE 染色觀察(倒置相差顯微鏡×100)
圖6
術后 4 周各組 HE 染色觀察(倒置相差顯微鏡×100)
a. 假手術組;b. 模型組;c. 低濃度干預組;d. 高濃度干預組
Figure6. HE staining of each group at 4 weeks after operation (Inverted phase contrast microscope×100)a. Sham group; b. Model group; c. Low concentration intervention group; d. High concentration intervention group
2.4.2 免疫組織化學染色
鏡下觀察見假手術組血管分布規則;兩干預組 CD31 血管染色較模型組更深,兩干預組間無明顯差異。見圖 7。定量分析顯示假手術組、模型組以及低、高濃度干預組 IA 值分別為 1.00±0.19、0.04±0.03、0.45±0.18、0.45±0.13。兩干預組 IA 值明顯高于模型組、低于假手術組,差異均有統計學意義(P<0.05),但兩干預組間比較差異無統計學意義(P>0.05)。
 圖7
術后 4 周各組免疫組織化學染色觀察(倒置相差顯微鏡×200)
圖7
術后 4 周各組免疫組織化學染色觀察(倒置相差顯微鏡×200)
箭頭示新生血管 a. 假手術組;b. 模型組;c. 低濃度干預組;d. 高濃度干預組
Figure7. Immunohistochemical staining of each group at 4 weeks after operation (Inverted phase contrast microscope×200)Arrows showed the neovascularization a. Sham group; b. Model group; c. Low concentration intervention group; d. High concentration intervention group
3 討論
研究表明,干細胞用作移植物治療脊髓損傷時,能夠通過分泌生長因子、調節免疫反應,促進神經環路重建及使脫髓鞘神經再髓鞘化等途徑,促進損傷神經再生[14]。目前多選擇移植 MSCs 及神經干細胞,獲得了一定治療效果。但干細胞治療脊髓損傷存在安全性較低、免疫排斥反應、存儲條件嚴格、獲取來源有限等問題,在一定程度上限制了其臨床轉化[15]。而干細胞來源的 sEVs 由于不存在干細胞移植中所面臨的免疫排斥反應等問題,顯示出較好的臨床轉化前景,目前已在多種組織修復治療中獲得較好效果[16]。
目前,sEVs 用于中樞神經系統損傷的治療研究已較多。研究顯示 sEVs 可能通過以下 3 種機制促進中樞神經系統損傷修復。① 在創傷性中樞神經系統損傷模型中使用 sEVs 治療后,循環中的中性粒細胞及單核細胞減少,提示 sEVs 可能通過緩解炎癥反應促進中樞神經組織修復[16]。② Zhang 等[17]的研究使用來源于 MSCs 的 sEVs 干預創傷性腦損傷模型,發現損傷部位血管密度增加,提示 sEVs 可通過促進血管新生,進而促進中樞神經組織修復。③ sEVs 可直接刺激神經軸突的再生來促進中樞神經組織修復[16]。
本研究發現 EPCs-sEVs 能促進脊髓損傷后功能恢復,術后 1 周內兩干預組小鼠后肢功能與模型組無明顯差異,但 2 周后小鼠后肢運動功能及感覺評價明顯高于模型組;術后 4 周,組織學觀察顯示兩干預組組織學結構恢復程度亦優于模型組,且免疫組織化學染色示新生血管更多。上述研究結果提示 EPCs-sEVs 可促進小鼠脊髓損傷的修復,作用機制可能是通過促進脊髓損傷部位血管新生而實現。目前已有諸多研究證據支持 EPCs-sEVs 在血管新生方面有著與 EPCs 相同的效果[18-20]。Li 等[21]研究證實 EPCs-sEVs 可通過增加血管生成相關分子的表達來促進血管內皮修復。此外,研究還認為 EPCs-sEVs 可通過向周圍靶細胞傳遞 miRNA-214,促進內皮細胞的增殖及分化,減少內皮細胞衰老,從而促進血管新生[22]。早期血管損傷后,局部殘存的神經元缺血、缺氧,導致局部組織出現二次損傷[23]。此外,血管新生還能為神經生長鋪設一條快速通道,便于神經軸突再生,因此促進脊髓損傷部位血管新生具有重要意義[24]。
目前,EPCs-sEVs 中促進脊髓損傷部位血管新生的有效成分尚未明確,有待后續深入研究,以期發現有效的促進血管新生的分子或 miRNA,進而通過人工制作脂質體包裹有效分子或 miRNA 達到直接替代 sEVs 促進脊髓損傷部位血管新生的目的。此外,本研究僅以小鼠作為研究模型,后續還需進一步在大型動物水平驗證 EPCs-sEVs 在治療脊髓損傷中的作用,以期為臨床轉化提供臨床前研究證據。
志謝:上海交通大學附屬第六人民醫院四肢顯微外科研究所。
作者貢獻:林俊卿參與研究設計和實施,數據收集及撰寫文章;黃騰立參與研究實施及數據收集;高濤參與文章撰寫并作批評性審閱;鄭憲友參與研究設計及對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究及文章撰寫過程中不存在利益沖突。基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計學分析及其報道。
機構倫理問題:研究方案經上海交通大學附屬第六人民醫院醫學倫理委員會批準(DWSY2020-0605)。動物實驗程序及開展方案符合動物使用及管理委員會規定。實驗動物使用許可證號:SYXK(滬)2016-0020。