引用本文: 王志坤, 張賢森, 李再學, 馮慶裕, 陳建庭, 謝文偉. 聚甲基丙烯酸甲酯骨水泥與同種異體骨混合強化羊椎體的生物力學研究. 中國修復重建外科雜志, 2021, 35(4): 471-476. doi: 10.7507/1002-1892.202011061 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
經皮椎體成形術已成為臨床治療骨質疏松性椎體壓縮骨折的常用手術方法[1],術中常用聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥填充,其為液態甲基丙烯酸甲酯(methacrylate,MMA)單體和粉末狀 MMA 聚合物組成的丙烯酸聚合物[2],術后可以提供脊柱機械穩定性[3]。但 PMMA 骨水泥具有生物學惰性,不適合骨骼生長,導致與局部骨骼間的相互作用較差[4]。為了提高 PMMA 骨水泥的生物活性,學者們將各種活性成分(如二氧化鈦、二氧化硅、磷酸三鈣、羥基磷灰石、生物陶瓷、生物活性硅酸鈣顆粒)摻入骨水泥中[5-12]。研究顯示活性成分的加入可以減少聚合過程中產生的熱量,促進骨水泥與骨組織之間鈣磷沉積過渡層的形成,并使 PMMA 骨水泥具有一定生物活性[13]。
同種異體骨主要成分為無機骨礦物,完全保留了天然骨組織的三維網架結構,具有良好的細胞相容性及骨傳導作用,植入人體后骨細胞可黏附生長,并最終完成爬行替代。本課題組前期體外研究發現 PMMA 骨水泥與同種異體骨組成的骨替代物可促進成骨細胞活力、黏附和分化[14]。本次研究將 PMMA 骨水泥和同種異體骨以 1∶1 比例混合后,填充強化羊骨質疏松性壓縮骨折椎體,比較強化前后椎體力學性能,探討其應用于臨床治療骨質疏松性椎體壓縮骨折的可行性。
1 材料與方法
1.1 主要試劑及儀器
PMMA 骨水泥(天津市合成材料工業研究所);Bio-Gene 同種異體骨(北京大清生物技術股份有限公司),骨粉直徑 0.25~1.00 mm;牙托粉(廣州市石膏制品廠)。
X 線機(北京航天中興醫療系統有限公司);C 臂 X 線機(通用公司,美國);Micro-CT(SCANCO MEDICAL 公司,瑞士);XR-36 型雙能 X 射線吸收儀(Lunar 公司,美國);SW10 電子式萬能試驗機(濟南恒瑞金試驗機廠);電子秤(上海英展機電企業有限公司);Graphpad prism 7 軟件(Graphpad 公司,美國)。
1.2 實驗方法
1.2.1 標本處理及分組
取 15 只市售新鮮成年山羊腰椎(L1~L5),剝離周圍肌肉、韌帶和骨膜以及椎間盤組織、軟骨終板,僅完整保留骨性終板,分離成單個椎體,注意保留椎體后部。經大體及 X 線透視觀察無明顯骨缺損、病變與畸形,共獲得 75 個椎體。修剪部分橫突和棘突尖端,以便于測試。
由于羊 L1~L3 椎體大小接近及 L4、L5 椎體大小接近,根據配對設計,將 L1~L3 椎體配對,L4、L5 椎體配對后,隨機分為同種異體骨組(A 組)、PMMA 骨水泥組(B 組)、PMMA 骨水泥與同種異體骨混合物組(C 組),每組 25 個椎體。
1.2.2 骨質疏松椎體模型制備及觀測
① 脫鈣處理:參照文獻[15]脫鈣方法進行處理。取 3 組椎體,用錐子分別于兩側橫突和小關節中線交界處鉆入椎弓根后,改用直徑為 4 mm 的鈍尖椎弓根探針沿此孔伸入椎體達 40 mm 深。將每個椎骨單獨置于 500 mL 鹽酸脫鈣溶液中,溶液溫度 20~22℃。首先,將 1 個塑料錐形接頭插入一側椎弓根上的孔,連接 1 根 60 cm 塑料管,推注 50 mL 脫鈣劑后,改用控制注射器式輸液泵輸注 480~500 mL 脫鈣劑,輸注速度為 40 mL/h,脫鈣時間 12 h。然后,于另一側椎弓根同法脫鈣 12 h。單個椎體共脫鈣時間 24 h。最后取出椎體用自來水沖洗椎骨,生理鹽水沖洗椎弓根孔。
② 觀測指標:脫鈣前將 3 組椎體置于恒溫干燥箱,105℃ 干燥 l h 后采用電子秤稱重(干重);然后將椎體放入盛有 50 mL 生理鹽水的 100 mL 量杯中,計算放入椎體前后體積差值,即為椎體體積。最后,用雙能 X 射線吸收儀測量骨密度。脫鈣后,同上法再次測量椎體質量及骨密度,按照以下公式計算骨密度下降比:(脫鈣前骨密度-脫鈣后骨密度)/脫鈣前骨密度×100%。
1.2.3 椎體強化模型制備及生物力學測試
脫鈣后 3 組椎體用牙托粉固定,置于力學試驗儀平行金屬板上,調整高度使椎體上、下兩個面與模具貼合,以 1 mm/min 加載速度預加載 100 N,以消除標本松弛或蠕變的影響,并使椎體充分固定于模具中,以免滑脫掉落影響測定結果。然后采用 5 mm/min 加載速度垂直軸向加壓,加載力精確度為 0.01 N,位移精確度為 0.01 mm,記錄載荷、位移數據;加載期間嚴密觀察椎體變化,持續加載至椎體發生壓縮骨折。整個過程保持室溫恒定,并使用注射器向椎體上噴灑生理鹽水保持濕潤。
3 組椎體骨折后,采用椎體成形穿刺針通過兩側椎弓根上的孔穿刺至椎體中央處(圖 1),C 臂 X 線機透視確認穿刺針位于椎體中央后,插入工作通道,A 組椎體注射 3 mL 同種異體骨并壓實;B 組注射 3 mL 常溫下調制并呈拉絲狀的 PMMA 骨水泥;C 組將 1.5 mL 常溫下調制的 PMMA 骨水泥以及 1.5 mL 同種異體骨攪拌混合,待呈拉絲狀時注射;透視監控下確保填充物無滲漏。注射后將 3 組椎體行 CT 掃描,觀察填充物分布情況。然后同上法持續加載至椎體發生骨折。采用 Graphpad prism 7 軟件繪制骨折前以及強化后載荷-位移曲線,計算失效強度及剛度,以發生骨折時位移值作為失效位移。
 圖1
穿刺針經雙側椎弓根插入骨質疏松椎體模型
Figure1.
The puncture needle was inserted into the osteoporotic vertebral body model through bilateral pedicles
圖1
穿刺針經雙側椎弓根插入骨質疏松椎體模型
Figure1.
The puncture needle was inserted into the osteoporotic vertebral body model through bilateral pedicles
1.3 統計學方法
采用 SPSS23.0 統計軟件進行分析。數據以均數±標準差表示,組內脫鈣處理前后比較采用配對 t 檢驗;組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;檢驗水準 α=0.05。
2 結果
2.1 骨質疏松椎體模型觀測
各組椎體脫鈣前質量、骨密度及體積比較,差異均無統計學意義(P>0.05);脫鈣后椎體骨密度及下降比、質量比較,差異亦無統計學意義(P>0.05)。3 組脫鈣前后椎體質量以及骨密度比較,差異均有統計學意義(P<0.05)。見表 1。
 )
Table1.
Comparison of bone density, weight, and volume between groups (n=25,
)
Table1.
Comparison of bone density, weight, and volume between groups (n=25,  )
)
2.2 生物力學測試
CT 示各組填充物在椎體內彌散均勻,均無滲漏表現(圖 2)。骨折前,3 組椎體失效強度、失效位移及剛度比較,差異均無統計學意義(P>0.05);經強化處理后,A 組失效位移明顯大于 B、C 組,失效強度及剛度小于 B、C 組;C 組失效位移大于 B 組,失效強度及剛度小于 B 組;組間比較差異均有統計學意義(P<0.05)。見表 2。
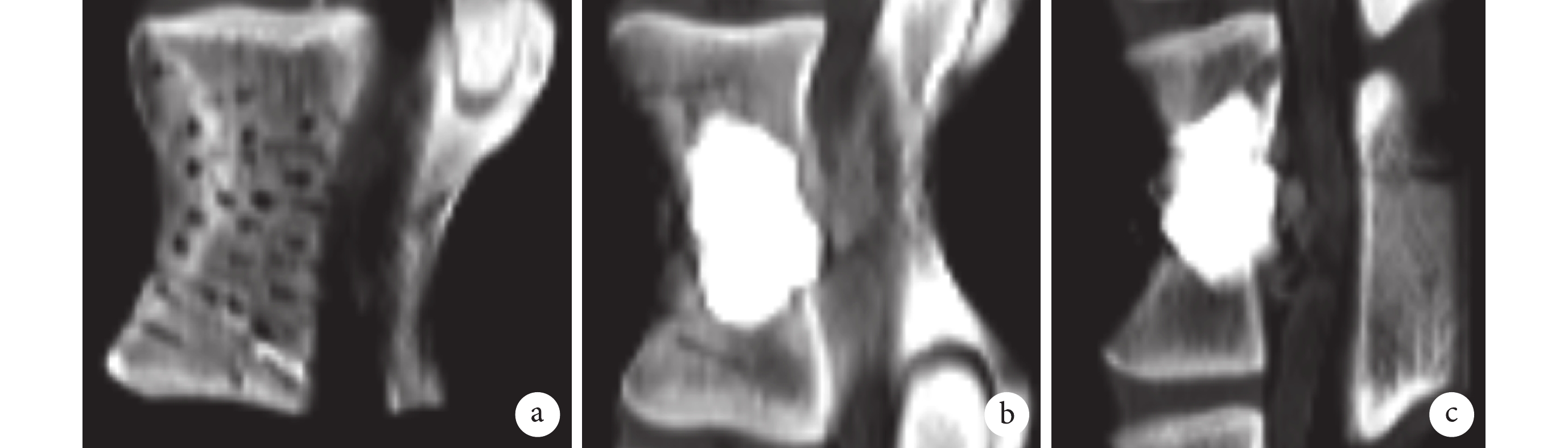
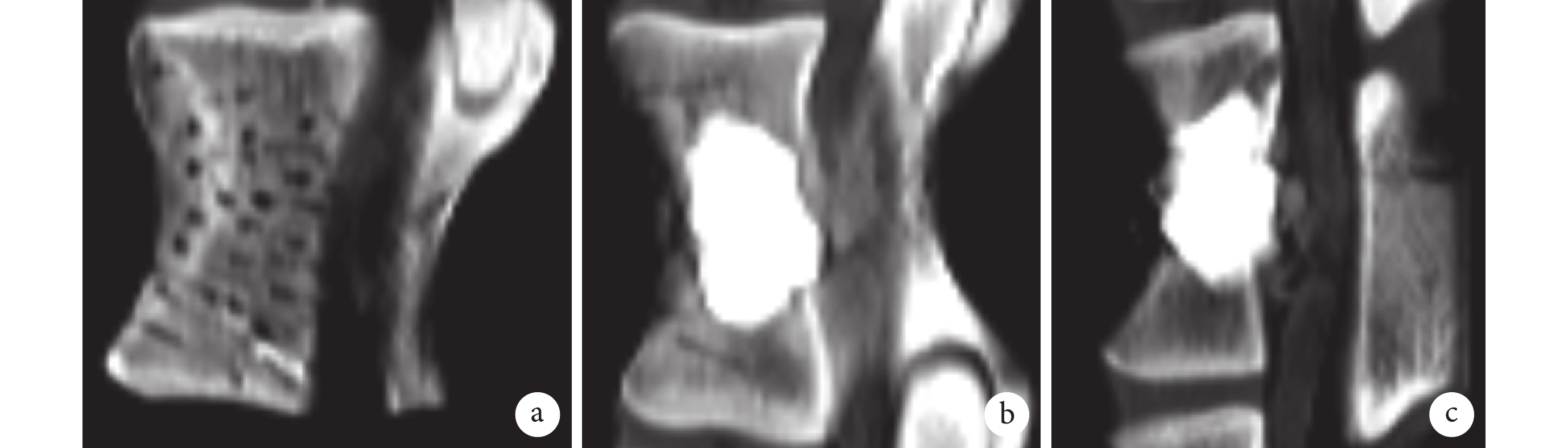 圖2
CT 觀察各組椎體中填充物分布
圖2
CT 觀察各組椎體中填充物分布
a. A 組;b. B 組;c. C 組
Figure2. CT observation of the implant distribution in the vertebral bodya. Group A; b. Group B; c. Group C
除 A 組失效強度骨折前與強化后差異無統計學意義(P>0.05)外,其余各組組內骨折前與強化后的失效強度、失效位移以及剛度比較,差異均有統計學意義(P<0.05)。經強化處理后,A、B、C 組失效強度分別達骨折前的 101%±4%、250%±11%、150%±5%,剛度達骨折前的 50%±4%、400%±12%、130%±5%,失效位移達骨折前的 139%±12%、50%±4%、94%±3%。見表 2。
 )
Table2.
Comparison of failure strength, failure displacement, and stiffness of vertebral bodies in each group (n=25,
)
Table2.
Comparison of failure strength, failure displacement, and stiffness of vertebral bodies in each group (n=25,  )
)
3 討論
在前期研究基礎上,本次研究擬通過羊椎體骨質疏松性椎體壓縮骨折模型探討 PMMA 骨水泥及同種異體骨混合物的強化效果。首先,我們參照文獻 [15] 方法建立了一個可重復的脫鈣椎體模型,椎體脫鈣后骨密度下降達 35% 左右,骨密度約為 0.70 g/cm2。研究表明當脊柱骨密度低于 0.75 g/cm2 時可確定為骨質疏松癥[16],提示本研究成功建立了羊骨質疏松椎體模型。本研究采用的脫鈣方案是用輸液泵通過椎弓根孔灌注酸溶液,大大縮短了脫鈣時間,提高了脫鈣成功率。
失效強度和剛度是椎體生物力學重要評價指標,其中失效強度反映椎體載荷能力,剛度反映軸向載荷下椎體抗變形能力。因此,本研究生物力學測試選擇上述兩指標來評估強化處理前后椎體的生物力學性能。結果表明,A 組經同種異體骨強化處理后椎體失效強度及剛度分別達骨折前 101%±4%、50%±4%,與尹知訓等[17]報道的經椎弓根椎體內植骨能恢復椎體最大抗壓強度,但剛度恢復較差的結果一致。故我們認為對于椎體壓縮性骨折經椎弓根植入同種異體骨后早期不宜負重,否則失去了椎體強化后早起下床活動的優點。
研究表明,脊柱載荷傳遞機制與椎體結構剛度有關[18]。因此,在獲得最大強度的同時,應盡量減少骨水泥強化對椎體剛度的影響。一些學者認為椎體成形術后椎體剛度較小能減輕相鄰椎體的退行性變[19]。本研究結果表明 B 組失效強度是骨折前的 250%±11%、剛度達骨折前 400%±12%,術后椎體剛度明顯升高,出現應力集中現象,容易導致鄰椎骨折[20]。文獻報道,經皮椎體成形術后 1 年新發骨折發生率為 5%~22%,術后 4 年為 17.2%~52%[21-23]。而鄰近椎體再骨折是臨床許多經皮椎體成形術后患者再次就醫的主要原因。
因此,調整 PMMA 骨水泥硬度,使其與人椎體松質骨硬度相匹配,有望降低經皮椎體成形術后鄰近椎體骨折風險[24]。Gutiérrez-Mejía 等[25]報道在標準骨水泥配方中加入 20wt% 丙烯酸丁酯/PMMA 納米顆粒后,骨水泥硬度降低 31%。Boger 等[26-27]通過添加透明質酸鈉和羥丙基甲基纖維素水溶液的方法,使制備的多孔 PMMA 骨水泥彈性模量明顯降低。Robo 等[28]通過加入亞油酸降低彈性模量來優化 PMMA 骨水泥硬度,使其更接近松質骨力學性能,而且亞油酸不會影響 PMMA 骨水泥在綿羊模型中的生物相容性。
本研究生物力學測試顯示,C 組椎體經 PMMA 骨水泥與同種異體骨混合物強化處理后,椎體失效強度及剛度小于 PMMA 骨水泥強化的 B 組,但高于同種異體骨強化的 A 組;而失效位移小于 A 組、大于 B 組;差異均有統計學意義。結果表明 3 種填充物中,PMMA 骨水泥與同種異體骨混合物既能恢復椎體失效強度,也能恢復椎體剛度,能滿足椎體填充材料的生物力學性能要求,可作為經皮椎體成形術中填充材料的選擇之一。
作者貢獻:王志坤負責實驗設計及實施、數據收集整理及統計分析、文章撰寫;張賢森、馮慶裕參與實驗設計及實施、協助數據收集整理;李再學協助數據收集整理;謝文偉、陳建庭指導實驗設計、實施及文章撰寫,對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經東莞市松山湖中心醫院 南方醫科大學附屬東莞石龍人民醫院醫學倫理委員會批準。
經皮椎體成形術已成為臨床治療骨質疏松性椎體壓縮骨折的常用手術方法[1],術中常用聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥填充,其為液態甲基丙烯酸甲酯(methacrylate,MMA)單體和粉末狀 MMA 聚合物組成的丙烯酸聚合物[2],術后可以提供脊柱機械穩定性[3]。但 PMMA 骨水泥具有生物學惰性,不適合骨骼生長,導致與局部骨骼間的相互作用較差[4]。為了提高 PMMA 骨水泥的生物活性,學者們將各種活性成分(如二氧化鈦、二氧化硅、磷酸三鈣、羥基磷灰石、生物陶瓷、生物活性硅酸鈣顆粒)摻入骨水泥中[5-12]。研究顯示活性成分的加入可以減少聚合過程中產生的熱量,促進骨水泥與骨組織之間鈣磷沉積過渡層的形成,并使 PMMA 骨水泥具有一定生物活性[13]。
同種異體骨主要成分為無機骨礦物,完全保留了天然骨組織的三維網架結構,具有良好的細胞相容性及骨傳導作用,植入人體后骨細胞可黏附生長,并最終完成爬行替代。本課題組前期體外研究發現 PMMA 骨水泥與同種異體骨組成的骨替代物可促進成骨細胞活力、黏附和分化[14]。本次研究將 PMMA 骨水泥和同種異體骨以 1∶1 比例混合后,填充強化羊骨質疏松性壓縮骨折椎體,比較強化前后椎體力學性能,探討其應用于臨床治療骨質疏松性椎體壓縮骨折的可行性。
1 材料與方法
1.1 主要試劑及儀器
PMMA 骨水泥(天津市合成材料工業研究所);Bio-Gene 同種異體骨(北京大清生物技術股份有限公司),骨粉直徑 0.25~1.00 mm;牙托粉(廣州市石膏制品廠)。
X 線機(北京航天中興醫療系統有限公司);C 臂 X 線機(通用公司,美國);Micro-CT(SCANCO MEDICAL 公司,瑞士);XR-36 型雙能 X 射線吸收儀(Lunar 公司,美國);SW10 電子式萬能試驗機(濟南恒瑞金試驗機廠);電子秤(上海英展機電企業有限公司);Graphpad prism 7 軟件(Graphpad 公司,美國)。
1.2 實驗方法
1.2.1 標本處理及分組
取 15 只市售新鮮成年山羊腰椎(L1~L5),剝離周圍肌肉、韌帶和骨膜以及椎間盤組織、軟骨終板,僅完整保留骨性終板,分離成單個椎體,注意保留椎體后部。經大體及 X 線透視觀察無明顯骨缺損、病變與畸形,共獲得 75 個椎體。修剪部分橫突和棘突尖端,以便于測試。
由于羊 L1~L3 椎體大小接近及 L4、L5 椎體大小接近,根據配對設計,將 L1~L3 椎體配對,L4、L5 椎體配對后,隨機分為同種異體骨組(A 組)、PMMA 骨水泥組(B 組)、PMMA 骨水泥與同種異體骨混合物組(C 組),每組 25 個椎體。
1.2.2 骨質疏松椎體模型制備及觀測
① 脫鈣處理:參照文獻[15]脫鈣方法進行處理。取 3 組椎體,用錐子分別于兩側橫突和小關節中線交界處鉆入椎弓根后,改用直徑為 4 mm 的鈍尖椎弓根探針沿此孔伸入椎體達 40 mm 深。將每個椎骨單獨置于 500 mL 鹽酸脫鈣溶液中,溶液溫度 20~22℃。首先,將 1 個塑料錐形接頭插入一側椎弓根上的孔,連接 1 根 60 cm 塑料管,推注 50 mL 脫鈣劑后,改用控制注射器式輸液泵輸注 480~500 mL 脫鈣劑,輸注速度為 40 mL/h,脫鈣時間 12 h。然后,于另一側椎弓根同法脫鈣 12 h。單個椎體共脫鈣時間 24 h。最后取出椎體用自來水沖洗椎骨,生理鹽水沖洗椎弓根孔。
② 觀測指標:脫鈣前將 3 組椎體置于恒溫干燥箱,105℃ 干燥 l h 后采用電子秤稱重(干重);然后將椎體放入盛有 50 mL 生理鹽水的 100 mL 量杯中,計算放入椎體前后體積差值,即為椎體體積。最后,用雙能 X 射線吸收儀測量骨密度。脫鈣后,同上法再次測量椎體質量及骨密度,按照以下公式計算骨密度下降比:(脫鈣前骨密度-脫鈣后骨密度)/脫鈣前骨密度×100%。
1.2.3 椎體強化模型制備及生物力學測試
脫鈣后 3 組椎體用牙托粉固定,置于力學試驗儀平行金屬板上,調整高度使椎體上、下兩個面與模具貼合,以 1 mm/min 加載速度預加載 100 N,以消除標本松弛或蠕變的影響,并使椎體充分固定于模具中,以免滑脫掉落影響測定結果。然后采用 5 mm/min 加載速度垂直軸向加壓,加載力精確度為 0.01 N,位移精確度為 0.01 mm,記錄載荷、位移數據;加載期間嚴密觀察椎體變化,持續加載至椎體發生壓縮骨折。整個過程保持室溫恒定,并使用注射器向椎體上噴灑生理鹽水保持濕潤。
3 組椎體骨折后,采用椎體成形穿刺針通過兩側椎弓根上的孔穿刺至椎體中央處(圖 1),C 臂 X 線機透視確認穿刺針位于椎體中央后,插入工作通道,A 組椎體注射 3 mL 同種異體骨并壓實;B 組注射 3 mL 常溫下調制并呈拉絲狀的 PMMA 骨水泥;C 組將 1.5 mL 常溫下調制的 PMMA 骨水泥以及 1.5 mL 同種異體骨攪拌混合,待呈拉絲狀時注射;透視監控下確保填充物無滲漏。注射后將 3 組椎體行 CT 掃描,觀察填充物分布情況。然后同上法持續加載至椎體發生骨折。采用 Graphpad prism 7 軟件繪制骨折前以及強化后載荷-位移曲線,計算失效強度及剛度,以發生骨折時位移值作為失效位移。
 圖1
穿刺針經雙側椎弓根插入骨質疏松椎體模型
Figure1.
The puncture needle was inserted into the osteoporotic vertebral body model through bilateral pedicles
圖1
穿刺針經雙側椎弓根插入骨質疏松椎體模型
Figure1.
The puncture needle was inserted into the osteoporotic vertebral body model through bilateral pedicles
1.3 統計學方法
采用 SPSS23.0 統計軟件進行分析。數據以均數±標準差表示,組內脫鈣處理前后比較采用配對 t 檢驗;組間比較采用單因素方差分析,兩兩比較采用 SNK 檢驗;檢驗水準 α=0.05。
2 結果
2.1 骨質疏松椎體模型觀測
各組椎體脫鈣前質量、骨密度及體積比較,差異均無統計學意義(P>0.05);脫鈣后椎體骨密度及下降比、質量比較,差異亦無統計學意義(P>0.05)。3 組脫鈣前后椎體質量以及骨密度比較,差異均有統計學意義(P<0.05)。見表 1。
 )
Table1.
Comparison of bone density, weight, and volume between groups (n=25,
)
Table1.
Comparison of bone density, weight, and volume between groups (n=25,  )
)
2.2 生物力學測試
CT 示各組填充物在椎體內彌散均勻,均無滲漏表現(圖 2)。骨折前,3 組椎體失效強度、失效位移及剛度比較,差異均無統計學意義(P>0.05);經強化處理后,A 組失效位移明顯大于 B、C 組,失效強度及剛度小于 B、C 組;C 組失效位移大于 B 組,失效強度及剛度小于 B 組;組間比較差異均有統計學意義(P<0.05)。見表 2。
 圖2
CT 觀察各組椎體中填充物分布
圖2
CT 觀察各組椎體中填充物分布
a. A 組;b. B 組;c. C 組
Figure2. CT observation of the implant distribution in the vertebral bodya. Group A; b. Group B; c. Group C
除 A 組失效強度骨折前與強化后差異無統計學意義(P>0.05)外,其余各組組內骨折前與強化后的失效強度、失效位移以及剛度比較,差異均有統計學意義(P<0.05)。經強化處理后,A、B、C 組失效強度分別達骨折前的 101%±4%、250%±11%、150%±5%,剛度達骨折前的 50%±4%、400%±12%、130%±5%,失效位移達骨折前的 139%±12%、50%±4%、94%±3%。見表 2。
 )
Table2.
Comparison of failure strength, failure displacement, and stiffness of vertebral bodies in each group (n=25,
)
Table2.
Comparison of failure strength, failure displacement, and stiffness of vertebral bodies in each group (n=25,  )
)
3 討論
在前期研究基礎上,本次研究擬通過羊椎體骨質疏松性椎體壓縮骨折模型探討 PMMA 骨水泥及同種異體骨混合物的強化效果。首先,我們參照文獻 [15] 方法建立了一個可重復的脫鈣椎體模型,椎體脫鈣后骨密度下降達 35% 左右,骨密度約為 0.70 g/cm2。研究表明當脊柱骨密度低于 0.75 g/cm2 時可確定為骨質疏松癥[16],提示本研究成功建立了羊骨質疏松椎體模型。本研究采用的脫鈣方案是用輸液泵通過椎弓根孔灌注酸溶液,大大縮短了脫鈣時間,提高了脫鈣成功率。
失效強度和剛度是椎體生物力學重要評價指標,其中失效強度反映椎體載荷能力,剛度反映軸向載荷下椎體抗變形能力。因此,本研究生物力學測試選擇上述兩指標來評估強化處理前后椎體的生物力學性能。結果表明,A 組經同種異體骨強化處理后椎體失效強度及剛度分別達骨折前 101%±4%、50%±4%,與尹知訓等[17]報道的經椎弓根椎體內植骨能恢復椎體最大抗壓強度,但剛度恢復較差的結果一致。故我們認為對于椎體壓縮性骨折經椎弓根植入同種異體骨后早期不宜負重,否則失去了椎體強化后早起下床活動的優點。
研究表明,脊柱載荷傳遞機制與椎體結構剛度有關[18]。因此,在獲得最大強度的同時,應盡量減少骨水泥強化對椎體剛度的影響。一些學者認為椎體成形術后椎體剛度較小能減輕相鄰椎體的退行性變[19]。本研究結果表明 B 組失效強度是骨折前的 250%±11%、剛度達骨折前 400%±12%,術后椎體剛度明顯升高,出現應力集中現象,容易導致鄰椎骨折[20]。文獻報道,經皮椎體成形術后 1 年新發骨折發生率為 5%~22%,術后 4 年為 17.2%~52%[21-23]。而鄰近椎體再骨折是臨床許多經皮椎體成形術后患者再次就醫的主要原因。
因此,調整 PMMA 骨水泥硬度,使其與人椎體松質骨硬度相匹配,有望降低經皮椎體成形術后鄰近椎體骨折風險[24]。Gutiérrez-Mejía 等[25]報道在標準骨水泥配方中加入 20wt% 丙烯酸丁酯/PMMA 納米顆粒后,骨水泥硬度降低 31%。Boger 等[26-27]通過添加透明質酸鈉和羥丙基甲基纖維素水溶液的方法,使制備的多孔 PMMA 骨水泥彈性模量明顯降低。Robo 等[28]通過加入亞油酸降低彈性模量來優化 PMMA 骨水泥硬度,使其更接近松質骨力學性能,而且亞油酸不會影響 PMMA 骨水泥在綿羊模型中的生物相容性。
本研究生物力學測試顯示,C 組椎體經 PMMA 骨水泥與同種異體骨混合物強化處理后,椎體失效強度及剛度小于 PMMA 骨水泥強化的 B 組,但高于同種異體骨強化的 A 組;而失效位移小于 A 組、大于 B 組;差異均有統計學意義。結果表明 3 種填充物中,PMMA 骨水泥與同種異體骨混合物既能恢復椎體失效強度,也能恢復椎體剛度,能滿足椎體填充材料的生物力學性能要求,可作為經皮椎體成形術中填充材料的選擇之一。
作者貢獻:王志坤負責實驗設計及實施、數據收集整理及統計分析、文章撰寫;張賢森、馮慶裕參與實驗設計及實施、協助數據收集整理;李再學協助數據收集整理;謝文偉、陳建庭指導實驗設計、實施及文章撰寫,對文章的知識性內容作批評性審閱。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經東莞市松山湖中心醫院 南方醫科大學附屬東莞石龍人民醫院醫學倫理委員會批準。