引用本文: 焦海山, 宋悅寧, 黃健, 李東印, 胡毅. 改性殼聚糖基導電復合材料神經導管的體內降解及組織相容性觀察. 中國修復重建外科雜志, 2021, 35(6): 769-775. doi: 10.7507/1002-1892.202101088 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
神經缺損最佳治療方法是自體神經移植修復,但存在供體來源有限、供區失神經功能障礙、神經瘤形成等問題。組織工程神經作為自體神經移植替代物,已成為神經再生的一個重要研究方向。組織工程神經構建需考慮支架、種子細胞和生長因子三要素,在眾多組織工程神經支架材料中,甲殼素及殼聚糖在生物相容性和降解性等方面優勢明顯,兩者各有優缺點。殼聚糖為甲殼素脫乙酰基所得,溶解性明顯高于天然甲殼素,方便去除共存雜質,較易加工成形;而甲殼素在降解速度和機械性能方面有一定優勢,但天然甲殼素溶解性差,不易加工處理,且與甲殼素共存的蛋白質難以清除[1-5]。
綜合考慮神經組織的可興奮性、神經細胞依靠動作電位傳遞信息、外界刺激會影響神經細胞黏附及生長等電生理特性因素,理想的組織工程神經支架材料除需具備獨特的形貌特征、良好的降解性及組織相容性外,還需具備導電性能,從而使組織工程神經與體內神經組織形成良好的電生理整合;以及當聯合應用電刺激時在神經缺損移植部位能建立局部電環境,充當神經組織間電信號傳遞的橋梁,通過增強神經分化增加內源性神經因子的表達,促進軸突早期萌發,提高神經再生率等,進而發揮促神經再生作用[6-9]。但是甲殼素、殼聚糖均不具備導電性能,為解決這一問題,本課題組前期研究[10]制備了納米聚吡咯(polypyrrole,PPy),并對殼聚糖進行乙酰化改性,構建納米 PPy/甲殼素復合材料,初步觀察顯示該復合材料具備導電性以及較好的體外生物相容性和降解性,但其體內組織相容性和降解情況尚不明確。在此基礎上,本次研究制備了改性殼聚糖基導電復合材料神經導管(以下簡稱:新型復合材料導管),通過觀察該導管體內降解及組織相容性,探討其作為組織工程神經支架材料的可行性。
1 材料與方法
1.1 主要試劑及儀器
健康雌性 SD 大鼠 30 只,體質量 160~180 g,由中國科學院上海實驗動物中心提供。殼聚糖(脫乙酰度 90%,南通興成生物制品廠);吡咯、小鼠抗巨噬細胞單抗(Sigma 公司,美國)、羊抗小鼠 IgG-TRITC(武漢博士德生物工程有限公司)。
VERTEX 70 傅里葉紅外光譜儀(Bruker 公司,德國);S4700 掃描電鏡(Hitachi 公司,日本);M-3 四探針電導測試儀(蘇州晶格電子有限公司);冰凍切片機(Leica 公司,德國);TI CFIS60 倒置熒光顯微鏡(Nikon 公司,日本)。
1.2 新型復合材料導管的制備及表征
1.2.1 制備方法
參照本課題組前期研究采用的微乳液聚合法[10-11]合成納米 PPy。具體方法:① 以十二烷基苯磺酸水溶液為乳化劑、FeCl3 為氧化劑,按照 1∶3.75 比例混合制備微乳液,將一定量吡咯單體加入微乳液中;室溫下聚合反應 24 h 后,丙酮終止反應;大量去離子水水洗,以離心半徑 3.5 cm、6 500 r/min 離心 5 min,分離沉淀,真空干燥后即得納米 PPy 粉末。取一定量納米 PPy 粉末,加入 0.5% 醋酸溶液中超聲震蕩,制備 1.5%納米 PPy 懸液。
② 采用 1% 醋酸溶解殼聚糖,制備 3% 殼聚糖溶液后,加入 1.5%納米 PPy 懸液,配成 3%納米 PPy/殼聚糖混合溶液,攪拌 4 h 后真空減壓脫氣;將混合溶液注入定制的成管模型,冷凍干燥,1.5%NaOH 脫酸中和 24 h,去離子水水洗至中性,冷凍干燥,獲得改性納米 PPy/殼聚糖復合材料導管(記作 CP 導管)。
③ 參照文獻[12]方法對 CP 導管進行乙酰化處理。將 CP 導管置于 150 mL 5% 醋酐甲醇溶液中,室溫下分別乙酰化反應 30、60、90 min 后,置于 4%NaOH 溶液處理,去離子水水洗至中性,冷凍干燥,獲得不同乙酰度的 CP 導管(分別記作 CAP1、CAP2、CAP3 導管),即新型復合材料導管。將各導管行環氧乙烷消毒后用于體內實驗。
1.2.2 表征方法
取 CP、CAP1、CAP2、CAP3 導管進行以下觀測:① 采用傅里葉紅外光譜儀測定紅外光譜圖,以董炎明等[13]報道的紅外光譜法測定導管殼聚糖乙酰度;② 導管經干燥、噴金后,掃描電鏡觀察表面形態及結構;③ 游標卡尺測量導管內徑、壁厚,采用四探針電導測試儀測定導管電導率。
1.3 新型復合材料導管體內降解及組織相容性觀測
1.3.1 動物模型制備
取 30 只大鼠腹腔注射復合麻醉劑(0.3 mL/100 g)后俯臥固定,術區備皮、消毒、鋪巾,在背部中線兩側旁開 0.5 cm 作縱切口,左、右側各 4 個切口;鈍性分離皮下筋膜,距切口約 1 cm 處制備隧道;兩側 4 個切口分別植入 1 個 CP、CAP1、CAP2、CAP3 導管,縫合關閉切口。術后 2、4、6、8、10、12 周各取 5 只動物,同法麻醉后按照原切口入路取材進行觀測。
1.3.2 觀測指標
① 大體觀察:術后觀察切口有無感染發生,4、8、12 周取材后大體觀察導管形態及完整性。② 神經導管降解觀測:植入前導管稱重(W1);取 2、4、6、8、10、12 周樣本,剝離導管表面結締組織,雙蒸水清洗 3 遍,以膠原酶和胰蛋白酶依次處理,再以 1%Triton X-100 去垢劑沖洗,雙蒸水清洗,凍干后稱重(W2),按以下公式計算降解率:降解率=(W1?W2)/W1×100%。③ 掃描電鏡觀察:取 12 周樣本干燥、噴金后,掃描電鏡觀察導管表面形態及微觀結構。④ 組織學觀察:取 4、8、12 周樣本置于 4% 多聚甲醛溶液,經梯度蔗糖溶液處理后, 5% 蔗糖包埋并連續切片,片厚 10 μm,常規 HE 染色和抗巨噬細胞免疫熒光染色 [一抗:小鼠抗巨噬細胞單抗(1∶150),二抗:羊抗小鼠 IgG-TRITC(1∶250)] 觀察。
1.4 統計學方法
采用 SPSS25.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準α=0.05。
2 結果
2.1 新型復合材料導管表征
2.1.1 傅里葉紅外光譜儀測定
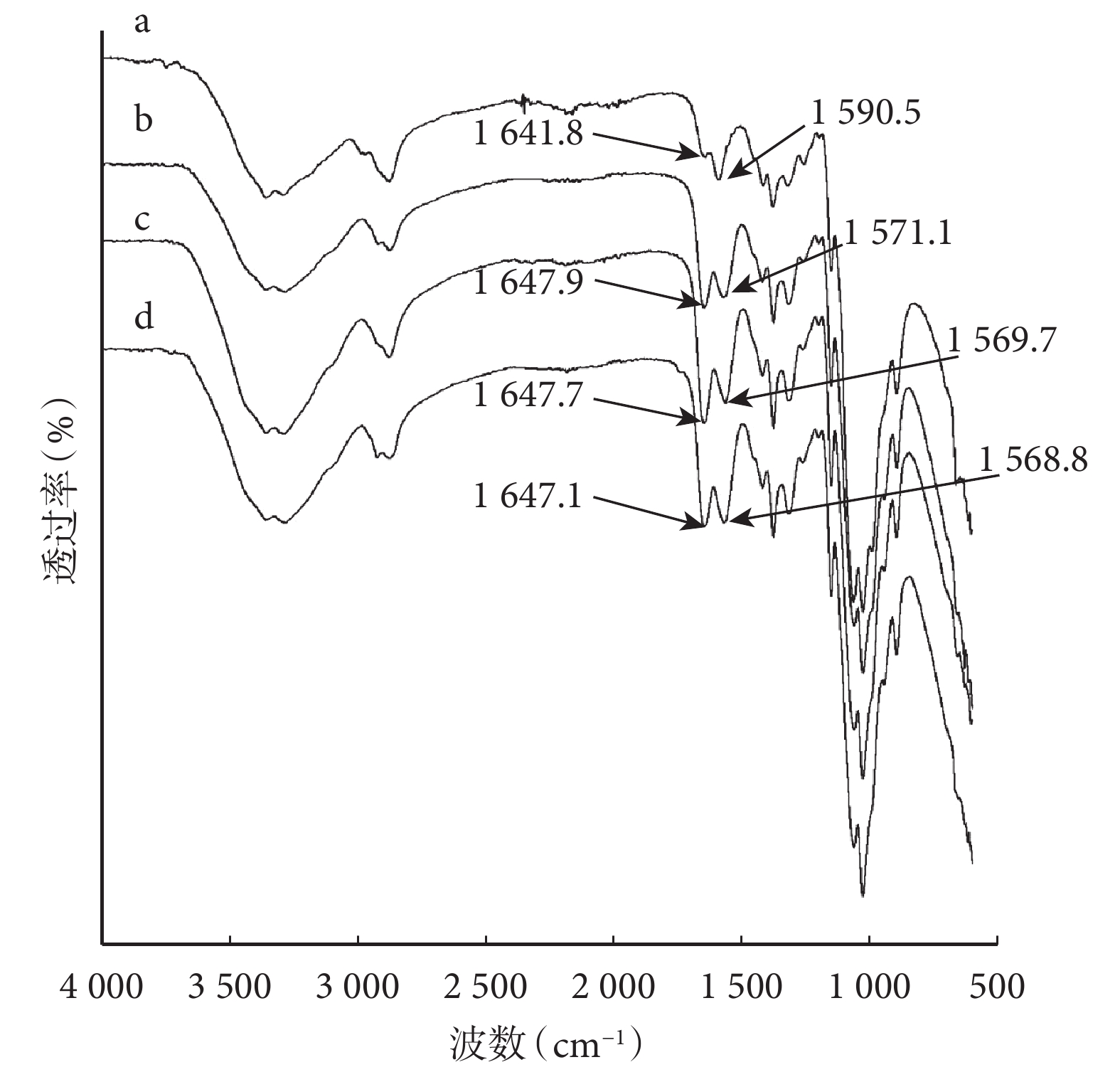
紅外光譜圖顯示 CP、CAP1、CAP2 和 CAP3 導管均可見 1 310 cm?1左右的酰胺Ⅲ譜帶(C-N)和 1 647 cm?1左右的酰胺Ⅰ譜帶(C=O);其中,CP 導管可見 1 590 cm?1左右的殼聚糖 NH2 彎曲振動特征峰,CAP1、CAP2 和 CAP3 導管由于 1 562 cm?1左右的酰胺Ⅱ譜帶增強,掩蓋了 NH2 彎曲振動特征峰(圖 1)。乙酰度測量顯示 CP 導管為 9.19%(與商品殼聚糖標示脫乙酰度 90% 相符),CAP1、CAP2、CAP3 導管分別為 33.8%、64.0%、82.2%。上述結果提示殼聚糖經乙酰化處理,獲得不同程度乙酰化改性殼聚糖材料。
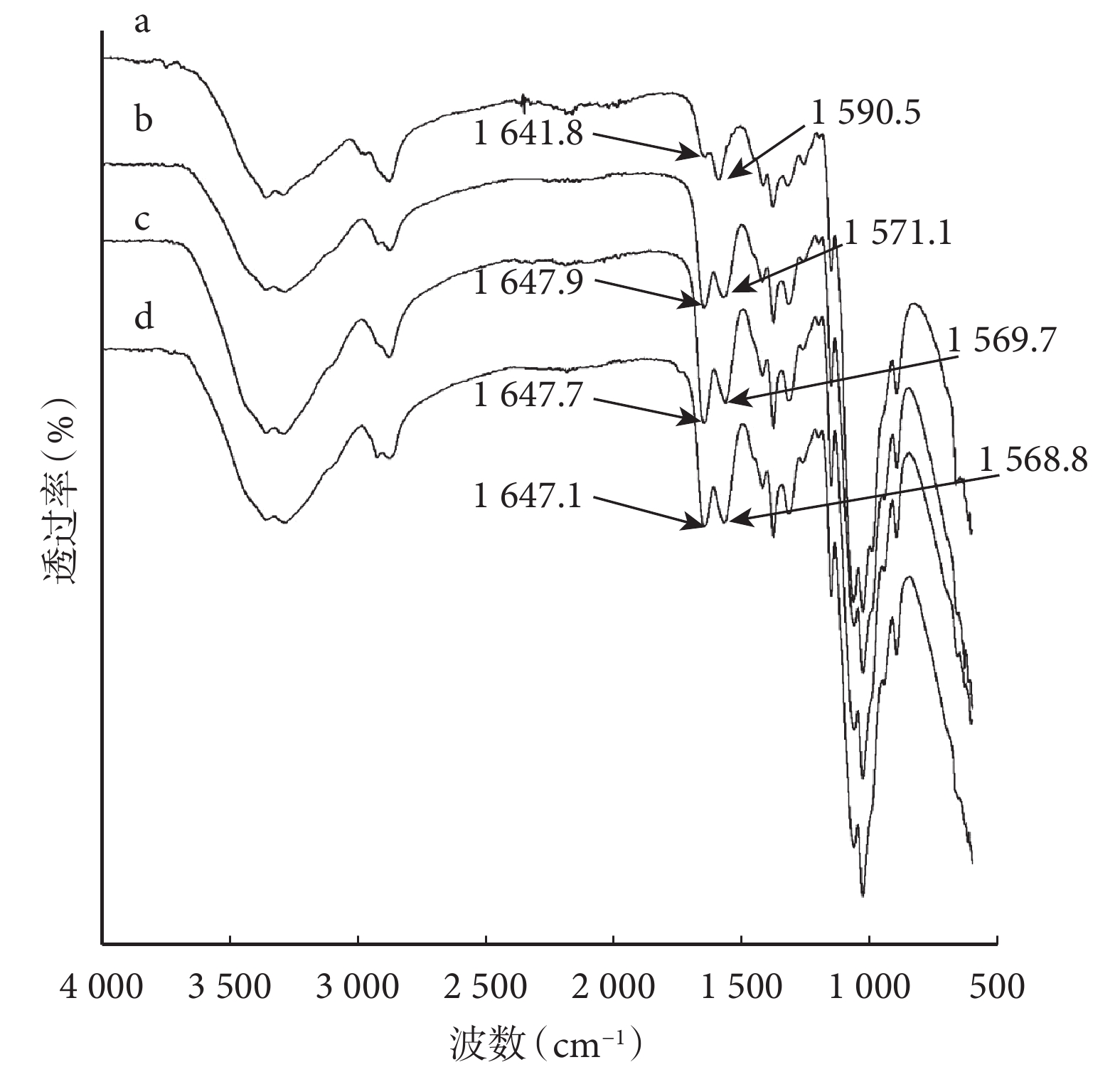 圖1
各導管紅外光譜圖
圖1
各導管紅外光譜圖
a:CP導管 b:CAP1導管 c:CAP2導管 d:CAP3導管
Figure1. Fourier infrared absorption spectrum of conduitsa: CP conduit b: CAP1 conduit c: CAP2 conduit d: CAP3 conduit
2.1.2 掃描電鏡觀察
鏡下見導管表面相對光滑,結構致密,各導管間無明顯差異,提示乙酰化處理未顯著改變材料微觀結構和表面形態。見圖 2。
 圖2
各導管掃描電鏡觀察(×5 000)
圖2
各導管掃描電鏡觀察(×5 000)
a. CP導管;b. CAP1導管;c. CAP2導管;d. CAP3導管
Figure2. SEM observation of conduits (×5 000)a. CP conduit; b. CAP1 conduit; c. CAP2 conduit; d. CAP3 conduit
2.1.3 導電性能測試
各導管內徑 1.4 mm、壁厚 0.2 mm,管壁有較多孔隙。CP、CAP1、CAP2、CAP3 導管電導率分別為(1.263±0.021)×10?3、(1.270±0.011)×10?3、(1.256±0.012)×10?3、(1.259±0.012)×10?3 S/cm,組間差異均無統計學意義(P>0.05)。
2.2 材料體內降解及組織相容性觀測
2.2.1 大體觀察
各導管植入后,動物切口均無紅腫等感染癥狀出現。術后 4 周,各導管周圍有結締組織包裹,均保持原外形,周圍無明顯炎癥,血管豐富;8 周時,CAP3 導管形態開始變化,其余導管均保持相對完整;12 周時,各導管均出現一定塌陷,其中 CAP3 導管塌陷尤為明顯。各時間點取材時均容易剝離。
2.2.2 神經導管降解觀測
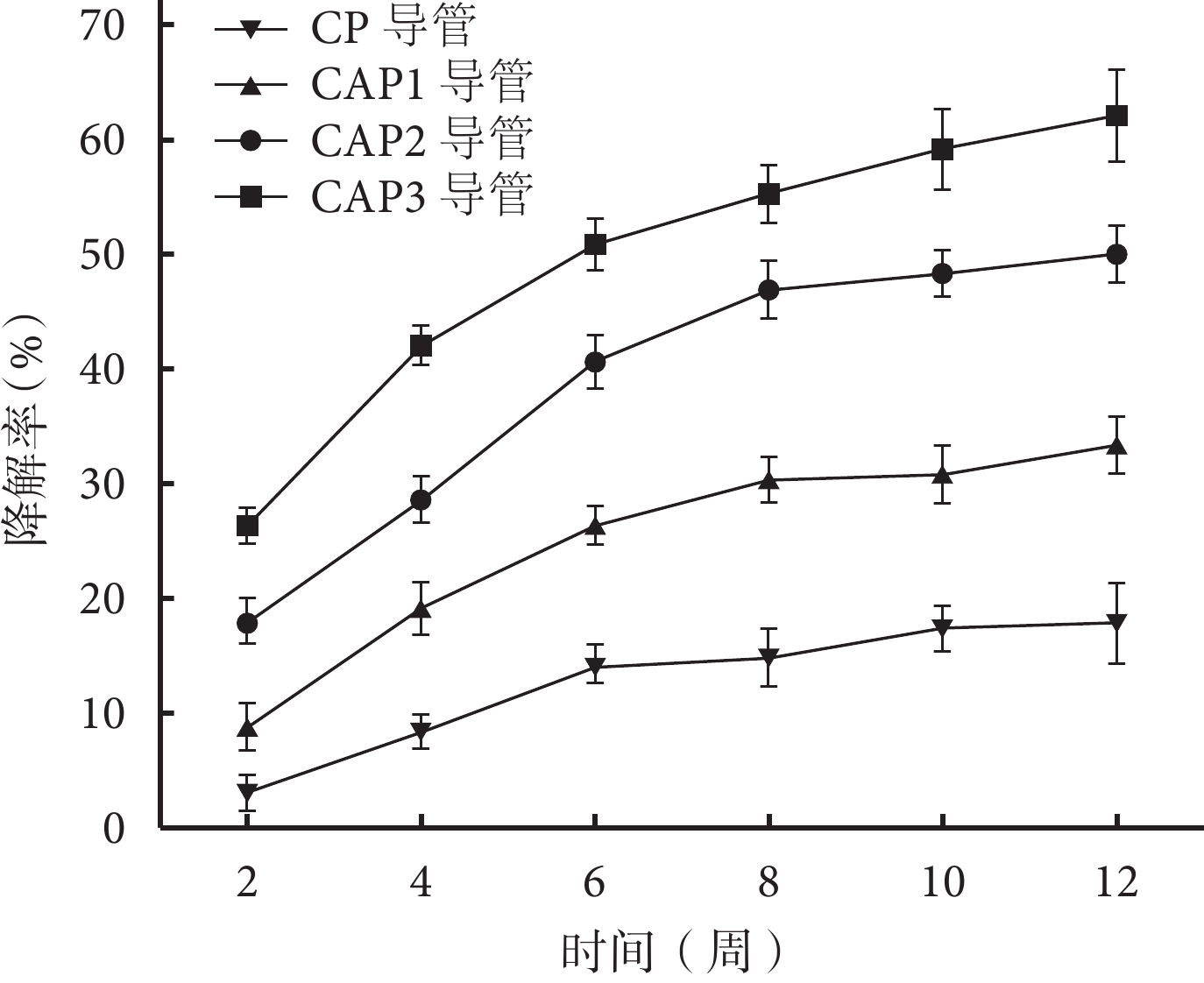
隨植入時間延長,各導管均出現不同程度質量丟失,且乙酰化度越高,質量變化越大;各時間點降解率組間比較,差異均有統計學意義(P<0.05)。見圖 3。
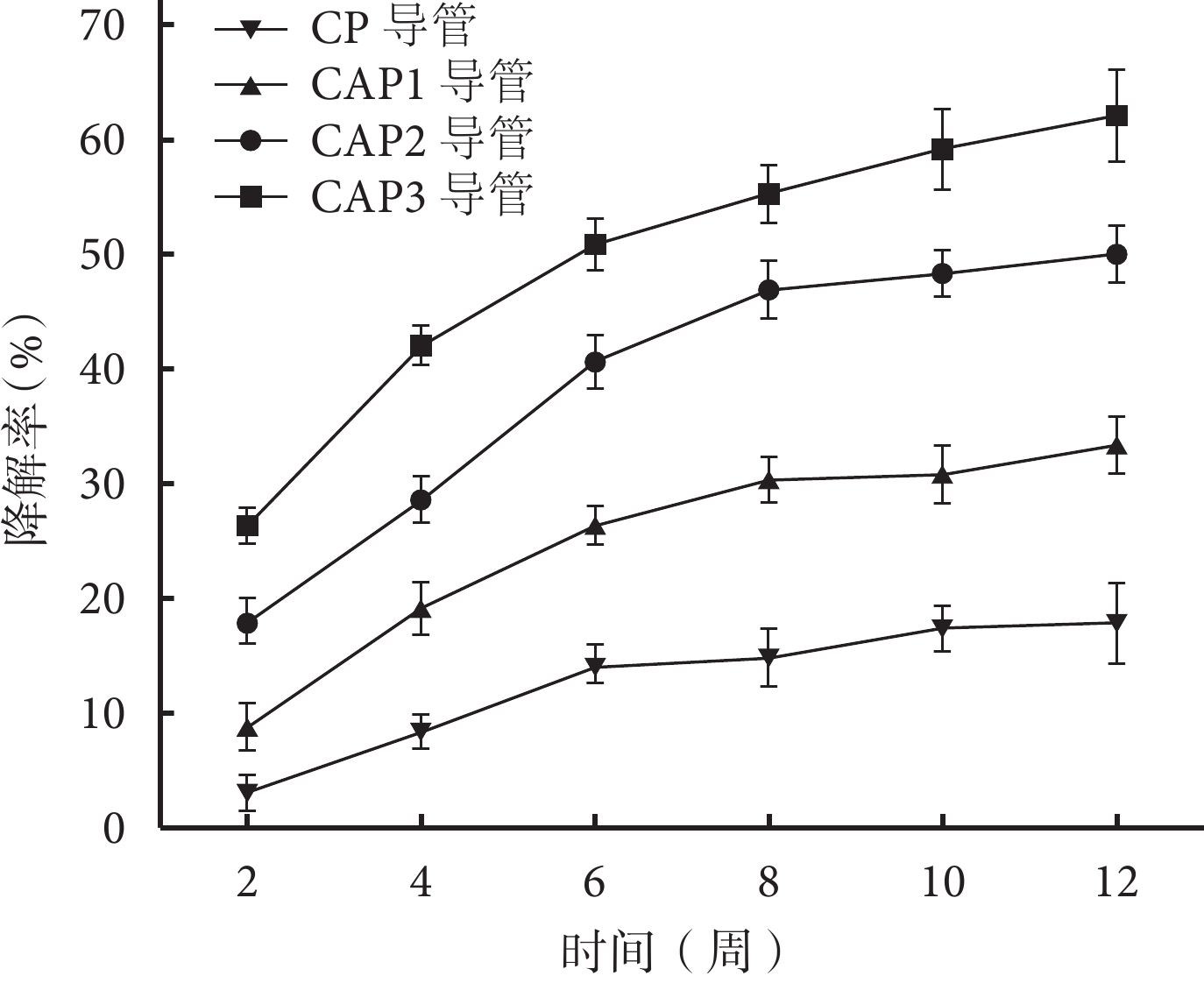 圖3
各時間點各導管降解率
Figure3.
The degradation rate of each conduit at each time point
圖3
各時間點各導管降解率
Figure3.
The degradation rate of each conduit at each time point
2.2.3 掃描電鏡觀察
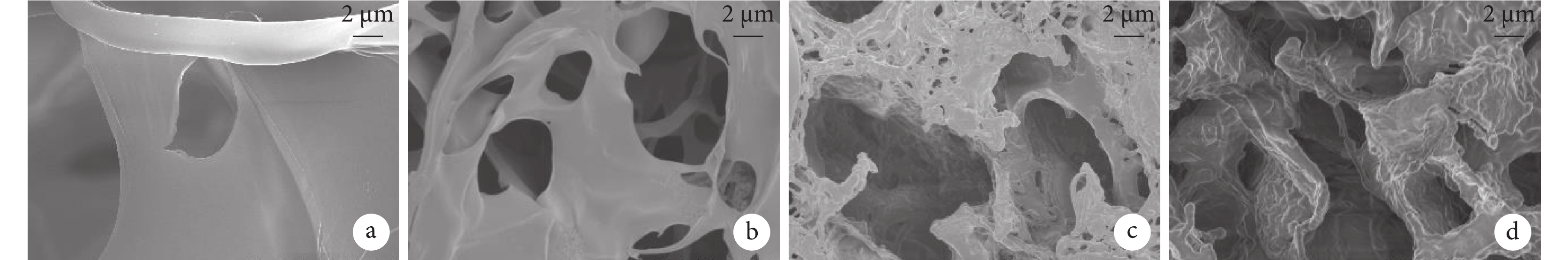
術后 12 周導管材料出現較多孔隙,且隨著乙酰化度增加,孔隙呈增大趨勢。見圖 4。
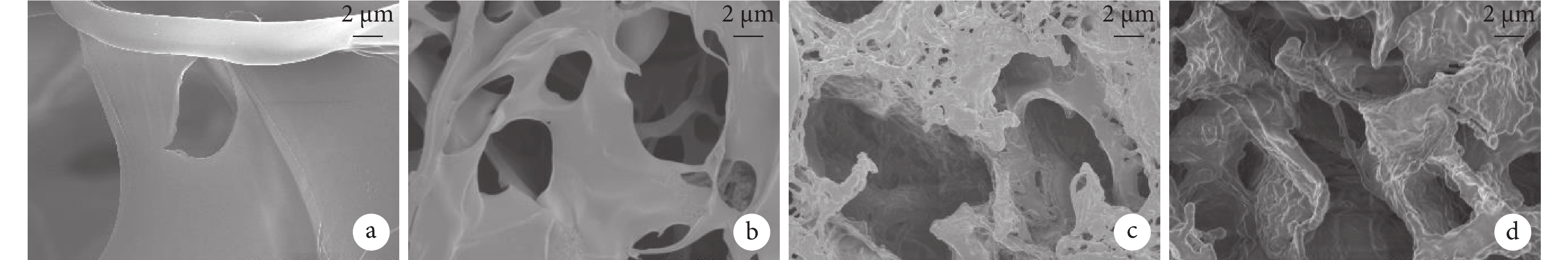 圖4
術后12周各導管掃描電鏡觀察(×5 000)
圖4
術后12周各導管掃描電鏡觀察(×5 000)
a. CP導管;b. CAP1導管;c. CAP2導管;d. CAP3導管
Figure4. SEM observation of conduits at 12 weeks after implantation (×5 000)a. CP conduit; b. CAP1 conduit; c. CAP2 conduit; d. CAP3 conduit
2.2.4 HE 染色
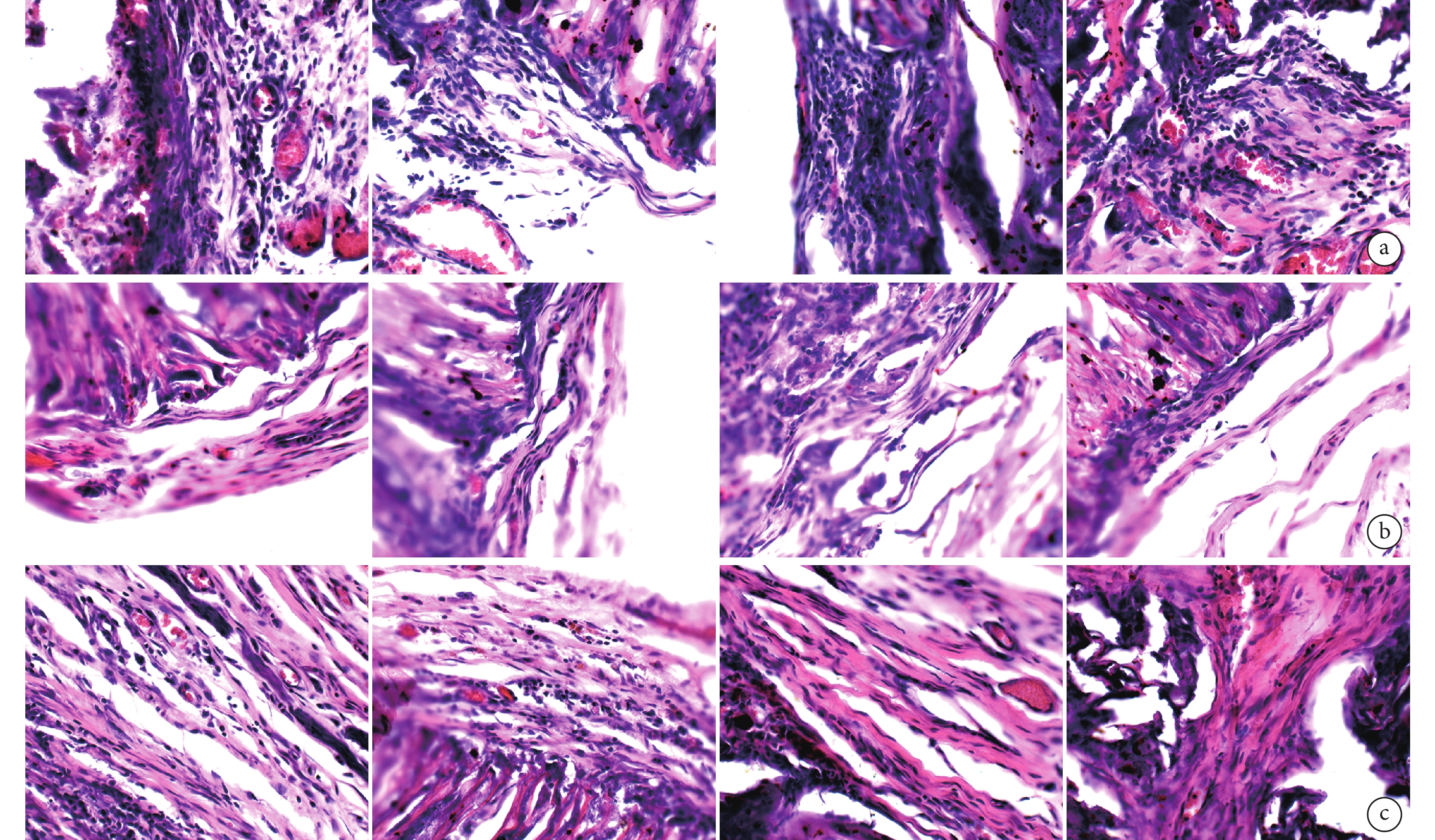
鏡下觀察見各導管植入后早期均有較多淋巴細胞浸潤,隨植入時間延長,淋巴細胞減少、成纖維細胞增多、膠原纖維增生明顯;8 周時 CP、CAP1、CAP2 導管仍可見導管輪廓,CAP3 導管塌陷明顯、結締組織長入;12 周時,各導管均出現不同程度塌陷、結締組織長入、膠原纖維增生包裹,血管豐富。見圖 5。
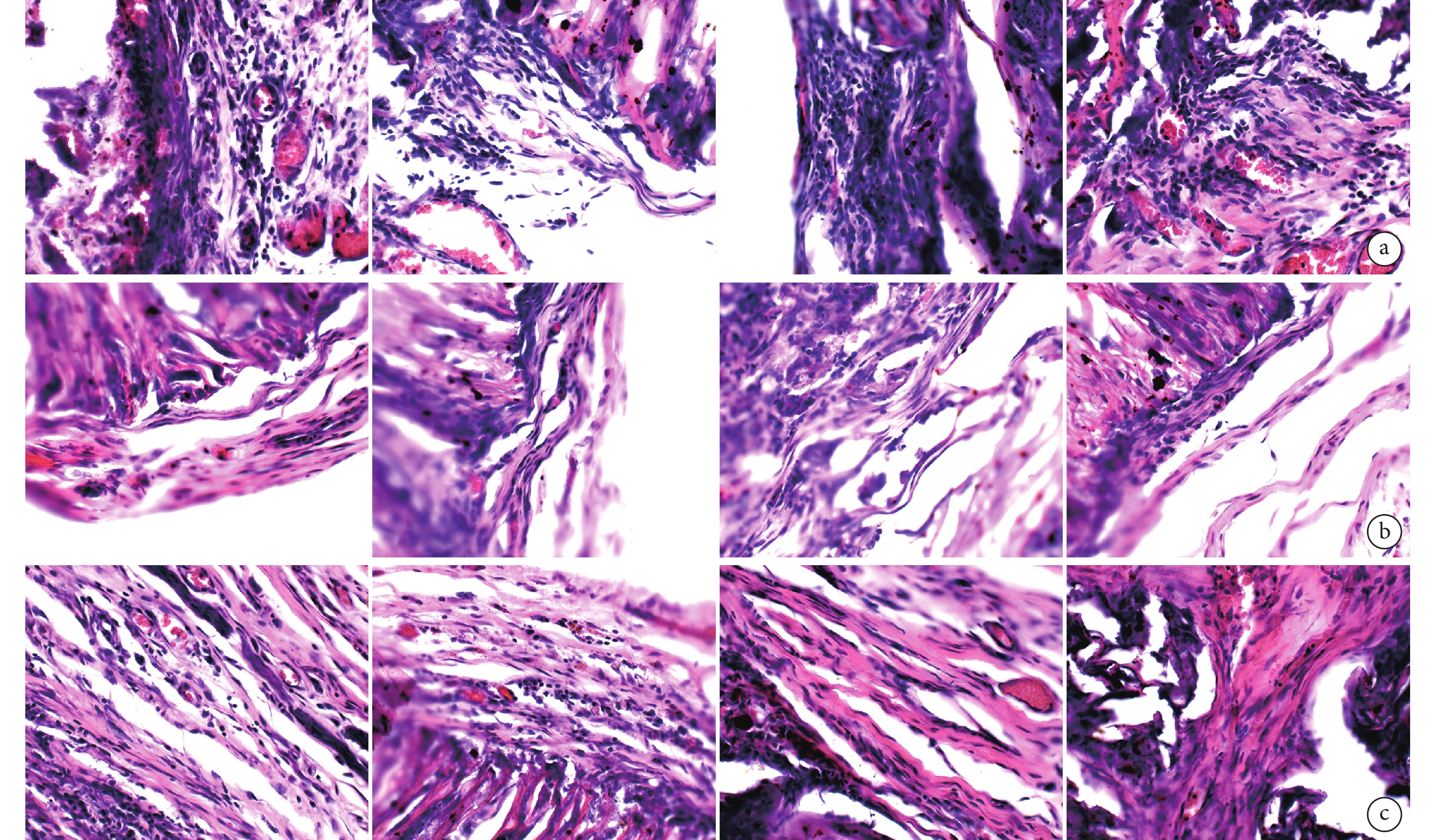 圖5
植入后各導管HE染色觀察(×640)
圖5
植入后各導管HE染色觀察(×640)
從左至右分別為CP、CAP1、CAP2、CAP3導管 a. 術后4周;b. 術后8周;c. 術后12周
Figure5. HE staining of each conduit after implantation (×640)From left to right for CP, CAP1, CAP2, and CAP3 couduits, respectively a. At 4 weeks after implantation; b. At 8 weeks after implantation; c. At 12 weeks after implantation
2.2.5 免疫熒光染色觀察
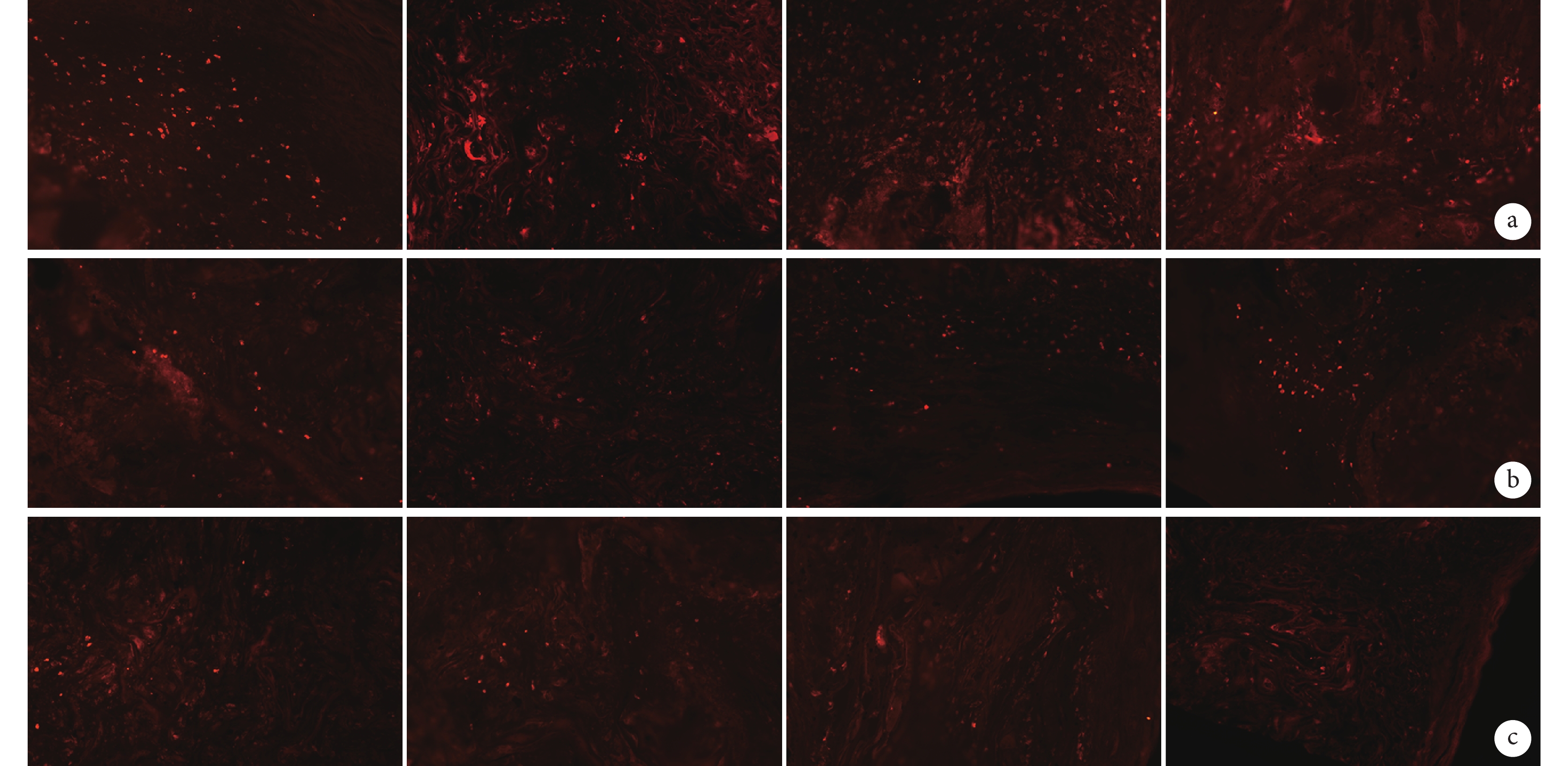
各導管植入后在早期均有較多巨噬細胞、淋巴細胞浸潤,隨植入時間延長,淋巴細胞有所減少,成纖維細胞增多,膠原纖維增生明顯。見圖 6。
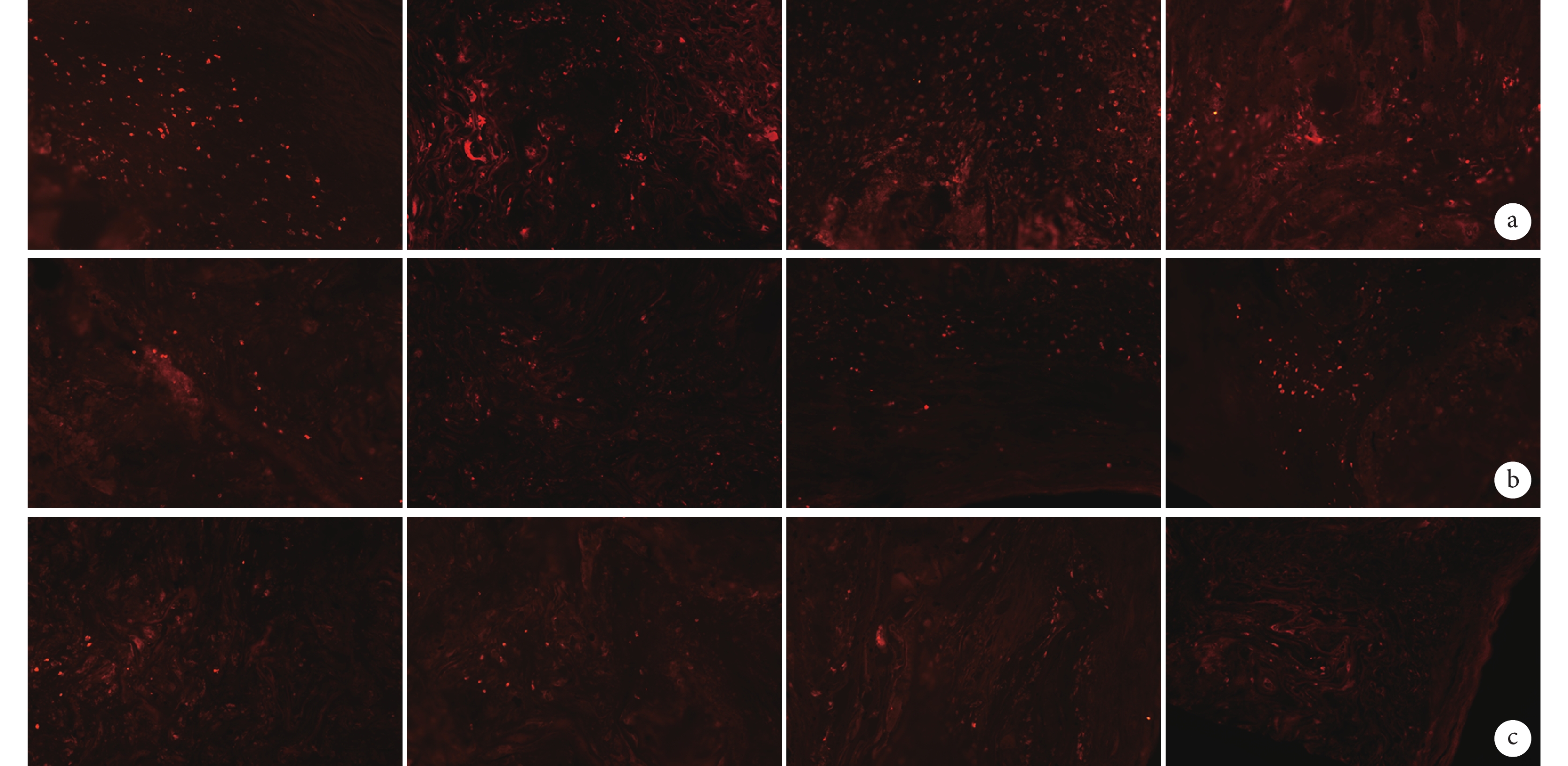 圖6
植入后各導管免疫熒光染色觀察(×200)
圖6
植入后各導管免疫熒光染色觀察(×200)
從左至右分別為CP、CAP1、CAP2、CAP3導管 a. 術后4周;b. 術后8周;c. 術后12周
Figure6. Immunofluorescence staining of each conduit after implantation (×200)From left to right for CP, CAP1, CAP2, and CAP3 couduits, respectively a. At 4 weeks after implantation; b. At 8 weeks after implantation; c. At 12 weeks after implantation
3 討論
近年來,組織工程神經成為神經再生研究領域的熱點,而理想的支架材料又是組織工程神經構建的關鍵[9, 14]。鑒于神經組織本身的電生理特性以及電刺激在神經再生中的重要作用[2, 6, 15-16],學者們開始研究新型導電材料,并提出導電性是理想組織工程神經支架材料的特性之一[6-10]。目前研究使用較多的導電材料有 PPy、聚乙撐二氧噻吩、石墨烯等,其中對 PPy 的研究相對較多。常用于 PPy 的聚合方法包括電化學聚合、化學氧化、模板法、靜電紡絲法等,本研究采用的是被譽為制備納米粒子“萬能方法”的微乳液聚合法。本課題組前期研究表明,該方法制備的 PPy 達到納米級,經紅外光譜儀鑒定符合 PPy 的紅外光譜特點,且成功摻雜十二烷基苯磺酸[10],為通過改變 PPy 尺寸實現導電高聚物降解創造了條件。
目前,殼聚糖的乙酰化改性方法已較成熟。一般認為在甲醇或乙醇體系中以乙酸酐作為酰化劑,對殼聚糖進行 N-乙酰化改性較簡便。另外,由于氨基反應活性比羥基大,乙酰化反應首先在氨基上發生,得到 O-乙酰化的殼聚糖反而較困難[17]。本研究中改性后材料的紅外光譜未觀察到 O-酰基特征吸收峰,說明酸酐與殼聚糖的氨基發生了乙酰化反應,得到了研究需要的改性殼聚糖。因 PPy 在復合材料中占比低于 10%,難以明顯影響紅外光譜中吸收峰的特點。
一般認為,PPy 本身具有較好的生物安全性[18-19],而殼聚糖經 N-乙酰化改性后,乙酰化本身也不會影響材料的生物安全性[12, 20]。本課題組前期研究提示納米 PPy/殼聚糖及改性的納米 PPy/殼聚糖材料均具有較好的體外生物相容性[10]。本研究將不同乙酰度的改性納米 PPy/殼聚糖導管材料植入大鼠皮下,通過組織學方法觀察植入材料體內組織相容性。結果顯示各組導管在植入早期均有較多淋巴細胞、巨噬細胞浸潤,隨著時間延長,淋巴細胞和巨噬細胞均逐漸減少,而成纖維細胞逐漸增多,膠原纖維增生明顯,血管順利長入,表明材料未對周圍組織產生明顯異物刺激和不良反應,具有較好的組織相容性。另一方面,一定程度的巨噬細胞聚集對 N-乙酰化改性殼聚糖的降解可能有促進作用。因為 N-乙酰化改性殼聚糖的降解主要是通過溶菌酶水解其糖苷鍵實現解聚[12, 20],而局部出現的巨噬細胞及其他炎癥細胞可在局部微環境釋放溶菌酶,對 N-乙酰化后的殼聚糖生物降解具有一定促進作用。
本研究制備的新型復合材料導管經檢測具備導電性能,其電導率與文獻報道的不同濃度 PPy 對應的電導率基本類似[11],增加 PPy 在復合材料中的濃度固然可以獲得更好導電性能,但考慮到 PPy 本身力學性能差、尚未發現可被體內某種酶降解、缺少活性基團等缺陷,目前研究常將納米 PPy 與其他可降解材料制備成復合材料[7, 11, 18],期望利用其小尺寸優勢能被排泄器官排出體外,但納米尺寸的粒子團聚問題尚無滿意解決方案,因而本研究在文獻報道基礎上在導電和降解之間進行選擇,采用 3%納米 PPy 制備導管材料,以期使導管在具備導電能力同時解決 PPy 的降解問題。
一般認為殼聚糖及甲殼素均具備降解性,但在一定脫乙酰度范圍內,其降解性能與脫乙酰度成負相關[20-21],文獻報道經過乙酰化改性的殼聚糖比殼聚糖本體具有更好的生物降解性,而且通過改變乙酰化程度可以控制殼聚糖的降解速率[12]。本研究結果與上述文獻報道結論相符,隨著乙酰度增加,導管降解有加快趨勢,這將有助于解決殼聚糖降解速度慢導致其在體內留存較長時間的問題,但是也不能片面追求降解速度而忽視神經再生對完整導管的依賴。
綜上述,本研究制備的新型復合材料導管具備較好的體內生物相容性、降解性,以及一定導電性能,初步具備作為組織工程神經支架材料的特性。下一步將通過橋接修復神經缺損實驗篩選合適的改性殼聚糖材料,使其既具有理想組織工程支架材料的生物相容性、適合支持神經再生的降解速度、良好的可塑性及生物安全性,又具備良好的導電性,為后續在導電材料基礎上引入低頻電刺激,使組織工程支架材料與電刺激的聯合應用成為可能,以提高周圍神經再生能力。
作者貢獻:焦海山負責實驗設計及實施,起草文章;宋悅寧負責實驗實施,數據分析,對文章的知識性內容作批評性審閱;黃健負責數據收集整理;胡毅負責實驗實施;李東印負責動物實驗。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經蘇州衛生職業技術學院動物實驗倫理委員會批準(SWAE201906)。實驗動物使用許可證號:SYXK(蘇)2016-0049。
神經缺損最佳治療方法是自體神經移植修復,但存在供體來源有限、供區失神經功能障礙、神經瘤形成等問題。組織工程神經作為自體神經移植替代物,已成為神經再生的一個重要研究方向。組織工程神經構建需考慮支架、種子細胞和生長因子三要素,在眾多組織工程神經支架材料中,甲殼素及殼聚糖在生物相容性和降解性等方面優勢明顯,兩者各有優缺點。殼聚糖為甲殼素脫乙酰基所得,溶解性明顯高于天然甲殼素,方便去除共存雜質,較易加工成形;而甲殼素在降解速度和機械性能方面有一定優勢,但天然甲殼素溶解性差,不易加工處理,且與甲殼素共存的蛋白質難以清除[1-5]。
綜合考慮神經組織的可興奮性、神經細胞依靠動作電位傳遞信息、外界刺激會影響神經細胞黏附及生長等電生理特性因素,理想的組織工程神經支架材料除需具備獨特的形貌特征、良好的降解性及組織相容性外,還需具備導電性能,從而使組織工程神經與體內神經組織形成良好的電生理整合;以及當聯合應用電刺激時在神經缺損移植部位能建立局部電環境,充當神經組織間電信號傳遞的橋梁,通過增強神經分化增加內源性神經因子的表達,促進軸突早期萌發,提高神經再生率等,進而發揮促神經再生作用[6-9]。但是甲殼素、殼聚糖均不具備導電性能,為解決這一問題,本課題組前期研究[10]制備了納米聚吡咯(polypyrrole,PPy),并對殼聚糖進行乙酰化改性,構建納米 PPy/甲殼素復合材料,初步觀察顯示該復合材料具備導電性以及較好的體外生物相容性和降解性,但其體內組織相容性和降解情況尚不明確。在此基礎上,本次研究制備了改性殼聚糖基導電復合材料神經導管(以下簡稱:新型復合材料導管),通過觀察該導管體內降解及組織相容性,探討其作為組織工程神經支架材料的可行性。
1 材料與方法
1.1 主要試劑及儀器
健康雌性 SD 大鼠 30 只,體質量 160~180 g,由中國科學院上海實驗動物中心提供。殼聚糖(脫乙酰度 90%,南通興成生物制品廠);吡咯、小鼠抗巨噬細胞單抗(Sigma 公司,美國)、羊抗小鼠 IgG-TRITC(武漢博士德生物工程有限公司)。
VERTEX 70 傅里葉紅外光譜儀(Bruker 公司,德國);S4700 掃描電鏡(Hitachi 公司,日本);M-3 四探針電導測試儀(蘇州晶格電子有限公司);冰凍切片機(Leica 公司,德國);TI CFIS60 倒置熒光顯微鏡(Nikon 公司,日本)。
1.2 新型復合材料導管的制備及表征
1.2.1 制備方法
參照本課題組前期研究采用的微乳液聚合法[10-11]合成納米 PPy。具體方法:① 以十二烷基苯磺酸水溶液為乳化劑、FeCl3 為氧化劑,按照 1∶3.75 比例混合制備微乳液,將一定量吡咯單體加入微乳液中;室溫下聚合反應 24 h 后,丙酮終止反應;大量去離子水水洗,以離心半徑 3.5 cm、6 500 r/min 離心 5 min,分離沉淀,真空干燥后即得納米 PPy 粉末。取一定量納米 PPy 粉末,加入 0.5% 醋酸溶液中超聲震蕩,制備 1.5%納米 PPy 懸液。
② 采用 1% 醋酸溶解殼聚糖,制備 3% 殼聚糖溶液后,加入 1.5%納米 PPy 懸液,配成 3%納米 PPy/殼聚糖混合溶液,攪拌 4 h 后真空減壓脫氣;將混合溶液注入定制的成管模型,冷凍干燥,1.5%NaOH 脫酸中和 24 h,去離子水水洗至中性,冷凍干燥,獲得改性納米 PPy/殼聚糖復合材料導管(記作 CP 導管)。
③ 參照文獻[12]方法對 CP 導管進行乙酰化處理。將 CP 導管置于 150 mL 5% 醋酐甲醇溶液中,室溫下分別乙酰化反應 30、60、90 min 后,置于 4%NaOH 溶液處理,去離子水水洗至中性,冷凍干燥,獲得不同乙酰度的 CP 導管(分別記作 CAP1、CAP2、CAP3 導管),即新型復合材料導管。將各導管行環氧乙烷消毒后用于體內實驗。
1.2.2 表征方法
取 CP、CAP1、CAP2、CAP3 導管進行以下觀測:① 采用傅里葉紅外光譜儀測定紅外光譜圖,以董炎明等[13]報道的紅外光譜法測定導管殼聚糖乙酰度;② 導管經干燥、噴金后,掃描電鏡觀察表面形態及結構;③ 游標卡尺測量導管內徑、壁厚,采用四探針電導測試儀測定導管電導率。
1.3 新型復合材料導管體內降解及組織相容性觀測
1.3.1 動物模型制備
取 30 只大鼠腹腔注射復合麻醉劑(0.3 mL/100 g)后俯臥固定,術區備皮、消毒、鋪巾,在背部中線兩側旁開 0.5 cm 作縱切口,左、右側各 4 個切口;鈍性分離皮下筋膜,距切口約 1 cm 處制備隧道;兩側 4 個切口分別植入 1 個 CP、CAP1、CAP2、CAP3 導管,縫合關閉切口。術后 2、4、6、8、10、12 周各取 5 只動物,同法麻醉后按照原切口入路取材進行觀測。
1.3.2 觀測指標
① 大體觀察:術后觀察切口有無感染發生,4、8、12 周取材后大體觀察導管形態及完整性。② 神經導管降解觀測:植入前導管稱重(W1);取 2、4、6、8、10、12 周樣本,剝離導管表面結締組織,雙蒸水清洗 3 遍,以膠原酶和胰蛋白酶依次處理,再以 1%Triton X-100 去垢劑沖洗,雙蒸水清洗,凍干后稱重(W2),按以下公式計算降解率:降解率=(W1?W2)/W1×100%。③ 掃描電鏡觀察:取 12 周樣本干燥、噴金后,掃描電鏡觀察導管表面形態及微觀結構。④ 組織學觀察:取 4、8、12 周樣本置于 4% 多聚甲醛溶液,經梯度蔗糖溶液處理后, 5% 蔗糖包埋并連續切片,片厚 10 μm,常規 HE 染色和抗巨噬細胞免疫熒光染色 [一抗:小鼠抗巨噬細胞單抗(1∶150),二抗:羊抗小鼠 IgG-TRITC(1∶250)] 觀察。
1.4 統計學方法
采用 SPSS25.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準α=0.05。
2 結果
2.1 新型復合材料導管表征
2.1.1 傅里葉紅外光譜儀測定
紅外光譜圖顯示 CP、CAP1、CAP2 和 CAP3 導管均可見 1 310 cm?1左右的酰胺Ⅲ譜帶(C-N)和 1 647 cm?1左右的酰胺Ⅰ譜帶(C=O);其中,CP 導管可見 1 590 cm?1左右的殼聚糖 NH2 彎曲振動特征峰,CAP1、CAP2 和 CAP3 導管由于 1 562 cm?1左右的酰胺Ⅱ譜帶增強,掩蓋了 NH2 彎曲振動特征峰(圖 1)。乙酰度測量顯示 CP 導管為 9.19%(與商品殼聚糖標示脫乙酰度 90% 相符),CAP1、CAP2、CAP3 導管分別為 33.8%、64.0%、82.2%。上述結果提示殼聚糖經乙酰化處理,獲得不同程度乙酰化改性殼聚糖材料。
 圖1
各導管紅外光譜圖
圖1
各導管紅外光譜圖
a:CP導管 b:CAP1導管 c:CAP2導管 d:CAP3導管
Figure1. Fourier infrared absorption spectrum of conduitsa: CP conduit b: CAP1 conduit c: CAP2 conduit d: CAP3 conduit
2.1.2 掃描電鏡觀察
鏡下見導管表面相對光滑,結構致密,各導管間無明顯差異,提示乙酰化處理未顯著改變材料微觀結構和表面形態。見圖 2。
 圖2
各導管掃描電鏡觀察(×5 000)
圖2
各導管掃描電鏡觀察(×5 000)
a. CP導管;b. CAP1導管;c. CAP2導管;d. CAP3導管
Figure2. SEM observation of conduits (×5 000)a. CP conduit; b. CAP1 conduit; c. CAP2 conduit; d. CAP3 conduit
2.1.3 導電性能測試
各導管內徑 1.4 mm、壁厚 0.2 mm,管壁有較多孔隙。CP、CAP1、CAP2、CAP3 導管電導率分別為(1.263±0.021)×10?3、(1.270±0.011)×10?3、(1.256±0.012)×10?3、(1.259±0.012)×10?3 S/cm,組間差異均無統計學意義(P>0.05)。
2.2 材料體內降解及組織相容性觀測
2.2.1 大體觀察
各導管植入后,動物切口均無紅腫等感染癥狀出現。術后 4 周,各導管周圍有結締組織包裹,均保持原外形,周圍無明顯炎癥,血管豐富;8 周時,CAP3 導管形態開始變化,其余導管均保持相對完整;12 周時,各導管均出現一定塌陷,其中 CAP3 導管塌陷尤為明顯。各時間點取材時均容易剝離。
2.2.2 神經導管降解觀測
隨植入時間延長,各導管均出現不同程度質量丟失,且乙酰化度越高,質量變化越大;各時間點降解率組間比較,差異均有統計學意義(P<0.05)。見圖 3。
 圖3
各時間點各導管降解率
Figure3.
The degradation rate of each conduit at each time point
圖3
各時間點各導管降解率
Figure3.
The degradation rate of each conduit at each time point
2.2.3 掃描電鏡觀察
術后 12 周導管材料出現較多孔隙,且隨著乙酰化度增加,孔隙呈增大趨勢。見圖 4。
 圖4
術后12周各導管掃描電鏡觀察(×5 000)
圖4
術后12周各導管掃描電鏡觀察(×5 000)
a. CP導管;b. CAP1導管;c. CAP2導管;d. CAP3導管
Figure4. SEM observation of conduits at 12 weeks after implantation (×5 000)a. CP conduit; b. CAP1 conduit; c. CAP2 conduit; d. CAP3 conduit
2.2.4 HE 染色
鏡下觀察見各導管植入后早期均有較多淋巴細胞浸潤,隨植入時間延長,淋巴細胞減少、成纖維細胞增多、膠原纖維增生明顯;8 周時 CP、CAP1、CAP2 導管仍可見導管輪廓,CAP3 導管塌陷明顯、結締組織長入;12 周時,各導管均出現不同程度塌陷、結締組織長入、膠原纖維增生包裹,血管豐富。見圖 5。
 圖5
植入后各導管HE染色觀察(×640)
圖5
植入后各導管HE染色觀察(×640)
從左至右分別為CP、CAP1、CAP2、CAP3導管 a. 術后4周;b. 術后8周;c. 術后12周
Figure5. HE staining of each conduit after implantation (×640)From left to right for CP, CAP1, CAP2, and CAP3 couduits, respectively a. At 4 weeks after implantation; b. At 8 weeks after implantation; c. At 12 weeks after implantation
2.2.5 免疫熒光染色觀察
各導管植入后在早期均有較多巨噬細胞、淋巴細胞浸潤,隨植入時間延長,淋巴細胞有所減少,成纖維細胞增多,膠原纖維增生明顯。見圖 6。
 圖6
植入后各導管免疫熒光染色觀察(×200)
圖6
植入后各導管免疫熒光染色觀察(×200)
從左至右分別為CP、CAP1、CAP2、CAP3導管 a. 術后4周;b. 術后8周;c. 術后12周
Figure6. Immunofluorescence staining of each conduit after implantation (×200)From left to right for CP, CAP1, CAP2, and CAP3 couduits, respectively a. At 4 weeks after implantation; b. At 8 weeks after implantation; c. At 12 weeks after implantation
3 討論
近年來,組織工程神經成為神經再生研究領域的熱點,而理想的支架材料又是組織工程神經構建的關鍵[9, 14]。鑒于神經組織本身的電生理特性以及電刺激在神經再生中的重要作用[2, 6, 15-16],學者們開始研究新型導電材料,并提出導電性是理想組織工程神經支架材料的特性之一[6-10]。目前研究使用較多的導電材料有 PPy、聚乙撐二氧噻吩、石墨烯等,其中對 PPy 的研究相對較多。常用于 PPy 的聚合方法包括電化學聚合、化學氧化、模板法、靜電紡絲法等,本研究采用的是被譽為制備納米粒子“萬能方法”的微乳液聚合法。本課題組前期研究表明,該方法制備的 PPy 達到納米級,經紅外光譜儀鑒定符合 PPy 的紅外光譜特點,且成功摻雜十二烷基苯磺酸[10],為通過改變 PPy 尺寸實現導電高聚物降解創造了條件。
目前,殼聚糖的乙酰化改性方法已較成熟。一般認為在甲醇或乙醇體系中以乙酸酐作為酰化劑,對殼聚糖進行 N-乙酰化改性較簡便。另外,由于氨基反應活性比羥基大,乙酰化反應首先在氨基上發生,得到 O-乙酰化的殼聚糖反而較困難[17]。本研究中改性后材料的紅外光譜未觀察到 O-酰基特征吸收峰,說明酸酐與殼聚糖的氨基發生了乙酰化反應,得到了研究需要的改性殼聚糖。因 PPy 在復合材料中占比低于 10%,難以明顯影響紅外光譜中吸收峰的特點。
一般認為,PPy 本身具有較好的生物安全性[18-19],而殼聚糖經 N-乙酰化改性后,乙酰化本身也不會影響材料的生物安全性[12, 20]。本課題組前期研究提示納米 PPy/殼聚糖及改性的納米 PPy/殼聚糖材料均具有較好的體外生物相容性[10]。本研究將不同乙酰度的改性納米 PPy/殼聚糖導管材料植入大鼠皮下,通過組織學方法觀察植入材料體內組織相容性。結果顯示各組導管在植入早期均有較多淋巴細胞、巨噬細胞浸潤,隨著時間延長,淋巴細胞和巨噬細胞均逐漸減少,而成纖維細胞逐漸增多,膠原纖維增生明顯,血管順利長入,表明材料未對周圍組織產生明顯異物刺激和不良反應,具有較好的組織相容性。另一方面,一定程度的巨噬細胞聚集對 N-乙酰化改性殼聚糖的降解可能有促進作用。因為 N-乙酰化改性殼聚糖的降解主要是通過溶菌酶水解其糖苷鍵實現解聚[12, 20],而局部出現的巨噬細胞及其他炎癥細胞可在局部微環境釋放溶菌酶,對 N-乙酰化后的殼聚糖生物降解具有一定促進作用。
本研究制備的新型復合材料導管經檢測具備導電性能,其電導率與文獻報道的不同濃度 PPy 對應的電導率基本類似[11],增加 PPy 在復合材料中的濃度固然可以獲得更好導電性能,但考慮到 PPy 本身力學性能差、尚未發現可被體內某種酶降解、缺少活性基團等缺陷,目前研究常將納米 PPy 與其他可降解材料制備成復合材料[7, 11, 18],期望利用其小尺寸優勢能被排泄器官排出體外,但納米尺寸的粒子團聚問題尚無滿意解決方案,因而本研究在文獻報道基礎上在導電和降解之間進行選擇,采用 3%納米 PPy 制備導管材料,以期使導管在具備導電能力同時解決 PPy 的降解問題。
一般認為殼聚糖及甲殼素均具備降解性,但在一定脫乙酰度范圍內,其降解性能與脫乙酰度成負相關[20-21],文獻報道經過乙酰化改性的殼聚糖比殼聚糖本體具有更好的生物降解性,而且通過改變乙酰化程度可以控制殼聚糖的降解速率[12]。本研究結果與上述文獻報道結論相符,隨著乙酰度增加,導管降解有加快趨勢,這將有助于解決殼聚糖降解速度慢導致其在體內留存較長時間的問題,但是也不能片面追求降解速度而忽視神經再生對完整導管的依賴。
綜上述,本研究制備的新型復合材料導管具備較好的體內生物相容性、降解性,以及一定導電性能,初步具備作為組織工程神經支架材料的特性。下一步將通過橋接修復神經缺損實驗篩選合適的改性殼聚糖材料,使其既具有理想組織工程支架材料的生物相容性、適合支持神經再生的降解速度、良好的可塑性及生物安全性,又具備良好的導電性,為后續在導電材料基礎上引入低頻電刺激,使組織工程支架材料與電刺激的聯合應用成為可能,以提高周圍神經再生能力。
作者貢獻:焦海山負責實驗設計及實施,起草文章;宋悅寧負責實驗實施,數據分析,對文章的知識性內容作批評性審閱;黃健負責數據收集整理;胡毅負責實驗實施;李東印負責動物實驗。
利益沖突:所有作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
機構倫理問題:研究方案經蘇州衛生職業技術學院動物實驗倫理委員會批準(SWAE201906)。實驗動物使用許可證號:SYXK(蘇)2016-0049。