引用本文: 施翔文, 倪昊楠, 李明軍, 吳一芃, 徐永清. 長鏈非編碼RNA在成骨分化相關信號通路中的調控作用. 中國修復重建外科雜志, 2022, 36(4): 479-486. doi: 10.7507/1002-1892.202111098 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
人體骨組織具有新陳代謝的活動特征,并在整個生命過程中反復重建,以維持骨骼的動態平衡[1],此過程中成骨分化介導的骨形成和破骨細胞介導的骨吸收共同構成骨穩態的動態調節[2-3]。而成骨細胞和破骨細胞功能失衡都會導致包括骨質疏松癥、骨關節炎等在內的多種骨代謝性疾病,這使得誘導成骨分化成為治療骨代謝疾病的重要策略[4]。BMSCs、牙髓干細胞(dental pulp stem cells,DPSCs)、牙周膜干細胞(periodontal ligament stem cells,PDLSCs)等因具有優越的成骨分化潛能,成為成骨分化機制研究的常用細胞。已有研究表明,BMSCs成骨分化需要轉錄因子、信號通路和生物力學信號緊密配合,這種相互作用網絡失調可能會影響BMSCs向成骨細胞的分化,進而破壞骨代謝平衡[5],信號通路作為其中較為重要一環已成為機制研究的熱點。
長鏈非編碼RNA(long non-coding RNA,lncRNA)作為生物控制和病理過程中重要的調控分子,參與了成骨分化過程,并介導多家族多條信號通路調控成骨分化[6],包括Wnt、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和TGF-β等信號通路。本文總結了近年研究發現的 lncRNA 在成骨分化相關通路中的調控機制,以期為骨代謝疾病的分子靶向治療提供參考。
1 lncRNA的特征及生物學功能
lncRNA是一類轉錄本長度超過200個核苷酸的非編碼RNA,屬于RNA聚合酶Ⅱ轉錄副產物。由于缺乏開放的閱讀框架,lncRNA很少或根本不具備翻譯蛋白質的能力,而直接在RNA水平調節基因表達[7]。它具有與mRNA相似的生物學特性,如5’-端帽和3’-端多聚腺苷酸(PolyA)尾[8],因此也被稱為mRNA樣lncRNA[9]。相關研究表明,超過40%的人類基因組轉錄沒有PolyA尾[10],這意味著lncRNA的組成和分布更加多樣。同時作為一種序列結構復雜的RNA轉錄產物,lncRNA轉錄后廣泛存在于哺乳動物細胞質和細胞核中[11-12],已成為基因組學領域的研究焦點[13]。雖然lncRNA的研究還處于早期階段,但相比已被研究數年的微小RNA(microRNA,miRNA),lncRNA具有更長的分子序列、空間結構和多種作用模式[14],且大多數lncRNA的二級結構、剪接形式和亞細胞定位相對保守,這些都為更多探索性研究提供了條件[15]。lncRNA的分類主要依據基因組定位、介導表型、作用機制和亞細胞定位等指標,尚無統一標準。例如,根據其與鄰近蛋白編碼基因的位置關系,可以分為正義lncRNA、反義lncRNA、內含子lncRNA、雙向lncRNA及基因間lncRNA;根據功能,又可分為信號分子、誘餌分子、引物和骨架分子[16]。
在成骨分化中,lncRNA主要通過3個方面參與基因表達調控。① 轉錄水平的調控:lncRNA可以通過調控轉錄因子的結合和組裝[17]、形成帶有調控序列的三鏈復合物[18]、或者通過與RNA聚合酶Ⅱ結合而干擾轉錄過程3種方式,控制其他基因的轉錄。
② 轉錄后水平的調控:lncRNA的功能依賴于與大腦中高表達的RNA結合蛋白(RNA-binding proteins,RBP)的相互作用[19]。lncRNA與RBP結合形成大量lncRNA/RBP復合物,這些復合物可以募集各種蛋白質復合物和激活下游分子。有報道MEG3作為競爭內源性RNA(competing endogenous RNA,ceRNA)在轉錄后mRNA修飾過程中調節成骨基因的表達[20]。
③ 表觀遺傳調控:一方面,lncRNA可控制染色質重塑,將染色質修飾物募集至DNA靶點;另一方面,lncRNA作為組蛋白修飾復合物的載體,誘導其甲基化[21]。DNA甲基化可以直接調節矮小相關轉錄因子2(runt-related transcription factor 2,Runx2)和成骨相關轉錄因子抗體的表達,從而影響骨形成[22]。隨著基因測序技術的進步,過去十年越來越多研究證實lncRNA參與了多種生物學功能,包括腫瘤[23]、炎癥[24]及各種代謝性疾病[25]。一些lncRNA還具有作為疾病診斷分子標志物的巨大潛力[26]。同樣在骨外科學和口腔外科學領域,lncRNA對成骨分化的重要調控功能正逐步顯現[27]。
相關lncRNA種類繁多,調控機制復雜,許多研究表明lncRNA通過介導多條“明星”信號通路在調控成骨細胞分化中發揮重要作用,對骨穩態調節具有重要意義[28]。
2 lncRNA與相關信號通路
2.1 Wnt/β-catenin信號通路
Wnt/β-catenin信號通路是一條被廣泛研究且高度保守的“明星”通路,在包括細胞分化在內的細胞增殖、細胞凋亡等表型中發揮重要作用[29]。激活Wnt/β-catenin信號通路可促進成骨分化進程,進而促進骨修復,已經成為lncRNA重要的下游分子機制。Shen等[30]的研究顯示使用含短發夾RNA(short hairpin RNA,shRNA)的慢病毒沉默大鼠第3代BMSCs中lncRNA HOTAIR表達,可導致ALP活性升高,成骨相關標志物骨鈣素、骨橋蛋白、Runx2增多,顯著促進成骨分化;進一步研究顯示,HOTAIR下調還會導致Wnt/β-catenin通路相關蛋白β-catenin、細胞周期蛋白D1、癌基因表達增加,從而促進BMSCs的成骨分化。Chen等[31]研究發現,在DPSCs中過表達lncRNA DANCR后, Wnt/β-catenin信號通路被抑制,進而抑制了細胞成牙分化。Jiang等[32]也得出了類似結論,他們通過小干擾RNA(small interfering RNA,siRNA)干擾小鼠胚胎成骨細胞前體細胞(MC3T3-E1)中DANCR的表達,激活Wnt/β-catenin信號通路,進而增強細胞成骨分化能力,提示DANCR可能成為成骨相關疾病潛在治療靶點。Deng等[33]發現lncRNA MEG3可上調果蠅zeste基因增強子同源物(EZH2)的表達,并通過組蛋白H3中賴氨酸27的三甲基化(H3K27me3)直接抑制β-catenin和Wnt配體表達,從而減弱成骨分化能力。為了證實MEG3對脛骨骨折愈合的負調控,Liu等[34]從相反角度進行驗證,在小鼠脛骨骨折模型中沉默MEG3后發現可激活Wnt/β-catenin信號通路,組織學檢查和生物力學試驗結果顯示骨折愈合和功能恢復加快;在體外實驗中也得到相同結果。Yin等[35]基于生物信息學分析發現lncRNA AK039312和AK079370參與了成骨分化過程,這些lncRNA能抑制Wnt/β-catenin信號通路的兩個關鍵轉錄因子TGF-7、淋巴增強結合因子1,從而抑制MC3T3-E1細胞的成骨分化。此外,他們還證明了這兩種lncRNA作為miR-199B-5p的海綿,均可調節糖原合成酶激酶 3表達,進一步負調控Wnt/β-catenin信號通路,揭示了其調控MC3T3-E1細胞成骨分化的具體通路機制。lncRNA AK045490(AK0)是一種成骨細胞分化抑制劑。Li等[36]采用兩種骨質疏松小鼠模型進行的體內實驗表明,AK0在切除卵巢組和骨質疏松組的表達水平分別高于保留卵巢組和健康組,提示AK0表達水平升高與骨丟失有關;進一步機制研究顯示,AK0通過抑制β-catenin的核轉位,下調T細胞因子1(T cell factor 1,TCF1)、淋巴增強結合因子1和Runx2,進而阻斷β-catenin/TCF1/Runx2信號通路,最終抑制成骨細胞分化和新骨形成。
此外,還有很多lncRNA激活Wnt/β-catenin信號通路正向調控成骨分化。H19是第1個被發現的lncRNA,位于人類11號染色體上[37],能通過吸附和抑制miRNA的表達起到ceRNA的作用。Liang等[38]揭示了H19在成骨分化中的調控網絡,他們發現H19同時抑制miR-22和miR-141與β-catenin結合,上調Wnt/β-catenin/Runx2表達,從而促進BMSCs的成骨分化。進一步研究發現,H19可以作為miR-675前體通過剪切產生兩個成熟的miRNA(miR-675-5p和miR-675-3p),進而通過Wnt/β-catenin信號通路調節成骨分化。Liu等[39]研究發現抑制lncRNA TUG1可進一步抑制Wnt/β-catenin信號通路相關蛋白表達,進而降低成骨細胞分化能力,提示該lncRNA可能作為骨形成的正向調節因子。結直腸腫瘤差異表達基因(colorectal neoplasia differentially expressed, CRNDE)是一種與腫瘤相關的lncRNA,Mulati等[40]首次揭示了其在成骨分化中的調控機制。他們發現在體外MC3T3-E1細胞中CRNDE高表達,為了進一步驗證CRNDE在體內的作用,采用成簇規律間隔的短回文重復序列與相關蛋白9系統建立了CRNDE基因敲除小鼠,發現小鼠骨量明顯減少,而過表達CRNDE可通過激活Wnt/β-catenin信號通路恢復部分成骨細胞的分化功能,該結果提示了Wnt/β-catenin信號通路可能作為骨代謝疾病的有效治療靶點。同樣,Xiang等[41]探究了lncRNA小核仁RNA宿主基因1(small nucleolar RNA host gene 1, SNHG1)在成骨中的作用,發現miR-101和成骨相關基因在成骨過程中上調,而Dickkopf相關蛋白1(Dickkopf related protein 1,DKK1)和SNHG1表達下調,表明miR-101過表達可能通過降低DKK1和SNHG1的表達水平而抑制成骨細胞分化,揭示Wnt/β-catenin信號通路是SNHG1/miR-101軸下游調控成骨分化的重要機制。Gao等[42]通過核糖核酸下拉實驗證實lncRNA KCNQ1OT1通過激活 Wnt/β-catenin信號通路促進BMSCs成骨分化,進而減輕骨破壞。類似研究發現lncRNA P21也可通過Wnt/β-catenin信號通路促進大鼠骨質疏松模型中的成骨分化[43]。此外,在炎癥條件下經典Wnt信號通路負調控成骨分化,Wang等[44]利用lncRNA基因芯片分析發現lncRNA POIR在牙周炎患者的PDLSCs成骨分化過程中明顯下調,過表達POIR在體內外均可促進細胞成骨分化,潛在機制可能是POIR作為miR-182的ceRNA,可抑制miR-182靶基因叉頭框蛋白1,并通過與TCF4競爭結合β-catenin,從而抑制經典Wnt信號通路來促進骨形成,揭示了lncRNA-miRNA調控網絡在PDLSCs成骨分化中的作用機制。
多種lncRNA借由Wnt/β-catenin信號通路調控成骨分化,以上研究從細胞和動物水平證明Wnt/β-catenin信號通路的激活能有效減輕甚至逆轉骨破壞,被認為是骨重塑的關鍵通路。未來研究應聚焦其下游或上游相關分子對成骨分化的調控機制,結合激活或過表達Wnt/β-catenin信號通路策略,可能為骨重塑相關疾病的靶向治療提供更廣泛的思路。
2.2 TGF-β/Smad信號通路
TGF-β信號通路參與組織器官形成和組織修復,在調控細胞增殖分化和傷口愈合等方面發揮重要作用[45]。Qu等[46]通過轉錄組微陣列分析鑒定出2 171個在人PDLSCs成骨分化過程中差異表達的lncRNA,經過進一步生物信息學分析還發現一些與此分化過程交互的關鍵通路,包括MAPK和TGF-β信號通路,提示兩種通路可能交叉調控成骨分化。而Smad作為BMP和TGF-β信號的負調控因子也參與了成骨分化調控。lncRNA GAS5已被證明能負向調節脂肪細胞的分化[47],Li等[48]的研究發現了其在成骨分化中的作用,采用shRNA沉默GAS5后人BMSCs成骨分化能力明顯增強,而Smad1/5/8信號通路中的其他分子(如BMP-2、BMP-4、BMP-7)表達無差異,最終發現Smad7是GAS5上游移碼突變體復合體的作用靶點;其具體機制可能是GAS5通過與上游移碼突變體相互作用降解Smad7,最終促進成骨細胞分化,首次揭示了GAS5對成骨的保護機制。同樣,Wei等[49]在非創傷性股骨頭壞死的成骨分化過程中采用siRNA干擾HOTAIR表達,發現可通過上調miR-17-5p及下調下游靶基因Smad7的活性促進成骨分化。此外,Smad突變小鼠身體尺寸小于野生型小鼠,可能是由于成骨分化能力減弱導致[50]。
Zhang等[51] 探討了lncRNA尿路上皮癌相關基因1(urothelial cancer associated 1,UCA1)在成骨細胞分化中的作用,采用定量PCR檢測發現骨質疏松患者血清UCA1水平明顯高于健康人,進一步抑制UCA1后BMP-2/Smad1/5/8信號通路被激活,促進成骨細胞分化。鑒于lncRNA SNHG7在骨折愈合相關機制待闡明,學者們進行了相關研究。Chen等[52]研究發現與正常組織相比,股骨頸骨折組織中SNHG7表達水平明顯下調,敲除SNHG7后成骨活性下降,并可下調TGF受體2、Smad2磷酸化和Smad3磷酸化的表達,從而抑制TGF-β信號通路,為骨折治療提供了全新視角。另外,H19是miR-675的前體RNA,可通過miR-675下調TGF-1β表達,抑制Smad3磷酸化,進而下調組蛋白去乙酰化酶(histone deacetylase,HDAC)4/5,最終增強人BMSCs成骨標志物Runx2和骨鈣素的表達[6]。
TGF-β/Smad信號通路是lncRNA調控成骨分化過程中的關鍵通路,但目前研究多集中于腫瘤轉移領域,骨修復方向報道多限于單一通路蛋白。隨著分子生物學、藥理學等學科的發展,TGF-β信號通路家族具體作用機制會逐漸清晰,有望為骨代謝疾病的分子治療奠定基礎。
2.3 MAPK家族相關信號通路
據報道,MAPK家族參與調控BMSCs的分化、礦化和增殖[53]。生長分化因子5(growth differentiation factor 5,GDF5)是成骨過程中重要調節因子,Yang等[54]發現過表達GAS5可以促進人PDLSCs中GDF5的表達,進一步研究GAS5和GDF5對MAPK信號通路蛋白的調節,發現在GDF5下調的細胞中p38和JNK磷酸化減少,而在GAS5過表達的細胞中p38和JNK磷酸化增加。以上結果證實了GAS5通過GDF5和p38/JNK信號通路調控人PDLSCs成骨分化的新機制。DANCR已被證實通過Wnt信號通路調控成骨分化過程,Zhang等[55]研究發現在BMSCs成骨分化過程中DANCR表達水平下調,過表達DANCR后p38/MAPK信號通路失活,并導致BMSCs成骨能力減弱,使用p38特異性抑制劑SB203580處理后成骨能力恢復;DANCR通過p38/MAPK信號通路調節人BMSCs成骨分化,可能成為一個調控骨破壞性疾病的潛在靶點和調節因子。此外,H19也與MAPK信號通路密切相關,能直接與p53蛋白結合抑制p53活性,從而促進MSCs成骨分化[56]。MAPK信號通路在成骨分化調控中起重要作用,但目前研究相對較少,且相關通路蛋白較分散,未來需要聚焦相關聯MAPK信號通路蛋白的機制研究,以期探索其調控成骨分化的關鍵靶點。
2.4 其他成骨分化相關信號通路
NF-κB轉錄因子家族主要參與應激誘導、免疫和炎癥反應,研究表明NF-κB信號通路還參與了應激和炎癥條件下對成骨分化的調控。Wang等[44]報道NF-κB信號通路誘導的炎癥微環境造成了lncRNA POIR/miR-182調控網絡的失衡,進而影響成骨分化。此外,Lu等[57]研究了DANCR在牙周組織創傷應激性損傷狀態下的分子機制。結果表明,創傷應激通過下調MC3T3-E1細胞中DANCR的表達,激活NF-κB信號通路以發揮成骨分化抑制作用,而過表達DANCR可上調ALP和Runx2基因表達,一定程度上減輕了創傷應激對成骨分化的抑制作用。有研究證實MEG3可調節miR-133a-3p的表達,抑制絕經后骨質疏松誘導的BMSCs成骨分化[58]。Chen等[59]報道lncRNA DEPTOR骨質疏松發展過程中呈高表達狀態,用shRNA 沉默DEPTOR可通過上調MEG3表達激活BMP-4信號通路,進而抑制BMSCs成骨分化,而MEG3的敲除可削弱DEPTOR對BMP-4信號通路的激活作用,體內外研究結果均一致。NOTCH1信號通路的激活和阻斷會影響BMSCs的分化,Che等[60]分別從小鼠骨質疏松模型和骨質疏松患者組織分離培養BMSCs,lncRNA HCG18表達均增加,其通過靶向miR-30a-5p/NOTCH1軸抑制BMSCs成骨分化,但目前關于成骨分化中 NOTCH1信號通路及其相關lncRNA 的研究較少。此外,PI3K/AKT信號通路也與成骨分化有關,有研究表明,lncRNA MEG3作為ceRNA,通過吸附miR-27A-3p上調lncRNA IGF-1表達,激活PI3K/AKT信號通路而促進牙周炎環境下PDLSCs成骨分化[61]。
總體來說,NF-κB、BMP-4、NOTCH1以及PI3K/AKT均參與成骨分化調控,雖然與lncRNA相關的報道很少,但仍是今后研究成骨分化機制的潛在靶點。
3 小結與展望
目前lncRNA主要通過Wnt/β-catenin、MAPK、TGF-β/Smad、NF-κB、Notch、BMP-4及PI3K/AKT信號通路調控成骨分化,而信號通路的開放或關閉都可能影響整個骨形成過程,在骨代謝相關疾病的分子靶向治療中有較廣闊應用前景(表1、圖1)。但到目前為止,lncRNA在成骨分化中的調節機制尚未明確[62],分子靶向藥物研發面臨諸多難題。一是受限于體外和動物實驗模擬成骨分化條件,與臨床還存在較大差距;二是研究手段和技術限制使得大部分研究僅涉及單條通路,未能闡明整個信號通路系統或存在Cross-talk的信號通路;三是絕大部分研究聚焦于lncRNA對下游通路的調控,缺乏探索上游分子的調控機制。
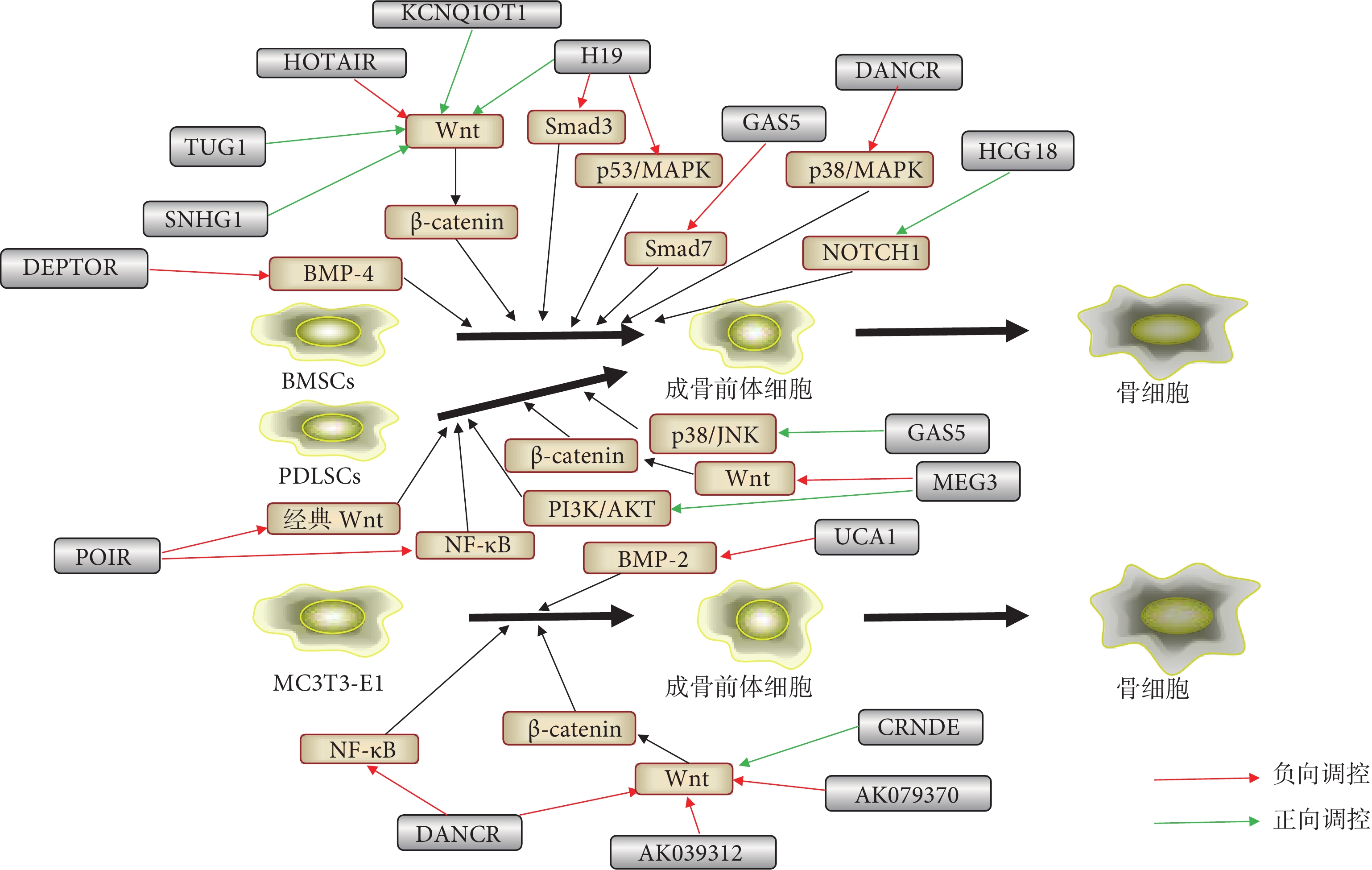
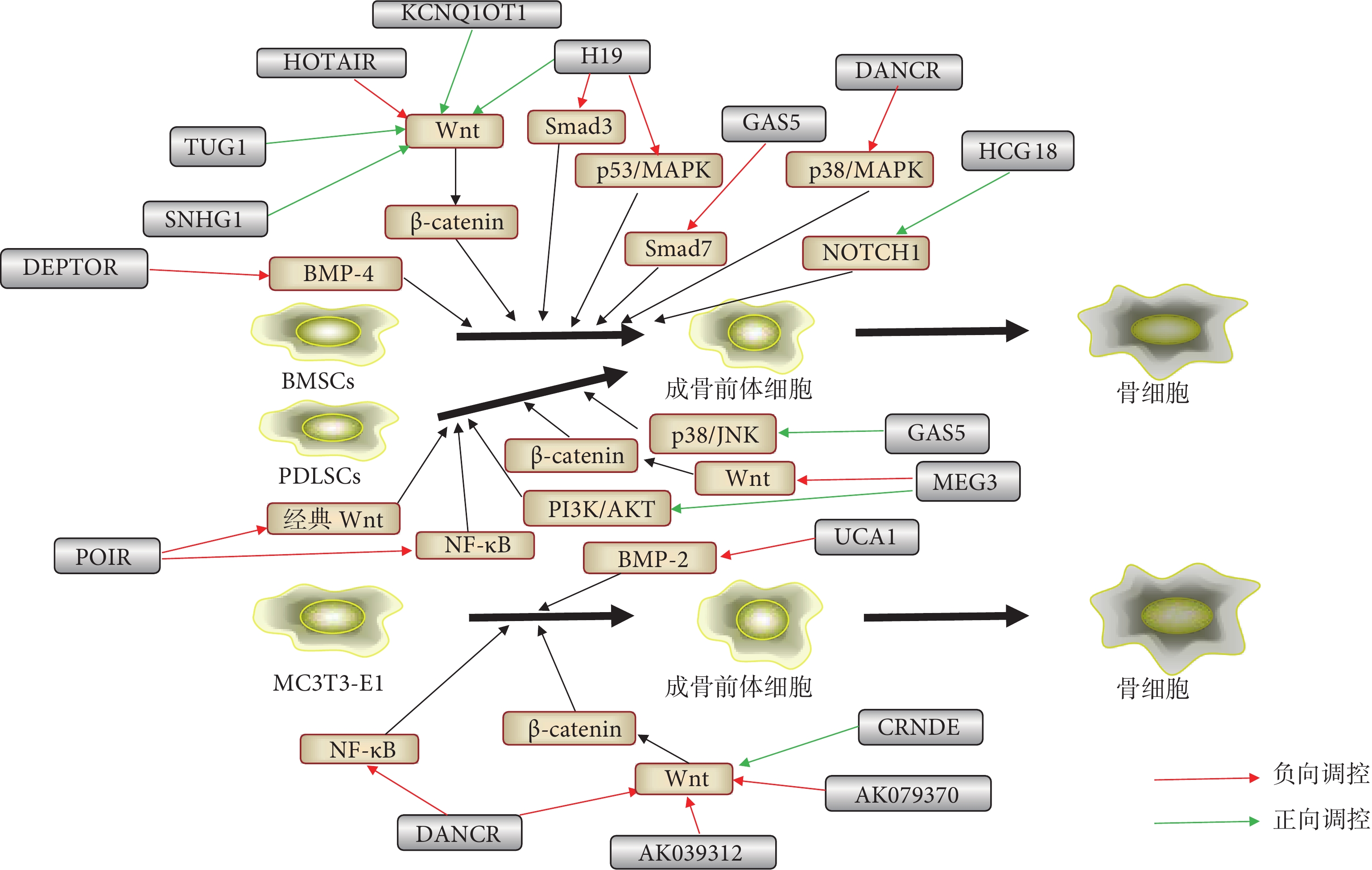 圖1
不同lncRNA在成骨分化過程中調控信號通路的示意圖
Figure1.
Schematic representation of different lncRNAs regulating signal pathways in the process of osteogenic differentiation
圖1
不同lncRNA在成骨分化過程中調控信號通路的示意圖
Figure1.
Schematic representation of different lncRNAs regulating signal pathways in the process of osteogenic differentiation
因此,未來lncRNA和相關信號通路在成骨分化方面的機制研究,有諸多發展方向值得探索。第一,lncRNA和miRNA作為相互競爭的ceRNA發揮信號通路調控功能;第二,在生物醫學領域迅速發展的lncRNA-蛋白質相互作用網絡[63],聯合多條通路間的Cross-talk可能成為未來研究趨勢;第三,尋求更契合人體成骨分化的動物模型和細胞條件,建立更為完備的lncRNA和相關信號通路數據庫。以上研究將為骨代謝的精準分子靶向治療臨床應用奠定可靠的理論基礎。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點及其報道
作者貢獻聲明 徐永清:綜述構思及思路設計;施翔文:觀點形成及撰寫文稿;倪昊楠:文獻查閱及信息提取;李明軍:收集相關資料;吳一芃:指導文章撰寫和修改
人體骨組織具有新陳代謝的活動特征,并在整個生命過程中反復重建,以維持骨骼的動態平衡[1],此過程中成骨分化介導的骨形成和破骨細胞介導的骨吸收共同構成骨穩態的動態調節[2-3]。而成骨細胞和破骨細胞功能失衡都會導致包括骨質疏松癥、骨關節炎等在內的多種骨代謝性疾病,這使得誘導成骨分化成為治療骨代謝疾病的重要策略[4]。BMSCs、牙髓干細胞(dental pulp stem cells,DPSCs)、牙周膜干細胞(periodontal ligament stem cells,PDLSCs)等因具有優越的成骨分化潛能,成為成骨分化機制研究的常用細胞。已有研究表明,BMSCs成骨分化需要轉錄因子、信號通路和生物力學信號緊密配合,這種相互作用網絡失調可能會影響BMSCs向成骨細胞的分化,進而破壞骨代謝平衡[5],信號通路作為其中較為重要一環已成為機制研究的熱點。
長鏈非編碼RNA(long non-coding RNA,lncRNA)作為生物控制和病理過程中重要的調控分子,參與了成骨分化過程,并介導多家族多條信號通路調控成骨分化[6],包括Wnt、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和TGF-β等信號通路。本文總結了近年研究發現的 lncRNA 在成骨分化相關通路中的調控機制,以期為骨代謝疾病的分子靶向治療提供參考。
1 lncRNA的特征及生物學功能
lncRNA是一類轉錄本長度超過200個核苷酸的非編碼RNA,屬于RNA聚合酶Ⅱ轉錄副產物。由于缺乏開放的閱讀框架,lncRNA很少或根本不具備翻譯蛋白質的能力,而直接在RNA水平調節基因表達[7]。它具有與mRNA相似的生物學特性,如5’-端帽和3’-端多聚腺苷酸(PolyA)尾[8],因此也被稱為mRNA樣lncRNA[9]。相關研究表明,超過40%的人類基因組轉錄沒有PolyA尾[10],這意味著lncRNA的組成和分布更加多樣。同時作為一種序列結構復雜的RNA轉錄產物,lncRNA轉錄后廣泛存在于哺乳動物細胞質和細胞核中[11-12],已成為基因組學領域的研究焦點[13]。雖然lncRNA的研究還處于早期階段,但相比已被研究數年的微小RNA(microRNA,miRNA),lncRNA具有更長的分子序列、空間結構和多種作用模式[14],且大多數lncRNA的二級結構、剪接形式和亞細胞定位相對保守,這些都為更多探索性研究提供了條件[15]。lncRNA的分類主要依據基因組定位、介導表型、作用機制和亞細胞定位等指標,尚無統一標準。例如,根據其與鄰近蛋白編碼基因的位置關系,可以分為正義lncRNA、反義lncRNA、內含子lncRNA、雙向lncRNA及基因間lncRNA;根據功能,又可分為信號分子、誘餌分子、引物和骨架分子[16]。
在成骨分化中,lncRNA主要通過3個方面參與基因表達調控。① 轉錄水平的調控:lncRNA可以通過調控轉錄因子的結合和組裝[17]、形成帶有調控序列的三鏈復合物[18]、或者通過與RNA聚合酶Ⅱ結合而干擾轉錄過程3種方式,控制其他基因的轉錄。
② 轉錄后水平的調控:lncRNA的功能依賴于與大腦中高表達的RNA結合蛋白(RNA-binding proteins,RBP)的相互作用[19]。lncRNA與RBP結合形成大量lncRNA/RBP復合物,這些復合物可以募集各種蛋白質復合物和激活下游分子。有報道MEG3作為競爭內源性RNA(competing endogenous RNA,ceRNA)在轉錄后mRNA修飾過程中調節成骨基因的表達[20]。
③ 表觀遺傳調控:一方面,lncRNA可控制染色質重塑,將染色質修飾物募集至DNA靶點;另一方面,lncRNA作為組蛋白修飾復合物的載體,誘導其甲基化[21]。DNA甲基化可以直接調節矮小相關轉錄因子2(runt-related transcription factor 2,Runx2)和成骨相關轉錄因子抗體的表達,從而影響骨形成[22]。隨著基因測序技術的進步,過去十年越來越多研究證實lncRNA參與了多種生物學功能,包括腫瘤[23]、炎癥[24]及各種代謝性疾病[25]。一些lncRNA還具有作為疾病診斷分子標志物的巨大潛力[26]。同樣在骨外科學和口腔外科學領域,lncRNA對成骨分化的重要調控功能正逐步顯現[27]。
相關lncRNA種類繁多,調控機制復雜,許多研究表明lncRNA通過介導多條“明星”信號通路在調控成骨細胞分化中發揮重要作用,對骨穩態調節具有重要意義[28]。
2 lncRNA與相關信號通路
2.1 Wnt/β-catenin信號通路
Wnt/β-catenin信號通路是一條被廣泛研究且高度保守的“明星”通路,在包括細胞分化在內的細胞增殖、細胞凋亡等表型中發揮重要作用[29]。激活Wnt/β-catenin信號通路可促進成骨分化進程,進而促進骨修復,已經成為lncRNA重要的下游分子機制。Shen等[30]的研究顯示使用含短發夾RNA(short hairpin RNA,shRNA)的慢病毒沉默大鼠第3代BMSCs中lncRNA HOTAIR表達,可導致ALP活性升高,成骨相關標志物骨鈣素、骨橋蛋白、Runx2增多,顯著促進成骨分化;進一步研究顯示,HOTAIR下調還會導致Wnt/β-catenin通路相關蛋白β-catenin、細胞周期蛋白D1、癌基因表達增加,從而促進BMSCs的成骨分化。Chen等[31]研究發現,在DPSCs中過表達lncRNA DANCR后, Wnt/β-catenin信號通路被抑制,進而抑制了細胞成牙分化。Jiang等[32]也得出了類似結論,他們通過小干擾RNA(small interfering RNA,siRNA)干擾小鼠胚胎成骨細胞前體細胞(MC3T3-E1)中DANCR的表達,激活Wnt/β-catenin信號通路,進而增強細胞成骨分化能力,提示DANCR可能成為成骨相關疾病潛在治療靶點。Deng等[33]發現lncRNA MEG3可上調果蠅zeste基因增強子同源物(EZH2)的表達,并通過組蛋白H3中賴氨酸27的三甲基化(H3K27me3)直接抑制β-catenin和Wnt配體表達,從而減弱成骨分化能力。為了證實MEG3對脛骨骨折愈合的負調控,Liu等[34]從相反角度進行驗證,在小鼠脛骨骨折模型中沉默MEG3后發現可激活Wnt/β-catenin信號通路,組織學檢查和生物力學試驗結果顯示骨折愈合和功能恢復加快;在體外實驗中也得到相同結果。Yin等[35]基于生物信息學分析發現lncRNA AK039312和AK079370參與了成骨分化過程,這些lncRNA能抑制Wnt/β-catenin信號通路的兩個關鍵轉錄因子TGF-7、淋巴增強結合因子1,從而抑制MC3T3-E1細胞的成骨分化。此外,他們還證明了這兩種lncRNA作為miR-199B-5p的海綿,均可調節糖原合成酶激酶 3表達,進一步負調控Wnt/β-catenin信號通路,揭示了其調控MC3T3-E1細胞成骨分化的具體通路機制。lncRNA AK045490(AK0)是一種成骨細胞分化抑制劑。Li等[36]采用兩種骨質疏松小鼠模型進行的體內實驗表明,AK0在切除卵巢組和骨質疏松組的表達水平分別高于保留卵巢組和健康組,提示AK0表達水平升高與骨丟失有關;進一步機制研究顯示,AK0通過抑制β-catenin的核轉位,下調T細胞因子1(T cell factor 1,TCF1)、淋巴增強結合因子1和Runx2,進而阻斷β-catenin/TCF1/Runx2信號通路,最終抑制成骨細胞分化和新骨形成。
此外,還有很多lncRNA激活Wnt/β-catenin信號通路正向調控成骨分化。H19是第1個被發現的lncRNA,位于人類11號染色體上[37],能通過吸附和抑制miRNA的表達起到ceRNA的作用。Liang等[38]揭示了H19在成骨分化中的調控網絡,他們發現H19同時抑制miR-22和miR-141與β-catenin結合,上調Wnt/β-catenin/Runx2表達,從而促進BMSCs的成骨分化。進一步研究發現,H19可以作為miR-675前體通過剪切產生兩個成熟的miRNA(miR-675-5p和miR-675-3p),進而通過Wnt/β-catenin信號通路調節成骨分化。Liu等[39]研究發現抑制lncRNA TUG1可進一步抑制Wnt/β-catenin信號通路相關蛋白表達,進而降低成骨細胞分化能力,提示該lncRNA可能作為骨形成的正向調節因子。結直腸腫瘤差異表達基因(colorectal neoplasia differentially expressed, CRNDE)是一種與腫瘤相關的lncRNA,Mulati等[40]首次揭示了其在成骨分化中的調控機制。他們發現在體外MC3T3-E1細胞中CRNDE高表達,為了進一步驗證CRNDE在體內的作用,采用成簇規律間隔的短回文重復序列與相關蛋白9系統建立了CRNDE基因敲除小鼠,發現小鼠骨量明顯減少,而過表達CRNDE可通過激活Wnt/β-catenin信號通路恢復部分成骨細胞的分化功能,該結果提示了Wnt/β-catenin信號通路可能作為骨代謝疾病的有效治療靶點。同樣,Xiang等[41]探究了lncRNA小核仁RNA宿主基因1(small nucleolar RNA host gene 1, SNHG1)在成骨中的作用,發現miR-101和成骨相關基因在成骨過程中上調,而Dickkopf相關蛋白1(Dickkopf related protein 1,DKK1)和SNHG1表達下調,表明miR-101過表達可能通過降低DKK1和SNHG1的表達水平而抑制成骨細胞分化,揭示Wnt/β-catenin信號通路是SNHG1/miR-101軸下游調控成骨分化的重要機制。Gao等[42]通過核糖核酸下拉實驗證實lncRNA KCNQ1OT1通過激活 Wnt/β-catenin信號通路促進BMSCs成骨分化,進而減輕骨破壞。類似研究發現lncRNA P21也可通過Wnt/β-catenin信號通路促進大鼠骨質疏松模型中的成骨分化[43]。此外,在炎癥條件下經典Wnt信號通路負調控成骨分化,Wang等[44]利用lncRNA基因芯片分析發現lncRNA POIR在牙周炎患者的PDLSCs成骨分化過程中明顯下調,過表達POIR在體內外均可促進細胞成骨分化,潛在機制可能是POIR作為miR-182的ceRNA,可抑制miR-182靶基因叉頭框蛋白1,并通過與TCF4競爭結合β-catenin,從而抑制經典Wnt信號通路來促進骨形成,揭示了lncRNA-miRNA調控網絡在PDLSCs成骨分化中的作用機制。
多種lncRNA借由Wnt/β-catenin信號通路調控成骨分化,以上研究從細胞和動物水平證明Wnt/β-catenin信號通路的激活能有效減輕甚至逆轉骨破壞,被認為是骨重塑的關鍵通路。未來研究應聚焦其下游或上游相關分子對成骨分化的調控機制,結合激活或過表達Wnt/β-catenin信號通路策略,可能為骨重塑相關疾病的靶向治療提供更廣泛的思路。
2.2 TGF-β/Smad信號通路
TGF-β信號通路參與組織器官形成和組織修復,在調控細胞增殖分化和傷口愈合等方面發揮重要作用[45]。Qu等[46]通過轉錄組微陣列分析鑒定出2 171個在人PDLSCs成骨分化過程中差異表達的lncRNA,經過進一步生物信息學分析還發現一些與此分化過程交互的關鍵通路,包括MAPK和TGF-β信號通路,提示兩種通路可能交叉調控成骨分化。而Smad作為BMP和TGF-β信號的負調控因子也參與了成骨分化調控。lncRNA GAS5已被證明能負向調節脂肪細胞的分化[47],Li等[48]的研究發現了其在成骨分化中的作用,采用shRNA沉默GAS5后人BMSCs成骨分化能力明顯增強,而Smad1/5/8信號通路中的其他分子(如BMP-2、BMP-4、BMP-7)表達無差異,最終發現Smad7是GAS5上游移碼突變體復合體的作用靶點;其具體機制可能是GAS5通過與上游移碼突變體相互作用降解Smad7,最終促進成骨細胞分化,首次揭示了GAS5對成骨的保護機制。同樣,Wei等[49]在非創傷性股骨頭壞死的成骨分化過程中采用siRNA干擾HOTAIR表達,發現可通過上調miR-17-5p及下調下游靶基因Smad7的活性促進成骨分化。此外,Smad突變小鼠身體尺寸小于野生型小鼠,可能是由于成骨分化能力減弱導致[50]。
Zhang等[51] 探討了lncRNA尿路上皮癌相關基因1(urothelial cancer associated 1,UCA1)在成骨細胞分化中的作用,采用定量PCR檢測發現骨質疏松患者血清UCA1水平明顯高于健康人,進一步抑制UCA1后BMP-2/Smad1/5/8信號通路被激活,促進成骨細胞分化。鑒于lncRNA SNHG7在骨折愈合相關機制待闡明,學者們進行了相關研究。Chen等[52]研究發現與正常組織相比,股骨頸骨折組織中SNHG7表達水平明顯下調,敲除SNHG7后成骨活性下降,并可下調TGF受體2、Smad2磷酸化和Smad3磷酸化的表達,從而抑制TGF-β信號通路,為骨折治療提供了全新視角。另外,H19是miR-675的前體RNA,可通過miR-675下調TGF-1β表達,抑制Smad3磷酸化,進而下調組蛋白去乙酰化酶(histone deacetylase,HDAC)4/5,最終增強人BMSCs成骨標志物Runx2和骨鈣素的表達[6]。
TGF-β/Smad信號通路是lncRNA調控成骨分化過程中的關鍵通路,但目前研究多集中于腫瘤轉移領域,骨修復方向報道多限于單一通路蛋白。隨著分子生物學、藥理學等學科的發展,TGF-β信號通路家族具體作用機制會逐漸清晰,有望為骨代謝疾病的分子治療奠定基礎。
2.3 MAPK家族相關信號通路
據報道,MAPK家族參與調控BMSCs的分化、礦化和增殖[53]。生長分化因子5(growth differentiation factor 5,GDF5)是成骨過程中重要調節因子,Yang等[54]發現過表達GAS5可以促進人PDLSCs中GDF5的表達,進一步研究GAS5和GDF5對MAPK信號通路蛋白的調節,發現在GDF5下調的細胞中p38和JNK磷酸化減少,而在GAS5過表達的細胞中p38和JNK磷酸化增加。以上結果證實了GAS5通過GDF5和p38/JNK信號通路調控人PDLSCs成骨分化的新機制。DANCR已被證實通過Wnt信號通路調控成骨分化過程,Zhang等[55]研究發現在BMSCs成骨分化過程中DANCR表達水平下調,過表達DANCR后p38/MAPK信號通路失活,并導致BMSCs成骨能力減弱,使用p38特異性抑制劑SB203580處理后成骨能力恢復;DANCR通過p38/MAPK信號通路調節人BMSCs成骨分化,可能成為一個調控骨破壞性疾病的潛在靶點和調節因子。此外,H19也與MAPK信號通路密切相關,能直接與p53蛋白結合抑制p53活性,從而促進MSCs成骨分化[56]。MAPK信號通路在成骨分化調控中起重要作用,但目前研究相對較少,且相關通路蛋白較分散,未來需要聚焦相關聯MAPK信號通路蛋白的機制研究,以期探索其調控成骨分化的關鍵靶點。
2.4 其他成骨分化相關信號通路
NF-κB轉錄因子家族主要參與應激誘導、免疫和炎癥反應,研究表明NF-κB信號通路還參與了應激和炎癥條件下對成骨分化的調控。Wang等[44]報道NF-κB信號通路誘導的炎癥微環境造成了lncRNA POIR/miR-182調控網絡的失衡,進而影響成骨分化。此外,Lu等[57]研究了DANCR在牙周組織創傷應激性損傷狀態下的分子機制。結果表明,創傷應激通過下調MC3T3-E1細胞中DANCR的表達,激活NF-κB信號通路以發揮成骨分化抑制作用,而過表達DANCR可上調ALP和Runx2基因表達,一定程度上減輕了創傷應激對成骨分化的抑制作用。有研究證實MEG3可調節miR-133a-3p的表達,抑制絕經后骨質疏松誘導的BMSCs成骨分化[58]。Chen等[59]報道lncRNA DEPTOR骨質疏松發展過程中呈高表達狀態,用shRNA 沉默DEPTOR可通過上調MEG3表達激活BMP-4信號通路,進而抑制BMSCs成骨分化,而MEG3的敲除可削弱DEPTOR對BMP-4信號通路的激活作用,體內外研究結果均一致。NOTCH1信號通路的激活和阻斷會影響BMSCs的分化,Che等[60]分別從小鼠骨質疏松模型和骨質疏松患者組織分離培養BMSCs,lncRNA HCG18表達均增加,其通過靶向miR-30a-5p/NOTCH1軸抑制BMSCs成骨分化,但目前關于成骨分化中 NOTCH1信號通路及其相關lncRNA 的研究較少。此外,PI3K/AKT信號通路也與成骨分化有關,有研究表明,lncRNA MEG3作為ceRNA,通過吸附miR-27A-3p上調lncRNA IGF-1表達,激活PI3K/AKT信號通路而促進牙周炎環境下PDLSCs成骨分化[61]。
總體來說,NF-κB、BMP-4、NOTCH1以及PI3K/AKT均參與成骨分化調控,雖然與lncRNA相關的報道很少,但仍是今后研究成骨分化機制的潛在靶點。
3 小結與展望
目前lncRNA主要通過Wnt/β-catenin、MAPK、TGF-β/Smad、NF-κB、Notch、BMP-4及PI3K/AKT信號通路調控成骨分化,而信號通路的開放或關閉都可能影響整個骨形成過程,在骨代謝相關疾病的分子靶向治療中有較廣闊應用前景(表1、圖1)。但到目前為止,lncRNA在成骨分化中的調節機制尚未明確[62],分子靶向藥物研發面臨諸多難題。一是受限于體外和動物實驗模擬成骨分化條件,與臨床還存在較大差距;二是研究手段和技術限制使得大部分研究僅涉及單條通路,未能闡明整個信號通路系統或存在Cross-talk的信號通路;三是絕大部分研究聚焦于lncRNA對下游通路的調控,缺乏探索上游分子的調控機制。
 圖1
不同lncRNA在成骨分化過程中調控信號通路的示意圖
Figure1.
Schematic representation of different lncRNAs regulating signal pathways in the process of osteogenic differentiation
圖1
不同lncRNA在成骨分化過程中調控信號通路的示意圖
Figure1.
Schematic representation of different lncRNAs regulating signal pathways in the process of osteogenic differentiation
因此,未來lncRNA和相關信號通路在成骨分化方面的機制研究,有諸多發展方向值得探索。第一,lncRNA和miRNA作為相互競爭的ceRNA發揮信號通路調控功能;第二,在生物醫學領域迅速發展的lncRNA-蛋白質相互作用網絡[63],聯合多條通路間的Cross-talk可能成為未來研究趨勢;第三,尋求更契合人體成骨分化的動物模型和細胞條件,建立更為完備的lncRNA和相關信號通路數據庫。以上研究將為骨代謝的精準分子靶向治療臨床應用奠定可靠的理論基礎。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點及其報道
作者貢獻聲明 徐永清:綜述構思及思路設計;施翔文:觀點形成及撰寫文稿;倪昊楠:文獻查閱及信息提取;李明軍:收集相關資料;吳一芃:指導文章撰寫和修改