引用本文: 方向, 雷森林, 羅翼, 周勇, 閔理, 張聞力, 屠重棋, 段宏. 基于三維多模態影像的3D打印技術輔助肢體惡性骨腫瘤手術研究. 中國修復重建外科雜志, 2022, 36(7): 804-810. doi: 10.7507/1002-1892.202202060 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
肢體惡性骨腫瘤的保肢治療是以手術為基礎的綜合治療[1-2],其中手術成功的關鍵是在保證良好廣泛切除邊界的同時實現功能重建[3-4]。傳統惡性骨腫瘤手術設計主要是術者根據不同模態的腫瘤影像數據結合個人經驗完成,存在術者主觀性較強,手術設計不夠精確的問題。
三維多模態影像技術能在三維層面清楚顯示腫瘤及周圍解剖結構,包括腫瘤骨組織邊界、軟組織邊界、骨與軟組織的水腫邊界范圍,以及重建包括腫瘤周圍臟器、血管和神經的三維模型,術者可以基于該模型客觀且精準地設計惡性骨腫瘤切除重建方案。我院于2012年開始將三維多模態影像技術用于復雜骨盆惡性腫瘤手術規劃中,并結合3D打印技術輔助手術,取得了良好初步療效[5-6]。在此基礎上,于2015年開始將其應用于肢體惡性骨腫瘤手術規劃并輔助手術。現回顧性分析2016年1月—2019年1月采用上述方法治療的肢體惡性骨腫瘤患者臨床資料,總結其可行性及有效性,為進一步臨床推廣奠定基礎。報告如下。
1 臨床資料
1.1 一般資料
患者納入標準:① 年齡≥14歲;② 初治的肢體原發惡性骨腫瘤;③ 初治的肢體骨轉移瘤且原發灶已行根治性治療;④ 腫瘤無遠處轉移;⑤ 選擇根治性保肢手術;⑥ 腫瘤直徑>10 cm且鄰近重要血管神經;⑦ 采用基于三維多模態影像的3D打印技術輔助手術;⑧ 臨床資料完整。排除不配合治療及隨訪者。2016年1月—2019年1月,15例患者符合選擇標準納入研究。
本組男6例,女9例;年齡17~73歲,中位年齡34歲。術前均行病理活檢明確診斷,其中骨肉瘤5例、軟骨肉瘤3例、尤文肉瘤2例、血管肉瘤1例、造釉細胞瘤1例、轉移性癌3例。Enneking分期:ⅡA期11例,ⅡB期4例。腫瘤部位:肱骨5例,尺骨2例,股骨3例,脛骨5例。病程2~8個月,中位病程4個月。
1.2 術前準備
1.2.1 三維多模態影像重建
術前患者行病灶部位CT增強掃描、MRI增強掃描和MR神經成像(magnetic resonance neurography,MRN)。采集上述影像數據以DICOM格式導入開源免費軟件Advanced Normalization Tools (ANTs;http://stnava.github.io/ANTs/), 通過“Affine”以及“Diffeomorphic registration”算法自動將MRI增強掃描及MRN圖像配準至CT圖像上。若自動配準效果欠佳,則采取手動輔助配準,參考點通常選取在CT增強掃描、MRI增強掃描以及MRN圖像上顯示效果均良好、且位置相對固定的結構,如動脈分叉處等。圖像配準質檢:通過手動測量關鍵解剖結構(如血管、神經、腫瘤、水腫范圍)的橫截面絕對重疊百分比(完全重疊橫截面面積/原始DICOM格式圖像的橫截面面積×100%),該值應達95%以上;若<95%則通過手動檢查并增加參考點等方式進行調整,直至>95%。
在開源免費軟件3D Slicer 4.11(www.slicer.org)中,通過“Level-set”、“Region-grow”、“Threshold control”等算法進行半自動圖像分割,主要結構包括腫瘤、水腫范圍、血管、神經等。圖像分割質檢:在橫截面上,通過手動測量已分割完成的關鍵解剖結構與原始DICOM格式圖像的最大偏移距離,保證其<1.5 mm;若該偏移距離>1.5 mm,則通過手動校正直至<1.5 mm。
最后將分割完成的模型,包括腫瘤的骨組織邊界、軟組織邊界、骨與軟組織水腫范圍、肌肉組織,以及腫瘤周圍重要血管和神經等,以.obj格式導入至3-matic 11.0軟件(Materialise公司,比利時),構建三維多模態影像模型。
1.2.2 計算機模擬手術
在三維多模態影像模型上進行計算機模擬手術,如腫瘤的骨組織切除邊界及軟組織切除范圍、保關節與否、可能損傷的重要血管神經及對應的安全手術入路、手術入路可能經過的軟組織腫瘤邊界及具體肌間隙層面等。綜合肢體功能重建要求,獲得最佳手術入路及手術切除范圍。需要說明的是,在本研究中腫瘤邊界包括兩方面內容,一個是腫瘤骨組織邊界,以MRI上腫瘤骨組織水腫范圍為邊界;另一個是腫瘤軟組織邊界,即腫瘤在MRI上的軟組織包塊為邊界。上述兩部分內容均已重建在三維多模態影像模型上。安全切除邊緣設計需要超出腫瘤在骨組織的水腫邊界至少1~2 cm,腫瘤的軟組織部分切緣設計需要保證腫瘤表面有正常軟組織覆蓋。
1.2.3 3D打印手術導板及假體設計
在計算機模擬手術明確切除范圍基礎上,結合三維多模態影像模型,設計對軟組織剝離最少、對血管神經牽拉最輕、對骨面最貼服、對術者操作角度最方便的個性化手術導板。
虛擬切除腫瘤后,設計具有良好初始穩定性和生物力學性能的3D打印個性化假體。結合三維多模態影像模型,根據腫瘤切除后的軟組織覆蓋及重要血管神經走行,微調假體表面微結構。必要時設計輔助假體安放的個性化手術導板。
1.2.4 體外模擬手術
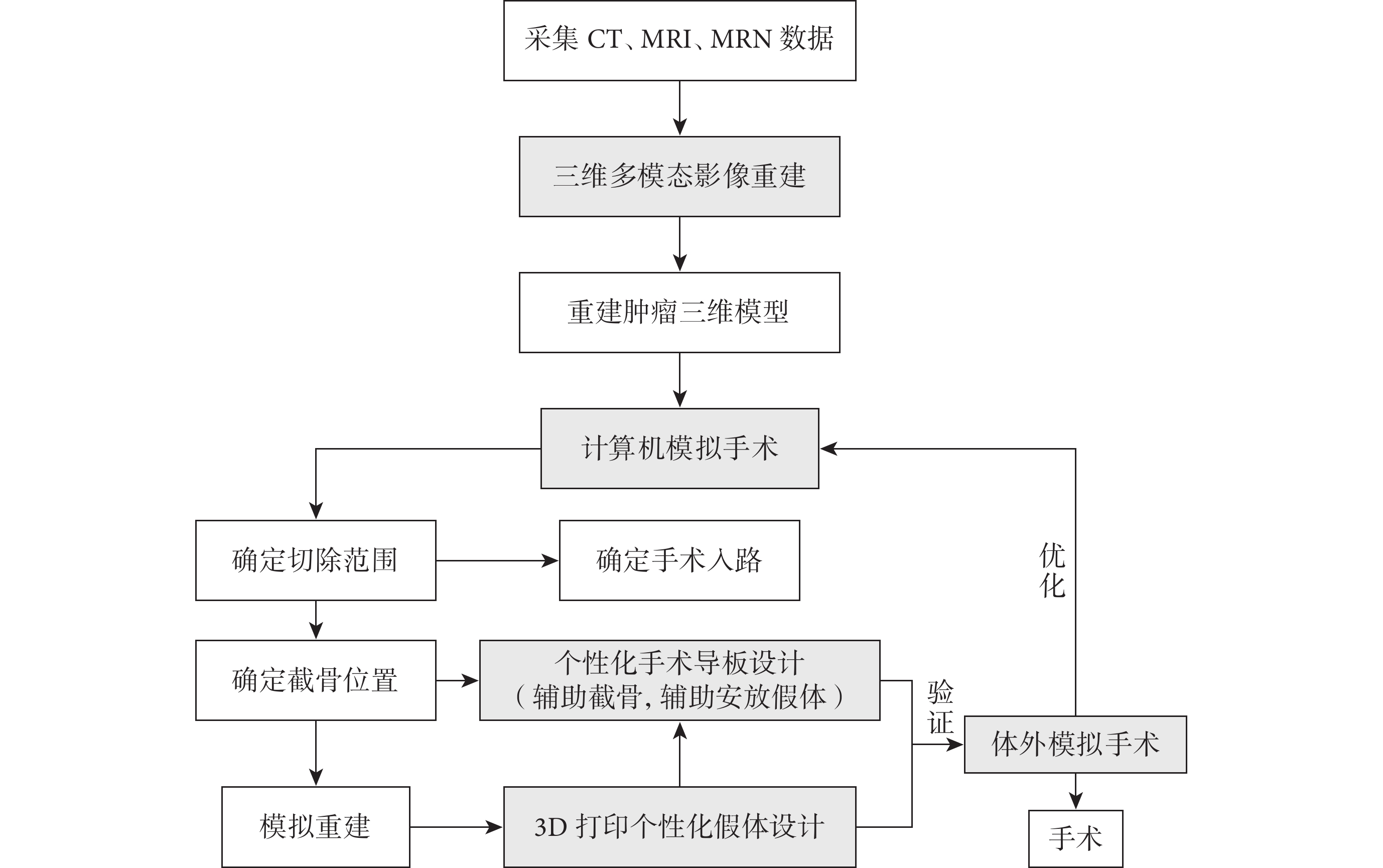
3D打印骨腫瘤模型、切除后重建模型、手術導板和個性化假體。其中,骨腫瘤模型包括完整骨組織、腫瘤和水腫范圍;切除后重建模型包括腫瘤切除后的剩余骨組織及切除的瘤段。測試手術導板的貼附情況,判斷假體設計的初始穩定性及生物力學性能,并據此進行相應設計優化。完整技術流程見圖1。注意原發惡性骨腫瘤患者手術規劃是根據新輔助化療前影像學檢查結果設計[7-8]。
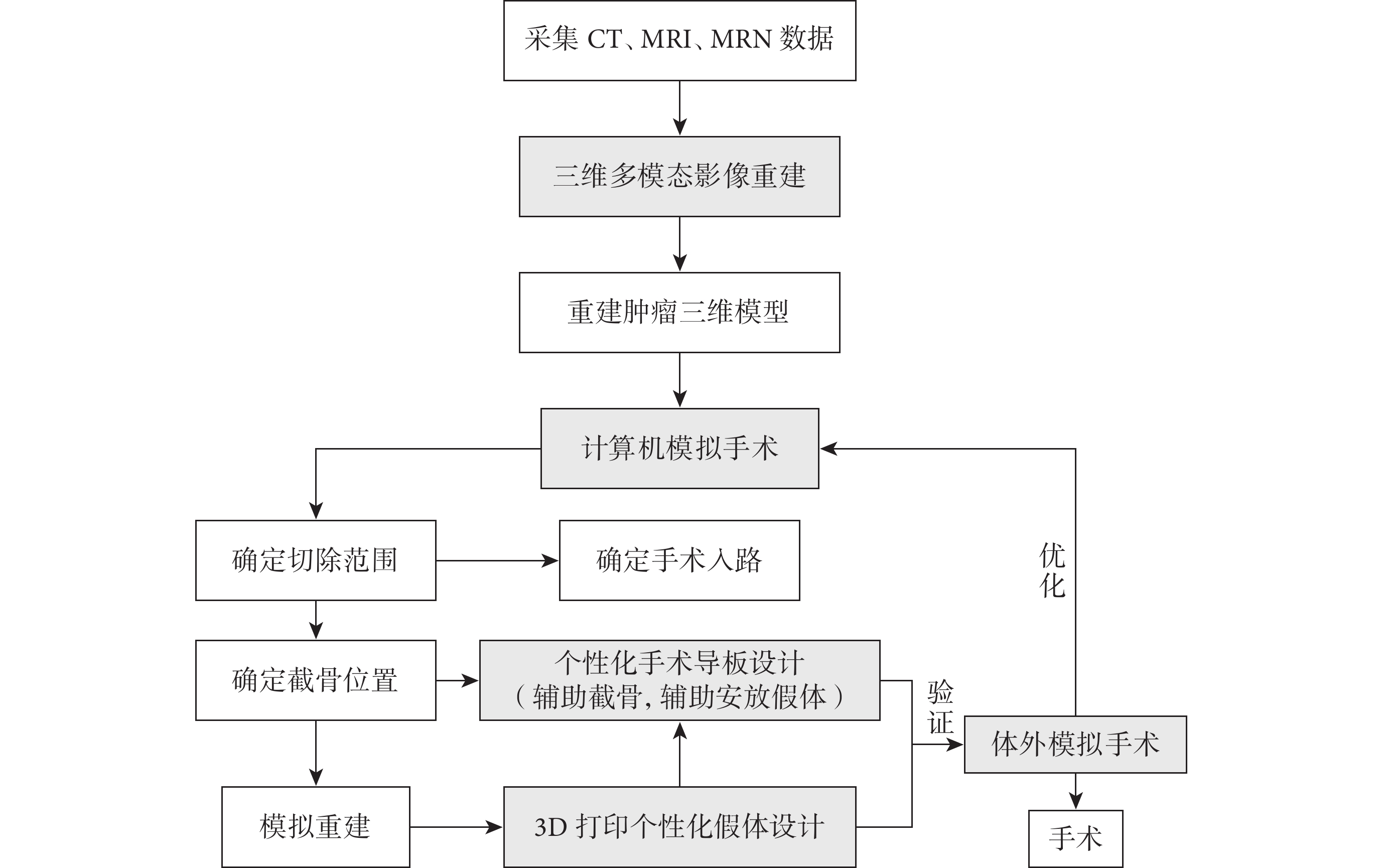 圖1
三維多模態影像輔助肢體惡性骨腫瘤保肢手術的技術流程圖
Figure1.
The workflow of 3D multimodality imaging for limb salvage surgery of maglignant bone tumor
圖1
三維多模態影像輔助肢體惡性骨腫瘤保肢手術的技術流程圖
Figure1.
The workflow of 3D multimodality imaging for limb salvage surgery of maglignant bone tumor
1.3 手術方法
根據肢體骨腫瘤常見手術入路,并結合術前規劃所設計的手術入路及注意事項實施手術[9]。暴露預定截骨段后,再次判斷截骨位置,確認無誤后使用個性化手術導板完成截骨。對于骨干中段等可能存在導板貼附不良等情況的部位,術中可采用手工測量,必要時結合3D打印骨腫瘤模型輔助完成導板貼附與截骨。最后使用個性化假體進行功能重建。本組膝關節置換2例,半肩關節置換2例,尺骨近端置換2例,保留關節干假體置換9例(肱骨3例、股骨1例、脛骨5例)。
1.4 圍術期處理及療效評價指標
根據腫瘤類型選擇相應的新輔助化療、術后化療、靶向治療等。其中,5例骨肉瘤、2例尤文肉瘤、1例血管肉瘤采用新輔助化療+術后化療;3例轉移性癌根據原發灶使用靶向藥物。術中和術后預防性應用抗生素。術后采用非甾體類抗炎藥鎮痛,必要時使用阿片類止痛藥。通常于術后3 d開始康復訓練并逐步增加訓練強度。具體肢體負重時間及強度根據假體設計、術中情況及術后切口恢復情況綜合決定。
記錄腫瘤切除外科邊界、手術時間、術中失血量、手術并發癥發生情況、美國肌肉骨骼腫瘤學會(MSTS)評分及腫瘤局部復發情況[10]。
2 結果
15例患者均按術前規劃完成手術,外科邊界均獲得廣泛切除邊界。手術時間80~240 min,中位數150 min。術中失血量100~400 mL,中位數200 mL。無術中重要血管、神經損傷導致肢體功能明顯受限發生。1例切口淺表感染,經換藥后愈合;其余患者切口均Ⅰ期愈合。
患者均獲隨訪,隨訪時間6~48個月,中位數24個月。其中2例患者因肺轉移分別于術后6、24個月死亡。隨訪期間未出現局部復發,無假體脫位及松動等并發癥發生。末次隨訪時MSTS評分為23~30分,平均25分。見圖2、3。
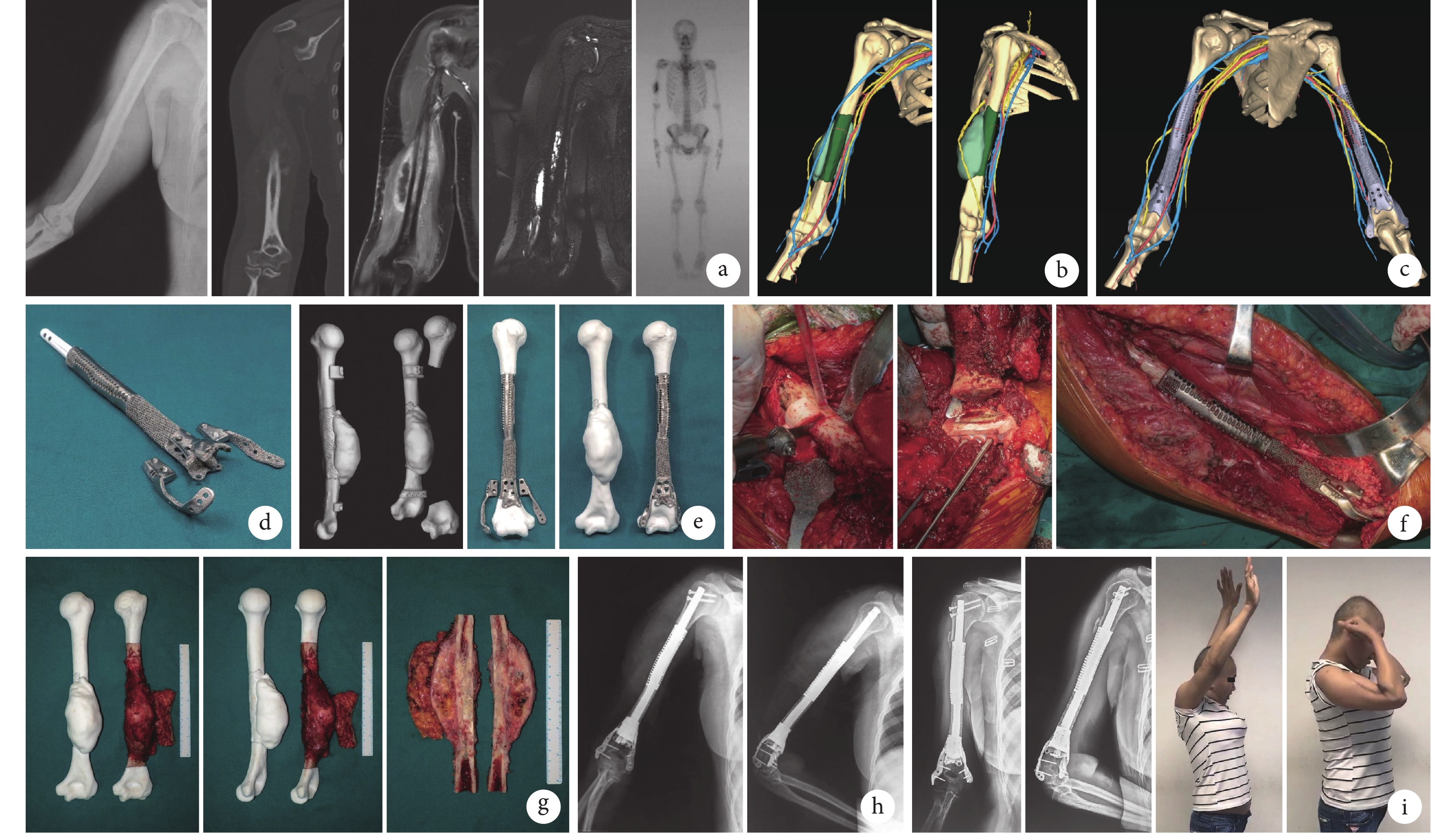
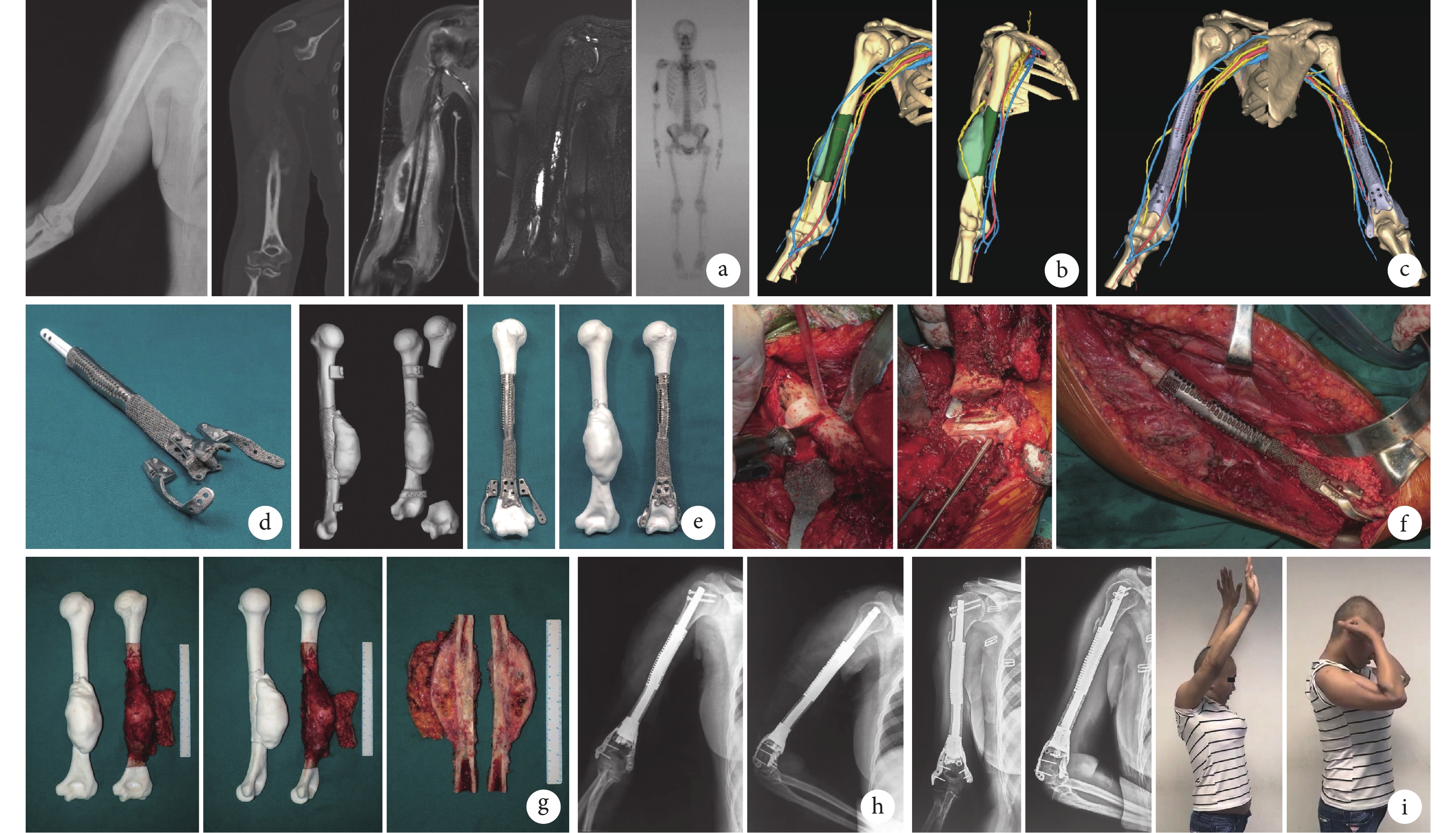 圖2
患者,女,44歲,肱骨骨肉瘤(EnnekingⅡA期)
圖2
患者,女,44歲,肱骨骨肉瘤(EnnekingⅡA期)
a. 術前X線片、CT增強掃描、MRI增強掃描、MRN及全身骨掃描;b. 三維多模態影像(綠色:腫瘤及水腫;黃色:神經;藍色、紅色:血管);c. 計算機模擬手術,其中近、遠端切緣分別距離水腫邊界4、2 cm;d. 3D打印假體;e. 個性化手術導板與體外模擬手術;f. 術中個性化手術導板輔助截骨、3D打印假體功能重建;g. 切除的腫瘤標本與3D打印腫瘤模型;h. 術后即刻X線片;i. 術后4個月X線片及肢體功能
Figure2. A 44-year-old female patient with osteosarcoma of the humerus (Enneking stageⅡA)a. Preoperative X-ray film, enhanced CT, enhanced MRI, magnetic resonance neurography, and whole body scan; b. 3D multimodality imaging (green: bone tumor and edema; yellow: nerves; blue and red: vessels); c. Computer-assisted surgical planning, the proximal and distal margin distances were 4 cm and 2 cm, respectively; d. 3D printed prosthesis; e. Personalized special instrument and in vitro simulation of surgery; f. Intraoperative view of personalized special instrument aiding surgery, and functional reconstruction with 3D printed prosthesis; g. Tumor specimen and 3D printed tumor model; h. X-ray film at immediate after operation; i. X-ray film and limb function at 4 months after operation
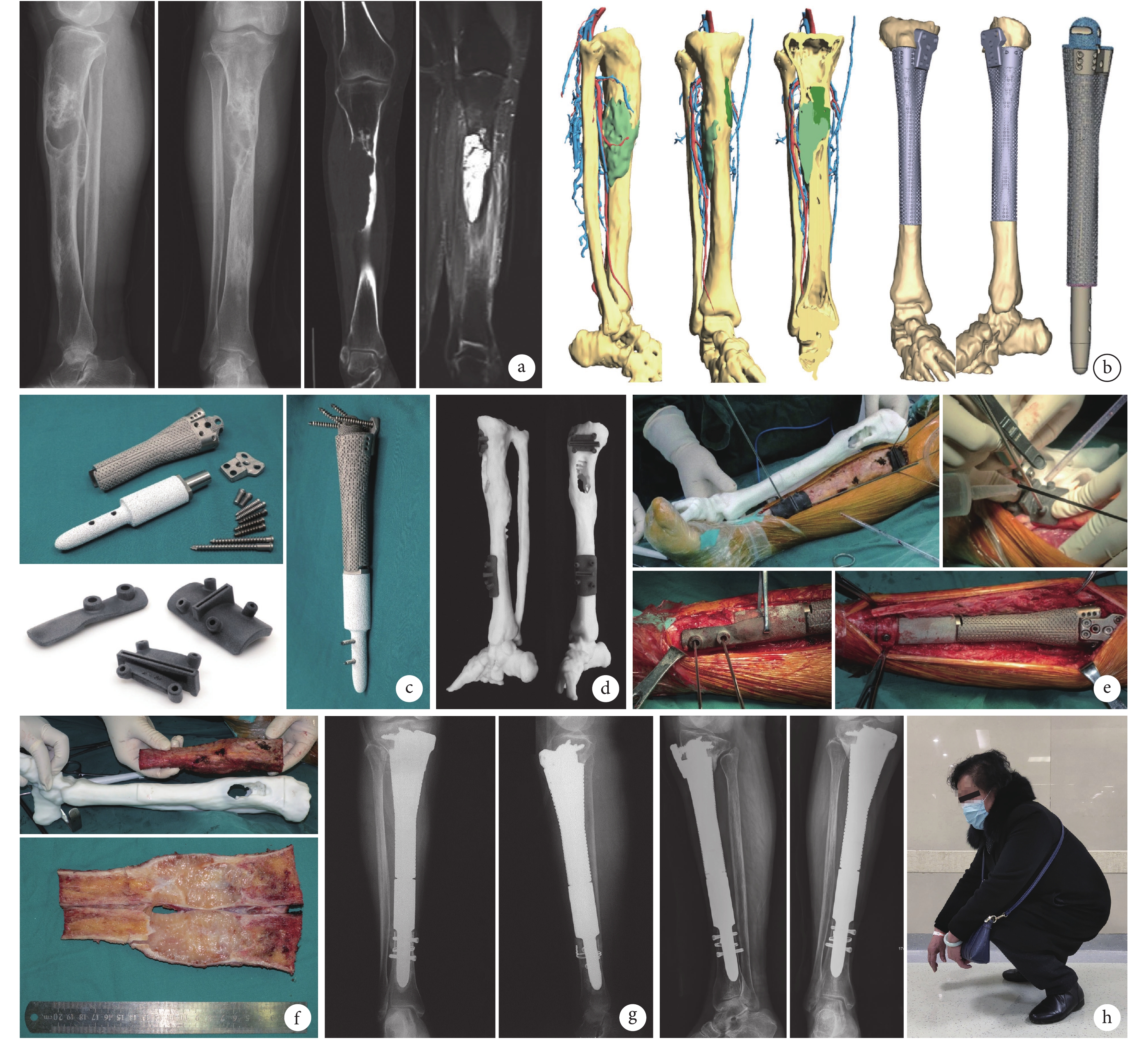
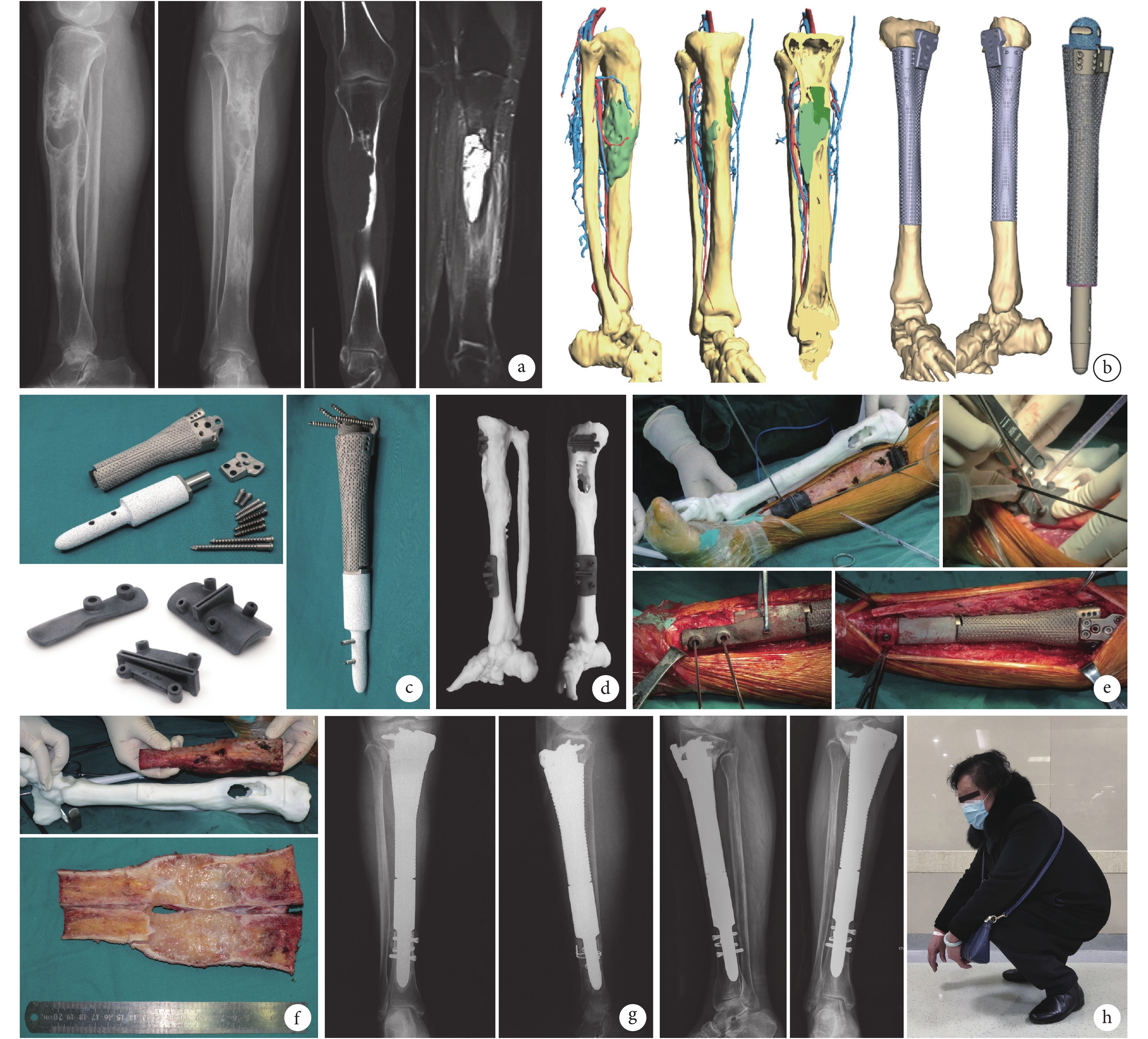 圖3
患者,女,73歲,脛骨中段造釉細胞瘤(EnnekingⅡA期)
圖3
患者,女,73歲,脛骨中段造釉細胞瘤(EnnekingⅡA期)
a. 術前X線片、CT增強掃描、MRI增強掃描;b. 三維多模態影像和計算機模擬手術,其中近、遠端切緣分別距離水腫邊界1.5、4.0 cm;c. 3D打印假體及個性化手術導板;d. 體外模擬手術;e. 術中個性化手術導板輔助截骨及固定、3D打印假體功能重建;f. 切除的腫瘤標本以及脛骨模型;g. 術后即刻X線片;h. 術后25個月X線片及肢體功能
Figure3. A 73-year-old female patient with ameloblastoma of the middle tibia (Enneking stageⅡA)a. Preoperative X-ray films, enhanced CT, and enhanced MRI; b. 3D multimodality imaging and computer-assisted surgical planning, the proximal and distal margin distances were 1.5 cm and 4.0 cm, respectively; c. 3D printed prosthesis and personalized special instrument; d. In vitro simulation of surgery; e. Intraoperative view of personalized special instrument aiding osteotomy and fixation of nails, and functional reconstruction with 3D printed prosthesis; f. Tumor specimen and 3D printed tibia model; g. X-ray film at immediate after operation; h. X-ray films and limb function at 25 months after operation
3 討論
近10年來,3D打印和計算機導航等新興技術蓬勃發展,不斷地將骨腫瘤手術切除重建準確性提到新高度[11-16]。然而,在骨腫瘤外科領域,精確手術切除和精準功能重建并非當前精準醫療的全部,精細的術前影像評估同樣非常重要。
目前,骨腫瘤的術前評估主要依賴于多種影像學。多排螺旋CT空間分辨率高,能清晰顯示骨骼及血管受累情況,但是對軟組織不敏感。MRI能補充前者不足,準確反映軟組織層次,特別是腫瘤、水腫范圍以及神經走行。在傳統術前評估中,術者需要從CT、MRI和MRN等不同模態的影像數據中提取關鍵信息。通常以骨組織為著眼點,即以CT數據為基礎進行三維重建,模擬手術切除重建;在此過程中術者需要不斷參考和比對二維MRI以及MRN圖像,以保證獲得安全手術切除邊界。雖然閱讀二維影像是外科醫生的基本功,但是多模態數據經過計算機系統整合處理后,其信息豐富程度以及可靠性遠超傳統人腦合成[17]。傳統人腦合成非常依賴術者經驗,甚至可能存在人為因素導致的主觀性偏差。因此,理論上三維多模態影像能夠使術前規劃更客觀而精細化,如可以更好地設計切緣、規避腫瘤原因以及先天各種解剖變異產生的手術操作風險、降低血管神經損傷風險、避免切進骨腫瘤的軟組織包塊中等,從而為精確手術切除和功能重建奠定基礎。除此以外,精細化術前規劃有效避免了術中臨時更改決策,從而節省手術時間、減少術中出血,加速患者術后康復。
在骨腫瘤外科領域,三維多模態影像最早應用于巨大骨盆惡性腫瘤[5-6]。此類腫瘤體積大、侵襲范圍廣,且常伴有周圍重要血管、神經及臟器受累[18]。三維多模態影像能在三維層面清晰地顯示上述結構,特別是軟組織邊界、水腫范圍和神經。所以,基于三維多模態影像的術前規劃能有效降低腫瘤邊界切除不夠、切進骨腫瘤的軟組織部分以及神經損傷的情況。而這也是傳統基于CT三維重建+二維MRI術前評估比較困難的部分。因此,骨盆惡性腫瘤是使用三維多模態影像進行術前規劃的最佳適應證之一。本研究中,納入的肢體惡性骨腫瘤直徑均超過10 cm且鄰近重要血管神經,同時大部分伴有腫瘤性軟組織包塊。所有患者均取得了良好手術切除邊界,術后早期隨訪也無局部復發,無術中重要神經損傷致肢體功能障礙的情況發生,提示基于三維多模態影像的術前規劃對于提高肢體腫瘤學預后以及減少血管神經損傷等手術并發癥具有一定價值。
基于三維多模態影像的術前評估和手術規劃,除了能夠提高腫瘤學預后,還對控制術中出血以及手術時間具有積極意義。由于三維多模態影像能綜合利用CT增強掃描、MRI增強掃描、MRN的優勢,在術前規劃方面具有較高指導性,相比傳統 CT三維重建+二維MRI模式,術前規劃內容更豐富而具體,如軟組織的三維切除范圍、可能損傷的重要血管神經三維位置及對應的安全手術入路、手術入路可能經過的軟組織腫瘤邊界。通過在三維層面的分析,可避免損傷重要血管神經,減少術中“走一步,看一步”的情況,從而達到真正提前設計手術。裴延軍等[19]為5例脛骨和1例股骨惡性腫瘤患者實施3D打印個性化假體重建手術,平均手術時間165.83 min、平均術中失血量233.33 mL。本組患者手術時間80~240 min,術中失血量100~400 mL。上述研究結果均體現了三維多模態影像在出血控制和手術時間方面是有益的。
本研究中,我們除了使用三維多模態影像進行計算機模擬手術,還進行了3D打印個性化導板和假體設計。在此過程中,三維多模態影像的價值主要體現在3D打印導板設計上。在傳統基于CT截骨導板設計時,由于截骨平面已確定,術者或工程師會單純基于骨組織進行導板設計[20-21],在此過程中通常不再參考二維MRI數據。事實上,導板安放附近軟組織剝離多少、操作角度方便與否、對附近血管神經牽拉程度如何,都與個性化導板設計的尺寸和形態有關。單純基于骨組織設計,很難同時考慮到以上問題。當然,與上述問題相關的額外手術創傷、手術操作方便程度,目前沒有客觀有效評價指標,實際意義尚不明確,還需要進一步研究。而在假體設計方面,三維多模態影像主要參與微調假體表面微結構,如根據腫瘤切除后的軟組織覆蓋及重要血管神經走行,對鄰近區域假體表面進行光滑處理、設置凹槽等。其對初始穩定性、生物力學功能可能無明顯影響[22]。本研究中患者術后肢體功能MSTS評分平均為25分,與文獻報道基本一致,也符合上述理論猜想[19, 23-25]。
基于三維多模態影像進行計算機模擬手術、設計3D打印個性化導板和假體,有利于實現腫瘤術前精準化評估,進而為實現精準而完整切除腫瘤、解剖學和功能學重建以及減少手術并發癥創造有利條件。本研究不足之處:惡性骨腫瘤發病率低,樣本量小;由于發病部位遍及全身,即使同一塊骨骼的切除重建也可能存在巨大差異,因此異質性大、無法設置具有相同基線的對照組。我們會在未來開展多中心大型臨床研究,以進一步研究基于三維多模態影像的3D打印技術在惡性骨腫瘤手術中的應用價值。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
倫理聲明 研究方案經四川大學華西醫院生物醫學倫理審查委員會批準(2019-1062),患者均簽署知情同意書
作者貢獻聲明 段宏、屠重棋、張聞力、閔理、周勇:參與研究設計和手術;方向、雷森林、羅翼:參與研究實施、數據收集分析,起草文章;段宏、屠重棋、張聞力:對文章的知識性內容作批評性審閱
肢體惡性骨腫瘤的保肢治療是以手術為基礎的綜合治療[1-2],其中手術成功的關鍵是在保證良好廣泛切除邊界的同時實現功能重建[3-4]。傳統惡性骨腫瘤手術設計主要是術者根據不同模態的腫瘤影像數據結合個人經驗完成,存在術者主觀性較強,手術設計不夠精確的問題。
三維多模態影像技術能在三維層面清楚顯示腫瘤及周圍解剖結構,包括腫瘤骨組織邊界、軟組織邊界、骨與軟組織的水腫邊界范圍,以及重建包括腫瘤周圍臟器、血管和神經的三維模型,術者可以基于該模型客觀且精準地設計惡性骨腫瘤切除重建方案。我院于2012年開始將三維多模態影像技術用于復雜骨盆惡性腫瘤手術規劃中,并結合3D打印技術輔助手術,取得了良好初步療效[5-6]。在此基礎上,于2015年開始將其應用于肢體惡性骨腫瘤手術規劃并輔助手術。現回顧性分析2016年1月—2019年1月采用上述方法治療的肢體惡性骨腫瘤患者臨床資料,總結其可行性及有效性,為進一步臨床推廣奠定基礎。報告如下。
1 臨床資料
1.1 一般資料
患者納入標準:① 年齡≥14歲;② 初治的肢體原發惡性骨腫瘤;③ 初治的肢體骨轉移瘤且原發灶已行根治性治療;④ 腫瘤無遠處轉移;⑤ 選擇根治性保肢手術;⑥ 腫瘤直徑>10 cm且鄰近重要血管神經;⑦ 采用基于三維多模態影像的3D打印技術輔助手術;⑧ 臨床資料完整。排除不配合治療及隨訪者。2016年1月—2019年1月,15例患者符合選擇標準納入研究。
本組男6例,女9例;年齡17~73歲,中位年齡34歲。術前均行病理活檢明確診斷,其中骨肉瘤5例、軟骨肉瘤3例、尤文肉瘤2例、血管肉瘤1例、造釉細胞瘤1例、轉移性癌3例。Enneking分期:ⅡA期11例,ⅡB期4例。腫瘤部位:肱骨5例,尺骨2例,股骨3例,脛骨5例。病程2~8個月,中位病程4個月。
1.2 術前準備
1.2.1 三維多模態影像重建
術前患者行病灶部位CT增強掃描、MRI增強掃描和MR神經成像(magnetic resonance neurography,MRN)。采集上述影像數據以DICOM格式導入開源免費軟件Advanced Normalization Tools (ANTs;http://stnava.github.io/ANTs/), 通過“Affine”以及“Diffeomorphic registration”算法自動將MRI增強掃描及MRN圖像配準至CT圖像上。若自動配準效果欠佳,則采取手動輔助配準,參考點通常選取在CT增強掃描、MRI增強掃描以及MRN圖像上顯示效果均良好、且位置相對固定的結構,如動脈分叉處等。圖像配準質檢:通過手動測量關鍵解剖結構(如血管、神經、腫瘤、水腫范圍)的橫截面絕對重疊百分比(完全重疊橫截面面積/原始DICOM格式圖像的橫截面面積×100%),該值應達95%以上;若<95%則通過手動檢查并增加參考點等方式進行調整,直至>95%。
在開源免費軟件3D Slicer 4.11(www.slicer.org)中,通過“Level-set”、“Region-grow”、“Threshold control”等算法進行半自動圖像分割,主要結構包括腫瘤、水腫范圍、血管、神經等。圖像分割質檢:在橫截面上,通過手動測量已分割完成的關鍵解剖結構與原始DICOM格式圖像的最大偏移距離,保證其<1.5 mm;若該偏移距離>1.5 mm,則通過手動校正直至<1.5 mm。
最后將分割完成的模型,包括腫瘤的骨組織邊界、軟組織邊界、骨與軟組織水腫范圍、肌肉組織,以及腫瘤周圍重要血管和神經等,以.obj格式導入至3-matic 11.0軟件(Materialise公司,比利時),構建三維多模態影像模型。
1.2.2 計算機模擬手術
在三維多模態影像模型上進行計算機模擬手術,如腫瘤的骨組織切除邊界及軟組織切除范圍、保關節與否、可能損傷的重要血管神經及對應的安全手術入路、手術入路可能經過的軟組織腫瘤邊界及具體肌間隙層面等。綜合肢體功能重建要求,獲得最佳手術入路及手術切除范圍。需要說明的是,在本研究中腫瘤邊界包括兩方面內容,一個是腫瘤骨組織邊界,以MRI上腫瘤骨組織水腫范圍為邊界;另一個是腫瘤軟組織邊界,即腫瘤在MRI上的軟組織包塊為邊界。上述兩部分內容均已重建在三維多模態影像模型上。安全切除邊緣設計需要超出腫瘤在骨組織的水腫邊界至少1~2 cm,腫瘤的軟組織部分切緣設計需要保證腫瘤表面有正常軟組織覆蓋。
1.2.3 3D打印手術導板及假體設計
在計算機模擬手術明確切除范圍基礎上,結合三維多模態影像模型,設計對軟組織剝離最少、對血管神經牽拉最輕、對骨面最貼服、對術者操作角度最方便的個性化手術導板。
虛擬切除腫瘤后,設計具有良好初始穩定性和生物力學性能的3D打印個性化假體。結合三維多模態影像模型,根據腫瘤切除后的軟組織覆蓋及重要血管神經走行,微調假體表面微結構。必要時設計輔助假體安放的個性化手術導板。
1.2.4 體外模擬手術
3D打印骨腫瘤模型、切除后重建模型、手術導板和個性化假體。其中,骨腫瘤模型包括完整骨組織、腫瘤和水腫范圍;切除后重建模型包括腫瘤切除后的剩余骨組織及切除的瘤段。測試手術導板的貼附情況,判斷假體設計的初始穩定性及生物力學性能,并據此進行相應設計優化。完整技術流程見圖1。注意原發惡性骨腫瘤患者手術規劃是根據新輔助化療前影像學檢查結果設計[7-8]。
 圖1
三維多模態影像輔助肢體惡性骨腫瘤保肢手術的技術流程圖
Figure1.
The workflow of 3D multimodality imaging for limb salvage surgery of maglignant bone tumor
圖1
三維多模態影像輔助肢體惡性骨腫瘤保肢手術的技術流程圖
Figure1.
The workflow of 3D multimodality imaging for limb salvage surgery of maglignant bone tumor
1.3 手術方法
根據肢體骨腫瘤常見手術入路,并結合術前規劃所設計的手術入路及注意事項實施手術[9]。暴露預定截骨段后,再次判斷截骨位置,確認無誤后使用個性化手術導板完成截骨。對于骨干中段等可能存在導板貼附不良等情況的部位,術中可采用手工測量,必要時結合3D打印骨腫瘤模型輔助完成導板貼附與截骨。最后使用個性化假體進行功能重建。本組膝關節置換2例,半肩關節置換2例,尺骨近端置換2例,保留關節干假體置換9例(肱骨3例、股骨1例、脛骨5例)。
1.4 圍術期處理及療效評價指標
根據腫瘤類型選擇相應的新輔助化療、術后化療、靶向治療等。其中,5例骨肉瘤、2例尤文肉瘤、1例血管肉瘤采用新輔助化療+術后化療;3例轉移性癌根據原發灶使用靶向藥物。術中和術后預防性應用抗生素。術后采用非甾體類抗炎藥鎮痛,必要時使用阿片類止痛藥。通常于術后3 d開始康復訓練并逐步增加訓練強度。具體肢體負重時間及強度根據假體設計、術中情況及術后切口恢復情況綜合決定。
記錄腫瘤切除外科邊界、手術時間、術中失血量、手術并發癥發生情況、美國肌肉骨骼腫瘤學會(MSTS)評分及腫瘤局部復發情況[10]。
2 結果
15例患者均按術前規劃完成手術,外科邊界均獲得廣泛切除邊界。手術時間80~240 min,中位數150 min。術中失血量100~400 mL,中位數200 mL。無術中重要血管、神經損傷導致肢體功能明顯受限發生。1例切口淺表感染,經換藥后愈合;其余患者切口均Ⅰ期愈合。
患者均獲隨訪,隨訪時間6~48個月,中位數24個月。其中2例患者因肺轉移分別于術后6、24個月死亡。隨訪期間未出現局部復發,無假體脫位及松動等并發癥發生。末次隨訪時MSTS評分為23~30分,平均25分。見圖2、3。
 圖2
患者,女,44歲,肱骨骨肉瘤(EnnekingⅡA期)
圖2
患者,女,44歲,肱骨骨肉瘤(EnnekingⅡA期)
a. 術前X線片、CT增強掃描、MRI增強掃描、MRN及全身骨掃描;b. 三維多模態影像(綠色:腫瘤及水腫;黃色:神經;藍色、紅色:血管);c. 計算機模擬手術,其中近、遠端切緣分別距離水腫邊界4、2 cm;d. 3D打印假體;e. 個性化手術導板與體外模擬手術;f. 術中個性化手術導板輔助截骨、3D打印假體功能重建;g. 切除的腫瘤標本與3D打印腫瘤模型;h. 術后即刻X線片;i. 術后4個月X線片及肢體功能
Figure2. A 44-year-old female patient with osteosarcoma of the humerus (Enneking stageⅡA)a. Preoperative X-ray film, enhanced CT, enhanced MRI, magnetic resonance neurography, and whole body scan; b. 3D multimodality imaging (green: bone tumor and edema; yellow: nerves; blue and red: vessels); c. Computer-assisted surgical planning, the proximal and distal margin distances were 4 cm and 2 cm, respectively; d. 3D printed prosthesis; e. Personalized special instrument and in vitro simulation of surgery; f. Intraoperative view of personalized special instrument aiding surgery, and functional reconstruction with 3D printed prosthesis; g. Tumor specimen and 3D printed tumor model; h. X-ray film at immediate after operation; i. X-ray film and limb function at 4 months after operation
 圖3
患者,女,73歲,脛骨中段造釉細胞瘤(EnnekingⅡA期)
圖3
患者,女,73歲,脛骨中段造釉細胞瘤(EnnekingⅡA期)
a. 術前X線片、CT增強掃描、MRI增強掃描;b. 三維多模態影像和計算機模擬手術,其中近、遠端切緣分別距離水腫邊界1.5、4.0 cm;c. 3D打印假體及個性化手術導板;d. 體外模擬手術;e. 術中個性化手術導板輔助截骨及固定、3D打印假體功能重建;f. 切除的腫瘤標本以及脛骨模型;g. 術后即刻X線片;h. 術后25個月X線片及肢體功能
Figure3. A 73-year-old female patient with ameloblastoma of the middle tibia (Enneking stageⅡA)a. Preoperative X-ray films, enhanced CT, and enhanced MRI; b. 3D multimodality imaging and computer-assisted surgical planning, the proximal and distal margin distances were 1.5 cm and 4.0 cm, respectively; c. 3D printed prosthesis and personalized special instrument; d. In vitro simulation of surgery; e. Intraoperative view of personalized special instrument aiding osteotomy and fixation of nails, and functional reconstruction with 3D printed prosthesis; f. Tumor specimen and 3D printed tibia model; g. X-ray film at immediate after operation; h. X-ray films and limb function at 25 months after operation
3 討論
近10年來,3D打印和計算機導航等新興技術蓬勃發展,不斷地將骨腫瘤手術切除重建準確性提到新高度[11-16]。然而,在骨腫瘤外科領域,精確手術切除和精準功能重建并非當前精準醫療的全部,精細的術前影像評估同樣非常重要。
目前,骨腫瘤的術前評估主要依賴于多種影像學。多排螺旋CT空間分辨率高,能清晰顯示骨骼及血管受累情況,但是對軟組織不敏感。MRI能補充前者不足,準確反映軟組織層次,特別是腫瘤、水腫范圍以及神經走行。在傳統術前評估中,術者需要從CT、MRI和MRN等不同模態的影像數據中提取關鍵信息。通常以骨組織為著眼點,即以CT數據為基礎進行三維重建,模擬手術切除重建;在此過程中術者需要不斷參考和比對二維MRI以及MRN圖像,以保證獲得安全手術切除邊界。雖然閱讀二維影像是外科醫生的基本功,但是多模態數據經過計算機系統整合處理后,其信息豐富程度以及可靠性遠超傳統人腦合成[17]。傳統人腦合成非常依賴術者經驗,甚至可能存在人為因素導致的主觀性偏差。因此,理論上三維多模態影像能夠使術前規劃更客觀而精細化,如可以更好地設計切緣、規避腫瘤原因以及先天各種解剖變異產生的手術操作風險、降低血管神經損傷風險、避免切進骨腫瘤的軟組織包塊中等,從而為精確手術切除和功能重建奠定基礎。除此以外,精細化術前規劃有效避免了術中臨時更改決策,從而節省手術時間、減少術中出血,加速患者術后康復。
在骨腫瘤外科領域,三維多模態影像最早應用于巨大骨盆惡性腫瘤[5-6]。此類腫瘤體積大、侵襲范圍廣,且常伴有周圍重要血管、神經及臟器受累[18]。三維多模態影像能在三維層面清晰地顯示上述結構,特別是軟組織邊界、水腫范圍和神經。所以,基于三維多模態影像的術前規劃能有效降低腫瘤邊界切除不夠、切進骨腫瘤的軟組織部分以及神經損傷的情況。而這也是傳統基于CT三維重建+二維MRI術前評估比較困難的部分。因此,骨盆惡性腫瘤是使用三維多模態影像進行術前規劃的最佳適應證之一。本研究中,納入的肢體惡性骨腫瘤直徑均超過10 cm且鄰近重要血管神經,同時大部分伴有腫瘤性軟組織包塊。所有患者均取得了良好手術切除邊界,術后早期隨訪也無局部復發,無術中重要神經損傷致肢體功能障礙的情況發生,提示基于三維多模態影像的術前規劃對于提高肢體腫瘤學預后以及減少血管神經損傷等手術并發癥具有一定價值。
基于三維多模態影像的術前評估和手術規劃,除了能夠提高腫瘤學預后,還對控制術中出血以及手術時間具有積極意義。由于三維多模態影像能綜合利用CT增強掃描、MRI增強掃描、MRN的優勢,在術前規劃方面具有較高指導性,相比傳統 CT三維重建+二維MRI模式,術前規劃內容更豐富而具體,如軟組織的三維切除范圍、可能損傷的重要血管神經三維位置及對應的安全手術入路、手術入路可能經過的軟組織腫瘤邊界。通過在三維層面的分析,可避免損傷重要血管神經,減少術中“走一步,看一步”的情況,從而達到真正提前設計手術。裴延軍等[19]為5例脛骨和1例股骨惡性腫瘤患者實施3D打印個性化假體重建手術,平均手術時間165.83 min、平均術中失血量233.33 mL。本組患者手術時間80~240 min,術中失血量100~400 mL。上述研究結果均體現了三維多模態影像在出血控制和手術時間方面是有益的。
本研究中,我們除了使用三維多模態影像進行計算機模擬手術,還進行了3D打印個性化導板和假體設計。在此過程中,三維多模態影像的價值主要體現在3D打印導板設計上。在傳統基于CT截骨導板設計時,由于截骨平面已確定,術者或工程師會單純基于骨組織進行導板設計[20-21],在此過程中通常不再參考二維MRI數據。事實上,導板安放附近軟組織剝離多少、操作角度方便與否、對附近血管神經牽拉程度如何,都與個性化導板設計的尺寸和形態有關。單純基于骨組織設計,很難同時考慮到以上問題。當然,與上述問題相關的額外手術創傷、手術操作方便程度,目前沒有客觀有效評價指標,實際意義尚不明確,還需要進一步研究。而在假體設計方面,三維多模態影像主要參與微調假體表面微結構,如根據腫瘤切除后的軟組織覆蓋及重要血管神經走行,對鄰近區域假體表面進行光滑處理、設置凹槽等。其對初始穩定性、生物力學功能可能無明顯影響[22]。本研究中患者術后肢體功能MSTS評分平均為25分,與文獻報道基本一致,也符合上述理論猜想[19, 23-25]。
基于三維多模態影像進行計算機模擬手術、設計3D打印個性化導板和假體,有利于實現腫瘤術前精準化評估,進而為實現精準而完整切除腫瘤、解剖學和功能學重建以及減少手術并發癥創造有利條件。本研究不足之處:惡性骨腫瘤發病率低,樣本量小;由于發病部位遍及全身,即使同一塊骨骼的切除重建也可能存在巨大差異,因此異質性大、無法設置具有相同基線的對照組。我們會在未來開展多中心大型臨床研究,以進一步研究基于三維多模態影像的3D打印技術在惡性骨腫瘤手術中的應用價值。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
倫理聲明 研究方案經四川大學華西醫院生物醫學倫理審查委員會批準(2019-1062),患者均簽署知情同意書
作者貢獻聲明 段宏、屠重棋、張聞力、閔理、周勇:參與研究設計和手術;方向、雷森林、羅翼:參與研究實施、數據收集分析,起草文章;段宏、屠重棋、張聞力:對文章的知識性內容作批評性審閱