引用本文: 亢衛波, 閆家智, 陳永杰, 李晨曦, 桑大成. 葉酸復合交聯多聚尿烷聚酯神經導管促進大鼠坐骨神經長距離缺損修復. 中國修復重建外科雜志, 2023, 37(5): 622-628. doi: 10.7507/1002-1892.202212081 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
周圍神經損傷可造成感覺及功能障礙甚至殘疾,嚴重影響患者生活質量,給患者家庭及社會帶來嚴重負擔[1-2]。因自體神經供體來源有限,周圍神經損傷特別是長距離損傷手術修復困難,目前仍面臨巨大挑戰[3]。因此,亟需尋找自體神經替代物以修復周圍神經缺損[1,4-5]。神經導管是使用自體組織、天然或人工合成材料制作而成,用以橋接神經斷端、促進周圍神經修復。交聯多聚尿烷聚酯(crosslinked urethane-doped polyester elastomer,CUPE)是一種新型生物導管材料,作為一種神經支架,其幾何形狀、力學性質和體內生物學性能良好,用于修復周圍神經缺損效果確切[6]。葉酸對于中樞神經生長發育至關重要,有研究表明通過腹腔內注射葉酸能夠促進損傷后坐骨神經功能恢復,并促進其髓鞘化及神經軸突再生[7-8]。
葉酸復合CUPE(folic acid coated-CUPE,fCUPE)神經導管支架用于修復坐骨神經長距離缺損能否獲得更顯著效果,目前尚無相關研究。本研究擬通過建立大鼠坐骨神經長距離缺損模型,應用fCUPE神經導管支架橋接大鼠缺損的周圍神經,旨在評價該支架對周圍神經損傷的修復作用,為長距離周圍神經損傷修復提供更有效的治療策略。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
3月齡雄性SD大鼠36只,體質量180~220 g,購自北京維通利華實驗動物技術有限公司。
本研究使用的CUPE及fCUPE神經導管支架均由美國賓夕法尼亞大學提供,制作材料及過程詳見文獻 [9-10]。CUPE神經導管支架內徑為2.5 mm、壁厚0.25 mm、外徑3 mm,置于100 mg/L葉酸溶液(濃度≥75%;Alfa Aesar公司,英國)中浸泡制備fCUPE神經導管支架,應用低溫冷凍干燥技術保存。使用高效液相色譜法檢測fCUPE神經導管支架上葉酸有效濃度為100 mg/L。
4%多聚甲醛(北京索萊寶科技有限公司);抗S-100抗體(武漢博士德生物工程有限公司);辣根過氧化物酶、山羊血清(北京中杉金橋生物技術有限公司);SAB復合物、蘇木素、中性樹膠(南京凱基生物科技發展有限公司);2%戊巴比妥鈉(上海哈靈生物科技有限公司)。
4℃冰箱(SANYO公司,日本);RM2245型石蠟切片機、DMIL型倒置相差顯微鏡(Leica公司,德國);DKN812C型恒溫干燥箱(Yamamto公司,日本);MEP-Micro型肌電圖機(Neurosoft公司,俄羅斯);8-0縫合線(強生公司,美國)。
1.2 實驗分組及方法
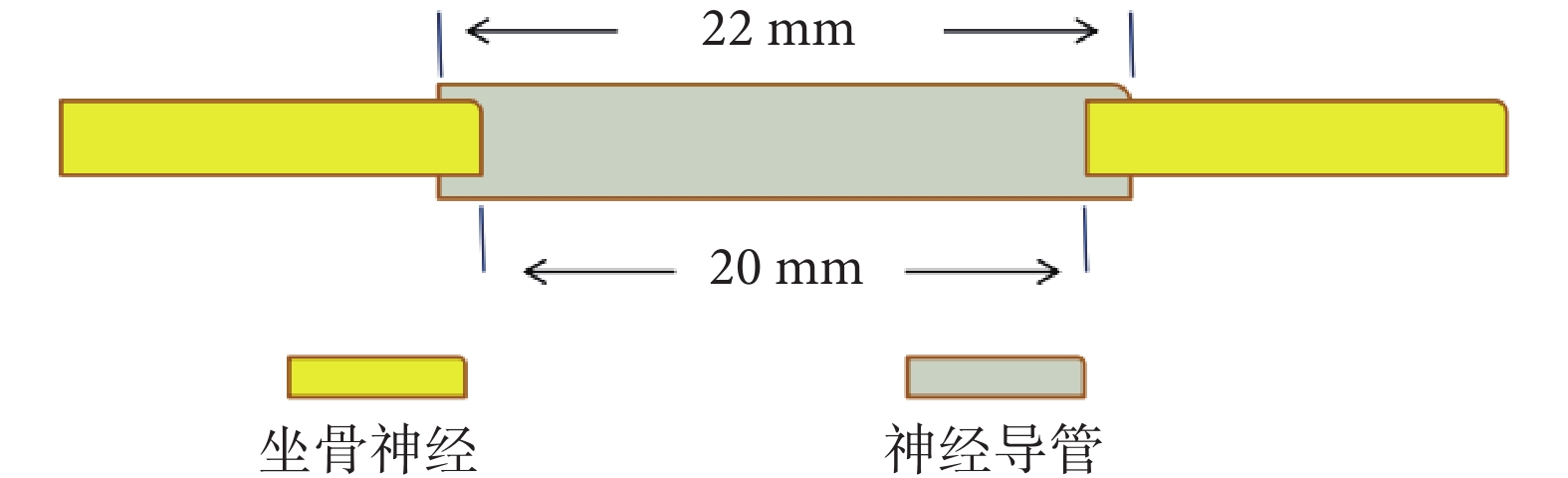
將36只大鼠隨機分為3組,每組12只,分別為CUPE神經導管支架移植組(A組)、fCUPE神經導管支架移植組(B組)及自體神經移植組(C組),取C組對側健康肢體作為對照組(D組)。大鼠坐骨神經缺損模型建立:各組大鼠腹腔內注射2%戊巴比妥鈉(40 mg/kg)麻醉后,取右側股后部縱切口,切開皮膚,鈍性分離周圍組織,由股后外側肌間隙顯露右側坐骨神經;在坐骨神經距梨狀肌出口5 mm處用顯微剪剪去長度為20 mm的神經組織,制備長距離神經缺損模型。然后A、B組分別將22 mm CUPE和fCUPE神經導管支架橋接神經近、遠斷端,2個斷端各遷入導管內1 mm,用8-0縫合線連接神經斷端與神經導管,縫合后神經導管中形成20 mm的神經缺損間隙(圖1);C組將切斷的坐骨神經翻轉后原位縫合。縫合大鼠肌肉及皮膚,待麻醉蘇醒后將大鼠飼養于25℃飼養室內,按時給予飼料及水,每日觀察大鼠情況。
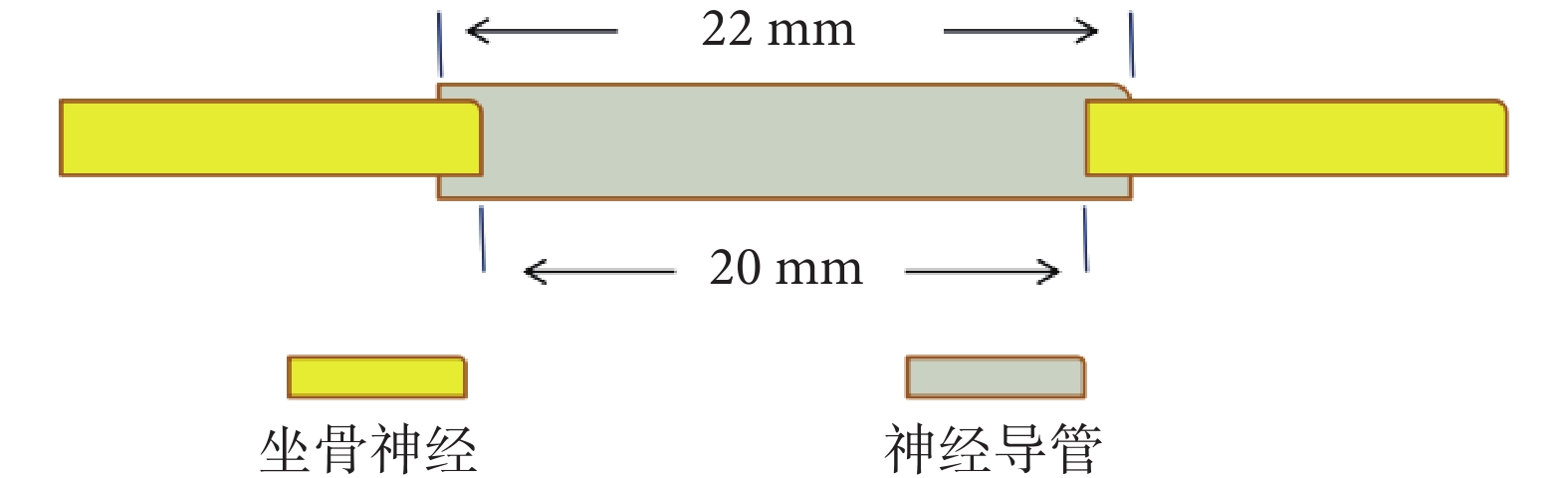 圖1
神經導管支架橋接缺損坐骨神經示意圖
Figure1.
Schematic diagram of sciatic nerve defect bridged by nerve conduit
圖1
神經導管支架橋接缺損坐骨神經示意圖
Figure1.
Schematic diagram of sciatic nerve defect bridged by nerve conduit
1.3 觀測指標
1.3.1 坐骨神經指數(sciatic function index,SFI)檢測
所有大鼠分別于術后1、2、3個月,用自制大鼠足印行走箱測量并計算SFI。行走箱為兩端開口的隧道狀管道,底端為平面,行走通道長50 cm、高12 cm、寬12 cm,箱底置等長、等寬白紙;藍色印泥浸染大鼠足底,將大鼠放在走道一端使其自由沿走道行走直至鉆進暗室內,記錄大鼠雙側后足清晰足印3~4個。收回白紙,分別測量左側足(正常側)和右側足(實驗側)相關指標(包括足印長度、足趾寬度、中間足趾寬度),根據Bain公式[11]計算A~C組SFI,0為正常,–100為完全損傷。見圖2。
 圖2
大鼠足印制作后各參數測量示意圖
圖2
大鼠足印制作后各參數測量示意圖
IT:中間足趾寬度 TS:足趾寬度 PL:足印長度
Figure2. Schematic diagram of measurement of each parameter after making rat footprintsIT: Distance from the second to the fourth toes TS: Distance from the first to the fifth toes PL: Distance from the heel to the third toe
1.3.2 神經傳導速度(nerve conduction velocity,NCV)檢測
所有大鼠分別于術后1、2、3個月,腹腔注射2%戊巴比妥鈉(40 mg/kg)麻醉后俯臥于鼠板上,四肢用皮筋固定;應用MEP-Micro型肌電圖機,將刺激電極正、負極接于大鼠腰椎椎旁區域(L4、5、L5、6水平,正、負極相距5 mm左右),接收電極正、負極插入大鼠腓腸肌中段(正負極相距5 mm左右),并測量刺激電極正極與接收電極正極間的距離,測算A~D組NCV。
1.3.3 大體及組織學觀測
術后3個月處死所有大鼠,充分暴露其實驗側坐骨神經,遠、近端距離縫合處各2 mm離斷坐骨神經,觀察A、B組導管支架降解以及周圍組織粘連情況,以及與神經兩斷端連接程度。然后取出A、B組中段神經導管及遠、近端部分神經組織,C組取相應位置組織,包埋并制作4 μm厚石蠟切片,行S-100免疫組織化學染色,光鏡下觀察其神經結構,并采用Image J圖像分析軟件計數A、B組雪旺細胞。
1.4 統計學方法
采用SPSS21.0統計軟件進行分析。計量資料行正態性檢驗均符合正態分布,數據以均數±標準差表示,兩組間比較采用獨立樣本t檢驗;多組間比較采用兩因素析因設計方差分析,兩兩比較采用Tukey檢驗;檢驗水準α=0.05。
2 結果
2.1 術后大體觀察
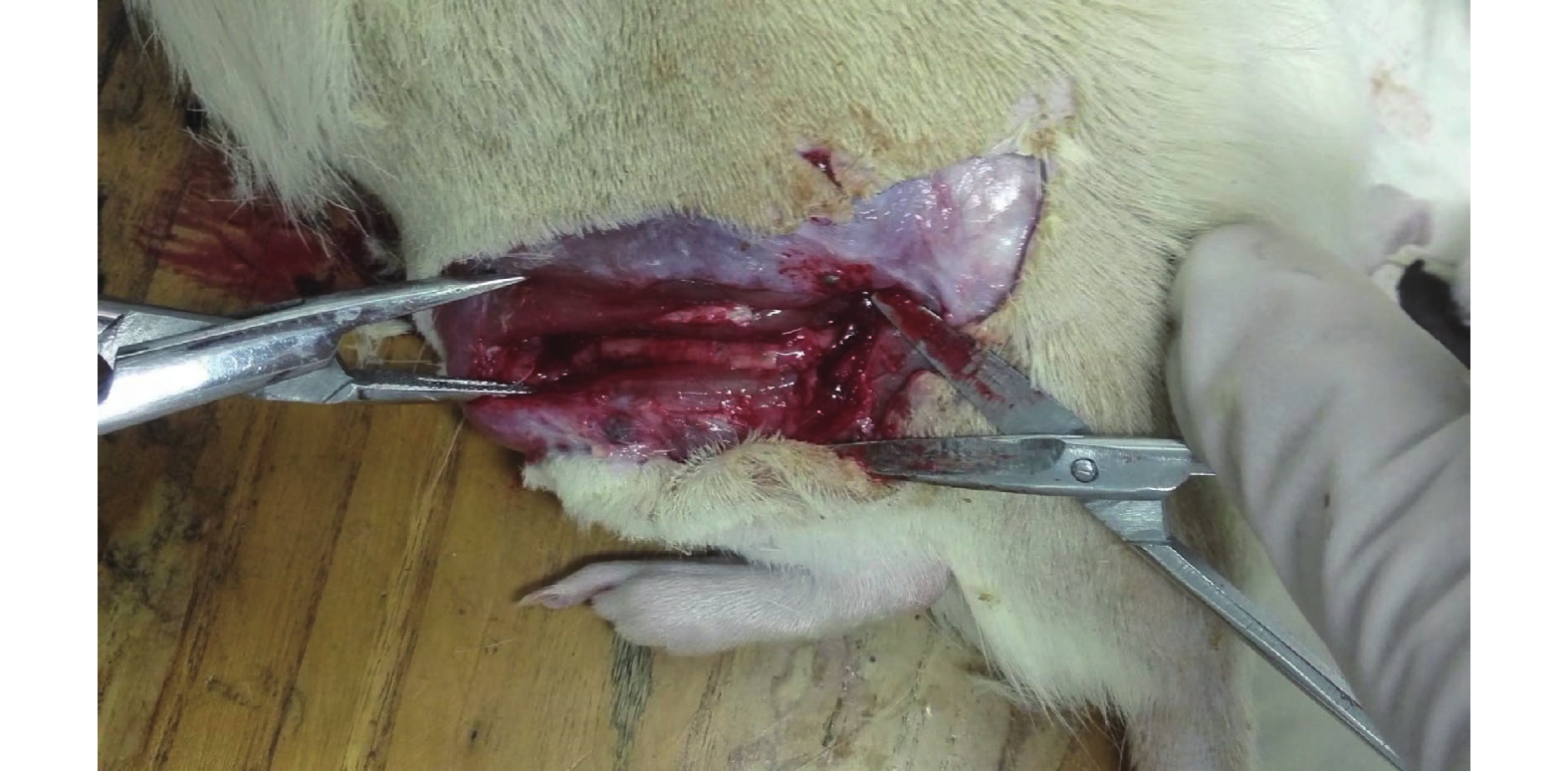
所有手術均順利完成,實驗過程中未出現大鼠死亡。術后3個月處死所有大鼠,暴露手術部位神經導管支架,可見A、B組支架均存在部分降解,神經及導管與周圍組織之間無嚴重粘連,導管與遠、近端神經連接正常,未見斷裂,神經兩斷端未出現明顯膨大狀態。導管材料均未出現折斷、反折、壓迫等情況。切斷神經導管支架可觀察到導管內出現類似神經的組織。見圖3。
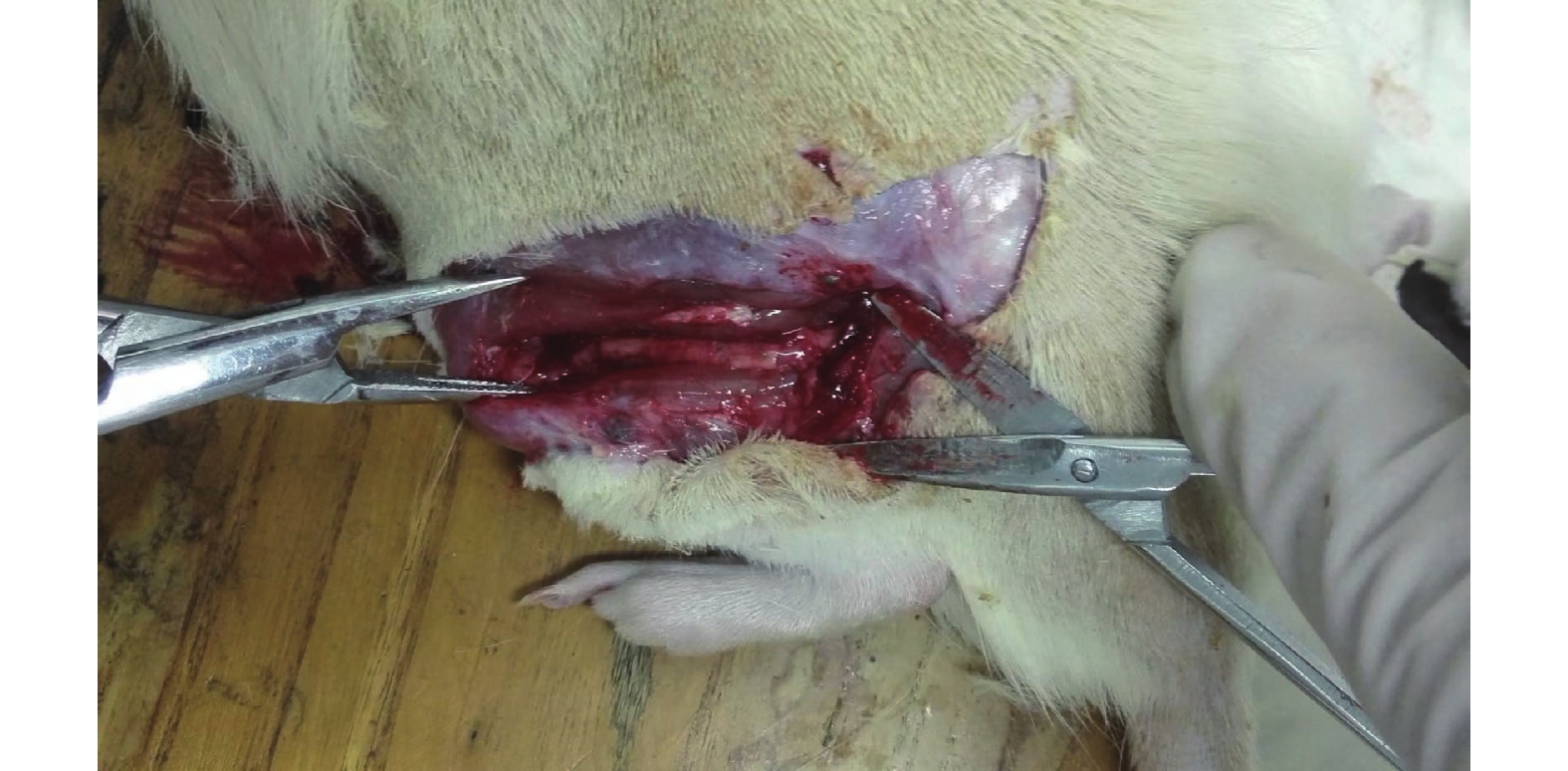 圖3
術后3個月神經導管遠、近端與神經連接正常,未見斷裂、反折、壓迫
Figure3.
At 3 months after operation, the connection between the proximal and distal ends of the nerve conduit and the nerve was normal, and no rupture, reflection or compression was found
圖3
術后3個月神經導管遠、近端與神經連接正常,未見斷裂、反折、壓迫
Figure3.
At 3 months after operation, the connection between the proximal and distal ends of the nerve conduit and the nerve was normal, and no rupture, reflection or compression was found
2.2 SFI檢測
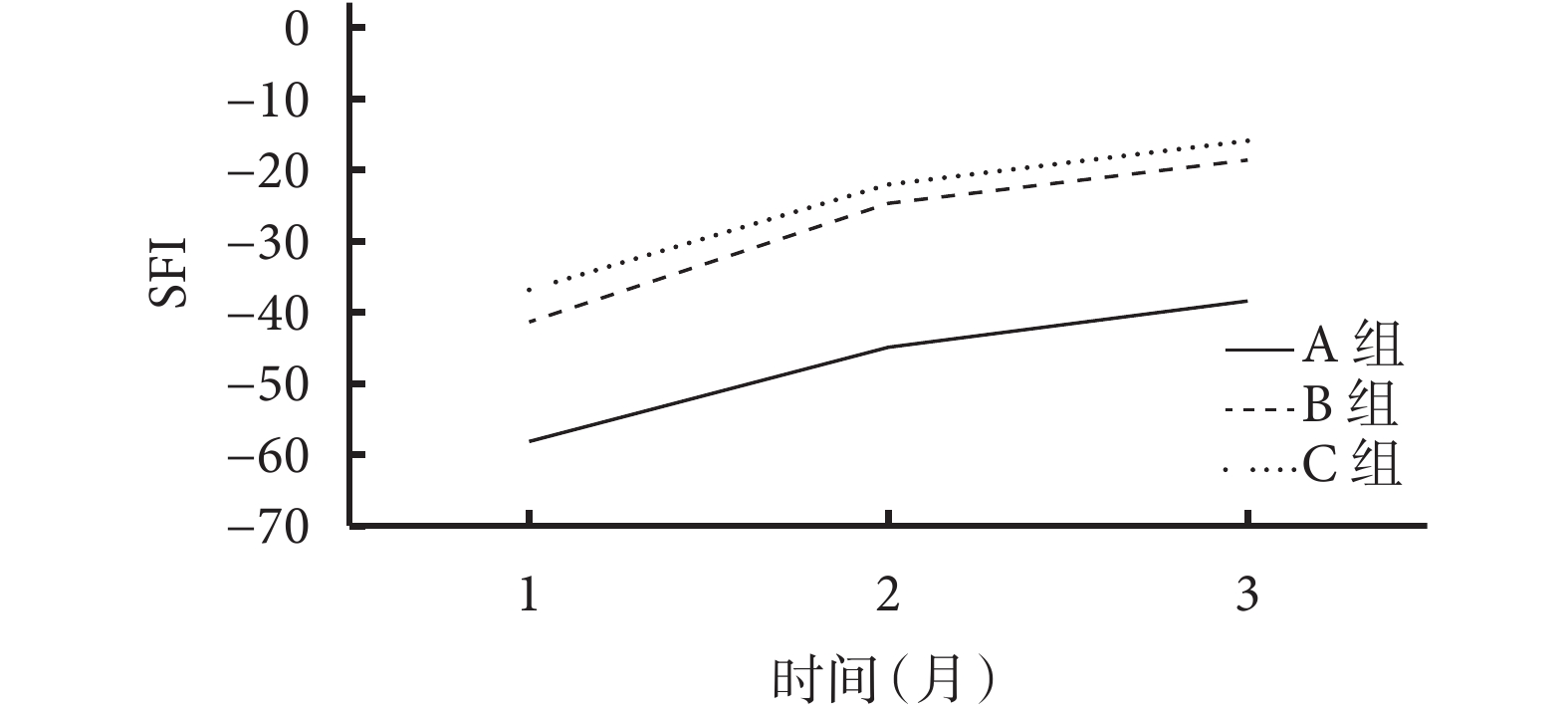
術后各時間點A組SFI均顯著高于C組,術后2、3個月時高于B組,差異均有統計學意義(P<0.05);術后各時間點B、C組間SFI比較差異均無統計學意義(P>0.05)。見表1、圖4。
 )
Table1.
Comparison of the SFI among groups at different time points after operation (n=12,
)
Table1.
Comparison of the SFI among groups at different time points after operation (n=12,  )
)
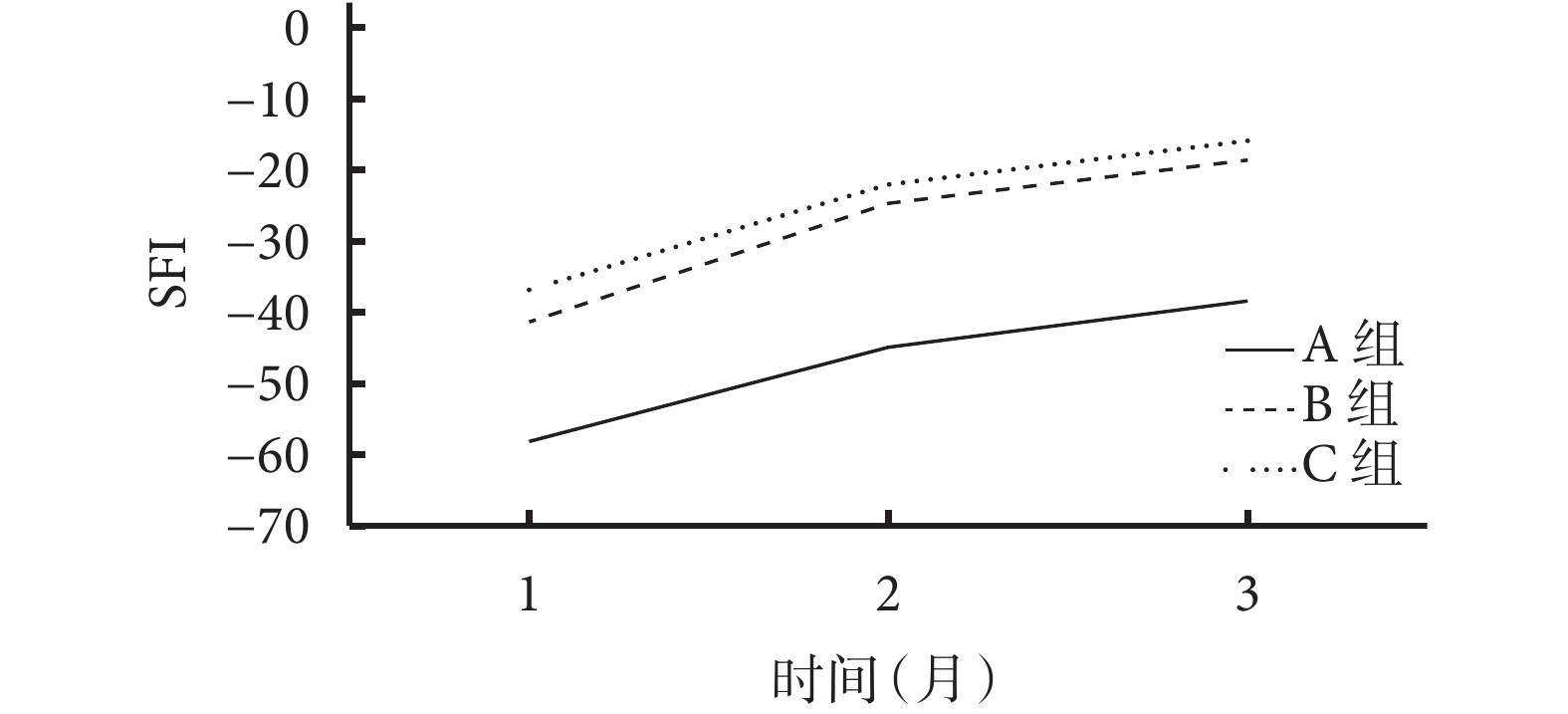 圖4
術后各時間點各組SFI
Figure4.
SFI of each group at different time points after operation
圖4
術后各時間點各組SFI
Figure4.
SFI of each group at different time points after operation
2.3 NCV檢測
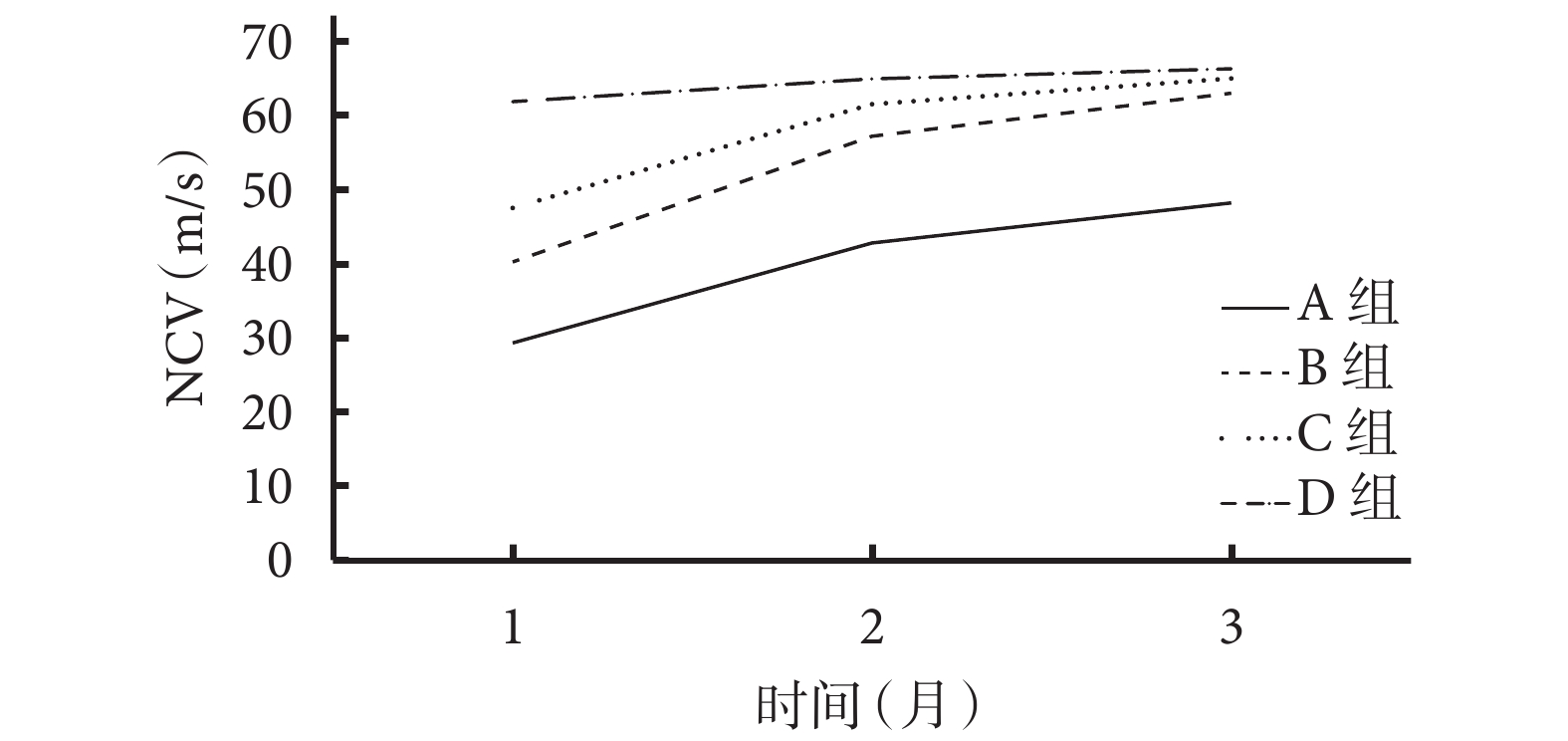
術后各時間點A組NCV均顯著慢于其余3組,差異有統計學意義(P<0.05);B、C組NCV均慢于D組,但僅術后1個月時差異有統計學意義(P<0.05);術后各時間點B、C組間差異均無統計學意義(P>0.05)。見表2、圖5。
 )
Table2.
Comparison of the NVC among groups at different time points after operation (n=12,
)
Table2.
Comparison of the NVC among groups at different time points after operation (n=12,  )
)
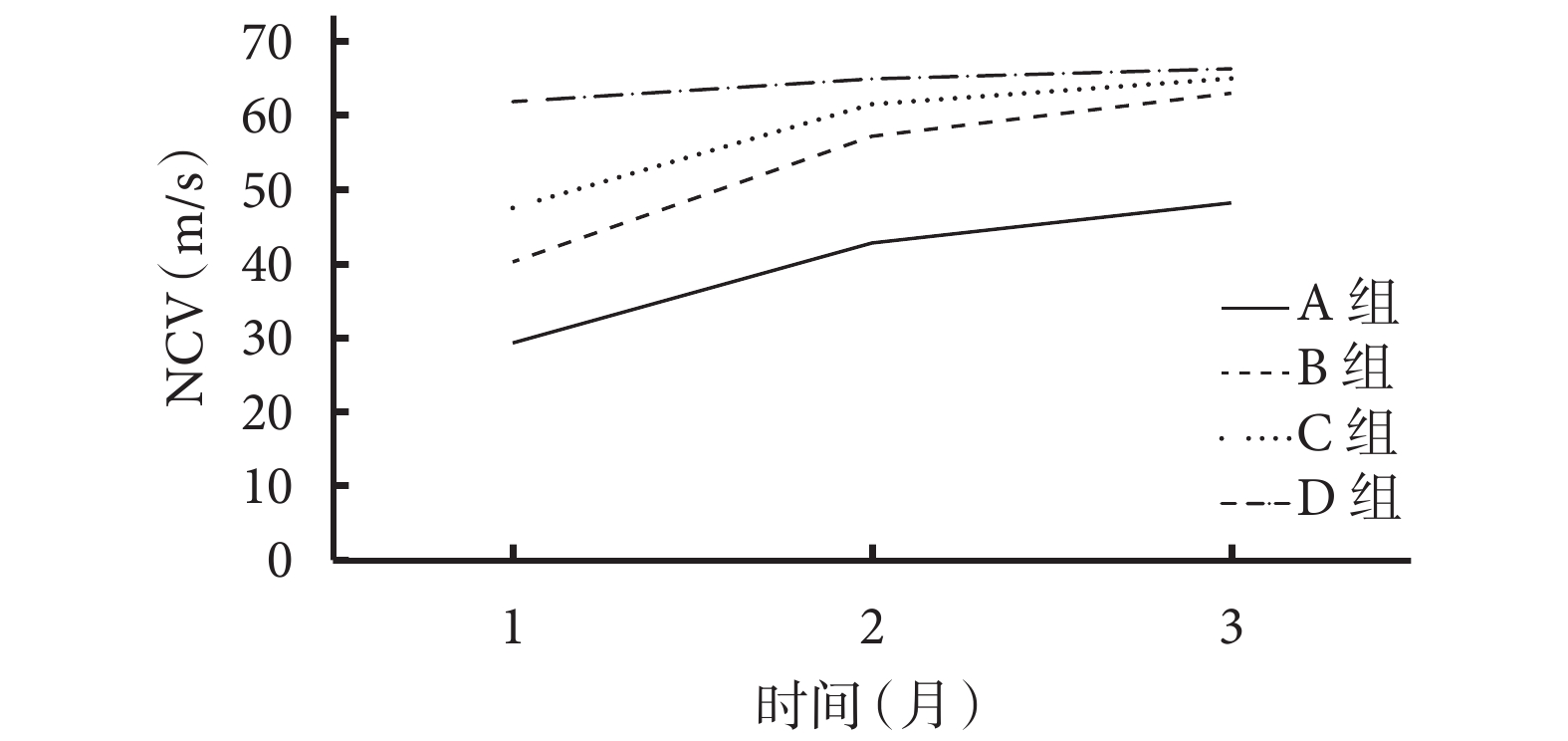 圖5
術后各時間點各組NCV
Figure5.
NCV of each group at different time points after operation
圖5
術后各時間點各組NCV
Figure5.
NCV of each group at different time points after operation
2.4 組織學檢測
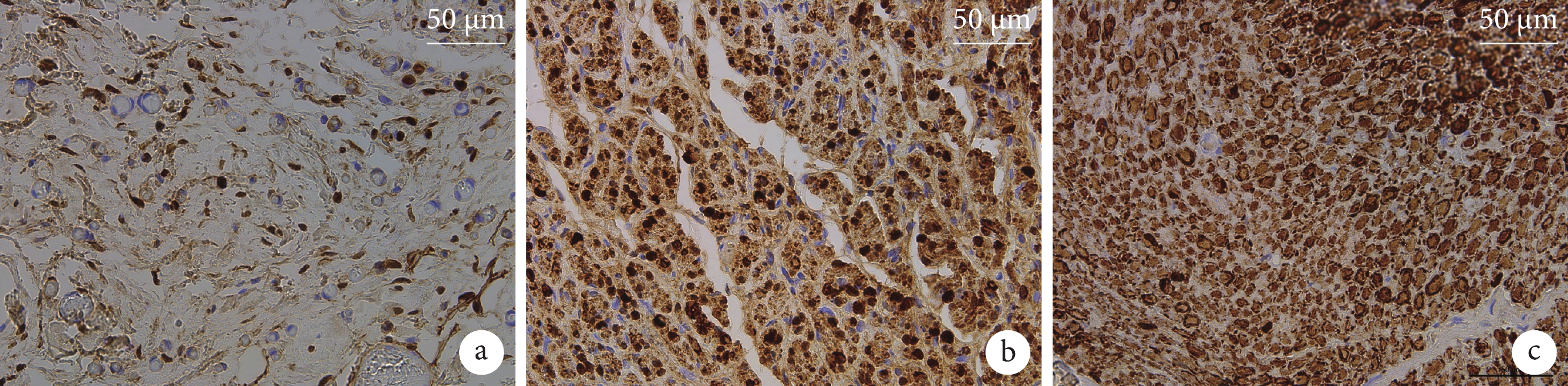
免疫組織化學染色示各組S-100染色均為陽性,但組織染色深淺存在差異。A組神經組織失去正常結構,組織染色淺,可見空洞樣結構,見大量非雪旺細胞;B組可見大量正常神經結構,染色較A組深,去分化雪旺細胞分布明顯,并可見少量髓鞘包繞神經束的結構;C組可見神經束排列整齊,雪旺細胞及髓鞘中靠近雪旺細胞核部分染色較深,髓鞘染色較淺,間質細胞無明顯染色。B組雪旺細胞數量為(727.50±57.60)個/mm2,顯著多于A組(298.33±153.12)個/mm2,差異有統計學意義(t=6.139,P<0.001)。見圖6。
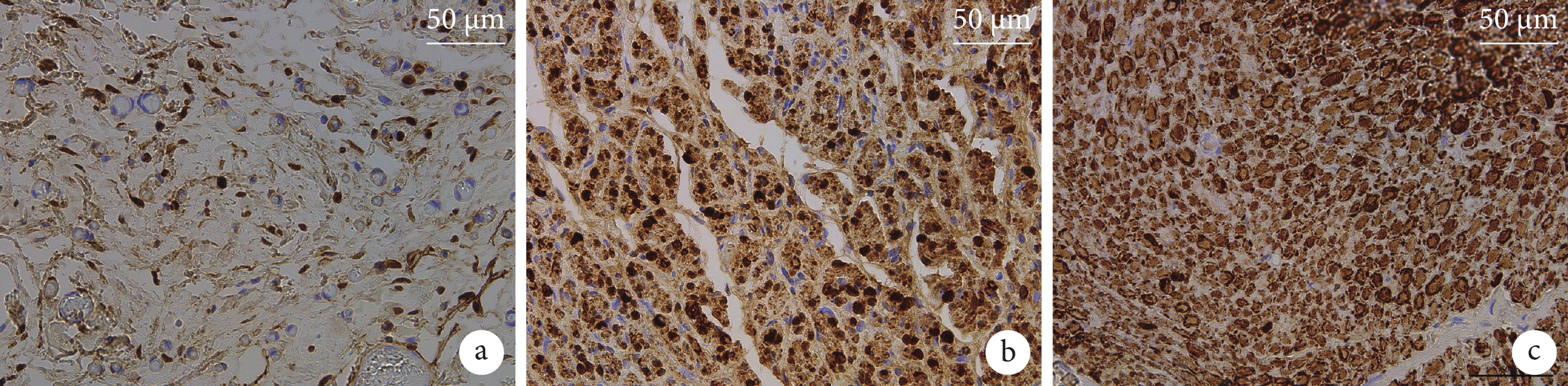 圖6
術后3個月各組S-100免疫組織化學染色觀察(×200)
圖6
術后3個月各組S-100免疫組織化學染色觀察(×200)
a. A組;b. B組;c. C組
Figure6. S-100 immunohistochemical staining observation in each group at 3 months after operation (×200)a. Group A; b. Group B; c. Group C
3 討論
周圍神經損傷造成的神經缺損主要采用自體神經移植治療[12],但成功率僅為50%,還存在供區神經功能喪失、神經來源有限、供區神經與受損神經匹配度差、增加手術次數等弊端,限制了其在周圍神經損傷修復中的臨床應用[13]。特別是對于長距離神經缺損修復效果更差。20世紀70年代后期,人們開始逐漸使用生物材料制成的神經導管修復周圍神經缺損[14]。然而,隨著對神經組織工程研究的深入,研究者們逐漸認識到單一神經導管因不含有任何生物活性物質,僅作為神經再生的物理通道,不具備生物活性,所以修復效果不甚理想。因此,目前周圍神經組織工程研究熱點已轉向增強導管生物活性等方面[15]。
葉酸作為一種水溶性維生素,對中樞神經系統的早期發育、功能發揮和缺損修復都起著重要作用,適量補充葉酸能夠預防各種中樞神經病變,如神經管缺陷、生長發育遲滯、癡呆、脊髓退變、癲癇等[8,16-17]。在周圍神經系統中,葉酸能夠緩解周圍神經卡壓產生的疼痛,同時延緩其功能衰退[18],并促進糖尿病患者周圍神經損傷后NGF的表達水平及髓鞘再生,進而改善NCV與肢體感覺異常,起到保護周圍神經功能的作用[19]。目前研究表明,通過腹腔注射葉酸能夠促進損傷后坐骨神經髓鞘化及神經軸突再生,利于其功能恢復[19-20]。由柔軟并富有彈性的CUPE制備神經導管,內部有多個縱向孔道、外部無孔鞘,能夠模仿天然神經內微管和神經外膜結構[21],相關研究驗證其能促進大鼠1 cm坐骨神經缺損中神經纖維再生及髓鞘化。而關于使用fCUPE神經導管支架修復神經缺損的研究尚未見報道。本研究建立大鼠坐骨神經缺損模型,使用fCUPE神經導管支架修復神經缺損,分別于術后1、2、3個月測算SFI和NCV,第3個月處死大鼠取神經組織進行S-100免疫組織染色并計數雪旺細胞,以觀察fCUPE神經導管支架對大鼠周圍神經缺損的修復效果。
坐骨神經缺損后會影響神經及肌肉功能[22],出現不同程度足外展、內收障礙、足下垂和跨越步態,表現為腳掌與前進方向的夾角隨神經缺損程度增大而增大[23],檢測SFI能夠評價缺損神經的功能恢復情況。本研究結果顯示,各時間點B組SFI明顯低于A組,術后3個月B組SFI雖仍高于C組,但已很接近,提示fCUPE神經導管支架具有明顯的神經修復效果,且長期應用可能具有與自體神經移植相似的效果。也說明葉酸在改善神經導管生物活性方面具備一定優勢。
神經的主要功能是傳導電信號,檢測NCV能反映再生神經功能恢復水平。本研究結果顯示,術后各組NCV均有不同程度恢復,雖然各時間點C組恢復情況均優于B組,但兩組NCV接近,差異無統計學意義(P>0.05);同時兩組NCV恢復情況均優于A組,且差異有統計學意義(P<0.05);術后3個月A組NCV最低,但B、C、D組結果相近;說明葉酸對促進周圍神經再生起著重要作用。
雪旺細胞是周圍神經系統中重要的膠質細胞,不僅參與髓鞘形成,而且在周圍神經損傷后的再生修復過程中發揮重要作用。雪旺細胞能夠通過吞噬軸突碎片,支持引導再生纖維生長,分泌多種神經營養因子,促進軸突向遠端生長,同時產生細胞外基質和細胞黏附分子,防止受損神經元胞體死亡[21]。本研究S-100免疫組織化學染色結果顯示,C組神經束排列整齊,雪旺細胞及髓鞘中靠近雪旺細胞核部分著色較深;A組神經組織失去正常結構,組織著色淺,可見空洞樣結構,見大量非雪旺細胞;而B組神經結構正常,染色較A組深,去分化雪旺細胞分布明顯,雪旺細胞顯著多于A組,且在光鏡下觀察到少量髓鞘包繞神經束的結構,提示葉酸有可能通過促進雪旺細胞生成,對周圍神經再生起到刺激作用。既往研究認為,葉酸可能通過促進雪旺細胞增殖和遷移以及NGF分泌來促進周圍神經損傷修復[24]。因此,本研究中fCUPE神經導管支架上復合的葉酸促進雪旺細胞增殖,可能是其促進周圍神經損傷修復的主要機制之一。
本研究尚存在不足,通過冷凍干燥技術使葉酸附著于神經導管支架內表面上存在兩個問題,無法保證葉酸晶體附著的數量以及無法保證葉酸緩慢釋放。而且本研究未檢測橋接神經導管后的葉酸體內釋放速率。因此,針對葉酸尋找一種更優化的局部緩慢釋放方法,是未來研究重點。
綜上述,fCUPE神經導管可顯著改善長距離坐骨神經缺損大鼠的行走功能,長期應用與自體神經移植修復效果接近;同時,葉酸可改善神經導管活性,增強神經導管的人體適用性;fCUPE神經導管支架可在短時間內明顯恢復神經傳導功能,且與自體神經移植效果一致;葉酸還可促進受損周圍神經組織的恢復,并促進雪旺細胞生成以刺激神經再生。因此,fCUPE神經導管支架可用于治療大鼠周圍神經缺損,且效果與自體神經移植具有高度一致性,可能成為潛在的周圍神經缺損移植的替代材料,研究其作用、機制及應用有望解決自體神經移植治療神經缺損修復效果差、供區神經功能喪失、供體不足以及和受損神經匹配度差等臨床問題。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經首都醫科大學附屬北京天壇醫院倫理委員會批準(201603001);實驗動物生產許可證批準號:SCXK(京)2021-0011,使用許可證批準號:SYXK(京)2022-0052
作者貢獻聲明 亢衛波:研究設計、數據分析及文章撰寫;閆家智:對文章的知識性內容作批評性審閱,為研究提供行政、技術和材料支持;陳永杰、李晨曦、桑大成:參與研究設計;陳永杰:采集、分析數據;李晨曦:參與起草文章;桑大成:參與文章修改
周圍神經損傷可造成感覺及功能障礙甚至殘疾,嚴重影響患者生活質量,給患者家庭及社會帶來嚴重負擔[1-2]。因自體神經供體來源有限,周圍神經損傷特別是長距離損傷手術修復困難,目前仍面臨巨大挑戰[3]。因此,亟需尋找自體神經替代物以修復周圍神經缺損[1,4-5]。神經導管是使用自體組織、天然或人工合成材料制作而成,用以橋接神經斷端、促進周圍神經修復。交聯多聚尿烷聚酯(crosslinked urethane-doped polyester elastomer,CUPE)是一種新型生物導管材料,作為一種神經支架,其幾何形狀、力學性質和體內生物學性能良好,用于修復周圍神經缺損效果確切[6]。葉酸對于中樞神經生長發育至關重要,有研究表明通過腹腔內注射葉酸能夠促進損傷后坐骨神經功能恢復,并促進其髓鞘化及神經軸突再生[7-8]。
葉酸復合CUPE(folic acid coated-CUPE,fCUPE)神經導管支架用于修復坐骨神經長距離缺損能否獲得更顯著效果,目前尚無相關研究。本研究擬通過建立大鼠坐骨神經長距離缺損模型,應用fCUPE神經導管支架橋接大鼠缺損的周圍神經,旨在評價該支架對周圍神經損傷的修復作用,為長距離周圍神經損傷修復提供更有效的治療策略。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
3月齡雄性SD大鼠36只,體質量180~220 g,購自北京維通利華實驗動物技術有限公司。
本研究使用的CUPE及fCUPE神經導管支架均由美國賓夕法尼亞大學提供,制作材料及過程詳見文獻 [9-10]。CUPE神經導管支架內徑為2.5 mm、壁厚0.25 mm、外徑3 mm,置于100 mg/L葉酸溶液(濃度≥75%;Alfa Aesar公司,英國)中浸泡制備fCUPE神經導管支架,應用低溫冷凍干燥技術保存。使用高效液相色譜法檢測fCUPE神經導管支架上葉酸有效濃度為100 mg/L。
4%多聚甲醛(北京索萊寶科技有限公司);抗S-100抗體(武漢博士德生物工程有限公司);辣根過氧化物酶、山羊血清(北京中杉金橋生物技術有限公司);SAB復合物、蘇木素、中性樹膠(南京凱基生物科技發展有限公司);2%戊巴比妥鈉(上海哈靈生物科技有限公司)。
4℃冰箱(SANYO公司,日本);RM2245型石蠟切片機、DMIL型倒置相差顯微鏡(Leica公司,德國);DKN812C型恒溫干燥箱(Yamamto公司,日本);MEP-Micro型肌電圖機(Neurosoft公司,俄羅斯);8-0縫合線(強生公司,美國)。
1.2 實驗分組及方法
將36只大鼠隨機分為3組,每組12只,分別為CUPE神經導管支架移植組(A組)、fCUPE神經導管支架移植組(B組)及自體神經移植組(C組),取C組對側健康肢體作為對照組(D組)。大鼠坐骨神經缺損模型建立:各組大鼠腹腔內注射2%戊巴比妥鈉(40 mg/kg)麻醉后,取右側股后部縱切口,切開皮膚,鈍性分離周圍組織,由股后外側肌間隙顯露右側坐骨神經;在坐骨神經距梨狀肌出口5 mm處用顯微剪剪去長度為20 mm的神經組織,制備長距離神經缺損模型。然后A、B組分別將22 mm CUPE和fCUPE神經導管支架橋接神經近、遠斷端,2個斷端各遷入導管內1 mm,用8-0縫合線連接神經斷端與神經導管,縫合后神經導管中形成20 mm的神經缺損間隙(圖1);C組將切斷的坐骨神經翻轉后原位縫合。縫合大鼠肌肉及皮膚,待麻醉蘇醒后將大鼠飼養于25℃飼養室內,按時給予飼料及水,每日觀察大鼠情況。
 圖1
神經導管支架橋接缺損坐骨神經示意圖
Figure1.
Schematic diagram of sciatic nerve defect bridged by nerve conduit
圖1
神經導管支架橋接缺損坐骨神經示意圖
Figure1.
Schematic diagram of sciatic nerve defect bridged by nerve conduit
1.3 觀測指標
1.3.1 坐骨神經指數(sciatic function index,SFI)檢測
所有大鼠分別于術后1、2、3個月,用自制大鼠足印行走箱測量并計算SFI。行走箱為兩端開口的隧道狀管道,底端為平面,行走通道長50 cm、高12 cm、寬12 cm,箱底置等長、等寬白紙;藍色印泥浸染大鼠足底,將大鼠放在走道一端使其自由沿走道行走直至鉆進暗室內,記錄大鼠雙側后足清晰足印3~4個。收回白紙,分別測量左側足(正常側)和右側足(實驗側)相關指標(包括足印長度、足趾寬度、中間足趾寬度),根據Bain公式[11]計算A~C組SFI,0為正常,–100為完全損傷。見圖2。
 圖2
大鼠足印制作后各參數測量示意圖
圖2
大鼠足印制作后各參數測量示意圖
IT:中間足趾寬度 TS:足趾寬度 PL:足印長度
Figure2. Schematic diagram of measurement of each parameter after making rat footprintsIT: Distance from the second to the fourth toes TS: Distance from the first to the fifth toes PL: Distance from the heel to the third toe
1.3.2 神經傳導速度(nerve conduction velocity,NCV)檢測
所有大鼠分別于術后1、2、3個月,腹腔注射2%戊巴比妥鈉(40 mg/kg)麻醉后俯臥于鼠板上,四肢用皮筋固定;應用MEP-Micro型肌電圖機,將刺激電極正、負極接于大鼠腰椎椎旁區域(L4、5、L5、6水平,正、負極相距5 mm左右),接收電極正、負極插入大鼠腓腸肌中段(正負極相距5 mm左右),并測量刺激電極正極與接收電極正極間的距離,測算A~D組NCV。
1.3.3 大體及組織學觀測
術后3個月處死所有大鼠,充分暴露其實驗側坐骨神經,遠、近端距離縫合處各2 mm離斷坐骨神經,觀察A、B組導管支架降解以及周圍組織粘連情況,以及與神經兩斷端連接程度。然后取出A、B組中段神經導管及遠、近端部分神經組織,C組取相應位置組織,包埋并制作4 μm厚石蠟切片,行S-100免疫組織化學染色,光鏡下觀察其神經結構,并采用Image J圖像分析軟件計數A、B組雪旺細胞。
1.4 統計學方法
采用SPSS21.0統計軟件進行分析。計量資料行正態性檢驗均符合正態分布,數據以均數±標準差表示,兩組間比較采用獨立樣本t檢驗;多組間比較采用兩因素析因設計方差分析,兩兩比較采用Tukey檢驗;檢驗水準α=0.05。
2 結果
2.1 術后大體觀察
所有手術均順利完成,實驗過程中未出現大鼠死亡。術后3個月處死所有大鼠,暴露手術部位神經導管支架,可見A、B組支架均存在部分降解,神經及導管與周圍組織之間無嚴重粘連,導管與遠、近端神經連接正常,未見斷裂,神經兩斷端未出現明顯膨大狀態。導管材料均未出現折斷、反折、壓迫等情況。切斷神經導管支架可觀察到導管內出現類似神經的組織。見圖3。
 圖3
術后3個月神經導管遠、近端與神經連接正常,未見斷裂、反折、壓迫
Figure3.
At 3 months after operation, the connection between the proximal and distal ends of the nerve conduit and the nerve was normal, and no rupture, reflection or compression was found
圖3
術后3個月神經導管遠、近端與神經連接正常,未見斷裂、反折、壓迫
Figure3.
At 3 months after operation, the connection between the proximal and distal ends of the nerve conduit and the nerve was normal, and no rupture, reflection or compression was found
2.2 SFI檢測
術后各時間點A組SFI均顯著高于C組,術后2、3個月時高于B組,差異均有統計學意義(P<0.05);術后各時間點B、C組間SFI比較差異均無統計學意義(P>0.05)。見表1、圖4。
 )
Table1.
Comparison of the SFI among groups at different time points after operation (n=12,
)
Table1.
Comparison of the SFI among groups at different time points after operation (n=12,  )
)
 圖4
術后各時間點各組SFI
Figure4.
SFI of each group at different time points after operation
圖4
術后各時間點各組SFI
Figure4.
SFI of each group at different time points after operation
2.3 NCV檢測
術后各時間點A組NCV均顯著慢于其余3組,差異有統計學意義(P<0.05);B、C組NCV均慢于D組,但僅術后1個月時差異有統計學意義(P<0.05);術后各時間點B、C組間差異均無統計學意義(P>0.05)。見表2、圖5。
 )
Table2.
Comparison of the NVC among groups at different time points after operation (n=12,
)
Table2.
Comparison of the NVC among groups at different time points after operation (n=12,  )
)
 圖5
術后各時間點各組NCV
Figure5.
NCV of each group at different time points after operation
圖5
術后各時間點各組NCV
Figure5.
NCV of each group at different time points after operation
2.4 組織學檢測
免疫組織化學染色示各組S-100染色均為陽性,但組織染色深淺存在差異。A組神經組織失去正常結構,組織染色淺,可見空洞樣結構,見大量非雪旺細胞;B組可見大量正常神經結構,染色較A組深,去分化雪旺細胞分布明顯,并可見少量髓鞘包繞神經束的結構;C組可見神經束排列整齊,雪旺細胞及髓鞘中靠近雪旺細胞核部分染色較深,髓鞘染色較淺,間質細胞無明顯染色。B組雪旺細胞數量為(727.50±57.60)個/mm2,顯著多于A組(298.33±153.12)個/mm2,差異有統計學意義(t=6.139,P<0.001)。見圖6。
 圖6
術后3個月各組S-100免疫組織化學染色觀察(×200)
圖6
術后3個月各組S-100免疫組織化學染色觀察(×200)
a. A組;b. B組;c. C組
Figure6. S-100 immunohistochemical staining observation in each group at 3 months after operation (×200)a. Group A; b. Group B; c. Group C
3 討論
周圍神經損傷造成的神經缺損主要采用自體神經移植治療[12],但成功率僅為50%,還存在供區神經功能喪失、神經來源有限、供區神經與受損神經匹配度差、增加手術次數等弊端,限制了其在周圍神經損傷修復中的臨床應用[13]。特別是對于長距離神經缺損修復效果更差。20世紀70年代后期,人們開始逐漸使用生物材料制成的神經導管修復周圍神經缺損[14]。然而,隨著對神經組織工程研究的深入,研究者們逐漸認識到單一神經導管因不含有任何生物活性物質,僅作為神經再生的物理通道,不具備生物活性,所以修復效果不甚理想。因此,目前周圍神經組織工程研究熱點已轉向增強導管生物活性等方面[15]。
葉酸作為一種水溶性維生素,對中樞神經系統的早期發育、功能發揮和缺損修復都起著重要作用,適量補充葉酸能夠預防各種中樞神經病變,如神經管缺陷、生長發育遲滯、癡呆、脊髓退變、癲癇等[8,16-17]。在周圍神經系統中,葉酸能夠緩解周圍神經卡壓產生的疼痛,同時延緩其功能衰退[18],并促進糖尿病患者周圍神經損傷后NGF的表達水平及髓鞘再生,進而改善NCV與肢體感覺異常,起到保護周圍神經功能的作用[19]。目前研究表明,通過腹腔注射葉酸能夠促進損傷后坐骨神經髓鞘化及神經軸突再生,利于其功能恢復[19-20]。由柔軟并富有彈性的CUPE制備神經導管,內部有多個縱向孔道、外部無孔鞘,能夠模仿天然神經內微管和神經外膜結構[21],相關研究驗證其能促進大鼠1 cm坐骨神經缺損中神經纖維再生及髓鞘化。而關于使用fCUPE神經導管支架修復神經缺損的研究尚未見報道。本研究建立大鼠坐骨神經缺損模型,使用fCUPE神經導管支架修復神經缺損,分別于術后1、2、3個月測算SFI和NCV,第3個月處死大鼠取神經組織進行S-100免疫組織染色并計數雪旺細胞,以觀察fCUPE神經導管支架對大鼠周圍神經缺損的修復效果。
坐骨神經缺損后會影響神經及肌肉功能[22],出現不同程度足外展、內收障礙、足下垂和跨越步態,表現為腳掌與前進方向的夾角隨神經缺損程度增大而增大[23],檢測SFI能夠評價缺損神經的功能恢復情況。本研究結果顯示,各時間點B組SFI明顯低于A組,術后3個月B組SFI雖仍高于C組,但已很接近,提示fCUPE神經導管支架具有明顯的神經修復效果,且長期應用可能具有與自體神經移植相似的效果。也說明葉酸在改善神經導管生物活性方面具備一定優勢。
神經的主要功能是傳導電信號,檢測NCV能反映再生神經功能恢復水平。本研究結果顯示,術后各組NCV均有不同程度恢復,雖然各時間點C組恢復情況均優于B組,但兩組NCV接近,差異無統計學意義(P>0.05);同時兩組NCV恢復情況均優于A組,且差異有統計學意義(P<0.05);術后3個月A組NCV最低,但B、C、D組結果相近;說明葉酸對促進周圍神經再生起著重要作用。
雪旺細胞是周圍神經系統中重要的膠質細胞,不僅參與髓鞘形成,而且在周圍神經損傷后的再生修復過程中發揮重要作用。雪旺細胞能夠通過吞噬軸突碎片,支持引導再生纖維生長,分泌多種神經營養因子,促進軸突向遠端生長,同時產生細胞外基質和細胞黏附分子,防止受損神經元胞體死亡[21]。本研究S-100免疫組織化學染色結果顯示,C組神經束排列整齊,雪旺細胞及髓鞘中靠近雪旺細胞核部分著色較深;A組神經組織失去正常結構,組織著色淺,可見空洞樣結構,見大量非雪旺細胞;而B組神經結構正常,染色較A組深,去分化雪旺細胞分布明顯,雪旺細胞顯著多于A組,且在光鏡下觀察到少量髓鞘包繞神經束的結構,提示葉酸有可能通過促進雪旺細胞生成,對周圍神經再生起到刺激作用。既往研究認為,葉酸可能通過促進雪旺細胞增殖和遷移以及NGF分泌來促進周圍神經損傷修復[24]。因此,本研究中fCUPE神經導管支架上復合的葉酸促進雪旺細胞增殖,可能是其促進周圍神經損傷修復的主要機制之一。
本研究尚存在不足,通過冷凍干燥技術使葉酸附著于神經導管支架內表面上存在兩個問題,無法保證葉酸晶體附著的數量以及無法保證葉酸緩慢釋放。而且本研究未檢測橋接神經導管后的葉酸體內釋放速率。因此,針對葉酸尋找一種更優化的局部緩慢釋放方法,是未來研究重點。
綜上述,fCUPE神經導管可顯著改善長距離坐骨神經缺損大鼠的行走功能,長期應用與自體神經移植修復效果接近;同時,葉酸可改善神經導管活性,增強神經導管的人體適用性;fCUPE神經導管支架可在短時間內明顯恢復神經傳導功能,且與自體神經移植效果一致;葉酸還可促進受損周圍神經組織的恢復,并促進雪旺細胞生成以刺激神經再生。因此,fCUPE神經導管支架可用于治療大鼠周圍神經缺損,且效果與自體神經移植具有高度一致性,可能成為潛在的周圍神經缺損移植的替代材料,研究其作用、機制及應用有望解決自體神經移植治療神經缺損修復效果差、供區神經功能喪失、供體不足以及和受損神經匹配度差等臨床問題。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經首都醫科大學附屬北京天壇醫院倫理委員會批準(201603001);實驗動物生產許可證批準號:SCXK(京)2021-0011,使用許可證批準號:SYXK(京)2022-0052
作者貢獻聲明 亢衛波:研究設計、數據分析及文章撰寫;閆家智:對文章的知識性內容作批評性審閱,為研究提供行政、技術和材料支持;陳永杰、李晨曦、桑大成:參與研究設計;陳永杰:采集、分析數據;李晨曦:參與起草文章;桑大成:參與文章修改