引用本文: 王雨順, 鄭鑒銳, 羅玉鴻, 陳雷, 彭志港, 葉根森, 王德利, 譚振. 巨噬細胞介導的骨免疫在股骨頭壞死中的作用及其機制研究. 中國修復重建外科雜志, 2024, 38(1): 119-124. doi: 10.7507/1002-1892.202308026 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
股骨頭壞死(osteonecrosis of the femoral head,ONFH)是各種有害因素長期刺激下局部骨細胞及骨髓內細胞死亡、局部骨免疫紊亂,進而導致骨再生修復障礙[1-3]。據報道,2023年全球約有3 000萬ONFH患者,我國已超過812萬[1, 3]。約94% ONFH患者會在5年內出現股骨頭塌陷、行走功能障礙,最終需要接受人工全髖關節置換術[1, 3-5]。ONFH具體發病機制尚未明確,傳統觀點認為與微血管脂肪栓塞、血液高凝狀態、局部血流減少、骨內高壓、骨細胞凋亡等有關[6]。
近年來,骨骼系統和免疫系統之間基于細胞因子、信號傳導通路的相互作用關系得到了深入研究,并發展成為一門新興交叉學科——骨免疫學[7-8]。骨免疫學相關研究顯示,由于存在著共同的細胞因子、轉錄因子和信號通路,免疫細胞可以影響各種骨細胞(BMSCs、成骨細胞、破骨細胞等)的活化和功能,調控骨形成和骨修復過程[9-10]。基于ONFH動物模型和人體組織標本的免疫組織化學和免疫浸潤生信分析顯示,骨壞死組織中有大量巨噬細胞浸潤,激活的T淋巴細胞和B淋巴細胞也可能參與了骨壞死發展[11-15],提示ONFH的發生可能與局部骨免疫狀態異常有關。
免疫細胞包括巨噬細胞、T淋巴細胞、B淋巴細胞、粒細胞和肥大細胞等,研究發現巨噬細胞是ONFH壞死骨組織中數量最多的免疫細胞類型,提示其可能是主導壞死骨組織中骨免疫失衡的主要細胞群[11]。巨噬細胞屬于先天免疫細胞,主要由單核細胞分化而來。單核-巨噬細胞存在于骨微環境中,也可在炎癥反應時由趨化因子招募至局部骨微環境[16-17]。巨噬細胞的異質性和可塑性使得不同類型巨噬細胞在調控炎癥反應中發揮不同作用,是調節骨免疫反應的核心細胞類型之一[16-17];介導的骨免疫在調節ONFH炎癥、骨損傷和骨修復過程中起著關鍵作用[18]。然而,巨噬細胞與各種骨細胞之間存在的復雜調控網絡及其介導的骨免疫對ONFH的影響,仍需要進一步總結歸納。本綜述將歸納巨噬細胞的分類和功能,總結巨噬細胞對ONFH中慢性炎癥的骨免疫調控作用,從骨免疫學層面闡述骨壞死病理生理機制,為ONFH治療提供新思路。
1 巨噬細胞的分類及其在骨組織損傷修復中的作用
巨噬細胞是炎癥和先天免疫系統的重要參與者,可以通過識別吞噬作用、殺傷靶細胞、參與炎癥反應、抗原提呈、免疫調節等功能維持機體穩態[19-20]。人體內巨噬細胞是由單核細胞分化而來的多功能可塑性細胞,在各種因素刺激下可分化為經典活化型(M1型)和選擇活化型(M2型),發揮特定功能,參與并調節機體的生理病理過程[19-20]。其中,M1型巨噬細胞由促炎介質脂多糖和干擾素γ誘導,分泌促炎因子IL-6、IL-1β、誘導型一氧化氮合成酶和TNF-α,參與和維持早期炎癥反應,具有病原體殺傷能力,又稱為“促炎表型”;M2型巨噬細胞由抗炎介質IL-4和IL-13誘導,分泌抗炎因子IL-10、TGF-β,促進組織損傷修復和炎癥消退,又稱為“抗炎表型”[21-23]。M2型巨噬細胞又可細分為M2a、M2b、M2c和M2d亞型,分別在增強細胞生長和組織修復、參與炎癥、吞噬作用和腫瘤進展中發揮重要作用[24]。
巨噬細胞具有良好可塑性,M1與M2兩種類型在特定微環境中相互轉換參與炎癥和骨組織再生修復重要過程[25-26]。正常骨損傷修復過程中首先發生急性炎癥,這是骨組織損傷后的保護措施,旨在消除有害刺激、細胞碎片和骨碎片,重建正常骨組織[27-29]。骨損傷發生時,局部骨細胞、死亡細胞和巨噬細胞會釋放多種內源性刺激因子,包括損傷相關分子模式、細胞因子和趨化因子等,進一步從血循環中招募巨噬細胞、中性粒細胞等免疫細胞[26]。其中,巨噬細胞在骨損傷發生初期向M1型極化,釋放IL-1β、IL-6、TNF-α、IL-11、基質細胞衍生因子1等炎癥/促炎因子,促進破骨細胞的分化和活化[30-33]。活化的巨噬細胞和破骨細胞吞噬并清除骨碎片和細胞碎片等刺激源;與此同時,促炎因子招募MSCs,啟動成骨和成血管活動[27-29]。隨著刺激源的清除,巨噬細胞M1型向M2型極化,M2型巨噬細胞有助于促進骨組織修復和再生。通過釋放BMP-2、BMP-4、TGF-β1、IL-10等細胞因子/抗炎因子,促進BMSCs和成骨細胞的分化和增殖,主導骨組織損傷部位炎癥反應的消退,為骨組織再生創造了有利局部環境[28-29]。巨噬細胞M1型向M2型極化所調控的“急性炎癥-炎癥消退”程序避免了炎癥反應帶來的副作用,促進了骨組織修復[29, 34]。
2 巨噬細胞介導的骨免疫失衡導致ONFH發生發展
ONFH可由糖皮質激素、酒精、免疫性疾病、鐮狀細胞病等引起,其本質上是在各種有害刺激影響下形成局部慢性炎癥,從而導致骨壞死后骨組織修復障礙[27, 35]。巨噬細胞所調控的慢性炎癥和骨修復障礙參與ONFH發生、發展。慢性炎癥中過量的炎癥因子將影響正常成骨反應;在骨損傷前期,瞬時的TNF-α、IL-6信號會招募骨再生所需MSCs,而慢性炎癥中持續高水平的TNF-α、IL-6會抑制成骨[29]。其次,巨噬細胞、中性粒細胞帶來的過量活性氧和蛋白酶會造成周圍正常組織損傷,擴大骨損傷范圍。此外,過度炎癥會刺激破骨細胞分化、活化,造成炎性骨溶解[36]。因此,慢性炎癥是造成骨修復障礙、加重骨組織損傷的重要原因。在ONFH中,壞死骨組織中局部死亡細胞碎片、骨碎片等刺激因素的清除受阻,誘導局部慢性炎癥形成,引起骨修復障礙并持續加重骨組織損傷。
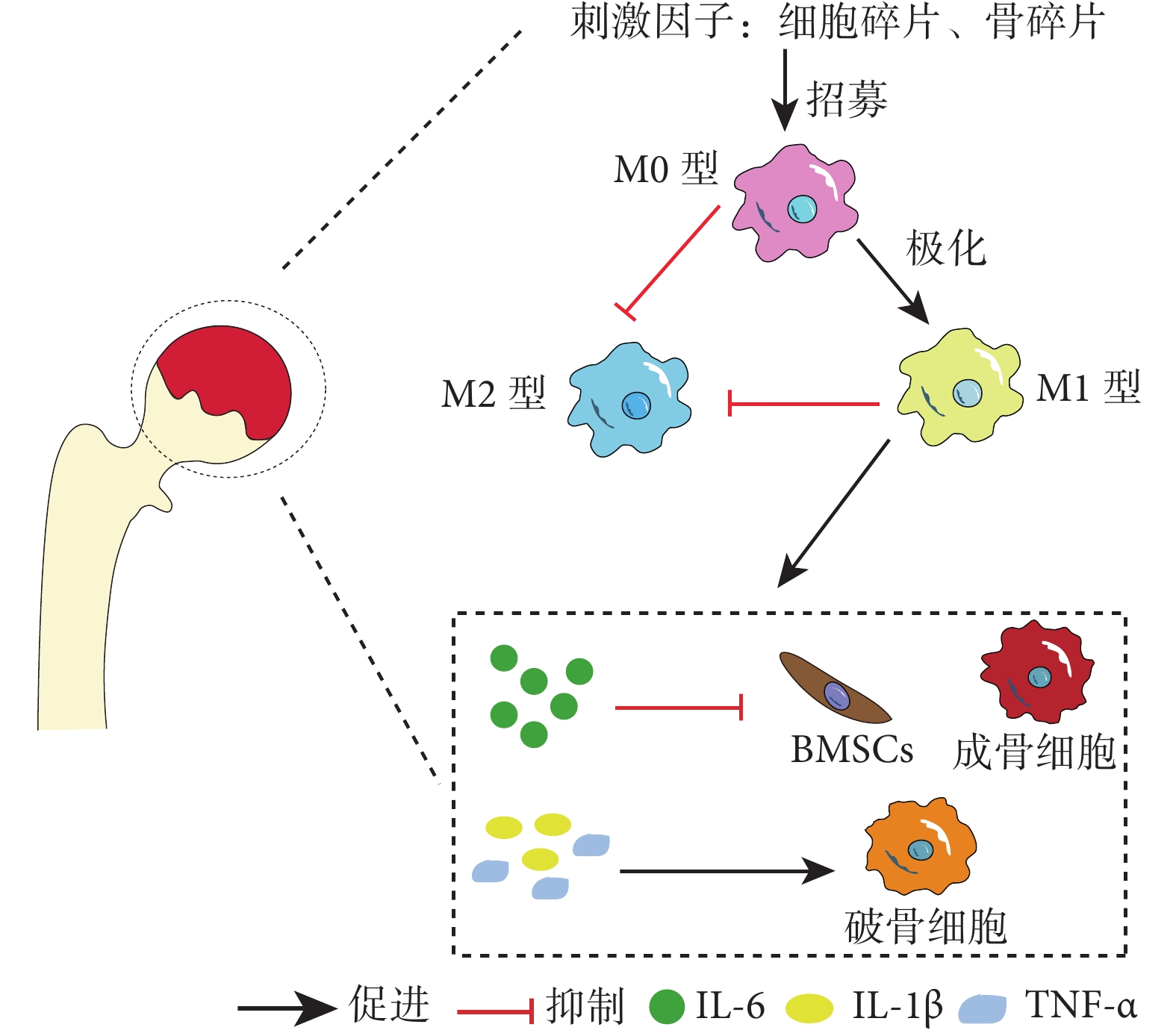
在ONFH發生、發展過程中,巨噬細胞持續向M1型極化,M2型極化受抑制;巨噬細胞介導的骨免疫失衡是壞死骨組織中慢性炎癥形成的重要原因之一。在ONFH動物模型中,骨壞死區域主要以M1型巨噬細胞為主,其分泌的大量促炎因子(TNF-α、IL-1β、IL-6等)促進了局部慢性炎癥的形成[37-38]。另外,在ONFH人體組織標本中也發現了M1型巨噬細胞浸潤,且M1/M2比例與ONFH的嚴重程度成正比[35]。骨壞死組織中浸潤的M1型巨噬細胞釋放的IL-6、TNF-α、IL-1β等炎癥介質可影響MSCs和成骨細胞的分化和活性,激活破骨細胞,加重骨組織壞死。IL-6是一種多效細胞因子,可調節廣泛分子網絡[39-40]。相關人體標本實驗發現,在ONFH骨壞死區域、滑膜組織和關節液中都可檢測到高水平IL-6[41]。在體外實驗中,IL-6可抑制MSCs和成骨細胞分化,并導致成骨細胞凋亡;同時,IL-6刺激成骨細胞高表達NF-κB受體活化因子配體,間接促進破骨細胞分化。在體內實驗中,清除巨噬細胞或抑制/敲除IL-6可增加骨壞死區域的骨細胞數量和礦物質沉積,促進骨壞死區域的骨形成[41-42]。TNF-α是另一個對骨細胞具有復雜影響的炎癥因子。瞬時的TNF-α信號可募集骨修復所需的BMSCs;而慢性炎癥中高水平TNF-α激活破骨細胞,主導炎性骨吸收過程[40, 43]。IL-1β不僅激活破骨細胞刺激骨吸收,還誘導成骨細胞表達CXC趨化因子配體13(CXC chemokine ligand 13,CXCL13);CXCL13可招募B淋巴細胞、T淋巴細胞,并促進局部炎癥反應[44]。由此可見,M1型巨噬細胞介導的慢性炎癥免疫微環境可影響正常骨吸收和骨形成,抑制骨壞死修復。見圖1。
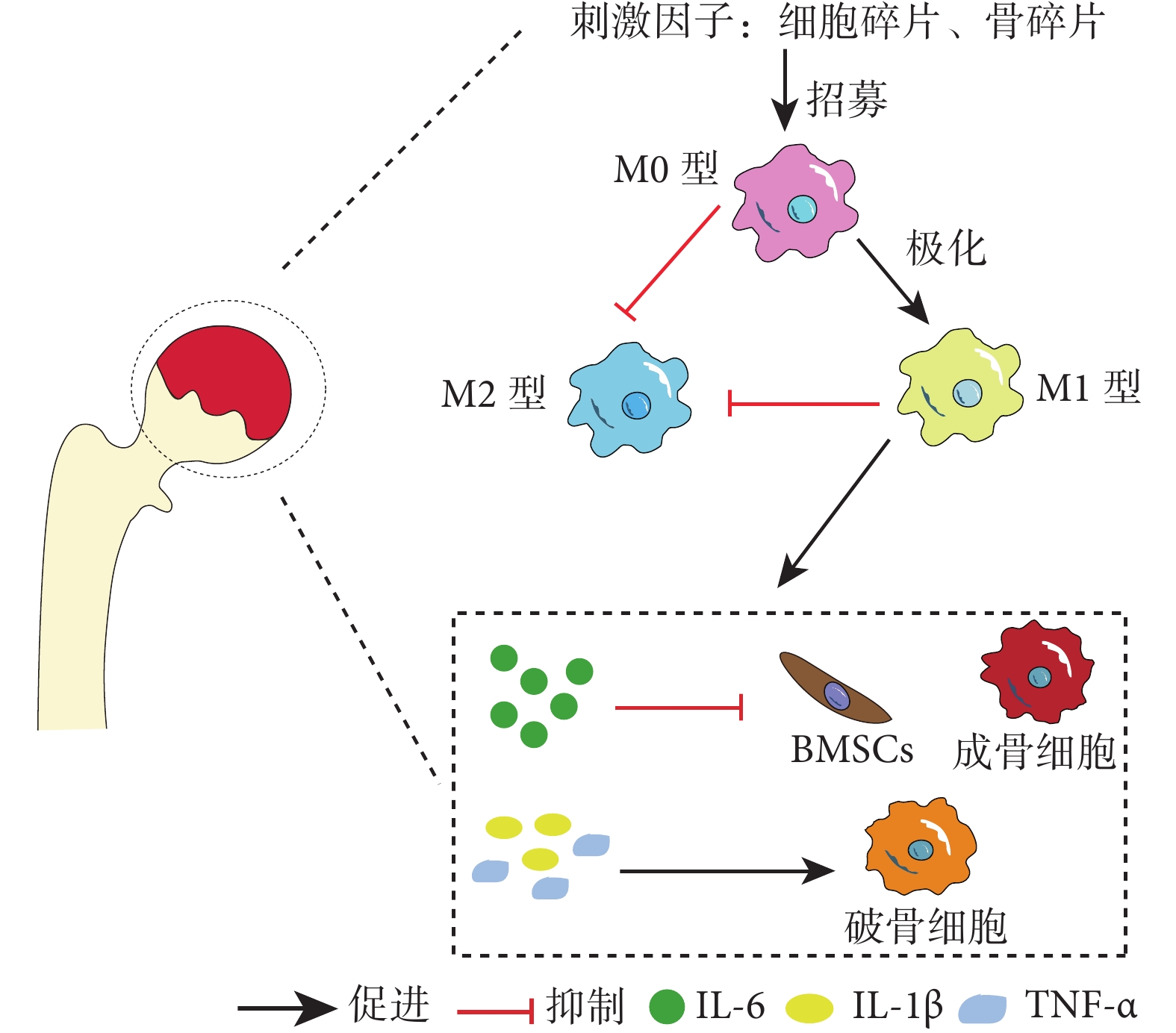 圖1
M1型巨噬細胞介導慢性炎癥免疫微環境抑制骨壞死修復過程,進而促使ONFH發生、發展示意圖
Figure1.
Schematic diagram of M1 macrophages mediating the chronic inflammatory microenvironment to inhibit the process of osteonecrosis repair and promote the development of ONFH
圖1
M1型巨噬細胞介導慢性炎癥免疫微環境抑制骨壞死修復過程,進而促使ONFH發生、發展示意圖
Figure1.
Schematic diagram of M1 macrophages mediating the chronic inflammatory microenvironment to inhibit the process of osteonecrosis repair and promote the development of ONFH
骨壞死修復障礙導致的ONFH發生、發展與巨噬細胞M1型極化的分子機制密切相關。既往研究發現,ONFH中活化的M1型巨噬細胞內Toll樣受體4(Toll-like receptor 4,TLR4)/NF-κB信號通路被激活[32]。TLR4/NF-κB信號通路參與巨噬細胞向骨壞死組織的招募,可促進巨噬細胞M1型極化并分泌炎癥因子;同時,激活的TLR4/NF-κB通路可能通過抑制Wnt/β-catenin通路來抑制骨生成[45-47]。JAK/STAT1通路是通過增加炎癥介導的骨細胞凋亡促進巨噬細胞M1型極化的另一個重要信號通路。此外,AKT/mTOR信號通路也與骨壞死和骨細胞凋亡中巨噬細胞M1型極化相關。因此,這些信號通路均在巨噬細胞M1型極化過程中發揮了重要作用。
3 調控巨噬細胞極化是潛在的ONFH治療策略
在ONFH局部免疫微環境中,巨噬細胞持續向M1型極化,M1/M2比例升高,可介導骨免疫失衡。而M1型巨噬細胞是主要的炎癥因子來源,其介導的慢性炎癥免疫微環境是抑制骨修復、促進ONFH進展的重要原因之一。因此,通過抑制巨噬細胞M1型極化或(和)促進M2型極化可能是治療ONFH的一種有效策略。
3.1 抑制巨噬細胞向M1型極化有效延緩ONFH進展
抑制巨噬細胞M1型極化相關信號通路(TLR4/NF-κB信號通路、JAK/STAT1信號通路和AKT/mTOR信號通路)是通過減少M1型巨噬細胞的局部浸潤,促進局部炎癥消退,減緩ONFH進展。既往研究發現,應用TLR4特異性抑制劑TAK242以及使用CRISPR-Cas9方法敲除TLR4,可有效抑制TLR4/ NF-κB信號通路和巨噬細胞M1型極化,降低了TNF-α、IL-1β和IL-6等炎癥因子水平,有效減輕ONFH骨壞死程度。體內研究表明,采用毛蕊異黃酮抑制TLR4/NF-κB通路可以明顯減輕大鼠ONFH病理改變,并且降低ONFH發生率[46]。Jin等[48]的研究發現姜黃素可抑制JAK/STAT1通路,從而抑制小鼠巨噬細胞M1型極化,避免了炎癥介導的骨細胞凋亡,有效減緩小鼠ONFH進展。此外,Tian等[31]的研究顯示人臍帶MSCs可通過抑制AKT/mTOR信號通路減少巨噬細胞M1型極化,改善糖皮質激素誘導的骨壞死和骨細胞凋亡。
總之,通過調節TLR4/NF-κB、JAK/STAT1、AKT/mTOR等信號通路抑制巨噬細胞M1型極化,可促進局部炎癥消退,是延緩骨壞死的有效手段。
3.2 調控巨噬細胞向M2型極化可修復壞死組織
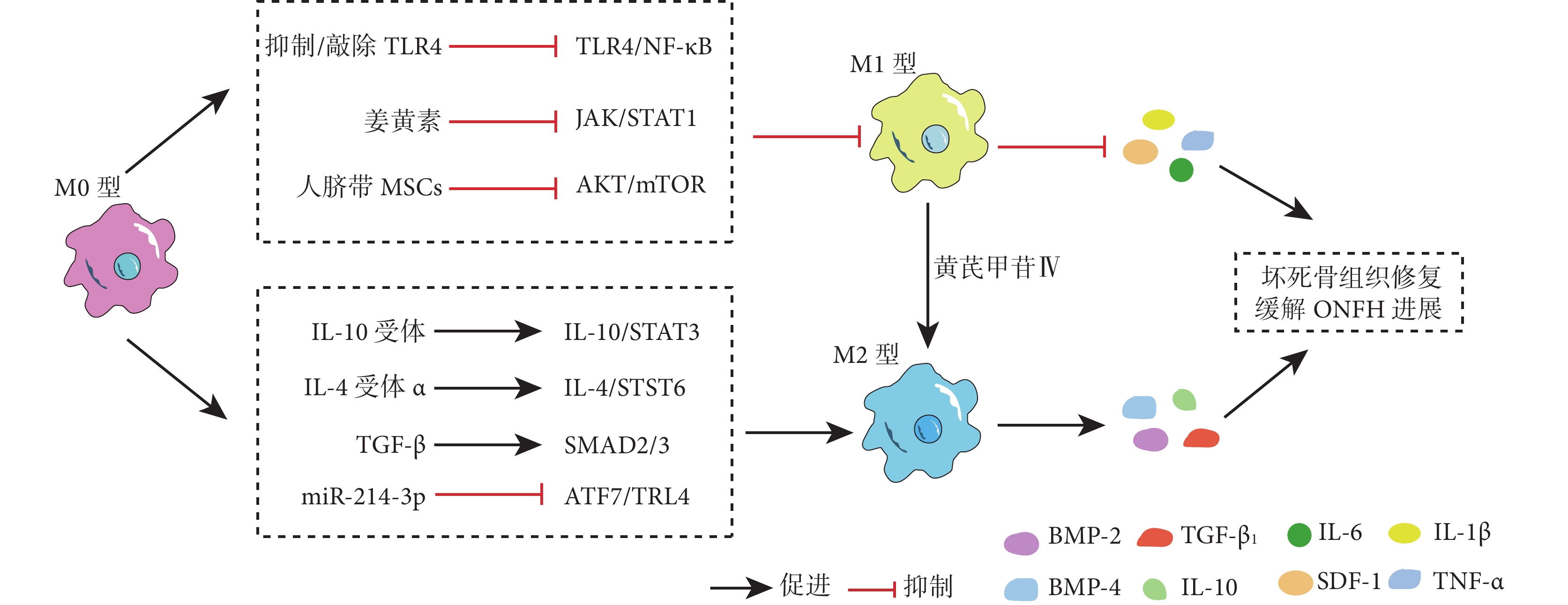
巨噬細胞M2型極化增加了抗炎因子IL-10、TGF-β和促成骨細胞因子BMP-2、BMP-4的分泌,構建的骨免疫微環境可促進骨組織損傷修復和炎癥消退[20, 26, 28]。目前已有研究使用外泌體、中藥提取物、水凝膠等治療ONFH,發現這些方法可促進巨噬細胞M2型極化并在局部構建骨免疫微環境促進骨修復。黃芪提取物黃芪甲苷Ⅳ被發現可以促進M1型巨噬細胞向M2型極化,抑制了骨細胞凋亡,促進骨壞死組織的修復[33]。在一項Legg-Calvé-Perthes病的相關研究中,研究者使用高表達miR-214-3p的工程化外泌體抑制ATF7/TLR4軸促進M2型極化,從而促進組織修復和血管生成,在一定程度上促進壞死骨組織修復[49]。在進一步研究中,工程化外泌體被裝載于細胞外基質模擬水凝膠中,確保了外泌體的持續釋放;這種外泌體水凝膠在大鼠激素性ONFH模型中能更有效地增強巨噬細胞 M2 型極化、血管生成和骨生成,從而修復壞死骨組織[50]。由此可見,調控巨噬細胞M2型極化有利于局部骨修復的骨免疫微環境形成,從而促進壞死骨組織再生修復。通過激活IL-10/STAT3、IL-4/STAT6、SMAD2/3等信號通路可刺激巨噬細胞M2型極化,可能成為ONFH的潛在治療手段[51-52]。見圖2。
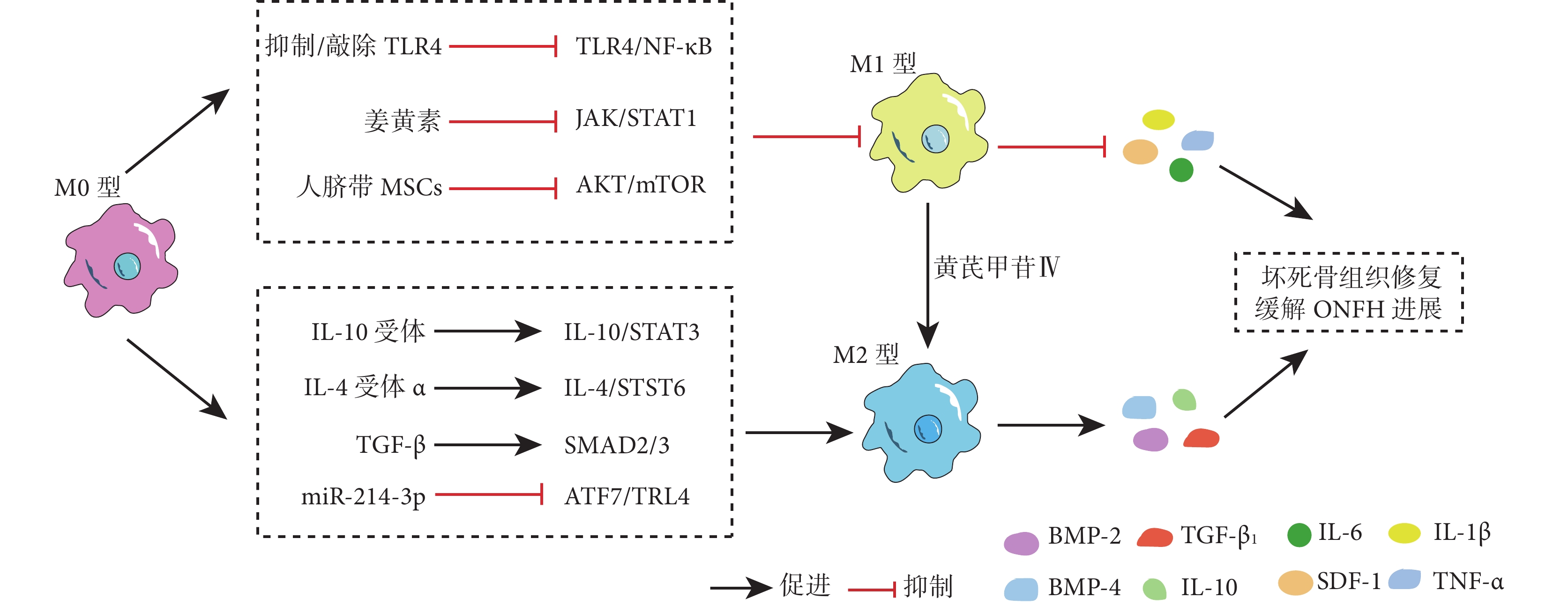 圖2
在慢性炎癥微環境中抑制巨噬細胞M1型極化或(和)調控巨噬細胞向M2型極化延緩ONFH進展示意圖
Figure2.
Schematic diagram of inhibiting the polarization of macrophages to M1 or (and) regulating the polarization of macrophages to M2 in the chronic inflammatory microenvironment to delay the progress of ONFH
圖2
在慢性炎癥微環境中抑制巨噬細胞M1型極化或(和)調控巨噬細胞向M2型極化延緩ONFH進展示意圖
Figure2.
Schematic diagram of inhibiting the polarization of macrophages to M1 or (and) regulating the polarization of macrophages to M2 in the chronic inflammatory microenvironment to delay the progress of ONFH
4 總結與展望
在ONFH發生、發展過程中,壞死骨組織浸潤的巨噬細胞主要向M1型極化,M1/M2比例失衡,導致局部骨免疫功能失衡,促進局部慢性炎癥免疫微環境形成,阻礙骨壞死再生修復。目前研究已明確巨噬細胞介導慢性炎癥免疫微環境是ONFH進展的重要機制,然而其他免疫細胞(中性粒細胞、B淋巴細胞、T淋巴細胞、樹突狀細胞等)在ONFH局部組織中的分布仍存在爭議[53-55],且在該病進展中作用尚不清楚。后續需要對ONFH中各種免疫細胞的亞型、各種免疫細胞之間以及各種免疫細胞與巨噬細胞之間的相互作用進行研究,但由于骨細胞和免疫細胞的異質性,這方面研究極具挑戰性。因此,對ONFH中復雜的骨免疫網絡進行深入研究將有利于開發新的ONFH治療手段。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點及其報道
作者貢獻聲明 王雨順、鄭鑒銳:綜述構思及設計、文獻查閱及文章撰寫;羅玉鴻、陳雷、彭志港、葉根森:資料整合;王德利、譚振:論文審閱及修改
股骨頭壞死(osteonecrosis of the femoral head,ONFH)是各種有害因素長期刺激下局部骨細胞及骨髓內細胞死亡、局部骨免疫紊亂,進而導致骨再生修復障礙[1-3]。據報道,2023年全球約有3 000萬ONFH患者,我國已超過812萬[1, 3]。約94% ONFH患者會在5年內出現股骨頭塌陷、行走功能障礙,最終需要接受人工全髖關節置換術[1, 3-5]。ONFH具體發病機制尚未明確,傳統觀點認為與微血管脂肪栓塞、血液高凝狀態、局部血流減少、骨內高壓、骨細胞凋亡等有關[6]。
近年來,骨骼系統和免疫系統之間基于細胞因子、信號傳導通路的相互作用關系得到了深入研究,并發展成為一門新興交叉學科——骨免疫學[7-8]。骨免疫學相關研究顯示,由于存在著共同的細胞因子、轉錄因子和信號通路,免疫細胞可以影響各種骨細胞(BMSCs、成骨細胞、破骨細胞等)的活化和功能,調控骨形成和骨修復過程[9-10]。基于ONFH動物模型和人體組織標本的免疫組織化學和免疫浸潤生信分析顯示,骨壞死組織中有大量巨噬細胞浸潤,激活的T淋巴細胞和B淋巴細胞也可能參與了骨壞死發展[11-15],提示ONFH的發生可能與局部骨免疫狀態異常有關。
免疫細胞包括巨噬細胞、T淋巴細胞、B淋巴細胞、粒細胞和肥大細胞等,研究發現巨噬細胞是ONFH壞死骨組織中數量最多的免疫細胞類型,提示其可能是主導壞死骨組織中骨免疫失衡的主要細胞群[11]。巨噬細胞屬于先天免疫細胞,主要由單核細胞分化而來。單核-巨噬細胞存在于骨微環境中,也可在炎癥反應時由趨化因子招募至局部骨微環境[16-17]。巨噬細胞的異質性和可塑性使得不同類型巨噬細胞在調控炎癥反應中發揮不同作用,是調節骨免疫反應的核心細胞類型之一[16-17];介導的骨免疫在調節ONFH炎癥、骨損傷和骨修復過程中起著關鍵作用[18]。然而,巨噬細胞與各種骨細胞之間存在的復雜調控網絡及其介導的骨免疫對ONFH的影響,仍需要進一步總結歸納。本綜述將歸納巨噬細胞的分類和功能,總結巨噬細胞對ONFH中慢性炎癥的骨免疫調控作用,從骨免疫學層面闡述骨壞死病理生理機制,為ONFH治療提供新思路。
1 巨噬細胞的分類及其在骨組織損傷修復中的作用
巨噬細胞是炎癥和先天免疫系統的重要參與者,可以通過識別吞噬作用、殺傷靶細胞、參與炎癥反應、抗原提呈、免疫調節等功能維持機體穩態[19-20]。人體內巨噬細胞是由單核細胞分化而來的多功能可塑性細胞,在各種因素刺激下可分化為經典活化型(M1型)和選擇活化型(M2型),發揮特定功能,參與并調節機體的生理病理過程[19-20]。其中,M1型巨噬細胞由促炎介質脂多糖和干擾素γ誘導,分泌促炎因子IL-6、IL-1β、誘導型一氧化氮合成酶和TNF-α,參與和維持早期炎癥反應,具有病原體殺傷能力,又稱為“促炎表型”;M2型巨噬細胞由抗炎介質IL-4和IL-13誘導,分泌抗炎因子IL-10、TGF-β,促進組織損傷修復和炎癥消退,又稱為“抗炎表型”[21-23]。M2型巨噬細胞又可細分為M2a、M2b、M2c和M2d亞型,分別在增強細胞生長和組織修復、參與炎癥、吞噬作用和腫瘤進展中發揮重要作用[24]。
巨噬細胞具有良好可塑性,M1與M2兩種類型在特定微環境中相互轉換參與炎癥和骨組織再生修復重要過程[25-26]。正常骨損傷修復過程中首先發生急性炎癥,這是骨組織損傷后的保護措施,旨在消除有害刺激、細胞碎片和骨碎片,重建正常骨組織[27-29]。骨損傷發生時,局部骨細胞、死亡細胞和巨噬細胞會釋放多種內源性刺激因子,包括損傷相關分子模式、細胞因子和趨化因子等,進一步從血循環中招募巨噬細胞、中性粒細胞等免疫細胞[26]。其中,巨噬細胞在骨損傷發生初期向M1型極化,釋放IL-1β、IL-6、TNF-α、IL-11、基質細胞衍生因子1等炎癥/促炎因子,促進破骨細胞的分化和活化[30-33]。活化的巨噬細胞和破骨細胞吞噬并清除骨碎片和細胞碎片等刺激源;與此同時,促炎因子招募MSCs,啟動成骨和成血管活動[27-29]。隨著刺激源的清除,巨噬細胞M1型向M2型極化,M2型巨噬細胞有助于促進骨組織修復和再生。通過釋放BMP-2、BMP-4、TGF-β1、IL-10等細胞因子/抗炎因子,促進BMSCs和成骨細胞的分化和增殖,主導骨組織損傷部位炎癥反應的消退,為骨組織再生創造了有利局部環境[28-29]。巨噬細胞M1型向M2型極化所調控的“急性炎癥-炎癥消退”程序避免了炎癥反應帶來的副作用,促進了骨組織修復[29, 34]。
2 巨噬細胞介導的骨免疫失衡導致ONFH發生發展
ONFH可由糖皮質激素、酒精、免疫性疾病、鐮狀細胞病等引起,其本質上是在各種有害刺激影響下形成局部慢性炎癥,從而導致骨壞死后骨組織修復障礙[27, 35]。巨噬細胞所調控的慢性炎癥和骨修復障礙參與ONFH發生、發展。慢性炎癥中過量的炎癥因子將影響正常成骨反應;在骨損傷前期,瞬時的TNF-α、IL-6信號會招募骨再生所需MSCs,而慢性炎癥中持續高水平的TNF-α、IL-6會抑制成骨[29]。其次,巨噬細胞、中性粒細胞帶來的過量活性氧和蛋白酶會造成周圍正常組織損傷,擴大骨損傷范圍。此外,過度炎癥會刺激破骨細胞分化、活化,造成炎性骨溶解[36]。因此,慢性炎癥是造成骨修復障礙、加重骨組織損傷的重要原因。在ONFH中,壞死骨組織中局部死亡細胞碎片、骨碎片等刺激因素的清除受阻,誘導局部慢性炎癥形成,引起骨修復障礙并持續加重骨組織損傷。
在ONFH發生、發展過程中,巨噬細胞持續向M1型極化,M2型極化受抑制;巨噬細胞介導的骨免疫失衡是壞死骨組織中慢性炎癥形成的重要原因之一。在ONFH動物模型中,骨壞死區域主要以M1型巨噬細胞為主,其分泌的大量促炎因子(TNF-α、IL-1β、IL-6等)促進了局部慢性炎癥的形成[37-38]。另外,在ONFH人體組織標本中也發現了M1型巨噬細胞浸潤,且M1/M2比例與ONFH的嚴重程度成正比[35]。骨壞死組織中浸潤的M1型巨噬細胞釋放的IL-6、TNF-α、IL-1β等炎癥介質可影響MSCs和成骨細胞的分化和活性,激活破骨細胞,加重骨組織壞死。IL-6是一種多效細胞因子,可調節廣泛分子網絡[39-40]。相關人體標本實驗發現,在ONFH骨壞死區域、滑膜組織和關節液中都可檢測到高水平IL-6[41]。在體外實驗中,IL-6可抑制MSCs和成骨細胞分化,并導致成骨細胞凋亡;同時,IL-6刺激成骨細胞高表達NF-κB受體活化因子配體,間接促進破骨細胞分化。在體內實驗中,清除巨噬細胞或抑制/敲除IL-6可增加骨壞死區域的骨細胞數量和礦物質沉積,促進骨壞死區域的骨形成[41-42]。TNF-α是另一個對骨細胞具有復雜影響的炎癥因子。瞬時的TNF-α信號可募集骨修復所需的BMSCs;而慢性炎癥中高水平TNF-α激活破骨細胞,主導炎性骨吸收過程[40, 43]。IL-1β不僅激活破骨細胞刺激骨吸收,還誘導成骨細胞表達CXC趨化因子配體13(CXC chemokine ligand 13,CXCL13);CXCL13可招募B淋巴細胞、T淋巴細胞,并促進局部炎癥反應[44]。由此可見,M1型巨噬細胞介導的慢性炎癥免疫微環境可影響正常骨吸收和骨形成,抑制骨壞死修復。見圖1。
 圖1
M1型巨噬細胞介導慢性炎癥免疫微環境抑制骨壞死修復過程,進而促使ONFH發生、發展示意圖
Figure1.
Schematic diagram of M1 macrophages mediating the chronic inflammatory microenvironment to inhibit the process of osteonecrosis repair and promote the development of ONFH
圖1
M1型巨噬細胞介導慢性炎癥免疫微環境抑制骨壞死修復過程,進而促使ONFH發生、發展示意圖
Figure1.
Schematic diagram of M1 macrophages mediating the chronic inflammatory microenvironment to inhibit the process of osteonecrosis repair and promote the development of ONFH
骨壞死修復障礙導致的ONFH發生、發展與巨噬細胞M1型極化的分子機制密切相關。既往研究發現,ONFH中活化的M1型巨噬細胞內Toll樣受體4(Toll-like receptor 4,TLR4)/NF-κB信號通路被激活[32]。TLR4/NF-κB信號通路參與巨噬細胞向骨壞死組織的招募,可促進巨噬細胞M1型極化并分泌炎癥因子;同時,激活的TLR4/NF-κB通路可能通過抑制Wnt/β-catenin通路來抑制骨生成[45-47]。JAK/STAT1通路是通過增加炎癥介導的骨細胞凋亡促進巨噬細胞M1型極化的另一個重要信號通路。此外,AKT/mTOR信號通路也與骨壞死和骨細胞凋亡中巨噬細胞M1型極化相關。因此,這些信號通路均在巨噬細胞M1型極化過程中發揮了重要作用。
3 調控巨噬細胞極化是潛在的ONFH治療策略
在ONFH局部免疫微環境中,巨噬細胞持續向M1型極化,M1/M2比例升高,可介導骨免疫失衡。而M1型巨噬細胞是主要的炎癥因子來源,其介導的慢性炎癥免疫微環境是抑制骨修復、促進ONFH進展的重要原因之一。因此,通過抑制巨噬細胞M1型極化或(和)促進M2型極化可能是治療ONFH的一種有效策略。
3.1 抑制巨噬細胞向M1型極化有效延緩ONFH進展
抑制巨噬細胞M1型極化相關信號通路(TLR4/NF-κB信號通路、JAK/STAT1信號通路和AKT/mTOR信號通路)是通過減少M1型巨噬細胞的局部浸潤,促進局部炎癥消退,減緩ONFH進展。既往研究發現,應用TLR4特異性抑制劑TAK242以及使用CRISPR-Cas9方法敲除TLR4,可有效抑制TLR4/ NF-κB信號通路和巨噬細胞M1型極化,降低了TNF-α、IL-1β和IL-6等炎癥因子水平,有效減輕ONFH骨壞死程度。體內研究表明,采用毛蕊異黃酮抑制TLR4/NF-κB通路可以明顯減輕大鼠ONFH病理改變,并且降低ONFH發生率[46]。Jin等[48]的研究發現姜黃素可抑制JAK/STAT1通路,從而抑制小鼠巨噬細胞M1型極化,避免了炎癥介導的骨細胞凋亡,有效減緩小鼠ONFH進展。此外,Tian等[31]的研究顯示人臍帶MSCs可通過抑制AKT/mTOR信號通路減少巨噬細胞M1型極化,改善糖皮質激素誘導的骨壞死和骨細胞凋亡。
總之,通過調節TLR4/NF-κB、JAK/STAT1、AKT/mTOR等信號通路抑制巨噬細胞M1型極化,可促進局部炎癥消退,是延緩骨壞死的有效手段。
3.2 調控巨噬細胞向M2型極化可修復壞死組織
巨噬細胞M2型極化增加了抗炎因子IL-10、TGF-β和促成骨細胞因子BMP-2、BMP-4的分泌,構建的骨免疫微環境可促進骨組織損傷修復和炎癥消退[20, 26, 28]。目前已有研究使用外泌體、中藥提取物、水凝膠等治療ONFH,發現這些方法可促進巨噬細胞M2型極化并在局部構建骨免疫微環境促進骨修復。黃芪提取物黃芪甲苷Ⅳ被發現可以促進M1型巨噬細胞向M2型極化,抑制了骨細胞凋亡,促進骨壞死組織的修復[33]。在一項Legg-Calvé-Perthes病的相關研究中,研究者使用高表達miR-214-3p的工程化外泌體抑制ATF7/TLR4軸促進M2型極化,從而促進組織修復和血管生成,在一定程度上促進壞死骨組織修復[49]。在進一步研究中,工程化外泌體被裝載于細胞外基質模擬水凝膠中,確保了外泌體的持續釋放;這種外泌體水凝膠在大鼠激素性ONFH模型中能更有效地增強巨噬細胞 M2 型極化、血管生成和骨生成,從而修復壞死骨組織[50]。由此可見,調控巨噬細胞M2型極化有利于局部骨修復的骨免疫微環境形成,從而促進壞死骨組織再生修復。通過激活IL-10/STAT3、IL-4/STAT6、SMAD2/3等信號通路可刺激巨噬細胞M2型極化,可能成為ONFH的潛在治療手段[51-52]。見圖2。
 圖2
在慢性炎癥微環境中抑制巨噬細胞M1型極化或(和)調控巨噬細胞向M2型極化延緩ONFH進展示意圖
Figure2.
Schematic diagram of inhibiting the polarization of macrophages to M1 or (and) regulating the polarization of macrophages to M2 in the chronic inflammatory microenvironment to delay the progress of ONFH
圖2
在慢性炎癥微環境中抑制巨噬細胞M1型極化或(和)調控巨噬細胞向M2型極化延緩ONFH進展示意圖
Figure2.
Schematic diagram of inhibiting the polarization of macrophages to M1 or (and) regulating the polarization of macrophages to M2 in the chronic inflammatory microenvironment to delay the progress of ONFH
4 總結與展望
在ONFH發生、發展過程中,壞死骨組織浸潤的巨噬細胞主要向M1型極化,M1/M2比例失衡,導致局部骨免疫功能失衡,促進局部慢性炎癥免疫微環境形成,阻礙骨壞死再生修復。目前研究已明確巨噬細胞介導慢性炎癥免疫微環境是ONFH進展的重要機制,然而其他免疫細胞(中性粒細胞、B淋巴細胞、T淋巴細胞、樹突狀細胞等)在ONFH局部組織中的分布仍存在爭議[53-55],且在該病進展中作用尚不清楚。后續需要對ONFH中各種免疫細胞的亞型、各種免疫細胞之間以及各種免疫細胞與巨噬細胞之間的相互作用進行研究,但由于骨細胞和免疫細胞的異質性,這方面研究極具挑戰性。因此,對ONFH中復雜的骨免疫網絡進行深入研究將有利于開發新的ONFH治療手段。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點及其報道
作者貢獻聲明 王雨順、鄭鑒銳:綜述構思及設計、文獻查閱及文章撰寫;羅玉鴻、陳雷、彭志港、葉根森:資料整合;王德利、譚振:論文審閱及修改