引用本文: 陳國輝, 李亞星, 張暉, 解慧琪. Piezo機械敏感性離子通道在骨關節系統中的作用. 中國修復重建外科雜志, 2024, 38(2): 240-248. doi: 10.7507/1002-1892.202310092 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
機械信號轉導是細胞感知并響應機械刺激的重要過程,在多種細胞行為、組織發育、器官感知以及機體生理/病理活動中發揮著關鍵作用[1-9]。骨關節系統作為脊椎動物的支撐和運動結構,與機械刺激關系尤為密切[10-12]。1892年,Wolff提出骨組織有著極強的環境適應能力,骨自身形態或是所受應力改變均會導致其內部結構和外部形態相應改變,且該過程遵循數學規律,此即著名的“Wolff定律”。20世紀80年代,Ilizarov提出了“張力-應力法則”,即對活體組織給予持續、穩定、緩慢牽拉,可刺激某些組織、細胞再生和活躍生長;并基于該法則進一步提出了牽張成骨技術,即通過牽拉刺激骨組織再生[13-22]。大量研究表明,骨關節系統的主要細胞,如BMSCs、成骨細胞(osteoblasts,OBs)、破骨細胞(osteoclasts,OCs)、軟骨細胞及骨細胞等均能感知并響應剪切、拉伸、壓縮等應力以及基質剛度等機械信號。此外,骨與關節的諸多疾病,如骨愈合障礙、骨質疏松以及骨關節炎等,也可能與細胞機械信號轉導障礙相關[23-30]。因此,深入了解骨組織及其主要細胞如何感知機械信號并將其轉化為生物信號,并確定這種信號轉導在骨關節系統的生理/病理過程,對于研究骨關節疾病的發病機制和治療靶點具有重要意義。
機械敏感性離子通道,又稱為“機械門控離子通道”,作為活細胞表面主要的機械傳感器,是細胞機械信號轉導過程的關鍵;其通過直接感知施加于細胞膜上的機械刺激,快速引起胞膜激發或胞內信號激活[30-32]。2010年,Patapoutian課題組首次鑒定出哺乳動物中介導陽離子內流的機械門控陽離子通道——Piezo蛋白家族(包括Piezo1和Piezo2兩個亞型),由此掀開了哺乳動物機械信號轉導研究的新篇章[33]。
Piezo蛋白是一類大型呈孔狀的多聚體膜蛋白,在果蠅、斑馬魚、鳥類、哺乳動物以及植物等多個物種中參與細胞機械信號轉導過程[34-43]。在外界機械刺激下,Piezo離子通道被激活后開放,致使陽離子跨膜運輸進入胞內,從而實現機械信號向電化學信號轉換,最終參與觸覺感知、本體感覺以及細胞分裂、增殖、分化、遷移等一系列細胞行為的調控[9,12,23,26,29,33-39]。研究顯示,Piezo蛋白在心血管系統、肺、皮膚、大腦等多種器官組織中均有表達[12,23,24,37,40-43],其中在骨關節系統中明顯高表達[12, 44],在BMSCs命運調節、骨骼發育、骨穩態維持、骨損傷修復以及骨關節炎發生、發展等諸多生理和病理過程中發揮關鍵作用[23-24,29,39,45-47]。
本文旨在回顧Piezo機械敏感性離子通道的最新研究進展,介紹其分子結構與作用機制,著重綜述骨關節系統中Piezo蛋白相關研究,以期為骨與關節領域機械信號轉導的后續研究提供方向。
1 Piezo蛋白的結構特征
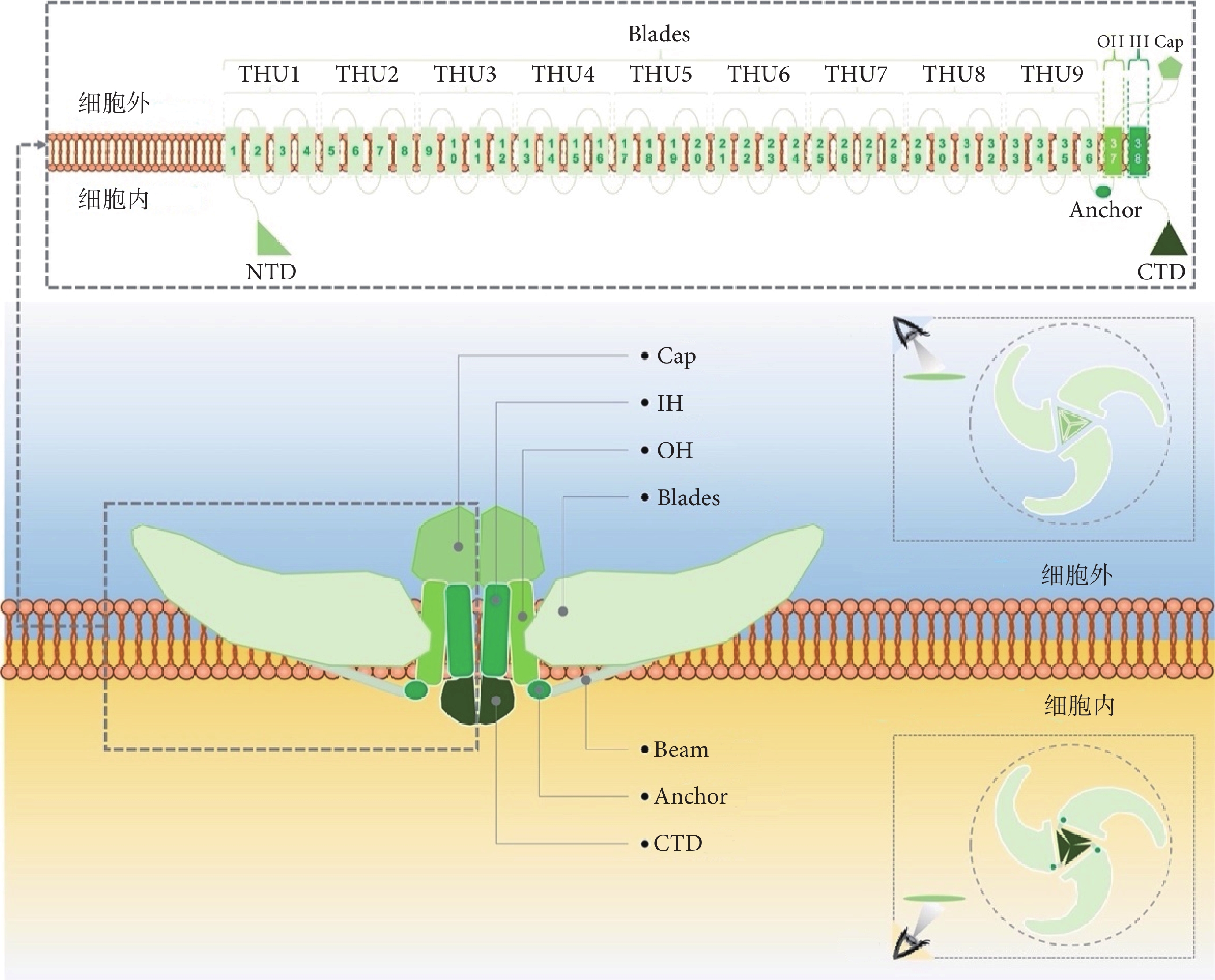
Piezo蛋白是一類大型跨膜蛋白[33]。Piezo1、 2蛋白在人體內分別由2 521、2 752個氨基酸構成,在小鼠體內則由2 547、2 822個氨基酸構成。Piezo 1、2蛋白結構大致相似,在低溫電鏡下小鼠Piezo1、2蛋白由3個單體構成類似于“三葉螺旋槳”的同源三聚體結構,每個蛋白單體擁有的38個跨膜螺旋構成了114個跨膜區域,在空間分布上形成碗狀凹陷結構(又稱“納米碗”);其蛋白單體N端的36個跨膜螺旋,即外周螺旋(peripheral helices,PHs),以每4個跨膜區組成1個單元的形式,構成9個重復的跨膜結構單元(transmembrane helical unit,THU;又稱Piezo repeat),形成向外周伸展的“螺旋槳葉片”結構(Blades);蛋白單體C端余下的2個跨膜螺旋 [由外周向中心分別為外螺旋(outer helix,OH)、內螺旋(inner helix,IH)] 則以三聚化形式參與構成供離子進入細胞的孔道(圖1)[48-51]。從結構上來看,Piezo1、2蛋白主要可以分為N端的“螺旋槳葉片”模塊、C端的中央孔模塊、起連接作用的“橫梁結構(Beam)”和“錨定區(Anchor)”;其中,C端的中央孔模塊包含OH、IH、胞內的C端結構域(C-terminal domain,CTD)以及胞外的“帽狀”結構域(C-terminal extracellular domain,CED;又稱Cap),以OH-Cap-IH-CTD順序連接;“橫梁結構”作為骨架支撐“螺旋槳葉片”并將其連接至C端結構域;“錨定區”楔入THU9(即repeat A)與OH之間,將外周“螺旋槳葉片”與中央孔模塊連接,即PHs-Anchor-OH-Cap-IH-CED順序連接[12,48-51]。
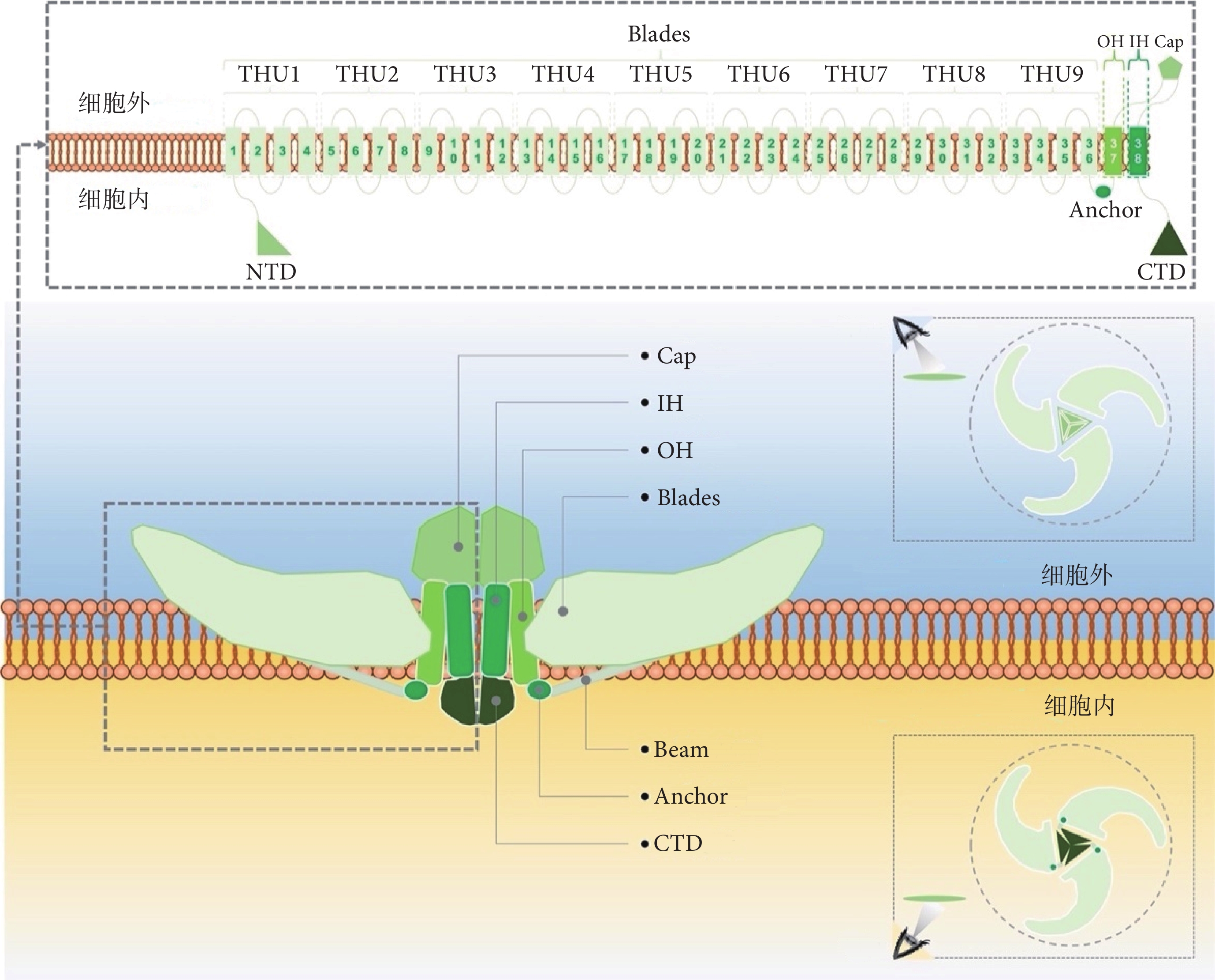 圖1
Piezo離子通道結構示意圖
Figure1.
Structure diagram of Piezo ion channel
圖1
Piezo離子通道結構示意圖
Figure1.
Structure diagram of Piezo ion channel
2 Piezo蛋白的門控機制
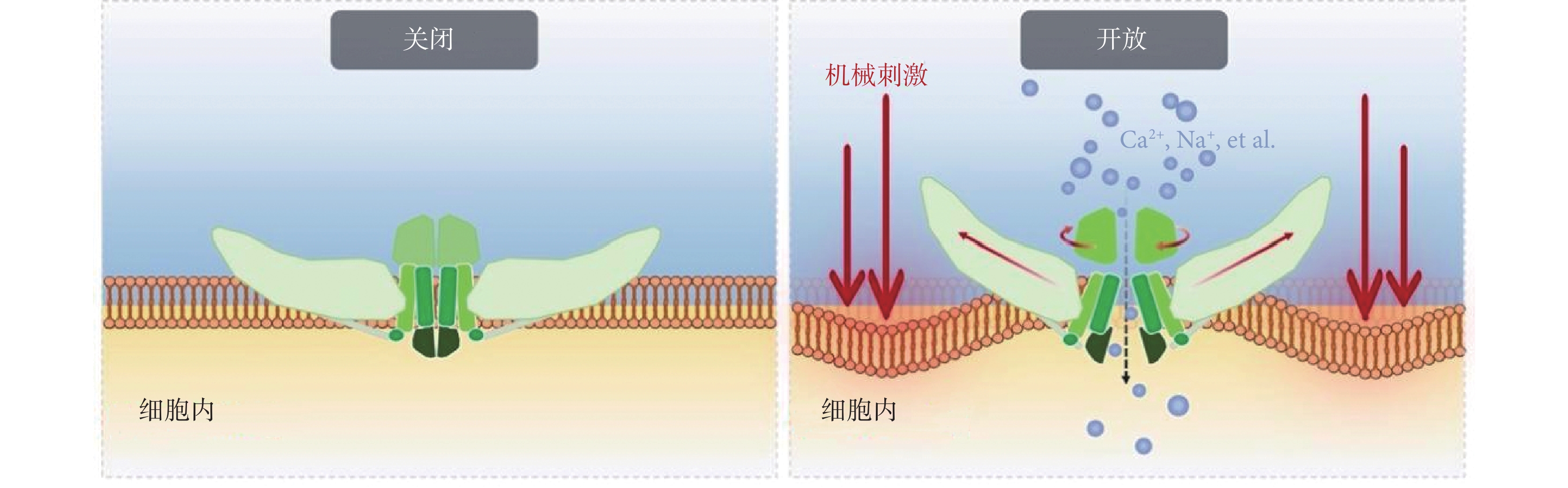
Piezo蛋白作為關鍵的機械傳感器,其作用在于感知外界機械刺激并允許陽離子進行跨膜運輸進入胞內,從而依靠所產生的電化學信號引發一系列細胞內下游信號反應,最終轉化為相應的生物學信號參與調控細胞行為。我國肖百龍博士課題組就Piezo離子通道門控機制發表了一系列研究,提出其機械門控的“杠桿作用機制假說”、“門塞-閂鎖門控機制”、“雙門控作用機制假說”等[38,49-52]。在Piezo2離子通道中,由3個IH合圍形成的中央孔道完全封閉,孔道上方存在一個收縮部位(上跨膜區孔道“閘門”);下方存在一個10? 長度的狹窄部位(下跨膜區孔道“閘門”),該狹窄部位由朝向孔道的殘基形成;而在Piezo1離子通道中,上述兩處“閘門”均處于擴張狀態[49,51]。Piezo蛋白胞外的CED可以通過旋轉運動來控制兩處激活“閘門”的開放(圖2)[51]。Piezo蛋白通過其“雙門控機制”實現機械刺激的感知與響應,即:機械刺激作用下,Piezo蛋白胞外的CED通過旋轉運動,打開上、下跨膜區孔道“閘門”;另一方面,機械刺激在外周“螺旋槳葉片”脂質分子間所產生的張力,被胞內的“橫梁結構”依靠“杠桿作用”傳遞至中央孔道模塊,拉開中央孔道區的“閂鎖”結構,進而拔除側向“門塞”結構,最終打開胞內的側向孔道,實現離子跨膜運輸進入胞內。
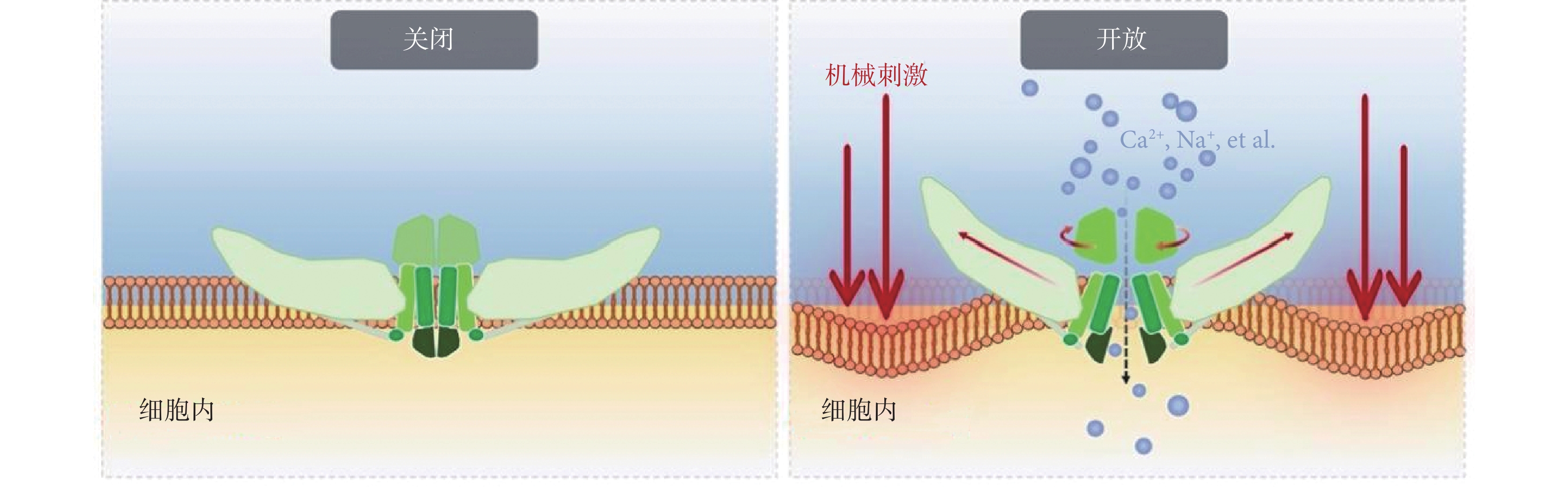 圖2
Piezo離子通道門控機制示意圖
Figure2.
Schematic diagram of Piezo ion channel gating mechanism
圖2
Piezo離子通道門控機制示意圖
Figure2.
Schematic diagram of Piezo ion channel gating mechanism
3 Piezo蛋白在骨關節系統中的作用
Piezo蛋白在骨髓、骨骼、關節軟骨以及椎間盤等組織中均有表達,通過介導相關細胞(如BMSCs、OBs、OCs、軟骨細胞以及骨細胞等)的機械-生物信號轉導過程,在骨關節細胞行為、器官發育、生理功能、病理過程等環節發揮重要調控作用 [46,52-57]。
3.1 Piezo蛋白與BMSCs
BMSCs是主要分布于髓內血管周圍的一類多能干細胞,能雙向分化為OBs與骨髓脂肪細胞,在維持髓內及骨骼穩態中發揮重要作用[58-59]。BMSCs的分裂、增殖、遷徙及其成骨-成脂雙向分化的命運轉歸等過程均受到化學、物理等刺激因素的調節[60-65]。動態牽拉、流體剪切應力等機械刺激均能有效促進BMSCs成骨分化[66-68]。Wu等[69]的循環拉伸刺激BMSCs實驗顯示,8%機械拉伸能有效促進ALP、BMP-2等成骨標志物表達,并促進Piezo1、2蛋白及瞬時受體電位香草素受體4型通道蛋白(transient receptor potential vanilloid 4,TRPV4)等機械敏感性離子通道的表達;采用小干擾RNA敲低相應離子通道蛋白表達后,循環牽拉刺激無法有效促進BMSCs成骨分化。上述結果表明BMSCs能響應拉伸刺激向成骨方向分化,在該過程中Piezo蛋白等機械敏感性離子通道扮演了關鍵作用。Zhou等[70]發現BMSCs依賴Piezo1、2蛋白通過細胞Ca2+內流信號,調節活化T細胞核因子、Yes相關蛋白1(Yes-associated protein 1,YAP1)與β-連環蛋白(β-catenin),進而響應流體剪切力與胞外基質剛度,調節成骨分化。并且在骨骼發育過程中,BMSCs中的Piezo1蛋白發揮主要作用,Piezo2蛋白起到協同作用[70]。因此,Piezo蛋白等機械敏感性離子通道通過響應拉伸刺激、細胞Ca2+ 內流信號調節向成骨方向分化。
3.2 Piezo蛋白與OBs
根據Wolff定律,增加機械負荷刺激,如運動鍛煉等,會增加骨量和骨骼強度;若缺乏機械負荷刺激,如長期臥床或暴露于太空失重環境,將導致骨量和骨強度降低[71-73]。在上述骨穩態與骨重塑過程中,OBs細胞增殖、分化、遷徙及其負責的骨基質合成、分泌和礦化,均受到各種因素調節[74-75]。機械刺激,如應變、壓縮、流體剪切等,能有效調節OBs行為,進而干預骨形成過程[76-81]。在此過程中Piezo1蛋白是OBs感知并響應機械刺激的關鍵傳感器[44,47]。Yoneda等[82]的研究表明Piezo1蛋白與TRPV4均參與調節成骨譜系細胞——OBs前體細胞MC3T3-E1的增殖。有研究報道低強度脈沖刺激可通過刺激MC3T3-E1細胞中Piezo1離子通道開放、Ca2+ 內流,激活細胞外調節蛋白激酶1/2的磷酸化和核周 F-肌動蛋白絲聚合,進而促進MC3T3-E1細胞增殖[65,83]。Song等[44]發現MC3T3-E1細胞依賴Piezo1蛋白感知流體剪切力,并部分通過Akt/糖原合成酶激酶3β/β‐catenin信號軸調控成骨特異性轉錄因子2基因表達,促進成骨分化。Sun等[47]采用小干擾RNA敲低MC3T3-E1細胞中Piezo1表達后,發現其成骨標志物ALP、骨鈣素以及Ⅰ型膠原α1(collagen type Ⅰ α1,Col1α1)表達量顯著降低;體內實驗中Piezo1敲低小鼠出現顱骨閉合不全、骨骼短小、骨厚度降低、骨小梁受損等成骨功能障礙。Wang等[29]的研究進一步表明OBs中Piezo1離子通道通過轉導YAP信號,調控Col2α1與Col9α2的表達,影響OBs-OCs之間細胞交流,調節OCs骨吸收活性,最終干預骨量調節。Piezo1離子通道影響OBs的增殖與遷移,并通過OBs-OCs之間細胞交流維持骨內穩態。
3.3 Piezo蛋白與OCs
OCs是由破骨祖細胞增殖分化形成的單核OCs前體彼此融合,在多種因素調節下形成并活化的多核細胞;主要分布于舊骨周圍,通過局部分泌酸與蛋白酶,如組織蛋白酶和基質金屬蛋白酶等,吸收礦化的舊骨,與OBs共同維持骨穩態、調節骨重塑[84-87]。研究發現,OBs缺失Piezo1機械敏感性離子通道會通過Piezo1/YAP軸增強OCs分化與活性,增加骨吸收;但OCs缺失Piezo1機械敏感性離子通道并不會引發骨丟失[29]。Jin等[88]采用牙周韌帶細胞(periodontal ligament cells,PDLCs)與OCs(RAW264.7細胞)共培養,發現Piezo1在機械應力預處理 PDLCs誘導OCs生成中發揮重要的傳感作用。在關于流體剪切力對造血祖細胞誘導OCs形成的研究中,發現低幅度的機械刺激激活Piezo1離子通道,抑制OCs形成,而高幅度刺激則導致骨破壞[3,89]。該研究結果可以解釋通常情況下機械負載有助于促進骨形成、增加骨質量,但在骨科或牙科植入物周圍機械負載異常增大時也可能刺激骨丟失這一現象。由此可見,Piezo1蛋白可以通過其宿主細胞間接參與調控OCs的形成及活性,進而調節骨重塑過程。
3.4 Piezo蛋白與骨細胞
骨細胞是嵌入骨礦化基質中的終末分化OBs,也是骨組織中數量最多(>90%)的細胞。骨細胞通過礦化骨內的腔隙小管系統,于彼此之間、骨細胞與骨表面的細胞之間,構建了廣泛通信網絡;在骨骼機械負載/卸載時,骨細胞將所感知的機械刺激轉換為生物信號,并通過上述通信網絡傳遞至OBs與OCs,參與調節OBs-OCs的動態平衡,在骨重塑過程中扮演關鍵性調控作用[90-95]。大量研究發現,骨細胞通過其所產生的Wnt信號通路負調節劑——硬化蛋白,對OBs數量與骨形成過程產生負反饋調節[90,96-99]。然而,尚不清楚骨細胞如何感知機械刺激,機械刺激對骨細胞中硬化蛋白表達又有何作用[100]。Piezo蛋白的發現為上述問題提供了解決思路。Sasaki等[101]發現Piezo1蛋白作為機械傳感器介導骨細胞Akt信號通路參與調控骨穩態。在5 Hz循環拉伸作用或Piezo1激活劑Yoda1刺激下,骨細胞(IDG-SW3)中Piezo1-Akt信號通路激活,硬化蛋白表達下降。另一項研究表明,在流體剪切應力作用下,骨細胞(MLO-Y4)的Piezo1離子通道表達上調; MLO-Y4依賴Piezo1離子通道促進YAP1入核,激活Wnt1信號通路表達,達到促進骨形成并減少骨吸收的作用[102]。Wang等[29]的研究表明,骨細胞Piezo1蛋白缺失會導致骨量下降、OCs數量增加;不同于OBs的Piezo1蛋白缺失,骨細胞中Piezo1離子通道缺失并不會導致自發骨折。綜上述,Piezo1離子通道在機械刺激時,通過調節Akt、Wnt1信號通路表達,維持骨內穩態。
3.5 Piezo蛋白與軟骨細胞
軟骨細胞是關節軟骨中唯一分化細胞,通過對關節軟骨基質的合成代謝和分解代謝調控來維持關節軟骨的穩態[103-104]。該合成-分解代謝過程的失衡可能引發軟骨破壞,從而導致骨關節炎的發生。盡管目前已經確定了許多可能引發代謝途徑失衡的危險因數,但具體的調節機制仍然未知[105]。研究發現,健康軟骨受到過大機械負載或受損軟骨受到生理機械負載都可能導致骨關節炎發生[106-109]。但是另一方面,機械負載對于維持軟骨健康結構和功能是必需的,適度運動可輔助骨關節炎的治療[110-113]。
軟骨細胞是一種機械敏感性細胞,其負責的軟骨代謝過程可能與組織的機械負荷相關[110, 114-119]。研究發現,Piezo1、2離子通道在軟骨細胞中表達,二者之間的協同作用可能賦予了關節軟骨對高應變機械信號的敏感性[54]。關節軟骨受到力學刺激時,Piezo1蛋白表達量增加,引發Ca2+ 內流;在初級關節軟骨細胞中,阻滯Piezo1機械敏感性離子通道介導的Ca2+ 內流,可減少機械損傷導致的軟骨細胞死亡,從而有望減輕過度機械刺激導致的軟骨損傷和創傷性骨關節炎[54]。Lee等[24]發現在骨關節炎軟骨細胞中IL-1α增加上調了Piezo1表達,其機制依賴于p38 MAPK與轉錄因子HNF4和ATF2/CREBP1,而Piezo1導致F-肌動蛋白減少,軟骨細胞易受到機械損傷。上述結果表明炎癥信號使得軟骨細胞中Piezo1機械轉導敏感性增加,可能是OA發生的前饋機制。Du等[120]研究軟骨細胞敲除TRPV4、Piezo1、Piezo2蛋白后對不同強度循環牽拉刺激的響應,發現3%~8%應變幅度(生理應變水平)下主要由TRPV4介導,Piezo1機械敏感性離子通道則主要介導13%應變幅度下的機械轉導,而Piezo2機械敏感性離子通道在對軟骨細胞產生損害的13%~18%應變幅度(過度機械刺激)下發揮主要作用。Du等[121]的另一項研究表明TRPV4主要介導197 kPa和78 kPa底物上軟骨細胞的Ca2+ 內流,而Piezo1、2機械敏感性離子通道則主要介導軟骨細胞對54、2 kPa底物的反應。綜上,針對Piezo1、2離子通道對高應變機械信號的敏感性,介導的Ca2+ 內流以及炎癥信號使得軟骨細胞中Piezo1離子通道機械轉導敏感性增加的特性,有望成為靶向性防治骨關節炎的新切入點。
4 總結與展望
2010年,Piezo1、2蛋白的發現揭示了細胞感知并響應機械信號的機制,為哺乳動物的機械信號轉導研究提供了新思路。Piezo1、2蛋白賦予了骨關節系統感知并響應機械應力的重要能力,在其細胞命運轉歸、骨骼發育、骨與軟骨穩態維持等方面發揮關鍵的機械傳感作用。Piezo機械敏感性離子通道通過響應拉伸刺激、細胞Ca2+ 內流信號調節向成骨方向分化;并影響OBs的增殖與遷移,通過OBs-OCs之間細胞交流維持骨內穩態。同時,Piezo1蛋白可以通過其宿主細胞間接參與調控OCs的形成及活性,進而調節骨重塑過程。而Piezo1離子通道在機械刺激時,通過調節Akt、Wnt1信號通路表達,維持骨內穩態;針對Piezo1、2離子通道對高應變機械信號的敏感性,介導的Ca2+ 內流以及炎癥信號使得軟骨細胞中Piezo1離子通道機械轉導敏感性增加的特性,有望成為靶向性防治骨關節炎的新切入點。盡管相關研究已經取得不少重大突破,但仍有諸多問題尚未闡明,比如現有研究主要圍繞Piezo1蛋白展開,而對Piezo2蛋白的具體作用知之甚少,Piezo2蛋白在骨關節系統中有無其特定功能,Piezo1與Piezo2兩種離子通道之間是否存在聯系,不同離子通道介導不同機械刺激的具體機制,在骨質疏松與骨關節炎等疾病的發生、發展過程中Piezo1扮演的角色,靶向Piezo離子通道的相關藥物如何應用于臨床,均有待研究探討。未來還需要繼續深入Piezo離子通道的研究,進一步闡明其在骨關節系統中的具體作用,以期為Piezo蛋白成為治療骨關節疾病新靶點奠定研究基礎。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
作者貢獻聲明 陳國輝:文獻檢索、文章起草;李亞星:文章撰寫;張暉、解慧琪:文章審校
機械信號轉導是細胞感知并響應機械刺激的重要過程,在多種細胞行為、組織發育、器官感知以及機體生理/病理活動中發揮著關鍵作用[1-9]。骨關節系統作為脊椎動物的支撐和運動結構,與機械刺激關系尤為密切[10-12]。1892年,Wolff提出骨組織有著極強的環境適應能力,骨自身形態或是所受應力改變均會導致其內部結構和外部形態相應改變,且該過程遵循數學規律,此即著名的“Wolff定律”。20世紀80年代,Ilizarov提出了“張力-應力法則”,即對活體組織給予持續、穩定、緩慢牽拉,可刺激某些組織、細胞再生和活躍生長;并基于該法則進一步提出了牽張成骨技術,即通過牽拉刺激骨組織再生[13-22]。大量研究表明,骨關節系統的主要細胞,如BMSCs、成骨細胞(osteoblasts,OBs)、破骨細胞(osteoclasts,OCs)、軟骨細胞及骨細胞等均能感知并響應剪切、拉伸、壓縮等應力以及基質剛度等機械信號。此外,骨與關節的諸多疾病,如骨愈合障礙、骨質疏松以及骨關節炎等,也可能與細胞機械信號轉導障礙相關[23-30]。因此,深入了解骨組織及其主要細胞如何感知機械信號并將其轉化為生物信號,并確定這種信號轉導在骨關節系統的生理/病理過程,對于研究骨關節疾病的發病機制和治療靶點具有重要意義。
機械敏感性離子通道,又稱為“機械門控離子通道”,作為活細胞表面主要的機械傳感器,是細胞機械信號轉導過程的關鍵;其通過直接感知施加于細胞膜上的機械刺激,快速引起胞膜激發或胞內信號激活[30-32]。2010年,Patapoutian課題組首次鑒定出哺乳動物中介導陽離子內流的機械門控陽離子通道——Piezo蛋白家族(包括Piezo1和Piezo2兩個亞型),由此掀開了哺乳動物機械信號轉導研究的新篇章[33]。
Piezo蛋白是一類大型呈孔狀的多聚體膜蛋白,在果蠅、斑馬魚、鳥類、哺乳動物以及植物等多個物種中參與細胞機械信號轉導過程[34-43]。在外界機械刺激下,Piezo離子通道被激活后開放,致使陽離子跨膜運輸進入胞內,從而實現機械信號向電化學信號轉換,最終參與觸覺感知、本體感覺以及細胞分裂、增殖、分化、遷移等一系列細胞行為的調控[9,12,23,26,29,33-39]。研究顯示,Piezo蛋白在心血管系統、肺、皮膚、大腦等多種器官組織中均有表達[12,23,24,37,40-43],其中在骨關節系統中明顯高表達[12, 44],在BMSCs命運調節、骨骼發育、骨穩態維持、骨損傷修復以及骨關節炎發生、發展等諸多生理和病理過程中發揮關鍵作用[23-24,29,39,45-47]。
本文旨在回顧Piezo機械敏感性離子通道的最新研究進展,介紹其分子結構與作用機制,著重綜述骨關節系統中Piezo蛋白相關研究,以期為骨與關節領域機械信號轉導的后續研究提供方向。
1 Piezo蛋白的結構特征
Piezo蛋白是一類大型跨膜蛋白[33]。Piezo1、 2蛋白在人體內分別由2 521、2 752個氨基酸構成,在小鼠體內則由2 547、2 822個氨基酸構成。Piezo 1、2蛋白結構大致相似,在低溫電鏡下小鼠Piezo1、2蛋白由3個單體構成類似于“三葉螺旋槳”的同源三聚體結構,每個蛋白單體擁有的38個跨膜螺旋構成了114個跨膜區域,在空間分布上形成碗狀凹陷結構(又稱“納米碗”);其蛋白單體N端的36個跨膜螺旋,即外周螺旋(peripheral helices,PHs),以每4個跨膜區組成1個單元的形式,構成9個重復的跨膜結構單元(transmembrane helical unit,THU;又稱Piezo repeat),形成向外周伸展的“螺旋槳葉片”結構(Blades);蛋白單體C端余下的2個跨膜螺旋 [由外周向中心分別為外螺旋(outer helix,OH)、內螺旋(inner helix,IH)] 則以三聚化形式參與構成供離子進入細胞的孔道(圖1)[48-51]。從結構上來看,Piezo1、2蛋白主要可以分為N端的“螺旋槳葉片”模塊、C端的中央孔模塊、起連接作用的“橫梁結構(Beam)”和“錨定區(Anchor)”;其中,C端的中央孔模塊包含OH、IH、胞內的C端結構域(C-terminal domain,CTD)以及胞外的“帽狀”結構域(C-terminal extracellular domain,CED;又稱Cap),以OH-Cap-IH-CTD順序連接;“橫梁結構”作為骨架支撐“螺旋槳葉片”并將其連接至C端結構域;“錨定區”楔入THU9(即repeat A)與OH之間,將外周“螺旋槳葉片”與中央孔模塊連接,即PHs-Anchor-OH-Cap-IH-CED順序連接[12,48-51]。
 圖1
Piezo離子通道結構示意圖
Figure1.
Structure diagram of Piezo ion channel
圖1
Piezo離子通道結構示意圖
Figure1.
Structure diagram of Piezo ion channel
2 Piezo蛋白的門控機制
Piezo蛋白作為關鍵的機械傳感器,其作用在于感知外界機械刺激并允許陽離子進行跨膜運輸進入胞內,從而依靠所產生的電化學信號引發一系列細胞內下游信號反應,最終轉化為相應的生物學信號參與調控細胞行為。我國肖百龍博士課題組就Piezo離子通道門控機制發表了一系列研究,提出其機械門控的“杠桿作用機制假說”、“門塞-閂鎖門控機制”、“雙門控作用機制假說”等[38,49-52]。在Piezo2離子通道中,由3個IH合圍形成的中央孔道完全封閉,孔道上方存在一個收縮部位(上跨膜區孔道“閘門”);下方存在一個10? 長度的狹窄部位(下跨膜區孔道“閘門”),該狹窄部位由朝向孔道的殘基形成;而在Piezo1離子通道中,上述兩處“閘門”均處于擴張狀態[49,51]。Piezo蛋白胞外的CED可以通過旋轉運動來控制兩處激活“閘門”的開放(圖2)[51]。Piezo蛋白通過其“雙門控機制”實現機械刺激的感知與響應,即:機械刺激作用下,Piezo蛋白胞外的CED通過旋轉運動,打開上、下跨膜區孔道“閘門”;另一方面,機械刺激在外周“螺旋槳葉片”脂質分子間所產生的張力,被胞內的“橫梁結構”依靠“杠桿作用”傳遞至中央孔道模塊,拉開中央孔道區的“閂鎖”結構,進而拔除側向“門塞”結構,最終打開胞內的側向孔道,實現離子跨膜運輸進入胞內。
 圖2
Piezo離子通道門控機制示意圖
Figure2.
Schematic diagram of Piezo ion channel gating mechanism
圖2
Piezo離子通道門控機制示意圖
Figure2.
Schematic diagram of Piezo ion channel gating mechanism
3 Piezo蛋白在骨關節系統中的作用
Piezo蛋白在骨髓、骨骼、關節軟骨以及椎間盤等組織中均有表達,通過介導相關細胞(如BMSCs、OBs、OCs、軟骨細胞以及骨細胞等)的機械-生物信號轉導過程,在骨關節細胞行為、器官發育、生理功能、病理過程等環節發揮重要調控作用 [46,52-57]。
3.1 Piezo蛋白與BMSCs
BMSCs是主要分布于髓內血管周圍的一類多能干細胞,能雙向分化為OBs與骨髓脂肪細胞,在維持髓內及骨骼穩態中發揮重要作用[58-59]。BMSCs的分裂、增殖、遷徙及其成骨-成脂雙向分化的命運轉歸等過程均受到化學、物理等刺激因素的調節[60-65]。動態牽拉、流體剪切應力等機械刺激均能有效促進BMSCs成骨分化[66-68]。Wu等[69]的循環拉伸刺激BMSCs實驗顯示,8%機械拉伸能有效促進ALP、BMP-2等成骨標志物表達,并促進Piezo1、2蛋白及瞬時受體電位香草素受體4型通道蛋白(transient receptor potential vanilloid 4,TRPV4)等機械敏感性離子通道的表達;采用小干擾RNA敲低相應離子通道蛋白表達后,循環牽拉刺激無法有效促進BMSCs成骨分化。上述結果表明BMSCs能響應拉伸刺激向成骨方向分化,在該過程中Piezo蛋白等機械敏感性離子通道扮演了關鍵作用。Zhou等[70]發現BMSCs依賴Piezo1、2蛋白通過細胞Ca2+內流信號,調節活化T細胞核因子、Yes相關蛋白1(Yes-associated protein 1,YAP1)與β-連環蛋白(β-catenin),進而響應流體剪切力與胞外基質剛度,調節成骨分化。并且在骨骼發育過程中,BMSCs中的Piezo1蛋白發揮主要作用,Piezo2蛋白起到協同作用[70]。因此,Piezo蛋白等機械敏感性離子通道通過響應拉伸刺激、細胞Ca2+ 內流信號調節向成骨方向分化。
3.2 Piezo蛋白與OBs
根據Wolff定律,增加機械負荷刺激,如運動鍛煉等,會增加骨量和骨骼強度;若缺乏機械負荷刺激,如長期臥床或暴露于太空失重環境,將導致骨量和骨強度降低[71-73]。在上述骨穩態與骨重塑過程中,OBs細胞增殖、分化、遷徙及其負責的骨基質合成、分泌和礦化,均受到各種因素調節[74-75]。機械刺激,如應變、壓縮、流體剪切等,能有效調節OBs行為,進而干預骨形成過程[76-81]。在此過程中Piezo1蛋白是OBs感知并響應機械刺激的關鍵傳感器[44,47]。Yoneda等[82]的研究表明Piezo1蛋白與TRPV4均參與調節成骨譜系細胞——OBs前體細胞MC3T3-E1的增殖。有研究報道低強度脈沖刺激可通過刺激MC3T3-E1細胞中Piezo1離子通道開放、Ca2+ 內流,激活細胞外調節蛋白激酶1/2的磷酸化和核周 F-肌動蛋白絲聚合,進而促進MC3T3-E1細胞增殖[65,83]。Song等[44]發現MC3T3-E1細胞依賴Piezo1蛋白感知流體剪切力,并部分通過Akt/糖原合成酶激酶3β/β‐catenin信號軸調控成骨特異性轉錄因子2基因表達,促進成骨分化。Sun等[47]采用小干擾RNA敲低MC3T3-E1細胞中Piezo1表達后,發現其成骨標志物ALP、骨鈣素以及Ⅰ型膠原α1(collagen type Ⅰ α1,Col1α1)表達量顯著降低;體內實驗中Piezo1敲低小鼠出現顱骨閉合不全、骨骼短小、骨厚度降低、骨小梁受損等成骨功能障礙。Wang等[29]的研究進一步表明OBs中Piezo1離子通道通過轉導YAP信號,調控Col2α1與Col9α2的表達,影響OBs-OCs之間細胞交流,調節OCs骨吸收活性,最終干預骨量調節。Piezo1離子通道影響OBs的增殖與遷移,并通過OBs-OCs之間細胞交流維持骨內穩態。
3.3 Piezo蛋白與OCs
OCs是由破骨祖細胞增殖分化形成的單核OCs前體彼此融合,在多種因素調節下形成并活化的多核細胞;主要分布于舊骨周圍,通過局部分泌酸與蛋白酶,如組織蛋白酶和基質金屬蛋白酶等,吸收礦化的舊骨,與OBs共同維持骨穩態、調節骨重塑[84-87]。研究發現,OBs缺失Piezo1機械敏感性離子通道會通過Piezo1/YAP軸增強OCs分化與活性,增加骨吸收;但OCs缺失Piezo1機械敏感性離子通道并不會引發骨丟失[29]。Jin等[88]采用牙周韌帶細胞(periodontal ligament cells,PDLCs)與OCs(RAW264.7細胞)共培養,發現Piezo1在機械應力預處理 PDLCs誘導OCs生成中發揮重要的傳感作用。在關于流體剪切力對造血祖細胞誘導OCs形成的研究中,發現低幅度的機械刺激激活Piezo1離子通道,抑制OCs形成,而高幅度刺激則導致骨破壞[3,89]。該研究結果可以解釋通常情況下機械負載有助于促進骨形成、增加骨質量,但在骨科或牙科植入物周圍機械負載異常增大時也可能刺激骨丟失這一現象。由此可見,Piezo1蛋白可以通過其宿主細胞間接參與調控OCs的形成及活性,進而調節骨重塑過程。
3.4 Piezo蛋白與骨細胞
骨細胞是嵌入骨礦化基質中的終末分化OBs,也是骨組織中數量最多(>90%)的細胞。骨細胞通過礦化骨內的腔隙小管系統,于彼此之間、骨細胞與骨表面的細胞之間,構建了廣泛通信網絡;在骨骼機械負載/卸載時,骨細胞將所感知的機械刺激轉換為生物信號,并通過上述通信網絡傳遞至OBs與OCs,參與調節OBs-OCs的動態平衡,在骨重塑過程中扮演關鍵性調控作用[90-95]。大量研究發現,骨細胞通過其所產生的Wnt信號通路負調節劑——硬化蛋白,對OBs數量與骨形成過程產生負反饋調節[90,96-99]。然而,尚不清楚骨細胞如何感知機械刺激,機械刺激對骨細胞中硬化蛋白表達又有何作用[100]。Piezo蛋白的發現為上述問題提供了解決思路。Sasaki等[101]發現Piezo1蛋白作為機械傳感器介導骨細胞Akt信號通路參與調控骨穩態。在5 Hz循環拉伸作用或Piezo1激活劑Yoda1刺激下,骨細胞(IDG-SW3)中Piezo1-Akt信號通路激活,硬化蛋白表達下降。另一項研究表明,在流體剪切應力作用下,骨細胞(MLO-Y4)的Piezo1離子通道表達上調; MLO-Y4依賴Piezo1離子通道促進YAP1入核,激活Wnt1信號通路表達,達到促進骨形成并減少骨吸收的作用[102]。Wang等[29]的研究表明,骨細胞Piezo1蛋白缺失會導致骨量下降、OCs數量增加;不同于OBs的Piezo1蛋白缺失,骨細胞中Piezo1離子通道缺失并不會導致自發骨折。綜上述,Piezo1離子通道在機械刺激時,通過調節Akt、Wnt1信號通路表達,維持骨內穩態。
3.5 Piezo蛋白與軟骨細胞
軟骨細胞是關節軟骨中唯一分化細胞,通過對關節軟骨基質的合成代謝和分解代謝調控來維持關節軟骨的穩態[103-104]。該合成-分解代謝過程的失衡可能引發軟骨破壞,從而導致骨關節炎的發生。盡管目前已經確定了許多可能引發代謝途徑失衡的危險因數,但具體的調節機制仍然未知[105]。研究發現,健康軟骨受到過大機械負載或受損軟骨受到生理機械負載都可能導致骨關節炎發生[106-109]。但是另一方面,機械負載對于維持軟骨健康結構和功能是必需的,適度運動可輔助骨關節炎的治療[110-113]。
軟骨細胞是一種機械敏感性細胞,其負責的軟骨代謝過程可能與組織的機械負荷相關[110, 114-119]。研究發現,Piezo1、2離子通道在軟骨細胞中表達,二者之間的協同作用可能賦予了關節軟骨對高應變機械信號的敏感性[54]。關節軟骨受到力學刺激時,Piezo1蛋白表達量增加,引發Ca2+ 內流;在初級關節軟骨細胞中,阻滯Piezo1機械敏感性離子通道介導的Ca2+ 內流,可減少機械損傷導致的軟骨細胞死亡,從而有望減輕過度機械刺激導致的軟骨損傷和創傷性骨關節炎[54]。Lee等[24]發現在骨關節炎軟骨細胞中IL-1α增加上調了Piezo1表達,其機制依賴于p38 MAPK與轉錄因子HNF4和ATF2/CREBP1,而Piezo1導致F-肌動蛋白減少,軟骨細胞易受到機械損傷。上述結果表明炎癥信號使得軟骨細胞中Piezo1機械轉導敏感性增加,可能是OA發生的前饋機制。Du等[120]研究軟骨細胞敲除TRPV4、Piezo1、Piezo2蛋白后對不同強度循環牽拉刺激的響應,發現3%~8%應變幅度(生理應變水平)下主要由TRPV4介導,Piezo1機械敏感性離子通道則主要介導13%應變幅度下的機械轉導,而Piezo2機械敏感性離子通道在對軟骨細胞產生損害的13%~18%應變幅度(過度機械刺激)下發揮主要作用。Du等[121]的另一項研究表明TRPV4主要介導197 kPa和78 kPa底物上軟骨細胞的Ca2+ 內流,而Piezo1、2機械敏感性離子通道則主要介導軟骨細胞對54、2 kPa底物的反應。綜上,針對Piezo1、2離子通道對高應變機械信號的敏感性,介導的Ca2+ 內流以及炎癥信號使得軟骨細胞中Piezo1離子通道機械轉導敏感性增加的特性,有望成為靶向性防治骨關節炎的新切入點。
4 總結與展望
2010年,Piezo1、2蛋白的發現揭示了細胞感知并響應機械信號的機制,為哺乳動物的機械信號轉導研究提供了新思路。Piezo1、2蛋白賦予了骨關節系統感知并響應機械應力的重要能力,在其細胞命運轉歸、骨骼發育、骨與軟骨穩態維持等方面發揮關鍵的機械傳感作用。Piezo機械敏感性離子通道通過響應拉伸刺激、細胞Ca2+ 內流信號調節向成骨方向分化;并影響OBs的增殖與遷移,通過OBs-OCs之間細胞交流維持骨內穩態。同時,Piezo1蛋白可以通過其宿主細胞間接參與調控OCs的形成及活性,進而調節骨重塑過程。而Piezo1離子通道在機械刺激時,通過調節Akt、Wnt1信號通路表達,維持骨內穩態;針對Piezo1、2離子通道對高應變機械信號的敏感性,介導的Ca2+ 內流以及炎癥信號使得軟骨細胞中Piezo1離子通道機械轉導敏感性增加的特性,有望成為靶向性防治骨關節炎的新切入點。盡管相關研究已經取得不少重大突破,但仍有諸多問題尚未闡明,比如現有研究主要圍繞Piezo1蛋白展開,而對Piezo2蛋白的具體作用知之甚少,Piezo2蛋白在骨關節系統中有無其特定功能,Piezo1與Piezo2兩種離子通道之間是否存在聯系,不同離子通道介導不同機械刺激的具體機制,在骨質疏松與骨關節炎等疾病的發生、發展過程中Piezo1扮演的角色,靶向Piezo離子通道的相關藥物如何應用于臨床,均有待研究探討。未來還需要繼續深入Piezo離子通道的研究,進一步闡明其在骨關節系統中的具體作用,以期為Piezo蛋白成為治療骨關節疾病新靶點奠定研究基礎。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
作者貢獻聲明 陳國輝:文獻檢索、文章起草;李亞星:文章撰寫;張暉、解慧琪:文章審校