版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
肩袖損傷隨著患者年齡增長,發病率逐漸增高,是一種常見的運動創傷和退行性疾病。研究表明,肩袖撕裂修復后12~24個月再撕裂率可高達21%[1],是運動醫學領域的一大挑戰,減少再撕裂發生至關重要[2]。目前,關節鏡手術是治療肩袖損傷的主要方法[3],通常采用聚醚醚酮(poly-ether-ether-ketone,PEEK)錨釘等高分子聚合材料進行固定[4]。然而,PEEK存在生物相容性差、力學性能不足,以及降解后可能引發組織反應和炎癥等問題[5]。與之相比,生物可降解鎂合金材料具有優異的力學性能和生物相容性,能夠提供足夠力學支撐,并在體內逐漸降解,減小“應力屏蔽”[6],從而避免二次手術需求[7-8]。Zhang等[9]研究表明,與可吸收縫線相比,鎂合金縫線在術后4周時,其表面形成了較為致密的腐蝕產物層,并未出現顯著的局部腐蝕現象,而到術后8周時腐蝕產物層開始松動并逐漸剝落,更有助于促進肌腱-骨纖維軟骨界面的再生。此外,He等[10]通過Micro-CT分析發現,鎂-鋅-釓 [Mg-Zn-Gd(ZG21)]合金縫線的降解加速了隧道內的骨生成;體外實驗表明,ZG21金屬提取物中的鈣-磷(Ca-P)成分能夠上調Wnt3a蛋白、β-連環蛋白(β-catenin)、骨鈣素和骨橋蛋白的表達,鎂合金降解過程中,其產物在愈合早期能夠促進成骨過程,尤其在隧道內的軟骨內成骨中加速了骨形成速度,顯著提升了前交叉韌帶重建過程中肌腱-骨界面的修復效果。同樣,Zhang等[11]設計了一種新型鎂合金帶線錨釘,優化了降解產物代謝和骨組織長入條件,顯著提高了纖維軟骨界面再生能力。與聚左旋乳酸錨釘相比,鎂合金帶線錨釘在肌腱-骨界面促進了聚集蛋白聚糖、Ⅱ型膠原蛋白、Sox9等軟骨分化相關標記物的表達。然而,鎂合金促進肌腱-骨愈合的分子機制尚不清楚。因此,本研究使用鎂合金縫線修復大鼠肩袖損傷,與Vicryl Plus 4-0可吸收縫線進行比較,探討鎂離子在肩袖損傷修復中促進肌腱-骨愈合作用的分子機制。
1 材料與方法
1.1 實驗動物及主要材料、試劑、儀器
8周齡SPF級雄性SD大鼠48只,體質量(230.25±20.03)g,由斯貝福(北京)生物技術有限公司提供。
鎂合金縫線由中國科學院金屬研究所提供,直徑0.23 mm,制作過程及有關力學性能和降解性能參考文獻 [9]。Vicryl Plus 4-0可吸收縫線購自美國強生公司,直徑約0.16 mm,主要成分為聚乳酸910,是由90%乙醇酸和10% L-丙交酯共聚而成;該縫線通過水解作用在體內被吸收,生成乳酸和乙醇酸,吸收過程通常在56~70 d內完成。
Masson染液套裝、Goldner染液套裝、牛血清白蛋白、蘇木素-伊紅染液、組織化學試劑盒、DAB顯色劑、通用型組織固定液、DAPI染色試劑、抗熒光淬滅封片劑、磷脂酰肌醇3-激酶(phosphatidylinositede 3-kinase,PI3K)-gamma Rabbit pAb抗體、Anti-蛋白激酶B2(protein kinase B2,AKT2)Rabbit pAb抗體、Anti-BMP-2 Rabbit pAb抗體、Anti-VEGF-A Rabbit pAb抗體、Anti-整合素β2亞基(Integrin beta-2,CD11b)Rabbit pAb抗體、Anti-精氨酸酶(Arginase 1,Arg1)Rabbit pAb抗體、SweScript RT Ⅰ First Strand cDNA Synthesis Kit、RNA提取液、2×Universal Blue SYBR Green qPCR Master Mix均購自武漢賽維爾生物科技有限公司。
NMC-200- Micro CT設備 [平生醫療科技(昆山)有限公司];WDW-50 E生物力學試驗機(濟南五星測試儀器有限公司);JB-P5脫水機(Donatello,DIAPATH公司,意大利);JB-P5包埋機(武漢俊杰電子有限公司);KD-P組織攤片機(金華科迪儀器設備有限公司);RM2016病理切片機(上海徠卡儀器有限公司);CRYOSTAR NX50冰凍切片機(Thermo Fisher Scientific公司,美國);DS-U3成像系統、E100熒光顯微鏡、Eclipse C1正置熒光顯微鏡(Nikon公司,日本);臺式高速冷凍型微量離心機(大龍興創實驗儀器股份公司);熒光定量PCR儀(Bio-rad公司,美國)。
1.2 動物模型制備及分組
取SD大鼠隨機分為3組,分別為鎂合金縫線修復組(A組18只)、Vicryl Plus 4-0可吸收縫線修復組(B組18只)和假手術組(C組12只,僅進行皮下切開和縫合)。隨機選擇大鼠一側肩關節進行手術,5%戊巴比妥鈉(40 mg/kg)腹腔注射麻醉后,肩部區域清洗、備皮,將大鼠固定于手術臺;于肩關節外側作縱切口,依次切開皮膚及皮下組織,以持針鉗分離三角肌;將肩關節置于內收、伸展和輕度內旋位,暴露岡上肌腱的肱骨大結節附著點,于肌腱附著處將其完全切斷,用刀片輕輕刮除肱骨附著區域的殘留肌腱和纖維軟骨組織。隨后用5 mL細針以垂直方向在足印區創建一個骨隧道,A、B組分別將對應縫線穿過骨隧道并在肌腱末端以Masson-Allen縫合法打結,固定岡上肌腱于肱骨大結節上;無菌生理鹽水沖洗,逐層縫合切口。術后連續 3 d給予 80 U 青霉素,大鼠可自由活動,定期監測其健康狀況。
1.3 觀測指標
術后1、2周A、B組分別取3只大鼠腹腔注射 5%戊巴比妥鈉(200 mg/kg)安樂死,取內臟進行檢測。術后2、4、8、12周A、B組分別取3只大鼠安樂死,C組分別于術后2周取1只,4、12周取4只,8周取3只大鼠安樂死,取岡上肌腱-肱骨近端標本進行實驗。
1.3.1 標本大體觀察
術后4、12 周,每組分別取3只大鼠岡上肌腱-肱骨近端標本,進行大體觀察。
1.3.2 Micro-CT觀察
術后2、4、12周A、B組分別取3只大鼠岡上肌腱-肱骨近端標本,用 4%多聚甲醛固定,采用Micro-CT 進行三維立體重建分析骨隧道及周圍骨組織的形成情況,檢測以下指標:骨小梁分離度(bone trabecular separation,Tb.Sp)、骨小梁厚度(bone trabecular thickness,Tb.Th)和骨小梁數量(bone trabecular numbe,Tb.N)。
1.3.3 生物力學試驗
術后4、8、12周,各組分別取3只大鼠岡上肌腱-肱骨近端標本,清除周圍組織。為評估修復后肌腱的實際承重能力,測試前移除用于修復的原始縫線。肱骨遠端用定制夾具固定,肌腱用紗布包裹后,使用2號Orthocord縫線編織以防止滑脫,并連接至測力傳感器上(圖1)。在WDW-50 E型生物力學試驗機上進行單軸拉伸測試。肌腱于0.05 N載荷下靜置1 min,然后施加載荷,直至肌腱從肱骨上剝離或斷裂。預載荷為1 N,載荷位移速率為0.5 mm/s。記錄極限載荷(N),并根據載荷-位移曲線線性區域的斜率計算剛度。
 圖1
標本固定于定制夾具上進行單軸拉伸試驗
Figure1.
Specimens were fixed on custom-made fixtures for uniaxial tensile test
圖1
標本固定于定制夾具上進行單軸拉伸試驗
Figure1.
Specimens were fixed on custom-made fixtures for uniaxial tensile test
1.3.4 大鼠臟器組織學觀察
分別于術后 1、2 周采集A、B組大鼠心臟、肝臟、脾臟、肺和腎臟等部位標本,經石蠟固定后5 μm厚切片。常規行HE染色觀察組織結構變化情況,評估生物體內鎂合金的安全性。
1.3.5 肌腱-骨界面組織形態學分析
術后2、4、12周A、B組分別取3只大鼠,C組取1只大鼠岡上肌腱-肱骨近端標本,于4%多聚甲醛溶液固定24 h。使用EDTA脫鈣2個月[9]后,從植入骨隧道的對側取出未完全降解的鎂合金縫線或Vicryl Plus 4-0可吸收縫線,盡量避免損傷縫線周圍組織。將樣本用梯度乙醇脫水,二甲苯洗滌,石蠟包埋,5 μm厚切片,常規行HE及Masson染色觀察。
參照文獻 [12] 方案,樣品聚合完成后進行包埋,切割成200 μm和10 μm厚切片,隨后行Goldner三色染色觀察。
1.3.6 免疫組織化學染色觀察
取A、B組上述部分切片,脫蠟液處理后,梯度乙醇洗滌;用3%H2O2阻斷內源性過氧化物酶活性25 min;3%牛血清白蛋白封閉切片。然后將切片與BMP-2和VEGF一抗于4°C下孵育過夜;PBS 洗滌,辣根過氧化物酶標記的山羊抗兔IgG二抗室溫下孵育50 min;行DAB染色后蘇木精復染,封閉。熒光顯微鏡觀察并采集圖像,使用CaseViewer軟件截取A、B組縫合線周圍熒光圖片,使用Image Pro Plus 9.0軟件定量分析BMP-2和VEGF陽性面積百分比。
1.3.7 肌腱-骨界面巨噬細胞M1/M2極化行為觀測
為了評估巨噬細胞在肌腱-骨界面的極化情況,進行CD11b和Arg1免疫熒光染色觀察。取A、B組部分切片,分別采用抗-CD11b(1∶500)和抗-Arg1(1∶200)抗體對M1型和M2型巨噬細胞標志物進行免疫熒光染色。實驗步驟:脫蠟至水,抗原修復,內源性酶阻斷,血清封閉,一抗孵育,二抗孵育,DAPI復染,封片后使用正置熒光顯微鏡觀察切片,采集DAPI、CD11b、Arg1等通道縫線周圍的熒光圖像。將圖像導入Image Pro Plus 9.0軟件,識別陽性染色區域,計算陽性染色面積占總面積的百分比作為CD11b和Arg1表達量。
1.3.8 實時熒光定量PCR(real time fluorescence quantitative PCR,RT-qPCR)檢測
術后2、4、12周,收集各組肌腱-骨界面縫合線周圍組織樣本,使用RNA提取液提取樣本總RNA,以SweScript RT Ⅰ First Strand cDNA Synthesis Kit反轉錄合成cDNA;然后于熒光定量PCR儀上使用2×Universal Blue SYBR Green qPCR Master Mix進行qPCR。以GAPDH為內參,采用2?ΔΔCt法計算PI3K和AKT2的mRNA相對表達量。引物序列見表1。
1.4 統計學方法
采用GraphPad Prism9.0統計軟件進行分析和繪圖。計量資料經Shapiro-Wilk檢驗均符合正態分布,數據以均數±標準差表示,組間多時間點比較采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser法進行校正,同一組別不同時間點比較采用Bonferroni法,同一時間點不同組別間比較采用多因素方差分析。檢驗水準取雙側α=0.05。
2 結果
2.1 標本大體觀察
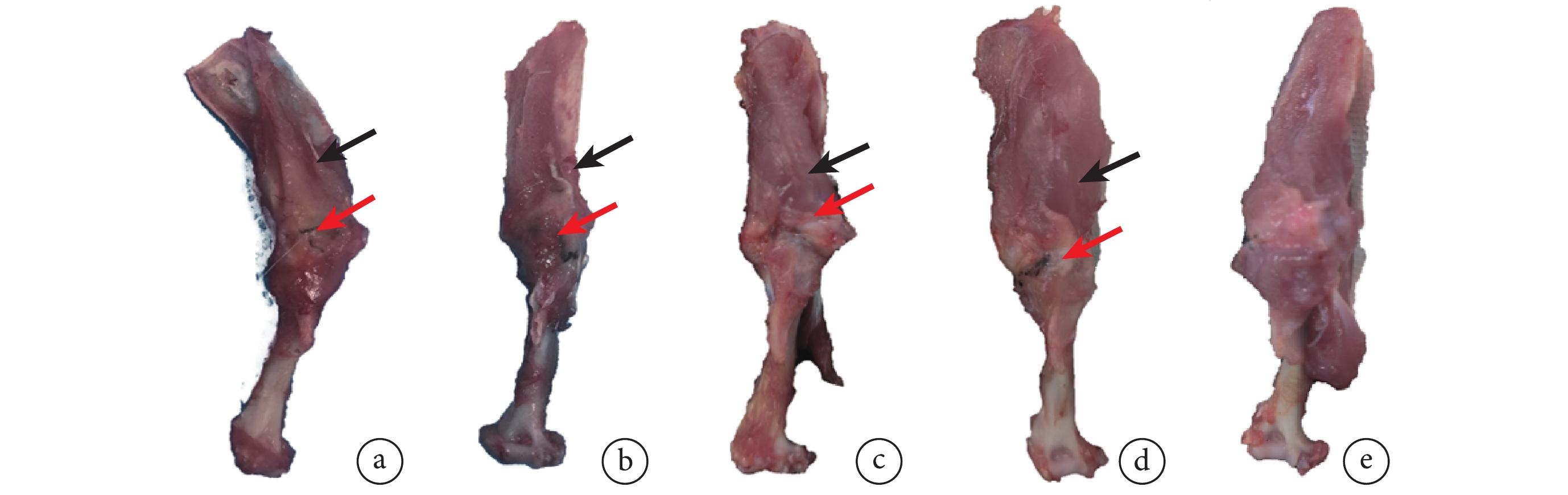
C組肌腱-骨界面整潔、邊界清晰,無顯著瘢痕組織增生,未見明顯炎癥反應或組織異常。術后4周,A、B組在肌腱-骨連接處均可見瘢痕組織增生,其中A組瘢痕增生更為顯著。術后12周,A、B組肌腱-骨界面發育良好,未見感染或骨關節炎發生,瘢痕組織增生顯著減少。與B組相比,A組岡上肌腱-肱骨界面形態更接近天然結構。見圖2。
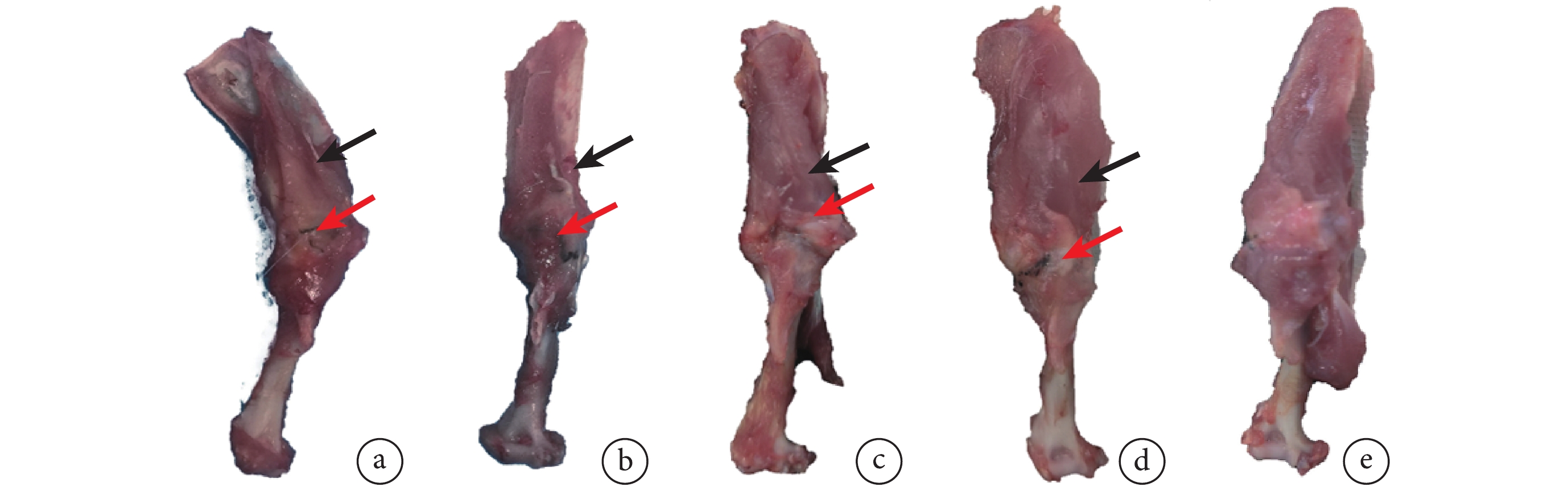 圖2
術后各時間點各組大鼠岡上肌腱-肱骨近端標本大體觀察
圖2
術后各時間點各組大鼠岡上肌腱-肱骨近端標本大體觀察
黑箭頭示岡上肌腱,紅箭頭示縫合線植入位置 a. 術后4周A組;b. 術后4周B組;c. 術后12周A組;d. 術后12周B組;e. C組
Figure2. Gross observation of supraspinatus tendon-proximal humerus specimens of rats in each group at each time point after operationBlack arrow showed supraspinatus tendon, and red arrow showed the position of suture implantation a. Group A at 4 weeks after operation; b. Group B at 4 weeks after operation; c. Group A at 12 weeks after operation; d. Group B at 12 weeks after operation; e. Group C
2.2 Micro-CT觀察
Micro-CT觀察示,A、B組骨體積隨時間推移呈現逐步增加的趨勢,尤其在術后4、12周時骨體積明顯增加。除術后2、12周Tb.Sp B組顯著高于A組、12周Tb.Th A組顯著高于B組(P<0.05)外,其余各時間點A、B組Tb.Sp、Tb.Th和Tb.N比較差異均無統計學意義(P>0.05)。見圖3、4。
 圖3
術后各時間點A、B組Micro-CT觀察
圖3
術后各時間點A、B組Micro-CT觀察
從左至右依次為矢狀位、骨隧道三維重建、標本三維重建 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周
Figure3. Micro-CT observation of groups A and B at each time point after operationFrom left to right for sagittal position, three-dimensional reconstruction of bone tunnel, and three-dimensional reconstruction of specimen, respectively a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation
 圖4
術后各時間點A、B組Micro-CT各檢測指標比較
圖4
術后各時間點A、B組Micro-CT各檢測指標比較
a. Tb.Sp;b. Tb.Th; c. Tb.N
Figure4. Comparison of Micro-CT indicators in groups A and B at each time point after operationa. Tb.Sp; b. Tb.Th; c. Tb.N
2.3 生物力學分析
術后隨時間延長,各組極限載荷和剛度均逐漸增加。除術后8、12周A、B組間比較極限載荷差異無統計學意義(P>0.05)外,其余各時間點各組間極限載荷及剛度差異均有統計學意義(P<0.05)。見圖5。
 圖5
術后各時間點各組極限載荷和剛度比較
圖5
術后各時間點各組極限載荷和剛度比較
a. 極限載荷;b. 剛度
Figure5. Comparison of ultimate load and stiffness for each group at each time point after operationa. Ultimate load; b. Stiffness
2.4 大鼠臟器組織學觀察
HE染色示,術后1、2周A、B組主要臟器(心臟、肝臟、脾臟、肺、腎臟)未見明顯病理改變。心臟結構正常,心肌纖維排列整齊,無炎癥細胞浸潤;肝臟肝小葉結構清晰,肝細胞排列規則,未見損傷或脂肪變性;脾臟形態正常,無脾細胞增生或壞死;肺組織結構完整,肺泡無明顯擴大或充血,未見急性炎癥細胞浸潤;腎臟腎小管排列整齊,無損傷或炎癥。見圖6。
 圖6
A、B組大鼠各臟器HE染色觀察(×5)
圖6
A、B組大鼠各臟器HE染色觀察(×5)
從左至右依次為心臟、肝臟、脾臟、肺和腎臟 a. A組術后1周;b. B組術后1周;c. A組術后2周;d. B組術后2周
Figure6. HE staining observation of each organ of rats in groups A and B (×5)From left to right for heart, liver, spleen, lungs, and kidneys, respectively a. Group A at 1 week after operation; b. Group B at 1 week after operation; c. Group A at 2 weeks after operation; d. Group B at 2 weeks after operation
2.5 肌腱-骨界面組織形態學分析
HE染色示,術后2周,A、B組均可見顯著炎癥反應,伴有大量炎癥細胞浸潤。4周,A、B組的肌腱-骨界面仍可見炎癥細胞,且尚未形成明顯的纖維軟骨過渡區;此時,肌腱樣組織的纖維排列紊亂,軟骨細胞增生,肌腱-骨界面的修復仍處于早期階段。12周,A、B組的肌腱-骨界面逐漸形成,膠原纖維排列規則、肌腱與骨之間緊密結合,成纖維細胞增多,礦化軟骨和纖維軟骨過渡區有序排列;與B組相比,A組修復效果更為顯著,其組織結構更接近C組正常的肌腱-骨界面。見圖7。
 圖7
各組術后各時間點肌腱-骨界面組織HE染色觀察(圖左×5,圖右×10)
圖7
各組術后各時間點肌腱-骨界面組織HE染色觀察(圖左×5,圖右×10)
B:骨骼 T:肌腱 FC:纖維軟骨 藍箭頭示軟骨細胞,紅箭頭示淋巴細胞,黑箭頭示成纖維細胞,綠箭頭示新生毛細血管 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周;g. 術后12周C組
Figure7. HE staining observation of tendon-bone interface tissue at each time point after operation in each group (×5 on the left and ×10 on the right)B: Bone T: Tendon FC: Fibrocartilage Blue arrows showed chondrocytes, red arrows showed lymphocytes, black arrows showed fibroblasts, and green arrows showed neocapillary vessels a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation; g. Group C at 12 weeks after operation
Masson染色示,術后2周,A、B組膠原纖維稀疏且排列無序。4周,A、B組肌腱-骨界面充滿連續纖維組織,膠原纖維不同程度交織增生;A組肌腱-骨界面較B組連接更緊密,紅染成纖維細胞核更多,而B組形成的膠原纖維細長且排列不規則。12周,與B組相比,A組的膠原纖維排列更加有序,增厚的纖維在界面按一定規則排列,更接近C組正常的肌腱-骨界面。見圖8。
 圖8
各組術后各時間點肌腱-骨界面組織Masson染色觀察(×5)
圖8
各組術后各時間點肌腱-骨界面組織Masson染色觀察(×5)
B:骨骼 T:肌腱 FC:纖維軟骨 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周;g. 術后12周C組
Figure8. Masson staining observation of tendon-bone interface tissue at each time point after operation in each group (×5)B: Bone T: Tendon FC: Fibrocartilage a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation; g. Group C at 12 weeks after operation
Goldner三色染色示,術后2周,A、B組均見少量礦化骨組織生成,軟骨組織開始形成。4周,A組礦化骨組織顯著增加,軟骨組織逐漸被礦化骨組織取代;而B組礦化骨組織增加較為緩慢,軟骨組織的替代過程相對較輕微,礦化程度不如A組顯著。12周,A組礦化骨組織已成熟,軟骨組織進一步減少,更接近C組正常肌腱-骨界面;B組礦化程度和纖維軟骨再生均不如A組顯著。見圖9。
 圖9
各組術后各時間點肌腱-骨界面組織Goldner三色染色觀察(×5)
圖9
各組術后各時間點肌腱-骨界面組織Goldner三色染色觀察(×5)
B:骨骼 T:肌腱 FC:纖維軟骨 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周;g. 術后12周C組
Figure9. Goldner trichrome staining observation of tendon-bone interface tissue at each time point after operation in each group (×5)B: Bone T: Tendon FC: Fibrocartilage a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation; g. Group C at 12 weeks after operation
2.6 免疫組織化學染色觀察
術后隨時間延長,兩組BMP-2和VEGF陽性面積百分比均逐漸減小。除術后2周A組BMP-2和VEGF陽性面積百分比顯著大于B組,差異有統計學意義(P<0.05)外,術后4、12周兩組間BMP-2和VEGF陽性面積百分比差異均無統計學意義(P>0.05)。見圖10、11。
 圖10
術后各時間點A、B組肌腱-骨界面免疫組織化學染色觀察(×5)
圖10
術后各時間點A、B組肌腱-骨界面免疫組織化學染色觀察(×5)
從左至右依次為術后2、4、12周 a. A組BMP-2表達;b. B組BMP-2表達;c. A組VEGF表達;d. B組VEGF表達
Figure10. Immunohistochemical staining observation of the tendon-bone interface in groups A and B at each time point after operation (×5)From left to right for 2, 4, and 12 weeks after operation a. BMP-2 expression in group A; b. BMP-2 expression in group B; c. VEGF expression in group A; d. VEGF expression in group B
 圖11
術后各時間點A、B組BMP-2和VEGF陽性面積百分比
圖11
術后各時間點A、B組BMP-2和VEGF陽性面積百分比
a. BMP-2;b. VEGF
Figure11. The percentage of positive area of BMP-2 and VEGF in groups A and B at each time point after operationa. BMP-2; b. VEGF
2.7 肌腱-骨界面巨噬細胞M1/M2極化行為觀測
術后隨時間延長,兩組CD11b和Arg1表達均呈下降趨勢。組間比較除術后2周A組Arg1表達大于B組,差異有統計學意義(P<0.05)外,其余時間點兩組間CD11b和Arg1表達差異均無統計學意義(P>0.05)。 見圖12、13。
 圖12
術后各時間點A、B組肌腱-骨界面巨噬細胞M1/M2極化行為觀察(正置熒光顯微鏡×5)
圖12
術后各時間點A、B組肌腱-骨界面巨噬細胞M1/M2極化行為觀察(正置熒光顯微鏡×5)
從左至右依次為Arg1、CD11b、DAPI及三者重疊 B:骨骼 T:肌腱 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周
Figure12. Observation of macrophage M1/M2 polarization behavior at the tendon-bone interface in groups A and B at each time point after operation (Orthostatic fluorescence microscope×5)From left to right for Arg1, CD11b, DAPI, and merge B: Bone T: Tendon a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation
 圖13
術后各時間點A、B組Arg1和CD11b表達比較
圖13
術后各時間點A、B組Arg1和CD11b表達比較
a. Arg1;b. CD11b
Figure13. Comparison of Arg1 and CD11b expressions in groups A and B at each time point after operationa. Arg1; b. CD11b
2.8 RT-qPCR檢測
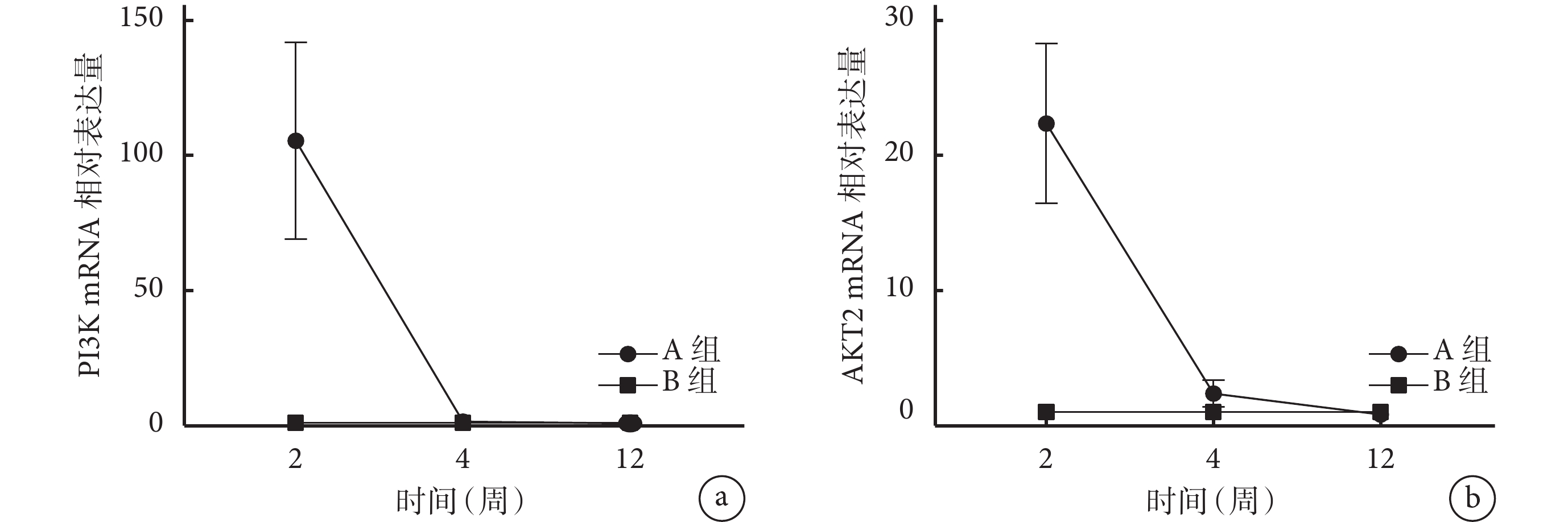
術后2周,A組PI3K mRNA相對表達量顯著高于B組,差異有統計學意義(P<0.001);A組AKT2 mRNA相對表達量高于B組,但差異無統計學意義(P>0.05)。其余時間點兩組PI3K和AKT2 mRNA相對表達量比較差異均無統計學意義(P>0.05)。見圖14。
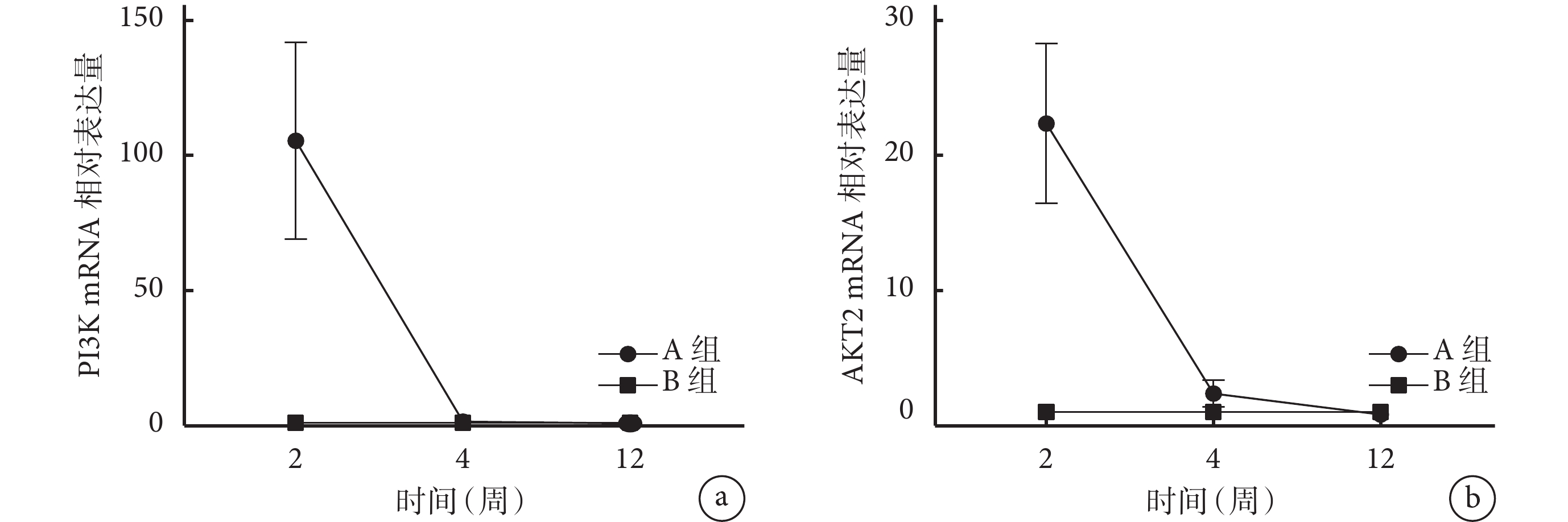 圖14
術后各時間點A、B組肌腱-骨界面炎癥相關基因mRNA相對表達量
圖14
術后各時間點A、B組肌腱-骨界面炎癥相關基因mRNA相對表達量
a. PI3K;b. AKT2
Figure14. Comparison of relative mRNA expression of tendon-bone interface inflammation-related genes in groups A and B at each time point after operationa. PI3K; b. AKT2
3 討論
鎂及其合金作為醫用可降解金屬材料,具有與人體骨骼相近的彈性模量及優異的力學性能,且具備成骨[13-15]、抗菌[16-17]、抗腫瘤[18]等性能。本研究采用鎂合金縫線與Vicryl Plus 4-0可吸收縫線修復大鼠岡上肌腱撕裂,以驗證鎂離子在肌腱-骨愈合中的關鍵作用。結果表明,鎂合金縫線通過在肌腱-骨愈合部位逐漸降解形成富鎂離子的微環境,促進肌腱-骨界面愈合并改善其生物力學性能。
本研究表明,鎂合金縫線在肌腱-骨界面的修復中表現出顯著效果。術后4周,HE染色示A組具有明顯抗炎能力,炎癥細胞浸潤程度明顯低于B組;而12周時B組仍觀察到一定炎癥反應,可能與Vicryl Plus 4-0可吸收縫線的酸性降解產物引起的異物反應有關。鎂合金的降解產物可促進Ca-P晶體沉積,掃描電鏡和能譜分析顯示ZG21絲降解后形成磷酸鈣沉積,這一過程有助于成骨。體外實驗也證實,金屬提取物中的Ca-P可增強Wnt3a、β-catenin、骨鈣素和骨橋蛋白的表達,從而促進成骨過程[19]。
本研究中,Masson染色及Goldern三色染色示A組在早期組織愈合情況、膠原沉積和軟骨組織礦化方面均優于B組,更接近于C組,表明鎂合金縫線在肌腱-骨界面的修復中更為有效。Micro-CT分析表明,A組在肌腱-骨連接處骨小梁的厚度及密度明顯高于B組,提示鎂離子能有效促進縫線周圍骨隧道的骨組織愈合和重建。免疫組織化學染色結果示,A組在主要時間點BMP-2和VEGF的表達水平高于B組,BMP-2能夠誘導BMSCs成骨分化[20]及纖維軟骨樣組織形成[21],促進新骨形成,VEGF則有助于血管再生及間接促進骨愈合[22],表明鎂合金組降解產生的富鎂離子微環境能夠促進纖維軟骨樣組織形成,進一步促進肌腱-骨愈合。Hashimoto等[23]的研究將重組人BMP-2注射至兔后肢趾屈肌腱中,1個月后發現在移植的肌腱-骨復合體中形成了纖維軟骨囊。Kim等[24]在兔髕骨肌腱模型的錨孔中填充1 mg BMP-2,組織學分析顯示與未使用BMP-2組相比,腱-骨界面處形成了有組織的纖維軟骨層。VEGF可刺激BMP-2上調,促進毛細血管通透性和血管生成[25],BMP-2及VEGF可促進肌腱-骨愈合[26]。
免疫熒光染色結果示,鎂離子能夠促進巨噬細胞M2極化,發揮抗炎作用,進而促進肌腱-骨愈合。本研究中,組內術后2、4、12周間CD11b表達差異有統計學意義(P<0.05),但兩組間差異無統計學意義(P>0.05),提示巨噬細胞M1極化在肌腱-骨愈合早期達到峰值。術后2、4、12周Arg1表達存在顯著變化(P<0.05);術后2周A組Arg1表達明顯高于B組(P<0.05),4周A組Arg1表達高于B組但差異無統計學意義(P>0.05),12周Arg1表達逐漸降低,兩組間差異無統計學意義(P>0.05),提示鎂合金縫線可能促進M2型巨噬細胞聚集,推動肌腱-骨界面巨噬細胞M1向M2轉化。Li等[27]通過使用溫度敏感的復合水凝膠,并將鎂-原花青素配位金屬多酚納米粒子(Mg-PC)集成其中,證實了鎂離子可以通過調控巨噬細胞M2極化減輕炎癥,并促進肌腱-骨界面的修復。
RT-qPCR結果示,鎂離子通過激活PI3K/AKT信號通路,促進了肌腱-骨愈合過程,包括炎癥反應、細胞增殖、組織重塑等過程,直至術后12周時愈合過程接近完成。Cai等[28]使用基于酶催化反應的鎂基礦化微球體外研究表明,這些微球能夠促進BMSCs的成骨分化,并激活PI3K/AKT信號通路,展示了其在骨再生中的潛力。此外,Sun等[29]通過構建鎂離子、鍶離子及不同礦化膠原組合體系,證實鎂離子能通過激活PI3K/AKT/GSK3β/β-catenin信號通路上調BMP-2表達,促進成骨細胞的分化和骨愈合。Zhang等[30]研究發現,鎂離子通過激活TRPM7/PI3K信號通路顯著促進VEGF表達,增強成骨細胞遷移能力,從而改善骨修復效果。本研究進一步驗證了鎂離子通過PI3K/AKT信號通路促進肌腱-骨愈合的作用。該信號通路不僅促進成骨細胞的增殖和分化,還通過抑制細胞凋亡、調控纖維軟骨生成、增強血管生成及調節免疫反應等多重機制,顯著加速了組織修復過程[31-32]。Cheng等[33] 在前交叉韌帶重建中使用鎂合金螺釘時發現,鎂離子能夠通過PI3K/AKT通路促進巨噬細胞M2極化,發揮抗炎作用,進而促進肌腱-骨愈合。因此,相比于傳統高分子聚合物材料,鎂合金不僅具備優越的力學性能和可降解特性,還通過釋放鎂離子創造有利的免疫微環境,進一步促進肌腱-骨界面的修復和愈合[34]。
本研究表明,生物可降解鎂合金材料在修復大鼠肌腱-骨界面中,能夠通過促進骨愈合重建、促進抗炎作用和激活PI3K/AKT信號通路,調控巨噬細胞M2極化,進而加速肌腱-骨愈合。鎂離子的逐漸釋放形成富鎂微環境,促進BMP-2和VEGF等細胞因子表達,有助于修復肌腱-骨界面。以上結果為鎂基生物材料在骨科手術中的潛在臨床應用,特別是在肌腱-骨損傷的修復方面提供了堅實基礎。
然而,本研究也存在一定局限性。首先,尚未深入探討鎂合金降解產物對周圍組織和全身環境的長期影響。其次,鎂合金的降解行為及鎂離子對PI3K/AKT通路及其他相關信號分子機制的作用尚需進一步研究。未來研究應聚焦于在不同動物模型中的應用,進一步探討其降解行為及對肌腱-骨愈合的長期影響,并優化鎂合金的使用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經斯貝福(北京)生物技術有限公司實驗動物福利倫理委員會批準(AWE2020041401),并嚴格遵循《關于善待實驗動物的指導意見》中的相關原則;實驗動物使用許可證號:SYXK-2017-0025
作者貢獻聲明 盛顯浩:動物實驗,論文撰寫,數據及資料收集;張文、宋首龍、張飛、張寶祥、田曉瑩、熊文韜:數據收集、論文修改;朱穎廣、謝雨欣、李子昂:數據收集及分析;譚麗麗、張強、王巖:論文指導;張強:課題設計及經費支持
肩袖損傷隨著患者年齡增長,發病率逐漸增高,是一種常見的運動創傷和退行性疾病。研究表明,肩袖撕裂修復后12~24個月再撕裂率可高達21%[1],是運動醫學領域的一大挑戰,減少再撕裂發生至關重要[2]。目前,關節鏡手術是治療肩袖損傷的主要方法[3],通常采用聚醚醚酮(poly-ether-ether-ketone,PEEK)錨釘等高分子聚合材料進行固定[4]。然而,PEEK存在生物相容性差、力學性能不足,以及降解后可能引發組織反應和炎癥等問題[5]。與之相比,生物可降解鎂合金材料具有優異的力學性能和生物相容性,能夠提供足夠力學支撐,并在體內逐漸降解,減小“應力屏蔽”[6],從而避免二次手術需求[7-8]。Zhang等[9]研究表明,與可吸收縫線相比,鎂合金縫線在術后4周時,其表面形成了較為致密的腐蝕產物層,并未出現顯著的局部腐蝕現象,而到術后8周時腐蝕產物層開始松動并逐漸剝落,更有助于促進肌腱-骨纖維軟骨界面的再生。此外,He等[10]通過Micro-CT分析發現,鎂-鋅-釓 [Mg-Zn-Gd(ZG21)]合金縫線的降解加速了隧道內的骨生成;體外實驗表明,ZG21金屬提取物中的鈣-磷(Ca-P)成分能夠上調Wnt3a蛋白、β-連環蛋白(β-catenin)、骨鈣素和骨橋蛋白的表達,鎂合金降解過程中,其產物在愈合早期能夠促進成骨過程,尤其在隧道內的軟骨內成骨中加速了骨形成速度,顯著提升了前交叉韌帶重建過程中肌腱-骨界面的修復效果。同樣,Zhang等[11]設計了一種新型鎂合金帶線錨釘,優化了降解產物代謝和骨組織長入條件,顯著提高了纖維軟骨界面再生能力。與聚左旋乳酸錨釘相比,鎂合金帶線錨釘在肌腱-骨界面促進了聚集蛋白聚糖、Ⅱ型膠原蛋白、Sox9等軟骨分化相關標記物的表達。然而,鎂合金促進肌腱-骨愈合的分子機制尚不清楚。因此,本研究使用鎂合金縫線修復大鼠肩袖損傷,與Vicryl Plus 4-0可吸收縫線進行比較,探討鎂離子在肩袖損傷修復中促進肌腱-骨愈合作用的分子機制。
1 材料與方法
1.1 實驗動物及主要材料、試劑、儀器
8周齡SPF級雄性SD大鼠48只,體質量(230.25±20.03)g,由斯貝福(北京)生物技術有限公司提供。
鎂合金縫線由中國科學院金屬研究所提供,直徑0.23 mm,制作過程及有關力學性能和降解性能參考文獻 [9]。Vicryl Plus 4-0可吸收縫線購自美國強生公司,直徑約0.16 mm,主要成分為聚乳酸910,是由90%乙醇酸和10% L-丙交酯共聚而成;該縫線通過水解作用在體內被吸收,生成乳酸和乙醇酸,吸收過程通常在56~70 d內完成。
Masson染液套裝、Goldner染液套裝、牛血清白蛋白、蘇木素-伊紅染液、組織化學試劑盒、DAB顯色劑、通用型組織固定液、DAPI染色試劑、抗熒光淬滅封片劑、磷脂酰肌醇3-激酶(phosphatidylinositede 3-kinase,PI3K)-gamma Rabbit pAb抗體、Anti-蛋白激酶B2(protein kinase B2,AKT2)Rabbit pAb抗體、Anti-BMP-2 Rabbit pAb抗體、Anti-VEGF-A Rabbit pAb抗體、Anti-整合素β2亞基(Integrin beta-2,CD11b)Rabbit pAb抗體、Anti-精氨酸酶(Arginase 1,Arg1)Rabbit pAb抗體、SweScript RT Ⅰ First Strand cDNA Synthesis Kit、RNA提取液、2×Universal Blue SYBR Green qPCR Master Mix均購自武漢賽維爾生物科技有限公司。
NMC-200- Micro CT設備 [平生醫療科技(昆山)有限公司];WDW-50 E生物力學試驗機(濟南五星測試儀器有限公司);JB-P5脫水機(Donatello,DIAPATH公司,意大利);JB-P5包埋機(武漢俊杰電子有限公司);KD-P組織攤片機(金華科迪儀器設備有限公司);RM2016病理切片機(上海徠卡儀器有限公司);CRYOSTAR NX50冰凍切片機(Thermo Fisher Scientific公司,美國);DS-U3成像系統、E100熒光顯微鏡、Eclipse C1正置熒光顯微鏡(Nikon公司,日本);臺式高速冷凍型微量離心機(大龍興創實驗儀器股份公司);熒光定量PCR儀(Bio-rad公司,美國)。
1.2 動物模型制備及分組
取SD大鼠隨機分為3組,分別為鎂合金縫線修復組(A組18只)、Vicryl Plus 4-0可吸收縫線修復組(B組18只)和假手術組(C組12只,僅進行皮下切開和縫合)。隨機選擇大鼠一側肩關節進行手術,5%戊巴比妥鈉(40 mg/kg)腹腔注射麻醉后,肩部區域清洗、備皮,將大鼠固定于手術臺;于肩關節外側作縱切口,依次切開皮膚及皮下組織,以持針鉗分離三角肌;將肩關節置于內收、伸展和輕度內旋位,暴露岡上肌腱的肱骨大結節附著點,于肌腱附著處將其完全切斷,用刀片輕輕刮除肱骨附著區域的殘留肌腱和纖維軟骨組織。隨后用5 mL細針以垂直方向在足印區創建一個骨隧道,A、B組分別將對應縫線穿過骨隧道并在肌腱末端以Masson-Allen縫合法打結,固定岡上肌腱于肱骨大結節上;無菌生理鹽水沖洗,逐層縫合切口。術后連續 3 d給予 80 U 青霉素,大鼠可自由活動,定期監測其健康狀況。
1.3 觀測指標
術后1、2周A、B組分別取3只大鼠腹腔注射 5%戊巴比妥鈉(200 mg/kg)安樂死,取內臟進行檢測。術后2、4、8、12周A、B組分別取3只大鼠安樂死,C組分別于術后2周取1只,4、12周取4只,8周取3只大鼠安樂死,取岡上肌腱-肱骨近端標本進行實驗。
1.3.1 標本大體觀察
術后4、12 周,每組分別取3只大鼠岡上肌腱-肱骨近端標本,進行大體觀察。
1.3.2 Micro-CT觀察
術后2、4、12周A、B組分別取3只大鼠岡上肌腱-肱骨近端標本,用 4%多聚甲醛固定,采用Micro-CT 進行三維立體重建分析骨隧道及周圍骨組織的形成情況,檢測以下指標:骨小梁分離度(bone trabecular separation,Tb.Sp)、骨小梁厚度(bone trabecular thickness,Tb.Th)和骨小梁數量(bone trabecular numbe,Tb.N)。
1.3.3 生物力學試驗
術后4、8、12周,各組分別取3只大鼠岡上肌腱-肱骨近端標本,清除周圍組織。為評估修復后肌腱的實際承重能力,測試前移除用于修復的原始縫線。肱骨遠端用定制夾具固定,肌腱用紗布包裹后,使用2號Orthocord縫線編織以防止滑脫,并連接至測力傳感器上(圖1)。在WDW-50 E型生物力學試驗機上進行單軸拉伸測試。肌腱于0.05 N載荷下靜置1 min,然后施加載荷,直至肌腱從肱骨上剝離或斷裂。預載荷為1 N,載荷位移速率為0.5 mm/s。記錄極限載荷(N),并根據載荷-位移曲線線性區域的斜率計算剛度。
 圖1
標本固定于定制夾具上進行單軸拉伸試驗
Figure1.
Specimens were fixed on custom-made fixtures for uniaxial tensile test
圖1
標本固定于定制夾具上進行單軸拉伸試驗
Figure1.
Specimens were fixed on custom-made fixtures for uniaxial tensile test
1.3.4 大鼠臟器組織學觀察
分別于術后 1、2 周采集A、B組大鼠心臟、肝臟、脾臟、肺和腎臟等部位標本,經石蠟固定后5 μm厚切片。常規行HE染色觀察組織結構變化情況,評估生物體內鎂合金的安全性。
1.3.5 肌腱-骨界面組織形態學分析
術后2、4、12周A、B組分別取3只大鼠,C組取1只大鼠岡上肌腱-肱骨近端標本,于4%多聚甲醛溶液固定24 h。使用EDTA脫鈣2個月[9]后,從植入骨隧道的對側取出未完全降解的鎂合金縫線或Vicryl Plus 4-0可吸收縫線,盡量避免損傷縫線周圍組織。將樣本用梯度乙醇脫水,二甲苯洗滌,石蠟包埋,5 μm厚切片,常規行HE及Masson染色觀察。
參照文獻 [12] 方案,樣品聚合完成后進行包埋,切割成200 μm和10 μm厚切片,隨后行Goldner三色染色觀察。
1.3.6 免疫組織化學染色觀察
取A、B組上述部分切片,脫蠟液處理后,梯度乙醇洗滌;用3%H2O2阻斷內源性過氧化物酶活性25 min;3%牛血清白蛋白封閉切片。然后將切片與BMP-2和VEGF一抗于4°C下孵育過夜;PBS 洗滌,辣根過氧化物酶標記的山羊抗兔IgG二抗室溫下孵育50 min;行DAB染色后蘇木精復染,封閉。熒光顯微鏡觀察并采集圖像,使用CaseViewer軟件截取A、B組縫合線周圍熒光圖片,使用Image Pro Plus 9.0軟件定量分析BMP-2和VEGF陽性面積百分比。
1.3.7 肌腱-骨界面巨噬細胞M1/M2極化行為觀測
為了評估巨噬細胞在肌腱-骨界面的極化情況,進行CD11b和Arg1免疫熒光染色觀察。取A、B組部分切片,分別采用抗-CD11b(1∶500)和抗-Arg1(1∶200)抗體對M1型和M2型巨噬細胞標志物進行免疫熒光染色。實驗步驟:脫蠟至水,抗原修復,內源性酶阻斷,血清封閉,一抗孵育,二抗孵育,DAPI復染,封片后使用正置熒光顯微鏡觀察切片,采集DAPI、CD11b、Arg1等通道縫線周圍的熒光圖像。將圖像導入Image Pro Plus 9.0軟件,識別陽性染色區域,計算陽性染色面積占總面積的百分比作為CD11b和Arg1表達量。
1.3.8 實時熒光定量PCR(real time fluorescence quantitative PCR,RT-qPCR)檢測
術后2、4、12周,收集各組肌腱-骨界面縫合線周圍組織樣本,使用RNA提取液提取樣本總RNA,以SweScript RT Ⅰ First Strand cDNA Synthesis Kit反轉錄合成cDNA;然后于熒光定量PCR儀上使用2×Universal Blue SYBR Green qPCR Master Mix進行qPCR。以GAPDH為內參,采用2?ΔΔCt法計算PI3K和AKT2的mRNA相對表達量。引物序列見表1。
1.4 統計學方法
采用GraphPad Prism9.0統計軟件進行分析和繪圖。計量資料經Shapiro-Wilk檢驗均符合正態分布,數據以均數±標準差表示,組間多時間點比較采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser法進行校正,同一組別不同時間點比較采用Bonferroni法,同一時間點不同組別間比較采用多因素方差分析。檢驗水準取雙側α=0.05。
2 結果
2.1 標本大體觀察
C組肌腱-骨界面整潔、邊界清晰,無顯著瘢痕組織增生,未見明顯炎癥反應或組織異常。術后4周,A、B組在肌腱-骨連接處均可見瘢痕組織增生,其中A組瘢痕增生更為顯著。術后12周,A、B組肌腱-骨界面發育良好,未見感染或骨關節炎發生,瘢痕組織增生顯著減少。與B組相比,A組岡上肌腱-肱骨界面形態更接近天然結構。見圖2。
 圖2
術后各時間點各組大鼠岡上肌腱-肱骨近端標本大體觀察
圖2
術后各時間點各組大鼠岡上肌腱-肱骨近端標本大體觀察
黑箭頭示岡上肌腱,紅箭頭示縫合線植入位置 a. 術后4周A組;b. 術后4周B組;c. 術后12周A組;d. 術后12周B組;e. C組
Figure2. Gross observation of supraspinatus tendon-proximal humerus specimens of rats in each group at each time point after operationBlack arrow showed supraspinatus tendon, and red arrow showed the position of suture implantation a. Group A at 4 weeks after operation; b. Group B at 4 weeks after operation; c. Group A at 12 weeks after operation; d. Group B at 12 weeks after operation; e. Group C
2.2 Micro-CT觀察
Micro-CT觀察示,A、B組骨體積隨時間推移呈現逐步增加的趨勢,尤其在術后4、12周時骨體積明顯增加。除術后2、12周Tb.Sp B組顯著高于A組、12周Tb.Th A組顯著高于B組(P<0.05)外,其余各時間點A、B組Tb.Sp、Tb.Th和Tb.N比較差異均無統計學意義(P>0.05)。見圖3、4。
 圖3
術后各時間點A、B組Micro-CT觀察
圖3
術后各時間點A、B組Micro-CT觀察
從左至右依次為矢狀位、骨隧道三維重建、標本三維重建 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周
Figure3. Micro-CT observation of groups A and B at each time point after operationFrom left to right for sagittal position, three-dimensional reconstruction of bone tunnel, and three-dimensional reconstruction of specimen, respectively a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation
 圖4
術后各時間點A、B組Micro-CT各檢測指標比較
圖4
術后各時間點A、B組Micro-CT各檢測指標比較
a. Tb.Sp;b. Tb.Th; c. Tb.N
Figure4. Comparison of Micro-CT indicators in groups A and B at each time point after operationa. Tb.Sp; b. Tb.Th; c. Tb.N
2.3 生物力學分析
術后隨時間延長,各組極限載荷和剛度均逐漸增加。除術后8、12周A、B組間比較極限載荷差異無統計學意義(P>0.05)外,其余各時間點各組間極限載荷及剛度差異均有統計學意義(P<0.05)。見圖5。
 圖5
術后各時間點各組極限載荷和剛度比較
圖5
術后各時間點各組極限載荷和剛度比較
a. 極限載荷;b. 剛度
Figure5. Comparison of ultimate load and stiffness for each group at each time point after operationa. Ultimate load; b. Stiffness
2.4 大鼠臟器組織學觀察
HE染色示,術后1、2周A、B組主要臟器(心臟、肝臟、脾臟、肺、腎臟)未見明顯病理改變。心臟結構正常,心肌纖維排列整齊,無炎癥細胞浸潤;肝臟肝小葉結構清晰,肝細胞排列規則,未見損傷或脂肪變性;脾臟形態正常,無脾細胞增生或壞死;肺組織結構完整,肺泡無明顯擴大或充血,未見急性炎癥細胞浸潤;腎臟腎小管排列整齊,無損傷或炎癥。見圖6。
 圖6
A、B組大鼠各臟器HE染色觀察(×5)
圖6
A、B組大鼠各臟器HE染色觀察(×5)
從左至右依次為心臟、肝臟、脾臟、肺和腎臟 a. A組術后1周;b. B組術后1周;c. A組術后2周;d. B組術后2周
Figure6. HE staining observation of each organ of rats in groups A and B (×5)From left to right for heart, liver, spleen, lungs, and kidneys, respectively a. Group A at 1 week after operation; b. Group B at 1 week after operation; c. Group A at 2 weeks after operation; d. Group B at 2 weeks after operation
2.5 肌腱-骨界面組織形態學分析
HE染色示,術后2周,A、B組均可見顯著炎癥反應,伴有大量炎癥細胞浸潤。4周,A、B組的肌腱-骨界面仍可見炎癥細胞,且尚未形成明顯的纖維軟骨過渡區;此時,肌腱樣組織的纖維排列紊亂,軟骨細胞增生,肌腱-骨界面的修復仍處于早期階段。12周,A、B組的肌腱-骨界面逐漸形成,膠原纖維排列規則、肌腱與骨之間緊密結合,成纖維細胞增多,礦化軟骨和纖維軟骨過渡區有序排列;與B組相比,A組修復效果更為顯著,其組織結構更接近C組正常的肌腱-骨界面。見圖7。
 圖7
各組術后各時間點肌腱-骨界面組織HE染色觀察(圖左×5,圖右×10)
圖7
各組術后各時間點肌腱-骨界面組織HE染色觀察(圖左×5,圖右×10)
B:骨骼 T:肌腱 FC:纖維軟骨 藍箭頭示軟骨細胞,紅箭頭示淋巴細胞,黑箭頭示成纖維細胞,綠箭頭示新生毛細血管 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周;g. 術后12周C組
Figure7. HE staining observation of tendon-bone interface tissue at each time point after operation in each group (×5 on the left and ×10 on the right)B: Bone T: Tendon FC: Fibrocartilage Blue arrows showed chondrocytes, red arrows showed lymphocytes, black arrows showed fibroblasts, and green arrows showed neocapillary vessels a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation; g. Group C at 12 weeks after operation
Masson染色示,術后2周,A、B組膠原纖維稀疏且排列無序。4周,A、B組肌腱-骨界面充滿連續纖維組織,膠原纖維不同程度交織增生;A組肌腱-骨界面較B組連接更緊密,紅染成纖維細胞核更多,而B組形成的膠原纖維細長且排列不規則。12周,與B組相比,A組的膠原纖維排列更加有序,增厚的纖維在界面按一定規則排列,更接近C組正常的肌腱-骨界面。見圖8。
 圖8
各組術后各時間點肌腱-骨界面組織Masson染色觀察(×5)
圖8
各組術后各時間點肌腱-骨界面組織Masson染色觀察(×5)
B:骨骼 T:肌腱 FC:纖維軟骨 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周;g. 術后12周C組
Figure8. Masson staining observation of tendon-bone interface tissue at each time point after operation in each group (×5)B: Bone T: Tendon FC: Fibrocartilage a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation; g. Group C at 12 weeks after operation
Goldner三色染色示,術后2周,A、B組均見少量礦化骨組織生成,軟骨組織開始形成。4周,A組礦化骨組織顯著增加,軟骨組織逐漸被礦化骨組織取代;而B組礦化骨組織增加較為緩慢,軟骨組織的替代過程相對較輕微,礦化程度不如A組顯著。12周,A組礦化骨組織已成熟,軟骨組織進一步減少,更接近C組正常肌腱-骨界面;B組礦化程度和纖維軟骨再生均不如A組顯著。見圖9。
 圖9
各組術后各時間點肌腱-骨界面組織Goldner三色染色觀察(×5)
圖9
各組術后各時間點肌腱-骨界面組織Goldner三色染色觀察(×5)
B:骨骼 T:肌腱 FC:纖維軟骨 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周;g. 術后12周C組
Figure9. Goldner trichrome staining observation of tendon-bone interface tissue at each time point after operation in each group (×5)B: Bone T: Tendon FC: Fibrocartilage a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation; g. Group C at 12 weeks after operation
2.6 免疫組織化學染色觀察
術后隨時間延長,兩組BMP-2和VEGF陽性面積百分比均逐漸減小。除術后2周A組BMP-2和VEGF陽性面積百分比顯著大于B組,差異有統計學意義(P<0.05)外,術后4、12周兩組間BMP-2和VEGF陽性面積百分比差異均無統計學意義(P>0.05)。見圖10、11。
 圖10
術后各時間點A、B組肌腱-骨界面免疫組織化學染色觀察(×5)
圖10
術后各時間點A、B組肌腱-骨界面免疫組織化學染色觀察(×5)
從左至右依次為術后2、4、12周 a. A組BMP-2表達;b. B組BMP-2表達;c. A組VEGF表達;d. B組VEGF表達
Figure10. Immunohistochemical staining observation of the tendon-bone interface in groups A and B at each time point after operation (×5)From left to right for 2, 4, and 12 weeks after operation a. BMP-2 expression in group A; b. BMP-2 expression in group B; c. VEGF expression in group A; d. VEGF expression in group B
 圖11
術后各時間點A、B組BMP-2和VEGF陽性面積百分比
圖11
術后各時間點A、B組BMP-2和VEGF陽性面積百分比
a. BMP-2;b. VEGF
Figure11. The percentage of positive area of BMP-2 and VEGF in groups A and B at each time point after operationa. BMP-2; b. VEGF
2.7 肌腱-骨界面巨噬細胞M1/M2極化行為觀測
術后隨時間延長,兩組CD11b和Arg1表達均呈下降趨勢。組間比較除術后2周A組Arg1表達大于B組,差異有統計學意義(P<0.05)外,其余時間點兩組間CD11b和Arg1表達差異均無統計學意義(P>0.05)。 見圖12、13。
 圖12
術后各時間點A、B組肌腱-骨界面巨噬細胞M1/M2極化行為觀察(正置熒光顯微鏡×5)
圖12
術后各時間點A、B組肌腱-骨界面巨噬細胞M1/M2極化行為觀察(正置熒光顯微鏡×5)
從左至右依次為Arg1、CD11b、DAPI及三者重疊 B:骨骼 T:肌腱 a. A組術后2周;b. B組術后2周;c. A組術后4周;d. B組術后4周;e. A組術后12周;f. B組術后12周
Figure12. Observation of macrophage M1/M2 polarization behavior at the tendon-bone interface in groups A and B at each time point after operation (Orthostatic fluorescence microscope×5)From left to right for Arg1, CD11b, DAPI, and merge B: Bone T: Tendon a. Group A at 2 weeks after operation; b. Group B at 2 weeks after operation; c. Group A at 4 weeks after operation; d. Group B at 4 weeks after operation; e. Group A at 12 weeks after operation; f. Group B at 12 weeks after operation
 圖13
術后各時間點A、B組Arg1和CD11b表達比較
圖13
術后各時間點A、B組Arg1和CD11b表達比較
a. Arg1;b. CD11b
Figure13. Comparison of Arg1 and CD11b expressions in groups A and B at each time point after operationa. Arg1; b. CD11b
2.8 RT-qPCR檢測
術后2周,A組PI3K mRNA相對表達量顯著高于B組,差異有統計學意義(P<0.001);A組AKT2 mRNA相對表達量高于B組,但差異無統計學意義(P>0.05)。其余時間點兩組PI3K和AKT2 mRNA相對表達量比較差異均無統計學意義(P>0.05)。見圖14。
 圖14
術后各時間點A、B組肌腱-骨界面炎癥相關基因mRNA相對表達量
圖14
術后各時間點A、B組肌腱-骨界面炎癥相關基因mRNA相對表達量
a. PI3K;b. AKT2
Figure14. Comparison of relative mRNA expression of tendon-bone interface inflammation-related genes in groups A and B at each time point after operationa. PI3K; b. AKT2
3 討論
鎂及其合金作為醫用可降解金屬材料,具有與人體骨骼相近的彈性模量及優異的力學性能,且具備成骨[13-15]、抗菌[16-17]、抗腫瘤[18]等性能。本研究采用鎂合金縫線與Vicryl Plus 4-0可吸收縫線修復大鼠岡上肌腱撕裂,以驗證鎂離子在肌腱-骨愈合中的關鍵作用。結果表明,鎂合金縫線通過在肌腱-骨愈合部位逐漸降解形成富鎂離子的微環境,促進肌腱-骨界面愈合并改善其生物力學性能。
本研究表明,鎂合金縫線在肌腱-骨界面的修復中表現出顯著效果。術后4周,HE染色示A組具有明顯抗炎能力,炎癥細胞浸潤程度明顯低于B組;而12周時B組仍觀察到一定炎癥反應,可能與Vicryl Plus 4-0可吸收縫線的酸性降解產物引起的異物反應有關。鎂合金的降解產物可促進Ca-P晶體沉積,掃描電鏡和能譜分析顯示ZG21絲降解后形成磷酸鈣沉積,這一過程有助于成骨。體外實驗也證實,金屬提取物中的Ca-P可增強Wnt3a、β-catenin、骨鈣素和骨橋蛋白的表達,從而促進成骨過程[19]。
本研究中,Masson染色及Goldern三色染色示A組在早期組織愈合情況、膠原沉積和軟骨組織礦化方面均優于B組,更接近于C組,表明鎂合金縫線在肌腱-骨界面的修復中更為有效。Micro-CT分析表明,A組在肌腱-骨連接處骨小梁的厚度及密度明顯高于B組,提示鎂離子能有效促進縫線周圍骨隧道的骨組織愈合和重建。免疫組織化學染色結果示,A組在主要時間點BMP-2和VEGF的表達水平高于B組,BMP-2能夠誘導BMSCs成骨分化[20]及纖維軟骨樣組織形成[21],促進新骨形成,VEGF則有助于血管再生及間接促進骨愈合[22],表明鎂合金組降解產生的富鎂離子微環境能夠促進纖維軟骨樣組織形成,進一步促進肌腱-骨愈合。Hashimoto等[23]的研究將重組人BMP-2注射至兔后肢趾屈肌腱中,1個月后發現在移植的肌腱-骨復合體中形成了纖維軟骨囊。Kim等[24]在兔髕骨肌腱模型的錨孔中填充1 mg BMP-2,組織學分析顯示與未使用BMP-2組相比,腱-骨界面處形成了有組織的纖維軟骨層。VEGF可刺激BMP-2上調,促進毛細血管通透性和血管生成[25],BMP-2及VEGF可促進肌腱-骨愈合[26]。
免疫熒光染色結果示,鎂離子能夠促進巨噬細胞M2極化,發揮抗炎作用,進而促進肌腱-骨愈合。本研究中,組內術后2、4、12周間CD11b表達差異有統計學意義(P<0.05),但兩組間差異無統計學意義(P>0.05),提示巨噬細胞M1極化在肌腱-骨愈合早期達到峰值。術后2、4、12周Arg1表達存在顯著變化(P<0.05);術后2周A組Arg1表達明顯高于B組(P<0.05),4周A組Arg1表達高于B組但差異無統計學意義(P>0.05),12周Arg1表達逐漸降低,兩組間差異無統計學意義(P>0.05),提示鎂合金縫線可能促進M2型巨噬細胞聚集,推動肌腱-骨界面巨噬細胞M1向M2轉化。Li等[27]通過使用溫度敏感的復合水凝膠,并將鎂-原花青素配位金屬多酚納米粒子(Mg-PC)集成其中,證實了鎂離子可以通過調控巨噬細胞M2極化減輕炎癥,并促進肌腱-骨界面的修復。
RT-qPCR結果示,鎂離子通過激活PI3K/AKT信號通路,促進了肌腱-骨愈合過程,包括炎癥反應、細胞增殖、組織重塑等過程,直至術后12周時愈合過程接近完成。Cai等[28]使用基于酶催化反應的鎂基礦化微球體外研究表明,這些微球能夠促進BMSCs的成骨分化,并激活PI3K/AKT信號通路,展示了其在骨再生中的潛力。此外,Sun等[29]通過構建鎂離子、鍶離子及不同礦化膠原組合體系,證實鎂離子能通過激活PI3K/AKT/GSK3β/β-catenin信號通路上調BMP-2表達,促進成骨細胞的分化和骨愈合。Zhang等[30]研究發現,鎂離子通過激活TRPM7/PI3K信號通路顯著促進VEGF表達,增強成骨細胞遷移能力,從而改善骨修復效果。本研究進一步驗證了鎂離子通過PI3K/AKT信號通路促進肌腱-骨愈合的作用。該信號通路不僅促進成骨細胞的增殖和分化,還通過抑制細胞凋亡、調控纖維軟骨生成、增強血管生成及調節免疫反應等多重機制,顯著加速了組織修復過程[31-32]。Cheng等[33] 在前交叉韌帶重建中使用鎂合金螺釘時發現,鎂離子能夠通過PI3K/AKT通路促進巨噬細胞M2極化,發揮抗炎作用,進而促進肌腱-骨愈合。因此,相比于傳統高分子聚合物材料,鎂合金不僅具備優越的力學性能和可降解特性,還通過釋放鎂離子創造有利的免疫微環境,進一步促進肌腱-骨界面的修復和愈合[34]。
本研究表明,生物可降解鎂合金材料在修復大鼠肌腱-骨界面中,能夠通過促進骨愈合重建、促進抗炎作用和激活PI3K/AKT信號通路,調控巨噬細胞M2極化,進而加速肌腱-骨愈合。鎂離子的逐漸釋放形成富鎂微環境,促進BMP-2和VEGF等細胞因子表達,有助于修復肌腱-骨界面。以上結果為鎂基生物材料在骨科手術中的潛在臨床應用,特別是在肌腱-骨損傷的修復方面提供了堅實基礎。
然而,本研究也存在一定局限性。首先,尚未深入探討鎂合金降解產物對周圍組織和全身環境的長期影響。其次,鎂合金的降解行為及鎂離子對PI3K/AKT通路及其他相關信號分子機制的作用尚需進一步研究。未來研究應聚焦于在不同動物模型中的應用,進一步探討其降解行為及對肌腱-骨愈合的長期影響,并優化鎂合金的使用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經斯貝福(北京)生物技術有限公司實驗動物福利倫理委員會批準(AWE2020041401),并嚴格遵循《關于善待實驗動物的指導意見》中的相關原則;實驗動物使用許可證號:SYXK-2017-0025
作者貢獻聲明 盛顯浩:動物實驗,論文撰寫,數據及資料收集;張文、宋首龍、張飛、張寶祥、田曉瑩、熊文韜:數據收集、論文修改;朱穎廣、謝雨欣、李子昂:數據收集及分析;譚麗麗、張強、王巖:論文指導;張強:課題設計及經費支持