引用本文: 李曉明, 向宗駿, 萬志渝, 魯勇國, 牟海德, 殷君太. 外周血炎性指標比值對中晚期食管鱗癌術后復發的預測價值. 中國胸心血管外科臨床雜志, 2019, 26(9): 865-869. doi: 10.7507/1007-4848.201812031 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
食管癌是我國常見的惡性腫瘤,其中鱗癌占 90%[1],中晚期食管癌術后的預后較差,復發是制約臨床治療效果的重要因素[2],故學者們一直在尋找一些方便、快捷的預測食管鱗癌預后的指標,以便為個體化治療及改善預后提供指導。近年來,腫瘤相關性炎性指標成為研究的熱點,這些指標中尤以外周血炎性指標比值的高低被認為對腫瘤預后的預測有較大的研究價值[3],非小細胞肺癌、肝細胞肝癌等的研究均顯示上述指標比值的增高是腫瘤患者預后不良的獨立危險因素[4-6],目前同時將中性粒細胞與淋巴細胞比值(NLR)、血小板與淋巴細胞比值(PLR)、單核細胞與淋巴細胞比值(MLR)三項炎性指標比值變化與中晚期食管鱗癌預后的相關性進行研究報道的文章甚為少見,作者對本院中晚期食管鱗癌行手術治療患者的資料進行了回顧分析,以發現上述指標變化在預測中晚期食管鱗癌預后中的價值。
1 資料與方法
1.1 臨床資料
本組納入 2014 年 7 月至 2015 年 7 月我院胸外科收治的符合入組標準的食管鱗癌患者 150 例,其中男 128 例、女 22 例,平均年齡(62.23±8.48)歲。
納入標準:(1) 術前病理學診斷為食管鱗癌,并行了根治性手術;(2) 患者術前無遠處轉移;(3) 根據 UICC/AJCC 食管鱗癌第 8 版分期 pTNM 為 ⅢA~ⅣA 期的患者。
排除標準:① 術前接受了放化療。② 術前伴有感染等影響血常規計數結果的疾病。③ 重復癌患者。
1.2 觀察指標
1.2.1 信息采集
患者一般資料包括性別、年齡、家族史、腫瘤部位、病理類型、腫瘤最大徑、組織學分化程度、浸潤深度、腫瘤神經侵犯程度、脈管侵犯程度、淋巴結轉移數、術后復發時間。術前血常規指標包括紅細胞、血紅蛋白、中性粒細胞計數、淋巴細胞計數、單核細胞計數、血小板計數。
1.2.2 隨訪
患者出院后采用電話隨訪,截至 2017 年 7 月 28 日。隨訪時間的中位數 18 個月,隨訪率 100.0%。
1.3 統計學分析
本組數據采用 SPSS 19.0 進行分析,用受試者工作特征(ROC)曲線確定 NLR、PLR、MLR 臨界值,并根據上述三項指標有無升高及升高多少進行分層分析:無指標升高作為對照組、一項指標升高作為觀察 1 組、兩項指標同時升高作為觀察 2 組、三項指標同時升高作為觀察 3 組。對這 4 個組進行分層分析。影響復發的危險因素采用 Kaplan-meier 中的 log-rank 行單因素分析,Cox 風險回歸模型行多因素分析。檢驗水準 α=0.05。
2 結果
2.1 一般情況
術后 T 分期占比為(T2/T3/T4:33/114/3),N 分期占比為(N1/N2/N3:85/47/18),G 分期占比為(G1/G2/G3:66/43/41)。
根據 NLR、PLR、MLR 值與術后無復發生存時間建立患者 ROC 曲線,當 NLR=3.49、PLR=152.28、MLR=0.36,Youden 指數最大,并以此值作為劃分的界值。按照上述界值將患者分組進行分析,結果顯示:患者總體中位無復發生存時間為 20 個月,其中高 NRL 組中位無復發生存時間為 14 個月,低 NLR 組中位無復發生存時間為 26 個月,高 PLR 組中位無復發生存時間 11 個月,低 PLR 組中位無復發生存時間為 18 個月,高 MLR 組中位無復發生存時間為 14 個月,低 MLR 組中位無復發生存時間為 25 個月。其差異有統計學意義,見表 1。
 )
)
2.2 分層結果分析顯示
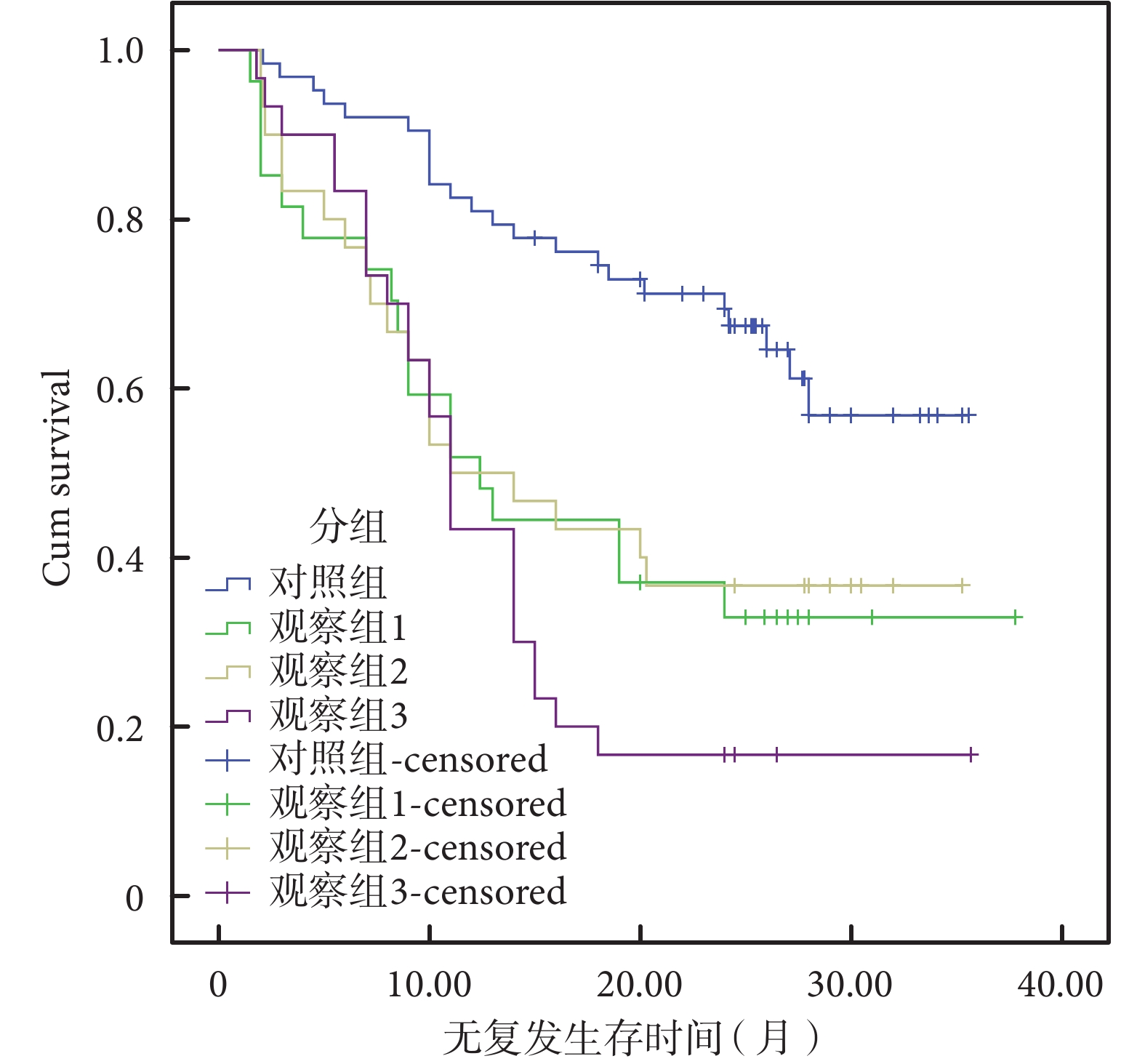
對照組、觀察 1 組、觀察 2 組、觀察 3 組的中位無復發生存時間為分別為 28 個月、19 個月、14 個月、 11 個月,差異有統計學意義(P=0.007)。四組的中位無復發生存率為 61.9%、22.2%、33.3%、6.9%,差異有統計學意義(P=0.00)。四組的 T 分期分布(T2/T3~4)分別為 17/46、4/23、5/25、7/23,差異無統計學意義(P=0.52)。四組的 N 分期分布(N1/N2/N3)分別為 44/12/7、19/6/2、13/15/2、9/14/7,差異有統計學意義(P=0.002)。四組的 G 分期分布(G1~2/G3)為 42/12、18/9、15/15、9/21;差異有統計學意義(P=0.005);見表 2、圖 1。
 )
)
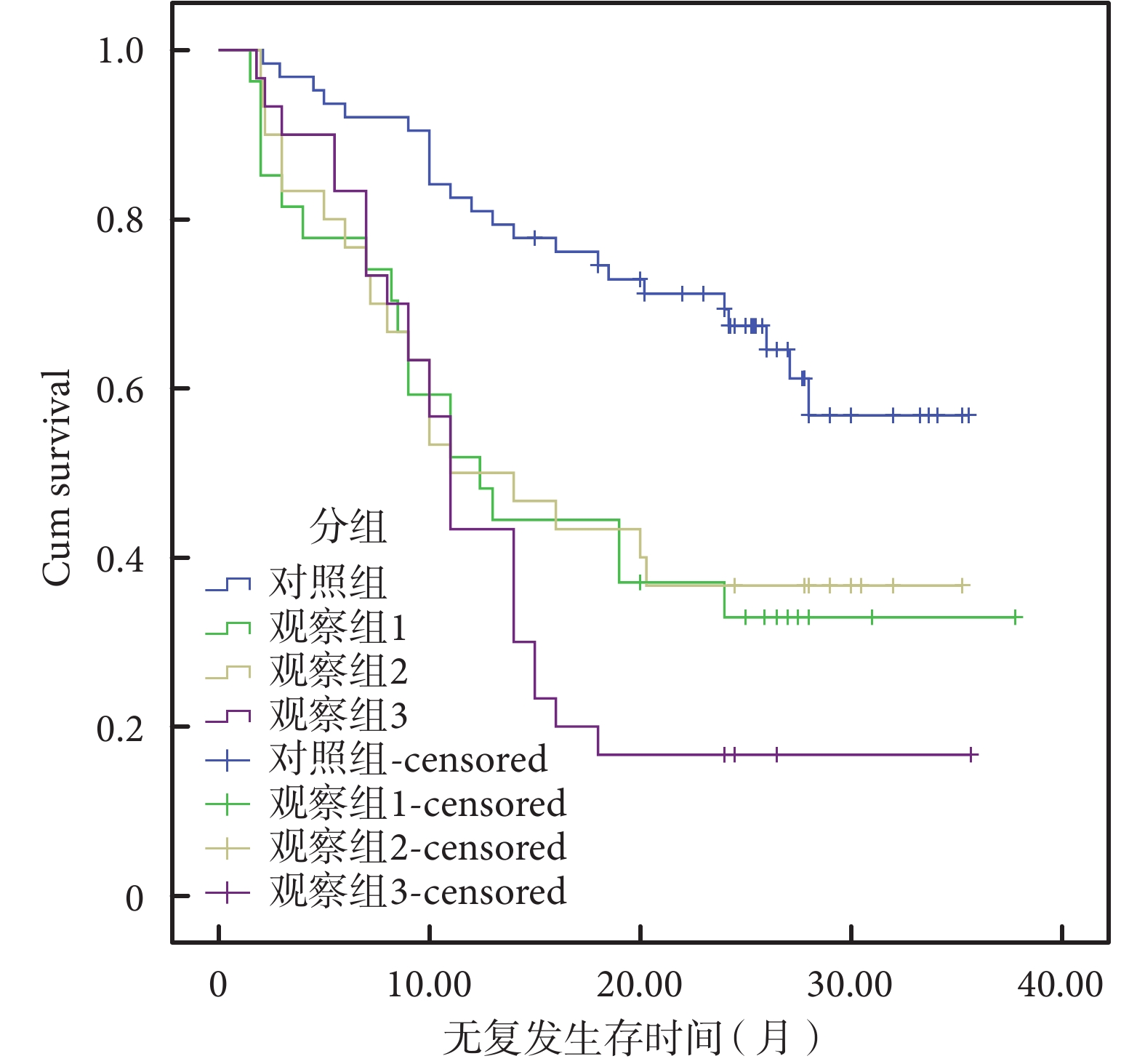 圖1
150 例患者生存曲線圖
圖1
150 例患者生存曲線圖
2.3 影響預后的危險因素分析
2.3.1 單因素分析
采用 Kaplan-Meier 中的 log-rank 行單因素分析顯示:N 分期、腫瘤分化程度、NLR 值、PLR 值、MLR 值單項升高及 NLR 值、PLR 值、MLR 值兩項或三項同時升高都是影響中晚期食管鱗癌術后復發的危險因素。
2.3.2 Cox 多因素分析
將上述指標納入 Cox 回歸模型。結果顯示:N 分期、腫瘤分化程度、MLR 值升高是中晚期食管鱗癌術后復發的獨立危險因素(HR=12.945,95% CI 2.31~72.548,P=0.00),見表 3。
3 討論
在人體中,中性粒細胞、單核細胞、淋巴細胞、血小板均參與構成了人體免疫系統。淋巴細胞主導人體的特異性免疫應答,中性粒細胞與單核細胞則參與形成人體固有免疫應答。血小板除了有凝血作用外,還參與免疫應答,尤其是炎癥反應,血小板在抗原-抗體復合物作用下,也可釋放炎性介質[7]。大量的研究表明,在腫瘤的發生過程中,機體的免疫系統可能通過多種途徑參與腫瘤的清除過程,而發揮免疫效應的細胞主要是淋巴細胞,故淋巴細胞數量絕對或相對減少便減弱了機體的免疫作用,尤其是 CD4、CD8 T 細胞比例失調時,可導致機體的免疫監視功能大大減弱,導致腫瘤免疫逃逸發生[8-9]。
另外,也有研究表明中性粒細胞、單核細胞、巨噬細胞等能產生大量的細胞因子,如腫瘤壞死因子、白細胞介素-1(IL-1)、前列腺素 E2(PGE2)、白三烯等物質。這些炎性介質既有抗腫瘤作用,也有促進腫瘤轉移與發展的作用[10-11],例如:PGE2、IL-1 等因子能夠逆轉和抑制 T 細胞活性,引起免疫抑制,導致腫瘤的生長與轉移。
既往研究表明術前 NLR、PLR、MLR 值可以間接反映腫瘤患者體內的免疫狀態,而且上述值的高低與腫瘤生長和轉移相關[12],本研究的分析結果也印證了上述觀點。
3.1 NLR、PLR、MLR 值的單獨或同時升高與 N 分期相關
本研究發現術前患者的 NLR、PLR、MLR 的單獨或同時升高與患者的 N 分期呈正相關,上述指標比值升高,患者淋巴結轉移越多,差異有統計學意義(P=0.002)。
3.2 NLR、PLR、MLR 值的單獨或同時升高與腫瘤分化程度相關
有研究顯示腫瘤相關炎性細胞因子可使 ERα 陽性的乳腺癌更具侵襲性,本研究也發現低分化鱗癌在對照組、觀察 1 組、觀察 2 組、觀察 3 組中占比分別為:33.33%、33.33%、50%、70%,差異有統計學意義(P=0.005),說明 NLR、PLR、MLR 單項、兩項、三項指標升高,腫瘤分化程度隨之越低。
3.3 NLR、PLR、MLR 值的單獨或同時升高與食管鱗癌早期復發相關
術前外周血炎性指標 NLR、PLR、MLR 升高組的患者術后復發快,復發率高,NLR、PLR、MLR 的高比值組的中位無復發生存期比低比值組分別縮短 12 個月、17 個月、11 個月。
而分層比較顯示,對照組或觀察 1 組的患者與觀察 2 組或觀察 3 組的患者進行比較,其淋巴結轉移數明顯少于后兩者,中位無復發生存期明顯延長,復發率顯著減少。
3.4 NLR、PLR、MLR 值與腫瘤 T 分期的關系
由于本研究所納入的是中晚期食管鱗癌手術的患者,其腫瘤外侵絕大多數為侵犯到了食管外膜,由于資料偏倚的原因,本研究未能得出上述幾項指標與腫瘤外侵程度的相關結果。還有待更大的樣本量進行分析。
綜上,本研究發現術前外周血炎性指標與ⅢA–ⅣA 期食管鱗癌預后轉歸具有相關性:① NLR 值、PLR 值、MLR 值的升高與 N 分期呈正相關;② NLR 值、PLR 值、MLR 值的升高與腫瘤分化程度之間呈負相關;③ NLR 值、PLR 值、MLR 值的升高與患者術后復發呈正相關。可以通過術前的血常規來計算出 NLR、PLR、MLR,從而預判中晚期食管鱗癌術后的預后情況。
在實體腫瘤中,越來越多的證據表明局部免疫應答和全身性炎癥與惡性腫瘤進展和癌癥患者預后相關[13]。炎癥介質與細胞效應物有助于惡性腫瘤細胞的增殖和存活,促進血管生成和轉移,破壞適應性免疫反應,并改變對激素和化學治療劑的反應,這為癌癥治療提供了新思路。已有學者在嘗試控制癌癥相關炎癥,從而抑制癌細胞生長[14]。隨著靶向與免疫治療的地位在癌癥治療中不斷提升,通過控制癌癥相關炎癥而治療癌癥可能成為一種新手段[15]。
利益沖突:無。
食管癌是我國常見的惡性腫瘤,其中鱗癌占 90%[1],中晚期食管癌術后的預后較差,復發是制約臨床治療效果的重要因素[2],故學者們一直在尋找一些方便、快捷的預測食管鱗癌預后的指標,以便為個體化治療及改善預后提供指導。近年來,腫瘤相關性炎性指標成為研究的熱點,這些指標中尤以外周血炎性指標比值的高低被認為對腫瘤預后的預測有較大的研究價值[3],非小細胞肺癌、肝細胞肝癌等的研究均顯示上述指標比值的增高是腫瘤患者預后不良的獨立危險因素[4-6],目前同時將中性粒細胞與淋巴細胞比值(NLR)、血小板與淋巴細胞比值(PLR)、單核細胞與淋巴細胞比值(MLR)三項炎性指標比值變化與中晚期食管鱗癌預后的相關性進行研究報道的文章甚為少見,作者對本院中晚期食管鱗癌行手術治療患者的資料進行了回顧分析,以發現上述指標變化在預測中晚期食管鱗癌預后中的價值。
1 資料與方法
1.1 臨床資料
本組納入 2014 年 7 月至 2015 年 7 月我院胸外科收治的符合入組標準的食管鱗癌患者 150 例,其中男 128 例、女 22 例,平均年齡(62.23±8.48)歲。
納入標準:(1) 術前病理學診斷為食管鱗癌,并行了根治性手術;(2) 患者術前無遠處轉移;(3) 根據 UICC/AJCC 食管鱗癌第 8 版分期 pTNM 為 ⅢA~ⅣA 期的患者。
排除標準:① 術前接受了放化療。② 術前伴有感染等影響血常規計數結果的疾病。③ 重復癌患者。
1.2 觀察指標
1.2.1 信息采集
患者一般資料包括性別、年齡、家族史、腫瘤部位、病理類型、腫瘤最大徑、組織學分化程度、浸潤深度、腫瘤神經侵犯程度、脈管侵犯程度、淋巴結轉移數、術后復發時間。術前血常規指標包括紅細胞、血紅蛋白、中性粒細胞計數、淋巴細胞計數、單核細胞計數、血小板計數。
1.2.2 隨訪
患者出院后采用電話隨訪,截至 2017 年 7 月 28 日。隨訪時間的中位數 18 個月,隨訪率 100.0%。
1.3 統計學分析
本組數據采用 SPSS 19.0 進行分析,用受試者工作特征(ROC)曲線確定 NLR、PLR、MLR 臨界值,并根據上述三項指標有無升高及升高多少進行分層分析:無指標升高作為對照組、一項指標升高作為觀察 1 組、兩項指標同時升高作為觀察 2 組、三項指標同時升高作為觀察 3 組。對這 4 個組進行分層分析。影響復發的危險因素采用 Kaplan-meier 中的 log-rank 行單因素分析,Cox 風險回歸模型行多因素分析。檢驗水準 α=0.05。
2 結果
2.1 一般情況
術后 T 分期占比為(T2/T3/T4:33/114/3),N 分期占比為(N1/N2/N3:85/47/18),G 分期占比為(G1/G2/G3:66/43/41)。
根據 NLR、PLR、MLR 值與術后無復發生存時間建立患者 ROC 曲線,當 NLR=3.49、PLR=152.28、MLR=0.36,Youden 指數最大,并以此值作為劃分的界值。按照上述界值將患者分組進行分析,結果顯示:患者總體中位無復發生存時間為 20 個月,其中高 NRL 組中位無復發生存時間為 14 個月,低 NLR 組中位無復發生存時間為 26 個月,高 PLR 組中位無復發生存時間 11 個月,低 PLR 組中位無復發生存時間為 18 個月,高 MLR 組中位無復發生存時間為 14 個月,低 MLR 組中位無復發生存時間為 25 個月。其差異有統計學意義,見表 1。
 )
)
2.2 分層結果分析顯示
對照組、觀察 1 組、觀察 2 組、觀察 3 組的中位無復發生存時間為分別為 28 個月、19 個月、14 個月、 11 個月,差異有統計學意義(P=0.007)。四組的中位無復發生存率為 61.9%、22.2%、33.3%、6.9%,差異有統計學意義(P=0.00)。四組的 T 分期分布(T2/T3~4)分別為 17/46、4/23、5/25、7/23,差異無統計學意義(P=0.52)。四組的 N 分期分布(N1/N2/N3)分別為 44/12/7、19/6/2、13/15/2、9/14/7,差異有統計學意義(P=0.002)。四組的 G 分期分布(G1~2/G3)為 42/12、18/9、15/15、9/21;差異有統計學意義(P=0.005);見表 2、圖 1。
 )
)
 圖1
150 例患者生存曲線圖
圖1
150 例患者生存曲線圖
2.3 影響預后的危險因素分析
2.3.1 單因素分析
采用 Kaplan-Meier 中的 log-rank 行單因素分析顯示:N 分期、腫瘤分化程度、NLR 值、PLR 值、MLR 值單項升高及 NLR 值、PLR 值、MLR 值兩項或三項同時升高都是影響中晚期食管鱗癌術后復發的危險因素。
2.3.2 Cox 多因素分析
將上述指標納入 Cox 回歸模型。結果顯示:N 分期、腫瘤分化程度、MLR 值升高是中晚期食管鱗癌術后復發的獨立危險因素(HR=12.945,95% CI 2.31~72.548,P=0.00),見表 3。
3 討論
在人體中,中性粒細胞、單核細胞、淋巴細胞、血小板均參與構成了人體免疫系統。淋巴細胞主導人體的特異性免疫應答,中性粒細胞與單核細胞則參與形成人體固有免疫應答。血小板除了有凝血作用外,還參與免疫應答,尤其是炎癥反應,血小板在抗原-抗體復合物作用下,也可釋放炎性介質[7]。大量的研究表明,在腫瘤的發生過程中,機體的免疫系統可能通過多種途徑參與腫瘤的清除過程,而發揮免疫效應的細胞主要是淋巴細胞,故淋巴細胞數量絕對或相對減少便減弱了機體的免疫作用,尤其是 CD4、CD8 T 細胞比例失調時,可導致機體的免疫監視功能大大減弱,導致腫瘤免疫逃逸發生[8-9]。
另外,也有研究表明中性粒細胞、單核細胞、巨噬細胞等能產生大量的細胞因子,如腫瘤壞死因子、白細胞介素-1(IL-1)、前列腺素 E2(PGE2)、白三烯等物質。這些炎性介質既有抗腫瘤作用,也有促進腫瘤轉移與發展的作用[10-11],例如:PGE2、IL-1 等因子能夠逆轉和抑制 T 細胞活性,引起免疫抑制,導致腫瘤的生長與轉移。
既往研究表明術前 NLR、PLR、MLR 值可以間接反映腫瘤患者體內的免疫狀態,而且上述值的高低與腫瘤生長和轉移相關[12],本研究的分析結果也印證了上述觀點。
3.1 NLR、PLR、MLR 值的單獨或同時升高與 N 分期相關
本研究發現術前患者的 NLR、PLR、MLR 的單獨或同時升高與患者的 N 分期呈正相關,上述指標比值升高,患者淋巴結轉移越多,差異有統計學意義(P=0.002)。
3.2 NLR、PLR、MLR 值的單獨或同時升高與腫瘤分化程度相關
有研究顯示腫瘤相關炎性細胞因子可使 ERα 陽性的乳腺癌更具侵襲性,本研究也發現低分化鱗癌在對照組、觀察 1 組、觀察 2 組、觀察 3 組中占比分別為:33.33%、33.33%、50%、70%,差異有統計學意義(P=0.005),說明 NLR、PLR、MLR 單項、兩項、三項指標升高,腫瘤分化程度隨之越低。
3.3 NLR、PLR、MLR 值的單獨或同時升高與食管鱗癌早期復發相關
術前外周血炎性指標 NLR、PLR、MLR 升高組的患者術后復發快,復發率高,NLR、PLR、MLR 的高比值組的中位無復發生存期比低比值組分別縮短 12 個月、17 個月、11 個月。
而分層比較顯示,對照組或觀察 1 組的患者與觀察 2 組或觀察 3 組的患者進行比較,其淋巴結轉移數明顯少于后兩者,中位無復發生存期明顯延長,復發率顯著減少。
3.4 NLR、PLR、MLR 值與腫瘤 T 分期的關系
由于本研究所納入的是中晚期食管鱗癌手術的患者,其腫瘤外侵絕大多數為侵犯到了食管外膜,由于資料偏倚的原因,本研究未能得出上述幾項指標與腫瘤外侵程度的相關結果。還有待更大的樣本量進行分析。
綜上,本研究發現術前外周血炎性指標與ⅢA–ⅣA 期食管鱗癌預后轉歸具有相關性:① NLR 值、PLR 值、MLR 值的升高與 N 分期呈正相關;② NLR 值、PLR 值、MLR 值的升高與腫瘤分化程度之間呈負相關;③ NLR 值、PLR 值、MLR 值的升高與患者術后復發呈正相關。可以通過術前的血常規來計算出 NLR、PLR、MLR,從而預判中晚期食管鱗癌術后的預后情況。
在實體腫瘤中,越來越多的證據表明局部免疫應答和全身性炎癥與惡性腫瘤進展和癌癥患者預后相關[13]。炎癥介質與細胞效應物有助于惡性腫瘤細胞的增殖和存活,促進血管生成和轉移,破壞適應性免疫反應,并改變對激素和化學治療劑的反應,這為癌癥治療提供了新思路。已有學者在嘗試控制癌癥相關炎癥,從而抑制癌細胞生長[14]。隨著靶向與免疫治療的地位在癌癥治療中不斷提升,通過控制癌癥相關炎癥而治療癌癥可能成為一種新手段[15]。
利益沖突:無。