引用本文: 程浩, 李白翎, 唐楊烽, 韓林, 徐志云, 周煒. A型主動脈夾層術后消化道出血危險因素的回顧性隊列研究. 中國胸心血管外科臨床雜志, 2024, 31(4): 531-537. doi: 10.7507/1007-4848.202207022 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
A型主動脈夾層累及外周動脈如腸系膜上動脈時,可發生急性腸系膜缺血(acute mesenteric ischemia,AMI),其術后易發生腸道出血、壞死等,死亡率高達60%~80%[1-2]。我中心對A型主動脈夾層累及腸系膜上動脈(雙腔/假腔供血/血栓形成)時無明顯腹痛的患者予以外科手術,術后觀察患者腸系膜缺血情況并予處理。
心臟術后消化道并發癥的重要病理生理因素是低心排血量綜合征、局部血流受損和低血壓相關的內臟灌注不良,引起腸系膜缺血性改變[2]。當無內臟動靜脈阻塞的臨床證據,而腸道仍發生了缺血性改變,并發癥包括腸穿孔、腹膜炎、腸道屏障破壞引起的菌血癥,進一步導致非腸系膜器官功能障礙的炎癥和休克,稱為非閉塞性腸系膜缺血(non-occlusive mesenteric ischemia,NOMI)[3]。腸系膜動脈造影曾是其診斷的金標準[3],現已逐漸被其他檢查替代,為排除性診斷。A型主動脈夾層術后部分患者合并心功能障礙、低氧血癥及外周動脈血流因夾層所致血流動力學受損,可發生多種消化道并發癥,最多見的臨床癥狀是消化道出血(gastrointestinal bleeding,GIB),其原因待進一步分析。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2017—2021年海軍軍醫大學附屬第一醫院心血管外科收治的A型主動脈夾層手術患者的臨床資料。根據術后是否存在 GIB 將患者分為 GIB 組和 non-GIB組。GIB組的選取標準包括:(1)術后大便隱血+++至++++、兩次或以上,因GIB輸注血制品和/或影響循環平穩的出血;(2)術后GIB并有腹痛和/或嚴重腹瀉、腹脹的患者。排除標準:(1)GIB量較小,經保守藥物治療迅速好轉的患者;(2)術后二次住院患者。
1.2 資料收集
從醫院病歷系統中收集患者圍術期資料。基線資料包括性別、年齡、體重指數、吸煙史、糖尿病史、冠心病史、高血壓史、是否二次手術、術前合并疾病(馬方綜合征、大動脈炎、急性腎功能不全、慢性腎功能不全)、DeBakey分型、術前肌酐值、血氧飽和度、左室射血分數、心包積液、夾層是否損傷冠狀動脈等。術中資料包括 A 型主動脈夾層術式、合并手術、體外循環時間、主動脈阻斷時間、停循環時間。術后資料包括二次開胸止血、撤除呼吸機時間>72 h、低心排血量綜合征、術后吸入氣氧濃度(fraction of inspired oxygen,FiO2)≥50%患者比例、連續性腎臟替代治療(continuous renal replacement therapy,CRRT)率、體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)使用率、腦梗死率、感染率、術后 GIB 時間、住 ICU 時間、住院時間和死亡率。患者術后FiO2≥50% 選取標準:FiO2≥50% 持續時間>24 h。
1.3 統計學分析
使用SPSS 22.0軟件進行統計學分析。計量資料若符合正態分布且滿足方差齊性則以均數±標準差( )描述,兩組間比較采用獨立樣本t檢驗,否則使用中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用非參數秩和檢驗;計數資料以例數和百分數描述,兩組間比較采用χ2檢驗。單因素分析中差異有統計學意義的變量納入多因素logistic回歸模型,分析A型主動脈夾層術后GIB的影響因素。P≤0.05為差異有統計學意義。
)描述,兩組間比較采用獨立樣本t檢驗,否則使用中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用非參數秩和檢驗;計數資料以例數和百分數描述,兩組間比較采用χ2檢驗。單因素分析中差異有統計學意義的變量納入多因素logistic回歸模型,分析A型主動脈夾層術后GIB的影響因素。P≤0.05為差異有統計學意義。
2 結果
2.1 兩組圍術期結果比較
GIB 組納入患者 18 例,non-GIB 組納入患者 511 例。GIB組患者年齡比non-GIB 組大[(60.11±10.63)歲 vs.(49.81±12.88)歲,P=0.001]。在急性和慢性腎衰竭方面兩組差異無統計學意義;兩組術前經皮動脈血氧飽和度(percutaneous arterial oxygen saturation,SpO2)<95%(雙鼻導管吸氧,最大氧濃度40%,對應氧分壓約70 mm Hg, 1 mm Hg=0.133 kPa)患者比例差異有統計學意義 ( P<0.001);見表1。
 /例(%)/M(P25,P75)]
/例(%)/M(P25,P75)]
兩組術中停循環時間差異有統計學意義[(31.56±13.68)min vs.(24.54±11.17)min,P=0.010];見表2。停循環時間長意味著更復雜的手術處理及患者各器官缺血缺氧時間更長。術后兩組患者撤除呼吸機時間>72 h、低心排血量綜合征、FiO2≥50%占比、CRRT、ECMO使用率差異有統計學意義(P<0.05)。GIB組患者的術后住ICU時間[(31.44±19.61)d vs.(9.37±10.31)d,P<0.001]及住院時間[(47.50±18.07)d vs.(21.66±14.33)d,P<0.001]明顯延長。GIB組患者感染率(44.4% vs. 17.0%,P=0.003)、死亡率(55.6% vs. 10.4%,P<0.001)高于non-GIB 組。發生GIB的時間為術后(22.44±12.63)d;見表3。
 /例(%)]
/例(%)]
 /例(%)]
/例(%)]
將差異有統計學意義(P≤0.05)的單變量納入多因素 logistic回歸模型,分析結果顯示術前SpO2<95%、撤除呼吸機時間>72 h、術后CRRT是A型主動脈夾層患者術后發生GIB的危險因素;見表4。
2.2 GIB組內分析
GIB組患者在有出血癥狀后,先采用保守藥物治療,并根據出血量調整腸內營養的喂養。消化道潰瘍患者出血量更大,缺血性結腸炎患者(1例,5.6%)主要表現為喂養不耐受,腹瀉癥狀明顯。GIB患者在出血前,大部分有腹脹史(10例,55.6%),當腹脹發生時,藥物通便排氣能緩解部分腹脹,對于無法緩解的患者可行其他檢查。腹痛是其次的臨床癥狀(6例,33.3%),部分患者選擇藥物止痛,劇烈腹痛應考慮AMI或腸道壞死穿孔;見表5。
2.2.1 夾層累及腸系膜上動脈
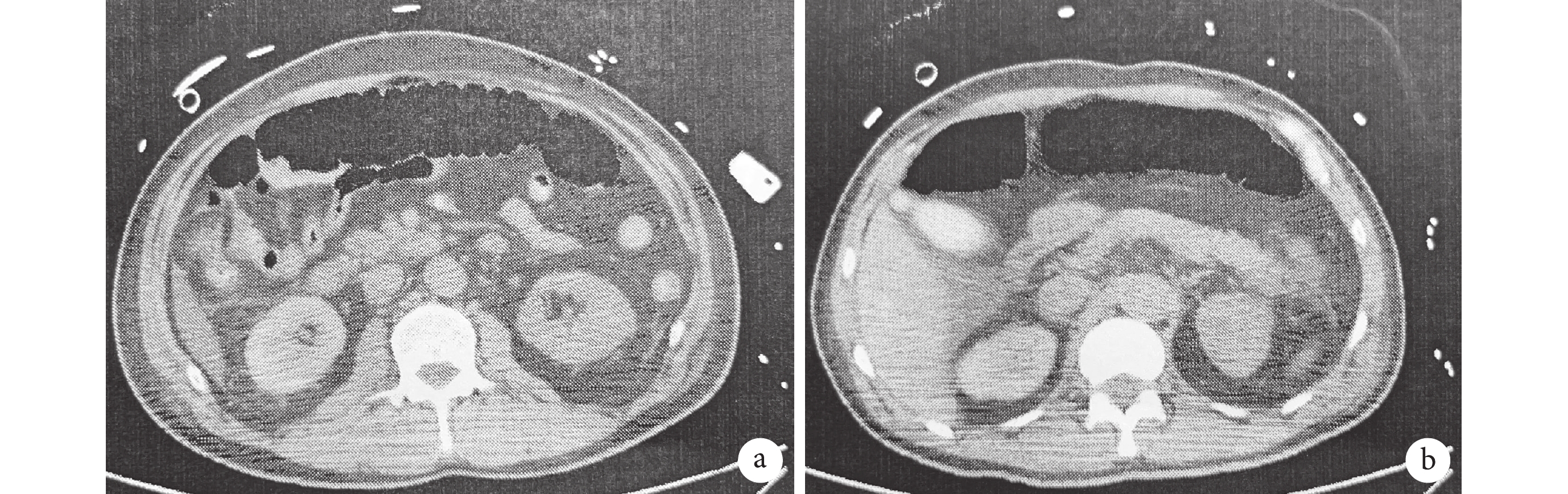
3例(16.7%)術前存在腸系膜上動脈夾層的患者(2例雙腔供血,1例假腔供血),術后2例患者腸系膜上動脈恢復真腔供血,其中1例術后發生結腸破裂行腸部分切除術,腹部增強CT顯示其腸系膜上動脈通暢,腸系膜下動脈缺血;另1例因合并低心排血量綜合征等而保守治療,后因感染、多器官衰竭死亡。1例術后腹部CT平片示橫結腸大量積氣(圖1),考慮腸系膜上動脈閉塞,后行數字減影血管造影下支架植入術,此患者術后因嚴重的右心功能障礙行ECMO支持,后死于多器官功能衰竭。此3例患者GIB發生在術后第7~33 d;見表5。
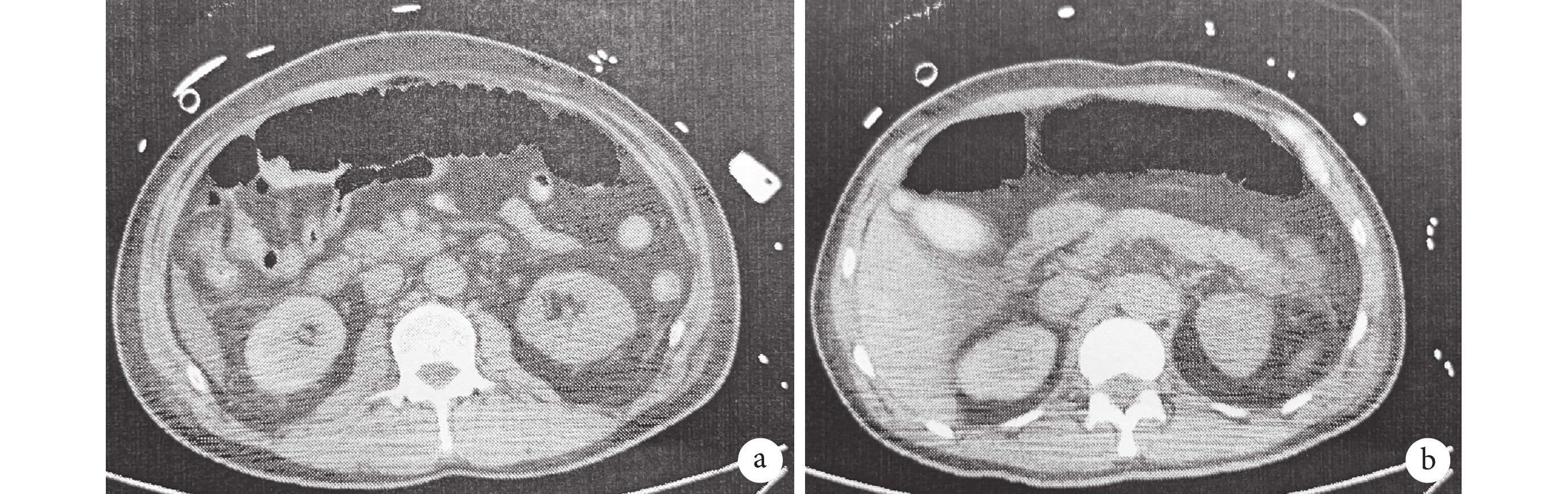 圖1
急性腸系膜缺血患者腹部CT
圖1
急性腸系膜缺血患者腹部CT
a:患者術前腸系膜上動脈為雙腔供血;b:術后發生急性腸系膜缺血時橫結腸積氣
2.2.2 非閉塞性腸系膜缺血的診斷及治療
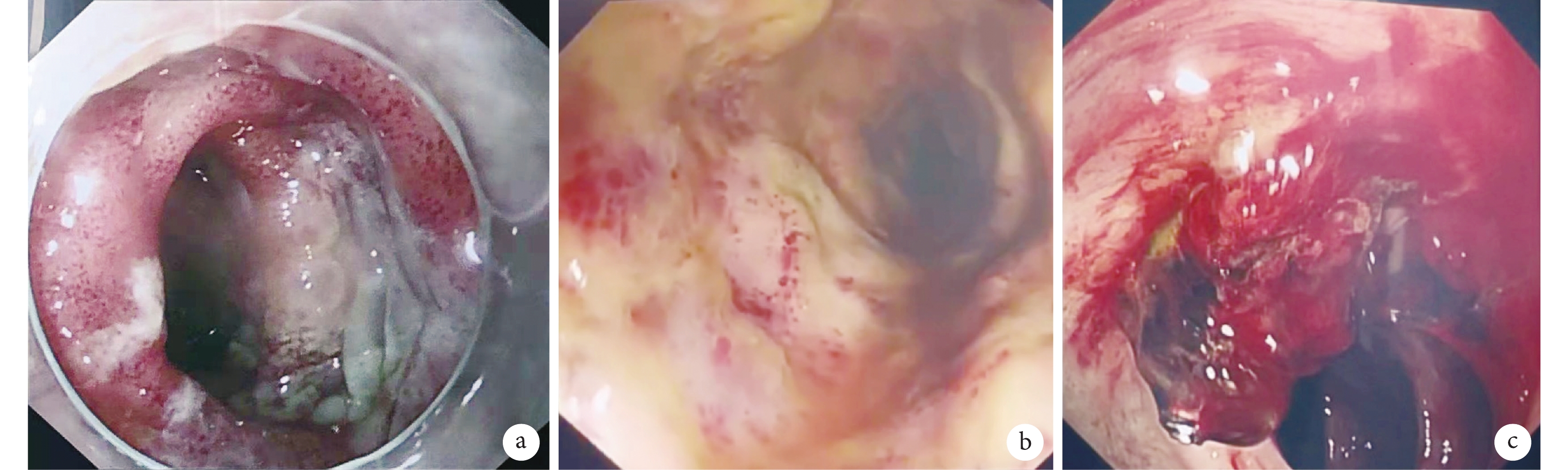
其余15例(83.3%)患者術前腸系膜上動脈通暢、無夾層累及,10例(55.6%)有消化道內鏡結果,7例(38.9%)的特點為廣泛的胃、十二指腸或結直腸黏膜蒼白、水腫、多發潰瘍和出血;見圖2。包括1例為巨大胃潰瘍復合十二指腸黏膜廣泛水腫、多發潰瘍的患者,術后12 d出血,排除應激性潰瘍,診斷為胃潰瘍合并NOMI。在發生腸道穿透性壞死前NOMI有一定的可逆性,前期內鏡檢查可以診斷和及時治療。多發潰瘍出血常需多次內鏡下止血(3例),甚至難以止血(2例)。另外1例缺血性結腸炎經保守藥物治療,并積極處理心功能不全,提高平均動脈壓并減少血管活性藥物的劑量等;見表5。但此患者最后仍死于感染、循環衰竭。
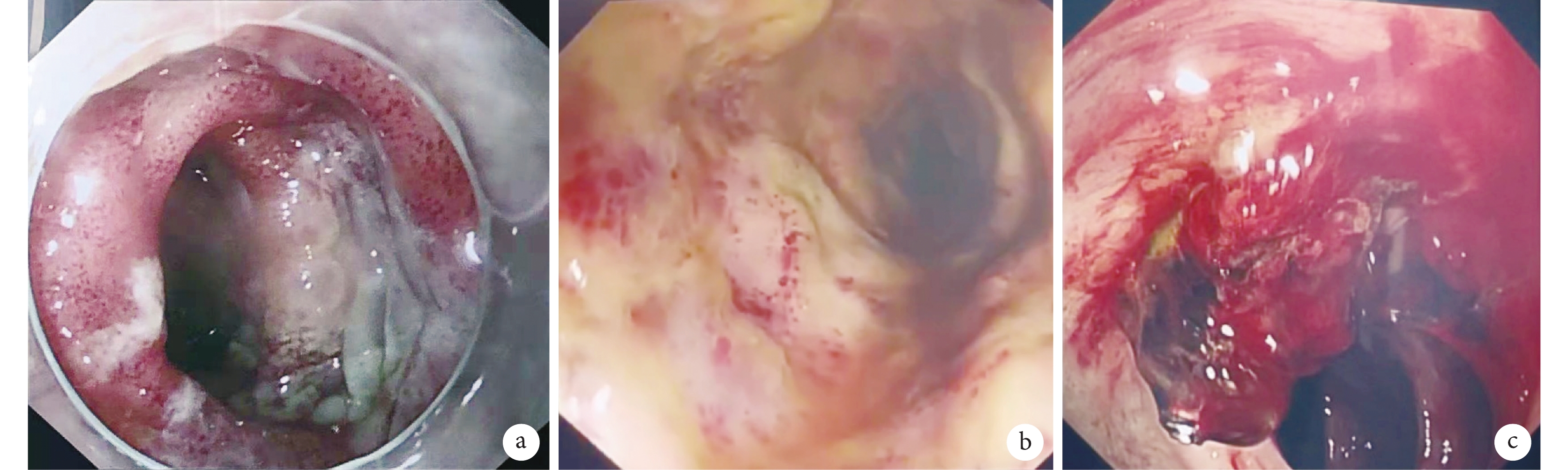 圖2
A型主動脈夾層術后結腸鏡下結腸缺血性改變的不同表現
圖2
A型主動脈夾層術后結腸鏡下結腸缺血性改變的不同表現
a~b:結腸缺血時黏膜水腫、蒼白;c:結腸潰瘍出血
2.2.3 其他
1例(5.6%)結腸內鏡陰性的患者,大量血便,數字減影血管造影發現胃動脈出血,行胃左動脈及胃十二指腸動脈栓塞術。此患者術后發生縱隔感染,最終患者因感染、循環衰竭死亡。1 例(5.6%)患者消化道內鏡診斷為胃體上部后壁潰瘍,經藥物治療后好轉出院。GIB 時間為術后 36 d。余6例(33.3%)患者因無消化道內鏡及術后腹部CT結果,無法診斷GIB疾病類型。
2.3 隨訪結果
GIB組8例患者存活,術后(47.50±18.07)d出院,1例行部分結腸切除術的患者6個月后再次手術閉合造口。其余患者術后半年生存良好,5例患者術后1年生存良好。
3 討論
在A型主動脈夾層術后患者中,GIB組患者年齡更大、低氧(SpO2<95%)比例高、術中停循環時間更長,術后撤除呼吸機時間>72 h、低心排血量綜合征、術后FiO2≥50%患者比例,CRRT、ECMO使用率和感染率等方面明顯高于non-GIB組(P<0.05)。腸損傷的病理生理存在不確定性,本研究的logistic回歸結果顯示,術前低氧(SpO2<95%)、術后撤除呼吸機時間>72 h及CRRT是A型主動脈夾層患者術后GIB的獨立危險因素。張浩陽[4]的研究也證明CRRT是A型主動脈夾層術后GIB的獨立危險因素。
在A型主動脈夾層累及腸系膜上動脈的患者中(3例,16.7%),術后部分患者恢復真腔供血,但發生GIB及其他消化道并發癥的幾率仍較高(3例,100.0%)、死亡率高(2例,66.7%)。在Yang等[5]的研究中,對于術前夾層累及外周動脈的病例(灌注不良綜合征),沒有心臟壓塞的穩定患者先行血管內再灌注(開窗/支架置入)再延遲開放修復治療,其30 d死亡率及院內死亡率均顯著下降(P<0.03)。這對于累及腸系膜上動脈的夾層患者是可以考慮的治療方法,但主動脈夾層破裂仍是制約因素。
NOMI為ICU常見并發癥,研究[2-3]認為和高齡、低心排血量綜合征、心房顫動、CRRT及先前的低血壓發作等相關,死亡率為50%~83%[2]。本研究中GIB組7例(38.9%)有內鏡檢查的患者在排除其他疾病后,診斷為NOMI,占比最高。在單因素分析中, GIB組的低氧相關數據,如術前SpO2<95%、術中停循環時間、術后FiO2≥50%、ECMO、撤除呼吸機時間>72 h,都與non-GIB組有明顯差異。從術前的低氧開始,術中及術后的低氧,腸系膜氧供均會受到影響。有研究[6]認為低氧,術后FiO2>40%即是主動脈夾層術后NOMI的獨立預測因子。
NOMI 發生機制[2]還涉及腸系膜血管收縮、腸道??缺氧同時代謝增加、缺血-再灌注損傷、細胞凋亡和腸細胞增殖減少等,并最終導致血管痙攣惡化、進一步的局部缺血和腸壁更廣泛的損傷,直至腸道全層損傷、梗死和患者死亡。及時發現患者腸黏膜缺血情況,積極進行干預。我中心部分GIB患者進行了消化道內鏡檢查,能及時診斷及治療,鏡下可見腸道黏膜水腫缺血(圖2)、廣泛潰瘍、潰瘍出血等,可在內鏡下止血等。當腸腔出現狹窄、腸壁壞死時,內鏡檢查難度及風險增大。內鏡也無法進行空回腸檢查,而據文獻[2,7]報道空回腸發生NOMI的幾率為33%~49%。據文獻[7]報道腹部增強CT檢查可以顯示腸壞死的直接和間接跡象,表現為壞死腸壁的強化缺失。但Bourcier等[8]的研究認為NOMI腸壞死患者只行腹部增強CT,診斷NOMI效果有限,單一的影像學檢查診斷準確率不高。腸道缺血壞死、穿孔為疾病的轉折點,積極行剖腹探查切除壞死腸道,觀察剩余腸段血供情況,必要時進行多次腸切除手術[9]。剖腹探查時機很重要,有研究[10]在ICU床旁使用腹腔鏡觀察切除后腸道血運情況,能夠及時開展二次及多次的腸切除手術,不增加相關死亡風險,能顯著降低死亡率。而文獻[2]報道腸切除術后患者的死亡率高達68%,患者心功能、全身狀態等是重要因素。我們的1例結腸部分切除患者術后存活出院。
在本研究中診斷為NOMI的患者,4例(22.2%)發生胃及十二指腸黏膜的缺血性改變,包括黏膜水腫、多發潰瘍及出血等。與結腸多發潰瘍出血(2例,11.1%)相比,胃及十二指腸的廣泛性潰瘍出血更加難以止血(2例,100.0%止血成功vs. 4例,50.0%止血成功),在懷疑十二指腸壞死時,外科手術難度較大,醫生更傾向于選擇保守治療,死亡率較高(2例,50.0%)。有單中心的研究[7]認為,NOMI患者發生腸道壞死時,部位和程度與生存率相關,越靠近近心端預后越差。
在術后GIB患者中有3例(16.7%)診斷為胃潰瘍,僅1例為單個胃潰瘍病灶。在Krawiec等[11]的研究中,心臟外科術后早期(30 d內)GIB的內鏡檢查中,術前既有的十二指腸潰瘍出血占比最高。在本研究中,此類型潰瘍占比不高,可能因素為內鏡檢查比例仍低,及此種潰瘍出血后藥物治療有效率較高。
少量患者因其他因素發生GIB,如縱隔感染導致消化道動脈出血。積極處理能有效止血,但患者的預后仍與原發疾病相關。
本研究為單中心回顧性研究,GIB組病例較少,內鏡資料偏少。A型主動脈夾層患者術后GIB中,NOMI占比高。對患者出現的GIB等進行積極治療,消化道內鏡檢查是診斷NOMI的有效途徑。對于懷疑發生腸道缺血性壞死的患者可行腹部增強CT檢查,對高風險患者進行外科治療。同時積極處理患者原發疾病,調整影響患者疾病發展的因素。
利益沖突:無。
作者貢獻:程浩負責數據整理、論文撰寫和修改、統計分析;周煒負責數據整理、論文撰寫和修改;唐楊烽、李白翎負責論文指導性評閱及批評性審閱;韓林、徐志云負責論文指導性評閱,支持性貢獻。
A型主動脈夾層累及外周動脈如腸系膜上動脈時,可發生急性腸系膜缺血(acute mesenteric ischemia,AMI),其術后易發生腸道出血、壞死等,死亡率高達60%~80%[1-2]。我中心對A型主動脈夾層累及腸系膜上動脈(雙腔/假腔供血/血栓形成)時無明顯腹痛的患者予以外科手術,術后觀察患者腸系膜缺血情況并予處理。
心臟術后消化道并發癥的重要病理生理因素是低心排血量綜合征、局部血流受損和低血壓相關的內臟灌注不良,引起腸系膜缺血性改變[2]。當無內臟動靜脈阻塞的臨床證據,而腸道仍發生了缺血性改變,并發癥包括腸穿孔、腹膜炎、腸道屏障破壞引起的菌血癥,進一步導致非腸系膜器官功能障礙的炎癥和休克,稱為非閉塞性腸系膜缺血(non-occlusive mesenteric ischemia,NOMI)[3]。腸系膜動脈造影曾是其診斷的金標準[3],現已逐漸被其他檢查替代,為排除性診斷。A型主動脈夾層術后部分患者合并心功能障礙、低氧血癥及外周動脈血流因夾層所致血流動力學受損,可發生多種消化道并發癥,最多見的臨床癥狀是消化道出血(gastrointestinal bleeding,GIB),其原因待進一步分析。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2017—2021年海軍軍醫大學附屬第一醫院心血管外科收治的A型主動脈夾層手術患者的臨床資料。根據術后是否存在 GIB 將患者分為 GIB 組和 non-GIB組。GIB組的選取標準包括:(1)術后大便隱血+++至++++、兩次或以上,因GIB輸注血制品和/或影響循環平穩的出血;(2)術后GIB并有腹痛和/或嚴重腹瀉、腹脹的患者。排除標準:(1)GIB量較小,經保守藥物治療迅速好轉的患者;(2)術后二次住院患者。
1.2 資料收集
從醫院病歷系統中收集患者圍術期資料。基線資料包括性別、年齡、體重指數、吸煙史、糖尿病史、冠心病史、高血壓史、是否二次手術、術前合并疾病(馬方綜合征、大動脈炎、急性腎功能不全、慢性腎功能不全)、DeBakey分型、術前肌酐值、血氧飽和度、左室射血分數、心包積液、夾層是否損傷冠狀動脈等。術中資料包括 A 型主動脈夾層術式、合并手術、體外循環時間、主動脈阻斷時間、停循環時間。術后資料包括二次開胸止血、撤除呼吸機時間>72 h、低心排血量綜合征、術后吸入氣氧濃度(fraction of inspired oxygen,FiO2)≥50%患者比例、連續性腎臟替代治療(continuous renal replacement therapy,CRRT)率、體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)使用率、腦梗死率、感染率、術后 GIB 時間、住 ICU 時間、住院時間和死亡率。患者術后FiO2≥50% 選取標準:FiO2≥50% 持續時間>24 h。
1.3 統計學分析
使用SPSS 22.0軟件進行統計學分析。計量資料若符合正態分布且滿足方差齊性則以均數±標準差( )描述,兩組間比較采用獨立樣本t檢驗,否則使用中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用非參數秩和檢驗;計數資料以例數和百分數描述,兩組間比較采用χ2檢驗。單因素分析中差異有統計學意義的變量納入多因素logistic回歸模型,分析A型主動脈夾層術后GIB的影響因素。P≤0.05為差異有統計學意義。
)描述,兩組間比較采用獨立樣本t檢驗,否則使用中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用非參數秩和檢驗;計數資料以例數和百分數描述,兩組間比較采用χ2檢驗。單因素分析中差異有統計學意義的變量納入多因素logistic回歸模型,分析A型主動脈夾層術后GIB的影響因素。P≤0.05為差異有統計學意義。
2 結果
2.1 兩組圍術期結果比較
GIB 組納入患者 18 例,non-GIB 組納入患者 511 例。GIB組患者年齡比non-GIB 組大[(60.11±10.63)歲 vs.(49.81±12.88)歲,P=0.001]。在急性和慢性腎衰竭方面兩組差異無統計學意義;兩組術前經皮動脈血氧飽和度(percutaneous arterial oxygen saturation,SpO2)<95%(雙鼻導管吸氧,最大氧濃度40%,對應氧分壓約70 mm Hg, 1 mm Hg=0.133 kPa)患者比例差異有統計學意義 ( P<0.001);見表1。
 /例(%)/M(P25,P75)]
/例(%)/M(P25,P75)]
兩組術中停循環時間差異有統計學意義[(31.56±13.68)min vs.(24.54±11.17)min,P=0.010];見表2。停循環時間長意味著更復雜的手術處理及患者各器官缺血缺氧時間更長。術后兩組患者撤除呼吸機時間>72 h、低心排血量綜合征、FiO2≥50%占比、CRRT、ECMO使用率差異有統計學意義(P<0.05)。GIB組患者的術后住ICU時間[(31.44±19.61)d vs.(9.37±10.31)d,P<0.001]及住院時間[(47.50±18.07)d vs.(21.66±14.33)d,P<0.001]明顯延長。GIB組患者感染率(44.4% vs. 17.0%,P=0.003)、死亡率(55.6% vs. 10.4%,P<0.001)高于non-GIB 組。發生GIB的時間為術后(22.44±12.63)d;見表3。
 /例(%)]
/例(%)]
 /例(%)]
/例(%)]
將差異有統計學意義(P≤0.05)的單變量納入多因素 logistic回歸模型,分析結果顯示術前SpO2<95%、撤除呼吸機時間>72 h、術后CRRT是A型主動脈夾層患者術后發生GIB的危險因素;見表4。
2.2 GIB組內分析
GIB組患者在有出血癥狀后,先采用保守藥物治療,并根據出血量調整腸內營養的喂養。消化道潰瘍患者出血量更大,缺血性結腸炎患者(1例,5.6%)主要表現為喂養不耐受,腹瀉癥狀明顯。GIB患者在出血前,大部分有腹脹史(10例,55.6%),當腹脹發生時,藥物通便排氣能緩解部分腹脹,對于無法緩解的患者可行其他檢查。腹痛是其次的臨床癥狀(6例,33.3%),部分患者選擇藥物止痛,劇烈腹痛應考慮AMI或腸道壞死穿孔;見表5。
2.2.1 夾層累及腸系膜上動脈
3例(16.7%)術前存在腸系膜上動脈夾層的患者(2例雙腔供血,1例假腔供血),術后2例患者腸系膜上動脈恢復真腔供血,其中1例術后發生結腸破裂行腸部分切除術,腹部增強CT顯示其腸系膜上動脈通暢,腸系膜下動脈缺血;另1例因合并低心排血量綜合征等而保守治療,后因感染、多器官衰竭死亡。1例術后腹部CT平片示橫結腸大量積氣(圖1),考慮腸系膜上動脈閉塞,后行數字減影血管造影下支架植入術,此患者術后因嚴重的右心功能障礙行ECMO支持,后死于多器官功能衰竭。此3例患者GIB發生在術后第7~33 d;見表5。
 圖1
急性腸系膜缺血患者腹部CT
圖1
急性腸系膜缺血患者腹部CT
a:患者術前腸系膜上動脈為雙腔供血;b:術后發生急性腸系膜缺血時橫結腸積氣
2.2.2 非閉塞性腸系膜缺血的診斷及治療
其余15例(83.3%)患者術前腸系膜上動脈通暢、無夾層累及,10例(55.6%)有消化道內鏡結果,7例(38.9%)的特點為廣泛的胃、十二指腸或結直腸黏膜蒼白、水腫、多發潰瘍和出血;見圖2。包括1例為巨大胃潰瘍復合十二指腸黏膜廣泛水腫、多發潰瘍的患者,術后12 d出血,排除應激性潰瘍,診斷為胃潰瘍合并NOMI。在發生腸道穿透性壞死前NOMI有一定的可逆性,前期內鏡檢查可以診斷和及時治療。多發潰瘍出血常需多次內鏡下止血(3例),甚至難以止血(2例)。另外1例缺血性結腸炎經保守藥物治療,并積極處理心功能不全,提高平均動脈壓并減少血管活性藥物的劑量等;見表5。但此患者最后仍死于感染、循環衰竭。
 圖2
A型主動脈夾層術后結腸鏡下結腸缺血性改變的不同表現
圖2
A型主動脈夾層術后結腸鏡下結腸缺血性改變的不同表現
a~b:結腸缺血時黏膜水腫、蒼白;c:結腸潰瘍出血
2.2.3 其他
1例(5.6%)結腸內鏡陰性的患者,大量血便,數字減影血管造影發現胃動脈出血,行胃左動脈及胃十二指腸動脈栓塞術。此患者術后發生縱隔感染,最終患者因感染、循環衰竭死亡。1 例(5.6%)患者消化道內鏡診斷為胃體上部后壁潰瘍,經藥物治療后好轉出院。GIB 時間為術后 36 d。余6例(33.3%)患者因無消化道內鏡及術后腹部CT結果,無法診斷GIB疾病類型。
2.3 隨訪結果
GIB組8例患者存活,術后(47.50±18.07)d出院,1例行部分結腸切除術的患者6個月后再次手術閉合造口。其余患者術后半年生存良好,5例患者術后1年生存良好。
3 討論
在A型主動脈夾層術后患者中,GIB組患者年齡更大、低氧(SpO2<95%)比例高、術中停循環時間更長,術后撤除呼吸機時間>72 h、低心排血量綜合征、術后FiO2≥50%患者比例,CRRT、ECMO使用率和感染率等方面明顯高于non-GIB組(P<0.05)。腸損傷的病理生理存在不確定性,本研究的logistic回歸結果顯示,術前低氧(SpO2<95%)、術后撤除呼吸機時間>72 h及CRRT是A型主動脈夾層患者術后GIB的獨立危險因素。張浩陽[4]的研究也證明CRRT是A型主動脈夾層術后GIB的獨立危險因素。
在A型主動脈夾層累及腸系膜上動脈的患者中(3例,16.7%),術后部分患者恢復真腔供血,但發生GIB及其他消化道并發癥的幾率仍較高(3例,100.0%)、死亡率高(2例,66.7%)。在Yang等[5]的研究中,對于術前夾層累及外周動脈的病例(灌注不良綜合征),沒有心臟壓塞的穩定患者先行血管內再灌注(開窗/支架置入)再延遲開放修復治療,其30 d死亡率及院內死亡率均顯著下降(P<0.03)。這對于累及腸系膜上動脈的夾層患者是可以考慮的治療方法,但主動脈夾層破裂仍是制約因素。
NOMI為ICU常見并發癥,研究[2-3]認為和高齡、低心排血量綜合征、心房顫動、CRRT及先前的低血壓發作等相關,死亡率為50%~83%[2]。本研究中GIB組7例(38.9%)有內鏡檢查的患者在排除其他疾病后,診斷為NOMI,占比最高。在單因素分析中, GIB組的低氧相關數據,如術前SpO2<95%、術中停循環時間、術后FiO2≥50%、ECMO、撤除呼吸機時間>72 h,都與non-GIB組有明顯差異。從術前的低氧開始,術中及術后的低氧,腸系膜氧供均會受到影響。有研究[6]認為低氧,術后FiO2>40%即是主動脈夾層術后NOMI的獨立預測因子。
NOMI 發生機制[2]還涉及腸系膜血管收縮、腸道??缺氧同時代謝增加、缺血-再灌注損傷、細胞凋亡和腸細胞增殖減少等,并最終導致血管痙攣惡化、進一步的局部缺血和腸壁更廣泛的損傷,直至腸道全層損傷、梗死和患者死亡。及時發現患者腸黏膜缺血情況,積極進行干預。我中心部分GIB患者進行了消化道內鏡檢查,能及時診斷及治療,鏡下可見腸道黏膜水腫缺血(圖2)、廣泛潰瘍、潰瘍出血等,可在內鏡下止血等。當腸腔出現狹窄、腸壁壞死時,內鏡檢查難度及風險增大。內鏡也無法進行空回腸檢查,而據文獻[2,7]報道空回腸發生NOMI的幾率為33%~49%。據文獻[7]報道腹部增強CT檢查可以顯示腸壞死的直接和間接跡象,表現為壞死腸壁的強化缺失。但Bourcier等[8]的研究認為NOMI腸壞死患者只行腹部增強CT,診斷NOMI效果有限,單一的影像學檢查診斷準確率不高。腸道缺血壞死、穿孔為疾病的轉折點,積極行剖腹探查切除壞死腸道,觀察剩余腸段血供情況,必要時進行多次腸切除手術[9]。剖腹探查時機很重要,有研究[10]在ICU床旁使用腹腔鏡觀察切除后腸道血運情況,能夠及時開展二次及多次的腸切除手術,不增加相關死亡風險,能顯著降低死亡率。而文獻[2]報道腸切除術后患者的死亡率高達68%,患者心功能、全身狀態等是重要因素。我們的1例結腸部分切除患者術后存活出院。
在本研究中診斷為NOMI的患者,4例(22.2%)發生胃及十二指腸黏膜的缺血性改變,包括黏膜水腫、多發潰瘍及出血等。與結腸多發潰瘍出血(2例,11.1%)相比,胃及十二指腸的廣泛性潰瘍出血更加難以止血(2例,100.0%止血成功vs. 4例,50.0%止血成功),在懷疑十二指腸壞死時,外科手術難度較大,醫生更傾向于選擇保守治療,死亡率較高(2例,50.0%)。有單中心的研究[7]認為,NOMI患者發生腸道壞死時,部位和程度與生存率相關,越靠近近心端預后越差。
在術后GIB患者中有3例(16.7%)診斷為胃潰瘍,僅1例為單個胃潰瘍病灶。在Krawiec等[11]的研究中,心臟外科術后早期(30 d內)GIB的內鏡檢查中,術前既有的十二指腸潰瘍出血占比最高。在本研究中,此類型潰瘍占比不高,可能因素為內鏡檢查比例仍低,及此種潰瘍出血后藥物治療有效率較高。
少量患者因其他因素發生GIB,如縱隔感染導致消化道動脈出血。積極處理能有效止血,但患者的預后仍與原發疾病相關。
本研究為單中心回顧性研究,GIB組病例較少,內鏡資料偏少。A型主動脈夾層患者術后GIB中,NOMI占比高。對患者出現的GIB等進行積極治療,消化道內鏡檢查是診斷NOMI的有效途徑。對于懷疑發生腸道缺血性壞死的患者可行腹部增強CT檢查,對高風險患者進行外科治療。同時積極處理患者原發疾病,調整影響患者疾病發展的因素。
利益沖突:無。
作者貢獻:程浩負責數據整理、論文撰寫和修改、統計分析;周煒負責數據整理、論文撰寫和修改;唐楊烽、李白翎負責論文指導性評閱及批評性審閱;韓林、徐志云負責論文指導性評閱,支持性貢獻。