版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
原發性肺黏液腺癌(primary pulmonary mucinous adenocarcinoma,PPMA)是一種特殊類型的腺癌,國外報道其僅占腺癌的0.25%[1],國內報道約占0.14%[2],是腺癌中一種很罕見的病理亞型。由于PPMA臨床表現較隱匿、缺乏特異性,僅少數患者表現出咳嗽、咳白色黏液樣痰,早期容易誤診或漏診而導致延誤病情,確診時往往喪失治療最佳時機,故探尋有效的輔助診斷方法迫在眉睫。根據PPMA在影像上的大體表現,多數學者[3-4]將其分為腫塊型及肺炎型;見圖1。針對PPMA在影像學上的不同表現,有學者認為與其惡性程度相關,也有學者表示肺炎型是腫塊型病程進展的表現[4-5],但均缺乏有效證據。基于此,本文引用現在較為可靠的免疫組織化學(組化)指標Ki-67指數對腫瘤的惡性程度進行評估,結合兩者在影像學上的特征表現分析兩者之間的關系。同時對比分析PPMA肺炎型及腫塊型的臨床表現、影像學特征,旨在提高臨床醫師對該疾病的認識,減少誤診及漏診,從而做到早發現、早診斷、早治療。
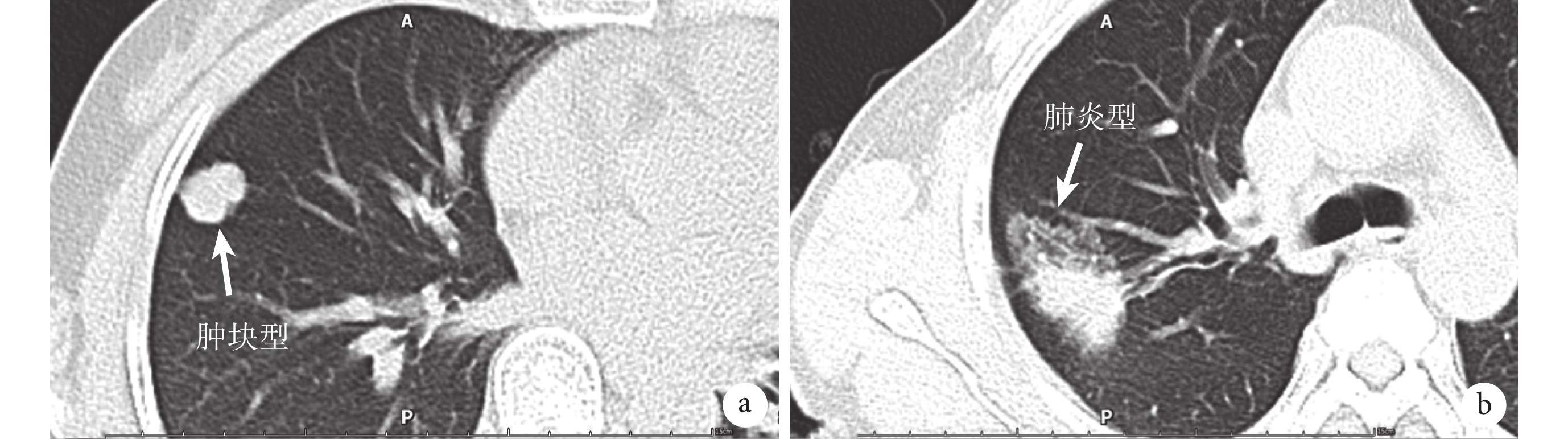
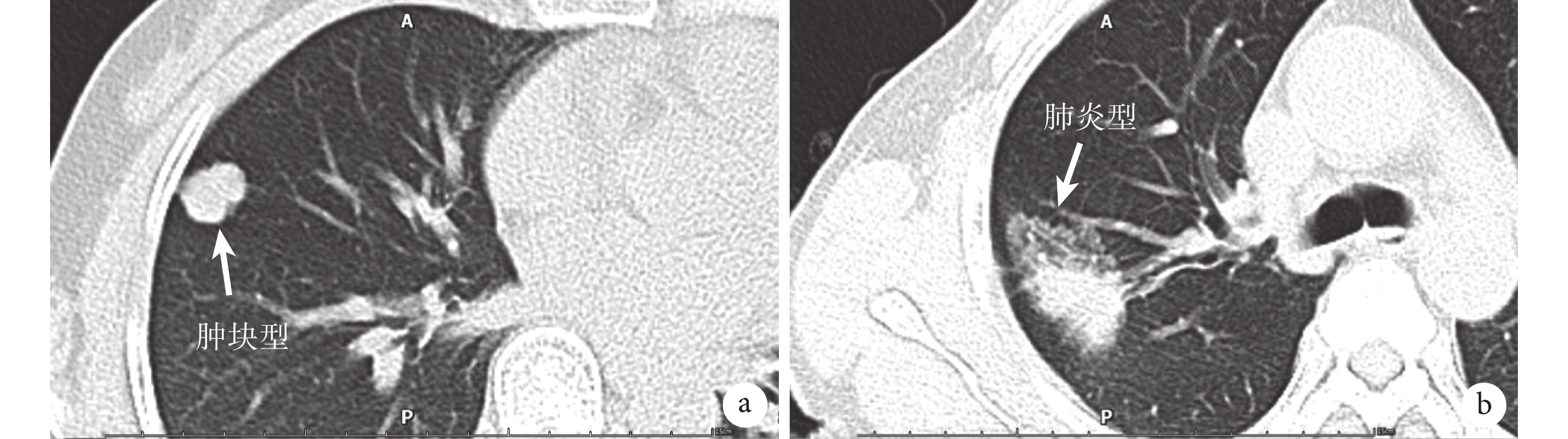 圖1
PPMA的影像學檢查
圖1
PPMA的影像學檢查
a:CT平掃下PPMA呈腫塊型表現:多為單發或者多發的圓形或類圓形白色斑點或者白色陰影,邊界多較為清晰,且具備肺腺癌的一般影像學特征,包括毛刺征、分葉征、空泡征、胸膜凹陷征等;b:CT平掃下PPMA呈肺炎型表現,病變可呈單發亦可成片分布,CT上多表現為大片狀磨玻璃密度影,因腫瘤內含有腫瘤細胞、黏液、肺泡組織等成分,故密度多表現不均勻且較低;PPMA:原發性肺黏液腺癌
1 資料與方法
1.1 臨床資料和分組
回顧性納入2011年5月—2022年3月廈門大學附屬第一醫院收治的PPMA患者。納入標準:(1)病理穿刺或術后病理證實為PPMA;(2)術前未行放化療或其他藥物治療;(3)臨床病歷資料詳細完整。排除標準:(1)同時具有良惡性腫瘤或多發腫瘤;(2)PPMA發生全身轉移;(3)肺黏液腺癌為非原發癌;(4)同時合并肺部感染。根據PPMA CT特征,將患者分為兩組:腫塊型組及肺炎型組。
1.2 CT檢測及分析
所有病例均采用GE LightSpeed 64排容積螺旋CT機,掃描范圍為胸部,管電壓120 kV,管電流250 mA,層厚5 mm,層距 5 mm。矩陣512×512,圖像顯示肺窗:窗位?600 HU,窗寬
1.3 Ki-67的檢測
所有病例標本均行伊紅-蘇木精染色和Ki-67免疫組化染色。在高倍鏡下(×400),Ki-67陽性表達為細胞核呈棕黃色顆粒,增殖指數為陽性染色細胞數/總細胞數×100%。
多項研究[7-9]稱,Ki-67臨界值在10%~14%之間可被推薦作為識別癌癥生存結局高風險的金標準。以Ki-67指數14%為界,將患者分為兩組:低Ki-67指數組(≤14%)和高Ki-67指數組(>14%)。
1.4 統計學分析
臨床資料數據采用SPSS 25.0進行分析。符合正態分布或近似正態分布的計量資料,以均數±標準差(x±s)描述,組間比較采用Student t檢驗或Welch t檢驗;非正態分布的計量資料則用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用Mann-Whitney U檢驗。計數資料采用頻數和百分比(%)描述,組間比較采用Pearson χ2檢驗。雙側P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過廈門大學第一附屬醫院醫學倫理委員會審批,批準號:XMYY-2022KY056。
2 結果
2.1 患者一般資料
共納入57例PPMA患者,其中男17例、女40例,平均年齡(53.82±10.65)歲。腫塊型組42例,肺炎型組15例。腫塊型組通過體檢發現的PPMA患者27例(64%),肺炎型組5例(33%),差異有統計學意義(P=0.038)。兩組患者年齡、性別、吸煙史、臨床表現及腫瘤位置差異均無統計學意義(P>0.05)。兩組中女性患者均多于男性,病變部位發生在雙肺下葉多于其他肺葉,咳嗽、咳痰為主要臨床癥狀;見表1。
2.2 影像學特征
兩組患者的腫瘤實性成分占比>0.8、類反暈征(圖2)、環形影的CT值、中心區域CT值、毛刺征、分葉征、血管集束征、空泡與空洞征差異均無統計學意義(P>0.05),但兩組中實性成分占比>0.8的比例均較高,分別為88%和80%;含有類反暈征的比例分別為55%和40%。兩組腫瘤最大徑、邊界情況、胸膜凹陷征差異有統計學意義(P<0.05);見表2。
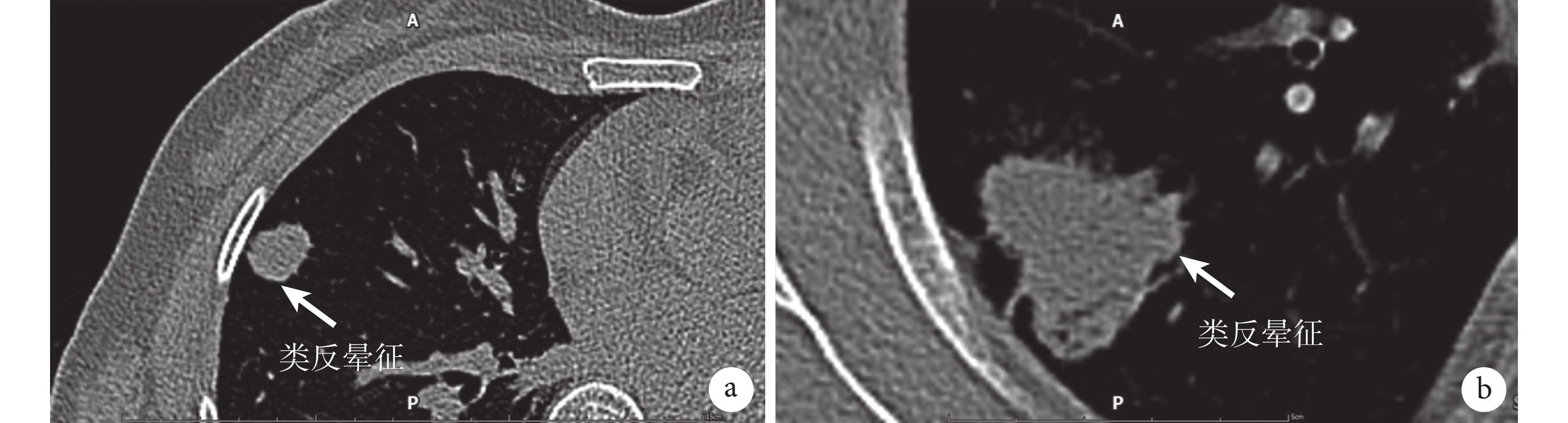
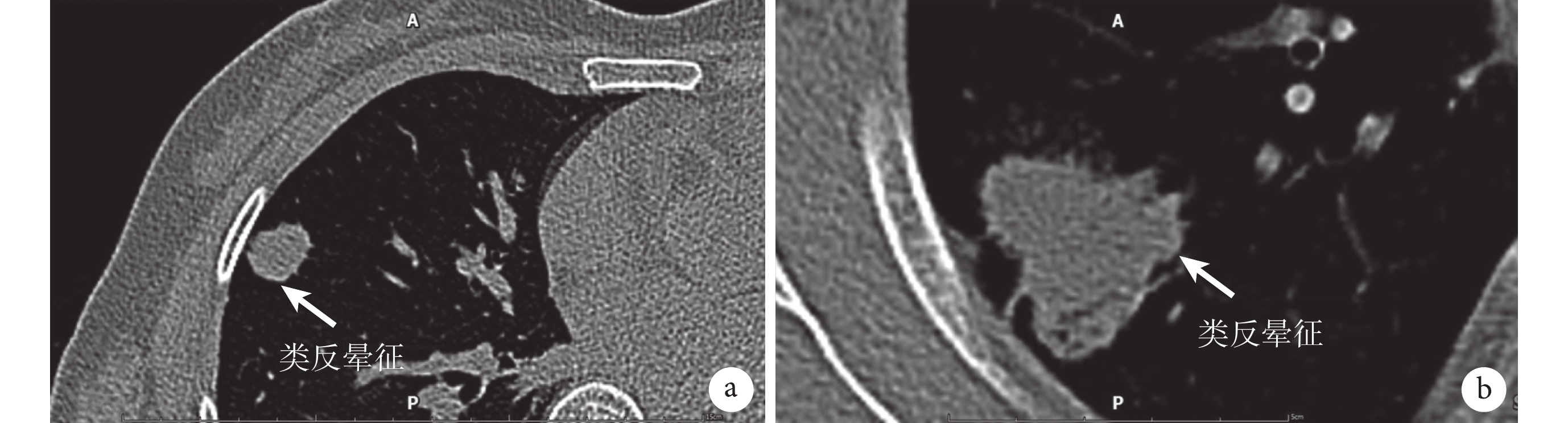 圖2
PPMA的類反暈征
圖2
PPMA的類反暈征
a:腫塊型PPMA的類反暈征;b:肺炎型PPMA的類反暈征;結節中間區域密度較低,邊緣由一圈或者半圈薄層環形密度增高影包繞;PPMA:原發性肺黏液腺癌
2.3 Ki-67指數比較
腫塊型組患者的中位Ki-67指數為10%(7%,20%),肺炎型組為10%(10%,25%),差異無統計學意義(P=0.532)。兩組患者的高、低Ki-67指數比例差異也無統計學意義(P=0.974);見表3。
3 討論
目前學術界對PPMA的研究尚還表淺,因該病為罕見病,無法大規模統計。本文對PPMA的臨床表現、影像學表現、Ki-67指數進行分析與討論。
3.1 PPMA的臨床表現
本研究中,患者平均年齡為(53.82±10.65)歲,女性患者所占比例為70%,與文獻[10]報道情況相同,表明該疾病好發于中老年女性人群,但仍需要更多病例來支持此觀點。吸煙患者共占16%,故暫不認為吸煙與該病相關。出現咳嗽、咳白色黏液樣痰的患者共21例,在出現臨床癥狀的患者中占比較高(84%),與文獻[10-11]報道情況大致相同,故可考慮咳嗽、咳大量白色黏液樣痰為PPMA的主要臨床表現。63%的病灶位于雙肺下葉,表明該病好發于雙下肺。其原因可能是黏液的相對質量大于空氣,受重力的影響,通過肺泡孔或者氣道,攜帶腫瘤細胞向雙下肺播散并種植[12]。
有研究[13-14]對PPMA腫塊型及肺炎型患者的年齡、性別、吸煙史、臨床表現進行比較分析,結果表明兩組均無明顯差異。本研究結果基本與報道相符,但體檢發現的患者比例在腫塊型組(64%)遠高于肺炎型組(33%),說明肺炎型組出現臨床癥狀后就診的比例高于腫塊型組,支持肺炎型是腫塊型在病程上的進展。
3.2 PPMA的影像學特征
現階段PPMA的診斷還是以病理診斷為金標準,影像學特征在診斷中具有重要參考價值。現階段低劑量胸部CT對肺癌篩查起到很大的作用。在CT觀察下,腫塊型病灶多見于肺組織的外周部位[10]。CT表現與一般肺腺癌特征無明顯差異,病灶邊緣可見分葉征、血管集束征、毛刺征,部分可見胸膜凹陷征及空泡與空洞征。肺炎型病灶在CT上多表現為斑片狀或大片狀模糊陰影,因腫瘤組織中有癌細胞、黏液、肺泡等成分,病灶密度不均且較低;由于病灶較散在或彌散,密度可呈水樣低密度。
本研究對兩組的影像學特征進行比較,結果發現腫瘤最大徑、邊界情況、胸膜凹陷征差異有統計學意義。PPMA邊界模糊的原因是肺泡腔內充滿黏液并向腔外彌散,彌散的黏液固化與肺泡實質緊密連接,從而使腫瘤邊界模糊不清,病灶呈現皺縮樣瘢痕樣外觀[10]。胸膜凹陷征是因臟層胸膜受腫瘤組織的影響,內陷皺縮形成的影像學特征。這三者均是反映疾病嚴重程度的有力指標。結果顯示,腫塊型組最大徑較肺炎型組小,腫塊型組邊界模糊和胸膜凹陷征占比均較肺炎型組低。以上3點均支持PPMA肺炎型是腫塊型在病程上的進展表現。
有研究[15]表明,在肺窗上實性成分占比>0.8或者縱隔窗上實性成分占比>0.6表示為浸潤性生長,而分葉征、毛刺征、血管集束征也是惡性腫瘤浸潤生長的參考指標。兩組中實性成分占比>0.8、分葉征、毛刺征、血管集束征差異均無統計學意義,但兩組上述指標均較高。這可能與該病本身的病理類型相關:PPMA腫瘤細胞增殖擴散及分泌的大量黏液向四周蔓延,均能使腫瘤呈浸潤性生長。至于空泡與空洞征,大部分學者認為空泡征是由于腫瘤細胞在細支氣管壁浸潤生長,導致小氣道狹窄或者形成活塞瓣,氣體易進難出,肺泡過度充氣破裂形成腔隙(<5 mm)[16],大量破裂的肺泡匯成空洞征(>5 mm)。本研究中,腫塊型組與肺炎型組的空泡與空洞征發生率差異無統計學意義,但發生率均較高,此征象可成為診斷該病的有力依據之一。
反暈征是指一個局灶性圓形或類圓形磨玻璃區域,圍繞著完整的實性環[6],是一種較為少見的影像學征象。反暈征可見于多種肺部疾病,其中以結核、隱源性機化性肺炎、真菌感染較為常見,也有報道[15]稱在肺腺癌見到此征象。已有不少文獻對肺腺癌CT的一般征象進行詳細闡述,包括分葉征、毛刺征、胸膜凹陷征等,但極少文獻提及反暈征。任華等[17]通過對34例表現為反暈征的肺磨玻璃結節患者進行分析,發現反暈征在肺癌中多見于肺腺癌,但未講述其具體的病理亞型。上述研究提出肺腺癌中出現反暈征可能與其生長方式有關,腺癌細胞貼壁生長,由于生長速度不一,從而使得生長較慢區域表現為磨玻璃密度影,生長較快區域表現為密度較高的環形影。有研究[18]對結核、隱源性機化性肺炎及真菌感染中出現反暈征的病理機制進行闡述:肺結核外環是因病灶沿著小葉內間質蔓延浸潤,最終連接而成,內暈是由于病灶侵及肺泡壁,向內擴散累及間質形成。隱源性機化性肺炎的外環是因遠端氣道內炎癥機化導致,中央低密度區是由腺泡間隔的炎性滲出和細胞碎片形成。真菌感染中出現反暈征則可能是肺實質和肺泡炎癥滲出共同形成[19]。本研究從影像學上發現部分PPMA患者出現類反暈征的表現,即病灶中間區域密度較低,表現為CT值較低,腫塊邊緣有一圈或者半圈薄層的環形密度增高影。其產生的原因可能是腫瘤細胞向肺泡腔內分泌大量黏液,導致肺泡腔擴大,加上活塞瓣的形成使肺泡壁受到破壞,黏液的滲透及蔓延導致大黏液湖的形成,在影像學上表現為中央低密度區域。由于黏液湖內含有細胞碎片、肺泡組織等,在張力的作用下,漂浮向腫瘤邊界,與增生活躍的腫瘤細胞及固化的黏液重疊,在影像學上表現出密度增高影。本研究中,全組近一半的患者出現類反暈征。兩組環形影CT值均遠高于中心區域CT值,表明該征象在鑒別PPMA與其他疾病中有重要參考價值。
3.3 PPMA與Ki-67指數的關系
Ki-67是現如今在各個醫學領域應用較多的免疫組化指標,是一種細胞增殖核抗原,反映腫瘤細胞增殖活性及評估腫瘤惡性程度的可靠指標[20]。Ki-67的高表達可能促進肺鱗狀細胞癌[21]、宮頸癌[22]和喉癌[23]的侵襲性和浸潤性生長。此外,Ki-67過表達與胃癌和乳腺癌的淋巴結轉移呈正相關[24-25]。也有研究[26]表明Ki-67增殖指數與腫瘤大小、腫瘤細胞的分化程度以及腫瘤患者的預后相關,在臨床上具有一定的參考價值,被廣泛認為是最有前途的細胞增殖標志物。腫瘤的惡性程度主要和其分化程度及免疫組化指標相關。有研究[27]表明,PPMA的分化程度通常較好,故本研究主要采用Ki-67指數來判斷PPMA兩種類型的惡性程度。結果顯示兩組差異無統計學意義。根據多項研究提供的Ki-67指數的“金標準”,我們以14%為界,將患者分為高表達組和低表達組,結果發現腫塊型組與肺炎型組患者的Ki-67指數分布差異也無統計學意義,表明腫塊型與肺炎型在惡性程度上無顯著差異。
綜上所述,PPMA腫塊型與肺炎型患者在惡性程度上無明顯差異,結合其臨床表現及影像學特征差異,認為肺炎型是腫塊型在病程上進展的表現。PPMA好發于中老年女性,多發生于雙下肺,臨床表現以咳嗽、咳白色黏液樣痰為主。CT上可表現多樣,其中類反暈征有望成為重要的影像學特征,聯合實性成分占比高、胸膜凹陷征及空泡征等特征,能對PPMA的診斷起到重要的輔助作用。
利益沖突:無。
作者貢獻:馮義輝負責文章選題,資料和文獻查閱,文章撰寫與修改;朱曉雷、張瀟文、方韶韓、李寧負責文獻查找,文章撰寫與修改;耿國軍負責文章選題、修改和審定。
原發性肺黏液腺癌(primary pulmonary mucinous adenocarcinoma,PPMA)是一種特殊類型的腺癌,國外報道其僅占腺癌的0.25%[1],國內報道約占0.14%[2],是腺癌中一種很罕見的病理亞型。由于PPMA臨床表現較隱匿、缺乏特異性,僅少數患者表現出咳嗽、咳白色黏液樣痰,早期容易誤診或漏診而導致延誤病情,確診時往往喪失治療最佳時機,故探尋有效的輔助診斷方法迫在眉睫。根據PPMA在影像上的大體表現,多數學者[3-4]將其分為腫塊型及肺炎型;見圖1。針對PPMA在影像學上的不同表現,有學者認為與其惡性程度相關,也有學者表示肺炎型是腫塊型病程進展的表現[4-5],但均缺乏有效證據。基于此,本文引用現在較為可靠的免疫組織化學(組化)指標Ki-67指數對腫瘤的惡性程度進行評估,結合兩者在影像學上的特征表現分析兩者之間的關系。同時對比分析PPMA肺炎型及腫塊型的臨床表現、影像學特征,旨在提高臨床醫師對該疾病的認識,減少誤診及漏診,從而做到早發現、早診斷、早治療。
 圖1
PPMA的影像學檢查
圖1
PPMA的影像學檢查
a:CT平掃下PPMA呈腫塊型表現:多為單發或者多發的圓形或類圓形白色斑點或者白色陰影,邊界多較為清晰,且具備肺腺癌的一般影像學特征,包括毛刺征、分葉征、空泡征、胸膜凹陷征等;b:CT平掃下PPMA呈肺炎型表現,病變可呈單發亦可成片分布,CT上多表現為大片狀磨玻璃密度影,因腫瘤內含有腫瘤細胞、黏液、肺泡組織等成分,故密度多表現不均勻且較低;PPMA:原發性肺黏液腺癌
1 資料與方法
1.1 臨床資料和分組
回顧性納入2011年5月—2022年3月廈門大學附屬第一醫院收治的PPMA患者。納入標準:(1)病理穿刺或術后病理證實為PPMA;(2)術前未行放化療或其他藥物治療;(3)臨床病歷資料詳細完整。排除標準:(1)同時具有良惡性腫瘤或多發腫瘤;(2)PPMA發生全身轉移;(3)肺黏液腺癌為非原發癌;(4)同時合并肺部感染。根據PPMA CT特征,將患者分為兩組:腫塊型組及肺炎型組。
1.2 CT檢測及分析
所有病例均采用GE LightSpeed 64排容積螺旋CT機,掃描范圍為胸部,管電壓120 kV,管電流250 mA,層厚5 mm,層距 5 mm。矩陣512×512,圖像顯示肺窗:窗位?600 HU,窗寬
1.3 Ki-67的檢測
所有病例標本均行伊紅-蘇木精染色和Ki-67免疫組化染色。在高倍鏡下(×400),Ki-67陽性表達為細胞核呈棕黃色顆粒,增殖指數為陽性染色細胞數/總細胞數×100%。
多項研究[7-9]稱,Ki-67臨界值在10%~14%之間可被推薦作為識別癌癥生存結局高風險的金標準。以Ki-67指數14%為界,將患者分為兩組:低Ki-67指數組(≤14%)和高Ki-67指數組(>14%)。
1.4 統計學分析
臨床資料數據采用SPSS 25.0進行分析。符合正態分布或近似正態分布的計量資料,以均數±標準差(x±s)描述,組間比較采用Student t檢驗或Welch t檢驗;非正態分布的計量資料則用中位數(上下四分位數)[M(P25,P75)]描述,組間比較采用Mann-Whitney U檢驗。計數資料采用頻數和百分比(%)描述,組間比較采用Pearson χ2檢驗。雙側P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究已通過廈門大學第一附屬醫院醫學倫理委員會審批,批準號:XMYY-2022KY056。
2 結果
2.1 患者一般資料
共納入57例PPMA患者,其中男17例、女40例,平均年齡(53.82±10.65)歲。腫塊型組42例,肺炎型組15例。腫塊型組通過體檢發現的PPMA患者27例(64%),肺炎型組5例(33%),差異有統計學意義(P=0.038)。兩組患者年齡、性別、吸煙史、臨床表現及腫瘤位置差異均無統計學意義(P>0.05)。兩組中女性患者均多于男性,病變部位發生在雙肺下葉多于其他肺葉,咳嗽、咳痰為主要臨床癥狀;見表1。
2.2 影像學特征
兩組患者的腫瘤實性成分占比>0.8、類反暈征(圖2)、環形影的CT值、中心區域CT值、毛刺征、分葉征、血管集束征、空泡與空洞征差異均無統計學意義(P>0.05),但兩組中實性成分占比>0.8的比例均較高,分別為88%和80%;含有類反暈征的比例分別為55%和40%。兩組腫瘤最大徑、邊界情況、胸膜凹陷征差異有統計學意義(P<0.05);見表2。
 圖2
PPMA的類反暈征
圖2
PPMA的類反暈征
a:腫塊型PPMA的類反暈征;b:肺炎型PPMA的類反暈征;結節中間區域密度較低,邊緣由一圈或者半圈薄層環形密度增高影包繞;PPMA:原發性肺黏液腺癌
2.3 Ki-67指數比較
腫塊型組患者的中位Ki-67指數為10%(7%,20%),肺炎型組為10%(10%,25%),差異無統計學意義(P=0.532)。兩組患者的高、低Ki-67指數比例差異也無統計學意義(P=0.974);見表3。
3 討論
目前學術界對PPMA的研究尚還表淺,因該病為罕見病,無法大規模統計。本文對PPMA的臨床表現、影像學表現、Ki-67指數進行分析與討論。
3.1 PPMA的臨床表現
本研究中,患者平均年齡為(53.82±10.65)歲,女性患者所占比例為70%,與文獻[10]報道情況相同,表明該疾病好發于中老年女性人群,但仍需要更多病例來支持此觀點。吸煙患者共占16%,故暫不認為吸煙與該病相關。出現咳嗽、咳白色黏液樣痰的患者共21例,在出現臨床癥狀的患者中占比較高(84%),與文獻[10-11]報道情況大致相同,故可考慮咳嗽、咳大量白色黏液樣痰為PPMA的主要臨床表現。63%的病灶位于雙肺下葉,表明該病好發于雙下肺。其原因可能是黏液的相對質量大于空氣,受重力的影響,通過肺泡孔或者氣道,攜帶腫瘤細胞向雙下肺播散并種植[12]。
有研究[13-14]對PPMA腫塊型及肺炎型患者的年齡、性別、吸煙史、臨床表現進行比較分析,結果表明兩組均無明顯差異。本研究結果基本與報道相符,但體檢發現的患者比例在腫塊型組(64%)遠高于肺炎型組(33%),說明肺炎型組出現臨床癥狀后就診的比例高于腫塊型組,支持肺炎型是腫塊型在病程上的進展。
3.2 PPMA的影像學特征
現階段PPMA的診斷還是以病理診斷為金標準,影像學特征在診斷中具有重要參考價值。現階段低劑量胸部CT對肺癌篩查起到很大的作用。在CT觀察下,腫塊型病灶多見于肺組織的外周部位[10]。CT表現與一般肺腺癌特征無明顯差異,病灶邊緣可見分葉征、血管集束征、毛刺征,部分可見胸膜凹陷征及空泡與空洞征。肺炎型病灶在CT上多表現為斑片狀或大片狀模糊陰影,因腫瘤組織中有癌細胞、黏液、肺泡等成分,病灶密度不均且較低;由于病灶較散在或彌散,密度可呈水樣低密度。
本研究對兩組的影像學特征進行比較,結果發現腫瘤最大徑、邊界情況、胸膜凹陷征差異有統計學意義。PPMA邊界模糊的原因是肺泡腔內充滿黏液并向腔外彌散,彌散的黏液固化與肺泡實質緊密連接,從而使腫瘤邊界模糊不清,病灶呈現皺縮樣瘢痕樣外觀[10]。胸膜凹陷征是因臟層胸膜受腫瘤組織的影響,內陷皺縮形成的影像學特征。這三者均是反映疾病嚴重程度的有力指標。結果顯示,腫塊型組最大徑較肺炎型組小,腫塊型組邊界模糊和胸膜凹陷征占比均較肺炎型組低。以上3點均支持PPMA肺炎型是腫塊型在病程上的進展表現。
有研究[15]表明,在肺窗上實性成分占比>0.8或者縱隔窗上實性成分占比>0.6表示為浸潤性生長,而分葉征、毛刺征、血管集束征也是惡性腫瘤浸潤生長的參考指標。兩組中實性成分占比>0.8、分葉征、毛刺征、血管集束征差異均無統計學意義,但兩組上述指標均較高。這可能與該病本身的病理類型相關:PPMA腫瘤細胞增殖擴散及分泌的大量黏液向四周蔓延,均能使腫瘤呈浸潤性生長。至于空泡與空洞征,大部分學者認為空泡征是由于腫瘤細胞在細支氣管壁浸潤生長,導致小氣道狹窄或者形成活塞瓣,氣體易進難出,肺泡過度充氣破裂形成腔隙(<5 mm)[16],大量破裂的肺泡匯成空洞征(>5 mm)。本研究中,腫塊型組與肺炎型組的空泡與空洞征發生率差異無統計學意義,但發生率均較高,此征象可成為診斷該病的有力依據之一。
反暈征是指一個局灶性圓形或類圓形磨玻璃區域,圍繞著完整的實性環[6],是一種較為少見的影像學征象。反暈征可見于多種肺部疾病,其中以結核、隱源性機化性肺炎、真菌感染較為常見,也有報道[15]稱在肺腺癌見到此征象。已有不少文獻對肺腺癌CT的一般征象進行詳細闡述,包括分葉征、毛刺征、胸膜凹陷征等,但極少文獻提及反暈征。任華等[17]通過對34例表現為反暈征的肺磨玻璃結節患者進行分析,發現反暈征在肺癌中多見于肺腺癌,但未講述其具體的病理亞型。上述研究提出肺腺癌中出現反暈征可能與其生長方式有關,腺癌細胞貼壁生長,由于生長速度不一,從而使得生長較慢區域表現為磨玻璃密度影,生長較快區域表現為密度較高的環形影。有研究[18]對結核、隱源性機化性肺炎及真菌感染中出現反暈征的病理機制進行闡述:肺結核外環是因病灶沿著小葉內間質蔓延浸潤,最終連接而成,內暈是由于病灶侵及肺泡壁,向內擴散累及間質形成。隱源性機化性肺炎的外環是因遠端氣道內炎癥機化導致,中央低密度區是由腺泡間隔的炎性滲出和細胞碎片形成。真菌感染中出現反暈征則可能是肺實質和肺泡炎癥滲出共同形成[19]。本研究從影像學上發現部分PPMA患者出現類反暈征的表現,即病灶中間區域密度較低,表現為CT值較低,腫塊邊緣有一圈或者半圈薄層的環形密度增高影。其產生的原因可能是腫瘤細胞向肺泡腔內分泌大量黏液,導致肺泡腔擴大,加上活塞瓣的形成使肺泡壁受到破壞,黏液的滲透及蔓延導致大黏液湖的形成,在影像學上表現為中央低密度區域。由于黏液湖內含有細胞碎片、肺泡組織等,在張力的作用下,漂浮向腫瘤邊界,與增生活躍的腫瘤細胞及固化的黏液重疊,在影像學上表現出密度增高影。本研究中,全組近一半的患者出現類反暈征。兩組環形影CT值均遠高于中心區域CT值,表明該征象在鑒別PPMA與其他疾病中有重要參考價值。
3.3 PPMA與Ki-67指數的關系
Ki-67是現如今在各個醫學領域應用較多的免疫組化指標,是一種細胞增殖核抗原,反映腫瘤細胞增殖活性及評估腫瘤惡性程度的可靠指標[20]。Ki-67的高表達可能促進肺鱗狀細胞癌[21]、宮頸癌[22]和喉癌[23]的侵襲性和浸潤性生長。此外,Ki-67過表達與胃癌和乳腺癌的淋巴結轉移呈正相關[24-25]。也有研究[26]表明Ki-67增殖指數與腫瘤大小、腫瘤細胞的分化程度以及腫瘤患者的預后相關,在臨床上具有一定的參考價值,被廣泛認為是最有前途的細胞增殖標志物。腫瘤的惡性程度主要和其分化程度及免疫組化指標相關。有研究[27]表明,PPMA的分化程度通常較好,故本研究主要采用Ki-67指數來判斷PPMA兩種類型的惡性程度。結果顯示兩組差異無統計學意義。根據多項研究提供的Ki-67指數的“金標準”,我們以14%為界,將患者分為高表達組和低表達組,結果發現腫塊型組與肺炎型組患者的Ki-67指數分布差異也無統計學意義,表明腫塊型與肺炎型在惡性程度上無顯著差異。
綜上所述,PPMA腫塊型與肺炎型患者在惡性程度上無明顯差異,結合其臨床表現及影像學特征差異,認為肺炎型是腫塊型在病程上進展的表現。PPMA好發于中老年女性,多發生于雙下肺,臨床表現以咳嗽、咳白色黏液樣痰為主。CT上可表現多樣,其中類反暈征有望成為重要的影像學特征,聯合實性成分占比高、胸膜凹陷征及空泡征等特征,能對PPMA的診斷起到重要的輔助作用。
利益沖突:無。
作者貢獻:馮義輝負責文章選題,資料和文獻查閱,文章撰寫與修改;朱曉雷、張瀟文、方韶韓、李寧負責文獻查找,文章撰寫與修改;耿國軍負責文章選題、修改和審定。