左心室輔助裝置(left ventricular assist device,LVAD)植入是針對終末期心力衰竭患者的重要治療手段,既可以幫助患者過渡到心臟移植階段,也可以作為目的治療直至其生命終末。近些年,第三代LVAD發展迅速,國內外陸續上市多個品牌,LVAD植入數量不斷增加,植入患者的長期生存率不斷提高,該設備展現出廣闊的發展前景。本文對LVAD的現狀、使用標準和注意事項、植入后常見并發癥進行概括,并對LVAD未來發展進行展望,期望對初次接觸該領域的研究者有一定幫助。
引用本文: 王沂, 李子軍, 易杰, 李豪, 陳明, 侯文明. 左心室輔助裝置的發展現狀及未來展望. 中國胸心血管外科臨床雜志, 2024, 31(11): 1670-1678. doi: 10.7507/1007-4848.202309038 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
目前,全球心力衰竭患者約有6 430萬人,我國心力衰竭患者約為890萬人[1],對于發展為終末期心力衰竭的患者,最有效的治療方法是心臟移植。但自心臟移植技術誕生至今,受限于供體稀缺以及移植配型等諸多原因,心臟移植不能滿足眾多心力衰竭患者的需要。因此,人們開始研究人工心臟技術,心室輔助裝置(ventricular assist device,VAD)應運而生。VAD可以用于過渡治療,維持患者的血流動力學穩定,等待心臟移植;也可作為老年患者的目的治療,直至其生命終末。VAD按照安裝部位不同可分為左心室輔助裝置(left ventricular assist device,LVAD)、右心室輔助裝置以及全心輔助裝置。其中,LVAD最多見。
1 左心室輔助裝置的發展
LVAD自誕生發展至今可概括為三代:脈動泵、軸流泵、離心泵。
1.1 脈動泵
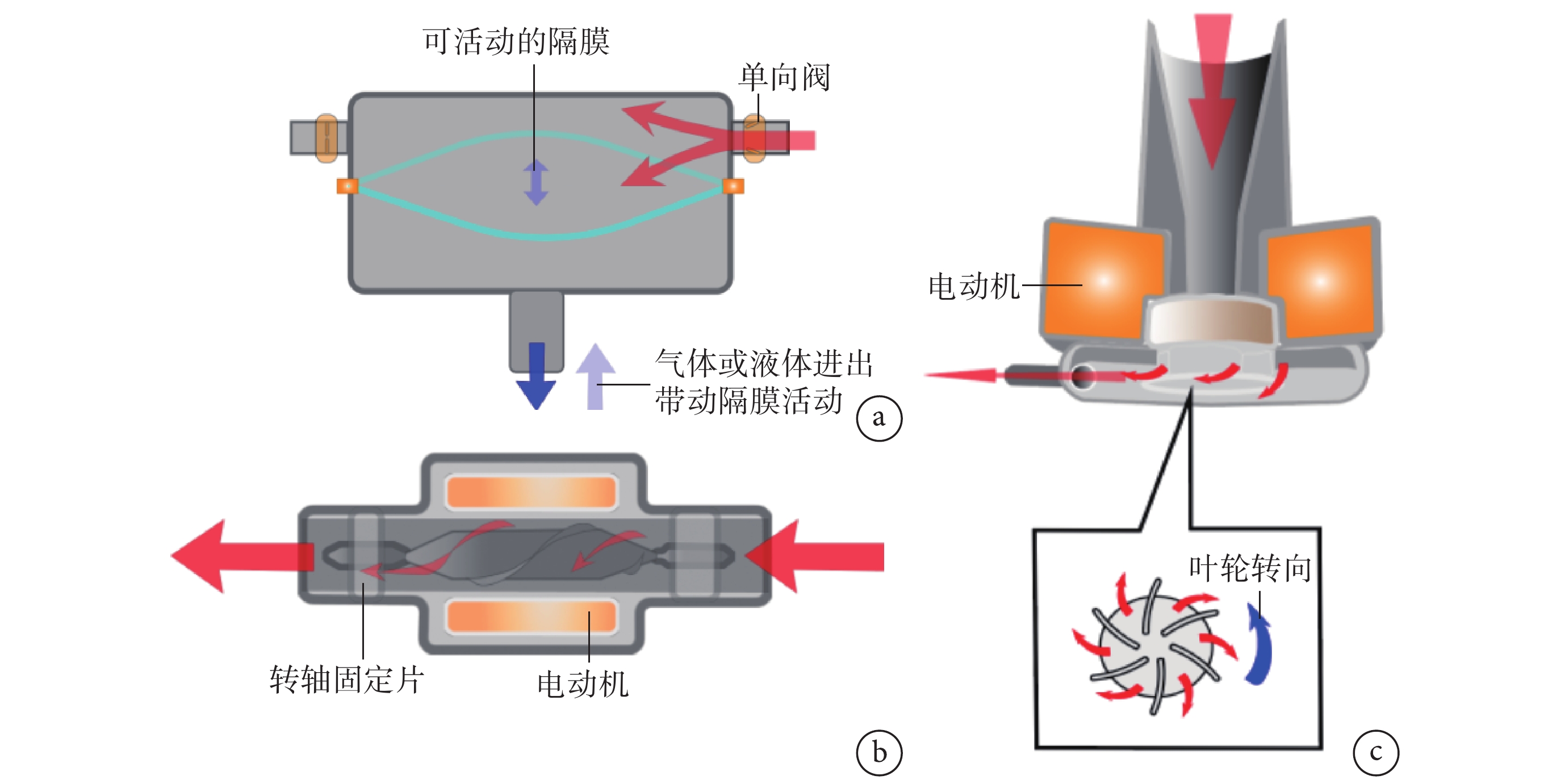
第一代LVAD脈動泵(如HeartMateXVE),以氣體或液體驅動,一般由單向瓣膜和能夠改變容積的中間空腔組成,該裝置工作時可以模擬心臟的舒縮活動,為仿生心泵(圖1a)。1966 年,DeBakey等在治療1例嚴重主動脈瓣關閉不全合并二尖瓣狹窄的女性患者時,使用一種滌綸增強硅橡膠制同步半球形氣泵,改善了心力衰竭導致的血流動力學狀況,首次成功使用LVAD[2]。脈動泵植入后1年生存率約是藥物治療的2倍(52% vs. 25%),2年生存率約為藥物治療的3倍(23% vs. 8%),通過應用LVAD的終末期心力衰竭患者長期生存率得到顯著改善,但LVAD植入后嚴重不良事件發生率是藥物治療的2倍以上(6.45% vs. 2.75%)[3-5]。脈動泵設備故障率高,約18~30個月后便會出現損壞,因此第一代LVAD并未廣泛使用,截至2005年僅應用337例[6]。第一代LVAD雖然并未廣泛應用于臨床,但其以機械裝置代替衰竭心臟工作的思路打開了一扇全新的大門。
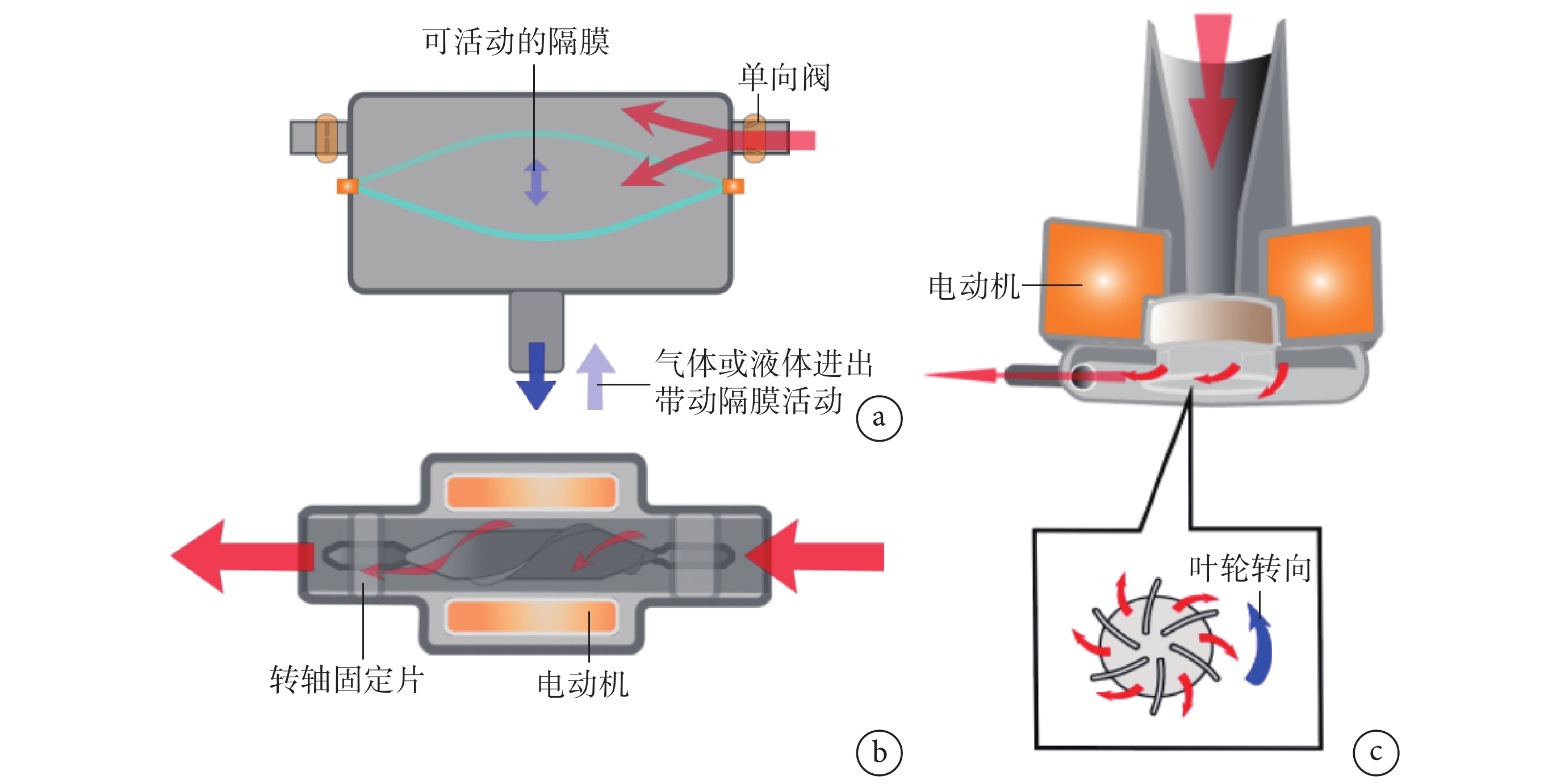 圖1
3種類型的左心室輔助裝置原理示意圖
圖1
3種類型的左心室輔助裝置原理示意圖
a:脈動泵;b:軸流泵;c:離心泵;紅色箭頭代表血流方向
1.2 軸流泵
第二代LVAD軸流泵(如HeartMateⅡ、Jarvik 2000、HeartAssist 5、Incor、Berlin Heart),其設計類似于機械水泵,葉輪轉軸與血流方向平行,利用葉輪旋轉形成持續血流(圖1b)。因此,軸流泵,包括離心泵,均被稱為連續血流左心室輔助裝置(continuous-flow left ventricular assist devices,CF-LVAD)。相對于脈動泵,軸流泵2年生存率為68%,5年生存率58%,且不良事件發生率和設備損壞更換率方面更低,再入院率較脈動泵下降38%[7-8],因而軸流泵在臨床應用上得到廣泛推廣。CF-LVAD患者的30 d、6個月生存率分別為94.2%、87.2%,在短期內使用LVAD能夠有效延長終末期心力衰竭患者生存期[9]。第二代LVAD在安全可靠性上有了明顯進步,截至2020年9月,HeartMateⅡ植入已超過27 000例,對全世界的心力衰竭患者做出巨大貢獻。但軸流泵為非仿生血泵,葉輪替代心臟舒縮活動進行持續血流輸送使患者脈搏減弱或消失。同時,軸流泵葉輪旋轉時氣蝕作用、機械損傷等原因,容易導致血栓形成[10]。血栓導致的栓塞或設備故障是軸流泵植入患者常見的并發癥。在對HeartMateⅡ植入患者的研究[11-12]發現,有11%的患者在平均(351±311)d后血栓形成,泵血栓形成是軸流泵設備故障的主要原因(50.5%)。泵血栓易形成的缺點不容忽視,因此研究者們思考如何減少泵血栓形成的重要因素—血細胞的機械性破環。
1.3 離心泵
第三代LVAD離心泵(如HeartWare HVAD、HeartMateⅢ),同脈動泵依靠葉輪驅動,包括磁懸浮、磁液懸浮、水懸浮等類型。葉輪與血泵無直接接觸,主動或被動地使葉輪懸浮于泵體中,葉輪旋轉時血液自葉輪與血泵之間的間隙流動(圖1c)。相對于軸流泵,離心泵葉輪無傳統的轉軸結構,同時效率更高,因而可以減慢葉輪轉速,減輕對血細胞的破環。部分品牌離心泵還能夠通過控制系統實現“脈搏”效果,進而起到沖刷作用。對比前兩代LVAD,離心泵顯著提高患者長期生存率。通過對HeartMateⅢ植入患者的研究[13-14]發現,6個月和2年生存率均>80%。離心泵作為第三代LVAD自其第一次批準應用于臨床至今不足10年,其技術是否長期可靠、能否長期改善患者生活工作等仍需要時間驗證。2017年,Rogers等[15]對HeartMateⅡ和HeartWare植入患者2年存活率研究發現,離心泵組卒中率是軸流泵的2倍以上(29.7% vs. 12.1%)。2021年6月,HeartWare母公司對該設備進行召回,原因在于設備出現啟動、重啟故障,以及過多的血細胞破環。對于LVAD植入患者,后期的隨訪和研究仍不可或缺。
2 左心室輔助裝置的使用標準及注意事項
盡管LVAD通常用于終末期心力衰竭患者,但國際上仍然沒有一個共同的心力衰竭標準或LVAD植入標準。根據《中國左心室輔助裝置候選者術前評估與管理專家共識(2023年)》[16],INTERMACS分級2~4級是LVAD植入的合適范圍,INTERMACS分級1級可進行LVAD植入,但術后死亡率較高,而INTERMACS分級5~7級在植入LVAD后與藥物治療相比并沒有顯著優勢,且有較高的再入院風險。值得注意的是,肺動脈高壓或近期罹患癌癥是移植的禁忌證,但卻不是 LVAD 治療的禁忌證,而復雜先天性心臟病、嚴重右心衰竭及部分急性肝損傷患者則不是 LVAD 的適應證,對于嚴重心源性休克患者,則不建議進行LVAD植入,術前心房顫動患者建議同期行左心耳切除術[16-17]。在進行LVAD植入前需要進行嚴密的術前評估,既包括心血管系統及血液系統,也包括呼吸系統、腎臟功能、肝臟功能等,若評估患者耐受力較差,則不建議進行LVAD植入[16]。LVAD的植入究竟是目的治療或過渡治療,沒有明確的界限,受限于患者病情變化及供體缺乏等原因,即使是以過渡治療作為目的,患者仍然有可能在較長的時間內接受LVAD,乃至生命終末。且近年統計數據顯示,將LVAD植入作為目的治療的比例在不斷上升[18-19]。
3 左心室輔助裝置植入后常見的并發癥
LVAD植入后并發癥常與設備存在聯系,可以將LVAD的并發癥分為LVAD特異性并發癥、LVAD相關性并發癥,以及非LVAD相關性并發癥。常見的LVAD特異性并發癥包括泵血栓形成、設備故障等;LVAD相關性并發癥包括感染、出血、腦卒中、高血壓、心律失常、右心衰竭等;非LVAD相關性并發癥包括非特異性感染等,與是否植入LVAD無顯著關聯性的術后并發癥。多種因素可以導致并發癥的發生,因此對并發癥的分類并不絕對。
3.1 左心室輔助裝置特異性并發癥
LVAD特異性并發癥主要是泵血栓形成,早期LVAD設備由于技術落后、護理條件差等原因,設備故障率和血栓形成率較高[6, 11],但隨著技術改進,設備故障已鮮有報道。對于LVAD植入患者,長期個體化使用華法林和阿司匹林是公認的抗凝方法。目前認為,將國際標準化比值(international normalized ratio,INR)控制在2.0~3.0是理想的范圍。然而,LVAD泵血栓形成是一個復雜的過程,為多因素作用的結果,很多指標僅作為推測性證據,如C反應蛋白、乳酸脫氫酶等[11, 20]。第三代LVAD設備問世后,設備血栓形成的風險明顯下降。有文獻[21]報道,1例HeartMateⅢ植入患者誤停用1個月華法林后無血栓形成表現,除INR為1.0外,各項指標良好。1例HeartMateⅢ植入患者僅使用阿司匹林抗凝,19個月后無血栓形成或栓塞證據[22]。更安全的設備、更合理的抗凝措施以及更具有特異性的檢測指標,LVAD特異性并發癥的發病率隨著設備發展而不斷降低。
3.2 左心室輔助裝置相關性并發癥
3.2.1 感染
感染是常見的并發癥,包括經皮部位、泵殼、流入道、流出道感染等,以經皮部位的傳動系統感染(driveline infection,DLI)最為多見。感染多以表層感染為起始,隨時間進展而逐漸蔓延至深層,在7.5個月后達到頂峰,感染率從每月2%進展到每月11%,在1年后逐漸下降并維持在2%水平[23]。感染部位分離得到的致病菌種類繁多,常見致病菌包括銅綠假單胞菌、金黃色葡萄球菌等,常見致病菌的感染率從20%~50%不等,可能與護理水平或地區差異有關,傳動系統安置部位與感染率無明顯關系,體重指數、年齡、傳動系統暴露程度的增加可以增加感染率,感染導致近40%的LVAD相關死亡[23-28]。若LVAD裝置持續存在,即使是進行加強護理,尚不能明確是否能降低感染率,根治左心衰竭及感染最好的方法是進行心臟移植,但感染也是心臟移植后6個月內死亡的主要原因[23-28]。
3.2.2 出血
LVAD植入后出血部位包括胃腸出血(45%)、傷口出血(12%)、鼻衄(4%)等,其中胃腸出血以上消化道出血最為多見(48%)。而引起出血最常見的原因有動靜脈畸形(36%)、血管發育不良(30%)以及胃炎(20%)等,這可能與脈搏減弱或胃腸缺血、缺氧有關,而導致出血的可能因素有很多,包括年齡、女性、缺血性病因及術前低血細胞比容等[29-32]。LVAD植入后出血與長期抗凝及獲得性血管性血友病也有一定關系,與之形成對照的是,在第一代LVAD脈動泵中,胃腸出血非常罕見,在第二代或三代LVAD移除后,血管性血友病因子水平及活性可恢復至正常水平[30]。雖然出血屬于LVAD植入后常見并發癥,但與腦卒中等并發癥相比,其預后較好,繼發于胃腸出血的死亡率僅4%[32]。但一旦發生急性胃腸出血,患者必須立即停止抗凝和抗血小板治療,在那些INR升高且有臨床意義的患者中,應嘗試逆轉抗凝治療,治療方法包括藥物治療和內鏡治療等[31]。中止抗凝是否會導致LVAD血栓形成相關報道較少。用于治療胃腸出血的藥物種類繁多,包括奧曲肽、生長抑素、沙利度胺、血管性血友病因子等,通常建議所有患者進行內鏡檢查,必要時可以進行血管造影等,需要注意的是,使用藥物造成的副作用并不罕見[31, 33-35]。
3.2.3 腦卒中
腦卒中是非常嚴重的并發癥,即使是第三代LVAD HeartMateⅢ在植入后1年腦卒中率仍然接近10%,腦卒中是LVAD支持下6~24個月死亡的主要原因,可分為缺血性和出血性腦卒中,兩者發生率大致相等(51% vs. 49%)[36]。女性和年齡<65歲是出血性卒中的風險因素,而女性和糖尿病史是缺血性卒中的風險因素,其他因素,如吸煙、菌血癥、泵血栓形成、高血壓等均可導致卒中[29, 37]。腦卒中患者死亡風險呈雙峰分布,植入時風險最高,9~12個月后風險再次上升,無卒中患者的死亡風險隨時間推移而逐漸下降[37]。同時,不同設備的卒中風險也不一樣,HeartMateⅢ在卒中風險上明顯低于HeartWare,但一旦發生卒中,HeartMateⅢ與HeartWare相比,其致殘和死亡風險明顯較高[38]。值得注意的是,缺血性卒中主要為心源性栓塞(92%),常引起輕度或中度嚴重程度的臨床癥狀,對于急性缺血性卒中通常禁用溶栓療法,但血管內治療(機械取栓)是一種可行的方法,由于擔心LVAD血栓形成,通常在缺血性卒中急性期繼續抗凝治療,中斷抗凝治療可能導致出血性轉化,缺血性卒中患者在3個月后,大部分(61%)達到了可接受的治療結果[39]。出血性卒中患者在卒中發生前多有相關性疾病,即使在卒中發生后緊急逆轉抗凝治療,仍有較高的死亡可能[39]。相關研究[40-42]發現,通過調整流出道吻合口角度和位置(較淺入射角和較淺流入道插管深度),或許能夠減少腦卒中的發生。通常,急性缺血性腦卒中需要在6 h內溶栓治療,但目前對于較長時間缺血引起的神經細胞缺血或壞死尚無有效的治療方法,在1990—2018年間2 489種神經保護藥物,僅10種進入臨床Ⅲ期,后均宣告失敗。因此,對于LVAD植入患者應盡早識別腦卒中風險,避免卒中的發生。
3.2.4 心律失常
LVAD植入后心律失常包括房性心律失常和室性心律失常,發生率為20%~50%,在LVAD植入前已有房性或室性心律失常的患者在術后有著更高的發病率或新發病率,這可能是由于 LVAD 植入后原有的異常心肌基質和復雜的電重塑共同作用的結果[43]。血泵抽吸作用也可以因心室變形以及室間隔偏移導致心律失常,但可通過調整血泵流量而改善[43]。心律失常多發生在術后早期,并在數周或數月后減少,盡管患者可有心悸、虛弱表現,但暈厥或心源性猝死極少,無論是房性或室性心律失常與術后死亡率之間沒有明確的關系,植入式電除顫儀或許有助于改善患者生活質量,但其植入時間的差異對死亡率似乎并沒有明顯的影響[43-44]。
3.2.5 右心衰竭
多數左心衰竭患者在LVAD植入前就有一定程度上的肺動脈高壓和右心室功能障礙,右心衰竭是多因素作用的結果,包括前后負荷變化、潛在的心肌病變等[45]。右心衰竭常伴隨多種并發癥,依據判定標準的不同,其發生率為9%~42%,且一旦發生雙心衰竭,其1年生存率<50%[45]。研究[46-47]指出,中心靜脈壓、肺動脈搏動指數、超聲心動圖、三尖瓣環平面收縮期偏移等指標均可能是右心衰竭的預測性指標。需要注意的是,右心衰竭風險評分(RVFRS)已經被證明是評估LVAD植入后右心衰竭的預測指標,該指標包括需要使用血管加壓器(4 分)、天門冬氨酸氨基轉移酶≥80 IU/L(2 分)、膽紅素≥2.0 mg/dL(2.5 分)、肌酐≥2.3 mg/dL(3 分),評分越高說明越有可能發生右心衰竭[48]。右心衰竭的發生機制尚不明確,可能包括二尖瓣或三尖瓣關閉不全、術中和術后并發癥導致的右心室缺血或栓塞、左心室收縮力下降使得右心室協同收縮力不足、原本存在的肺動脈高壓繼續加重引起右心室后負荷進一步增加、心輸出量增加使回心血流增加引起原有的右心功能不全惡化、圍術期輸液或腎功能障礙導致的容量管理失衡等,由于植入VAD動物模型的缺乏,對于LVAD植入后右心衰竭的發生機制尚未完全闡明[48-50]。值得注意的是,術前使用磷酸二酯酶-5抑制劑可能導致更高的右心衰竭發生率[51]。通過改進手術方法,如微創LVAD植入、LVAD植入聯合三尖瓣修復術等手段可能降低術后右心衰竭風險,至少能夠縮短手術時間及住院時間,促進患者術后康復[48, 52-53]。
3.2.6 高血壓
CF-LVAD植入患者脈搏通常會減弱或消失,因此LVAD植入患者的血壓一般采用多普勒測量的平均動脈壓(mean arterial pressure,MAP),MAP控制目標一般為80 mm Hg(1 mm Hg=0.133 kPa),當MAP>90 mm Hg即定義為高血壓[30, 54]。血壓控制不良、脈壓過小可導致或加劇主動脈瓣關閉不全,因此建議將脈壓控制>15 mm Hg[54-55]。一般使用1~2種血壓控制藥物即可將血壓控制在理想范圍,如β受體阻滯劑、血管緊張素轉換酶抑制劑(ACEI)或血管緊張素受體阻滯劑(ARB)等[54]。
LVAD植入后并發癥之間存在緊密聯系,如累及循環的感染可增加卒中風險,極少/完全無脈搏血流可能會通過反饋調節引起高血壓,高血壓可促使泵血栓形成,血栓形成后出血風險可增加2倍,出血后血栓栓塞風險大幅度升高等,但各并發癥之間的相互作用機制尚不明確[36]。對于LVAD植入后并發癥,應當盡量避免其發生,因此需要進一步探明并發癥的發生機制,對設備進行改進,早期發現可疑指標,完善術前評估,這些依賴于技術水平的進步。
4 國內外左心室輔助裝置的現狀
4.1 國外左心室輔助裝置的現狀
截至2023年,LVAD自其首次成功應用于臨床已有60年。自2014年第三代LVAD HeartWare HVAD獲批上市后,離心泵逐漸占據市場份額,以HeartMateⅡ為代表的第二代LVAD逐漸退出市場,僅部分國家或地區使用。國外LVAD市場主要由雅培(Abbott)、美敦力、Abiomed 3家公司占據,其中雅培(Abbott)公司旗下的HeartMateⅢ占據最主要地位。
美敦力公司旗下的HeartWare為代表性的液力懸浮泵,利用血液流動進行被動懸浮,具有發熱較低、不需要電子傳感器、技術難度小等優點,但葉輪與泵體間隙較小,對血細胞的損傷較大。2021年6月3日,HeartWare因設備故障和血栓形成等負面影響而退市。
雅培(Abbott)公司旗下的HeartMateⅢ為全磁懸浮離心泵,利用磁力支撐進行主動懸浮,目前為全球LVAD植入的主流產品,也是目前植入數量最多、長期反饋數據最多的第三代LVAD。2014年6月25日完成首例臨床植入,自2017年后迅速擠占市場,2019年植入LVAD中77.7%為全磁懸浮離心泵,HeartWare 和軸流泵僅占20.5%和1.8%,2年后,選擇全磁懸浮設備的比例增加至92.7%[18-19]。在2023年,這一比例增加至99.8%[56]。HeartMateⅢ葉輪側面間隙0.5 mm,上下間隙1 mm,是同類產品的10~20倍,有利于減少剪切力,減輕血細胞損傷[57]。統計數據表明,HeartMateⅢ植入患者5年生存率58.4%,且卒中、大出血等嚴重并發癥的發生率均低于軸流泵[58-59]。
Abiomed公司旗下的Impella是唯一獲得美國食品藥品監督管理局(FAD)認證的經皮介入式VAD,也是世界上最小的心泵。2012年,Impella CP獲批上市,后續又推出Impella 2.5、Impella 5.0、Impella 5.5、Impella LD等型號。主要用于嚴重心源性休克、高風險經皮冠狀動脈介入治療以及緊急授權后用于體外膜肺氧合支持下出現的肺水腫、心力衰竭患者5 d內的治療,替代心臟進行短期、緊急供血,為心臟手術和恢復爭取時間。在心源性休克患者中使用Impella能夠促使心肌恢復,改善患者預后[60-61]。
根據美國胸外科醫師協會(Society of Thoracic Surgeons,STS)年度報告, 2019年為LVAD植入數量高峰,達3 198例,其中73%的患者將植入作為目的治療。在2021年,81.1%的患者將植入作為目的治療,1年和5年生存率分別為83.0%和51.9%[18-19]。而在2023年,1年和5年生存率增加至86%和64%[56]。統計數據表明,將LVAD植入作為目的治療已經是相對成熟的技術。
4.2 國內左心室輔助裝置的發展
國內LVAD發展較晚,跳過了第一代和第二代的研發,因此國內上市的LVAD均為第三代設備。國產LVAD針對國人體質狀況進行研發,目前正處于起步發展階段,截至2023年3月,僅363例應用[62]。研究[62]發現,國產LVAD的1年、2年和3年生存率分別為94.7%、92.0%、 90.7%,已經與國內的心臟移植效果相當。目前,獲批上市的國產LVAD有重慶永仁心(EVAHEART)、蘇州同心(CH-VAD)、航天泰心(Heartcon)以及深圳核心(Corheart 6)。
重慶永仁心(EVAHEART):2017年7月首次動物實驗,2018年1月完成首例臨床植入,2019年8月26日獲批上市,是我國首個上市的心室輔助產品。該設備引進了日本技術,采用液力懸浮,適用于短期治療,也是唯一獲批的國產目的治療LVAD。該泵植入后患者仍可保留脈搏,有利于心功能的保留或恢復。葉輪轉速較慢,約1 600~2 200 r/min,目的在于減少剪切力,從而減少血管性血友病因子降解[63]。采用無尖插入插管,有利于血流沖刷,減少血液淤滯,降低血栓形成風險[42]。Zayat等[64]通過模擬循環對比EVAHEART和HeartMateⅢ凝血狀況,EVAHEART溶血及凝血激活均較少。
蘇州同心(CH-VAD):2014年12月首次動物實驗,2017年6月完成首例臨床植入,2021年11月24日獲批上市,是國內首個擁有完備知識產權的國產人工心臟。采用磁懸浮技術,心包腔內植入,適用于短期治療。與重慶永仁心(EVAHEART)相比,蘇州同心(CH-VAD)的離心泵葉輪和轉子處于同一平面,因而明顯減少了泵體厚度,縮減血泵重量。CH-VAD在正常條件下剪切力>100 pa的時間占0.4%,相對于HeartWare具有低2倍的溶血指數,在血小板激活和血栓形成風險上也較HeartWare低[65-66]。
航天泰心(Heartcon):2013年3月首次動物實驗,2019年3月首次臨床應用,2022年7月13日上市,是國內首個采用磁液懸浮技術的植入式磁液懸浮LVAD,適用于短期治療。對于目前的Heartcon植入患者,其短期治療效果積極,但長期療效仍需要進一步研究[67-68]。
深圳核心(Corheart 6):2020年首次動物實驗,2021年10月首次臨床植入,2023年6月6日上市,是國內首個應用于兒童的心室輔助產品。該泵采用磁懸浮技術,適用于短期治療。葉輪扁平化設計,無分流鼻錐,進一步減少空間占用,該泵重量僅90 g,是目前全球重量最輕、體積最小的LVAD。在動物實驗中,該泵表現出良好的血液相容性,在對患者的早期治療上也獲得滿意的效果[68-69]。
5 小結和展望
LVAD是支持終末期心力衰竭患者過渡到心臟移植的重要手段,也是許多老年患者的目的治療。即使是不進行心臟移植,部分LVAD植入患者仍然能夠生存10年以上。LVAD植入后并發癥與設備本身存在直接或間接的聯系,作為人工制品植入的缺陷,制品老化、設備損壞、人體排異、血栓形成、不能夠完全替代正常人體功能等問題持久存在。因此,對于未來LVAD的發展可以從以下幾個方面進行。
5.1 完全植入
無線充電技術的發展使完全植入設備無法進行電池更換的問題理論上得到解決。目前最輕最小的LVAD重量僅90 g,隨著新技術的發展能夠推進設備進一步小型化,實現LVAD的完全植入,從而避免線纜感染等問題,改善患者生存質量[70]。關于完全植入的研究是LVAD發展的熱門方向,但設備小型化意味著葉輪轉速必須進一步提高才能滿足泵血需要,這或許會增加對血細胞的破壞。同時,完全植入后對設備的維護難度也將增加,無線傳輸發熱等問題仍有待解決[71]。不過,已有研究者[70, 72]取得了一定成果,如體外磁體驅動LVAD、針對植入設備的新型脈沖無線輸電等。
5.2 減少血栓形成
患者植入LVAD后血栓形成是多因素作用的結果,包括機械性和非機械性因素,栓子脫落引起的栓塞也是患者死亡或再入院的常見原因,使用無免疫原性材料或生物兼容性材料,減輕葉輪對血細胞的破環,個體化使用華法林等抗凝藥物,加強對LVAD植入患者的血液敏感指標監測等措施,能夠預防或早期發現血栓形成[20, 73]。近些年第三代LVAD設備配合抗凝措施能夠明顯減少血栓的形成,但與正常人相比,植入后腦卒中等嚴重并發癥的發生率仍然較高。
5.3 微創手術
微創LVAD植入手術是否能夠讓患者明顯受益的研究較少,但微創手術可降低大出血、嚴重右心衰竭、呼吸衰竭和使用血制品的風險,縮短機械通氣時間和住院時間[74]。即使是INTERMACS分級1級的心源性休克患者,在應用微創手術后仍然可能降低術后死亡率[75-76]。
5.4 磁流體血泵
葉輪對血細胞的機械性破環是泵血栓形成的重要原因,從軸流泵到離心泵的改進目的之一便是減少機械性損傷。磁流體泵是利用血液與海水相似的導電能力,當血液在磁場中時產生感應電流與洛倫茲力,進而推動血液流動。血液動力的產生無類似于仿生泵的擠壓作用,也無非仿生泵的葉輪破壞作用,進而減少血栓形成的風險[77]。磁流體血泵雖然去除了葉輪結構,但相關研究較少,血細胞在磁場中長期穿行是否會受到影響仍未知。
《中國心血管健康與疾病報告2022》[78]指出,2021年全國僅738例心臟移植,仍有大量患者最終因心力衰竭而死亡。通過推進LVAD在國內應用有希望解決這一問題,LVAD作為人工制品相對于心臟移植有著諸多優點。首先,LVAD作為一種機械裝置,能夠通過技術的熟練和改進獲取更低廉的價格和更高的質量、產量。其次,LVAD的獲取沒有倫理學上的負擔,不受移植供體來源的影響,也不存在供受體之間的配型等問題。然后,作為患者最關心的術后生存率問題,依據STS統計數據,LVAD植入后能夠獲取較長的生存時間和較好的生活質量,國內LVAD植入后生存率已經和心臟移植水平相當[18-19, 56, 62]。最后,已有4款國產LVAD獲批上市,尚有其他LVAD正在研發中,如心擎醫療的MoyoAssist? Extra-VAD[79-80]。國產LVAD發展迅速,盡管目前LVAD植入價格不菲,但為大量心力衰竭患者帶來了生存的希望。隨著國產LVAD技術水平的進步和成本的下降,LVAD能夠更廣泛地幫助心力衰竭患者。
利益沖突:無。
作者貢獻:王沂、李子軍負責文章撰寫;易杰、李豪、陳明負責文獻查閱;侯文明負責文章設計及審閱。
目前,全球心力衰竭患者約有6 430萬人,我國心力衰竭患者約為890萬人[1],對于發展為終末期心力衰竭的患者,最有效的治療方法是心臟移植。但自心臟移植技術誕生至今,受限于供體稀缺以及移植配型等諸多原因,心臟移植不能滿足眾多心力衰竭患者的需要。因此,人們開始研究人工心臟技術,心室輔助裝置(ventricular assist device,VAD)應運而生。VAD可以用于過渡治療,維持患者的血流動力學穩定,等待心臟移植;也可作為老年患者的目的治療,直至其生命終末。VAD按照安裝部位不同可分為左心室輔助裝置(left ventricular assist device,LVAD)、右心室輔助裝置以及全心輔助裝置。其中,LVAD最多見。
1 左心室輔助裝置的發展
LVAD自誕生發展至今可概括為三代:脈動泵、軸流泵、離心泵。
1.1 脈動泵
第一代LVAD脈動泵(如HeartMateXVE),以氣體或液體驅動,一般由單向瓣膜和能夠改變容積的中間空腔組成,該裝置工作時可以模擬心臟的舒縮活動,為仿生心泵(圖1a)。1966 年,DeBakey等在治療1例嚴重主動脈瓣關閉不全合并二尖瓣狹窄的女性患者時,使用一種滌綸增強硅橡膠制同步半球形氣泵,改善了心力衰竭導致的血流動力學狀況,首次成功使用LVAD[2]。脈動泵植入后1年生存率約是藥物治療的2倍(52% vs. 25%),2年生存率約為藥物治療的3倍(23% vs. 8%),通過應用LVAD的終末期心力衰竭患者長期生存率得到顯著改善,但LVAD植入后嚴重不良事件發生率是藥物治療的2倍以上(6.45% vs. 2.75%)[3-5]。脈動泵設備故障率高,約18~30個月后便會出現損壞,因此第一代LVAD并未廣泛使用,截至2005年僅應用337例[6]。第一代LVAD雖然并未廣泛應用于臨床,但其以機械裝置代替衰竭心臟工作的思路打開了一扇全新的大門。
 圖1
3種類型的左心室輔助裝置原理示意圖
圖1
3種類型的左心室輔助裝置原理示意圖
a:脈動泵;b:軸流泵;c:離心泵;紅色箭頭代表血流方向
1.2 軸流泵
第二代LVAD軸流泵(如HeartMateⅡ、Jarvik 2000、HeartAssist 5、Incor、Berlin Heart),其設計類似于機械水泵,葉輪轉軸與血流方向平行,利用葉輪旋轉形成持續血流(圖1b)。因此,軸流泵,包括離心泵,均被稱為連續血流左心室輔助裝置(continuous-flow left ventricular assist devices,CF-LVAD)。相對于脈動泵,軸流泵2年生存率為68%,5年生存率58%,且不良事件發生率和設備損壞更換率方面更低,再入院率較脈動泵下降38%[7-8],因而軸流泵在臨床應用上得到廣泛推廣。CF-LVAD患者的30 d、6個月生存率分別為94.2%、87.2%,在短期內使用LVAD能夠有效延長終末期心力衰竭患者生存期[9]。第二代LVAD在安全可靠性上有了明顯進步,截至2020年9月,HeartMateⅡ植入已超過27 000例,對全世界的心力衰竭患者做出巨大貢獻。但軸流泵為非仿生血泵,葉輪替代心臟舒縮活動進行持續血流輸送使患者脈搏減弱或消失。同時,軸流泵葉輪旋轉時氣蝕作用、機械損傷等原因,容易導致血栓形成[10]。血栓導致的栓塞或設備故障是軸流泵植入患者常見的并發癥。在對HeartMateⅡ植入患者的研究[11-12]發現,有11%的患者在平均(351±311)d后血栓形成,泵血栓形成是軸流泵設備故障的主要原因(50.5%)。泵血栓易形成的缺點不容忽視,因此研究者們思考如何減少泵血栓形成的重要因素—血細胞的機械性破環。
1.3 離心泵
第三代LVAD離心泵(如HeartWare HVAD、HeartMateⅢ),同脈動泵依靠葉輪驅動,包括磁懸浮、磁液懸浮、水懸浮等類型。葉輪與血泵無直接接觸,主動或被動地使葉輪懸浮于泵體中,葉輪旋轉時血液自葉輪與血泵之間的間隙流動(圖1c)。相對于軸流泵,離心泵葉輪無傳統的轉軸結構,同時效率更高,因而可以減慢葉輪轉速,減輕對血細胞的破環。部分品牌離心泵還能夠通過控制系統實現“脈搏”效果,進而起到沖刷作用。對比前兩代LVAD,離心泵顯著提高患者長期生存率。通過對HeartMateⅢ植入患者的研究[13-14]發現,6個月和2年生存率均>80%。離心泵作為第三代LVAD自其第一次批準應用于臨床至今不足10年,其技術是否長期可靠、能否長期改善患者生活工作等仍需要時間驗證。2017年,Rogers等[15]對HeartMateⅡ和HeartWare植入患者2年存活率研究發現,離心泵組卒中率是軸流泵的2倍以上(29.7% vs. 12.1%)。2021年6月,HeartWare母公司對該設備進行召回,原因在于設備出現啟動、重啟故障,以及過多的血細胞破環。對于LVAD植入患者,后期的隨訪和研究仍不可或缺。
2 左心室輔助裝置的使用標準及注意事項
盡管LVAD通常用于終末期心力衰竭患者,但國際上仍然沒有一個共同的心力衰竭標準或LVAD植入標準。根據《中國左心室輔助裝置候選者術前評估與管理專家共識(2023年)》[16],INTERMACS分級2~4級是LVAD植入的合適范圍,INTERMACS分級1級可進行LVAD植入,但術后死亡率較高,而INTERMACS分級5~7級在植入LVAD后與藥物治療相比并沒有顯著優勢,且有較高的再入院風險。值得注意的是,肺動脈高壓或近期罹患癌癥是移植的禁忌證,但卻不是 LVAD 治療的禁忌證,而復雜先天性心臟病、嚴重右心衰竭及部分急性肝損傷患者則不是 LVAD 的適應證,對于嚴重心源性休克患者,則不建議進行LVAD植入,術前心房顫動患者建議同期行左心耳切除術[16-17]。在進行LVAD植入前需要進行嚴密的術前評估,既包括心血管系統及血液系統,也包括呼吸系統、腎臟功能、肝臟功能等,若評估患者耐受力較差,則不建議進行LVAD植入[16]。LVAD的植入究竟是目的治療或過渡治療,沒有明確的界限,受限于患者病情變化及供體缺乏等原因,即使是以過渡治療作為目的,患者仍然有可能在較長的時間內接受LVAD,乃至生命終末。且近年統計數據顯示,將LVAD植入作為目的治療的比例在不斷上升[18-19]。
3 左心室輔助裝置植入后常見的并發癥
LVAD植入后并發癥常與設備存在聯系,可以將LVAD的并發癥分為LVAD特異性并發癥、LVAD相關性并發癥,以及非LVAD相關性并發癥。常見的LVAD特異性并發癥包括泵血栓形成、設備故障等;LVAD相關性并發癥包括感染、出血、腦卒中、高血壓、心律失常、右心衰竭等;非LVAD相關性并發癥包括非特異性感染等,與是否植入LVAD無顯著關聯性的術后并發癥。多種因素可以導致并發癥的發生,因此對并發癥的分類并不絕對。
3.1 左心室輔助裝置特異性并發癥
LVAD特異性并發癥主要是泵血栓形成,早期LVAD設備由于技術落后、護理條件差等原因,設備故障率和血栓形成率較高[6, 11],但隨著技術改進,設備故障已鮮有報道。對于LVAD植入患者,長期個體化使用華法林和阿司匹林是公認的抗凝方法。目前認為,將國際標準化比值(international normalized ratio,INR)控制在2.0~3.0是理想的范圍。然而,LVAD泵血栓形成是一個復雜的過程,為多因素作用的結果,很多指標僅作為推測性證據,如C反應蛋白、乳酸脫氫酶等[11, 20]。第三代LVAD設備問世后,設備血栓形成的風險明顯下降。有文獻[21]報道,1例HeartMateⅢ植入患者誤停用1個月華法林后無血栓形成表現,除INR為1.0外,各項指標良好。1例HeartMateⅢ植入患者僅使用阿司匹林抗凝,19個月后無血栓形成或栓塞證據[22]。更安全的設備、更合理的抗凝措施以及更具有特異性的檢測指標,LVAD特異性并發癥的發病率隨著設備發展而不斷降低。
3.2 左心室輔助裝置相關性并發癥
3.2.1 感染
感染是常見的并發癥,包括經皮部位、泵殼、流入道、流出道感染等,以經皮部位的傳動系統感染(driveline infection,DLI)最為多見。感染多以表層感染為起始,隨時間進展而逐漸蔓延至深層,在7.5個月后達到頂峰,感染率從每月2%進展到每月11%,在1年后逐漸下降并維持在2%水平[23]。感染部位分離得到的致病菌種類繁多,常見致病菌包括銅綠假單胞菌、金黃色葡萄球菌等,常見致病菌的感染率從20%~50%不等,可能與護理水平或地區差異有關,傳動系統安置部位與感染率無明顯關系,體重指數、年齡、傳動系統暴露程度的增加可以增加感染率,感染導致近40%的LVAD相關死亡[23-28]。若LVAD裝置持續存在,即使是進行加強護理,尚不能明確是否能降低感染率,根治左心衰竭及感染最好的方法是進行心臟移植,但感染也是心臟移植后6個月內死亡的主要原因[23-28]。
3.2.2 出血
LVAD植入后出血部位包括胃腸出血(45%)、傷口出血(12%)、鼻衄(4%)等,其中胃腸出血以上消化道出血最為多見(48%)。而引起出血最常見的原因有動靜脈畸形(36%)、血管發育不良(30%)以及胃炎(20%)等,這可能與脈搏減弱或胃腸缺血、缺氧有關,而導致出血的可能因素有很多,包括年齡、女性、缺血性病因及術前低血細胞比容等[29-32]。LVAD植入后出血與長期抗凝及獲得性血管性血友病也有一定關系,與之形成對照的是,在第一代LVAD脈動泵中,胃腸出血非常罕見,在第二代或三代LVAD移除后,血管性血友病因子水平及活性可恢復至正常水平[30]。雖然出血屬于LVAD植入后常見并發癥,但與腦卒中等并發癥相比,其預后較好,繼發于胃腸出血的死亡率僅4%[32]。但一旦發生急性胃腸出血,患者必須立即停止抗凝和抗血小板治療,在那些INR升高且有臨床意義的患者中,應嘗試逆轉抗凝治療,治療方法包括藥物治療和內鏡治療等[31]。中止抗凝是否會導致LVAD血栓形成相關報道較少。用于治療胃腸出血的藥物種類繁多,包括奧曲肽、生長抑素、沙利度胺、血管性血友病因子等,通常建議所有患者進行內鏡檢查,必要時可以進行血管造影等,需要注意的是,使用藥物造成的副作用并不罕見[31, 33-35]。
3.2.3 腦卒中
腦卒中是非常嚴重的并發癥,即使是第三代LVAD HeartMateⅢ在植入后1年腦卒中率仍然接近10%,腦卒中是LVAD支持下6~24個月死亡的主要原因,可分為缺血性和出血性腦卒中,兩者發生率大致相等(51% vs. 49%)[36]。女性和年齡<65歲是出血性卒中的風險因素,而女性和糖尿病史是缺血性卒中的風險因素,其他因素,如吸煙、菌血癥、泵血栓形成、高血壓等均可導致卒中[29, 37]。腦卒中患者死亡風險呈雙峰分布,植入時風險最高,9~12個月后風險再次上升,無卒中患者的死亡風險隨時間推移而逐漸下降[37]。同時,不同設備的卒中風險也不一樣,HeartMateⅢ在卒中風險上明顯低于HeartWare,但一旦發生卒中,HeartMateⅢ與HeartWare相比,其致殘和死亡風險明顯較高[38]。值得注意的是,缺血性卒中主要為心源性栓塞(92%),常引起輕度或中度嚴重程度的臨床癥狀,對于急性缺血性卒中通常禁用溶栓療法,但血管內治療(機械取栓)是一種可行的方法,由于擔心LVAD血栓形成,通常在缺血性卒中急性期繼續抗凝治療,中斷抗凝治療可能導致出血性轉化,缺血性卒中患者在3個月后,大部分(61%)達到了可接受的治療結果[39]。出血性卒中患者在卒中發生前多有相關性疾病,即使在卒中發生后緊急逆轉抗凝治療,仍有較高的死亡可能[39]。相關研究[40-42]發現,通過調整流出道吻合口角度和位置(較淺入射角和較淺流入道插管深度),或許能夠減少腦卒中的發生。通常,急性缺血性腦卒中需要在6 h內溶栓治療,但目前對于較長時間缺血引起的神經細胞缺血或壞死尚無有效的治療方法,在1990—2018年間2 489種神經保護藥物,僅10種進入臨床Ⅲ期,后均宣告失敗。因此,對于LVAD植入患者應盡早識別腦卒中風險,避免卒中的發生。
3.2.4 心律失常
LVAD植入后心律失常包括房性心律失常和室性心律失常,發生率為20%~50%,在LVAD植入前已有房性或室性心律失常的患者在術后有著更高的發病率或新發病率,這可能是由于 LVAD 植入后原有的異常心肌基質和復雜的電重塑共同作用的結果[43]。血泵抽吸作用也可以因心室變形以及室間隔偏移導致心律失常,但可通過調整血泵流量而改善[43]。心律失常多發生在術后早期,并在數周或數月后減少,盡管患者可有心悸、虛弱表現,但暈厥或心源性猝死極少,無論是房性或室性心律失常與術后死亡率之間沒有明確的關系,植入式電除顫儀或許有助于改善患者生活質量,但其植入時間的差異對死亡率似乎并沒有明顯的影響[43-44]。
3.2.5 右心衰竭
多數左心衰竭患者在LVAD植入前就有一定程度上的肺動脈高壓和右心室功能障礙,右心衰竭是多因素作用的結果,包括前后負荷變化、潛在的心肌病變等[45]。右心衰竭常伴隨多種并發癥,依據判定標準的不同,其發生率為9%~42%,且一旦發生雙心衰竭,其1年生存率<50%[45]。研究[46-47]指出,中心靜脈壓、肺動脈搏動指數、超聲心動圖、三尖瓣環平面收縮期偏移等指標均可能是右心衰竭的預測性指標。需要注意的是,右心衰竭風險評分(RVFRS)已經被證明是評估LVAD植入后右心衰竭的預測指標,該指標包括需要使用血管加壓器(4 分)、天門冬氨酸氨基轉移酶≥80 IU/L(2 分)、膽紅素≥2.0 mg/dL(2.5 分)、肌酐≥2.3 mg/dL(3 分),評分越高說明越有可能發生右心衰竭[48]。右心衰竭的發生機制尚不明確,可能包括二尖瓣或三尖瓣關閉不全、術中和術后并發癥導致的右心室缺血或栓塞、左心室收縮力下降使得右心室協同收縮力不足、原本存在的肺動脈高壓繼續加重引起右心室后負荷進一步增加、心輸出量增加使回心血流增加引起原有的右心功能不全惡化、圍術期輸液或腎功能障礙導致的容量管理失衡等,由于植入VAD動物模型的缺乏,對于LVAD植入后右心衰竭的發生機制尚未完全闡明[48-50]。值得注意的是,術前使用磷酸二酯酶-5抑制劑可能導致更高的右心衰竭發生率[51]。通過改進手術方法,如微創LVAD植入、LVAD植入聯合三尖瓣修復術等手段可能降低術后右心衰竭風險,至少能夠縮短手術時間及住院時間,促進患者術后康復[48, 52-53]。
3.2.6 高血壓
CF-LVAD植入患者脈搏通常會減弱或消失,因此LVAD植入患者的血壓一般采用多普勒測量的平均動脈壓(mean arterial pressure,MAP),MAP控制目標一般為80 mm Hg(1 mm Hg=0.133 kPa),當MAP>90 mm Hg即定義為高血壓[30, 54]。血壓控制不良、脈壓過小可導致或加劇主動脈瓣關閉不全,因此建議將脈壓控制>15 mm Hg[54-55]。一般使用1~2種血壓控制藥物即可將血壓控制在理想范圍,如β受體阻滯劑、血管緊張素轉換酶抑制劑(ACEI)或血管緊張素受體阻滯劑(ARB)等[54]。
LVAD植入后并發癥之間存在緊密聯系,如累及循環的感染可增加卒中風險,極少/完全無脈搏血流可能會通過反饋調節引起高血壓,高血壓可促使泵血栓形成,血栓形成后出血風險可增加2倍,出血后血栓栓塞風險大幅度升高等,但各并發癥之間的相互作用機制尚不明確[36]。對于LVAD植入后并發癥,應當盡量避免其發生,因此需要進一步探明并發癥的發生機制,對設備進行改進,早期發現可疑指標,完善術前評估,這些依賴于技術水平的進步。
4 國內外左心室輔助裝置的現狀
4.1 國外左心室輔助裝置的現狀
截至2023年,LVAD自其首次成功應用于臨床已有60年。自2014年第三代LVAD HeartWare HVAD獲批上市后,離心泵逐漸占據市場份額,以HeartMateⅡ為代表的第二代LVAD逐漸退出市場,僅部分國家或地區使用。國外LVAD市場主要由雅培(Abbott)、美敦力、Abiomed 3家公司占據,其中雅培(Abbott)公司旗下的HeartMateⅢ占據最主要地位。
美敦力公司旗下的HeartWare為代表性的液力懸浮泵,利用血液流動進行被動懸浮,具有發熱較低、不需要電子傳感器、技術難度小等優點,但葉輪與泵體間隙較小,對血細胞的損傷較大。2021年6月3日,HeartWare因設備故障和血栓形成等負面影響而退市。
雅培(Abbott)公司旗下的HeartMateⅢ為全磁懸浮離心泵,利用磁力支撐進行主動懸浮,目前為全球LVAD植入的主流產品,也是目前植入數量最多、長期反饋數據最多的第三代LVAD。2014年6月25日完成首例臨床植入,自2017年后迅速擠占市場,2019年植入LVAD中77.7%為全磁懸浮離心泵,HeartWare 和軸流泵僅占20.5%和1.8%,2年后,選擇全磁懸浮設備的比例增加至92.7%[18-19]。在2023年,這一比例增加至99.8%[56]。HeartMateⅢ葉輪側面間隙0.5 mm,上下間隙1 mm,是同類產品的10~20倍,有利于減少剪切力,減輕血細胞損傷[57]。統計數據表明,HeartMateⅢ植入患者5年生存率58.4%,且卒中、大出血等嚴重并發癥的發生率均低于軸流泵[58-59]。
Abiomed公司旗下的Impella是唯一獲得美國食品藥品監督管理局(FAD)認證的經皮介入式VAD,也是世界上最小的心泵。2012年,Impella CP獲批上市,后續又推出Impella 2.5、Impella 5.0、Impella 5.5、Impella LD等型號。主要用于嚴重心源性休克、高風險經皮冠狀動脈介入治療以及緊急授權后用于體外膜肺氧合支持下出現的肺水腫、心力衰竭患者5 d內的治療,替代心臟進行短期、緊急供血,為心臟手術和恢復爭取時間。在心源性休克患者中使用Impella能夠促使心肌恢復,改善患者預后[60-61]。
根據美國胸外科醫師協會(Society of Thoracic Surgeons,STS)年度報告, 2019年為LVAD植入數量高峰,達3 198例,其中73%的患者將植入作為目的治療。在2021年,81.1%的患者將植入作為目的治療,1年和5年生存率分別為83.0%和51.9%[18-19]。而在2023年,1年和5年生存率增加至86%和64%[56]。統計數據表明,將LVAD植入作為目的治療已經是相對成熟的技術。
4.2 國內左心室輔助裝置的發展
國內LVAD發展較晚,跳過了第一代和第二代的研發,因此國內上市的LVAD均為第三代設備。國產LVAD針對國人體質狀況進行研發,目前正處于起步發展階段,截至2023年3月,僅363例應用[62]。研究[62]發現,國產LVAD的1年、2年和3年生存率分別為94.7%、92.0%、 90.7%,已經與國內的心臟移植效果相當。目前,獲批上市的國產LVAD有重慶永仁心(EVAHEART)、蘇州同心(CH-VAD)、航天泰心(Heartcon)以及深圳核心(Corheart 6)。
重慶永仁心(EVAHEART):2017年7月首次動物實驗,2018年1月完成首例臨床植入,2019年8月26日獲批上市,是我國首個上市的心室輔助產品。該設備引進了日本技術,采用液力懸浮,適用于短期治療,也是唯一獲批的國產目的治療LVAD。該泵植入后患者仍可保留脈搏,有利于心功能的保留或恢復。葉輪轉速較慢,約1 600~2 200 r/min,目的在于減少剪切力,從而減少血管性血友病因子降解[63]。采用無尖插入插管,有利于血流沖刷,減少血液淤滯,降低血栓形成風險[42]。Zayat等[64]通過模擬循環對比EVAHEART和HeartMateⅢ凝血狀況,EVAHEART溶血及凝血激活均較少。
蘇州同心(CH-VAD):2014年12月首次動物實驗,2017年6月完成首例臨床植入,2021年11月24日獲批上市,是國內首個擁有完備知識產權的國產人工心臟。采用磁懸浮技術,心包腔內植入,適用于短期治療。與重慶永仁心(EVAHEART)相比,蘇州同心(CH-VAD)的離心泵葉輪和轉子處于同一平面,因而明顯減少了泵體厚度,縮減血泵重量。CH-VAD在正常條件下剪切力>100 pa的時間占0.4%,相對于HeartWare具有低2倍的溶血指數,在血小板激活和血栓形成風險上也較HeartWare低[65-66]。
航天泰心(Heartcon):2013年3月首次動物實驗,2019年3月首次臨床應用,2022年7月13日上市,是國內首個采用磁液懸浮技術的植入式磁液懸浮LVAD,適用于短期治療。對于目前的Heartcon植入患者,其短期治療效果積極,但長期療效仍需要進一步研究[67-68]。
深圳核心(Corheart 6):2020年首次動物實驗,2021年10月首次臨床植入,2023年6月6日上市,是國內首個應用于兒童的心室輔助產品。該泵采用磁懸浮技術,適用于短期治療。葉輪扁平化設計,無分流鼻錐,進一步減少空間占用,該泵重量僅90 g,是目前全球重量最輕、體積最小的LVAD。在動物實驗中,該泵表現出良好的血液相容性,在對患者的早期治療上也獲得滿意的效果[68-69]。
5 小結和展望
LVAD是支持終末期心力衰竭患者過渡到心臟移植的重要手段,也是許多老年患者的目的治療。即使是不進行心臟移植,部分LVAD植入患者仍然能夠生存10年以上。LVAD植入后并發癥與設備本身存在直接或間接的聯系,作為人工制品植入的缺陷,制品老化、設備損壞、人體排異、血栓形成、不能夠完全替代正常人體功能等問題持久存在。因此,對于未來LVAD的發展可以從以下幾個方面進行。
5.1 完全植入
無線充電技術的發展使完全植入設備無法進行電池更換的問題理論上得到解決。目前最輕最小的LVAD重量僅90 g,隨著新技術的發展能夠推進設備進一步小型化,實現LVAD的完全植入,從而避免線纜感染等問題,改善患者生存質量[70]。關于完全植入的研究是LVAD發展的熱門方向,但設備小型化意味著葉輪轉速必須進一步提高才能滿足泵血需要,這或許會增加對血細胞的破壞。同時,完全植入后對設備的維護難度也將增加,無線傳輸發熱等問題仍有待解決[71]。不過,已有研究者[70, 72]取得了一定成果,如體外磁體驅動LVAD、針對植入設備的新型脈沖無線輸電等。
5.2 減少血栓形成
患者植入LVAD后血栓形成是多因素作用的結果,包括機械性和非機械性因素,栓子脫落引起的栓塞也是患者死亡或再入院的常見原因,使用無免疫原性材料或生物兼容性材料,減輕葉輪對血細胞的破環,個體化使用華法林等抗凝藥物,加強對LVAD植入患者的血液敏感指標監測等措施,能夠預防或早期發現血栓形成[20, 73]。近些年第三代LVAD設備配合抗凝措施能夠明顯減少血栓的形成,但與正常人相比,植入后腦卒中等嚴重并發癥的發生率仍然較高。
5.3 微創手術
微創LVAD植入手術是否能夠讓患者明顯受益的研究較少,但微創手術可降低大出血、嚴重右心衰竭、呼吸衰竭和使用血制品的風險,縮短機械通氣時間和住院時間[74]。即使是INTERMACS分級1級的心源性休克患者,在應用微創手術后仍然可能降低術后死亡率[75-76]。
5.4 磁流體血泵
葉輪對血細胞的機械性破環是泵血栓形成的重要原因,從軸流泵到離心泵的改進目的之一便是減少機械性損傷。磁流體泵是利用血液與海水相似的導電能力,當血液在磁場中時產生感應電流與洛倫茲力,進而推動血液流動。血液動力的產生無類似于仿生泵的擠壓作用,也無非仿生泵的葉輪破壞作用,進而減少血栓形成的風險[77]。磁流體血泵雖然去除了葉輪結構,但相關研究較少,血細胞在磁場中長期穿行是否會受到影響仍未知。
《中國心血管健康與疾病報告2022》[78]指出,2021年全國僅738例心臟移植,仍有大量患者最終因心力衰竭而死亡。通過推進LVAD在國內應用有希望解決這一問題,LVAD作為人工制品相對于心臟移植有著諸多優點。首先,LVAD作為一種機械裝置,能夠通過技術的熟練和改進獲取更低廉的價格和更高的質量、產量。其次,LVAD的獲取沒有倫理學上的負擔,不受移植供體來源的影響,也不存在供受體之間的配型等問題。然后,作為患者最關心的術后生存率問題,依據STS統計數據,LVAD植入后能夠獲取較長的生存時間和較好的生活質量,國內LVAD植入后生存率已經和心臟移植水平相當[18-19, 56, 62]。最后,已有4款國產LVAD獲批上市,尚有其他LVAD正在研發中,如心擎醫療的MoyoAssist? Extra-VAD[79-80]。國產LVAD發展迅速,盡管目前LVAD植入價格不菲,但為大量心力衰竭患者帶來了生存的希望。隨著國產LVAD技術水平的進步和成本的下降,LVAD能夠更廣泛地幫助心力衰竭患者。
利益沖突:無。
作者貢獻:王沂、李子軍負責文章撰寫;易杰、李豪、陳明負責文獻查閱;侯文明負責文章設計及審閱。