版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
心臟傳導系統(cardiac conduction system,CCS)是由特殊的心臟細胞組成,它們通過協調房室收縮來建立心臟的有律性跳動,其結構結構包括竇房結(sinoatrial node,SAN)、房室結(atrioventricular node,AVN)、房室束(atrioventricular bundle,AVB)、左右束支(bundle branch,BB)及浦肯野纖維(Purkinje fiber,PF)。由于CCS無法用肉眼識別,只能經驗性地借助一些解剖學標志來判斷CCS位置[1-3],因此在心內直視手術中常常被意外損傷,誘發心律失常。其中,傳導阻滯是最嚴重的心律失常類型,特別是在先心病的手術中[4-7]。這不僅會延長住院時間,而且存在植入起搏器的風險,給患者造成額外的痛苦和花費,同時會降低生活質量[8-9]。
為了減少手術中心臟傳導組織的損傷對提高心臟外科手術預后,既往研究[10-15]做了不少嘗試,但因準確性較差、顯像不充分而應用受限。活體熒光成像技術是利用抗體與抗原特異性結合的原理,將熒光染料標記上特異性抗體,來實現特定組織的特異性熒光顯像,常用于外科術中定位[16-18]。超極化激活的環核苷酸門控陽離子電流通道蛋白 4(hyperpolarization-activated cyclic nucleotide-gated channel,HCN4),是一種表達于膜表面離子通道蛋白,在傳導細胞和非傳導細胞中差異性表達,常作為組織切片免疫熒光的特異性靶點[19-20]。另外,連接蛋白(connexin,Cx)參與構成心肌細胞間的縫隙連接,不同亞型在不同心肌中表達存在差異:在SAN及AVN中觀察到Cx45高表達,Cx43低表達,在心房肌中Cx43大量表達Cx45低表達,Cx43常作為工作心肌的標記物[19-20]。以上標志物的表達差異,為其在CCS顯像中的應用提供了可能。
本研究擬利用HCN4作為CCS特異性靶點,使用針對該靶點熒光染料標記的抗體,通過模擬真實手術主動脈順行性灌注過程,對CCS的術中實時可視化方法的可行性及成像效果進行了初步的探究。?
1 材料與方法
1.1 主要實驗試劑
Mouse anti-connexin 43(Santa Cruz,美國);rabbit anti-HCN4(博奧森,中國);goat anti-mouse IgG(Alexa Fluor 405)(Thermo Fisher,美國);goat anti-rabbit IgG(Alexa Fluor 633)(Thermo Fisher,美國);goat anti-mouse IgG(TRITC)(Jackson,美國);goat anti-rabbit IgG(Alexa Fluor 647)(Jackson,美國);DAPI溶液(索萊寶,中國)。
1.2 主要實驗儀器
熒光體視顯微鏡(Leica M205 FCA,德國);數字切片掃描儀(Olympus,日本);圖像處理軟件(Leica,德國);OLYMPUS(Olympus,日本)。
1.3 實驗動物
雄性SPFSD大鼠,9~11周齡,體重350~400 g,購自成都達碩實驗動物有限公司,均在四川大學華西臨床醫學院/華西醫院實驗動物中心動物房進行飼養。實驗動物的飼養和處理遵循美國國立衛生研究院“護理和使用實驗室動物指南”(NIH Publication No.85-23)。實驗動物生產許可證號:SCXK(川)2020-0030。
1.4 實驗方法
1.4.1 離體大鼠心臟主動脈順行性灌注模型構建及預處理
使用異氟烷麻醉33只大鼠后,尾靜脈注射肝素鈉(100 IU/kg)全身肝素化。使用解剖剪逐層打開胸腔充分暴露心臟,迅速離斷各大血管(保留一定長度主動脈),完整取下大鼠心臟,使用預先準備的冰肝素鈉-生理鹽水稀釋液(12 500 U/100 mL)沖洗。將22G留置針經斷端插入主動脈近端管腔內并固定。排氣后將留置針通過輸液延長管連接注射器后固定于微量泵,以4 mL/min經主動脈-冠脈順行性灌注冰肝素-生理鹽水稀釋液,直至灌出液無明顯紅色。使用4%多聚甲醛溶液以4 mL/min灌注固定心臟10 min,PBS溶液(pH 7.2~7.4)灌洗30 min;5%BSA溶液以1 mL/min灌注封閉50 min,PBS溶液灌洗30 min,用于后續經主動脈灌注抗體溶液實驗。后續需石蠟切片免疫熒光實驗的心臟標本,使用4%多聚甲醛溶液以4 mL/min灌注固定心臟30 min后,浸泡于4%多聚甲醛溶液中4℃固定72 h。
1.4.2 劑量-熒光強度研究
一抗(rabbit anti-HCN4/Mouse anti-connexin 43)稀釋液灌注4 h后PBS灌洗30 min,二抗[goat anti-rabbit IgG(Alexa Fluor 633)/goat anti-mouse IgG(Alexa Fluor 405)]稀釋液灌注2 h后PBS灌洗30 min,流量固定為1 mL/min。使用體視熒光顯微鏡拍攝觀察。設置5組灌注劑量梯度,每組3只大鼠:一抗原液劑量2.5 μL/5μL,3.75 μL/7.5μL,5 μL/10μL,7.5 μL/15μL,10 μL/20μL。針對HCN4的一抗與二抗原液體積比例固定為1∶2,針對Cx43的一抗與二抗原液體積比例固定為1∶1。
1.4.3 時間-熒光強度研究
先后取劑量梯度為5 μL/10μL一抗原液稀釋液和10 μL/10μL二抗原液稀液灌注心臟,流量固定為1 mL/min。設置5組灌注時間梯度,每組3只大鼠:1 h/0.5 h,2 h/1 h,4 h/2 h,6 h/3 h,8 h/4 h。后使用體視熒光顯微鏡拍攝觀察。
1.4.4 光化學穩定性研究
先后取劑量梯度為5 μL/10μL一抗原液稀釋液和10 μL/10μL二抗原液稀液灌注3只大鼠心臟,流量固定為1 mL/min。灌注時間梯度設置為:4 h/2 h。灌注完成后解剖右心房及右室,暴露房室交界區心內膜面,使用LED臺燈連續光照,并分別在0 h、0.5 h、1 h、2 h、3 h、4 h、5 h、6 h、7 h、8 h后使用體視熒光顯微鏡拍攝觀察。
1.4.5 組織學對比驗證
為驗證離體大鼠心臟經主動脈順行性灌注抗體溶液后體視熒光顯微鏡下顯影結構的性質,將灌注后的大鼠心臟制作為冰凍切片,并取同一層面下石蠟切片進行標準的免疫熒光染色,于熒光顯微鏡下進行觀察比對。
將灌注后的大鼠心臟制作為冰凍切片,并取同一層面下石蠟切片進行標準的免疫熒光染色,于熒光顯微鏡下進行觀察比對。冰凍切片及石蠟切片使用Olympus VS200數字切片掃描儀采集圖像,圖像使用OLYMPUS OlyVIA V3.4.1軟件分析處理,石蠟切片與冰凍切片HCN4熒光信號設置為紅色,Cx43熒光信號設置為綠色。根據熒光強弱分析組織中HCN4與Cx43表達差異,傳導組織表達特定為HCN4高表達,Cx43低表達,以此標準識別傳導組織。
1.4.6 CCS熒光成像的分析
由于預實驗中CCS中的其它成分可視化效果不佳,并未按預期出現SAN、AVN下級的分支AVB和BB的顯影。故灌注完成后使用標本針固定大鼠心臟,解剖后置于熒光體式顯微鏡下,只觀察AVN:房-室交界區,并采集圖像。采集圖像后使用Leica Application Suite X軟件分析處理。房室交界區半定量熒光分析:(1)在冠狀竇與三尖瓣環之間,平行三尖瓣環作一直線段,橫穿紅色熒光聚集區域,測定該直線段路徑中的HCN4和Cx43熒光信號強度變化趨勢,在該直線段上每間隔0.1 mm計算HCN4/Cx43熒光強度比值,評估兩種熒光信號的差異性大小。(2)使用直徑為2 mm的圓形圈選房室交界區熒光最強處,視作AVN以測量該區域中的平均熒光強度,將圓圈外圍1 mm內區域熒光視作背景熒光,計算AVN與背景熒光強度比值評估成像質量,比值越大則認為成像質量越好。
1.5 統計學分析
數據統計分析使用 SPSS 25.0 統計軟件(SPSS Inc.,Chicago,IL,USA)完成,連續變量使用均數±標準差(x±s)描述。組間重復測量資料采用重復測量方差分析,多配對樣本資料采用Friedman非參數檢驗進行統計分析。P≤0.05為差異有統計學意義。
1.6 倫理審查
本實驗獲得四川大學華西醫院實驗動物倫理委員會審批同意,批件號:20220125001。
2 結果
2.1 房-室交界區成像
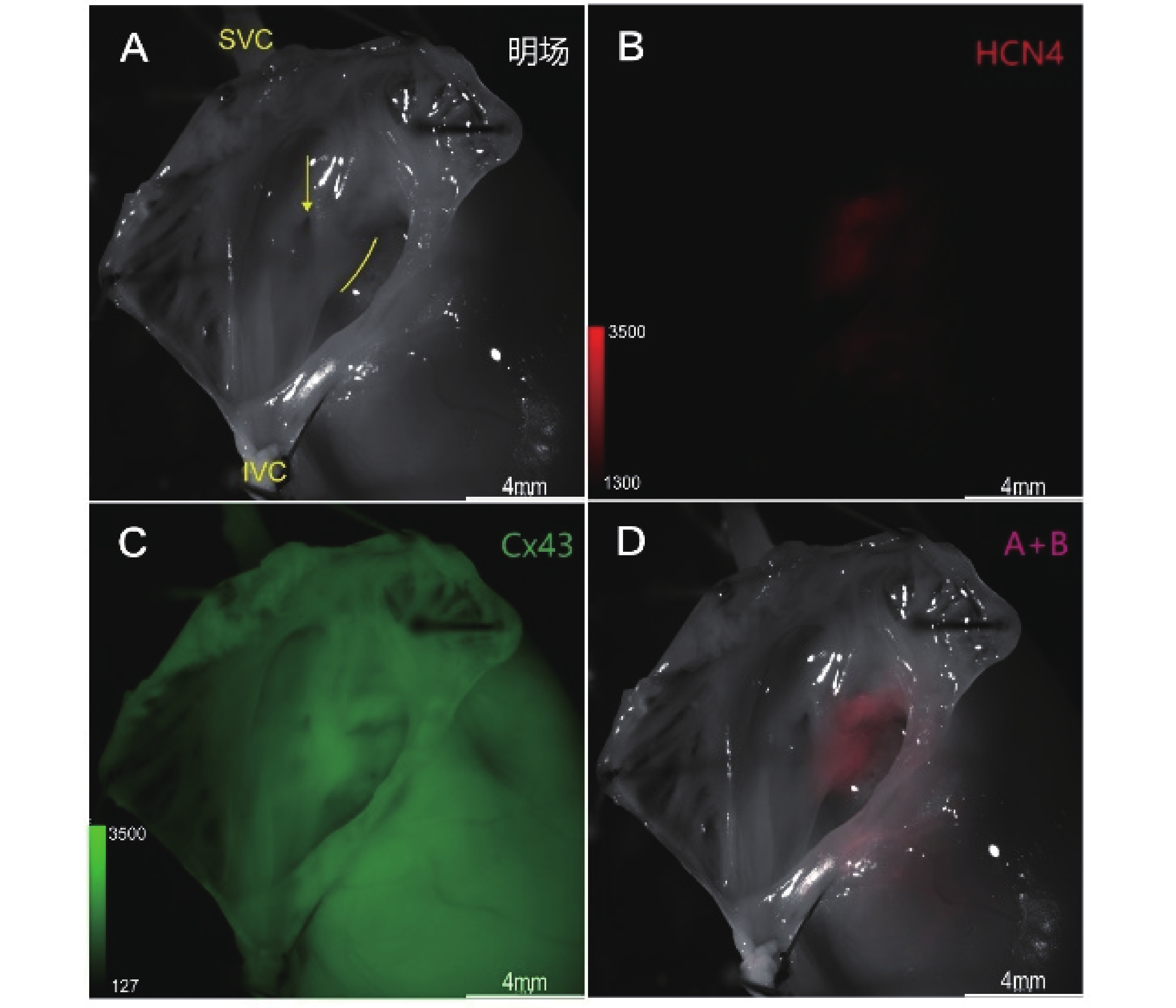
冠狀竇口與三尖瓣環之間為房室交界區(圖1a)。在體視熒光顯微鏡下,右房內房-室交界區可見一形狀不規則的HCN4紅色熒光信號聚集區域,沿心臟長軸徑長約2 mm(圖1b)。與明場重疊后可見該紅色熒光聚集結構位于冠狀竇口與三尖瓣環之間,緊鄰三尖瓣環(圖1d)。CX43綠色熒光信號在相同位置熒光信號略有聚集(圖1c)。
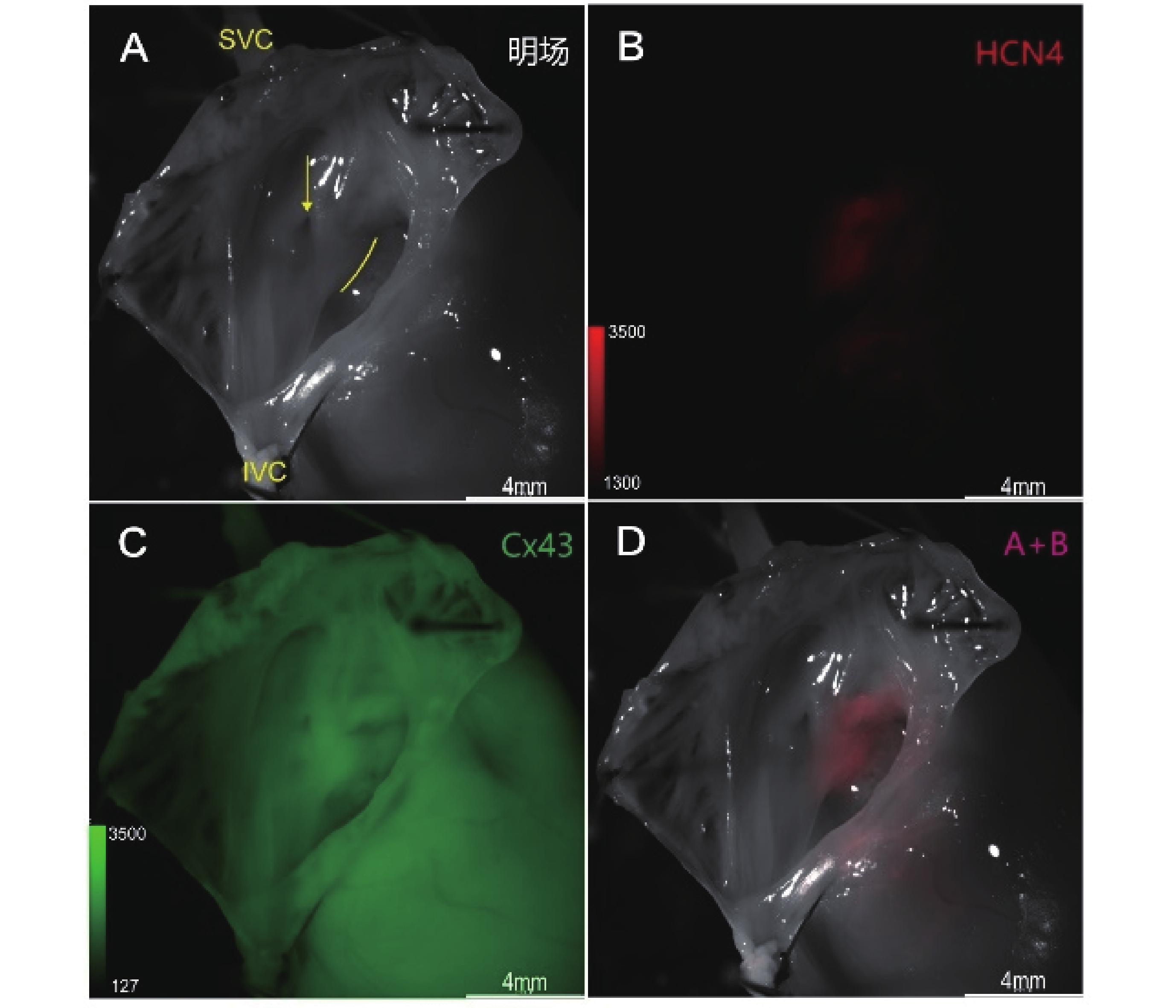 圖1
房-室交界區熒光成像圖
圖1
房-室交界區熒光成像圖
a:明場;b:HCN4熒光信號;c:Cx43熒光信號;d:A+B疊加。SVC:上腔靜脈;IVC:下腔靜脈;黃色箭頭:冠狀竇口;黃色弧線:三尖瓣環;黃色方框示房-室交界區
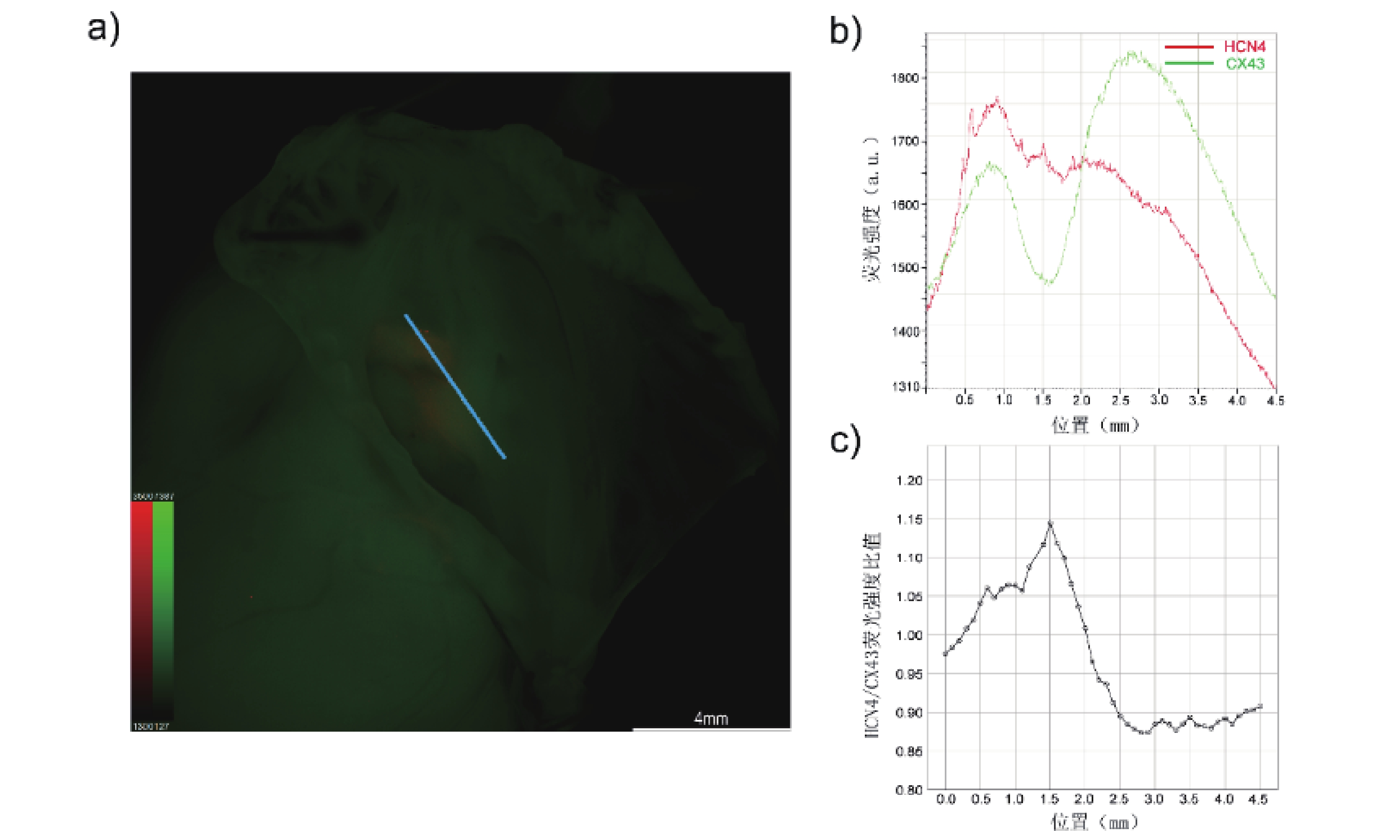
在冠狀竇口與三尖瓣環之間,平行三尖瓣環作一直線段,橫穿紅色熒光聚集區域,測定該路徑中的HCN4和CX43熒光信號強度連續變化趨勢(圖2a)。在該路徑中從左至右,Cx43熒光信號強度在1.0~2.5 mm之間出現了下降的“波谷”,而在同一區間內,HCN4熒光信號強度則相對平穩,二者變化趨勢在該區間內不一致(圖2b)。通過比較HCN4/Cx43熒光強度比值變化,這種差異在1.5 mm處達到最大(圖2c)。這提示在該區域內存在HCN4高表達而CX43低表達的特點。
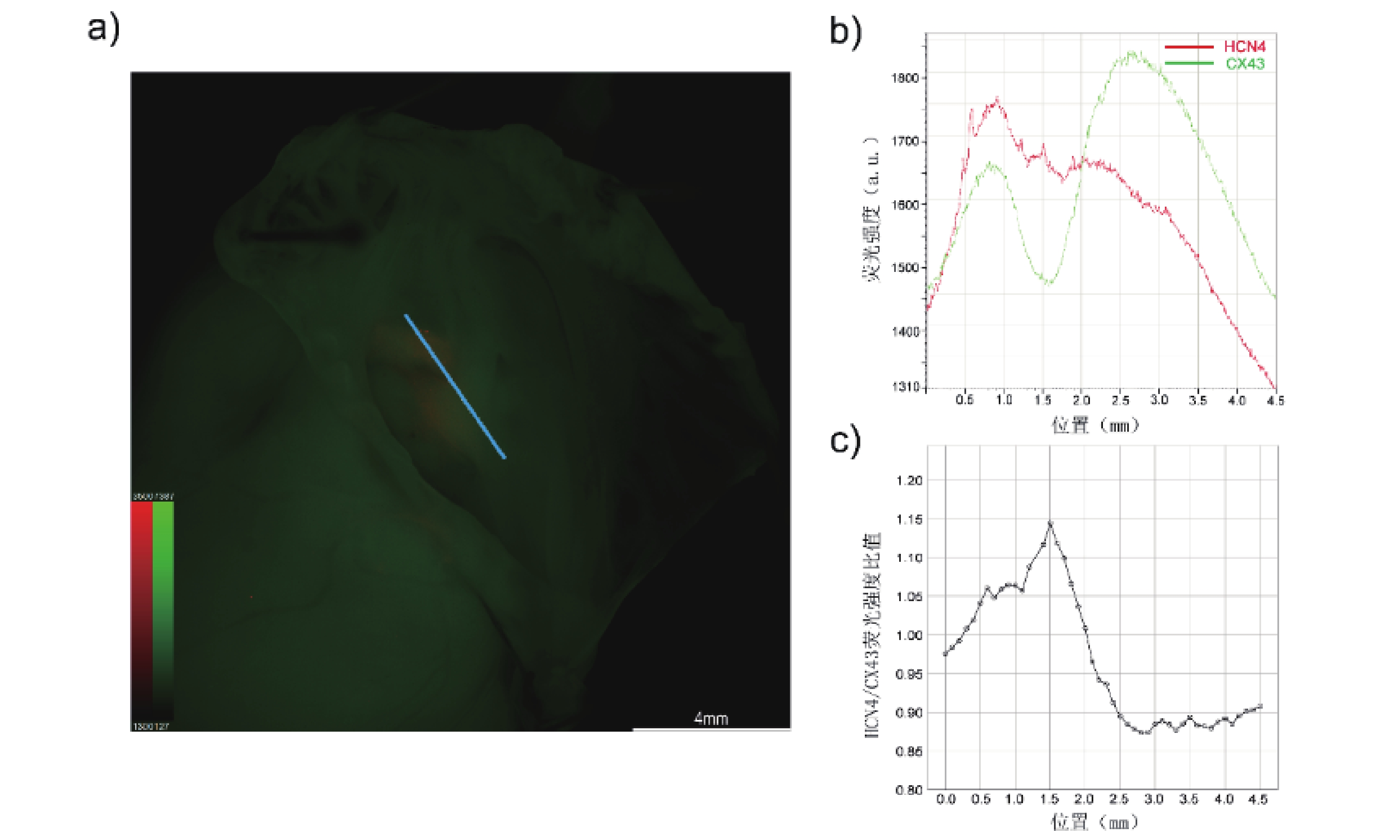 圖2
選定路徑HCN4與Cx43熒光信號半定量分析
圖2
選定路徑HCN4與Cx43熒光信號半定量分析
a: 整體圖像呈鏡像翻轉,藍色直線為選定路徑
2.2 組織學對比驗證
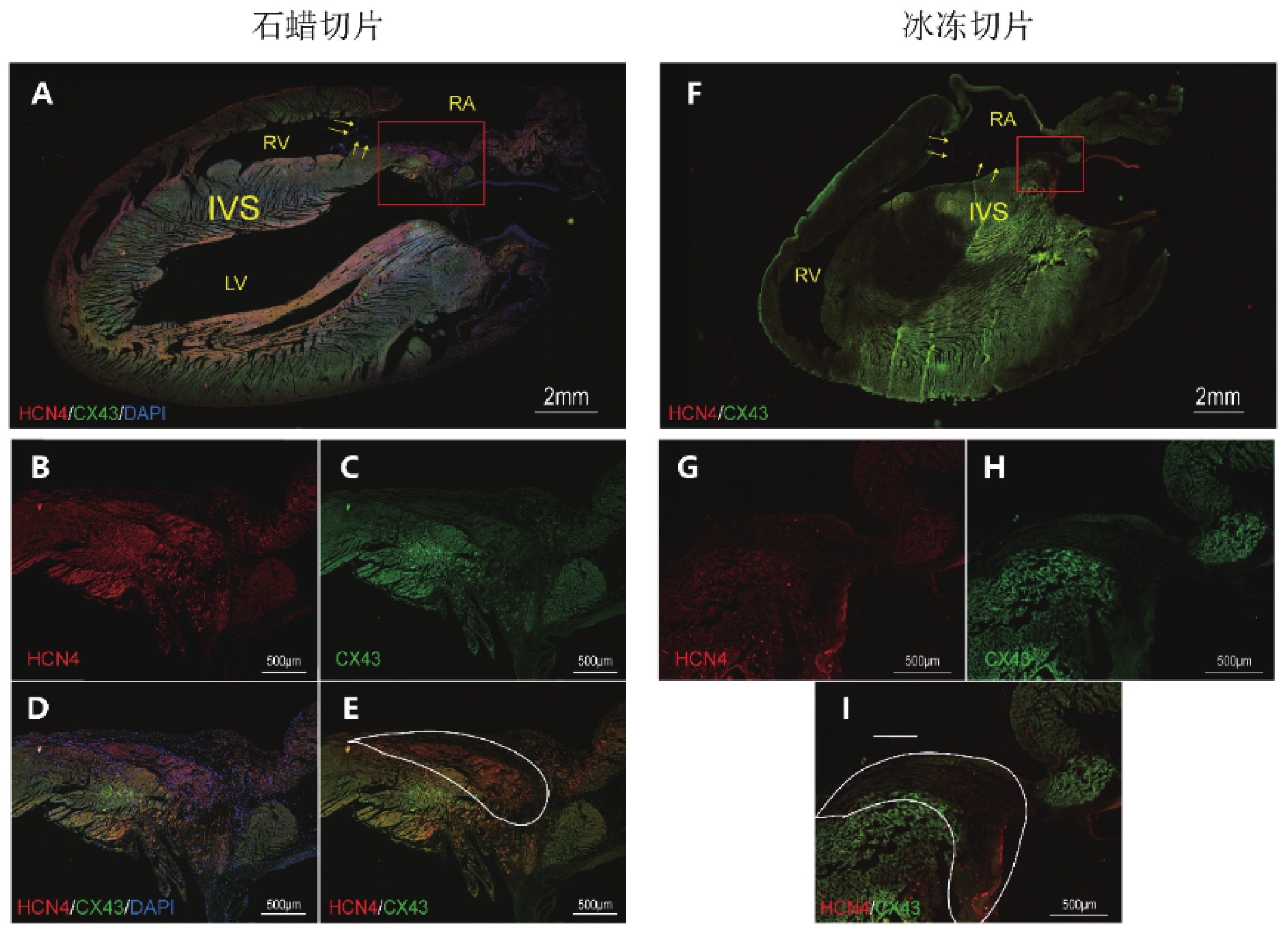
為進一步探究經主動脈順行性灌注抗體溶液后在房室交界區出現的紅色熒光信號聚集結構的性質,取使用灌注法標記熒光后的大鼠心臟,沿心室長軸進行冰凍切片,顯露室間隔剖面于熒光顯微鏡下成像(圖3f),并與同一層面下的標準石蠟切片免疫熒光染色圖像進行對比(圖3a),分析兩種熒光染色方法下的組織學特點。
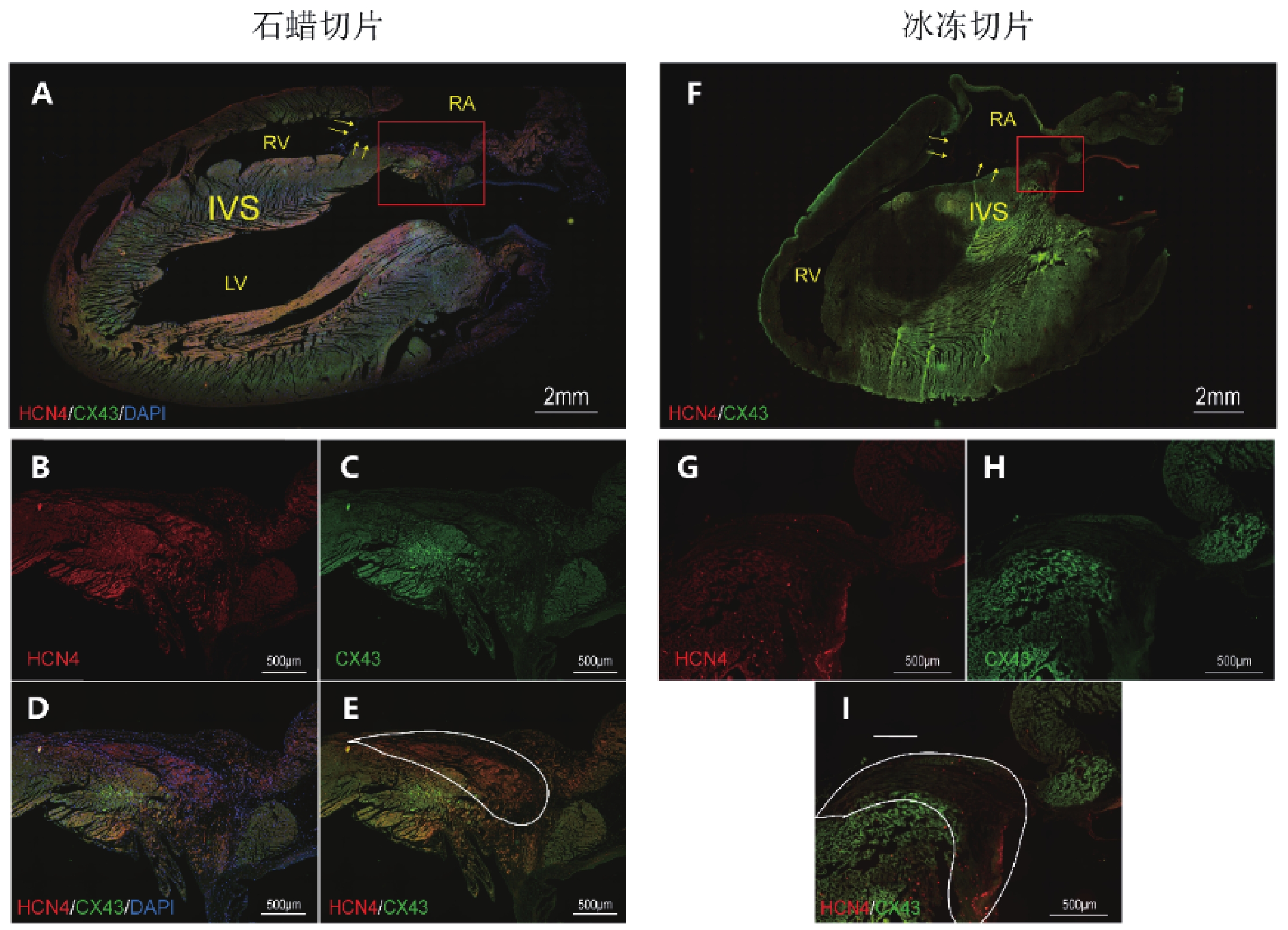 圖3
大鼠心臟標準石蠟切片免疫熒光染色與經主動脈灌注熒光染色冰凍切片顯微圖
圖3
大鼠心臟標準石蠟切片免疫熒光染色與經主動脈灌注熒光染色冰凍切片顯微圖
a~e:石蠟切片;f~i:冰凍切片;b~e:A中紅色方框區域放大;g~h:F中紅色方框區域放大;RA:右心房;RV:右心室;LV:左心室;IVS:室間隔;黃色箭頭示三尖瓣及其附著緣
在標準石蠟切片免疫熒光染色圖像中,三尖瓣環上方的房室交界區心內膜下,可見一HCN4高表達而Cx43低表達的梭形區域,沿心臟長軸方向長度約2 mm,即為AVN(圖3b~c,e,白圈區域)。同一層面下的冰凍切片中,三尖瓣環上方心內膜下也出現了存在同樣Cx43的HCN4表達特點的結構(圖3g~i,白圈區域)。該結構與熒光體式顯微鏡下的紅色熒光信號聚集結構位置一致,均位于三尖瓣環上方且緊鄰三尖瓣瓣環。
此外,通過對冰凍切片的整體觀察,發現切片上存在大小及形狀不一的片狀熒光暗區,熒光信號呈現不均勻狀態(圖3f)。
2.3 劑量-熒光強度研究
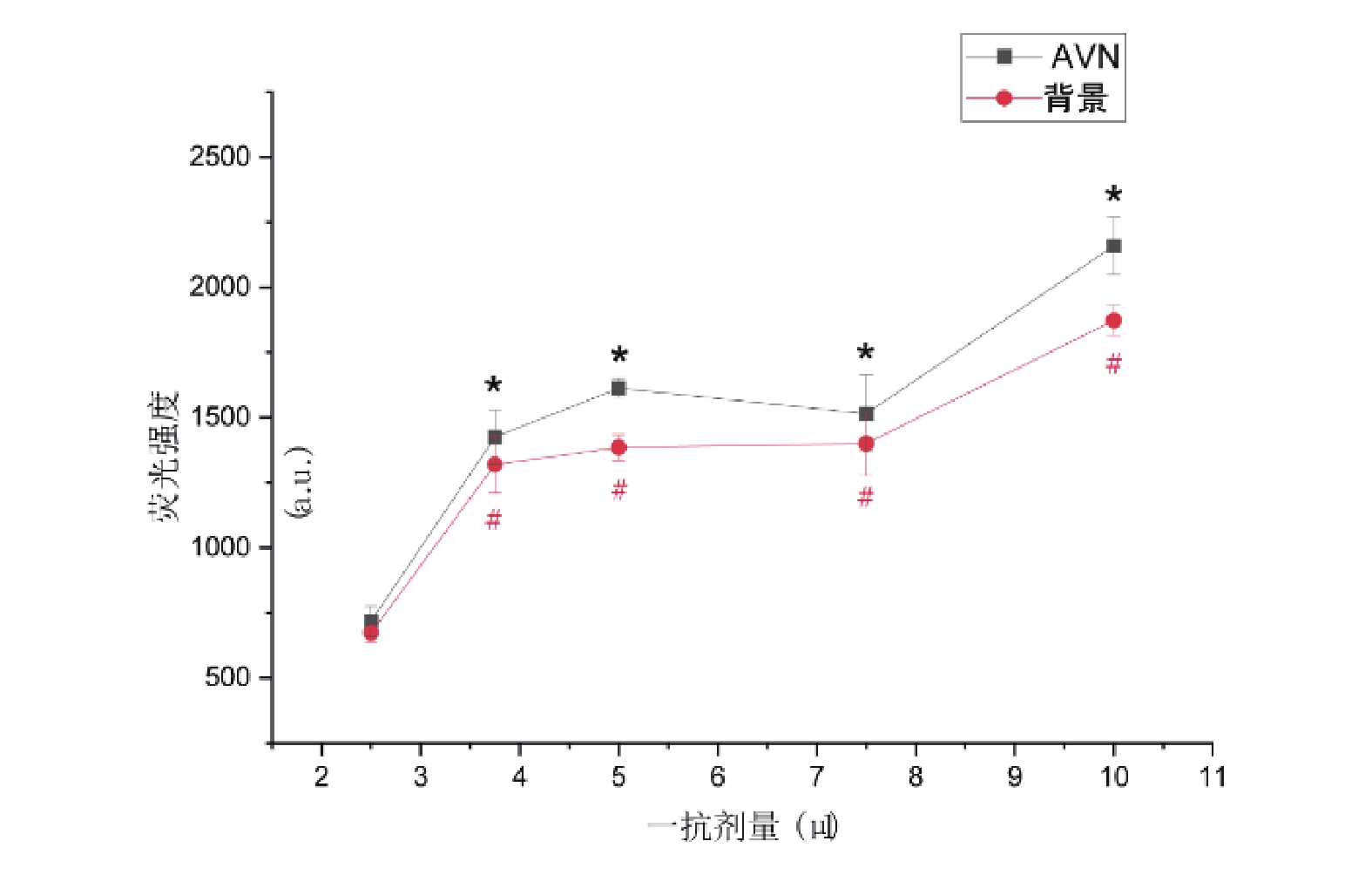
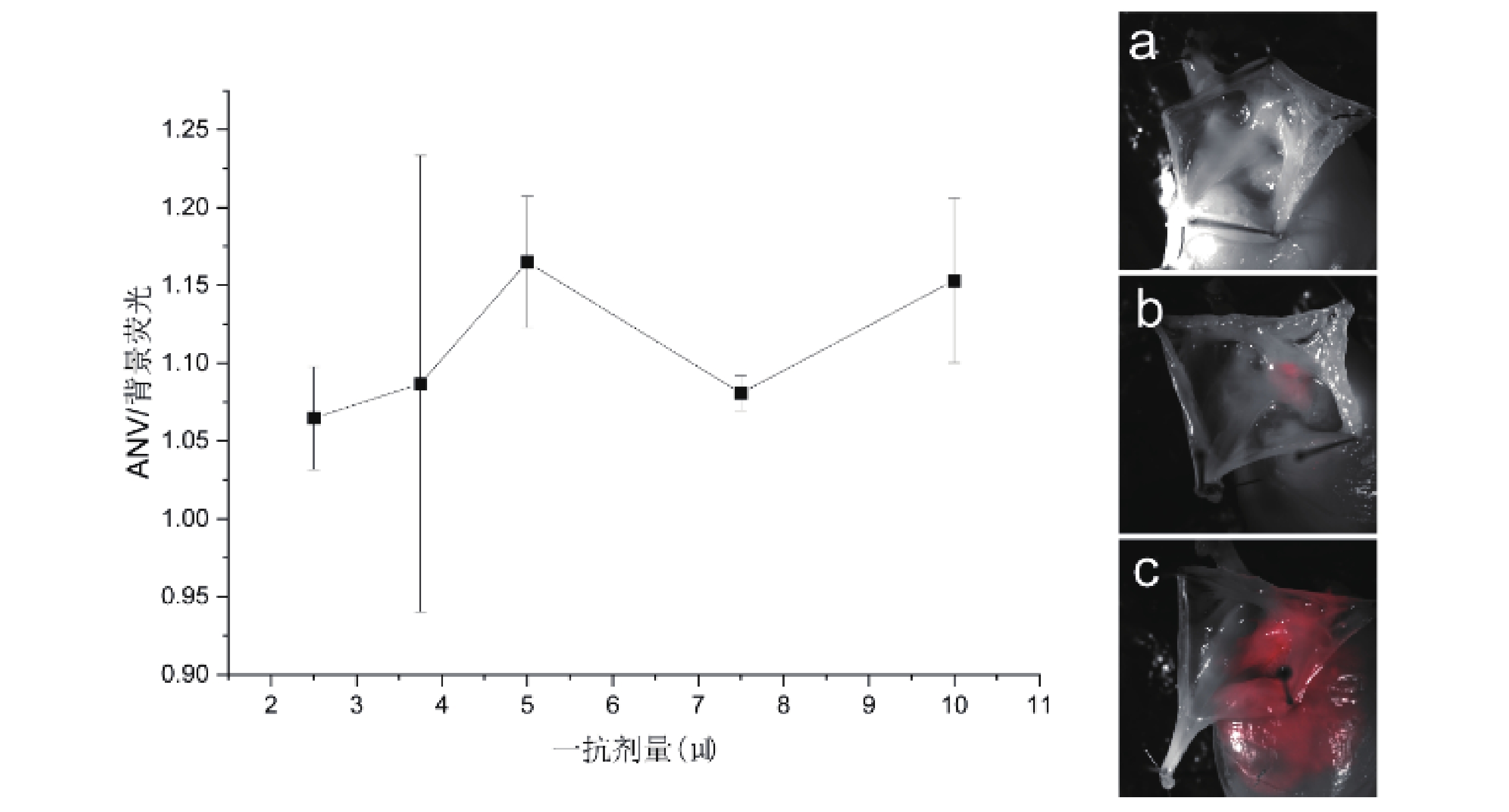
當一抗(anti-HCN4)劑量為2.5 μL時,AVN及背景熒光強度分別為717.32±57.82和673.06±35.07,隨著一抗劑量的增加,AVN與背景熒光強度均出現升高,后續劑量梯度組與2.5 μL組比較,均存在統計學差異(P<0.05)。3.75~7.5 μL之間出現一平臺期,7.5 μL組與3.75 μL組和5 μL組比較無統計差異(P>0.05,圖4)。AVN/背景熒光強度比值各組間比較變化均差異無統計學意義(P>0.05),不同劑量抗體下,成像質量不一(圖5)。
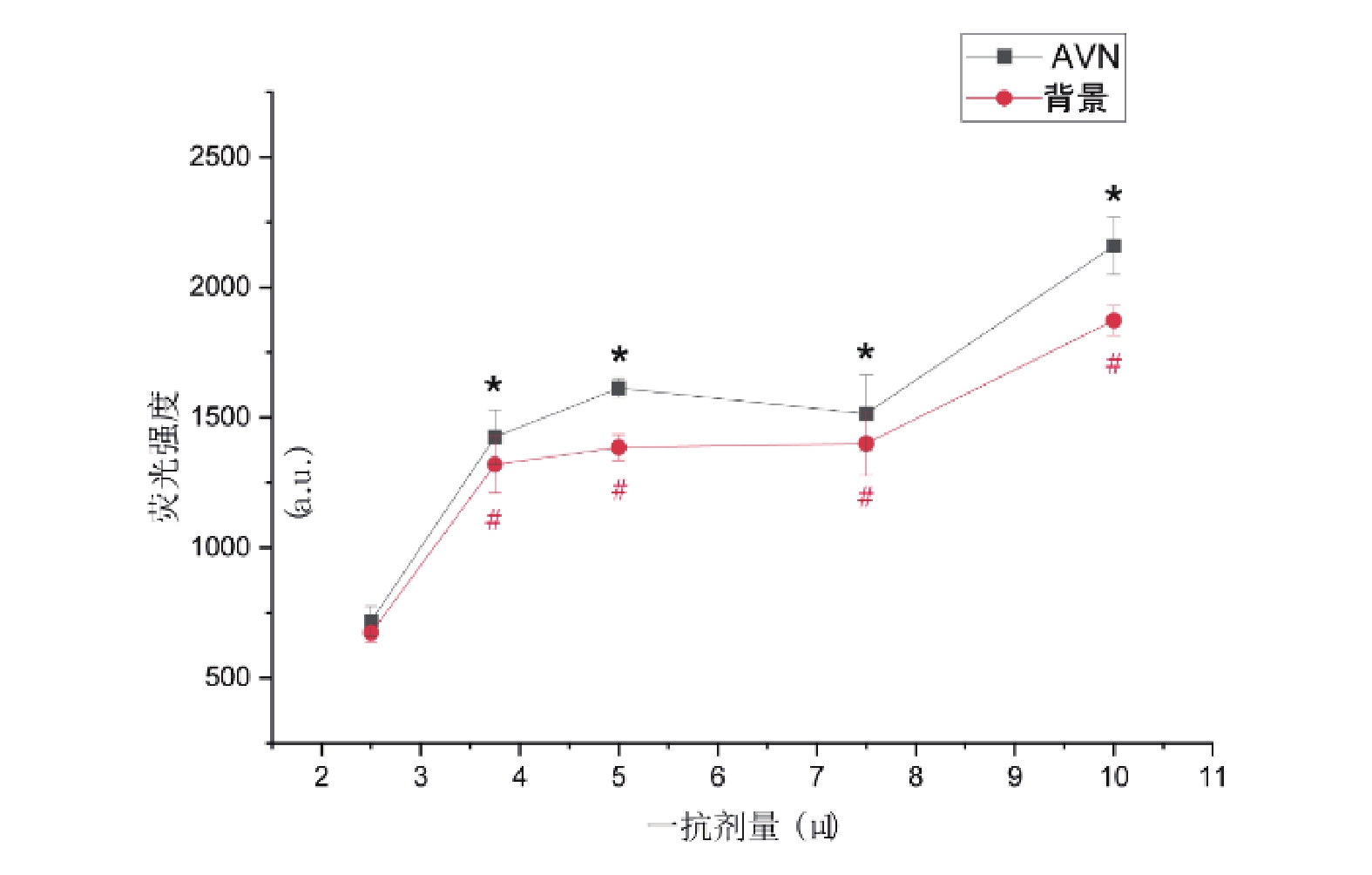 圖4
不同一抗劑量下熒光強度變化趨勢
圖4
不同一抗劑量下熒光強度變化趨勢
與2.5 μL組比較, */#:
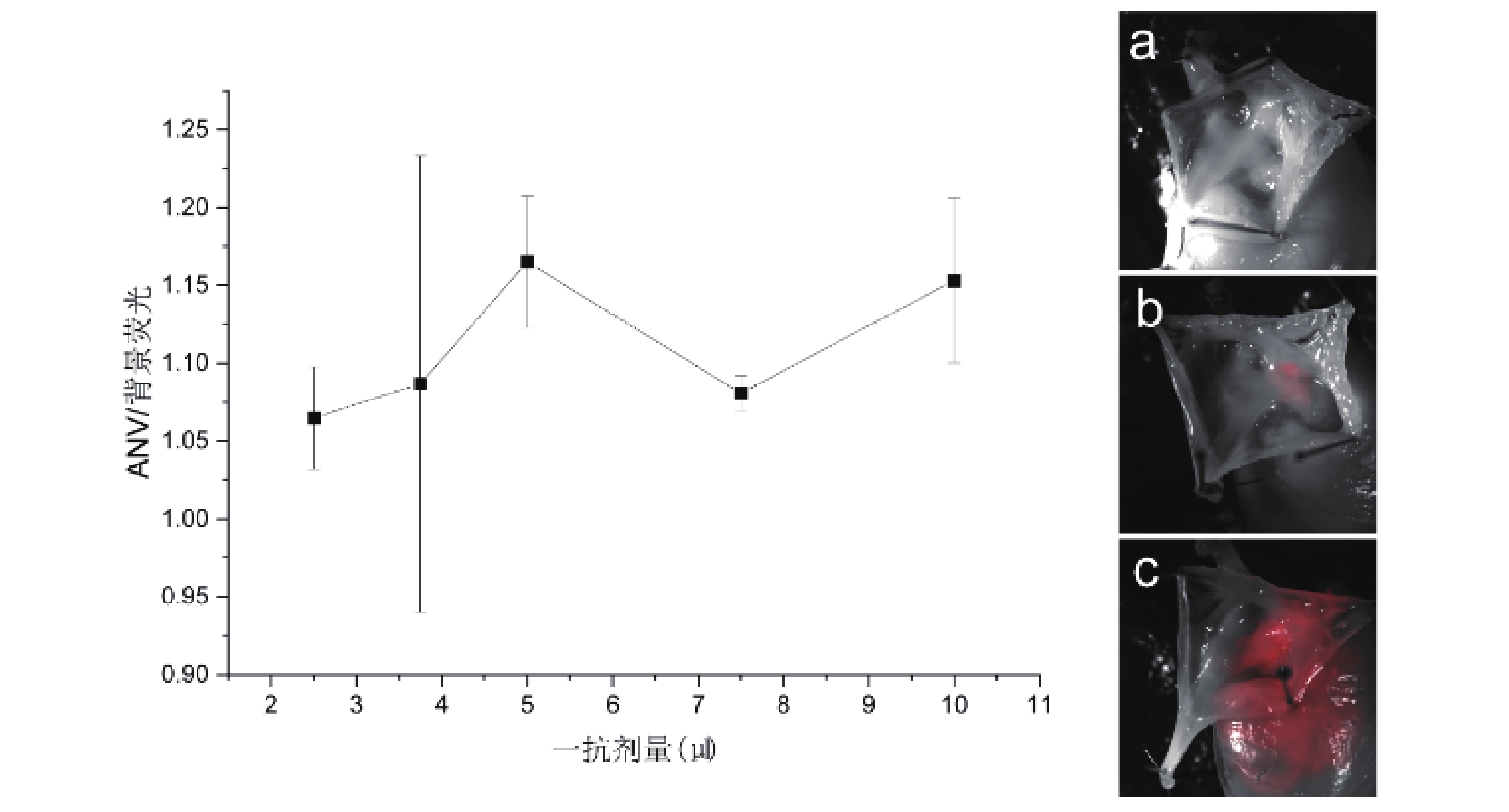 圖5
不同一抗劑量下AVN/背景熒光變化趨勢及成像圖
圖5
不同一抗劑量下AVN/背景熒光變化趨勢及成像圖
a~c:劑量分別為2.5、5、10 μL時AVN成像圖
2.4 時間-熒光強度研究
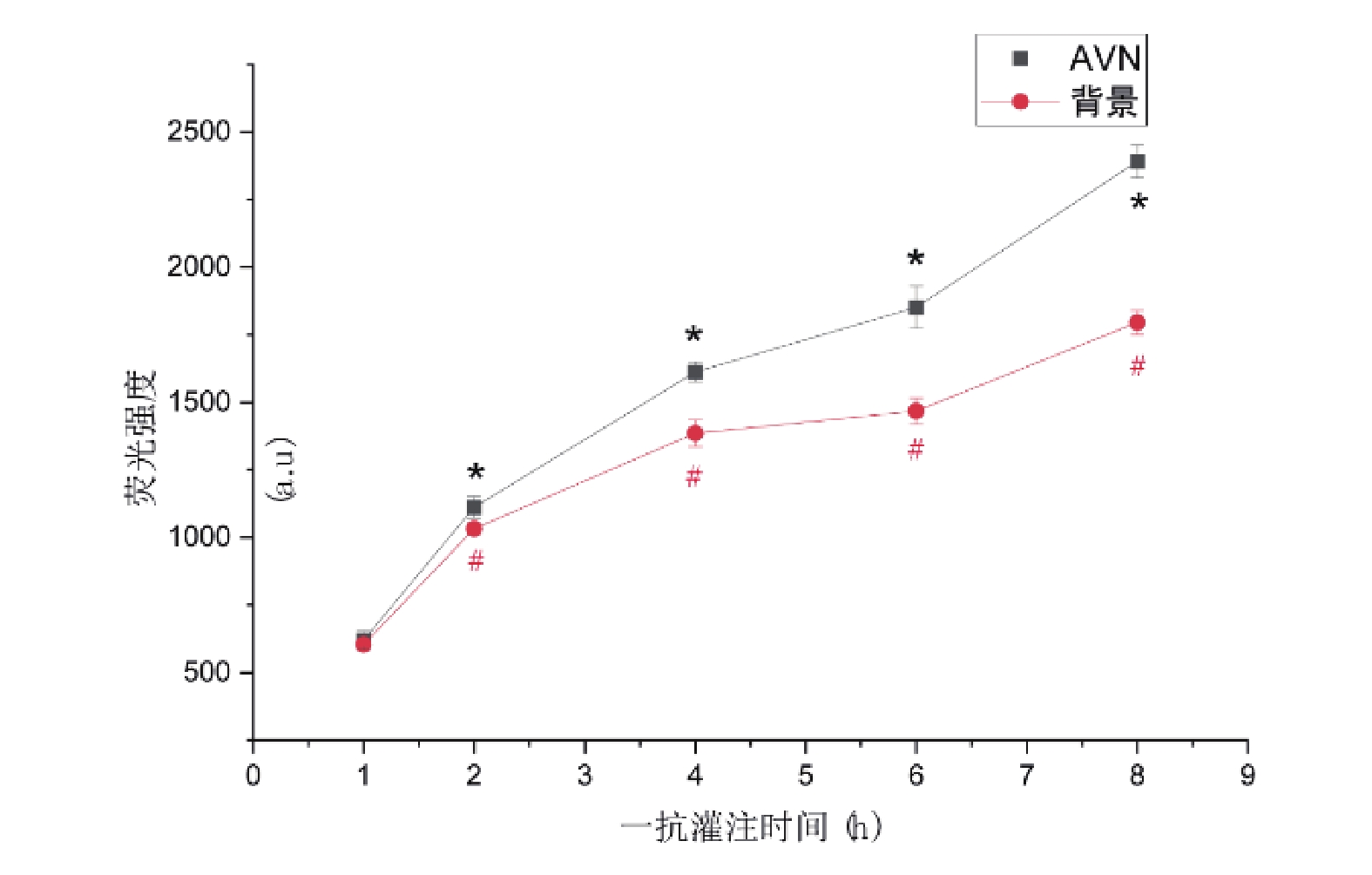
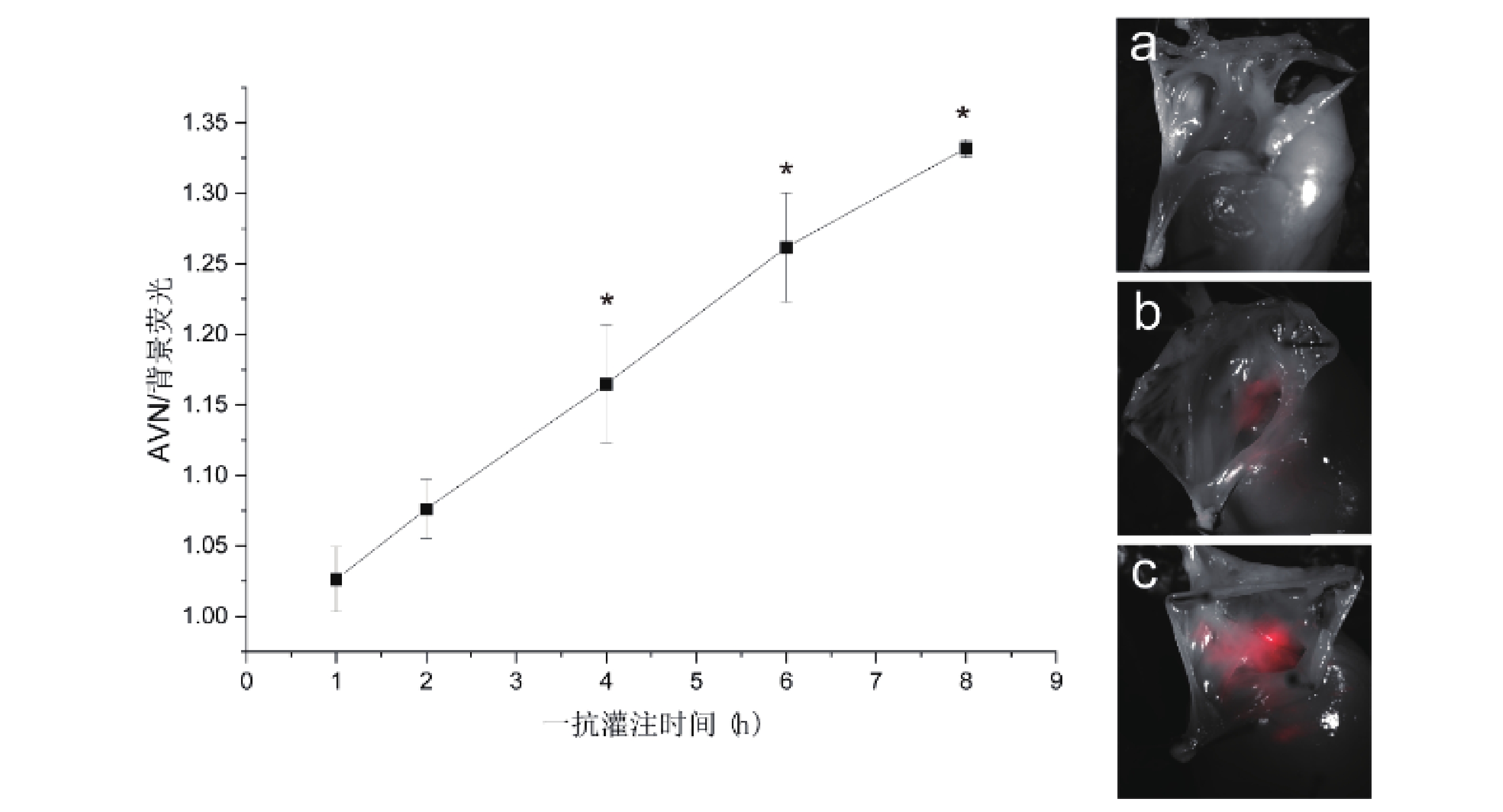
當灌注時間為1 h時,AVN及背景熒光強度分別為619.84±34.19和603.67±20.84,隨著一抗灌注時間的增加,AVN與背景熒光強度均上升,抗體灌注時間越長,AVN與背景熒光強度越大,各時間梯度組間比較均具有統計學差異(P<0.05,圖6)。AVN/背景熒光強度比值隨灌注時間的增加而增大,除1 h組和2 h組差異無統計學意義外(P>0.05),其余各組均存在統計學差異(P<0.05),比值在研究范圍內于8 h處達最大,成像質量最佳(圖7)。
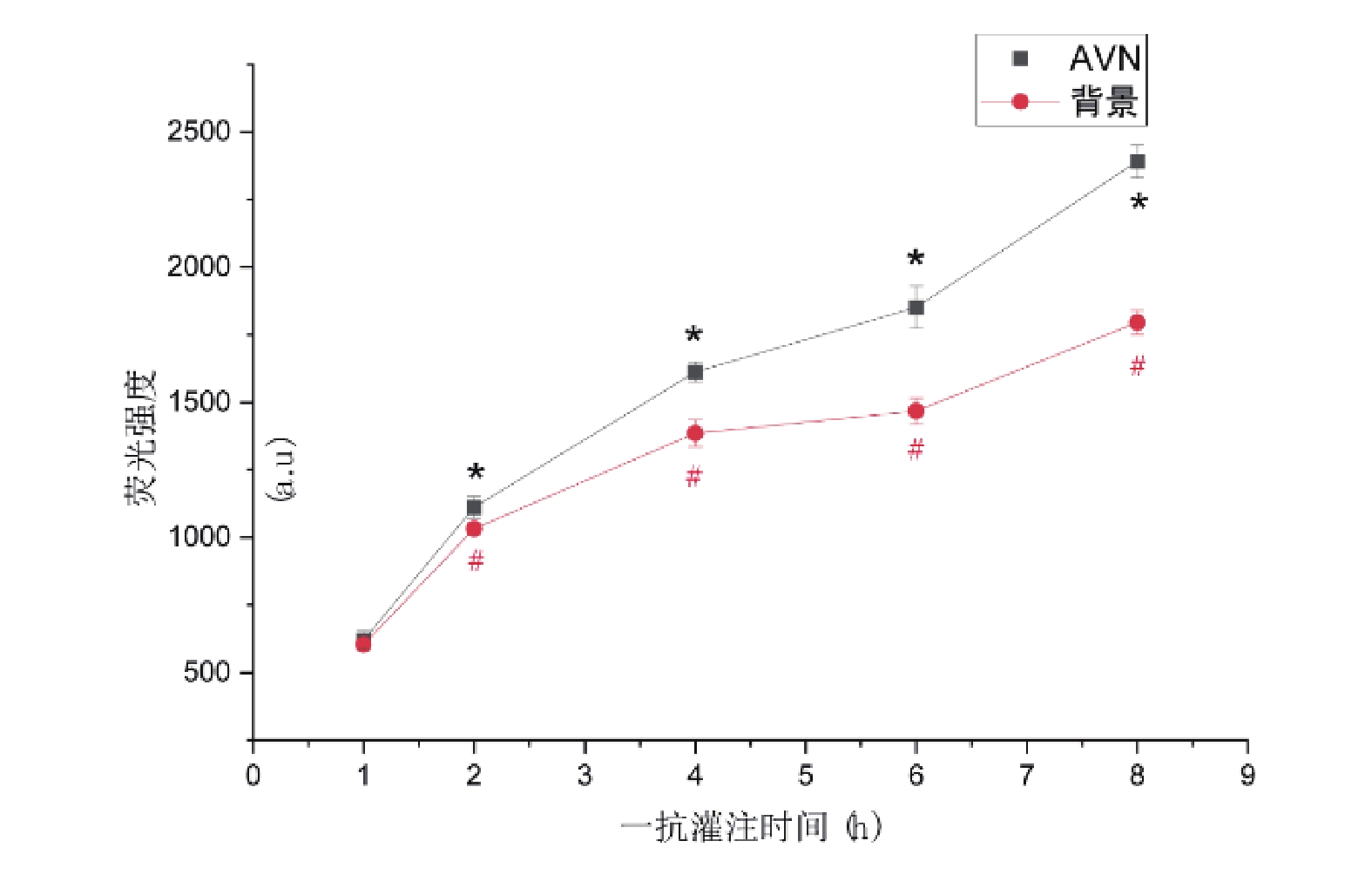 圖6
不同一抗灌注時間熒光強度變化趨勢
圖6
不同一抗灌注時間熒光強度變化趨勢
與1 h組比較, */#:
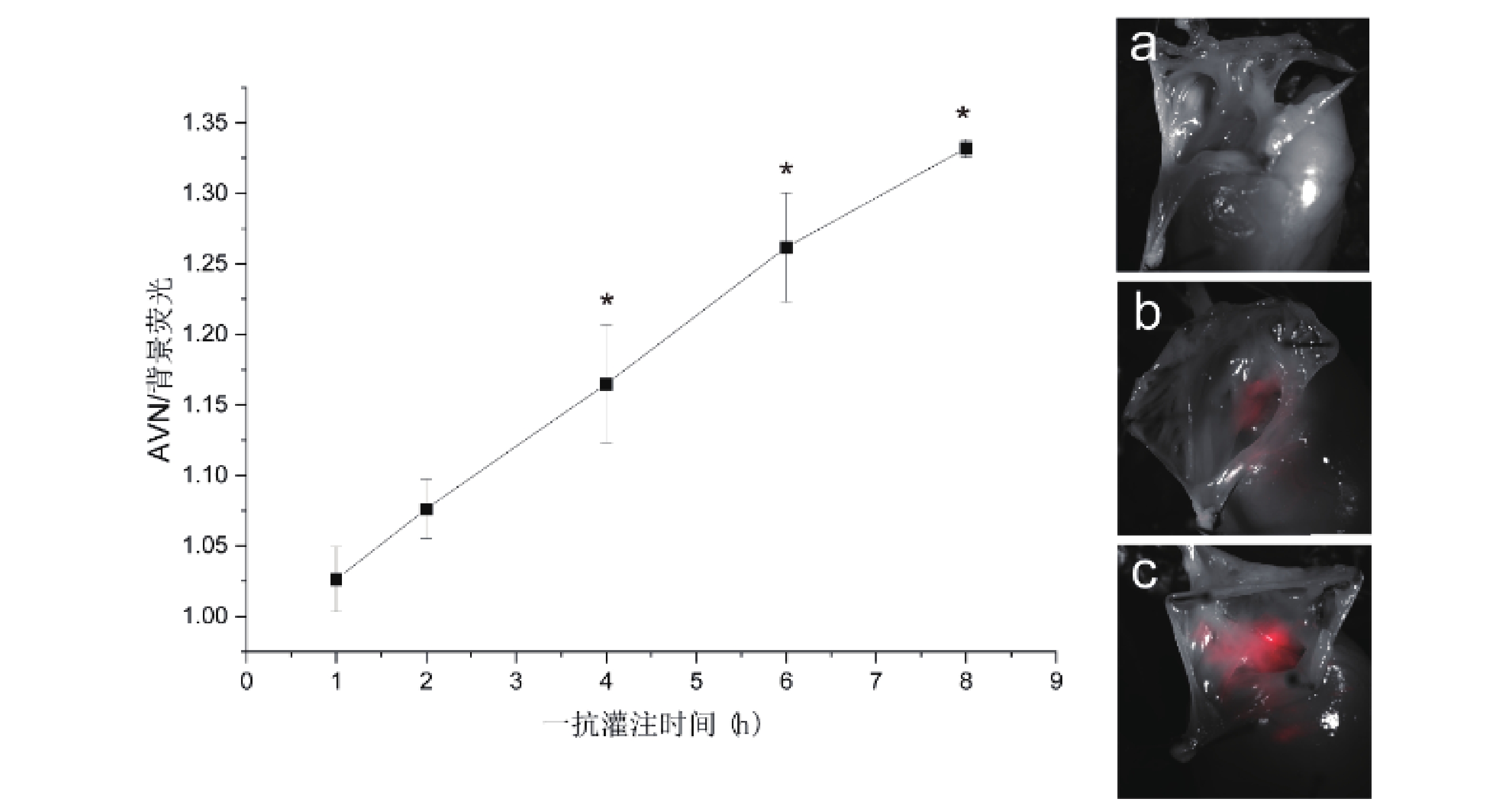 圖7
不同一抗灌注時間AVN/背景熒光變化趨勢及成像圖
圖7
不同一抗灌注時間AVN/背景熒光變化趨勢及成像圖
a~c:灌注時間分別為1、4、8 h時AVN成像圖;與1 h組比較,*:
2.5 光穩定性研究
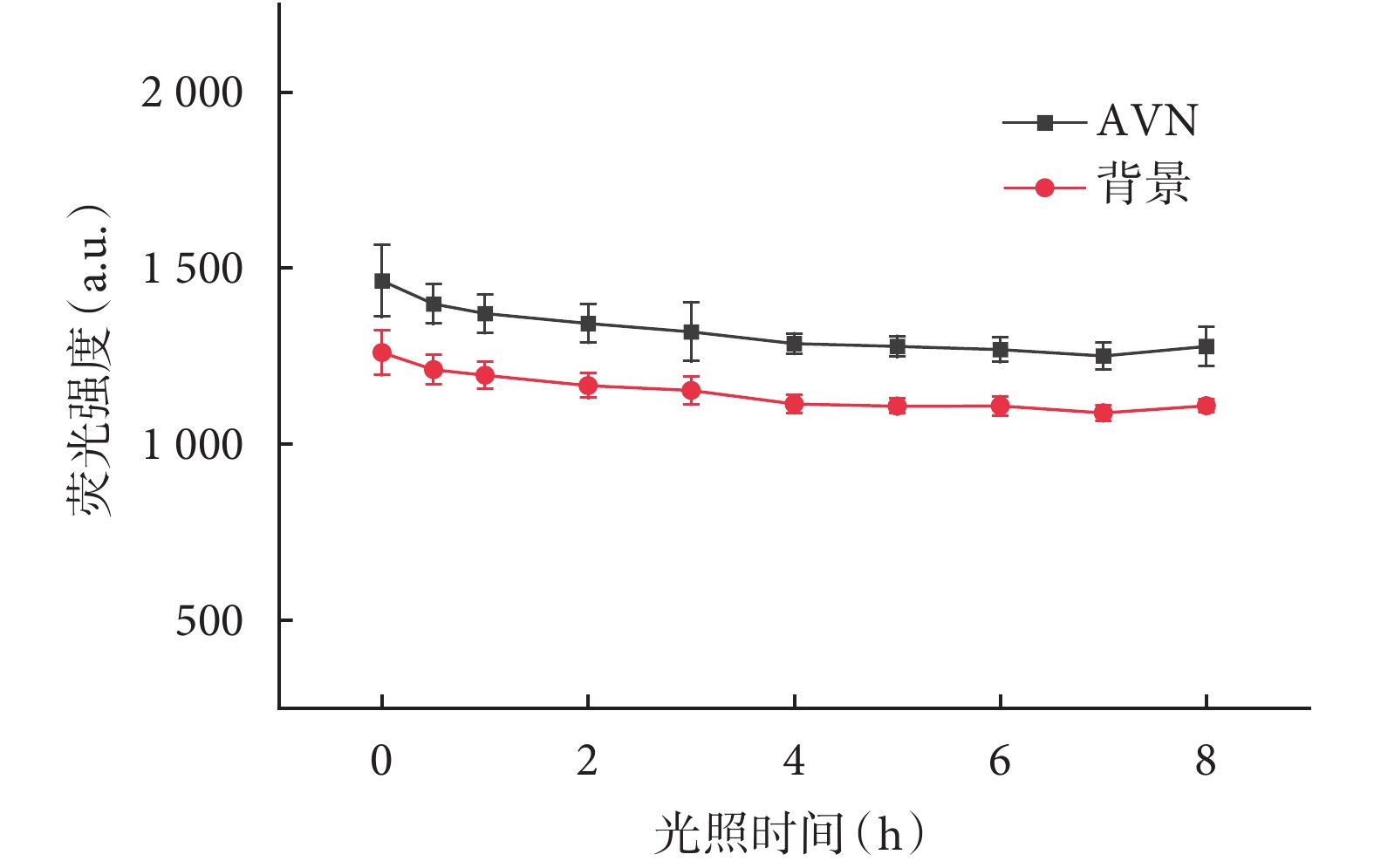
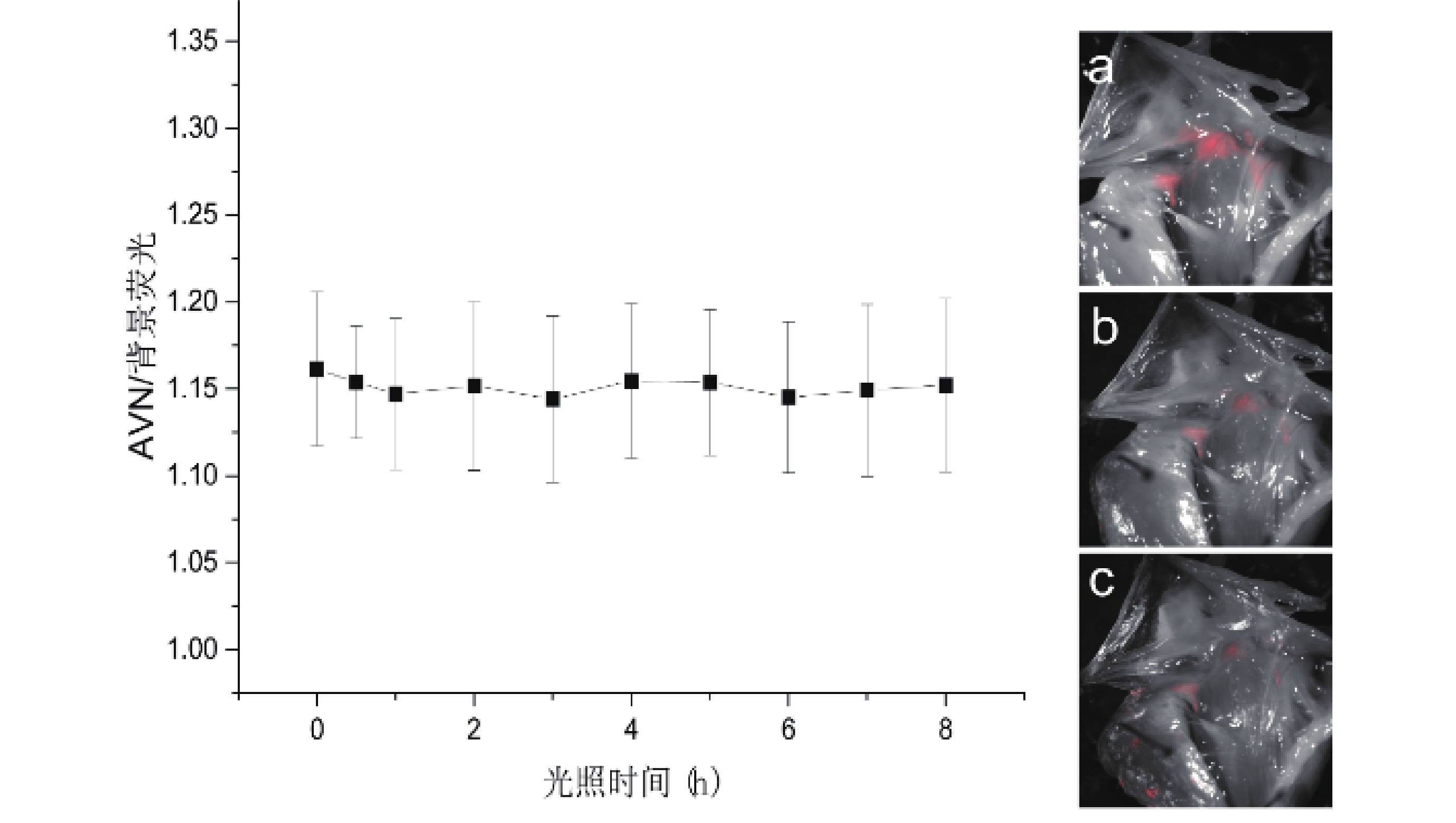
將灌注后標記熒光的心臟標本解剖后,暴露于LED臺燈光照下模擬手術室無影燈光源照射,探究熒光穩定性。隨光照時間的延長,AVN熒光強度出現下降趨勢(P<0.05),背景熒光強度出現下降趨勢(P<0.05,圖8)。AVN與背景熒光強度比值隨光照時間的延長變化差異無統計學意義(P>0.05),房室交界區在經過長達8 h光照后,仍能維持一定程度顯影(圖9)。
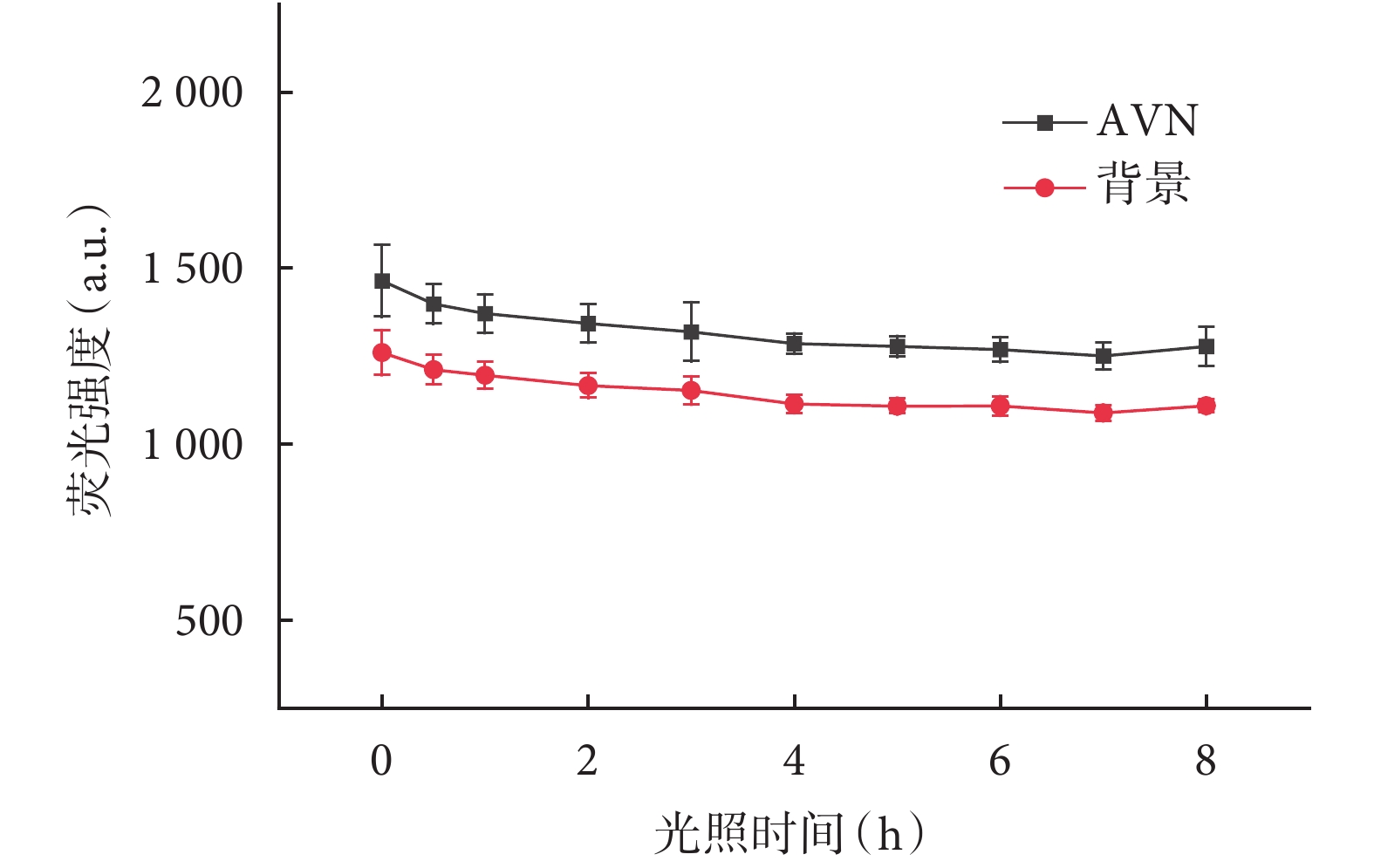 圖8
暴露時間與熒光強度關系
圖8
暴露時間與熒光強度關系
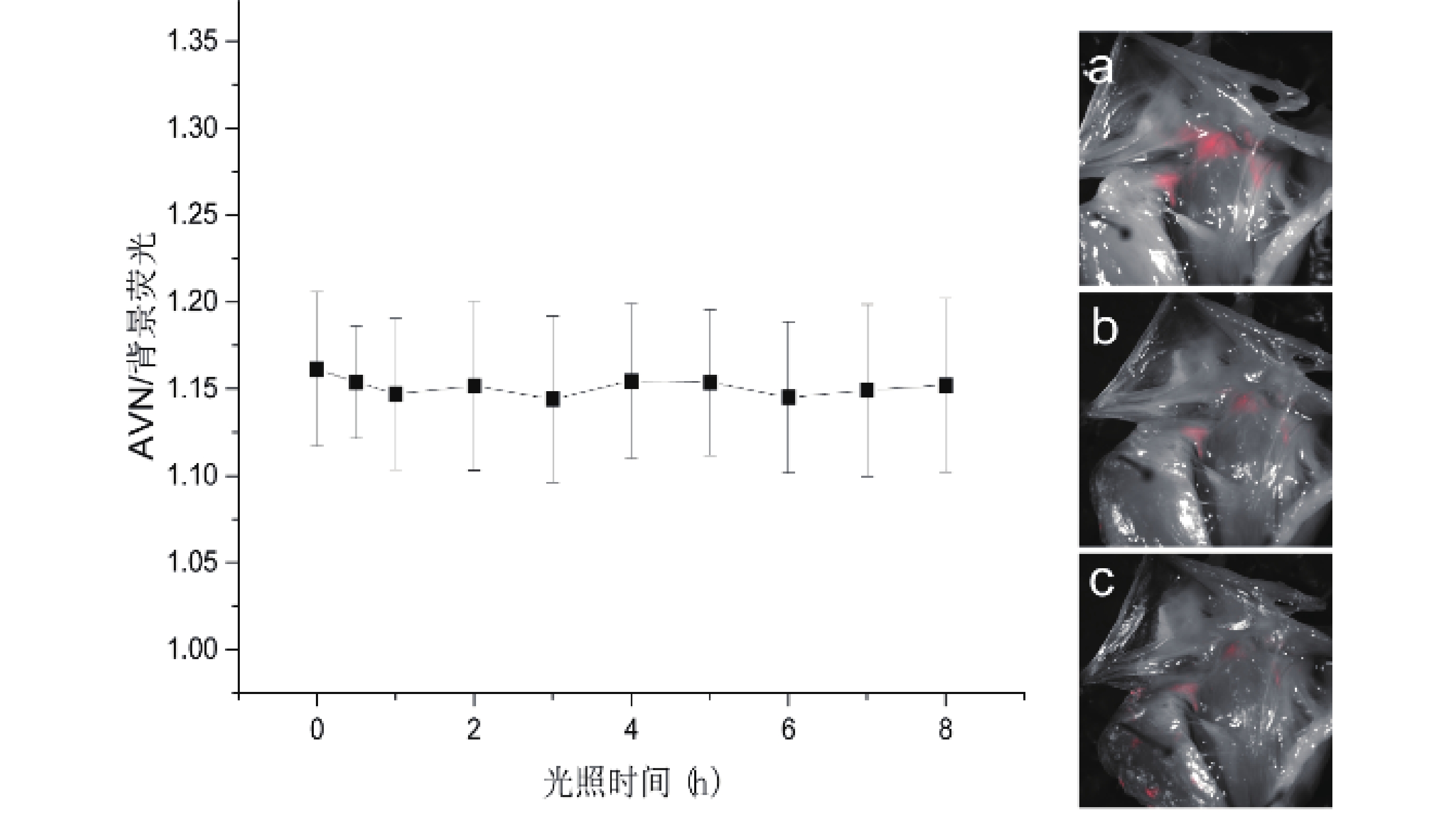 圖9
光照時間與AVN/背景熒光強度比值關系及成像圖
圖9
光照時間與AVN/背景熒光強度比值關系及成像圖
a~c:光照時間分別為0、3、8 h時AVN成像圖
3 討論
研究如何減少手術中心臟傳導組織的損傷對提高心臟外科手術預后具有極其重要的臨床意義。過去幾十年來出現了一些術中實時識別和定位CCS嘗試,例如,術中使用電阻抗測量和局部心電圖的方法[11-14]區分CCS及工作心肌,但其準確性不盡人意,并且有悖于心肌保護原則。近幾年的最新嘗試是使用光纖共聚焦顯微鏡(fibre-optic confocal microscopy,FCM)與直接應用于組織表面的非特異性熒光染料相結合,使用手持式FCM探頭,對心內膜下的組織進行成像[10,15]。但由于激光穿透深度的限制,僅能觀察位置較為表淺的SAN及AVN,而對于更為深層的結構,如AVB、BB等則不適用。
3.1 CCS經主動脈順行性灌注抗體標記的熒光染料的成像效果
本研究通過經主動脈順行性灌注以HCN4作為CCS特異性靶的抗體并進行熒光染色,能在體視熒光顯微鏡下觀察到房室交界區存在紅色熒信號聚集結構,該結構位于冠狀竇口與三尖瓣環之間,緊鄰三尖瓣環,沿心臟長軸徑長約2 mm。通過對該結構中的紅、綠熒光強度進行進一步的半定量分析,發現兩種熒光強度變化趨勢不一致,這提示在該結構內存在HCN4高表達而CX43低表達的特點,符合既往研究對CCS表型的描述[21-23]。為了進一步驗證出現在房室交界區的紅色熒光信號聚集結構性質,對免疫熒光染色石蠟切片和冰凍切片的圖像進行了組織學對比。兩種切片在相同位置均發現同樣HCN4高表達而表達Cx43低表達特點的結構。綜上認為,體式熒光顯微鏡下所見紅色熒光結構即為AVN,經主動脈順行性灌注抗體標記的熒光染料的方法能成功實現AVN的肉眼可視化。
3.2 抗體劑量和灌注時間對AVN成像質量的影響及光化學穩定性
隨著抗體劑量的增加,AVN與背景熒光強度均呈現上升趨勢,在3.75~7.5 μL之間可見一平臺期。但隨抗體劑量的增加,對成像質量的提升作用并不十分顯著。而灌注時間越長,成像質量卻越高。在本實驗的時間梯度內(1~8 h),比值的差異持續升高而未出現峰值,這表明抗原抗體結合反應仍不完全。同時也說明在本實驗中改變抗體劑量時AVN成像效果不一,可能與抗體灌注時間過短,抗體與抗原結合不充分有關。繼續延長反應時間讓抗原抗體反應充分,可能是進一步提升AVN成像質量的關鍵。
熒光染料原有的發光性可能會受損,出現熒光減弱的現象,即光漂白(photobleaching)[24]。為模擬在心內直視手術中無影燈照射的臨床場景中光漂白顯像的發生,使用LED臺燈對經主動脈灌注標記熒光的大鼠心臟房室交接區進行持續照射。本實驗中,隨著光照時間的延長,AVN及背景熒光信號均呈現下降趨勢,但二者下降幅度一致,因而AVN與背景熒光強度比值并未出現明顯下降,在8 h的持續光照后仍維持了一定的成像效果。在先心病兒童群體中,平均體外循環時間往往需1~3 h[25-26],光漂白實驗的結果說明Alexa Fluor 633的成像性能的維持時間足夠滿足絕大部分心臟手術。
3.3 抗體試劑的給藥方式
在心臟手術中使心臟停跳,大部分是通過在主動脈根部灌注停跳液的方式來實現的。經主動脈根部灌注的方式給藥具有藥物用量少和作用范圍局限,不進入全身血液循環的優點,因此本實驗設計之初選用此種方式進行給藥。但根據本實驗的實驗結果,抗原抗體充分結合以達到最佳成像效果的時間較長,遠遠超過了心臟手術本身的時間。此外,由于長時間的灌注,容易出現灌注不均勻的現象。因此,在活體動物中使用特異性抗體標記的熒光染料對CCS進行染色時,經主動脈給藥并不是合適的方法。但是,目前已有研究通過靜脈注射抗體標記的熒光染料的方法,成功實現了活體動物腫瘤病灶的實時熒光成像,并用于指導腫瘤病灶的完整切除[16-18]。經靜脈給藥的方式更為簡單,但抗體制劑的用量可能更大,在CCS活體熒光成像領域有待進一步研究。
3.4 創新性及局限性
本研究創新性地以HCN4作為CCS特異性靶點并進行熒光染色,成功在大標本中實現了AVN的可視化,初步證明了使用特異性抗體標記的熒光染料的可行性。本研究仍存在一定局限性。本研究使用標本為離體的大鼠心臟,并進行醛固定操作,BSA進行封閉,以及一抗和二抗進行熒光染色,處理過程繁雜、耗時長,在活體動物中抗體與CCS的結合能力以及成像效果未知。在圈選目標區域測定AVN及背景熒光強度時,其位置僅為大致范圍,測定數據并不精確,可能使實驗結果不準確。LED臺燈和無影燈的發光強度之間有較大的差距,用LED臺燈代替無影燈模擬光漂白顯像的發生,不足以模擬真實臨床場景,需要進一步研究。此外,本實驗樣本量少,可能造成實驗結果的偏差。
3.5 展望
本研究目前處于相對早期的階段,使用標本為離體標本,并未在活體動物上進行熒光成像,使用抗體標記的熒光染料進行CCS成像在活體動物中的成像效果以及臨床適用性仍有待探討。本研究是對CCS活體熒光成像領域的一次初步的探索,初步證明了使用特異性抗體標記的熒光染料的可行性。利用特異性靶點的方法在CCS可視化領域具有廣闊的臨床轉化前景。
本研究在體視熒光顯微鏡下,經主動脈順行性灌注抗體標記的熒光染料(Alexa Fluor 633)能成功對離體大鼠心臟CCS中的AVN進行成像。實驗結果表明:抗體劑量的增加,對AVN成像效果的影響并不顯著;抗體灌注時間越長,AVN的成像效果越好;Alexa Fluor 633在長時間(8 h)暴露于光照后,仍能維持一定的AVN顯影。
利益沖突:無。
作者貢獻:任一飛參與實驗實施、文章撰寫和修改;于鍇參與實驗設計和文章撰寫;干昌平對實驗的相關內容進行指導和進行論文修改。
心臟傳導系統(cardiac conduction system,CCS)是由特殊的心臟細胞組成,它們通過協調房室收縮來建立心臟的有律性跳動,其結構結構包括竇房結(sinoatrial node,SAN)、房室結(atrioventricular node,AVN)、房室束(atrioventricular bundle,AVB)、左右束支(bundle branch,BB)及浦肯野纖維(Purkinje fiber,PF)。由于CCS無法用肉眼識別,只能經驗性地借助一些解剖學標志來判斷CCS位置[1-3],因此在心內直視手術中常常被意外損傷,誘發心律失常。其中,傳導阻滯是最嚴重的心律失常類型,特別是在先心病的手術中[4-7]。這不僅會延長住院時間,而且存在植入起搏器的風險,給患者造成額外的痛苦和花費,同時會降低生活質量[8-9]。
為了減少手術中心臟傳導組織的損傷對提高心臟外科手術預后,既往研究[10-15]做了不少嘗試,但因準確性較差、顯像不充分而應用受限。活體熒光成像技術是利用抗體與抗原特異性結合的原理,將熒光染料標記上特異性抗體,來實現特定組織的特異性熒光顯像,常用于外科術中定位[16-18]。超極化激活的環核苷酸門控陽離子電流通道蛋白 4(hyperpolarization-activated cyclic nucleotide-gated channel,HCN4),是一種表達于膜表面離子通道蛋白,在傳導細胞和非傳導細胞中差異性表達,常作為組織切片免疫熒光的特異性靶點[19-20]。另外,連接蛋白(connexin,Cx)參與構成心肌細胞間的縫隙連接,不同亞型在不同心肌中表達存在差異:在SAN及AVN中觀察到Cx45高表達,Cx43低表達,在心房肌中Cx43大量表達Cx45低表達,Cx43常作為工作心肌的標記物[19-20]。以上標志物的表達差異,為其在CCS顯像中的應用提供了可能。
本研究擬利用HCN4作為CCS特異性靶點,使用針對該靶點熒光染料標記的抗體,通過模擬真實手術主動脈順行性灌注過程,對CCS的術中實時可視化方法的可行性及成像效果進行了初步的探究。?
1 材料與方法
1.1 主要實驗試劑
Mouse anti-connexin 43(Santa Cruz,美國);rabbit anti-HCN4(博奧森,中國);goat anti-mouse IgG(Alexa Fluor 405)(Thermo Fisher,美國);goat anti-rabbit IgG(Alexa Fluor 633)(Thermo Fisher,美國);goat anti-mouse IgG(TRITC)(Jackson,美國);goat anti-rabbit IgG(Alexa Fluor 647)(Jackson,美國);DAPI溶液(索萊寶,中國)。
1.2 主要實驗儀器
熒光體視顯微鏡(Leica M205 FCA,德國);數字切片掃描儀(Olympus,日本);圖像處理軟件(Leica,德國);OLYMPUS(Olympus,日本)。
1.3 實驗動物
雄性SPFSD大鼠,9~11周齡,體重350~400 g,購自成都達碩實驗動物有限公司,均在四川大學華西臨床醫學院/華西醫院實驗動物中心動物房進行飼養。實驗動物的飼養和處理遵循美國國立衛生研究院“護理和使用實驗室動物指南”(NIH Publication No.85-23)。實驗動物生產許可證號:SCXK(川)2020-0030。
1.4 實驗方法
1.4.1 離體大鼠心臟主動脈順行性灌注模型構建及預處理
使用異氟烷麻醉33只大鼠后,尾靜脈注射肝素鈉(100 IU/kg)全身肝素化。使用解剖剪逐層打開胸腔充分暴露心臟,迅速離斷各大血管(保留一定長度主動脈),完整取下大鼠心臟,使用預先準備的冰肝素鈉-生理鹽水稀釋液(12 500 U/100 mL)沖洗。將22G留置針經斷端插入主動脈近端管腔內并固定。排氣后將留置針通過輸液延長管連接注射器后固定于微量泵,以4 mL/min經主動脈-冠脈順行性灌注冰肝素-生理鹽水稀釋液,直至灌出液無明顯紅色。使用4%多聚甲醛溶液以4 mL/min灌注固定心臟10 min,PBS溶液(pH 7.2~7.4)灌洗30 min;5%BSA溶液以1 mL/min灌注封閉50 min,PBS溶液灌洗30 min,用于后續經主動脈灌注抗體溶液實驗。后續需石蠟切片免疫熒光實驗的心臟標本,使用4%多聚甲醛溶液以4 mL/min灌注固定心臟30 min后,浸泡于4%多聚甲醛溶液中4℃固定72 h。
1.4.2 劑量-熒光強度研究
一抗(rabbit anti-HCN4/Mouse anti-connexin 43)稀釋液灌注4 h后PBS灌洗30 min,二抗[goat anti-rabbit IgG(Alexa Fluor 633)/goat anti-mouse IgG(Alexa Fluor 405)]稀釋液灌注2 h后PBS灌洗30 min,流量固定為1 mL/min。使用體視熒光顯微鏡拍攝觀察。設置5組灌注劑量梯度,每組3只大鼠:一抗原液劑量2.5 μL/5μL,3.75 μL/7.5μL,5 μL/10μL,7.5 μL/15μL,10 μL/20μL。針對HCN4的一抗與二抗原液體積比例固定為1∶2,針對Cx43的一抗與二抗原液體積比例固定為1∶1。
1.4.3 時間-熒光強度研究
先后取劑量梯度為5 μL/10μL一抗原液稀釋液和10 μL/10μL二抗原液稀液灌注心臟,流量固定為1 mL/min。設置5組灌注時間梯度,每組3只大鼠:1 h/0.5 h,2 h/1 h,4 h/2 h,6 h/3 h,8 h/4 h。后使用體視熒光顯微鏡拍攝觀察。
1.4.4 光化學穩定性研究
先后取劑量梯度為5 μL/10μL一抗原液稀釋液和10 μL/10μL二抗原液稀液灌注3只大鼠心臟,流量固定為1 mL/min。灌注時間梯度設置為:4 h/2 h。灌注完成后解剖右心房及右室,暴露房室交界區心內膜面,使用LED臺燈連續光照,并分別在0 h、0.5 h、1 h、2 h、3 h、4 h、5 h、6 h、7 h、8 h后使用體視熒光顯微鏡拍攝觀察。
1.4.5 組織學對比驗證
為驗證離體大鼠心臟經主動脈順行性灌注抗體溶液后體視熒光顯微鏡下顯影結構的性質,將灌注后的大鼠心臟制作為冰凍切片,并取同一層面下石蠟切片進行標準的免疫熒光染色,于熒光顯微鏡下進行觀察比對。
將灌注后的大鼠心臟制作為冰凍切片,并取同一層面下石蠟切片進行標準的免疫熒光染色,于熒光顯微鏡下進行觀察比對。冰凍切片及石蠟切片使用Olympus VS200數字切片掃描儀采集圖像,圖像使用OLYMPUS OlyVIA V3.4.1軟件分析處理,石蠟切片與冰凍切片HCN4熒光信號設置為紅色,Cx43熒光信號設置為綠色。根據熒光強弱分析組織中HCN4與Cx43表達差異,傳導組織表達特定為HCN4高表達,Cx43低表達,以此標準識別傳導組織。
1.4.6 CCS熒光成像的分析
由于預實驗中CCS中的其它成分可視化效果不佳,并未按預期出現SAN、AVN下級的分支AVB和BB的顯影。故灌注完成后使用標本針固定大鼠心臟,解剖后置于熒光體式顯微鏡下,只觀察AVN:房-室交界區,并采集圖像。采集圖像后使用Leica Application Suite X軟件分析處理。房室交界區半定量熒光分析:(1)在冠狀竇與三尖瓣環之間,平行三尖瓣環作一直線段,橫穿紅色熒光聚集區域,測定該直線段路徑中的HCN4和Cx43熒光信號強度變化趨勢,在該直線段上每間隔0.1 mm計算HCN4/Cx43熒光強度比值,評估兩種熒光信號的差異性大小。(2)使用直徑為2 mm的圓形圈選房室交界區熒光最強處,視作AVN以測量該區域中的平均熒光強度,將圓圈外圍1 mm內區域熒光視作背景熒光,計算AVN與背景熒光強度比值評估成像質量,比值越大則認為成像質量越好。
1.5 統計學分析
數據統計分析使用 SPSS 25.0 統計軟件(SPSS Inc.,Chicago,IL,USA)完成,連續變量使用均數±標準差(x±s)描述。組間重復測量資料采用重復測量方差分析,多配對樣本資料采用Friedman非參數檢驗進行統計分析。P≤0.05為差異有統計學意義。
1.6 倫理審查
本實驗獲得四川大學華西醫院實驗動物倫理委員會審批同意,批件號:20220125001。
2 結果
2.1 房-室交界區成像
冠狀竇口與三尖瓣環之間為房室交界區(圖1a)。在體視熒光顯微鏡下,右房內房-室交界區可見一形狀不規則的HCN4紅色熒光信號聚集區域,沿心臟長軸徑長約2 mm(圖1b)。與明場重疊后可見該紅色熒光聚集結構位于冠狀竇口與三尖瓣環之間,緊鄰三尖瓣環(圖1d)。CX43綠色熒光信號在相同位置熒光信號略有聚集(圖1c)。
 圖1
房-室交界區熒光成像圖
圖1
房-室交界區熒光成像圖
a:明場;b:HCN4熒光信號;c:Cx43熒光信號;d:A+B疊加。SVC:上腔靜脈;IVC:下腔靜脈;黃色箭頭:冠狀竇口;黃色弧線:三尖瓣環;黃色方框示房-室交界區
在冠狀竇口與三尖瓣環之間,平行三尖瓣環作一直線段,橫穿紅色熒光聚集區域,測定該路徑中的HCN4和CX43熒光信號強度連續變化趨勢(圖2a)。在該路徑中從左至右,Cx43熒光信號強度在1.0~2.5 mm之間出現了下降的“波谷”,而在同一區間內,HCN4熒光信號強度則相對平穩,二者變化趨勢在該區間內不一致(圖2b)。通過比較HCN4/Cx43熒光強度比值變化,這種差異在1.5 mm處達到最大(圖2c)。這提示在該區域內存在HCN4高表達而CX43低表達的特點。
 圖2
選定路徑HCN4與Cx43熒光信號半定量分析
圖2
選定路徑HCN4與Cx43熒光信號半定量分析
a: 整體圖像呈鏡像翻轉,藍色直線為選定路徑
2.2 組織學對比驗證
為進一步探究經主動脈順行性灌注抗體溶液后在房室交界區出現的紅色熒光信號聚集結構的性質,取使用灌注法標記熒光后的大鼠心臟,沿心室長軸進行冰凍切片,顯露室間隔剖面于熒光顯微鏡下成像(圖3f),并與同一層面下的標準石蠟切片免疫熒光染色圖像進行對比(圖3a),分析兩種熒光染色方法下的組織學特點。
 圖3
大鼠心臟標準石蠟切片免疫熒光染色與經主動脈灌注熒光染色冰凍切片顯微圖
圖3
大鼠心臟標準石蠟切片免疫熒光染色與經主動脈灌注熒光染色冰凍切片顯微圖
a~e:石蠟切片;f~i:冰凍切片;b~e:A中紅色方框區域放大;g~h:F中紅色方框區域放大;RA:右心房;RV:右心室;LV:左心室;IVS:室間隔;黃色箭頭示三尖瓣及其附著緣
在標準石蠟切片免疫熒光染色圖像中,三尖瓣環上方的房室交界區心內膜下,可見一HCN4高表達而Cx43低表達的梭形區域,沿心臟長軸方向長度約2 mm,即為AVN(圖3b~c,e,白圈區域)。同一層面下的冰凍切片中,三尖瓣環上方心內膜下也出現了存在同樣Cx43的HCN4表達特點的結構(圖3g~i,白圈區域)。該結構與熒光體式顯微鏡下的紅色熒光信號聚集結構位置一致,均位于三尖瓣環上方且緊鄰三尖瓣瓣環。
此外,通過對冰凍切片的整體觀察,發現切片上存在大小及形狀不一的片狀熒光暗區,熒光信號呈現不均勻狀態(圖3f)。
2.3 劑量-熒光強度研究
當一抗(anti-HCN4)劑量為2.5 μL時,AVN及背景熒光強度分別為717.32±57.82和673.06±35.07,隨著一抗劑量的增加,AVN與背景熒光強度均出現升高,后續劑量梯度組與2.5 μL組比較,均存在統計學差異(P<0.05)。3.75~7.5 μL之間出現一平臺期,7.5 μL組與3.75 μL組和5 μL組比較無統計差異(P>0.05,圖4)。AVN/背景熒光強度比值各組間比較變化均差異無統計學意義(P>0.05),不同劑量抗體下,成像質量不一(圖5)。
 圖4
不同一抗劑量下熒光強度變化趨勢
圖4
不同一抗劑量下熒光強度變化趨勢
與2.5 μL組比較, */#:
 圖5
不同一抗劑量下AVN/背景熒光變化趨勢及成像圖
圖5
不同一抗劑量下AVN/背景熒光變化趨勢及成像圖
a~c:劑量分別為2.5、5、10 μL時AVN成像圖
2.4 時間-熒光強度研究
當灌注時間為1 h時,AVN及背景熒光強度分別為619.84±34.19和603.67±20.84,隨著一抗灌注時間的增加,AVN與背景熒光強度均上升,抗體灌注時間越長,AVN與背景熒光強度越大,各時間梯度組間比較均具有統計學差異(P<0.05,圖6)。AVN/背景熒光強度比值隨灌注時間的增加而增大,除1 h組和2 h組差異無統計學意義外(P>0.05),其余各組均存在統計學差異(P<0.05),比值在研究范圍內于8 h處達最大,成像質量最佳(圖7)。
 圖6
不同一抗灌注時間熒光強度變化趨勢
圖6
不同一抗灌注時間熒光強度變化趨勢
與1 h組比較, */#:
 圖7
不同一抗灌注時間AVN/背景熒光變化趨勢及成像圖
圖7
不同一抗灌注時間AVN/背景熒光變化趨勢及成像圖
a~c:灌注時間分別為1、4、8 h時AVN成像圖;與1 h組比較,*:
2.5 光穩定性研究
將灌注后標記熒光的心臟標本解剖后,暴露于LED臺燈光照下模擬手術室無影燈光源照射,探究熒光穩定性。隨光照時間的延長,AVN熒光強度出現下降趨勢(P<0.05),背景熒光強度出現下降趨勢(P<0.05,圖8)。AVN與背景熒光強度比值隨光照時間的延長變化差異無統計學意義(P>0.05),房室交界區在經過長達8 h光照后,仍能維持一定程度顯影(圖9)。
 圖8
暴露時間與熒光強度關系
圖8
暴露時間與熒光強度關系
 圖9
光照時間與AVN/背景熒光強度比值關系及成像圖
圖9
光照時間與AVN/背景熒光強度比值關系及成像圖
a~c:光照時間分別為0、3、8 h時AVN成像圖
3 討論
研究如何減少手術中心臟傳導組織的損傷對提高心臟外科手術預后具有極其重要的臨床意義。過去幾十年來出現了一些術中實時識別和定位CCS嘗試,例如,術中使用電阻抗測量和局部心電圖的方法[11-14]區分CCS及工作心肌,但其準確性不盡人意,并且有悖于心肌保護原則。近幾年的最新嘗試是使用光纖共聚焦顯微鏡(fibre-optic confocal microscopy,FCM)與直接應用于組織表面的非特異性熒光染料相結合,使用手持式FCM探頭,對心內膜下的組織進行成像[10,15]。但由于激光穿透深度的限制,僅能觀察位置較為表淺的SAN及AVN,而對于更為深層的結構,如AVB、BB等則不適用。
3.1 CCS經主動脈順行性灌注抗體標記的熒光染料的成像效果
本研究通過經主動脈順行性灌注以HCN4作為CCS特異性靶的抗體并進行熒光染色,能在體視熒光顯微鏡下觀察到房室交界區存在紅色熒信號聚集結構,該結構位于冠狀竇口與三尖瓣環之間,緊鄰三尖瓣環,沿心臟長軸徑長約2 mm。通過對該結構中的紅、綠熒光強度進行進一步的半定量分析,發現兩種熒光強度變化趨勢不一致,這提示在該結構內存在HCN4高表達而CX43低表達的特點,符合既往研究對CCS表型的描述[21-23]。為了進一步驗證出現在房室交界區的紅色熒光信號聚集結構性質,對免疫熒光染色石蠟切片和冰凍切片的圖像進行了組織學對比。兩種切片在相同位置均發現同樣HCN4高表達而表達Cx43低表達特點的結構。綜上認為,體式熒光顯微鏡下所見紅色熒光結構即為AVN,經主動脈順行性灌注抗體標記的熒光染料的方法能成功實現AVN的肉眼可視化。
3.2 抗體劑量和灌注時間對AVN成像質量的影響及光化學穩定性
隨著抗體劑量的增加,AVN與背景熒光強度均呈現上升趨勢,在3.75~7.5 μL之間可見一平臺期。但隨抗體劑量的增加,對成像質量的提升作用并不十分顯著。而灌注時間越長,成像質量卻越高。在本實驗的時間梯度內(1~8 h),比值的差異持續升高而未出現峰值,這表明抗原抗體結合反應仍不完全。同時也說明在本實驗中改變抗體劑量時AVN成像效果不一,可能與抗體灌注時間過短,抗體與抗原結合不充分有關。繼續延長反應時間讓抗原抗體反應充分,可能是進一步提升AVN成像質量的關鍵。
熒光染料原有的發光性可能會受損,出現熒光減弱的現象,即光漂白(photobleaching)[24]。為模擬在心內直視手術中無影燈照射的臨床場景中光漂白顯像的發生,使用LED臺燈對經主動脈灌注標記熒光的大鼠心臟房室交接區進行持續照射。本實驗中,隨著光照時間的延長,AVN及背景熒光信號均呈現下降趨勢,但二者下降幅度一致,因而AVN與背景熒光強度比值并未出現明顯下降,在8 h的持續光照后仍維持了一定的成像效果。在先心病兒童群體中,平均體外循環時間往往需1~3 h[25-26],光漂白實驗的結果說明Alexa Fluor 633的成像性能的維持時間足夠滿足絕大部分心臟手術。
3.3 抗體試劑的給藥方式
在心臟手術中使心臟停跳,大部分是通過在主動脈根部灌注停跳液的方式來實現的。經主動脈根部灌注的方式給藥具有藥物用量少和作用范圍局限,不進入全身血液循環的優點,因此本實驗設計之初選用此種方式進行給藥。但根據本實驗的實驗結果,抗原抗體充分結合以達到最佳成像效果的時間較長,遠遠超過了心臟手術本身的時間。此外,由于長時間的灌注,容易出現灌注不均勻的現象。因此,在活體動物中使用特異性抗體標記的熒光染料對CCS進行染色時,經主動脈給藥并不是合適的方法。但是,目前已有研究通過靜脈注射抗體標記的熒光染料的方法,成功實現了活體動物腫瘤病灶的實時熒光成像,并用于指導腫瘤病灶的完整切除[16-18]。經靜脈給藥的方式更為簡單,但抗體制劑的用量可能更大,在CCS活體熒光成像領域有待進一步研究。
3.4 創新性及局限性
本研究創新性地以HCN4作為CCS特異性靶點并進行熒光染色,成功在大標本中實現了AVN的可視化,初步證明了使用特異性抗體標記的熒光染料的可行性。本研究仍存在一定局限性。本研究使用標本為離體的大鼠心臟,并進行醛固定操作,BSA進行封閉,以及一抗和二抗進行熒光染色,處理過程繁雜、耗時長,在活體動物中抗體與CCS的結合能力以及成像效果未知。在圈選目標區域測定AVN及背景熒光強度時,其位置僅為大致范圍,測定數據并不精確,可能使實驗結果不準確。LED臺燈和無影燈的發光強度之間有較大的差距,用LED臺燈代替無影燈模擬光漂白顯像的發生,不足以模擬真實臨床場景,需要進一步研究。此外,本實驗樣本量少,可能造成實驗結果的偏差。
3.5 展望
本研究目前處于相對早期的階段,使用標本為離體標本,并未在活體動物上進行熒光成像,使用抗體標記的熒光染料進行CCS成像在活體動物中的成像效果以及臨床適用性仍有待探討。本研究是對CCS活體熒光成像領域的一次初步的探索,初步證明了使用特異性抗體標記的熒光染料的可行性。利用特異性靶點的方法在CCS可視化領域具有廣闊的臨床轉化前景。
本研究在體視熒光顯微鏡下,經主動脈順行性灌注抗體標記的熒光染料(Alexa Fluor 633)能成功對離體大鼠心臟CCS中的AVN進行成像。實驗結果表明:抗體劑量的增加,對AVN成像效果的影響并不顯著;抗體灌注時間越長,AVN的成像效果越好;Alexa Fluor 633在長時間(8 h)暴露于光照后,仍能維持一定的AVN顯影。
利益沖突:無。
作者貢獻:任一飛參與實驗實施、文章撰寫和修改;于鍇參與實驗設計和文章撰寫;干昌平對實驗的相關內容進行指導和進行論文修改。