引用本文: 周子秦, 黃陶然, 乃吉木丁·阿布都熱西提, 張勇, 袁海云, 謝年謹, 費洪文, 劉輝, 莊建, 陳寄梅, 溫樹生. 國產自膨式介入肺動脈瓣支架經胸植入術治療肺動脈瓣反流的前瞻性隊列研究. 中國胸心血管外科臨床雜志, 2024, 31(9): 1305-1312. doi: 10.7507/1007-4848.202312046 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
包括法洛四聯癥、右心室雙出口、肺動脈閉鎖合并室間隔缺損在內的一些合并圓椎動脈干畸形的先天性心臟病在接受初次手術治療后常發生右心室流出道功能障礙。右心室流出道功能障礙表現為肺動脈反流或狹窄,其中肺動脈瓣反流患者常常表現為長期慢性右心室容量負荷過重導致的右心室擴張、重塑、功能障礙,最終引起終末期心力衰竭、心律失常和心源性猝死[1-2]。經導管肺動脈瓣植入術(transcatheter pulmonary valve implantation,TPVI)是目前這些患者的標準治療方法,可有效改善右心室擴張和功能障礙,緩解癥狀[3-5]。目前臨床實踐中,主要應用兩款國外生產的瓣膜,分別是Melody瓣膜(美敦力)和Sapien 瓣膜(愛德華茲生命科學)[3,6-7]。這兩款瓣膜主要應用于通過同種移植或者帶瓣管道重建右心室流出道患者。然而,在我國有很大一部分患者使用跨瓣環補片的方式重建右心室流出道,這部分患者右心室流出道直徑往往超出目前臨床實踐中可用瓣膜的范圍[8-9]。介入肺動脈瓣支架(SalusTM)是針對這一問題研發的新型自膨式國產瓣膜支架,其采用非體外循環下經胸微創切口入路。我們團隊于2022年[10]報道了首批接受自膨式介入肺動脈瓣支架經胸植入術患者的早期結果。本研究的目的是評估介入肺動脈瓣支架(SalusTM)的中期安全性和有效性。
1 資料與方法
1.1 臨床資料
這是一項前瞻性臨床研究。納入標準:(1)2021年9月2日—2023年7月18日在本中心接受治療的先天性心臟病術后出現中重度肺動脈瓣反流患者;(2)年齡≥14歲;(3)患者有右心室流出道功能不全相關癥狀,包括運動耐量下降、呼吸困難、暈厥、心悸或患者無癥狀但有以下任意一種情況:中度以上功能性三尖瓣反流;右心室舒張末期容積指數(right ventricular end-diastolic volume index,RVEDVI)≥130 mL/m2;右心室射血分數<45%;QRS波寬度≥160 ms;持續性房性或室性心律失常;(4)肺動脈平均壓≤30 mm Hg(1 mm Hg=0.133 kPa);(5)主肺動脈內徑≥16 mm,主肺動脈長度≥20 mm。排除標準:(1)肺動脈高壓(平均壓>30 mm Hg)或存在以下解剖學評估不適合的情況:右心室流出道位置異常;或冠狀動脈畸形或術前檢查提示有壓迫冠狀動脈的風險;或合并其他心臟畸形需同期行心臟手術;(2)急性代償性心力衰竭;(3)感染性心內膜炎;(4)對阿司匹林或肝素、鎳鈦合金、造影劑及相關成分過敏或抵抗;(5)預期壽命<1年;(6)孕婦、哺乳期女性或試驗期間有妊娠計劃者。
1.2 手術方法
手術在全身麻醉、非體外循環下進行。一般采用劍突下小切口(2.5~5.0 cm)開胸,分離心包粘連,游離出升主動脈與主肺動脈。全身肝素化后,經股靜脈穿刺植入導絲、造影導管,行右心室及肺動脈造影,并結合食管超聲結果來明確肺動脈直徑、長度及形狀并選擇適合型號的瓣膜支架。在右心室表面縫合荷包,經荷包縫合口穿刺植入導絲、擴張條。導絲推入至肺動脈遠端后,植入鞘管至肺動脈分叉前,穩定后緩慢釋放支架。支架完全釋放后,食管超聲評估位置正常、無瓣周漏。隨后退出輸送鞘后再次造影,確認位置正常,無瓣周漏。退出股靜脈造影導絲。右心室荷包收緊打結,局部止血,分層縫合切口。
1.3 瓣膜基本情況
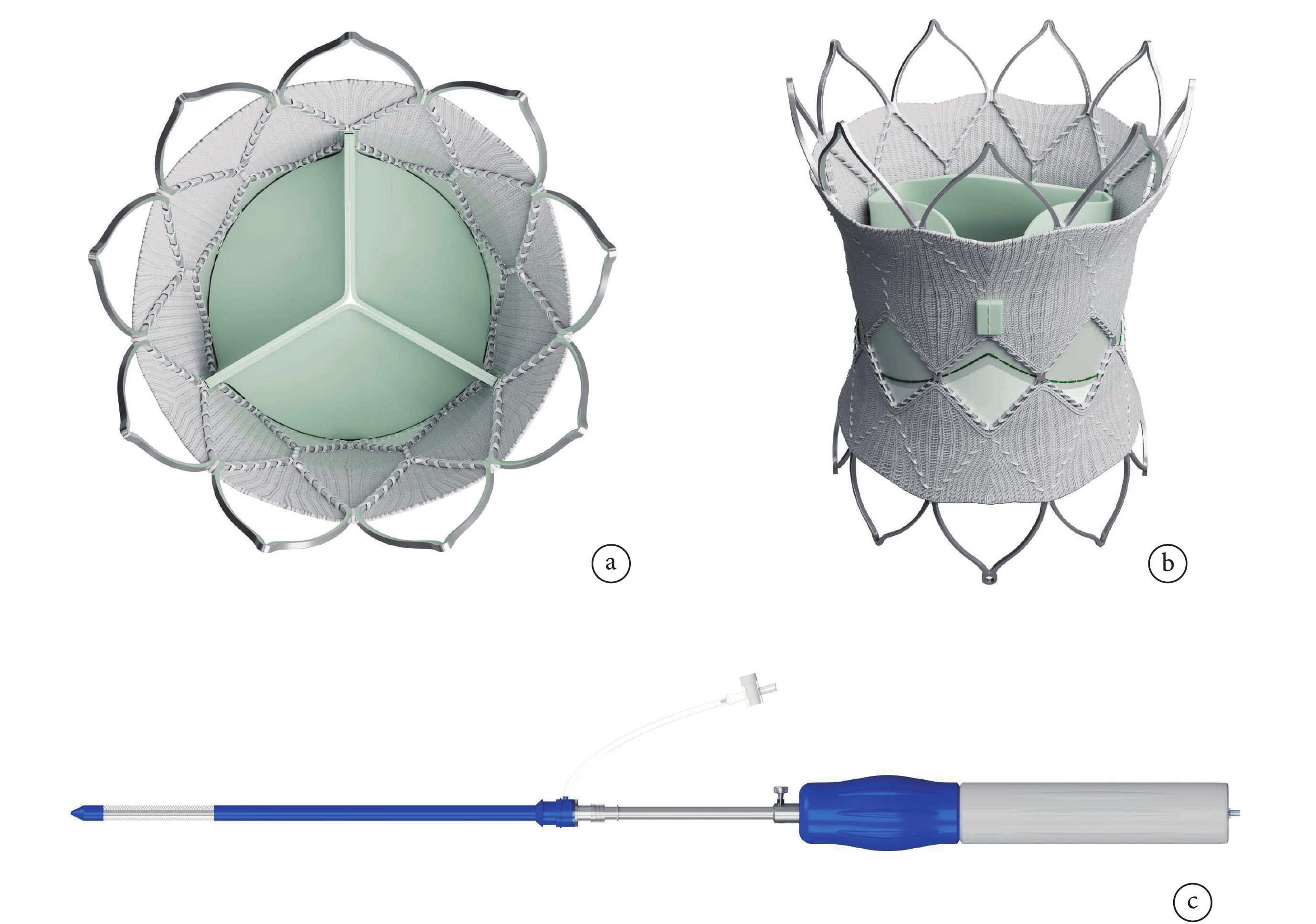
手術采用SalusTM介入肺動脈瓣及其輸送系統(圖1)。其由一個鎳鈦合金支架和一個三葉牛心包組織構成。瓣膜共8個型號,直徑22~36 mm。
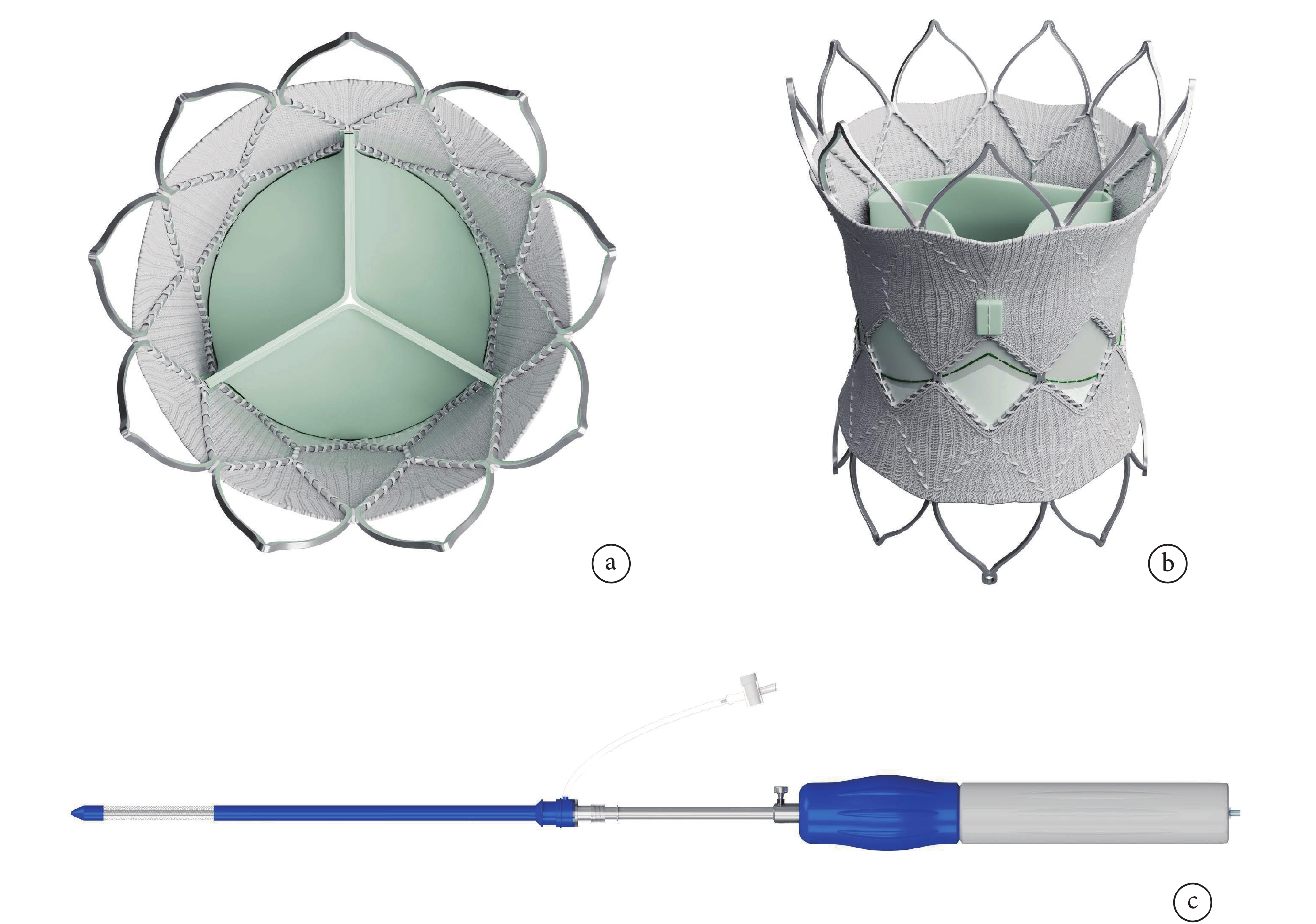 圖1
SalusTM介入肺動脈瓣及其輸送裝置
圖1
SalusTM介入肺動脈瓣及其輸送裝置
a:三葉牛心包組織;b:鎳鈦合金支架;c:輸送裝置
1.4 資料收集與隨訪
術前、隨訪1、6和12個月時行臨床評估、胸部X線片、心電圖和經胸超聲心動圖檢查。在術前和隨訪12個月時進行多層計算機斷層掃描(CT)和心臟磁共振成像檢查。主要不良結局包括隨訪期間死亡、再次手術、復發重度肺動脈瓣反流。
超聲心動圖檢查評價肺動脈瓣反流嚴重程度的標準[11]為:(1)輕度反流定義為起始部反流束寬度與肺動脈內徑的比值<25%;(2)中度反流定義為起始部反流束寬度與肺動脈內徑的比值在26%~50%范圍內;(3)重度反流定義為起始部反流束寬度與肺動脈內徑的比值>50%。評價三尖瓣反流嚴重程度的標準為:(1)輕度三尖瓣反流定義為反流束面積與右心房面積之比<20%,反流束長度<1.4 cm;(2)中度三尖瓣反流定義為面積之比20%~40%,反流束長度 1.4~3.0 cm;(3)重度三尖瓣反流定義為面積之比>40%,反流束長度>3.0 cm。
1.5 統計學分析
分類變量以頻數(百分比)描述;符合正態分布的連續性變量以均數±標準差(x±s)描述;不符合正態分布的連續變量以中位數(上下四分位數)[M(P25,P75)]描述。按照資料類型,術前與術后臨床資料比較分別采用配對t檢驗、McNemar’s檢驗和Wilcoxon符號秩檢驗。檢驗水準α=0.05。所用統計分析軟件為SPSS 24.0。
1.6 倫理審查
本研究按照《赫爾辛基宣言》中概述的原則進行,并獲廣東省人民醫院醫學倫理委員會批準,倫理審批號:QX2021-011-02。所有參與者均提供針對研究的書面知情同意書。
2 結果
2.1 患者基線特征
共納入38例患者,平均年齡(24.08±8.12)歲,平均體重(57.66±13.54)kg。其中男23例(60.5%)、女15例(39.5%)。33例為法洛四聯癥矯治術后,3例為肺動脈閉鎖矯治術后,1例為右心室雙出口矯治術后,1例為肺動脈狹窄矯治術后。有7例(18.4%)術前紐約心臟協會心功能分級為Ⅲ級,其余患者均為Ⅱ級。另有23例(60.5%)存在不同程度的心力衰竭癥狀表現,如胸悶、胸痛、氣促等(表1)。
2.2 圍術期結果
全組患者均成功行自膨式介入肺動脈瓣支架植入術,手術時間(173.55±70.43)min(表1)。3例(7.9%)患者術中出現瓣膜支架移位,隨后立刻在體外循環支持下完成瓣膜支架復位。術中無其他不良事件發生。患者術后中位機械通氣時間為265.00(141.25,440.00)min,術后中位ICU治療時間23.00(20.44,39.38)h(表1)。術后住院期間:1例(2.6%)患者出現下壁心肌梗死,CT檢查排除冠狀動脈壓迫可能,予以硝酸甘油對癥治療后轉歸消失,隨訪期間未再復發;1例(2.6%)患者出現術后傷口愈合不良,經過多次換藥清創后轉歸消失。
2.3 隨訪結果
所有患者中位隨訪時間12.00(6.00,17.50)個月。隨訪期間,無死亡或再干預患者,無復發重度肺動脈瓣反流。術后6個月與基線比較,右心房上下徑(P<0.001)、右心室上下徑(P=0.001)、下腔靜脈內徑(P<0.001)和三尖瓣環收縮期位移(P<0.001)顯著縮短,三尖瓣反流程度和肺動脈瓣反流程度顯著改善(P<0.05)(表2~3)。截至目前,有20例患者完成術后1年的隨訪(另外18例術后未滿1年)。與術前比較,心臟磁共振測RVEDVI(P<0.001)、右心室收縮末期容積指數(right ventricular end-systolic volume index,RVESVI)(P=0.001)以及右心室上下徑(P=0.006)顯著降低或減小,肺動脈瓣反流程度顯著改善(P<0.001),但三尖瓣反流程度差異無統計學意義(P=0.550)(表4)。1例(2.6%)出現雙側氣胸,未經治療轉歸消失。3例(7.9%)出現胸悶、胸痛,予以強心利尿藥改善心功能,其中1例(2.6%)癥狀轉歸消失,另外2例(5.3%)癥狀持續存在。1例(2.6%)出現頻發性室性早搏,未經治療轉歸消失(表5)。
3 討論
右心室流出道功能不全患者需要在發生不可逆性右心室擴張或心功能惡化前接受肺動脈瓣置換[12]。以法洛四聯癥根治術后患者為例,Cuypers等[1]報道144例患者35年內肺動脈瓣置換的累計發生率為44%。臨床試驗[3, 13-14]證明,TPVI 安全性和有效性均佳。然而,目前臨床常用的兩種經導管肺動脈瓣支架(Melody和Sapien)均為球囊擴張瓣膜支架,僅推薦用于治療同種移植物或者帶瓣管道重建的右心室流出道[8-9]。這并不適用于國內許多右心室流出道功能不全患者,因為大部分患者采用跨瓣環補片技術重建右心室流出道,這兩種瓣膜系統不足以在擴張的原生右心室流出道內維持穩定。因此,自膨式肺動脈瓣支架系統應運而生。
國內外目前已有多款自膨式肺動脈瓣膜支架正在投入臨床試驗或應用。較早的一款國外研發的自膨式肺動脈瓣支架(Pulsta)由Kim等[15]報道應用,隨后是國內的兩種支架(Venus P-valve和PT-valve),其在早期臨床試驗中均表現出良好的安全性和有效性[16-17]。本研究應用的是北京佰仁公司研發生產的SalusTM介入肺動脈瓣支架系統。其采用經胸入路,優勢在于操作更簡便,定位更準確。Virk 等[18]的一項Meta分析結果顯示TPVI瓣膜移位發生率為2.4%。Morgan等[17]的研究中,37例經皮介入肺動脈瓣支架植入術中有2例(5.4%)患者發生瓣膜支架遷移而導致二次手術;與之相比,本研究中有3例患者發生術中瓣膜支架遷移,但立刻在術中建立體外循環,完成瓣膜復位,有效避免二次手術。不僅如此,經胸入路可在同期行肺動脈環縮術以避免或減輕瓣周漏。冠狀動脈受壓迫是圍術期最嚴重并發癥,可導致患者術中死亡[3]。其主要原因是復雜先天性心臟病常合并冠狀動脈發育異常或者矯治術后改變了冠狀動脈與主肺動脈的位置關系。本試驗中所有患者在入組前均行冠狀動脈CT檢查,提前評估主要血管的毗鄰關系以避免冠狀動脈受壓的發生。本研究所有患者均成功行自膨式介入肺動脈瓣支架植入術,且圍術期未出現冠狀動脈壓迫、支架斷裂、心律失常、血栓形成等嚴重并發癥。
本研究在12個月(中位數)的隨訪期間里,無死亡患者或者再干預患者。有研究[19]表明,在大約1年、2年和4年的隨訪期間,TPVI后再次干預的發生率分別低于10%、20%和30%。感染性心內膜炎是TPVI患者術后中遠期的重要并發癥。一項多中心前瞻性研究[20]結果顯示,TPVI患者術后5年感染性心內膜炎累計發生率為11%。一旦發生該并發癥,多數患者需要再次干預。本研究嚴格按照人工瓣膜感染性心內膜炎指南建議,預防性使用抗生素,圍術期以及術后隨訪期間沒有發生相關并發癥[21]。然而,感染性心內膜炎往往發生于術后中遠期,本研究隨訪時間較短,需要更長隨訪時間才能評估經胸入路患者與TPVI患者術后發生感染性心內膜炎的差異。術后6個月和術后12個月,超聲心動圖檢查顯示肺動脈瓣功能改善維持良好,無重度肺動脈瓣反流復發。心臟磁共振結果顯示,與基線資料相比,術后RVEDVI和RVESVI顯著降低,提示患者右心室發生重塑,心功能顯著改善。這與其他經導管肺動脈瓣支架系統治療右心室流出道功能不全患者獲得的早中期結果相似[6,13,17,22]。
綜上所述,自膨式介入肺動脈瓣支架經胸植入術治療重度肺動脈瓣反流患者安全、有效,顯示出良好的術后1年臨床和血流動力學結果。本研究的局限性在于單中心,小樣本量;其長期治療效果也需要更長的隨訪時間來觀察。
利益沖突:無。
作者貢獻:周子秦負責研究設計,資料收集、分析,初稿撰寫;黃陶然負責資料收集;乃吉木丁·阿布都熱西提負責文獻檢索;張勇、袁海云、謝年謹、費洪文、劉輝參與資料收集;莊建與陳寄梅修改論文,提出重要的建設性意見;溫樹生負責研究設計,修改論文;所有作者均同意論文發表。
致謝 感謝吳倩、馮佳慧兩位臨床協調員為本研究做出的貢獻。感謝廣東省人民醫院先心病病區、心外ICU及介入導管室相關醫務人員對本研究的支持與貢獻。
包括法洛四聯癥、右心室雙出口、肺動脈閉鎖合并室間隔缺損在內的一些合并圓椎動脈干畸形的先天性心臟病在接受初次手術治療后常發生右心室流出道功能障礙。右心室流出道功能障礙表現為肺動脈反流或狹窄,其中肺動脈瓣反流患者常常表現為長期慢性右心室容量負荷過重導致的右心室擴張、重塑、功能障礙,最終引起終末期心力衰竭、心律失常和心源性猝死[1-2]。經導管肺動脈瓣植入術(transcatheter pulmonary valve implantation,TPVI)是目前這些患者的標準治療方法,可有效改善右心室擴張和功能障礙,緩解癥狀[3-5]。目前臨床實踐中,主要應用兩款國外生產的瓣膜,分別是Melody瓣膜(美敦力)和Sapien 瓣膜(愛德華茲生命科學)[3,6-7]。這兩款瓣膜主要應用于通過同種移植或者帶瓣管道重建右心室流出道患者。然而,在我國有很大一部分患者使用跨瓣環補片的方式重建右心室流出道,這部分患者右心室流出道直徑往往超出目前臨床實踐中可用瓣膜的范圍[8-9]。介入肺動脈瓣支架(SalusTM)是針對這一問題研發的新型自膨式國產瓣膜支架,其采用非體外循環下經胸微創切口入路。我們團隊于2022年[10]報道了首批接受自膨式介入肺動脈瓣支架經胸植入術患者的早期結果。本研究的目的是評估介入肺動脈瓣支架(SalusTM)的中期安全性和有效性。
1 資料與方法
1.1 臨床資料
這是一項前瞻性臨床研究。納入標準:(1)2021年9月2日—2023年7月18日在本中心接受治療的先天性心臟病術后出現中重度肺動脈瓣反流患者;(2)年齡≥14歲;(3)患者有右心室流出道功能不全相關癥狀,包括運動耐量下降、呼吸困難、暈厥、心悸或患者無癥狀但有以下任意一種情況:中度以上功能性三尖瓣反流;右心室舒張末期容積指數(right ventricular end-diastolic volume index,RVEDVI)≥130 mL/m2;右心室射血分數<45%;QRS波寬度≥160 ms;持續性房性或室性心律失常;(4)肺動脈平均壓≤30 mm Hg(1 mm Hg=0.133 kPa);(5)主肺動脈內徑≥16 mm,主肺動脈長度≥20 mm。排除標準:(1)肺動脈高壓(平均壓>30 mm Hg)或存在以下解剖學評估不適合的情況:右心室流出道位置異常;或冠狀動脈畸形或術前檢查提示有壓迫冠狀動脈的風險;或合并其他心臟畸形需同期行心臟手術;(2)急性代償性心力衰竭;(3)感染性心內膜炎;(4)對阿司匹林或肝素、鎳鈦合金、造影劑及相關成分過敏或抵抗;(5)預期壽命<1年;(6)孕婦、哺乳期女性或試驗期間有妊娠計劃者。
1.2 手術方法
手術在全身麻醉、非體外循環下進行。一般采用劍突下小切口(2.5~5.0 cm)開胸,分離心包粘連,游離出升主動脈與主肺動脈。全身肝素化后,經股靜脈穿刺植入導絲、造影導管,行右心室及肺動脈造影,并結合食管超聲結果來明確肺動脈直徑、長度及形狀并選擇適合型號的瓣膜支架。在右心室表面縫合荷包,經荷包縫合口穿刺植入導絲、擴張條。導絲推入至肺動脈遠端后,植入鞘管至肺動脈分叉前,穩定后緩慢釋放支架。支架完全釋放后,食管超聲評估位置正常、無瓣周漏。隨后退出輸送鞘后再次造影,確認位置正常,無瓣周漏。退出股靜脈造影導絲。右心室荷包收緊打結,局部止血,分層縫合切口。
1.3 瓣膜基本情況
手術采用SalusTM介入肺動脈瓣及其輸送系統(圖1)。其由一個鎳鈦合金支架和一個三葉牛心包組織構成。瓣膜共8個型號,直徑22~36 mm。
 圖1
SalusTM介入肺動脈瓣及其輸送裝置
圖1
SalusTM介入肺動脈瓣及其輸送裝置
a:三葉牛心包組織;b:鎳鈦合金支架;c:輸送裝置
1.4 資料收集與隨訪
術前、隨訪1、6和12個月時行臨床評估、胸部X線片、心電圖和經胸超聲心動圖檢查。在術前和隨訪12個月時進行多層計算機斷層掃描(CT)和心臟磁共振成像檢查。主要不良結局包括隨訪期間死亡、再次手術、復發重度肺動脈瓣反流。
超聲心動圖檢查評價肺動脈瓣反流嚴重程度的標準[11]為:(1)輕度反流定義為起始部反流束寬度與肺動脈內徑的比值<25%;(2)中度反流定義為起始部反流束寬度與肺動脈內徑的比值在26%~50%范圍內;(3)重度反流定義為起始部反流束寬度與肺動脈內徑的比值>50%。評價三尖瓣反流嚴重程度的標準為:(1)輕度三尖瓣反流定義為反流束面積與右心房面積之比<20%,反流束長度<1.4 cm;(2)中度三尖瓣反流定義為面積之比20%~40%,反流束長度 1.4~3.0 cm;(3)重度三尖瓣反流定義為面積之比>40%,反流束長度>3.0 cm。
1.5 統計學分析
分類變量以頻數(百分比)描述;符合正態分布的連續性變量以均數±標準差(x±s)描述;不符合正態分布的連續變量以中位數(上下四分位數)[M(P25,P75)]描述。按照資料類型,術前與術后臨床資料比較分別采用配對t檢驗、McNemar’s檢驗和Wilcoxon符號秩檢驗。檢驗水準α=0.05。所用統計分析軟件為SPSS 24.0。
1.6 倫理審查
本研究按照《赫爾辛基宣言》中概述的原則進行,并獲廣東省人民醫院醫學倫理委員會批準,倫理審批號:QX2021-011-02。所有參與者均提供針對研究的書面知情同意書。
2 結果
2.1 患者基線特征
共納入38例患者,平均年齡(24.08±8.12)歲,平均體重(57.66±13.54)kg。其中男23例(60.5%)、女15例(39.5%)。33例為法洛四聯癥矯治術后,3例為肺動脈閉鎖矯治術后,1例為右心室雙出口矯治術后,1例為肺動脈狹窄矯治術后。有7例(18.4%)術前紐約心臟協會心功能分級為Ⅲ級,其余患者均為Ⅱ級。另有23例(60.5%)存在不同程度的心力衰竭癥狀表現,如胸悶、胸痛、氣促等(表1)。
2.2 圍術期結果
全組患者均成功行自膨式介入肺動脈瓣支架植入術,手術時間(173.55±70.43)min(表1)。3例(7.9%)患者術中出現瓣膜支架移位,隨后立刻在體外循環支持下完成瓣膜支架復位。術中無其他不良事件發生。患者術后中位機械通氣時間為265.00(141.25,440.00)min,術后中位ICU治療時間23.00(20.44,39.38)h(表1)。術后住院期間:1例(2.6%)患者出現下壁心肌梗死,CT檢查排除冠狀動脈壓迫可能,予以硝酸甘油對癥治療后轉歸消失,隨訪期間未再復發;1例(2.6%)患者出現術后傷口愈合不良,經過多次換藥清創后轉歸消失。
2.3 隨訪結果
所有患者中位隨訪時間12.00(6.00,17.50)個月。隨訪期間,無死亡或再干預患者,無復發重度肺動脈瓣反流。術后6個月與基線比較,右心房上下徑(P<0.001)、右心室上下徑(P=0.001)、下腔靜脈內徑(P<0.001)和三尖瓣環收縮期位移(P<0.001)顯著縮短,三尖瓣反流程度和肺動脈瓣反流程度顯著改善(P<0.05)(表2~3)。截至目前,有20例患者完成術后1年的隨訪(另外18例術后未滿1年)。與術前比較,心臟磁共振測RVEDVI(P<0.001)、右心室收縮末期容積指數(right ventricular end-systolic volume index,RVESVI)(P=0.001)以及右心室上下徑(P=0.006)顯著降低或減小,肺動脈瓣反流程度顯著改善(P<0.001),但三尖瓣反流程度差異無統計學意義(P=0.550)(表4)。1例(2.6%)出現雙側氣胸,未經治療轉歸消失。3例(7.9%)出現胸悶、胸痛,予以強心利尿藥改善心功能,其中1例(2.6%)癥狀轉歸消失,另外2例(5.3%)癥狀持續存在。1例(2.6%)出現頻發性室性早搏,未經治療轉歸消失(表5)。
3 討論
右心室流出道功能不全患者需要在發生不可逆性右心室擴張或心功能惡化前接受肺動脈瓣置換[12]。以法洛四聯癥根治術后患者為例,Cuypers等[1]報道144例患者35年內肺動脈瓣置換的累計發生率為44%。臨床試驗[3, 13-14]證明,TPVI 安全性和有效性均佳。然而,目前臨床常用的兩種經導管肺動脈瓣支架(Melody和Sapien)均為球囊擴張瓣膜支架,僅推薦用于治療同種移植物或者帶瓣管道重建的右心室流出道[8-9]。這并不適用于國內許多右心室流出道功能不全患者,因為大部分患者采用跨瓣環補片技術重建右心室流出道,這兩種瓣膜系統不足以在擴張的原生右心室流出道內維持穩定。因此,自膨式肺動脈瓣支架系統應運而生。
國內外目前已有多款自膨式肺動脈瓣膜支架正在投入臨床試驗或應用。較早的一款國外研發的自膨式肺動脈瓣支架(Pulsta)由Kim等[15]報道應用,隨后是國內的兩種支架(Venus P-valve和PT-valve),其在早期臨床試驗中均表現出良好的安全性和有效性[16-17]。本研究應用的是北京佰仁公司研發生產的SalusTM介入肺動脈瓣支架系統。其采用經胸入路,優勢在于操作更簡便,定位更準確。Virk 等[18]的一項Meta分析結果顯示TPVI瓣膜移位發生率為2.4%。Morgan等[17]的研究中,37例經皮介入肺動脈瓣支架植入術中有2例(5.4%)患者發生瓣膜支架遷移而導致二次手術;與之相比,本研究中有3例患者發生術中瓣膜支架遷移,但立刻在術中建立體外循環,完成瓣膜復位,有效避免二次手術。不僅如此,經胸入路可在同期行肺動脈環縮術以避免或減輕瓣周漏。冠狀動脈受壓迫是圍術期最嚴重并發癥,可導致患者術中死亡[3]。其主要原因是復雜先天性心臟病常合并冠狀動脈發育異常或者矯治術后改變了冠狀動脈與主肺動脈的位置關系。本試驗中所有患者在入組前均行冠狀動脈CT檢查,提前評估主要血管的毗鄰關系以避免冠狀動脈受壓的發生。本研究所有患者均成功行自膨式介入肺動脈瓣支架植入術,且圍術期未出現冠狀動脈壓迫、支架斷裂、心律失常、血栓形成等嚴重并發癥。
本研究在12個月(中位數)的隨訪期間里,無死亡患者或者再干預患者。有研究[19]表明,在大約1年、2年和4年的隨訪期間,TPVI后再次干預的發生率分別低于10%、20%和30%。感染性心內膜炎是TPVI患者術后中遠期的重要并發癥。一項多中心前瞻性研究[20]結果顯示,TPVI患者術后5年感染性心內膜炎累計發生率為11%。一旦發生該并發癥,多數患者需要再次干預。本研究嚴格按照人工瓣膜感染性心內膜炎指南建議,預防性使用抗生素,圍術期以及術后隨訪期間沒有發生相關并發癥[21]。然而,感染性心內膜炎往往發生于術后中遠期,本研究隨訪時間較短,需要更長隨訪時間才能評估經胸入路患者與TPVI患者術后發生感染性心內膜炎的差異。術后6個月和術后12個月,超聲心動圖檢查顯示肺動脈瓣功能改善維持良好,無重度肺動脈瓣反流復發。心臟磁共振結果顯示,與基線資料相比,術后RVEDVI和RVESVI顯著降低,提示患者右心室發生重塑,心功能顯著改善。這與其他經導管肺動脈瓣支架系統治療右心室流出道功能不全患者獲得的早中期結果相似[6,13,17,22]。
綜上所述,自膨式介入肺動脈瓣支架經胸植入術治療重度肺動脈瓣反流患者安全、有效,顯示出良好的術后1年臨床和血流動力學結果。本研究的局限性在于單中心,小樣本量;其長期治療效果也需要更長的隨訪時間來觀察。
利益沖突:無。
作者貢獻:周子秦負責研究設計,資料收集、分析,初稿撰寫;黃陶然負責資料收集;乃吉木丁·阿布都熱西提負責文獻檢索;張勇、袁海云、謝年謹、費洪文、劉輝參與資料收集;莊建與陳寄梅修改論文,提出重要的建設性意見;溫樹生負責研究設計,修改論文;所有作者均同意論文發表。
致謝 感謝吳倩、馮佳慧兩位臨床協調員為本研究做出的貢獻。感謝廣東省人民醫院先心病病區、心外ICU及介入導管室相關醫務人員對本研究的支持與貢獻。