2023年國內外關于經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)的臨床研究、基礎研究和新器械層出不窮。本文擬從國際年度進展、國內年度進展、國內應用研發情況三方面回顧2023年TAVR取得的進步,著重介紹國內外新的臨床和基礎研究成果,涌現出的新器械、新技術以及我國TAVR開展應用情況,并展望TAVR在2024年的發展趨勢。
引用本文: 潘文志, 方雁行, 李捷, 李飛, 周達新, 葛均波. 經導管主動脈瓣置換術2023年度報告. 中國胸心血管外科臨床雜志, 2024, 31(4): 498-503. doi: 10.7507/1007-4848.202401070 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)自2002年誕生以來已發展為介入心臟病學中舉足輕重的一項技術。隨著近年來與各項前沿學科的不斷融合,TAVR出現了大量新發明、新進展。本文擬從國際年度進展、國內年度進展、國內應用研發情況三方面回顧2023年TAVR取得的進步,并展望2024年TAVR的發展趨勢。
1 國際年度進展
1.1 臨床研究進展
1.1.1 低危患者TAVR長期結果不劣于外科手術
2023年經導管心臟治療大會(Transcatheter Cardiovascular Therapeutics,TCT)公布了多項TAVR相關的臨床研究進展,其中最引人矚目的為PARTNER 3的5年隨訪[1]和Evolut Low Risk的4年隨訪結果[2]。數據顯示,低危TAVR患者的長期結果不劣于外科手術。PARTNER 3 研究的5年隨訪正式結果[1]發表于N Engl J Med,該研究共納入1 000例外科手術低危患者,患者平均年齡73歲,胸外科醫師協會(Society of Thoracic Surgeons,STS)評分為1.9%。試驗組5年時全因死亡率為10%(對照組為 8.2%),心血管死亡率為5.5%(對照組為5.1%),與對照的外科手術組的差異無統計學意義。Evolut Low Risk是一項前瞻性、隨機、多中心的隨機對照試驗[2],旨在比較使用Evolut系列產品進行TAVR與外科主動脈瓣置換術(surgical aortic valve replacement,SAVR)在外科手術低危患者中的安全性和有效性。Evolut Low Risk研究共納入1 414例患者,其中TAVR組730例,SAVR組684例,平均年齡74歲,STS評分2.0%。結果顯示,在4年時全因死亡率+致殘性卒中的主要終點方面,TAVR組為10.7%,而SAVR組為14.1%,TAVR組比SAVR降低26%(P=0.05)。TAVR組收益似乎隨著時間推移而增加,主要終點的絕對差異從1年時的1.8% 增至4年時的3.4%。若以死亡+腦卒中+再住院為終點,則兩者差異更加顯著,4年時為18.0%和22.4%(P=0.04)[2]。而在術后并發癥方面,PARTNER 3研究[1]表明,TAVR組的新發心房顫動(房顫)和嚴重出血的發生率均低于SAVR組(13.7% vs. 42.2%,10.2% vs. 14.8%)。而Evolut Low Risk研究則顯示,自膨脹式瓣膜TAVR組的房顫發生率較低(14.0% vs. 40.8%,P<0.001),而永久起搏器植入率更高(24.6% vs. 9.9%,P<0.001)。
1.1.2 TAVR長期瓣膜血流動力學優于SAVR
上述兩項研究不僅證實了TAVR在低危患者中長期結果的非劣效性,還得出了TAVR的長期瓣膜血流動力學優于SAVR的結果。PARTNER 3 研究的5年隨訪結果[1]顯示,TAVR的血流動力學性能與SAVR相似[平均跨瓣壓差12.8 mm Hg vs. 11.7 mm Hg(1 mm Hg=0.133 kPa),P<0.05;平均有效瓣口面積1.9 cm2 vs. 1.8 cm2,P<0.05];而Evolut Low Risk的4年隨訪結果[2]表明,自膨脹式瓣膜TAVR無論是有效瓣口面積(2.1 cm2 vs. 2.0 cm2,P<0.05),還是跨瓣壓差(9.8 mm Hg vs. 12.1 mm Hg, P<0.01),均優于SAVR[1-2]。在另一項旨在比較Sapien 3 TAVR與SAVR的5年隨訪研究[3]中,Sapien 3 TAVR展現出更優異的長期血流動力學結果。Sapien 3瓣膜的有效瓣口面積大于SAVR(1.6 cm2 vs. 1.4 cm2,P<0.0001),而兩者平均跨瓣壓差(11.2 mm Hg vs. 10.6 mm Hg,P=0.59)相近。O'Hair等[4]比較了進行CoreValve/Evolut R TAVR和SAVR的高危患者的預后,發現相較于SAVR,TAVR組在第30 d隨訪或出院時的有效瓣口面積更大[(1.1±0.3)cm2 vs. (0.9±0.3)cm2,P<0.001],并且平均跨瓣壓差更小[(8.8±3.9)mm Hg vs.(12.3±5.8)mm Hg,P<0.001],而上述數據在后續的5年隨訪中基本維持不變。以上研究均有力證明了TAVR相較于SAVR在長期血流動力學方面的優越性和安全性。
1.1.3 TAVR社會經濟學效益顯著
在基礎和臨床研究之外,已陸續有研究者開始關注TAVR的社會經濟學效益,以期從新視角證明TAVR相較于SAVR的優勢所在。一項發表于Circulation的研究[5]顯示,以PARTNER 3試驗納入的患者為研究對象,在0~30 d的隨訪中,TAVR患者的費用明顯低于SAVR患者的費用[(1 178±2 845)美元 vs. (5 074±7 262)美元,P<0.001],在1~6個月時,TAVR組的費用同樣更少[(4403±7289)美元 vs. (6 017±15 605)美元,P<0.001],而在6~12個月的隨訪期間,TAVR患者的費用也不比SAVR患者高[(5 685±15 828)美元 vs.(4 613±11 775)美元,P=0.258]。在2年隨訪中,TAVR相較于SAVR在經濟學上占優勢地位,TAVR患者的人均質量調整生命年相對提高 0.049,并且平均節省成本 2 193 美元。Ryffel等[6]調查了21個高收入國家的TAVR應用范圍擴大對主動脈瓣狹窄(aortic stenosis,AS)相關死亡率的影響,發現TAVR的滲透率增加與年齡≥65歲的患者AS相關年齡調整死亡率的下降趨勢相一致,并且TAVR應用率較高國家老年人AS相關年齡調整死亡率較低。由此可見,TAVR的廣泛應用不僅挽救了眾多外科手術高危或者禁忌的AS患者,降低了全球多個國家AS患者的總體死亡率,還帶來了顯著的社會經濟學效益。
1.1.4 磁共振成像成為TAVR術前評估的另一選擇
目前TAVR術前評估主要依靠心臟超聲和計算機體層成像(computed tomography,CT)。但是鑒于相當一部分準備接受TAVR的患者患有慢性腎病,使用含碘造影劑會對他們造成影響,因此心臟磁共振成像(cardiovascular magnetic resonance,CMR)可能成為一種很有前景的替代方法。最新研究[7]表明,在分別使用CMR指導與CT指導TAVR的術前評估時,器械成功率差異無統計學意義(93.5% vs. 90.7%,P非劣效<0.01);而CT指導的TAVR,卒中或短暫性腦缺血發作(5.4% vs. 0.7%,P=0.02)、永久起搏器植入發生率較高(11.6% vs. 3.6%,P=0.01),余并發癥差異無統計學意義。這一研究結果有望加速CMR被列入TAVR術前評估常規方法的進程,也至少在目前為無法行增強CT檢查的患者行TAVR治療提供了另一種有效的替代性評估方式。
1.1.5 小瓣環患者選擇何種瓣膜為優尚無定論
小瓣環者在植入TAVR瓣膜后,可能會由于有效瓣口面積較小,跨瓣壓差升高,引發血流動力學問題,瓣膜-患者不匹配的發生率較高,容易出現早期瓣膜衰敗,因此學界對于小瓣環者選擇何種TAVR瓣膜為優存在爭議。Swiss TAVI注冊研究[8]納入了171對小瓣環(面積<430 mm2)重度AS患者,盡管隨訪5年時自膨脹式瓣膜的血流動力學優于球囊擴張式瓣膜[平均壓差(8.0±4.8)mm Hg vs. (12.5±4.5)mm Hg,P<0.001);有效瓣口面積(1.81±0.46)cm2 vs. (1.49±0.42)cm2,P<0.001],但這種優勢并未轉化成臨床獲益,二者死亡率(50.4% vs. 39.6%,P=0.269)差異無統計學意義,并且使用自膨脹式瓣膜患者的致殘性腦卒中發生率更高(6.6% vs. 0.6%,P=0.030)。小瓣環患者應該選擇TAVR還是SAVR同樣是爭議的熱點。在VIVA試驗中,研究者將151例小瓣環重度AS(平均瓣環直徑<23 mm)隨機分組至TAVR(n=77)和SAVR(n=74),結果顯示沒有證據表明TAVR相對于SAVR在瓣膜血流動力學性能方面具有優勢,TAVR組重度瓣膜-患者不匹配率較低,但是差異無統計學意義(5.6% vs. 10.3%,P=0.30),并且TAVR和SAVR的早期(30 d)和晚期(2年)臨床結果無顯著差異[9]。在30 d的隨訪時,兩組死亡率和卒中發生率差異無統計學意義(1.3% vs. 1.4%,P=1.00,0 vs. 2.7%,P=0.24)。而在2年隨訪時,TAVR和SAVR組死亡率、卒中發生率、心臟相關入院率等方面的差異均無統計學意義(9.1% vs. 8.1%,P=0.89;3.9% vs. 4.1%,P=0.95;19.5% vs. 20.3%,P=0.80)。因此對于小瓣環AS患者應選擇何種瓣膜尚無定論,有待更大規模的臨床研究和更長期的隨訪證實。
1.1.6 TAVR瓣膜衰敗后再行TAVR成為研究新熱點
隨著TAVR走向低齡、低危人群,由于此類人群具有較長的預期壽命,可能需要不止一次干預治療,因此,目前TAVR瓣膜衰敗后再次行TAVR已成為研究新熱點,而再次行TAVR后的冠狀動脈堵塞風險評估、血流動力學變化以及如何保留冠狀動脈通路均是當下關注的重點。最新研究[10]表明,在Evolut瓣膜衰敗后再次行TAVR的可行性受多因素影響,與原生瓣環的解剖結構以及前兩個瓣膜的植入深度有關。在Evolut的較低位置植入Sapien 3可以降低冠狀動脈血流受損的風險,同時保留冠狀動脈通路。而Tang等[11]也得出了類似結論,即Evolut瓣膜衰敗后使用Sapien 3再次行TAVR后的冠狀動脈通路與Evolut的初始植入深度、Sapien 3在Evolut中的流出位置以及原生瓣環的解剖結構有關。盡管如此,已有研究[12]表明TAVR瓣中瓣手術容易導致瓣葉血栓,并且TAVR瓣膜衰敗后再次TAVR術后的瓣膜耐久性尚未得到充分評估,因此TAVR衰敗后再次行TAVR的各種并發癥風險仍未明朗,需要進一步的臨床研究來提供更多證據。
1.1.7 一站式TAVR+經導管左心耳封堵術獲得證據
AS患者常合并房顫。2023年發表的WACTH-TAVR研究[13]為TAVR+經導管左心耳封堵術(transcatheter left atrial appendage occlusion,LAAO)提供了循證醫學證據。該研究納入了來自多中心的349例患者,隨機分配至TAVR+LAAO組和TAVR+藥物治療組,研究人群的平均年齡約為81歲,非瓣膜性房顫患者發生腦卒中的危險評分(CHA2DS2-VASc)為4.9分,HAS-BLED評分為3分。隨訪2年后發現TAVR+ LAAO組在包括全因死亡率、卒中和大出血的復合終點處達到非劣效的結果[22.7 vs. 27.3 次事件/ 100例患者年,HR=0.86,95%CI(0.60,1.22),P非劣效性<0.001],證明在合并房顫的嚴重AS患者中,進行一站式LAAO+TAVR的治療效果并不遜色于單純TAVR+藥物治療。但TAVR+LAAO組的動脈或靜脈血栓形成或栓塞風險相較于TAVR+藥物治療組增加約4倍[9% vs. 1.7%,HR=5.03,95%CI(1.47,17.26)]。其中靜脈血栓事件為主要不良事件;與TAVR+藥物治療組比較,TAVR+LAAO組的靜脈血栓事件風險增加10倍[HR=11,95%CI(1.40,85.70)],在臨床實踐中予以高度重視。
1.2 新器械和新技術
1.2.1 DurAVR仿生瓣膜
隨著TAVR技術不斷優化,其瓣膜設計理念也在不斷更新,DurAVR仿生瓣膜是一種由3D打印而成的一體化瓣葉主動脈瓣膜,結合了球囊擴張式瓣膜短瓣架及自膨脹式瓣膜優異的血流動力學設計和緣對齊的優點。DurAVR的一體化瓣膜設計與天然主動脈瓣膜極為相似,因此具有較大的有效瓣口面積、更加一致的層流,理論上可提供更優異的血流動力學效果和更長的使用壽命。2023年7月31日的首次報道[14]稱,DurAVR已被成功用于瓣中瓣手術。此外,DurAVR首次人體試驗研究的初步結果表明,DurAVR具有良好的安全性,血流動力學表現良好,并在為期1年的隨訪中得到維持,患者平均有效瓣口面積1.96 cm2,平均跨瓣壓差8.82 mm Hg,血流動力學恢復接近正常。此研究結果將作為未來臨床試驗的基礎,以更好地了解仿生設計(血流動力學和正常血流)的短期收益如何影響AS長期治療中的生活質量、瓣膜耐久性、心肌恢復、心肌重塑和主動脈病變。
1.2.2 Jena Valve
Jena Valve作為主動脈瓣反流(aortic regurgitation,AR)領域備受關注的一款瓣膜,在2023 大會上公布了其臨床研究ALIGN-AR的1年結果,顯示出了較好的治療效果。其30 d主要安全性終點發生率為26.7%,1年主要有效性終點發生率為7.8%,主要安全終點和主要療效終點均符合預設的非劣效標準(40.5%、25.0%)。超聲隨訪呈現出良好的有效瓣口面積和低跨瓣壓差,1年中度以上瓣周漏發生率0%,后期入組患者永久起搏器植入發生率14%,患者心功能及生活質量得到持續改善,左室收縮末期內徑、左室舒張末期內徑及左室質量等心室重塑指標改善明顯[15]。ALIGN-AR的1年隨訪結果表明了Trilogy系統這一特有的瓣膜設計及釋放機制在單純主動脈瓣反流(pure aortic regurgitation,PAR)患者中有可靠的臨床表現和穩定的臨床獲益。
1.2.3 體外聚焦超聲震波技術
由于TAVR或SAVR治療AS時可能會有并發癥以及部分高齡患者預期壽命有限,因此瓣膜置換并非首選方案,非侵入性療法可為這些患者提供替代治療的可能性。體外聚焦超聲震波技術作為一種創新式無創治療AS的方式,備受矚目,相關研究于2023年發表于Lancet。Messas等[16]納入40例STS評分為5%~6%的患者,在術后6個月隨訪時無患者出現卒中或死亡,并且主動脈瓣口面積[(0.64±0.21)cm2 vs.(0.58±0.19)cm2,P=0.0088]、跨瓣壓差[(38.8±17.8)mm Hg vs.(41.9±20.1)mm Hg,P=0.024]、紐約心臟協會(New York Heart Association,NYHA)評分(2.3±0.8 vs. 3.0±0.7,P<0.0001)較術前均有不同程度改善。這表明此術雖治療效果有限,但是其安全性和可行性良好,有理由期待其在未來的進一步優化和發展。
1.2.4 起搏壓力監測導絲
在TAVR輔助器械方面,國外推出了一款同時具有起搏和壓力檢測功能的TAVR專用導絲SavvyWire(OpSens公司)。其為0.035英寸預成形導絲,具有專用起搏特性和遠端壓力傳感器,可連續監測血流動力學壓力。研究[17]證實其起搏效果良好,無死亡、卒中或心室穿孔報告,未來應用值得期待。
2 國內TAVR年度進展
2.1 王建安院士團隊揭示二葉式主動脈瓣形成的新機制
過去10年,參與主動脈瓣發育和二葉式主動脈瓣(bicuspid aortic valve,BAV)形成的基因已被越來越多的人所認識。充分了解主動脈瓣發育和BAV形成的分子機制將大大優化 BAV治療策略。王建安院士團隊的原創研究[18]發現了一種新型的導致 BAV的ADAMTS16p.H357Q變體,而ADAMTS16 缺乏會導致BAV的形成,從而揭示了BAV患者發病的新機制。
2.2 吳永健教授團隊:中國原創AI算法—提高了TAVR術前評估質量
主動脈瓣復合體的CT成像評估對于TAVR的成功至關重要。然而,TAVR術前評估耗時長,并且結果因人而異。吳永健教授團隊開發并驗證了一種基于深度學習的算法,用于TAVR術前CT評估和解剖風險因素的檢測,該算法與資深影像醫師相比具有顯著的一致性[19]。此研究發表于Lancet子刊上,引發業界熱議,有望改善臨床實踐中的 TAVR方案。
2.3 復旦中山團隊:Hanchor Valve的研究結果及“三明治”法
復旦大學附屬中山醫院團隊在大會上報告了Hanchor Valve的初步研究結果。Hanchor Valve經導管主動脈瓣膜系統是國內首款球囊擴張式經股入路的可治療PAR的瓣膜產品,Hanchor Valve單中心27例確證性臨床研究[20]結果顯示,術中無不良事件發生,平均導管操作時間短,所有患者術后即刻反流降至無或者微量,左室舒張末期內徑明顯改善,展現了這一產品廣闊的應用前景,是國產醫療器械的一次重大突破。此外,潘文志教授通過1例超大瓣環單純天然主動脈瓣反流(pure native aortic regurgitation,PNAR)病例,向全球同行展示了其與周達新教授發明的“三明治”植入法。由于PNAR解剖特點的復雜性、手術技術要求高、手術并發癥多等因素,長期以來被視為TAVR的相對禁忌證,并且目前尚無針對性器械獲批上市。潘文志教授[21]詳細介紹了為此類患者行TAVR的挑戰所在,以及“三明治”法瓣中瓣植入技術的操作要點與臨床效用,為進一步提高PNAR患者TAVR的手術成功率和安全性提供了有跡可循的參考方向。
2.4 宋光遠教授攜團隊成功完成TaurusTrio多中心注冊臨床研究首例入組
2023年7月6日,宋光遠教授攜團隊于首都醫科大學附屬安貞醫院成功完成TaurusTrio多中心注冊臨床研究首例入組。首日入組病例均為不能常規開展外科手術的重度AR患者,手術過程順利,人工瓣膜植入后位置理想,形態良好,術后即刻反流消失,平均導管操作時間20 min,最快僅10 min,驗證了TaurusTrio在標準化手術流程指導下的安全性與易操作性,也標志著經股動脈(transfemoral,TF)-TAVR治療AR這一新技術再次邁出了堅實的一步。
2.5 《單純主動脈瓣反流經股動脈主動脈瓣置換中國專家共識2023》重磅發布
TAVR最初被應用于治療AS,隨后逐漸拓展到AR治療領域,然而我國尚無具有AR適應證的TF-TAVR器械上市。國內外學者正探索使用針對AS的TAVR瓣膜以“超適應證”的方式治療AR患者的可能性,結果顯示該方式可作為外科手術高危患者的一種選擇。盡管如此,AR患者與AS患者在解剖結構、瓣膜選擇、操作方式以及并發癥等方面差異較大,總體上使用TF-TAVR瓣膜治療AR手術難度大,成功率較AS低。為了促進我國TF-TAVR治療AR的安全、規范、健康發展,為該技術的臨床使用提供支持和指導,同時也為臨床超適應證使用提供合規性支持,中國醫師協會心血管內科醫師分會結構性心臟病學組編寫了《單純主動脈瓣反流經股動脈主動脈瓣置換中國專家共識2023》[22],成為國際首個PAR專家共識。執筆專家團隊針對AR患者TF-TAVR臨床實踐中的重點及難點,結合所檢索到的文獻(截至2023年9月1日)的證據力度,梳理出9個核心問題并做出深入分析,形成9個核心觀點。推薦等級參照GRADE(Grading of Recommendations,Assess,Development and Evaluation),涵蓋適應證、瓣膜選擇、術前評估、術中操作要點、并發癥防治、術后管理等方面。
3 國內應用研發情況
3.1 開展應用情況
自葛均波院士帶領團隊在2010年開展我國首例TAVR手術以來,我國的TAVR手術量呈現穩定上升的趨勢。我國已于2023年度(截至11月30日)開展TAVR手術13 572 例(商業化12 952例,臨床試驗620例),預計全年植入量約1.5萬例,較去年的8439例有顯著提升。而TAVR植入量排名前5位的省或直轄市依次是北京、四川、廣東、上海、浙江。
根據瓣膜中心NTCVR數據庫顯示,目前我國TAVR手術最主流的麻醉方式仍為全身麻醉,占89%,而最常用的入路仍是經股動脈,占76.8%,其次為經心尖,占21.7%,這也是我國開展TAVR技術的一大特色。在患者自身情況方面,隨著TAVR適應證拓寬,中風險和低風險的TAVR患者逐漸增多。2010年至今,在接受TAVR手術的患者中,中風險TAVR患者(STS評分4%~8%)占44.18%,低風險患者(STS評分<4%)占38.43%。中國瓣膜中心數據庫NTCVR分析數據顯示,2010年以來我國接受TAVR手術的BAV和三葉式主動脈瓣(無融合型)患者的數量接近,三葉瓣略多,為52.31%,而二葉瓣患者中又以0型二葉瓣和1型二葉瓣為主。在圍術期事件方面,TAVR圍術期不良事件發生率不斷降低,目前發生率排名前3的圍術期不良事件分別為新發左束支傳導性阻滯(8.60%)、新發房室傳導阻滯(6.96%)和永久起搏器植入(6.54%),而其中永久起搏器植入發生率已較前顯著下降。
3.2 新器械研發進展
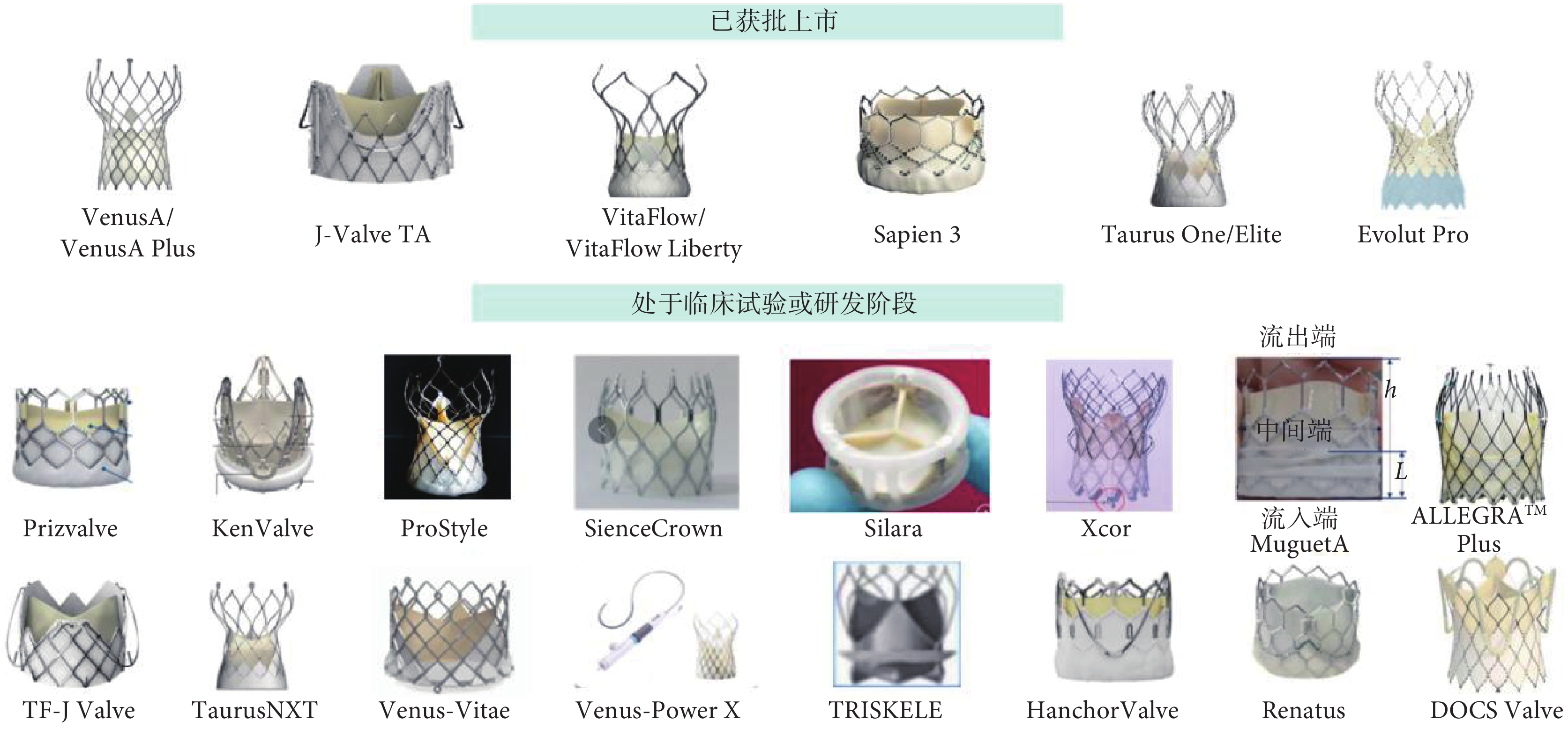
截至目前,在我國獲批上市的TAVR瓣膜共有6款,分別為VenusA/VenusA plus、J-Valve TA、VitaFlow/VitaFlow Liberty、Sapien 3、Taurus One/Elite、Evolut Pro,而還處于臨床試驗或研發階段的TAVR瓣膜更是多達20余款,主要器械見圖1。用于治療PAR的TF-TAVR器械的研發已在我國成為新熱點,步伐領先世界,包括Hanchor Valve、TF J-Valve、 TF JenaValve、DOCS Valve、PioneerValve5種器械,前3者已經完成上市前臨床試驗入組。而目前未上市的國產球囊擴張式瓣膜產品(包括PrizeValve、MuguetA、Renatus 3種瓣膜)均已完成臨床試驗入組或遞交上市審批材料,標志著我國在球囊擴張式瓣膜市場的空白即將被填補。此外,目前已上市的新型自膨脹式瓣膜(具有全可回收、短瓣架、干瓣等特性)正在對產品進行迭代升級,有望在未來取得更好的療效。在瓣膜材料方面,我國研發的聚合物瓣膜引領未來。世界首個聚合物TAVR瓣膜TRISKELE(以心醫療)已于2023年7月完成首次植入手術,初步臨床研究結果優秀[23]。由此可見,我國TAVR瓣膜的研發熱度不減,呈現百舸爭流之勢。
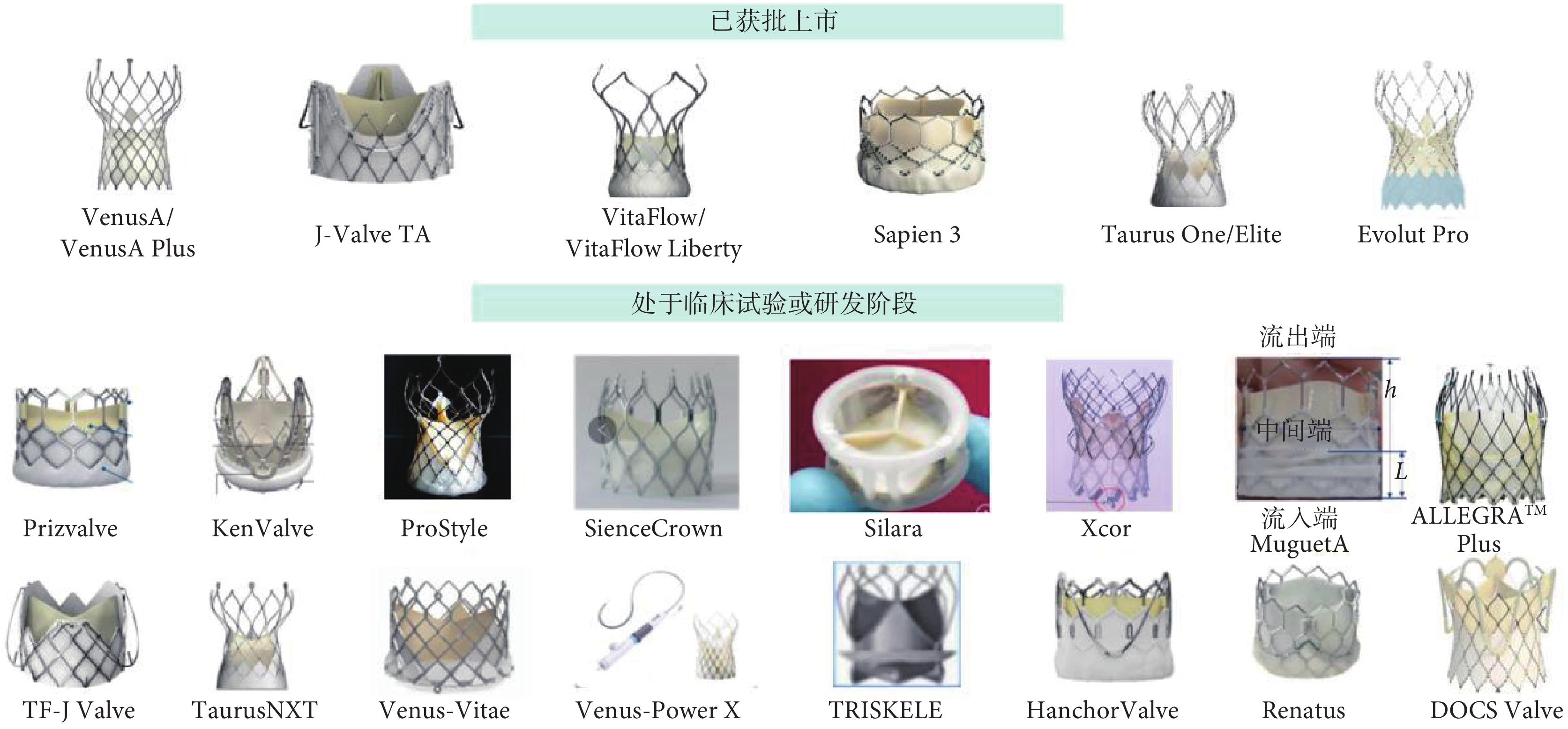 圖1
2023年中國經導管主動脈瓣置換術瓣膜匯總
圖1
2023年中國經導管主動脈瓣置換術瓣膜匯總
4 2024年度展望
(1)雖然目前TAVR發展有放緩的趨勢,但在局部方向仍有較大的發展空間,如PAR、低齡患者以及中度或無癥狀患者。(2)國際TAVR臨床研究將持續進行,主要集中在小瓣環、瓣膜耐久性、冠狀動脈入路、全生命周期管理等方面。(3) 2024年我國TAVR仍將保持快速增長趨勢,預計年植入量將達2萬例。隨著《單純主動脈瓣反流經股動脈主動脈瓣置換中國專家共識2023》的發布及技術的提高,PAR的TF-TAVR手術量將明顯增加。(4)幾款新型自膨脹式瓣膜和球囊擴張式瓣膜最快將于2024年獲批上市。
利益沖突:無。
作者貢獻:潘文志收集數據,查閱文獻,撰寫、修改初稿;方雁行撰寫初稿;李捷與李飛收集數據、查閱文獻;周達新與葛均波審核修改。
經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)自2002年誕生以來已發展為介入心臟病學中舉足輕重的一項技術。隨著近年來與各項前沿學科的不斷融合,TAVR出現了大量新發明、新進展。本文擬從國際年度進展、國內年度進展、國內應用研發情況三方面回顧2023年TAVR取得的進步,并展望2024年TAVR的發展趨勢。
1 國際年度進展
1.1 臨床研究進展
1.1.1 低危患者TAVR長期結果不劣于外科手術
2023年經導管心臟治療大會(Transcatheter Cardiovascular Therapeutics,TCT)公布了多項TAVR相關的臨床研究進展,其中最引人矚目的為PARTNER 3的5年隨訪[1]和Evolut Low Risk的4年隨訪結果[2]。數據顯示,低危TAVR患者的長期結果不劣于外科手術。PARTNER 3 研究的5年隨訪正式結果[1]發表于N Engl J Med,該研究共納入1 000例外科手術低危患者,患者平均年齡73歲,胸外科醫師協會(Society of Thoracic Surgeons,STS)評分為1.9%。試驗組5年時全因死亡率為10%(對照組為 8.2%),心血管死亡率為5.5%(對照組為5.1%),與對照的外科手術組的差異無統計學意義。Evolut Low Risk是一項前瞻性、隨機、多中心的隨機對照試驗[2],旨在比較使用Evolut系列產品進行TAVR與外科主動脈瓣置換術(surgical aortic valve replacement,SAVR)在外科手術低危患者中的安全性和有效性。Evolut Low Risk研究共納入1 414例患者,其中TAVR組730例,SAVR組684例,平均年齡74歲,STS評分2.0%。結果顯示,在4年時全因死亡率+致殘性卒中的主要終點方面,TAVR組為10.7%,而SAVR組為14.1%,TAVR組比SAVR降低26%(P=0.05)。TAVR組收益似乎隨著時間推移而增加,主要終點的絕對差異從1年時的1.8% 增至4年時的3.4%。若以死亡+腦卒中+再住院為終點,則兩者差異更加顯著,4年時為18.0%和22.4%(P=0.04)[2]。而在術后并發癥方面,PARTNER 3研究[1]表明,TAVR組的新發心房顫動(房顫)和嚴重出血的發生率均低于SAVR組(13.7% vs. 42.2%,10.2% vs. 14.8%)。而Evolut Low Risk研究則顯示,自膨脹式瓣膜TAVR組的房顫發生率較低(14.0% vs. 40.8%,P<0.001),而永久起搏器植入率更高(24.6% vs. 9.9%,P<0.001)。
1.1.2 TAVR長期瓣膜血流動力學優于SAVR
上述兩項研究不僅證實了TAVR在低危患者中長期結果的非劣效性,還得出了TAVR的長期瓣膜血流動力學優于SAVR的結果。PARTNER 3 研究的5年隨訪結果[1]顯示,TAVR的血流動力學性能與SAVR相似[平均跨瓣壓差12.8 mm Hg vs. 11.7 mm Hg(1 mm Hg=0.133 kPa),P<0.05;平均有效瓣口面積1.9 cm2 vs. 1.8 cm2,P<0.05];而Evolut Low Risk的4年隨訪結果[2]表明,自膨脹式瓣膜TAVR無論是有效瓣口面積(2.1 cm2 vs. 2.0 cm2,P<0.05),還是跨瓣壓差(9.8 mm Hg vs. 12.1 mm Hg, P<0.01),均優于SAVR[1-2]。在另一項旨在比較Sapien 3 TAVR與SAVR的5年隨訪研究[3]中,Sapien 3 TAVR展現出更優異的長期血流動力學結果。Sapien 3瓣膜的有效瓣口面積大于SAVR(1.6 cm2 vs. 1.4 cm2,P<0.0001),而兩者平均跨瓣壓差(11.2 mm Hg vs. 10.6 mm Hg,P=0.59)相近。O'Hair等[4]比較了進行CoreValve/Evolut R TAVR和SAVR的高危患者的預后,發現相較于SAVR,TAVR組在第30 d隨訪或出院時的有效瓣口面積更大[(1.1±0.3)cm2 vs. (0.9±0.3)cm2,P<0.001],并且平均跨瓣壓差更小[(8.8±3.9)mm Hg vs.(12.3±5.8)mm Hg,P<0.001],而上述數據在后續的5年隨訪中基本維持不變。以上研究均有力證明了TAVR相較于SAVR在長期血流動力學方面的優越性和安全性。
1.1.3 TAVR社會經濟學效益顯著
在基礎和臨床研究之外,已陸續有研究者開始關注TAVR的社會經濟學效益,以期從新視角證明TAVR相較于SAVR的優勢所在。一項發表于Circulation的研究[5]顯示,以PARTNER 3試驗納入的患者為研究對象,在0~30 d的隨訪中,TAVR患者的費用明顯低于SAVR患者的費用[(1 178±2 845)美元 vs. (5 074±7 262)美元,P<0.001],在1~6個月時,TAVR組的費用同樣更少[(4403±7289)美元 vs. (6 017±15 605)美元,P<0.001],而在6~12個月的隨訪期間,TAVR患者的費用也不比SAVR患者高[(5 685±15 828)美元 vs.(4 613±11 775)美元,P=0.258]。在2年隨訪中,TAVR相較于SAVR在經濟學上占優勢地位,TAVR患者的人均質量調整生命年相對提高 0.049,并且平均節省成本 2 193 美元。Ryffel等[6]調查了21個高收入國家的TAVR應用范圍擴大對主動脈瓣狹窄(aortic stenosis,AS)相關死亡率的影響,發現TAVR的滲透率增加與年齡≥65歲的患者AS相關年齡調整死亡率的下降趨勢相一致,并且TAVR應用率較高國家老年人AS相關年齡調整死亡率較低。由此可見,TAVR的廣泛應用不僅挽救了眾多外科手術高危或者禁忌的AS患者,降低了全球多個國家AS患者的總體死亡率,還帶來了顯著的社會經濟學效益。
1.1.4 磁共振成像成為TAVR術前評估的另一選擇
目前TAVR術前評估主要依靠心臟超聲和計算機體層成像(computed tomography,CT)。但是鑒于相當一部分準備接受TAVR的患者患有慢性腎病,使用含碘造影劑會對他們造成影響,因此心臟磁共振成像(cardiovascular magnetic resonance,CMR)可能成為一種很有前景的替代方法。最新研究[7]表明,在分別使用CMR指導與CT指導TAVR的術前評估時,器械成功率差異無統計學意義(93.5% vs. 90.7%,P非劣效<0.01);而CT指導的TAVR,卒中或短暫性腦缺血發作(5.4% vs. 0.7%,P=0.02)、永久起搏器植入發生率較高(11.6% vs. 3.6%,P=0.01),余并發癥差異無統計學意義。這一研究結果有望加速CMR被列入TAVR術前評估常規方法的進程,也至少在目前為無法行增強CT檢查的患者行TAVR治療提供了另一種有效的替代性評估方式。
1.1.5 小瓣環患者選擇何種瓣膜為優尚無定論
小瓣環者在植入TAVR瓣膜后,可能會由于有效瓣口面積較小,跨瓣壓差升高,引發血流動力學問題,瓣膜-患者不匹配的發生率較高,容易出現早期瓣膜衰敗,因此學界對于小瓣環者選擇何種TAVR瓣膜為優存在爭議。Swiss TAVI注冊研究[8]納入了171對小瓣環(面積<430 mm2)重度AS患者,盡管隨訪5年時自膨脹式瓣膜的血流動力學優于球囊擴張式瓣膜[平均壓差(8.0±4.8)mm Hg vs. (12.5±4.5)mm Hg,P<0.001);有效瓣口面積(1.81±0.46)cm2 vs. (1.49±0.42)cm2,P<0.001],但這種優勢并未轉化成臨床獲益,二者死亡率(50.4% vs. 39.6%,P=0.269)差異無統計學意義,并且使用自膨脹式瓣膜患者的致殘性腦卒中發生率更高(6.6% vs. 0.6%,P=0.030)。小瓣環患者應該選擇TAVR還是SAVR同樣是爭議的熱點。在VIVA試驗中,研究者將151例小瓣環重度AS(平均瓣環直徑<23 mm)隨機分組至TAVR(n=77)和SAVR(n=74),結果顯示沒有證據表明TAVR相對于SAVR在瓣膜血流動力學性能方面具有優勢,TAVR組重度瓣膜-患者不匹配率較低,但是差異無統計學意義(5.6% vs. 10.3%,P=0.30),并且TAVR和SAVR的早期(30 d)和晚期(2年)臨床結果無顯著差異[9]。在30 d的隨訪時,兩組死亡率和卒中發生率差異無統計學意義(1.3% vs. 1.4%,P=1.00,0 vs. 2.7%,P=0.24)。而在2年隨訪時,TAVR和SAVR組死亡率、卒中發生率、心臟相關入院率等方面的差異均無統計學意義(9.1% vs. 8.1%,P=0.89;3.9% vs. 4.1%,P=0.95;19.5% vs. 20.3%,P=0.80)。因此對于小瓣環AS患者應選擇何種瓣膜尚無定論,有待更大規模的臨床研究和更長期的隨訪證實。
1.1.6 TAVR瓣膜衰敗后再行TAVR成為研究新熱點
隨著TAVR走向低齡、低危人群,由于此類人群具有較長的預期壽命,可能需要不止一次干預治療,因此,目前TAVR瓣膜衰敗后再次行TAVR已成為研究新熱點,而再次行TAVR后的冠狀動脈堵塞風險評估、血流動力學變化以及如何保留冠狀動脈通路均是當下關注的重點。最新研究[10]表明,在Evolut瓣膜衰敗后再次行TAVR的可行性受多因素影響,與原生瓣環的解剖結構以及前兩個瓣膜的植入深度有關。在Evolut的較低位置植入Sapien 3可以降低冠狀動脈血流受損的風險,同時保留冠狀動脈通路。而Tang等[11]也得出了類似結論,即Evolut瓣膜衰敗后使用Sapien 3再次行TAVR后的冠狀動脈通路與Evolut的初始植入深度、Sapien 3在Evolut中的流出位置以及原生瓣環的解剖結構有關。盡管如此,已有研究[12]表明TAVR瓣中瓣手術容易導致瓣葉血栓,并且TAVR瓣膜衰敗后再次TAVR術后的瓣膜耐久性尚未得到充分評估,因此TAVR衰敗后再次行TAVR的各種并發癥風險仍未明朗,需要進一步的臨床研究來提供更多證據。
1.1.7 一站式TAVR+經導管左心耳封堵術獲得證據
AS患者常合并房顫。2023年發表的WACTH-TAVR研究[13]為TAVR+經導管左心耳封堵術(transcatheter left atrial appendage occlusion,LAAO)提供了循證醫學證據。該研究納入了來自多中心的349例患者,隨機分配至TAVR+LAAO組和TAVR+藥物治療組,研究人群的平均年齡約為81歲,非瓣膜性房顫患者發生腦卒中的危險評分(CHA2DS2-VASc)為4.9分,HAS-BLED評分為3分。隨訪2年后發現TAVR+ LAAO組在包括全因死亡率、卒中和大出血的復合終點處達到非劣效的結果[22.7 vs. 27.3 次事件/ 100例患者年,HR=0.86,95%CI(0.60,1.22),P非劣效性<0.001],證明在合并房顫的嚴重AS患者中,進行一站式LAAO+TAVR的治療效果并不遜色于單純TAVR+藥物治療。但TAVR+LAAO組的動脈或靜脈血栓形成或栓塞風險相較于TAVR+藥物治療組增加約4倍[9% vs. 1.7%,HR=5.03,95%CI(1.47,17.26)]。其中靜脈血栓事件為主要不良事件;與TAVR+藥物治療組比較,TAVR+LAAO組的靜脈血栓事件風險增加10倍[HR=11,95%CI(1.40,85.70)],在臨床實踐中予以高度重視。
1.2 新器械和新技術
1.2.1 DurAVR仿生瓣膜
隨著TAVR技術不斷優化,其瓣膜設計理念也在不斷更新,DurAVR仿生瓣膜是一種由3D打印而成的一體化瓣葉主動脈瓣膜,結合了球囊擴張式瓣膜短瓣架及自膨脹式瓣膜優異的血流動力學設計和緣對齊的優點。DurAVR的一體化瓣膜設計與天然主動脈瓣膜極為相似,因此具有較大的有效瓣口面積、更加一致的層流,理論上可提供更優異的血流動力學效果和更長的使用壽命。2023年7月31日的首次報道[14]稱,DurAVR已被成功用于瓣中瓣手術。此外,DurAVR首次人體試驗研究的初步結果表明,DurAVR具有良好的安全性,血流動力學表現良好,并在為期1年的隨訪中得到維持,患者平均有效瓣口面積1.96 cm2,平均跨瓣壓差8.82 mm Hg,血流動力學恢復接近正常。此研究結果將作為未來臨床試驗的基礎,以更好地了解仿生設計(血流動力學和正常血流)的短期收益如何影響AS長期治療中的生活質量、瓣膜耐久性、心肌恢復、心肌重塑和主動脈病變。
1.2.2 Jena Valve
Jena Valve作為主動脈瓣反流(aortic regurgitation,AR)領域備受關注的一款瓣膜,在2023 大會上公布了其臨床研究ALIGN-AR的1年結果,顯示出了較好的治療效果。其30 d主要安全性終點發生率為26.7%,1年主要有效性終點發生率為7.8%,主要安全終點和主要療效終點均符合預設的非劣效標準(40.5%、25.0%)。超聲隨訪呈現出良好的有效瓣口面積和低跨瓣壓差,1年中度以上瓣周漏發生率0%,后期入組患者永久起搏器植入發生率14%,患者心功能及生活質量得到持續改善,左室收縮末期內徑、左室舒張末期內徑及左室質量等心室重塑指標改善明顯[15]。ALIGN-AR的1年隨訪結果表明了Trilogy系統這一特有的瓣膜設計及釋放機制在單純主動脈瓣反流(pure aortic regurgitation,PAR)患者中有可靠的臨床表現和穩定的臨床獲益。
1.2.3 體外聚焦超聲震波技術
由于TAVR或SAVR治療AS時可能會有并發癥以及部分高齡患者預期壽命有限,因此瓣膜置換并非首選方案,非侵入性療法可為這些患者提供替代治療的可能性。體外聚焦超聲震波技術作為一種創新式無創治療AS的方式,備受矚目,相關研究于2023年發表于Lancet。Messas等[16]納入40例STS評分為5%~6%的患者,在術后6個月隨訪時無患者出現卒中或死亡,并且主動脈瓣口面積[(0.64±0.21)cm2 vs.(0.58±0.19)cm2,P=0.0088]、跨瓣壓差[(38.8±17.8)mm Hg vs.(41.9±20.1)mm Hg,P=0.024]、紐約心臟協會(New York Heart Association,NYHA)評分(2.3±0.8 vs. 3.0±0.7,P<0.0001)較術前均有不同程度改善。這表明此術雖治療效果有限,但是其安全性和可行性良好,有理由期待其在未來的進一步優化和發展。
1.2.4 起搏壓力監測導絲
在TAVR輔助器械方面,國外推出了一款同時具有起搏和壓力檢測功能的TAVR專用導絲SavvyWire(OpSens公司)。其為0.035英寸預成形導絲,具有專用起搏特性和遠端壓力傳感器,可連續監測血流動力學壓力。研究[17]證實其起搏效果良好,無死亡、卒中或心室穿孔報告,未來應用值得期待。
2 國內TAVR年度進展
2.1 王建安院士團隊揭示二葉式主動脈瓣形成的新機制
過去10年,參與主動脈瓣發育和二葉式主動脈瓣(bicuspid aortic valve,BAV)形成的基因已被越來越多的人所認識。充分了解主動脈瓣發育和BAV形成的分子機制將大大優化 BAV治療策略。王建安院士團隊的原創研究[18]發現了一種新型的導致 BAV的ADAMTS16p.H357Q變體,而ADAMTS16 缺乏會導致BAV的形成,從而揭示了BAV患者發病的新機制。
2.2 吳永健教授團隊:中國原創AI算法—提高了TAVR術前評估質量
主動脈瓣復合體的CT成像評估對于TAVR的成功至關重要。然而,TAVR術前評估耗時長,并且結果因人而異。吳永健教授團隊開發并驗證了一種基于深度學習的算法,用于TAVR術前CT評估和解剖風險因素的檢測,該算法與資深影像醫師相比具有顯著的一致性[19]。此研究發表于Lancet子刊上,引發業界熱議,有望改善臨床實踐中的 TAVR方案。
2.3 復旦中山團隊:Hanchor Valve的研究結果及“三明治”法
復旦大學附屬中山醫院團隊在大會上報告了Hanchor Valve的初步研究結果。Hanchor Valve經導管主動脈瓣膜系統是國內首款球囊擴張式經股入路的可治療PAR的瓣膜產品,Hanchor Valve單中心27例確證性臨床研究[20]結果顯示,術中無不良事件發生,平均導管操作時間短,所有患者術后即刻反流降至無或者微量,左室舒張末期內徑明顯改善,展現了這一產品廣闊的應用前景,是國產醫療器械的一次重大突破。此外,潘文志教授通過1例超大瓣環單純天然主動脈瓣反流(pure native aortic regurgitation,PNAR)病例,向全球同行展示了其與周達新教授發明的“三明治”植入法。由于PNAR解剖特點的復雜性、手術技術要求高、手術并發癥多等因素,長期以來被視為TAVR的相對禁忌證,并且目前尚無針對性器械獲批上市。潘文志教授[21]詳細介紹了為此類患者行TAVR的挑戰所在,以及“三明治”法瓣中瓣植入技術的操作要點與臨床效用,為進一步提高PNAR患者TAVR的手術成功率和安全性提供了有跡可循的參考方向。
2.4 宋光遠教授攜團隊成功完成TaurusTrio多中心注冊臨床研究首例入組
2023年7月6日,宋光遠教授攜團隊于首都醫科大學附屬安貞醫院成功完成TaurusTrio多中心注冊臨床研究首例入組。首日入組病例均為不能常規開展外科手術的重度AR患者,手術過程順利,人工瓣膜植入后位置理想,形態良好,術后即刻反流消失,平均導管操作時間20 min,最快僅10 min,驗證了TaurusTrio在標準化手術流程指導下的安全性與易操作性,也標志著經股動脈(transfemoral,TF)-TAVR治療AR這一新技術再次邁出了堅實的一步。
2.5 《單純主動脈瓣反流經股動脈主動脈瓣置換中國專家共識2023》重磅發布
TAVR最初被應用于治療AS,隨后逐漸拓展到AR治療領域,然而我國尚無具有AR適應證的TF-TAVR器械上市。國內外學者正探索使用針對AS的TAVR瓣膜以“超適應證”的方式治療AR患者的可能性,結果顯示該方式可作為外科手術高危患者的一種選擇。盡管如此,AR患者與AS患者在解剖結構、瓣膜選擇、操作方式以及并發癥等方面差異較大,總體上使用TF-TAVR瓣膜治療AR手術難度大,成功率較AS低。為了促進我國TF-TAVR治療AR的安全、規范、健康發展,為該技術的臨床使用提供支持和指導,同時也為臨床超適應證使用提供合規性支持,中國醫師協會心血管內科醫師分會結構性心臟病學組編寫了《單純主動脈瓣反流經股動脈主動脈瓣置換中國專家共識2023》[22],成為國際首個PAR專家共識。執筆專家團隊針對AR患者TF-TAVR臨床實踐中的重點及難點,結合所檢索到的文獻(截至2023年9月1日)的證據力度,梳理出9個核心問題并做出深入分析,形成9個核心觀點。推薦等級參照GRADE(Grading of Recommendations,Assess,Development and Evaluation),涵蓋適應證、瓣膜選擇、術前評估、術中操作要點、并發癥防治、術后管理等方面。
3 國內應用研發情況
3.1 開展應用情況
自葛均波院士帶領團隊在2010年開展我國首例TAVR手術以來,我國的TAVR手術量呈現穩定上升的趨勢。我國已于2023年度(截至11月30日)開展TAVR手術13 572 例(商業化12 952例,臨床試驗620例),預計全年植入量約1.5萬例,較去年的8439例有顯著提升。而TAVR植入量排名前5位的省或直轄市依次是北京、四川、廣東、上海、浙江。
根據瓣膜中心NTCVR數據庫顯示,目前我國TAVR手術最主流的麻醉方式仍為全身麻醉,占89%,而最常用的入路仍是經股動脈,占76.8%,其次為經心尖,占21.7%,這也是我國開展TAVR技術的一大特色。在患者自身情況方面,隨著TAVR適應證拓寬,中風險和低風險的TAVR患者逐漸增多。2010年至今,在接受TAVR手術的患者中,中風險TAVR患者(STS評分4%~8%)占44.18%,低風險患者(STS評分<4%)占38.43%。中國瓣膜中心數據庫NTCVR分析數據顯示,2010年以來我國接受TAVR手術的BAV和三葉式主動脈瓣(無融合型)患者的數量接近,三葉瓣略多,為52.31%,而二葉瓣患者中又以0型二葉瓣和1型二葉瓣為主。在圍術期事件方面,TAVR圍術期不良事件發生率不斷降低,目前發生率排名前3的圍術期不良事件分別為新發左束支傳導性阻滯(8.60%)、新發房室傳導阻滯(6.96%)和永久起搏器植入(6.54%),而其中永久起搏器植入發生率已較前顯著下降。
3.2 新器械研發進展
截至目前,在我國獲批上市的TAVR瓣膜共有6款,分別為VenusA/VenusA plus、J-Valve TA、VitaFlow/VitaFlow Liberty、Sapien 3、Taurus One/Elite、Evolut Pro,而還處于臨床試驗或研發階段的TAVR瓣膜更是多達20余款,主要器械見圖1。用于治療PAR的TF-TAVR器械的研發已在我國成為新熱點,步伐領先世界,包括Hanchor Valve、TF J-Valve、 TF JenaValve、DOCS Valve、PioneerValve5種器械,前3者已經完成上市前臨床試驗入組。而目前未上市的國產球囊擴張式瓣膜產品(包括PrizeValve、MuguetA、Renatus 3種瓣膜)均已完成臨床試驗入組或遞交上市審批材料,標志著我國在球囊擴張式瓣膜市場的空白即將被填補。此外,目前已上市的新型自膨脹式瓣膜(具有全可回收、短瓣架、干瓣等特性)正在對產品進行迭代升級,有望在未來取得更好的療效。在瓣膜材料方面,我國研發的聚合物瓣膜引領未來。世界首個聚合物TAVR瓣膜TRISKELE(以心醫療)已于2023年7月完成首次植入手術,初步臨床研究結果優秀[23]。由此可見,我國TAVR瓣膜的研發熱度不減,呈現百舸爭流之勢。
 圖1
2023年中國經導管主動脈瓣置換術瓣膜匯總
圖1
2023年中國經導管主動脈瓣置換術瓣膜匯總
4 2024年度展望
(1)雖然目前TAVR發展有放緩的趨勢,但在局部方向仍有較大的發展空間,如PAR、低齡患者以及中度或無癥狀患者。(2)國際TAVR臨床研究將持續進行,主要集中在小瓣環、瓣膜耐久性、冠狀動脈入路、全生命周期管理等方面。(3) 2024年我國TAVR仍將保持快速增長趨勢,預計年植入量將達2萬例。隨著《單純主動脈瓣反流經股動脈主動脈瓣置換中國專家共識2023》的發布及技術的提高,PAR的TF-TAVR手術量將明顯增加。(4)幾款新型自膨脹式瓣膜和球囊擴張式瓣膜最快將于2024年獲批上市。
利益沖突:無。
作者貢獻:潘文志收集數據,查閱文獻,撰寫、修改初稿;方雁行撰寫初稿;李捷與李飛收集數據、查閱文獻;周達新與葛均波審核修改。