國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)于近期正式發布了第九版肺癌TNM分期。本次分期基于全新的數據庫,涵蓋2011—2019年間25個國家75個中心的124 581例肺癌患者的數據,在排除數據不完整的患者后,共納入87 043例患者的資料,并基于此分析結果,對第八版肺癌TNM分期進行調整,更新成第九版肺癌TNM分期。此版中亞洲患者占比提升,中國患者占比增幅顯著。第九版肺癌TNM分期將為肺癌診治及預后評估提供更合理的參考依據。本文就IASLC第九版肺癌TNM分期標準的數據庫更新、分期變化及其修訂依據進行解讀,為廣大臨床醫生提供參考。
引用本文: 趙珂嘉, 劉成武, 劉倫旭. 《IASLC第九版肺癌TNM分期》解讀. 中國胸心血管外科臨床雜志, 2024, 31(4): 489-497. doi: 10.7507/1007-4848.202403015 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌TNM分期是指導肺癌診治及預后評估的重要依據,其發展歷程可分為三個階段。第一階段(UICC版和AJCC版,1968—1986年),1968年國際抗癌聯盟 (Union for International Cancer Control, UICC) 首次發布了癌癥TNM分期指南[1]。隨后1977年美國癌癥聯合委員會( American Joint Committee on Cancer,AJCC)也發布了其第一版癌癥TNM分期,為美國醫生提供實體癌診療參考[2]。此后,UICC版和AJCC版的TNM分期平行存在并各自更新。第二階段(UICC/AJCC版,1987—2006年):1987年UICC和AJCC的TNM分期合并統一,業內統稱為UICC/AJCC癌癥TNM分期,并于2002年更新至第六版[3]。第三階段(IASLC建議版,2007年至今):國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)于1997年成立了下屬機構即分期和預后因素委員會(Staging and Prognostic Factors Committee,SPFC),旨在制定更科學合理的國際通用版肺癌TNM分期。該項工作得到癌癥研究與生物統計學中心(Cancer Research and Biostatistics,CRAB)的協助,CRAB為其提供了巨量肺癌患者數據[4]。SPFC對這些數據進行了分析,并于2007年提出了修訂TNM分期的系列建議[5-8]。這些建議被UICC和AJCC采納并形成了第七版肺癌TNM分期。2015年,IASLC根據1999—2010年的77 156例有效肺癌患者的數據分析,更新了第八版肺癌TNM分期,即我們現今使用的肺癌分期標準[9-10]。
第八版肺癌TNM分期于2017年1月1日起正式施行,至今已有7年。而近年來靶向治療、免疫治療等諸多治療手段的創新和進步顯著提高了肺癌患者預后。舊數據庫中的資料難以反映當前狀況,因此基于新數據庫修訂新版肺癌TNM分期勢在必行。近期,IASLC在Journal of Thoracic Oncology雜志上發布了全新版本(第九版)肺癌TNM分期標準[11]。第九版分期與第八版分期的基本框架相同,第九版分期采用了近年來的病例進行分析,且增加了病例來源的多樣性,尤其是大量增加了中國肺癌患者的臨床數據。因此,第九版分期更貼近國人的臨床現狀。此外,第九版在N分期、M分期和TNM分期方面有多處更新,分期更科學,更符合肺癌患者預后的實際情況,為肺癌診療和預后評估提供重要依據。
1 第九版肺癌分期數據庫
IASLC在2023年2月發布了第九版肺癌分期數據庫[12]。該數據庫收集了2011—2019年期間來自25個國家和75個中心的124 581例肺癌患者的臨床資料。其中亞洲64 045例(51.4%),歐洲30 827例(24.7%),北美洲19 608 例(15.7%),澳洲5 704例(4.6%),中南美洲4 225例(3.4%),非洲及中東172例(0.1%)[12]。排除不合格患者的臨床資料后,納入87 043例有效患者的臨床資料用于分析,其中浸潤性腺癌52 069例(59.8%),鱗狀細胞癌15 872例(18.2%),原位腺癌1 142例(1.3%),腺鱗癌1 100例(1.3%),大細胞癌1 057例(1.2%),小細胞癌5 530例(6.4%),大細胞神經內分泌癌689例(0.8%)[12]。
第九版肺癌分期數據庫的數據來源分為兩種形式,分別是經過預處理的批量數據集和保留原始數據的病歷電子數據采集(electronic data capture, EDC)系統。EDC系統支持投稿者在線提交及檢索自身研究數據。該系統含有T分期、N分期及M分期的判定要素,以及在臨床分期或病理分期中分類的具體理由[12]。相比批量數據集,EDC系統在實時性、準確性、可追溯性及靈活性等諸多方面具有顯著優勢,更適合用于臨床研究數據的采集與傳輸。然而,由于傳統習慣、成本考慮及法規要求等多重因素,第九版肺癌分期數據庫中EDC所占比例僅為18.9%(23 548/124 581),大部分數據仍以批量數據集形式提交。四川大學華西醫院作為國內重要的數據貢獻方,共提供8 010例患者的數據,占總數據的6.4%(8 010/124 581),且全部為EDC數據,占數據庫全部EDC病例的34.0%(8 010/23 548)[12]。
相較于第七版[4]或第八版數據庫[10],第九版肺癌分期數據庫有諸多改變(表1)。在收集時間方面,第九版肺癌分期數據庫采用了2011年后的臨床數據,更準確地捕獲了當前肺癌診療的現狀。數據量方面,本次共計納入124 581例患者及87 043例患者的有效數據,皆創下歷年之最。病例分布方面,亞洲患者所占比例穩步提升,自第七版的11.5%升至第八版的44.0%,第九版高達51.4%。其中,我國患者的比重顯著增長,從第八版的0.8%升至第九版的12.1%,這意味著第九版肺癌TNM分期結果能更真實地反映我國肺癌患者的實際預后。然而,有效數據中小細胞肺癌的患者數由第七版的13 032例(16.0%,13 032/81 495)持續下降至第九版的5 530例(6.4%,5 530/87 043)[4,12]。因此,第九版肺癌TNM分期數據庫能否更準確反映小細胞肺癌預后仍需進一步觀察。總的來說,新版數據庫采用了近年肺癌患者的數據,并增加了患者來源的多樣性,特別是我國肺癌患者例數大幅擴充。因此,第九版肺癌TNM分期數據庫更科學合理的同時也更加符合我國的臨床實際情況。
2 第九版肺癌TNM分期變化及其修訂依據
2.1 T分期
T分期無改動(表2)。盡管第九版T分期的定義與前一版保持一致,但特別值得注意的是,SPFC就T3分期的不同亞型(侵犯胸壁的T3與其他類型的T3)在預后方面的差異提出了深入的探討。研究[13]發現,在病理分期中,pT3-侵犯胸壁組的患者預后顯著差于pT3-其他類型組,甚至接近于pT4的預后情況。然而,這一預后差異在臨床分期中并未得到體現,即cT3-侵犯胸壁組與cT3-其他類型組的患者在預后上并無明顯差別。考慮到T3分期在不同情境下(病理與臨床)的預后差異性,第九版分期系統最終決定將侵犯胸壁或壁層胸膜的情況仍歸類為T3,而并未升級至T4。我們列出了歷次 IASLC 版 T 分期的演變情況(表3)。
在第九版肺癌TNM分期數據庫分析結果的支持下,第九版T分期再次驗證了第八版分期對肺癌患者預后評估的準確性,尤其是腫瘤最大徑作為預后評估的關鍵因素。在近10年的研究中,盡管我們對早期肺癌的異質性、生物學行為以及其他危險因素(如不良病理亞型、脈管癌栓、神經侵犯、氣腔內播散等)有了更為深入的認識,但由于這些信息在臨床治療前的獲取難度較大,因此在分期系統中的實際應用仍然有限,未能撼動腫瘤最大徑在分期和預后評估中的核心地位。
2.2 N分期
新版N分期將原N2淋巴結轉移細分為N2a(單站轉移)及N2b(多站轉移)(表2)。自2007年IASLC首次發布第七版N分期[6]以來,該分期系統已在臨床實踐中廣泛應用了16年。盡管在2015年,IASLC推出了第八版N分期[14],但其并未對第七版內容進行實質性修改。然而,隨著醫療技術的不斷進步和臨床研究數據的積累,不少研究者呼吁對N分期進行更精細劃分。第九版N分期[15]基于對大規模臨床數據的分析(包括45 032例臨床N分期和35 009例病理N分期)將N2細分為N2a(單站轉移)及N2b(多站轉移)。
在N分期的亞組分析中,研究者運用Kaplan-Meier生存分析法,對不同亞組分類間的5年生存率進行了深入評估。若所觀察到的生存率差異小于5%,則該亞組分類被視為在臨床上無顯著意義[15]。為了更精確地揭示這些差異,研究者[15]進一步采用了多變量Cox比例風險生存模型來確定各亞組的風險比。在N分期的亞組分析中,研究者對N1a(單站N1)、N1b(多站N1)、N2a1(不涉及N1的單站N2或跳躍性轉移)、N2a2(涉及N1的單站N2)以及N2b(多站N2)進行了詳盡的探索性分析。研究[15]結果顯示,各個N1亞類之間的5年生存率估計值差異以及N1亞類與N2a1之間的差異均較小,差異無統計學意義,并且在臨床和病理分期上也未呈現出一致性。相比之下,N2亞組之間的差異有統計學意義。基于上述分析結果,第九版N分期決定維持對N0、N1、N3的原有描述,僅對N2進行細分,將其劃分為N2a和N2b兩個子類別[15]。這一調整旨在更準確地反映不同N2亞組之間的生存率差異,并為臨床實踐提供更精準的分期指導。此外,我們列出了歷次 IASLC 版 N 分期的演變情況(表4)。
臨床實踐中,N分期對治療方案的選擇具有重要影響。單站與多站、融合與非融合、可切除與不可切除等因素都會直接影響治療策略制定。過去,由于對此類患者劃分不夠精細,N2患者的治療模式存在混亂,包括誘導治療后手術、根治性同步放化療以及直接按晚期患者治療等不同方法。新的TNM分期將單站N2患者單獨分類,為臨床醫生提供了更為明確的指導,有助于實現局部晚期患者的細分和個體化治療。對于臨床醫生而言,需在臨床診斷期間提高正電子發射計算機斷層掃描(PET-CT)、有創淋巴結活檢等的使用率,以提高臨床分期的準確性;對可切除或潛在可切除患者的謹慎評估,關乎外科手術在局部晚期肺癌中的參與度;對于手術患者,應規范淋巴結清掃的范圍與質量控制,確保術后病理分期的準確性,以指導術后輔助治療。
2.3 M分期
將原M1c(胸腔外多轉移灶)細分為M1c1(胸腔外的多轉移灶在同一器官)和M1c2(胸腔外的多轉移灶在不同器官)(表2)。自2007年IASLC首次發布第七版M分期[7]以來,M分期的修訂重點在于深入探討胸腔外轉移情況。我們列出各版M 分期演變情況(表5)。2015年發布的第八版將第七版中的M1b(胸腔外轉移)細分為M1b(胸腔外單轉移灶)與M1c(胸腔外多轉移灶)[16]。第九版將M1c(胸腔外多轉移灶)進一步細分為M1c1(胸腔外的多轉移灶在同一器官)和M1c2(胸腔外的多轉移灶在不同器官)[11]。在M分期亞組分析中,研究人員[17]運用Kaplan-Meier生存分析法及多變量Cox比例風險生存模型探討各M分期細分是否具有臨床意義。結果顯示,胸腔外多轉移灶在同一器官(M1c1)的腫瘤患者生存結果[中位生存期 1.0(0.9~1.0)年]介于胸腔外單轉移灶(M1b)的腫瘤患者[中位生存期1.2(1.1~1.3)年]與胸腔外多轉移灶在不同器官(M1c2)的腫瘤患者[中位生存期 0.6(0.6~0.7)年]之間,因此對M1c的細分有臨床意義[17]。此外,研究者還對諸多M分期尚存困惑的情況進行了分析。臨床中,部分惡性胸腔積液檢測的細胞學結果呈現陰性,盡管如此,臨床醫生會結合臨床情況將其歸類為惡性胸腔積液。因此,關于惡性胸腔積液是否必須經細胞學證實這一問題存在爭議。研究[17]數據表明,細胞學確診與未確診的惡性積液在生存率方面的差異并無統計學意義。然而,這并不意味著我們可以忽視胸腔積液的細胞學檢測而僅憑醫生的主觀臆斷。此外,研究人員[17]也嘗試采用最大轉移灶的最大徑作為患者預后指標,發現最大轉移灶最大徑<1 cm的患者預后更好。
對于晚期患者,尤其是那些被歸類為“寡”轉移的患者,除了全身系統性藥物治療,局部治療確實可能為患者帶來顯著益處。然而,如何精確定義“寡”轉移這一概念在學術界一直爭議廣泛[18]。目前,關于肺癌寡轉移灶的具體定義尚未達成共識,不同的研究[19]在描述總轉移灶數、涉及的轉移器官數以及單個器官內的轉移灶數時均有差異。最近對M1c分期的進一步細分為我們提供了一個新的視角。將那些能夠通過整合局部治療手段進行治療的M1c1病例定義為“寡”轉移組,可能是一個有前景的方向。這樣的定義有助于更精確地識別那些可能從局部治療中獲益的患者。然而,這一想法的實用性和有效性仍需要更多的臨床研究來加以驗證和支持。
2.4 TNM分期及預后
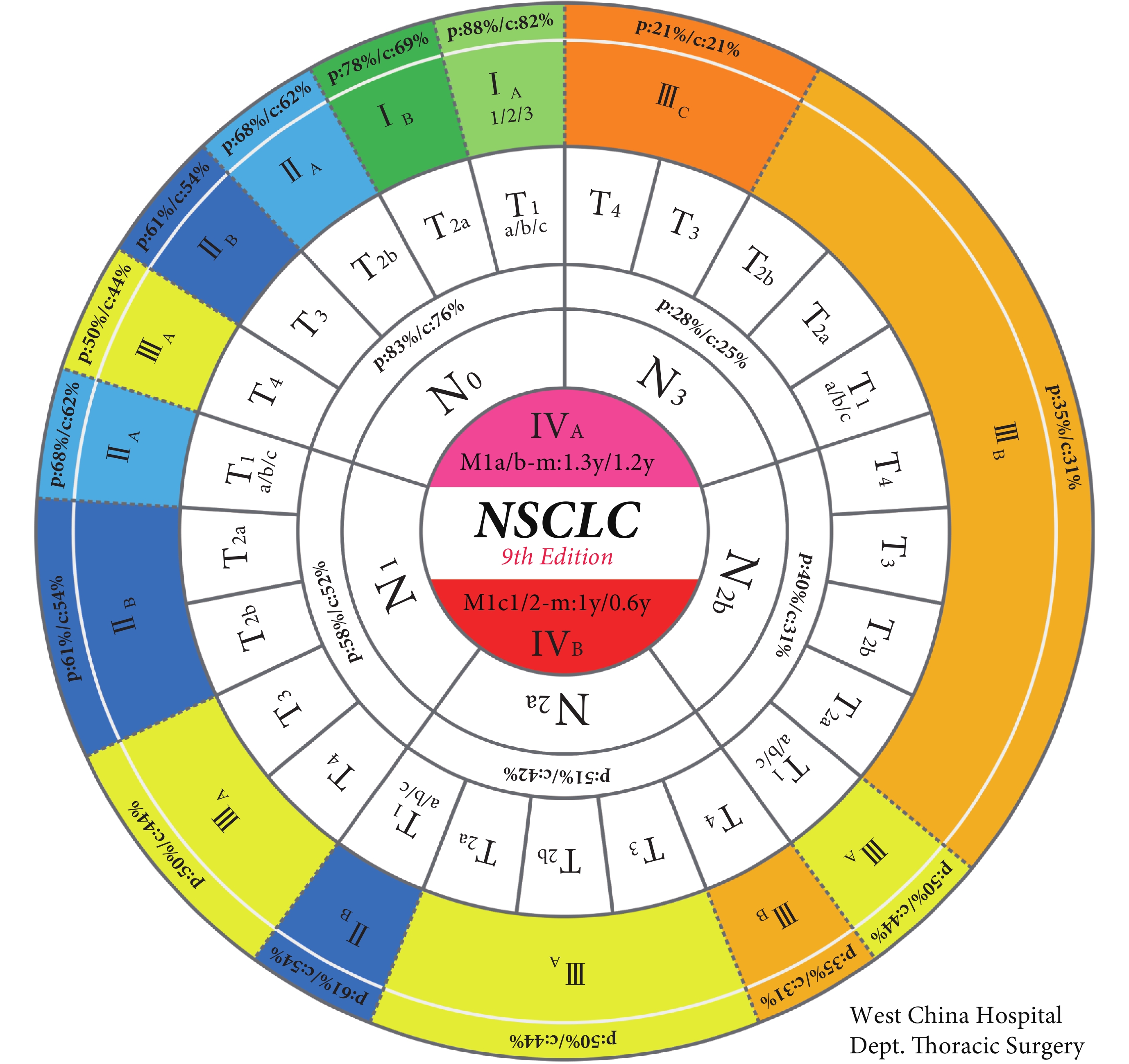
經過第九版N分期的調整,第九版TNM分期亦作相應變更。本次更新將T1N1M0的預后由ⅡB降為ⅡA。N2細分為N2a和N2b后其對應關系做了如下調整:T1N2aM0歸為ⅡB期; T2a~3N2aM0及T1N2bM0歸為ⅢA期;T4N2aM0及T2a~4N2bM0歸為ⅢB期,其余分期不變。我們總結了歷次IASLC版TNM分期演變(表6)[11]。盡管更為精細的N分期帶來了更精確的生存曲線,卻也增加了TNM分期的復雜性和記憶難度。因此,我們為第九版肺癌TNM分期設計了一種全新的呈現形式(圖1),考慮到臨床實踐中通常按M-N-T的順序判斷分期,故本圖的設計暗合此邏輯規律。由內向外,首先確定相應的M分期情況,再確定N分期,繼而確定T分期,最終確定對應的TNM分期。該TNM分期圖清晰美觀,從業者可以通過該圖迅速確定相應TNM 分期及預后情況,這些數據對于醫生判斷預后及決定后續治療策略都有重要參考價值。此外,第九版肺癌TNM分期表格法的呈現方式也總結至表7,以供參閱。
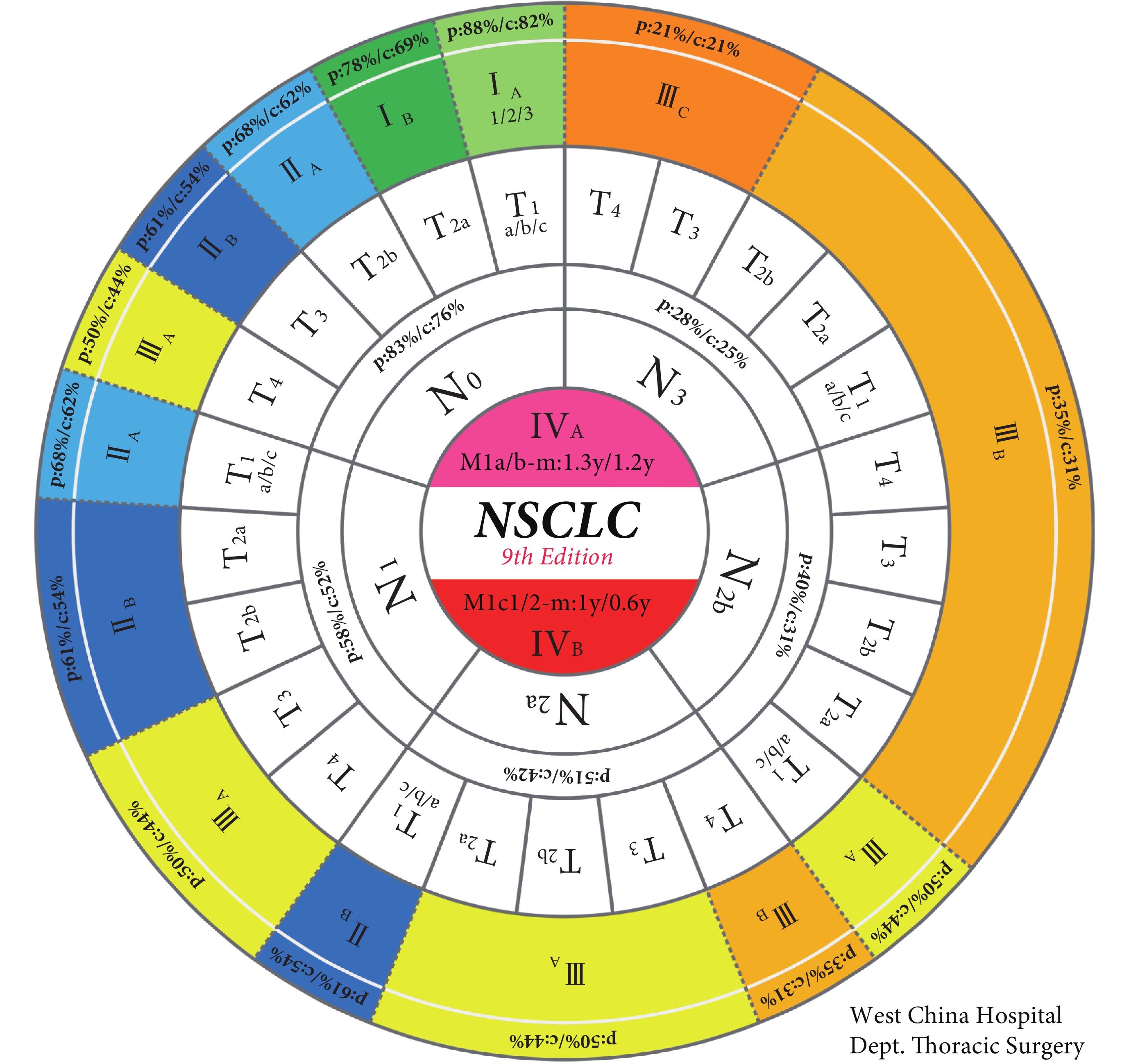 圖1
第九版肺癌TNM分期圖
圖1
第九版肺癌TNM分期圖
p:pathologic(病理分期對應的預后);c:clinical(臨床分期對應的預后);m:median survival(中位生存期);y:year(年)
3 總結與展望
肺癌TNM分期是診治肺癌的基石,其為描述肺癌提供了清晰且統一的定義,從而確保相關從業者之間可以準確無誤地溝通。此外,其對患者個體分期的評估以及預后的判斷均具有重要意義,因此每次肺癌TNM分期更新都是學界重大事件。
相較第八版分期,第九版肺癌TNM分期在諸多方面取得了顯著進步。盡管新數據庫仍存在患者分布不均等問題,但其依然展示出以下亮點:(1)本次收錄的患者總數及有效患者數均為各版本最多;(2)在患者分布上,亞洲患者占比(51.4%)穩步提升,尤其是中國患者占比從第八版的0.8%升至第九版的12.1%;(3)EDC病例占比持續增長,為后續更多可能的分析研究奠定基礎,且我國EDC病例總數和占比都走在了世界前列。TNM分期的改動方面:T分期:無改動;N分期:將原N2淋巴結轉移細分為N2a(單站轉移)及N2b(多站轉移);M分期:將原M1c(胸腔外多轉移灶)細分為M1c1(胸腔外的多轉移灶在同一器官)和M1c2(胸腔外的多轉移灶在不同器官)。TNM分期及預后也根據上述變更做了相應調整。最后,新的TNM分期在生存曲線分層上表現優異,這種更為細致的分期不僅有助于更精確地反映疾病的進展狀況和預后情況,還將進一步影響后續治療策略的選擇。
隨著肺癌治療策略的多元化發展,技術進步不斷拓展治療的邊界,例如針對寡轉移性疾病的局部療法,使得部分Ⅳa期患者也獲得手術機會。然而,當前肺癌TNM分期系統自1968年首版發布以來,仍主要基于解剖學范疇進行界定,這在很大程度上已無法充分滿足現代肺癌治療,尤其是迅速發展的靶向治療和免疫治療等系統性治療手段對預后判斷的需求。近年來,大數據和人工智能技術在醫學領域的應用日益廣泛,特別是在癌癥診療和預后評估方面展現出巨大潛力。對于肺癌TNM分期系統而言,這些技術有望帶來革命性的變革。通過整合各大醫院構建的肺癌大數據,我們能夠獲取更大規模、更具代表性的患者信息,進而使TNM分期系統更精確地反映不同患者群體的特征。同時,結合人工智能的深度學習和數據挖掘技術,我們有望從海量數據中發掘出新的分期模式和治療響應特征,為肺癌診療提供更加科學、個性化的依據。此外,我們還迫切希望找到與現有TNM分期系統相聯動的生物標志物,以更準確地預測各種治療方式下患者的預后情況。然而,目前IASLC的數據庫尚未實現這一目標。雖然我們期望TNM分期能涵蓋更多影響因素,以便更準確評估不同分期和治療狀況下的患者預后,但也需謹記Detterbeck(第九版分期負責人之一)[20]所言,“分期并不是為了包含所有預后和治療選擇的因素,它不是預后模型或治療指南,只是預后評估和協助確定治療方案的工具。”最后,我們向以Asamura博士、Nishimura博士與Ramón Rami-Porta博士為代表的眾多第九版TNM分期奠基人致敬,同時感謝IASLC和CRAB對于肺癌TNM分期系統做出的卓越貢獻。我們期待IASLC在未來能夠繼續推陳出新,不斷改善肺癌TNM分期系統。
利益沖突:無。
作者貢獻:趙珂嘉和劉成武負責文獻檢索、數據分析及文章撰寫;劉倫旭負責本文構思與設計、文章修改及對審核定稿。
聲明:編輯本文英文摘要時采用AiBot機器人對話(由微信號chatgpt1231注冊)進行英文語言潤色,并經人工核對。
肺癌TNM分期是指導肺癌診治及預后評估的重要依據,其發展歷程可分為三個階段。第一階段(UICC版和AJCC版,1968—1986年),1968年國際抗癌聯盟 (Union for International Cancer Control, UICC) 首次發布了癌癥TNM分期指南[1]。隨后1977年美國癌癥聯合委員會( American Joint Committee on Cancer,AJCC)也發布了其第一版癌癥TNM分期,為美國醫生提供實體癌診療參考[2]。此后,UICC版和AJCC版的TNM分期平行存在并各自更新。第二階段(UICC/AJCC版,1987—2006年):1987年UICC和AJCC的TNM分期合并統一,業內統稱為UICC/AJCC癌癥TNM分期,并于2002年更新至第六版[3]。第三階段(IASLC建議版,2007年至今):國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)于1997年成立了下屬機構即分期和預后因素委員會(Staging and Prognostic Factors Committee,SPFC),旨在制定更科學合理的國際通用版肺癌TNM分期。該項工作得到癌癥研究與生物統計學中心(Cancer Research and Biostatistics,CRAB)的協助,CRAB為其提供了巨量肺癌患者數據[4]。SPFC對這些數據進行了分析,并于2007年提出了修訂TNM分期的系列建議[5-8]。這些建議被UICC和AJCC采納并形成了第七版肺癌TNM分期。2015年,IASLC根據1999—2010年的77 156例有效肺癌患者的數據分析,更新了第八版肺癌TNM分期,即我們現今使用的肺癌分期標準[9-10]。
第八版肺癌TNM分期于2017年1月1日起正式施行,至今已有7年。而近年來靶向治療、免疫治療等諸多治療手段的創新和進步顯著提高了肺癌患者預后。舊數據庫中的資料難以反映當前狀況,因此基于新數據庫修訂新版肺癌TNM分期勢在必行。近期,IASLC在Journal of Thoracic Oncology雜志上發布了全新版本(第九版)肺癌TNM分期標準[11]。第九版分期與第八版分期的基本框架相同,第九版分期采用了近年來的病例進行分析,且增加了病例來源的多樣性,尤其是大量增加了中國肺癌患者的臨床數據。因此,第九版分期更貼近國人的臨床現狀。此外,第九版在N分期、M分期和TNM分期方面有多處更新,分期更科學,更符合肺癌患者預后的實際情況,為肺癌診療和預后評估提供重要依據。
1 第九版肺癌分期數據庫
IASLC在2023年2月發布了第九版肺癌分期數據庫[12]。該數據庫收集了2011—2019年期間來自25個國家和75個中心的124 581例肺癌患者的臨床資料。其中亞洲64 045例(51.4%),歐洲30 827例(24.7%),北美洲19 608 例(15.7%),澳洲5 704例(4.6%),中南美洲4 225例(3.4%),非洲及中東172例(0.1%)[12]。排除不合格患者的臨床資料后,納入87 043例有效患者的臨床資料用于分析,其中浸潤性腺癌52 069例(59.8%),鱗狀細胞癌15 872例(18.2%),原位腺癌1 142例(1.3%),腺鱗癌1 100例(1.3%),大細胞癌1 057例(1.2%),小細胞癌5 530例(6.4%),大細胞神經內分泌癌689例(0.8%)[12]。
第九版肺癌分期數據庫的數據來源分為兩種形式,分別是經過預處理的批量數據集和保留原始數據的病歷電子數據采集(electronic data capture, EDC)系統。EDC系統支持投稿者在線提交及檢索自身研究數據。該系統含有T分期、N分期及M分期的判定要素,以及在臨床分期或病理分期中分類的具體理由[12]。相比批量數據集,EDC系統在實時性、準確性、可追溯性及靈活性等諸多方面具有顯著優勢,更適合用于臨床研究數據的采集與傳輸。然而,由于傳統習慣、成本考慮及法規要求等多重因素,第九版肺癌分期數據庫中EDC所占比例僅為18.9%(23 548/124 581),大部分數據仍以批量數據集形式提交。四川大學華西醫院作為國內重要的數據貢獻方,共提供8 010例患者的數據,占總數據的6.4%(8 010/124 581),且全部為EDC數據,占數據庫全部EDC病例的34.0%(8 010/23 548)[12]。
相較于第七版[4]或第八版數據庫[10],第九版肺癌分期數據庫有諸多改變(表1)。在收集時間方面,第九版肺癌分期數據庫采用了2011年后的臨床數據,更準確地捕獲了當前肺癌診療的現狀。數據量方面,本次共計納入124 581例患者及87 043例患者的有效數據,皆創下歷年之最。病例分布方面,亞洲患者所占比例穩步提升,自第七版的11.5%升至第八版的44.0%,第九版高達51.4%。其中,我國患者的比重顯著增長,從第八版的0.8%升至第九版的12.1%,這意味著第九版肺癌TNM分期結果能更真實地反映我國肺癌患者的實際預后。然而,有效數據中小細胞肺癌的患者數由第七版的13 032例(16.0%,13 032/81 495)持續下降至第九版的5 530例(6.4%,5 530/87 043)[4,12]。因此,第九版肺癌TNM分期數據庫能否更準確反映小細胞肺癌預后仍需進一步觀察。總的來說,新版數據庫采用了近年肺癌患者的數據,并增加了患者來源的多樣性,特別是我國肺癌患者例數大幅擴充。因此,第九版肺癌TNM分期數據庫更科學合理的同時也更加符合我國的臨床實際情況。
2 第九版肺癌TNM分期變化及其修訂依據
2.1 T分期
T分期無改動(表2)。盡管第九版T分期的定義與前一版保持一致,但特別值得注意的是,SPFC就T3分期的不同亞型(侵犯胸壁的T3與其他類型的T3)在預后方面的差異提出了深入的探討。研究[13]發現,在病理分期中,pT3-侵犯胸壁組的患者預后顯著差于pT3-其他類型組,甚至接近于pT4的預后情況。然而,這一預后差異在臨床分期中并未得到體現,即cT3-侵犯胸壁組與cT3-其他類型組的患者在預后上并無明顯差別。考慮到T3分期在不同情境下(病理與臨床)的預后差異性,第九版分期系統最終決定將侵犯胸壁或壁層胸膜的情況仍歸類為T3,而并未升級至T4。我們列出了歷次 IASLC 版 T 分期的演變情況(表3)。
在第九版肺癌TNM分期數據庫分析結果的支持下,第九版T分期再次驗證了第八版分期對肺癌患者預后評估的準確性,尤其是腫瘤最大徑作為預后評估的關鍵因素。在近10年的研究中,盡管我們對早期肺癌的異質性、生物學行為以及其他危險因素(如不良病理亞型、脈管癌栓、神經侵犯、氣腔內播散等)有了更為深入的認識,但由于這些信息在臨床治療前的獲取難度較大,因此在分期系統中的實際應用仍然有限,未能撼動腫瘤最大徑在分期和預后評估中的核心地位。
2.2 N分期
新版N分期將原N2淋巴結轉移細分為N2a(單站轉移)及N2b(多站轉移)(表2)。自2007年IASLC首次發布第七版N分期[6]以來,該分期系統已在臨床實踐中廣泛應用了16年。盡管在2015年,IASLC推出了第八版N分期[14],但其并未對第七版內容進行實質性修改。然而,隨著醫療技術的不斷進步和臨床研究數據的積累,不少研究者呼吁對N分期進行更精細劃分。第九版N分期[15]基于對大規模臨床數據的分析(包括45 032例臨床N分期和35 009例病理N分期)將N2細分為N2a(單站轉移)及N2b(多站轉移)。
在N分期的亞組分析中,研究者運用Kaplan-Meier生存分析法,對不同亞組分類間的5年生存率進行了深入評估。若所觀察到的生存率差異小于5%,則該亞組分類被視為在臨床上無顯著意義[15]。為了更精確地揭示這些差異,研究者[15]進一步采用了多變量Cox比例風險生存模型來確定各亞組的風險比。在N分期的亞組分析中,研究者對N1a(單站N1)、N1b(多站N1)、N2a1(不涉及N1的單站N2或跳躍性轉移)、N2a2(涉及N1的單站N2)以及N2b(多站N2)進行了詳盡的探索性分析。研究[15]結果顯示,各個N1亞類之間的5年生存率估計值差異以及N1亞類與N2a1之間的差異均較小,差異無統計學意義,并且在臨床和病理分期上也未呈現出一致性。相比之下,N2亞組之間的差異有統計學意義。基于上述分析結果,第九版N分期決定維持對N0、N1、N3的原有描述,僅對N2進行細分,將其劃分為N2a和N2b兩個子類別[15]。這一調整旨在更準確地反映不同N2亞組之間的生存率差異,并為臨床實踐提供更精準的分期指導。此外,我們列出了歷次 IASLC 版 N 分期的演變情況(表4)。
臨床實踐中,N分期對治療方案的選擇具有重要影響。單站與多站、融合與非融合、可切除與不可切除等因素都會直接影響治療策略制定。過去,由于對此類患者劃分不夠精細,N2患者的治療模式存在混亂,包括誘導治療后手術、根治性同步放化療以及直接按晚期患者治療等不同方法。新的TNM分期將單站N2患者單獨分類,為臨床醫生提供了更為明確的指導,有助于實現局部晚期患者的細分和個體化治療。對于臨床醫生而言,需在臨床診斷期間提高正電子發射計算機斷層掃描(PET-CT)、有創淋巴結活檢等的使用率,以提高臨床分期的準確性;對可切除或潛在可切除患者的謹慎評估,關乎外科手術在局部晚期肺癌中的參與度;對于手術患者,應規范淋巴結清掃的范圍與質量控制,確保術后病理分期的準確性,以指導術后輔助治療。
2.3 M分期
將原M1c(胸腔外多轉移灶)細分為M1c1(胸腔外的多轉移灶在同一器官)和M1c2(胸腔外的多轉移灶在不同器官)(表2)。自2007年IASLC首次發布第七版M分期[7]以來,M分期的修訂重點在于深入探討胸腔外轉移情況。我們列出各版M 分期演變情況(表5)。2015年發布的第八版將第七版中的M1b(胸腔外轉移)細分為M1b(胸腔外單轉移灶)與M1c(胸腔外多轉移灶)[16]。第九版將M1c(胸腔外多轉移灶)進一步細分為M1c1(胸腔外的多轉移灶在同一器官)和M1c2(胸腔外的多轉移灶在不同器官)[11]。在M分期亞組分析中,研究人員[17]運用Kaplan-Meier生存分析法及多變量Cox比例風險生存模型探討各M分期細分是否具有臨床意義。結果顯示,胸腔外多轉移灶在同一器官(M1c1)的腫瘤患者生存結果[中位生存期 1.0(0.9~1.0)年]介于胸腔外單轉移灶(M1b)的腫瘤患者[中位生存期1.2(1.1~1.3)年]與胸腔外多轉移灶在不同器官(M1c2)的腫瘤患者[中位生存期 0.6(0.6~0.7)年]之間,因此對M1c的細分有臨床意義[17]。此外,研究者還對諸多M分期尚存困惑的情況進行了分析。臨床中,部分惡性胸腔積液檢測的細胞學結果呈現陰性,盡管如此,臨床醫生會結合臨床情況將其歸類為惡性胸腔積液。因此,關于惡性胸腔積液是否必須經細胞學證實這一問題存在爭議。研究[17]數據表明,細胞學確診與未確診的惡性積液在生存率方面的差異并無統計學意義。然而,這并不意味著我們可以忽視胸腔積液的細胞學檢測而僅憑醫生的主觀臆斷。此外,研究人員[17]也嘗試采用最大轉移灶的最大徑作為患者預后指標,發現最大轉移灶最大徑<1 cm的患者預后更好。
對于晚期患者,尤其是那些被歸類為“寡”轉移的患者,除了全身系統性藥物治療,局部治療確實可能為患者帶來顯著益處。然而,如何精確定義“寡”轉移這一概念在學術界一直爭議廣泛[18]。目前,關于肺癌寡轉移灶的具體定義尚未達成共識,不同的研究[19]在描述總轉移灶數、涉及的轉移器官數以及單個器官內的轉移灶數時均有差異。最近對M1c分期的進一步細分為我們提供了一個新的視角。將那些能夠通過整合局部治療手段進行治療的M1c1病例定義為“寡”轉移組,可能是一個有前景的方向。這樣的定義有助于更精確地識別那些可能從局部治療中獲益的患者。然而,這一想法的實用性和有效性仍需要更多的臨床研究來加以驗證和支持。
2.4 TNM分期及預后
經過第九版N分期的調整,第九版TNM分期亦作相應變更。本次更新將T1N1M0的預后由ⅡB降為ⅡA。N2細分為N2a和N2b后其對應關系做了如下調整:T1N2aM0歸為ⅡB期; T2a~3N2aM0及T1N2bM0歸為ⅢA期;T4N2aM0及T2a~4N2bM0歸為ⅢB期,其余分期不變。我們總結了歷次IASLC版TNM分期演變(表6)[11]。盡管更為精細的N分期帶來了更精確的生存曲線,卻也增加了TNM分期的復雜性和記憶難度。因此,我們為第九版肺癌TNM分期設計了一種全新的呈現形式(圖1),考慮到臨床實踐中通常按M-N-T的順序判斷分期,故本圖的設計暗合此邏輯規律。由內向外,首先確定相應的M分期情況,再確定N分期,繼而確定T分期,最終確定對應的TNM分期。該TNM分期圖清晰美觀,從業者可以通過該圖迅速確定相應TNM 分期及預后情況,這些數據對于醫生判斷預后及決定后續治療策略都有重要參考價值。此外,第九版肺癌TNM分期表格法的呈現方式也總結至表7,以供參閱。
 圖1
第九版肺癌TNM分期圖
圖1
第九版肺癌TNM分期圖
p:pathologic(病理分期對應的預后);c:clinical(臨床分期對應的預后);m:median survival(中位生存期);y:year(年)
3 總結與展望
肺癌TNM分期是診治肺癌的基石,其為描述肺癌提供了清晰且統一的定義,從而確保相關從業者之間可以準確無誤地溝通。此外,其對患者個體分期的評估以及預后的判斷均具有重要意義,因此每次肺癌TNM分期更新都是學界重大事件。
相較第八版分期,第九版肺癌TNM分期在諸多方面取得了顯著進步。盡管新數據庫仍存在患者分布不均等問題,但其依然展示出以下亮點:(1)本次收錄的患者總數及有效患者數均為各版本最多;(2)在患者分布上,亞洲患者占比(51.4%)穩步提升,尤其是中國患者占比從第八版的0.8%升至第九版的12.1%;(3)EDC病例占比持續增長,為后續更多可能的分析研究奠定基礎,且我國EDC病例總數和占比都走在了世界前列。TNM分期的改動方面:T分期:無改動;N分期:將原N2淋巴結轉移細分為N2a(單站轉移)及N2b(多站轉移);M分期:將原M1c(胸腔外多轉移灶)細分為M1c1(胸腔外的多轉移灶在同一器官)和M1c2(胸腔外的多轉移灶在不同器官)。TNM分期及預后也根據上述變更做了相應調整。最后,新的TNM分期在生存曲線分層上表現優異,這種更為細致的分期不僅有助于更精確地反映疾病的進展狀況和預后情況,還將進一步影響后續治療策略的選擇。
隨著肺癌治療策略的多元化發展,技術進步不斷拓展治療的邊界,例如針對寡轉移性疾病的局部療法,使得部分Ⅳa期患者也獲得手術機會。然而,當前肺癌TNM分期系統自1968年首版發布以來,仍主要基于解剖學范疇進行界定,這在很大程度上已無法充分滿足現代肺癌治療,尤其是迅速發展的靶向治療和免疫治療等系統性治療手段對預后判斷的需求。近年來,大數據和人工智能技術在醫學領域的應用日益廣泛,特別是在癌癥診療和預后評估方面展現出巨大潛力。對于肺癌TNM分期系統而言,這些技術有望帶來革命性的變革。通過整合各大醫院構建的肺癌大數據,我們能夠獲取更大規模、更具代表性的患者信息,進而使TNM分期系統更精確地反映不同患者群體的特征。同時,結合人工智能的深度學習和數據挖掘技術,我們有望從海量數據中發掘出新的分期模式和治療響應特征,為肺癌診療提供更加科學、個性化的依據。此外,我們還迫切希望找到與現有TNM分期系統相聯動的生物標志物,以更準確地預測各種治療方式下患者的預后情況。然而,目前IASLC的數據庫尚未實現這一目標。雖然我們期望TNM分期能涵蓋更多影響因素,以便更準確評估不同分期和治療狀況下的患者預后,但也需謹記Detterbeck(第九版分期負責人之一)[20]所言,“分期并不是為了包含所有預后和治療選擇的因素,它不是預后模型或治療指南,只是預后評估和協助確定治療方案的工具。”最后,我們向以Asamura博士、Nishimura博士與Ramón Rami-Porta博士為代表的眾多第九版TNM分期奠基人致敬,同時感謝IASLC和CRAB對于肺癌TNM分期系統做出的卓越貢獻。我們期待IASLC在未來能夠繼續推陳出新,不斷改善肺癌TNM分期系統。
利益沖突:無。
作者貢獻:趙珂嘉和劉成武負責文獻檢索、數據分析及文章撰寫;劉倫旭負責本文構思與設計、文章修改及對審核定稿。
聲明:編輯本文英文摘要時采用AiBot機器人對話(由微信號chatgpt1231注冊)進行英文語言潤色,并經人工核對。