版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
二尖瓣反流(mitral regurgitation,MR)是全球最常見的心臟瓣膜病[1],其與心力衰竭的發生密切相關,未經治療的有癥狀的MR患者年全因死亡率超過5%[1-2]。我國研究[3]結果表明,老年人群中MR的發病率明顯高于主動脈瓣狹窄、主動脈瓣反流等,單純MR即占 26.9%[4]。國內研究人員[5]指出,需要治療的MR患者超過200萬例。
二尖瓣裝置主要由瓣環、瓣葉、腱索、乳頭肌以及鄰近的左心房室、壁組成。二尖瓣功能的正常進行要求二尖瓣瓣環大小合適、瓣葉結構完整、乳頭肌收縮牽拉腱索發揮瓣葉的支撐作用、左心室肌肉收縮產生關閉的力量適當、心室形態及功能正常。任何一個因素出現異常都會導致MR,若不加干預則會進展為不可逆的心力衰竭。MR按發生機制可分為SMR與DMR,DMR病因是瓣膜本身結構發生病變,主要包括二尖瓣粘液樣變,脫垂、連枷樣、腱索斷裂,退行性變(鈣化、增厚),感染性疾病,炎癥性疾病,先天性疾病[6];SMR即心臟本身或瓣膜周圍支撐結構發生病變[7],主要有缺血性心臟病、非缺血性心臟病,瓣環擴張[6]。
目前的臨床數據顯示MR患者大多年齡過高或合并有較多較重的慢性疾病,手術治療MR患者死亡風險高,約一半MR患者無法耐受傳統外科手術治療[8],MitraClip 作為具有代表性的緣對緣介入器械進行TEER技術,可有效減小瓣口面積,來滿足手術高危患者的臨床需求。此項技術的出現改變了嚴重的有癥狀的MR患者的治療現狀,并成功治療越來越多的復雜病例,是手術風險高或無法手術的中重度或者重度MR患者的一種有效治療選擇[9-10]。自2003年以來,據國外研究統計超過100 000名[9, 11-12]患有嚴重MR的患者接受了MitraClip技術的經導管二尖瓣修復治療,并且可有效治療高達80%的MR患者[13],并改善MR相關的臨床癥狀。
MitraClip作為一種新興的治療方法,首先用于DMR患者治療且被證實了其可行性,在SMR的MitraClip治療中,超過75%的SMR患者證實可使其二尖瓣功能等級得以改善[14-17],在SMR和DMR患者中成功實施的臨床數據證實該項技術可作為MR患者的有效治療手段[12, 18-19]。2017年歐洲心臟病學會/歐洲心胸外科協會瓣膜性心臟病管理指南(2b)以及2020年美國心臟病學會/美國心臟協會瓣膜病管理指南(2a)所推薦應用TEER技術治療MR[9, 20]。但由于SMR與DMR患者之間存在特征(年齡、合并癥)以及左心室與瓣膜結構功能之間的重要差異[21],因此關于兩組患者治療后的臨床結局仍然缺乏明確的療效對比[22-23]。因此,本研究旨在評估嚴重SMR和DMR患者在接受MitraClip治療后的短期和中期臨床療效差異,我們希望通過比較這兩種MR類型在接受MitraClip治療后的反應,為MR的個體化治療策略提供有價值的見解,并為未來臨床決策提供更精確、全面的指導。
1 資料與方法
1.1 納入和排除標準
1.1.1 研究類型
隨機對照研究驗(RCT)或隊列研究,限定為英文或中文文獻;
1.1.2 研究對象
經超聲心動圖或CT檢查結合基礎疾病診斷為SMR或DMR行MitraClip治療的患者
1.1.3 干預措施
實驗組為接受MitraClip的SMR患者,對照組為接受MitraClip的DMR患者
1.1.4 結局指標
主要結局指標為全因死亡率、1年心力衰竭再入院率,次要結局指標為手術成功率,術中夾子植入數,術后二尖瓣跨瓣壓差,二次外科開胸或再次導管介入治療。
1.1.5 排除標準
(1)難以區分具體MR類型的文獻;(2)植入夾子類型為非MitraClip的文獻;(3)無對應結局指標數據的文獻;(4)綜述、Meta、會議摘要等文獻;(5)非中、英文文獻;(6)無法獲取全文的文獻
1.2 檢索策略
計算機檢索PubMed、EMbase、the Cochrane Library、Web of Science、中國生物醫學文獻數據庫(CBM)、知網、萬方數據庫以及維普數據庫,收集關于SMR與DMR患者行MitraClip治療術后的的相關研究,檢索時限均為建庫至 2024 年 1 月。主要的英文檢索詞為transcatheter edge-to-edge mitral valve repair、MitraClip、TEER、subsequent mitral regurgitation、degraded mitral regurgitation等;主要的中文檢索詞為:經導管二尖瓣緣對緣修復,功能性二尖瓣反流、退行性二尖瓣反流等,檢索時采用主題詞、自由詞相結合。
1.3 文獻篩選與數據提取
兩位研究員各自獨立根據納排標準進行嚴格的文獻篩選和數據提取,隨后進行交叉核對,以確保準確性。當納入排除文獻有分歧不能解決時,由第三方介入協商后進行判定。文獻資料提取內容包括:(1)納入文獻的特征:第一作者、發表年限、研究類型等;(2)納入研究患者的基本資料:樣本量、年齡、性別、合并癥等;(3)手術相關資料:MR類型、二尖瓣鉗夾器械類型、手術持續時間等;(4)結局指標:全因死亡、心衰再入院率、術后二尖瓣跨瓣壓差等;(5)決定納入文獻的質量評價信息。
1.4 納入文獻的治療評價
采用Jadad量表對納入RCT進行文獻質量評價[24],采用紐卡斯爾-渥太華量表(Newcastle-Ottawa Scale,NOS)對納入隊列研究進行文獻質量評價[25],評分涉及3部分:(1)患者選擇(4 個條目,4 分);(2)組間可比性(1 個條目,2 分);(3)結果測量(3 個條目,3 分)。滿分 9 分,評價后分數越高則表明研究質量越高。≥7分為高質量研究,5~6 分為中等質量研究,≤4 分為低質量研究。
1.5 GRADE證據分級評價
運用GRADEpro進行證據質量評價,可分為高級、中級、低級、極低級,評價內容包括偏倚風險、不一致性、間接性、不精確性、發表偏倚5個方面。
1.6 統計學分析
采用Stata18.0軟件進行Meta分析。分類變量使用比值比(odds ratio,OR)為效應量,連續變量使用標準均數差(standard mean difference,SMD)為效應量,所有效應量均提供95%的置信區間(Confidence interval,CI)。應用χ2檢驗(設定α=0.10)和I2統計量進行納入文獻異質性評定。P值≥0.10且I2<50%時,納入研究之間不存在顯著的統計學異質性,采用固定效應模型進行Meta分析。反之,在P值<0.10或I2≥50%時,采用隨機效應模型進行Meta分析,Meta 分析的校驗水準為α=0.05。存在明顯臨床異質性時,采用亞組分析或逐一剔除法進行敏感性分析等方法處理,或只進行描述性分析。結局指標的發表偏倚通過漏斗圖判斷,再采用 Egger檢驗定量評價。
2 結果
2.1 文獻檢索及篩選結果
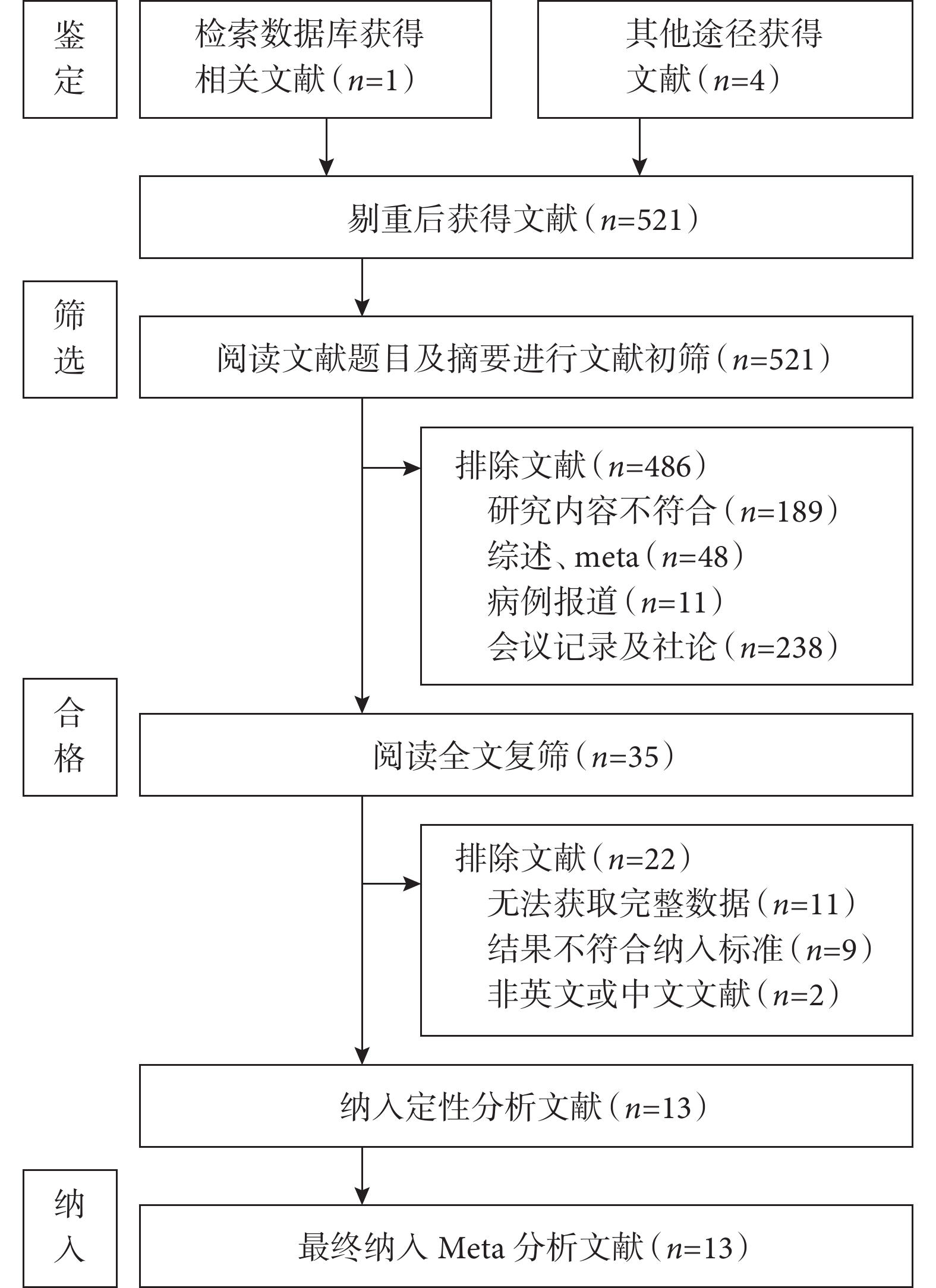
共檢索出 1 274 篇文獻,根據納排標準最終決定納入13[16, 26-37]篇臨床研究,共有6 707例患者,文獻篩選過程及結果見圖1。
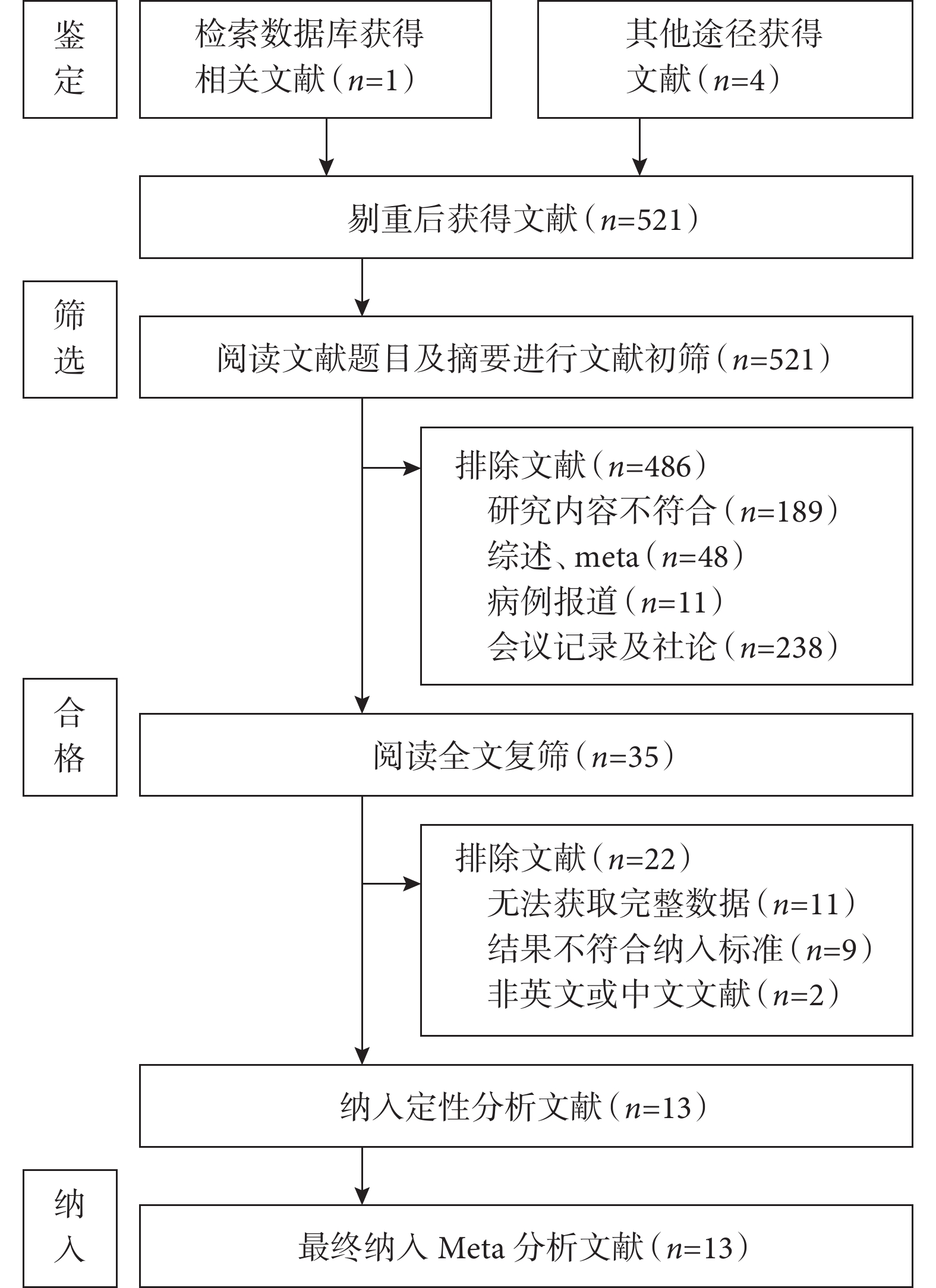 圖1
納入文獻篩選流程圖
圖1
納入文獻篩選流程圖
2.2 納入文獻及患者基本特征
納入研究NOS評分均≥6分,納入文獻特征見表1,患者基線資料見表2。兩組患者術前的STS評分、logistic EuroSCOREⅡ評分差異無統計學意義,logistic EuroSCOREⅠ評分[SMD=0.22,95%CI(0.07,0.38),P<0.01,I2=0%]DMR組患者評分高于SMR組患者,差異有統計學意義。
2.3 Meta分析結果
2.3.1 主要結局指標
2.3.1.1 全因死亡率
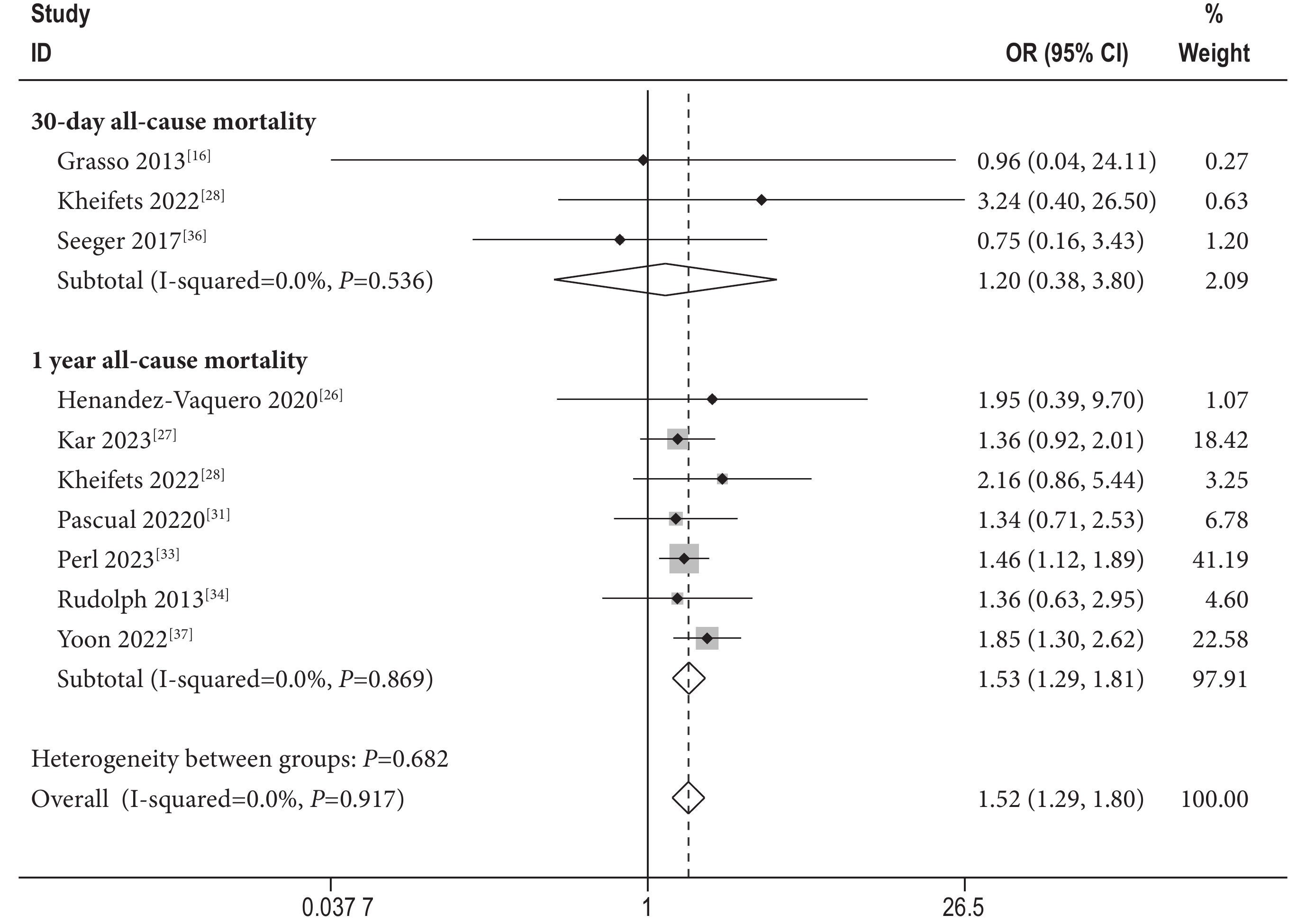
3篇文獻[16, 28, 36]報道了30 d全因死亡率,7篇文獻[26-28,32-34,37]報道了1年全因死亡率。采用固定效應模型進行Meta分析,結果顯示:經MitraClip治療后30 d全因死亡率[OR=1.20,95%CI(0.38,3.80),P=0.76,I2=0%]SMR組患者高于DMR組患者,差異無統計學意義。1 年全因死亡率[OR=1.53,95%CI(1.30,1.81),P<0.01,I2=0%]SMR組高于DMR組,差異有統計學意義(圖2)。
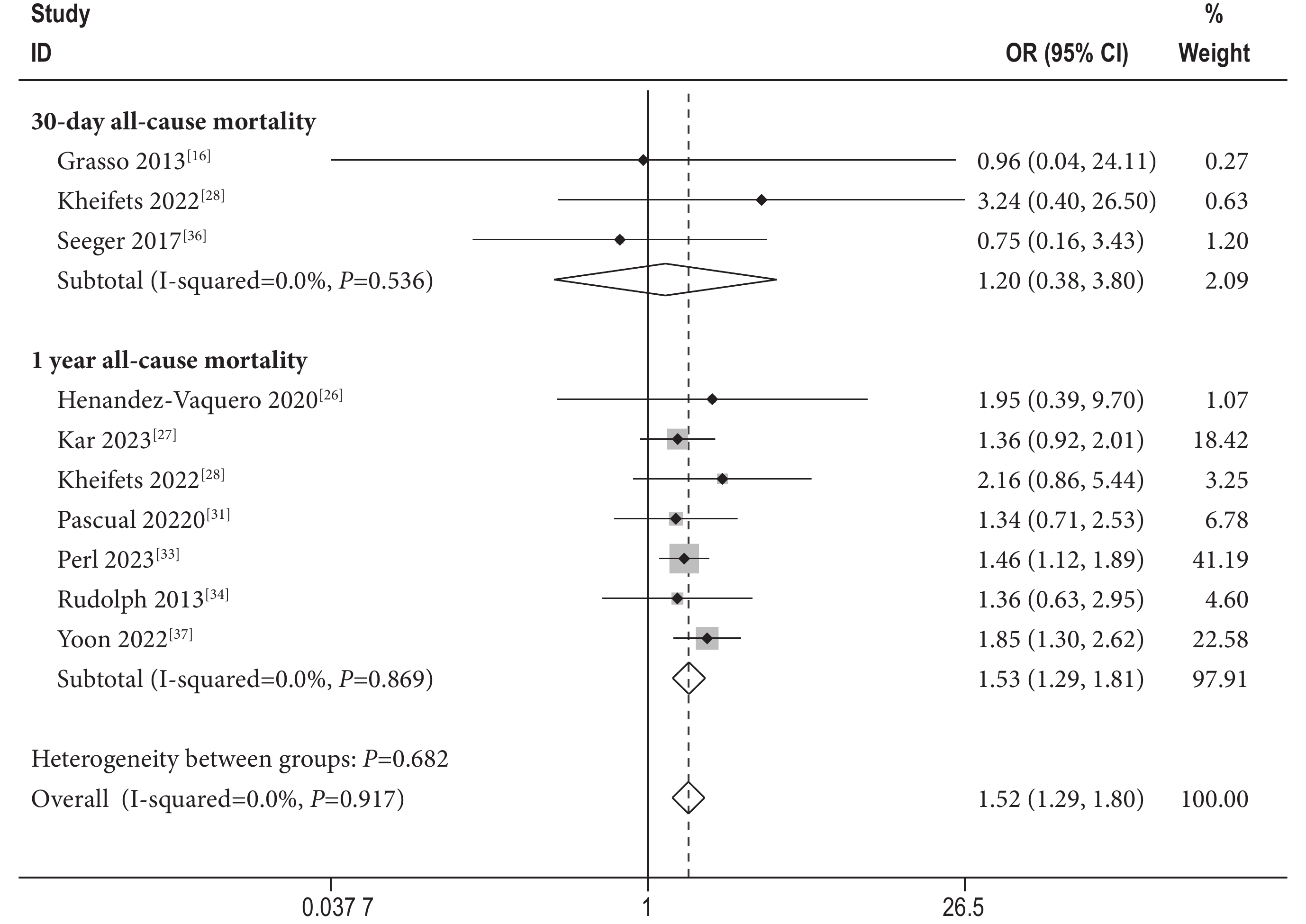 圖2
全因死亡率森林圖
圖2
全因死亡率森林圖
2.3.1.2 1 年心力衰竭再入院
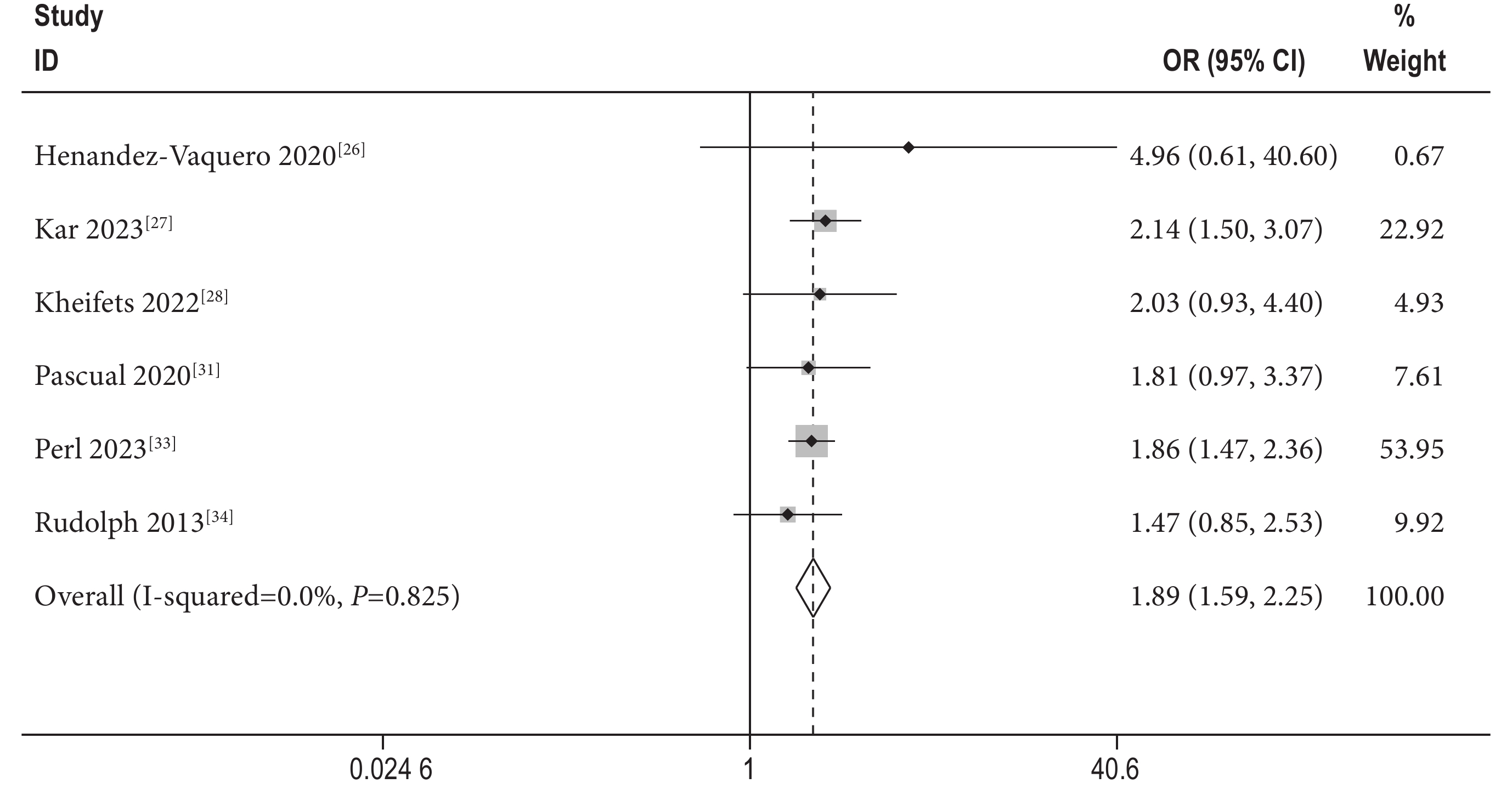
6篇文獻[26-28, 31, 33-34]提供了1年心力衰竭再入院率的相關數據,采用固定效應模型進行Meta分析,結果顯示[OR=1.90,95%CI(1.60,2.26),P<0.01,I2=0%]SMR組高于DMR組,差異有統計學意義(圖3)。
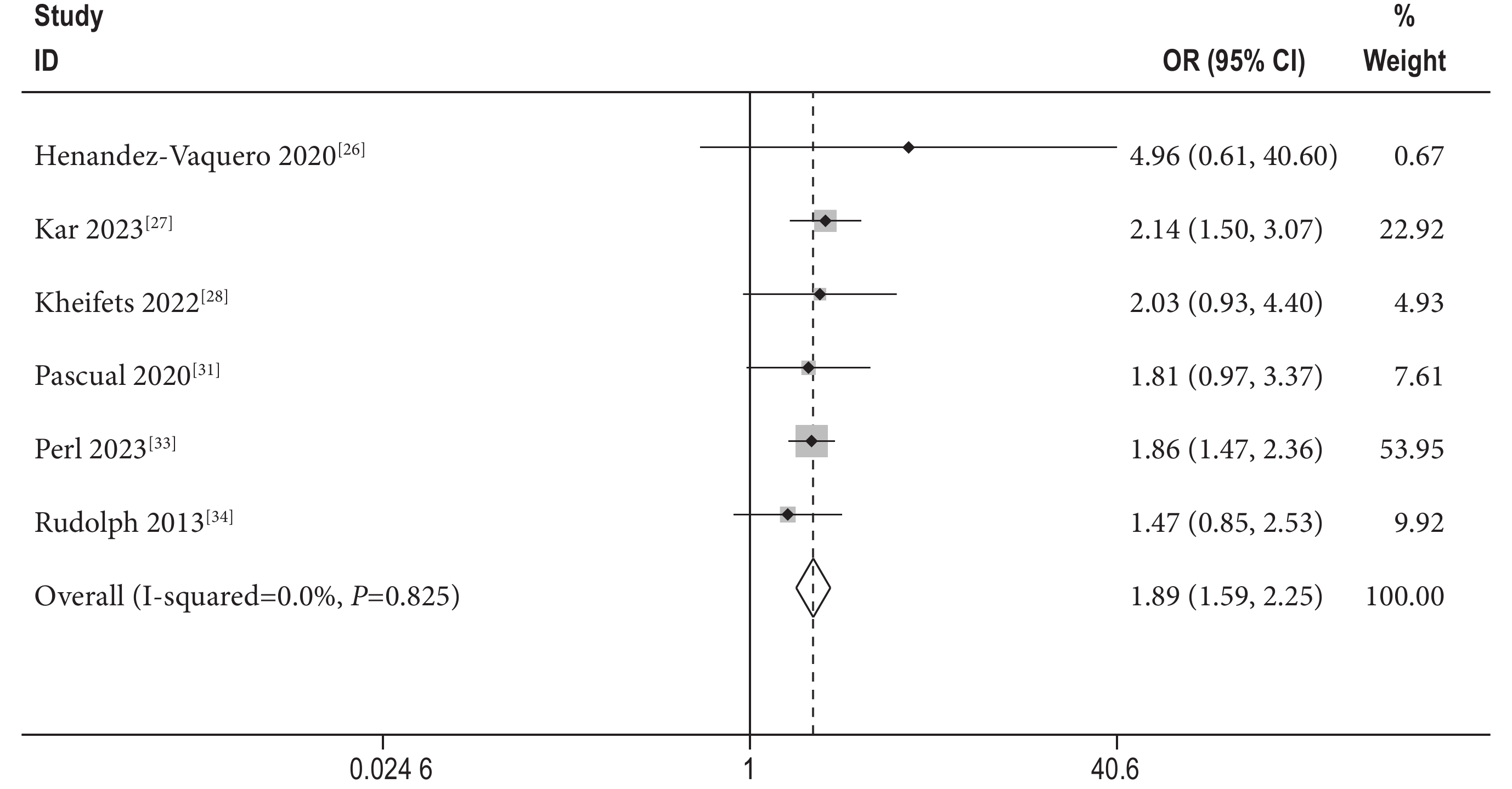 圖3
1年心力衰竭再入院率森林圖
圖3
1年心力衰竭再入院率森林圖
2.3.2 次要結局指標
2.3.2.1 手術成功率
8篇文獻[16, 26, 28, 31, 33-36]報道了手術成功率,采用固定效應模型進行Meta分析,結果顯示SMR組在手術成功率[OR=0.98,95%CI(0.89,1.10),P=0.64,I2=0%]高于DMR組,差異無統計學意義(表3)。
2.3.2.2 術中夾子植入數
6篇文獻[26, 31, 33, 35-37]報道了術中MitraClip器械裝置植入數量。隨機效應模型行Meta分析示:術中MitraClip器械植入數[SMD=–0.04,95%CI(–0.20,0.12),P=0.61,I2=72%]中SMR組與DMR組相比,差異無統計學意義(表3)。
2.3.2.3 術后二尖瓣跨瓣壓差
6篇文獻[12, 26, 31-32, 35-36]報道了術后二尖瓣跨瓣壓差的相關數據,使用隨機效應模型進行Meta分析,結果示[SMD=–0.47,95%CI(–0.65,–0.30),P<0.01,I2=51%]DMR組高于SMR組,差異有統計學意義(表3)。
2.3.2.4 二次開胸治療
7篇文獻[12, 26-27, 31, 33-34, 37]報道了二次開胸手術,采用固定效應模型進行Meta分析,二次開胸手術[OR=0.41,95%CI(0.20,0.83),P=0.01,I2=0%]DMR組患者高于SMR組患者,差異有統計學意義(表3)。
2.3.2.5 再次導管介入治療
4篇文獻[12, 26, 32, 36]報道了再次導管介入治療,采用固定效應模型進行Meta分析,再次導管介入治療[OR=1.05,95%CI(0.47,2.35),P=0.90,I2=0%]DMR組患者高于SMR組患者,差異無統計學意義(表3)。
2.4 敏感性分析
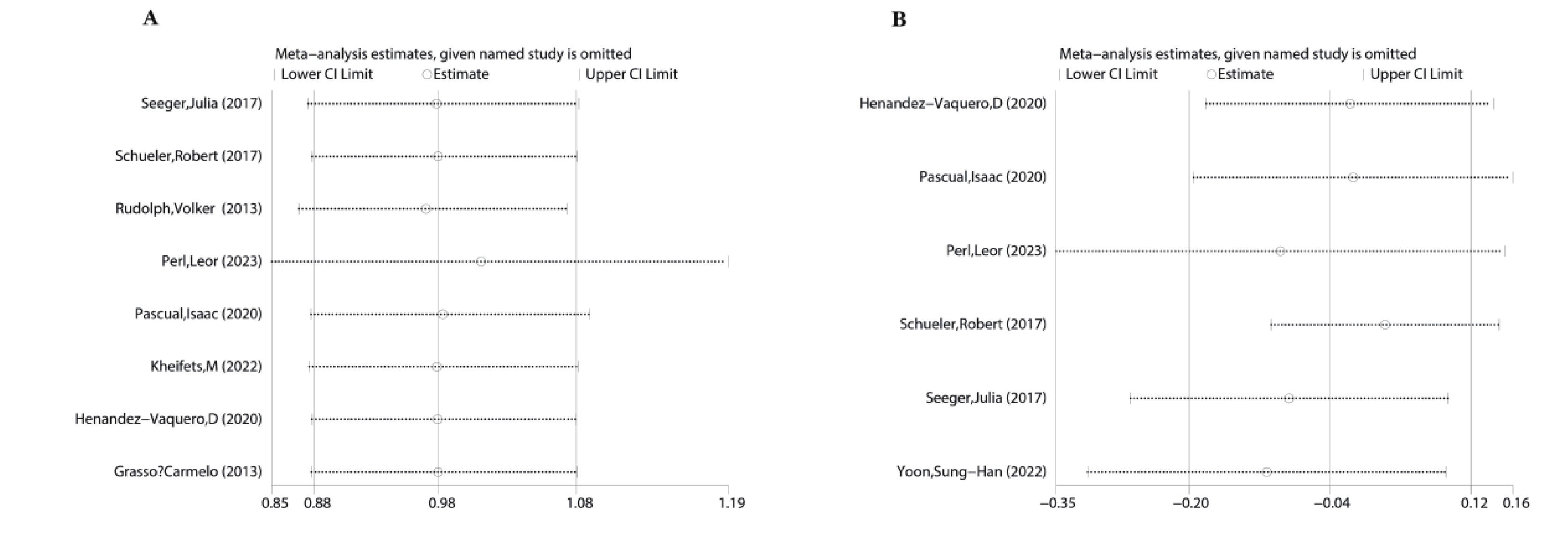
手術成功率、術中植入MitraClip器械數量存在顯著異質性,因研究數據不完整無法采用亞組分析,采用逐個排除獨立研究的敏感性分析方法。分析結果表明,異質性保持基本一致,對綜合結果沒有顯著影響,表明研究結果較可靠(圖4)。
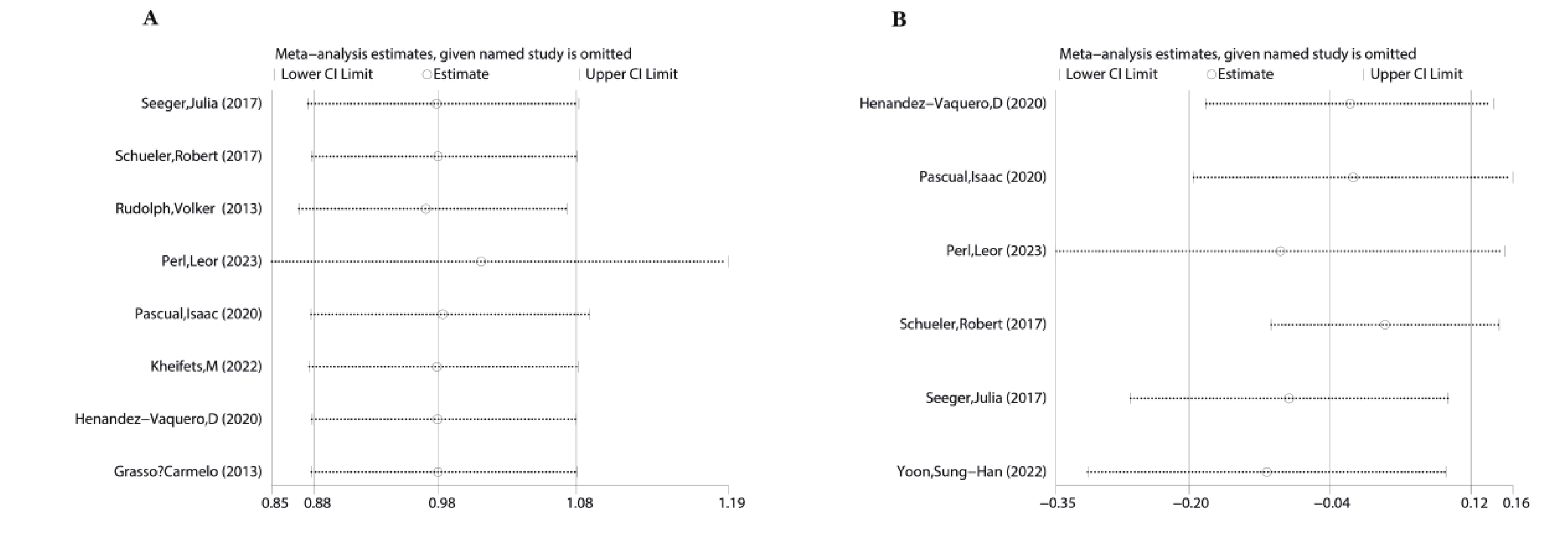 圖4
手術成功率和術中夾子植入敏感性分析
圖4
手術成功率和術中夾子植入敏感性分析
a:手術成功率;b:術中夾子植入
2.5 發表偏倚
采用Stata18.0行漏斗圖檢測均無明顯不對稱,Egger檢驗結果顯示,全因死亡率(P=0.97)、1 年心力衰竭再入院率(P=0.58)、手術成功率(P=0.11)、術中器械植入數(P=0.29)、術后二尖瓣跨瓣壓差(P=0.93)、再次治療(P=0.19)均不存在明顯的發表偏倚。
2.6 GRADE證據分級
對納入研究結局指標進行GRADE證據分級。結果顯示全因死亡率、1年心力衰竭再入院率、手術成功率、二次開胸治療以及后續再次導管介入治療為低質量證據,術中夾子植入數和術后二尖瓣跨瓣壓差為極低質量證據(表4)。
3 討論
MR是一種常見且較復雜的瓣膜病,其發病率與年齡呈正相關,在全球范圍內約2% 的人口患有MR,特別是在≥75歲老年人中,MR患者高達9.3%[1]。輕度MR會影響患者的生活質量,中重度MR若不及時干預,會導致心房顫動、肺動脈高壓、心功能不全等疾病的發生,終末期MR患者死亡率及因心力衰竭再住院率會大大增加。據統計,MR患者在未得到有效治療的情況下,5年死亡率約為50%[38]。因此,對于MR的早期識別、及時干預和有效治療至關重要。2003年MitraClip首次用于臨床,現已成為唯一一個同時獲得歐盟CE標記、美國食品和藥物管理局(FDA)以及國家藥品監督管理局批準的微創二尖瓣修復系統。作為全球最成熟的TEER手術器械,MitraClip系統已治療了超過10萬例[9, 11, 12] MR患者。2023 年COPAT 注冊研究顯示,在經MitraClip治療后的MR患者的2年、3年隨訪結果證明相較于接受保守治療,對于中重度或重度MR患者,經MitraClip 治療后的全因死亡率與因心力衰竭再住院率更低[15, 39]。2015年,EVERESTⅡ試驗證實經MitraClip治療后可明顯改善MR患者的癥狀及心功能[15]。同時,2016 年發布的亞太地區 MitraClip 注冊研究(MARS 研究)結果證實MitraClip 系統對DMR及SMR患者有顯著治療作用,同樣也證實了亞太地區MR人群經MitraClip導管治療的的安全性與有效性[40, 41]。
此篇Meta分析中,共納入了13篇文獻,結果顯示接受MitraClip治療的30 d及1年全因死亡率、心力衰竭再入院率SMR組患者均多于DMR組患者。手術成功率、術中MitraClip器械植入數量、術后二尖瓣跨瓣壓差、再次導管微創介入、二次開胸治療DMR組高于SMR組患者。整體而言,經MitraClip治療的MR患者短期療效中,SMR組患者表現較好,但中期預后,SMR組患者反而較差,這與SMR組患者存在更高的風險特征[42](合并癥多,心室射血分數差等)相關。
Yoon等[37]的研究結果顯示,相對于DMR患者,SMR患者發生房顫的幾率更高,且左室射血分數更低,左室的容積也更大。與早期研究結果一致[14-16],本文通過觀察納入研究人群的基線資料發現,SMR組患者合并發生冠狀動脈粥樣硬化性心臟病(coronary artery disease,CAD)發生率更高,左室射血分數(left ventricular ejection fraction,LVEF)更低,心室更大。本篇Meta分析結果顯示SMR組1年的全因死亡率、1年心力衰竭再入院率高于DMR組。若心臟瓣膜病合并有LVEF下降常提示心肌出現嚴重且不可逆的損害、心室功能已經受到嚴重傷害[43-44],這是影響心臟瓣膜手術治療的主要高危因素之一[45],Raposeiras-Roubi等的研究[46]也表明左心室功能降低是MR經導管修復術后全因死亡率的獨立危險因素,因此可以證實合并嚴重并發癥、心臟功能下降是造成SMR患者全因死亡率、因心力衰竭再入院率高的重要原因。
多中心歐洲GRASP的數據表明,DMR患者術中需要植入比SMR患者更多的MitraClip器械夾子[21],本篇Meta分析結果同樣顯示DMR組患者需要更多數量的夾子,但該差異并不顯著,可能與納入文獻數量等有關。SMR組比DMR組患者有更高的手術成功率,這可能是MitraClip器械由于DMR組患者原發性的瓣葉結構改變、瓣葉破壞而難以抓取瓣葉成功放置夾子以及放置夾子短時間脫落造成[15, 47]。本文中,DMR組患者的術后跨瓣壓差高于SMR組患者,這可能與DMR組患者術中植入夾子數量更多有關。過高的MVPG會影響心臟功能,影響MR治療效果與預后[12, 48]。因此可以通過避免MitraClip術后出現MVPG過高來有效控制MR患者的預后。
經MitraClip成功治療的MR患者中1 年總體再次干預率約為8%,2年約為10%[34, 49] 。國外學者Rudolph[34]的研究表明,在納入研究的人群中,再次干預在2個月內進行,并且MR患者中除2例的二尖瓣沒有原發性的損害外,其余的MR患者均有原發的二尖瓣形態學改變,這也是再次干預的重要原因之一。在本次Meta分析中總體再次干預率DMR組高于SMR組,這可能是由于病因不同而導致,DMR因為原發的二尖瓣瓣葉受損、二尖瓣前葉長度較短,對合緣高度較低,對合深度較淺,瓣葉栓系比例較低,瓣環內外徑較短導致術后早期再次發生嚴重反流,使其二次干預,SMR組再次干預率較低也可能是由于二尖瓣功能得到損害以及合并嚴重并發癥及原發病的進展,導致其無法耐受再次干預措施。
隨著MitraClip系統的迭代以及臨床經驗的不斷積累,其在臨床中的應用取得了重大進展。很多以前因二尖瓣病變解剖結構不理想(如A1/P1、A3/P3、交界區以及巴洛病等)而無法接受TEER的患者,逐漸也可以實現TEER 治療,并取得良好的即刻與長期療效。未來TEER的發展趨勢將聚焦于聯合經導管進行瓣環成形或腱索植入、非瓣膜A2/P2區域的TEER治療、TEER術后再次行TEER治療以及隨著器械的更新迭代圍繞患者個性化需求進行定制等方面[7]。
本研究存在的局限性包括:(1)僅對隊列研究進行分析,這可能導致一定程度的偏倚;(2)部分患者的數據缺失,限制進行更詳細的亞組分析,例如心衰分級等;(3)受到納入研究的隨訪時間限制,該Meta分析主要關注短期和中期的結果,缺失長期預后的相關數據;(4)納入的研究患者均為歐美人群,這可能造成一定偏倚。
綜上所述,MitraClip具有創傷小、手術時間短等優點,尤其適用于心功能差、無法耐受外科手術老年人群,現已成為越來越多醫院及患者的選擇,本研究表明DMR患者接受MitraClip治療后表現良好,SMR患者的早期療效也尚可。MitraClip技術的精進以及不斷增加的經驗使其成為具有合適解剖結構患者的有效治療選擇。未來的研究應該致力于進一步驗證以上發現,并探索長期的臨床效果和預后。
利益沖突:無。
作者貢獻:黎旭華負責研究思路提出與論文撰寫,衛治理負責選題;白淇元、陳浩、陳陽負責文獻檢索與數據整理分析;劉世棟、宋兵負責論文審閱與修改。
二尖瓣反流(mitral regurgitation,MR)是全球最常見的心臟瓣膜病[1],其與心力衰竭的發生密切相關,未經治療的有癥狀的MR患者年全因死亡率超過5%[1-2]。我國研究[3]結果表明,老年人群中MR的發病率明顯高于主動脈瓣狹窄、主動脈瓣反流等,單純MR即占 26.9%[4]。國內研究人員[5]指出,需要治療的MR患者超過200萬例。
二尖瓣裝置主要由瓣環、瓣葉、腱索、乳頭肌以及鄰近的左心房室、壁組成。二尖瓣功能的正常進行要求二尖瓣瓣環大小合適、瓣葉結構完整、乳頭肌收縮牽拉腱索發揮瓣葉的支撐作用、左心室肌肉收縮產生關閉的力量適當、心室形態及功能正常。任何一個因素出現異常都會導致MR,若不加干預則會進展為不可逆的心力衰竭。MR按發生機制可分為SMR與DMR,DMR病因是瓣膜本身結構發生病變,主要包括二尖瓣粘液樣變,脫垂、連枷樣、腱索斷裂,退行性變(鈣化、增厚),感染性疾病,炎癥性疾病,先天性疾病[6];SMR即心臟本身或瓣膜周圍支撐結構發生病變[7],主要有缺血性心臟病、非缺血性心臟病,瓣環擴張[6]。
目前的臨床數據顯示MR患者大多年齡過高或合并有較多較重的慢性疾病,手術治療MR患者死亡風險高,約一半MR患者無法耐受傳統外科手術治療[8],MitraClip 作為具有代表性的緣對緣介入器械進行TEER技術,可有效減小瓣口面積,來滿足手術高危患者的臨床需求。此項技術的出現改變了嚴重的有癥狀的MR患者的治療現狀,并成功治療越來越多的復雜病例,是手術風險高或無法手術的中重度或者重度MR患者的一種有效治療選擇[9-10]。自2003年以來,據國外研究統計超過100 000名[9, 11-12]患有嚴重MR的患者接受了MitraClip技術的經導管二尖瓣修復治療,并且可有效治療高達80%的MR患者[13],并改善MR相關的臨床癥狀。
MitraClip作為一種新興的治療方法,首先用于DMR患者治療且被證實了其可行性,在SMR的MitraClip治療中,超過75%的SMR患者證實可使其二尖瓣功能等級得以改善[14-17],在SMR和DMR患者中成功實施的臨床數據證實該項技術可作為MR患者的有效治療手段[12, 18-19]。2017年歐洲心臟病學會/歐洲心胸外科協會瓣膜性心臟病管理指南(2b)以及2020年美國心臟病學會/美國心臟協會瓣膜病管理指南(2a)所推薦應用TEER技術治療MR[9, 20]。但由于SMR與DMR患者之間存在特征(年齡、合并癥)以及左心室與瓣膜結構功能之間的重要差異[21],因此關于兩組患者治療后的臨床結局仍然缺乏明確的療效對比[22-23]。因此,本研究旨在評估嚴重SMR和DMR患者在接受MitraClip治療后的短期和中期臨床療效差異,我們希望通過比較這兩種MR類型在接受MitraClip治療后的反應,為MR的個體化治療策略提供有價值的見解,并為未來臨床決策提供更精確、全面的指導。
1 資料與方法
1.1 納入和排除標準
1.1.1 研究類型
隨機對照研究驗(RCT)或隊列研究,限定為英文或中文文獻;
1.1.2 研究對象
經超聲心動圖或CT檢查結合基礎疾病診斷為SMR或DMR行MitraClip治療的患者
1.1.3 干預措施
實驗組為接受MitraClip的SMR患者,對照組為接受MitraClip的DMR患者
1.1.4 結局指標
主要結局指標為全因死亡率、1年心力衰竭再入院率,次要結局指標為手術成功率,術中夾子植入數,術后二尖瓣跨瓣壓差,二次外科開胸或再次導管介入治療。
1.1.5 排除標準
(1)難以區分具體MR類型的文獻;(2)植入夾子類型為非MitraClip的文獻;(3)無對應結局指標數據的文獻;(4)綜述、Meta、會議摘要等文獻;(5)非中、英文文獻;(6)無法獲取全文的文獻
1.2 檢索策略
計算機檢索PubMed、EMbase、the Cochrane Library、Web of Science、中國生物醫學文獻數據庫(CBM)、知網、萬方數據庫以及維普數據庫,收集關于SMR與DMR患者行MitraClip治療術后的的相關研究,檢索時限均為建庫至 2024 年 1 月。主要的英文檢索詞為transcatheter edge-to-edge mitral valve repair、MitraClip、TEER、subsequent mitral regurgitation、degraded mitral regurgitation等;主要的中文檢索詞為:經導管二尖瓣緣對緣修復,功能性二尖瓣反流、退行性二尖瓣反流等,檢索時采用主題詞、自由詞相結合。
1.3 文獻篩選與數據提取
兩位研究員各自獨立根據納排標準進行嚴格的文獻篩選和數據提取,隨后進行交叉核對,以確保準確性。當納入排除文獻有分歧不能解決時,由第三方介入協商后進行判定。文獻資料提取內容包括:(1)納入文獻的特征:第一作者、發表年限、研究類型等;(2)納入研究患者的基本資料:樣本量、年齡、性別、合并癥等;(3)手術相關資料:MR類型、二尖瓣鉗夾器械類型、手術持續時間等;(4)結局指標:全因死亡、心衰再入院率、術后二尖瓣跨瓣壓差等;(5)決定納入文獻的質量評價信息。
1.4 納入文獻的治療評價
采用Jadad量表對納入RCT進行文獻質量評價[24],采用紐卡斯爾-渥太華量表(Newcastle-Ottawa Scale,NOS)對納入隊列研究進行文獻質量評價[25],評分涉及3部分:(1)患者選擇(4 個條目,4 分);(2)組間可比性(1 個條目,2 分);(3)結果測量(3 個條目,3 分)。滿分 9 分,評價后分數越高則表明研究質量越高。≥7分為高質量研究,5~6 分為中等質量研究,≤4 分為低質量研究。
1.5 GRADE證據分級評價
運用GRADEpro進行證據質量評價,可分為高級、中級、低級、極低級,評價內容包括偏倚風險、不一致性、間接性、不精確性、發表偏倚5個方面。
1.6 統計學分析
采用Stata18.0軟件進行Meta分析。分類變量使用比值比(odds ratio,OR)為效應量,連續變量使用標準均數差(standard mean difference,SMD)為效應量,所有效應量均提供95%的置信區間(Confidence interval,CI)。應用χ2檢驗(設定α=0.10)和I2統計量進行納入文獻異質性評定。P值≥0.10且I2<50%時,納入研究之間不存在顯著的統計學異質性,采用固定效應模型進行Meta分析。反之,在P值<0.10或I2≥50%時,采用隨機效應模型進行Meta分析,Meta 分析的校驗水準為α=0.05。存在明顯臨床異質性時,采用亞組分析或逐一剔除法進行敏感性分析等方法處理,或只進行描述性分析。結局指標的發表偏倚通過漏斗圖判斷,再采用 Egger檢驗定量評價。
2 結果
2.1 文獻檢索及篩選結果
共檢索出 1 274 篇文獻,根據納排標準最終決定納入13[16, 26-37]篇臨床研究,共有6 707例患者,文獻篩選過程及結果見圖1。
 圖1
納入文獻篩選流程圖
圖1
納入文獻篩選流程圖
2.2 納入文獻及患者基本特征
納入研究NOS評分均≥6分,納入文獻特征見表1,患者基線資料見表2。兩組患者術前的STS評分、logistic EuroSCOREⅡ評分差異無統計學意義,logistic EuroSCOREⅠ評分[SMD=0.22,95%CI(0.07,0.38),P<0.01,I2=0%]DMR組患者評分高于SMR組患者,差異有統計學意義。
2.3 Meta分析結果
2.3.1 主要結局指標
2.3.1.1 全因死亡率
3篇文獻[16, 28, 36]報道了30 d全因死亡率,7篇文獻[26-28,32-34,37]報道了1年全因死亡率。采用固定效應模型進行Meta分析,結果顯示:經MitraClip治療后30 d全因死亡率[OR=1.20,95%CI(0.38,3.80),P=0.76,I2=0%]SMR組患者高于DMR組患者,差異無統計學意義。1 年全因死亡率[OR=1.53,95%CI(1.30,1.81),P<0.01,I2=0%]SMR組高于DMR組,差異有統計學意義(圖2)。
 圖2
全因死亡率森林圖
圖2
全因死亡率森林圖
2.3.1.2 1 年心力衰竭再入院
6篇文獻[26-28, 31, 33-34]提供了1年心力衰竭再入院率的相關數據,采用固定效應模型進行Meta分析,結果顯示[OR=1.90,95%CI(1.60,2.26),P<0.01,I2=0%]SMR組高于DMR組,差異有統計學意義(圖3)。
 圖3
1年心力衰竭再入院率森林圖
圖3
1年心力衰竭再入院率森林圖
2.3.2 次要結局指標
2.3.2.1 手術成功率
8篇文獻[16, 26, 28, 31, 33-36]報道了手術成功率,采用固定效應模型進行Meta分析,結果顯示SMR組在手術成功率[OR=0.98,95%CI(0.89,1.10),P=0.64,I2=0%]高于DMR組,差異無統計學意義(表3)。
2.3.2.2 術中夾子植入數
6篇文獻[26, 31, 33, 35-37]報道了術中MitraClip器械裝置植入數量。隨機效應模型行Meta分析示:術中MitraClip器械植入數[SMD=–0.04,95%CI(–0.20,0.12),P=0.61,I2=72%]中SMR組與DMR組相比,差異無統計學意義(表3)。
2.3.2.3 術后二尖瓣跨瓣壓差
6篇文獻[12, 26, 31-32, 35-36]報道了術后二尖瓣跨瓣壓差的相關數據,使用隨機效應模型進行Meta分析,結果示[SMD=–0.47,95%CI(–0.65,–0.30),P<0.01,I2=51%]DMR組高于SMR組,差異有統計學意義(表3)。
2.3.2.4 二次開胸治療
7篇文獻[12, 26-27, 31, 33-34, 37]報道了二次開胸手術,采用固定效應模型進行Meta分析,二次開胸手術[OR=0.41,95%CI(0.20,0.83),P=0.01,I2=0%]DMR組患者高于SMR組患者,差異有統計學意義(表3)。
2.3.2.5 再次導管介入治療
4篇文獻[12, 26, 32, 36]報道了再次導管介入治療,采用固定效應模型進行Meta分析,再次導管介入治療[OR=1.05,95%CI(0.47,2.35),P=0.90,I2=0%]DMR組患者高于SMR組患者,差異無統計學意義(表3)。
2.4 敏感性分析
手術成功率、術中植入MitraClip器械數量存在顯著異質性,因研究數據不完整無法采用亞組分析,采用逐個排除獨立研究的敏感性分析方法。分析結果表明,異質性保持基本一致,對綜合結果沒有顯著影響,表明研究結果較可靠(圖4)。
 圖4
手術成功率和術中夾子植入敏感性分析
圖4
手術成功率和術中夾子植入敏感性分析
a:手術成功率;b:術中夾子植入
2.5 發表偏倚
采用Stata18.0行漏斗圖檢測均無明顯不對稱,Egger檢驗結果顯示,全因死亡率(P=0.97)、1 年心力衰竭再入院率(P=0.58)、手術成功率(P=0.11)、術中器械植入數(P=0.29)、術后二尖瓣跨瓣壓差(P=0.93)、再次治療(P=0.19)均不存在明顯的發表偏倚。
2.6 GRADE證據分級
對納入研究結局指標進行GRADE證據分級。結果顯示全因死亡率、1年心力衰竭再入院率、手術成功率、二次開胸治療以及后續再次導管介入治療為低質量證據,術中夾子植入數和術后二尖瓣跨瓣壓差為極低質量證據(表4)。
3 討論
MR是一種常見且較復雜的瓣膜病,其發病率與年齡呈正相關,在全球范圍內約2% 的人口患有MR,特別是在≥75歲老年人中,MR患者高達9.3%[1]。輕度MR會影響患者的生活質量,中重度MR若不及時干預,會導致心房顫動、肺動脈高壓、心功能不全等疾病的發生,終末期MR患者死亡率及因心力衰竭再住院率會大大增加。據統計,MR患者在未得到有效治療的情況下,5年死亡率約為50%[38]。因此,對于MR的早期識別、及時干預和有效治療至關重要。2003年MitraClip首次用于臨床,現已成為唯一一個同時獲得歐盟CE標記、美國食品和藥物管理局(FDA)以及國家藥品監督管理局批準的微創二尖瓣修復系統。作為全球最成熟的TEER手術器械,MitraClip系統已治療了超過10萬例[9, 11, 12] MR患者。2023 年COPAT 注冊研究顯示,在經MitraClip治療后的MR患者的2年、3年隨訪結果證明相較于接受保守治療,對于中重度或重度MR患者,經MitraClip 治療后的全因死亡率與因心力衰竭再住院率更低[15, 39]。2015年,EVERESTⅡ試驗證實經MitraClip治療后可明顯改善MR患者的癥狀及心功能[15]。同時,2016 年發布的亞太地區 MitraClip 注冊研究(MARS 研究)結果證實MitraClip 系統對DMR及SMR患者有顯著治療作用,同樣也證實了亞太地區MR人群經MitraClip導管治療的的安全性與有效性[40, 41]。
此篇Meta分析中,共納入了13篇文獻,結果顯示接受MitraClip治療的30 d及1年全因死亡率、心力衰竭再入院率SMR組患者均多于DMR組患者。手術成功率、術中MitraClip器械植入數量、術后二尖瓣跨瓣壓差、再次導管微創介入、二次開胸治療DMR組高于SMR組患者。整體而言,經MitraClip治療的MR患者短期療效中,SMR組患者表現較好,但中期預后,SMR組患者反而較差,這與SMR組患者存在更高的風險特征[42](合并癥多,心室射血分數差等)相關。
Yoon等[37]的研究結果顯示,相對于DMR患者,SMR患者發生房顫的幾率更高,且左室射血分數更低,左室的容積也更大。與早期研究結果一致[14-16],本文通過觀察納入研究人群的基線資料發現,SMR組患者合并發生冠狀動脈粥樣硬化性心臟病(coronary artery disease,CAD)發生率更高,左室射血分數(left ventricular ejection fraction,LVEF)更低,心室更大。本篇Meta分析結果顯示SMR組1年的全因死亡率、1年心力衰竭再入院率高于DMR組。若心臟瓣膜病合并有LVEF下降常提示心肌出現嚴重且不可逆的損害、心室功能已經受到嚴重傷害[43-44],這是影響心臟瓣膜手術治療的主要高危因素之一[45],Raposeiras-Roubi等的研究[46]也表明左心室功能降低是MR經導管修復術后全因死亡率的獨立危險因素,因此可以證實合并嚴重并發癥、心臟功能下降是造成SMR患者全因死亡率、因心力衰竭再入院率高的重要原因。
多中心歐洲GRASP的數據表明,DMR患者術中需要植入比SMR患者更多的MitraClip器械夾子[21],本篇Meta分析結果同樣顯示DMR組患者需要更多數量的夾子,但該差異并不顯著,可能與納入文獻數量等有關。SMR組比DMR組患者有更高的手術成功率,這可能是MitraClip器械由于DMR組患者原發性的瓣葉結構改變、瓣葉破壞而難以抓取瓣葉成功放置夾子以及放置夾子短時間脫落造成[15, 47]。本文中,DMR組患者的術后跨瓣壓差高于SMR組患者,這可能與DMR組患者術中植入夾子數量更多有關。過高的MVPG會影響心臟功能,影響MR治療效果與預后[12, 48]。因此可以通過避免MitraClip術后出現MVPG過高來有效控制MR患者的預后。
經MitraClip成功治療的MR患者中1 年總體再次干預率約為8%,2年約為10%[34, 49] 。國外學者Rudolph[34]的研究表明,在納入研究的人群中,再次干預在2個月內進行,并且MR患者中除2例的二尖瓣沒有原發性的損害外,其余的MR患者均有原發的二尖瓣形態學改變,這也是再次干預的重要原因之一。在本次Meta分析中總體再次干預率DMR組高于SMR組,這可能是由于病因不同而導致,DMR因為原發的二尖瓣瓣葉受損、二尖瓣前葉長度較短,對合緣高度較低,對合深度較淺,瓣葉栓系比例較低,瓣環內外徑較短導致術后早期再次發生嚴重反流,使其二次干預,SMR組再次干預率較低也可能是由于二尖瓣功能得到損害以及合并嚴重并發癥及原發病的進展,導致其無法耐受再次干預措施。
隨著MitraClip系統的迭代以及臨床經驗的不斷積累,其在臨床中的應用取得了重大進展。很多以前因二尖瓣病變解剖結構不理想(如A1/P1、A3/P3、交界區以及巴洛病等)而無法接受TEER的患者,逐漸也可以實現TEER 治療,并取得良好的即刻與長期療效。未來TEER的發展趨勢將聚焦于聯合經導管進行瓣環成形或腱索植入、非瓣膜A2/P2區域的TEER治療、TEER術后再次行TEER治療以及隨著器械的更新迭代圍繞患者個性化需求進行定制等方面[7]。
本研究存在的局限性包括:(1)僅對隊列研究進行分析,這可能導致一定程度的偏倚;(2)部分患者的數據缺失,限制進行更詳細的亞組分析,例如心衰分級等;(3)受到納入研究的隨訪時間限制,該Meta分析主要關注短期和中期的結果,缺失長期預后的相關數據;(4)納入的研究患者均為歐美人群,這可能造成一定偏倚。
綜上所述,MitraClip具有創傷小、手術時間短等優點,尤其適用于心功能差、無法耐受外科手術老年人群,現已成為越來越多醫院及患者的選擇,本研究表明DMR患者接受MitraClip治療后表現良好,SMR患者的早期療效也尚可。MitraClip技術的精進以及不斷增加的經驗使其成為具有合適解剖結構患者的有效治療選擇。未來的研究應該致力于進一步驗證以上發現,并探索長期的臨床效果和預后。
利益沖突:無。
作者貢獻:黎旭華負責研究思路提出與論文撰寫,衛治理負責選題;白淇元、陳浩、陳陽負責文獻檢索與數據整理分析;劉世棟、宋兵負責論文審閱與修改。