版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
A型主動脈夾層(type A aortic dissection,TAAD)是一種極為兇險的心血管病急癥,其起病隱匿,發展迅速,因重要臟器灌注不足導致嚴重并發癥,甚至因主動脈破裂而至死亡[1]。近年來主動脈夾層的發病率呈持續升高趨勢[2],隨著手術技術及腦保護方法的改進,主動脈病變的修復也更積極、更徹底[3-4]。
孤立性左椎動脈(isolated left vertebral artery,ILVA)是指左椎動脈直接起源于主動脈弓的先天性主動脈弓部分支血管變異,發生率約為3.6%[5],而在胸主動脈疾病患者中為6.3%[6]。ILVA對主動脈弓部置換過程中分支吻合策略和腦灌注方法有較大影響,尤其是Willis環不完整的患者,ILVA術中處理不當可能會導致嚴重的腦部并發癥[7]。對于ILVA在主動脈全弓置換術中行血運重建的最佳策略,目前仍沒有達成共識。在本研究回顧性分析了2017年3月—2023年10 月在北部戰區總醫院心血管外科住院,主動脈夾層累及弓部的504例患者,采用單一胸骨上段小切口行主動脈全弓置換、象鼻支架植入及合并手術,其中共有31例患者合并孤立性左椎動脈,根據夾層撕裂情況,在術中不同的時機通過ILVA-左頸總動脈(left common carotid artery,LCCA)或ILVA-分支人工血管吻合進行ILVA重建,通過分析術中資料及圍術期情況以評價ILVA重建效果。
1 資料與方法
1.1 臨床資料和分組
回顧性篩選2017年3月—2023年10月在北部戰區總醫院心血管外科行外科手術治療的主動脈夾層的529例患者,所有患者均經胸腹主動脈CT血管造影(CT angiography,CTA)明確主動脈夾層診斷。納入標準:(1)接受單一胸骨上段小切口行全主動脈弓置換、象鼻支架植入術及其他并行手術;(2)發病到手術時間<14 d。排除標準:(1)合并嚴重肝、腎功能不全;(2)嚴重冠心病、心功能不全或左心室射血分數(left ventricular ejection fraction,LVEF)<0.45;(3)術前嚴重神經系統癥狀,包括腦梗死癥狀、截癱及昏迷。
通過術前胸腹主動脈CTA及術中探查來明確孤立性左椎動脈診斷,根據是否診斷ILVA將患者分為ILVA組及常規組。根據ILVA組中ILVA的重建時機將患者分為非體外循環組與體外循環組。
1.2 數據收集
(1)一般資料:患者性別、年齡、體重指數(body mass index,BMI)、既往病史、LVEF;(2)術中資料:術式、體外循環時間、主動脈阻斷時間、停循環時間、ILVA重建位置、ILVA重建時間;(3)術后資料:紅細胞用量、術后住院時間、術后并發癥(二次止血、二次氣管插管、顱內并發癥、肺部感染、消化道出血、急性腎功能衰竭、惡性心律失常等)、院內死亡率。
1.3 手術方法
全身麻醉成功后,采用單一胸骨上段小切口進行手術,即自上鋸開胸骨至第4肋間水平再橫斷右半胸骨,游離弓上各分支血管。全身肝素化后,經無夾層累及的弓上分支進行動脈插管,首選無名動脈,其次為左、右頸總動脈及左、右鎖骨下動脈,經右心房插腔房管,經右上肺靜脈插左心引流管,建立體外循環并逐步降溫,經冠脈開口直接灌注停跳液,根據近端夾層程度行相應術式(升主動脈置換、Bentall、David等)。待降溫達標后,分別阻斷弓上分支,同時根據腦血氧飽和度情況進行單側或雙側順行性腦灌注,于左頸總動脈和左鎖骨下動脈(left subclavian artery,LSA)間橫斷主動脈弓,將象鼻支架置入遠端主動脈真腔內并撐開,將帶氣囊導管置入象鼻支架內進行下半身灌注。取四分支血管與象鼻支架近心端、主動脈弓遠端進行連續縫合,后經第4分支血管繼續下半身灌注。首先重建左頸總動脈或無名動脈以盡快恢復雙腦灌注,隨后完成四分支血管近心端吻后開放升主動脈,心臟復跳,最后分別吻合剩余分支完成手術。
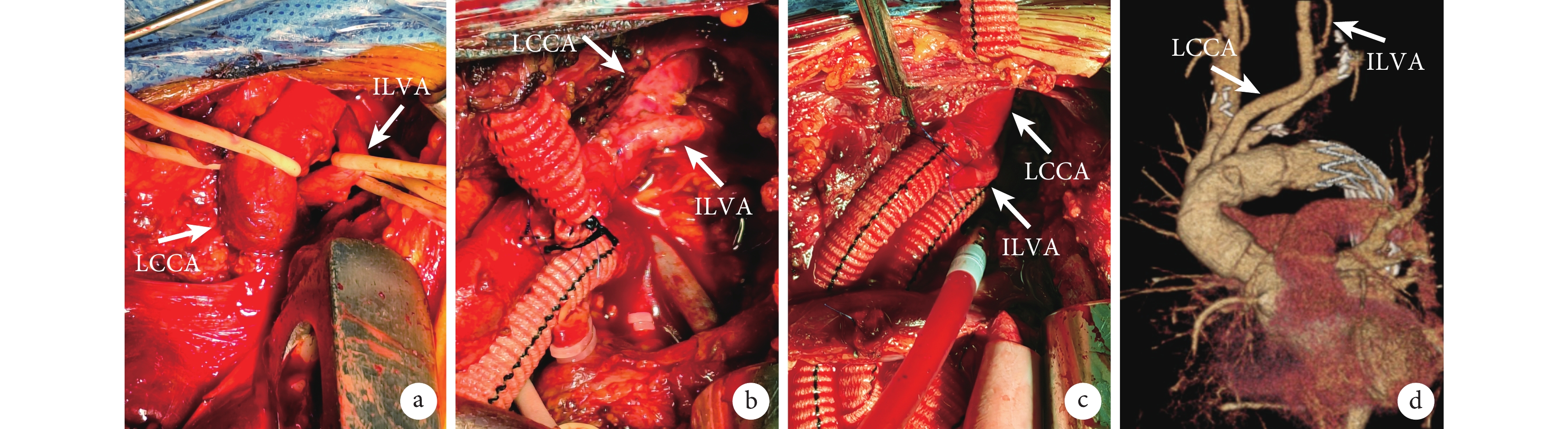
根據左頸總動脈是否被夾層累及,孤立性左頸總動脈重建方法分為兩種:(1)左頸總動脈無夾層:在充分游離LCCA及ILVA基礎上,轉流前,使用阻斷帶分別阻斷LCCA及ILVA,根據ILVA直徑,在LCCA側壁做一相應大小切口,用類似冠狀動脈近端吻合的方法使用6-0 Prolene線將ILVA近端端側連續縫合至LCCA上,解除阻斷,恢復供血(圖2b)。(2)左頸總動脈夾層: 在心臟復跳后,完成弓部分支血管重建,恢復雙側腦灌注,根據ILVA與LCCA、LSA距離及位置選擇其中一支血管進行吻合。阻斷分支人工血管,使用電灼筆在其上做一開口,在使用同上的方法使用6-0 Prolene線進行ILVA與分支人工血管的吻合,解除阻斷,恢復供血(圖2c)。
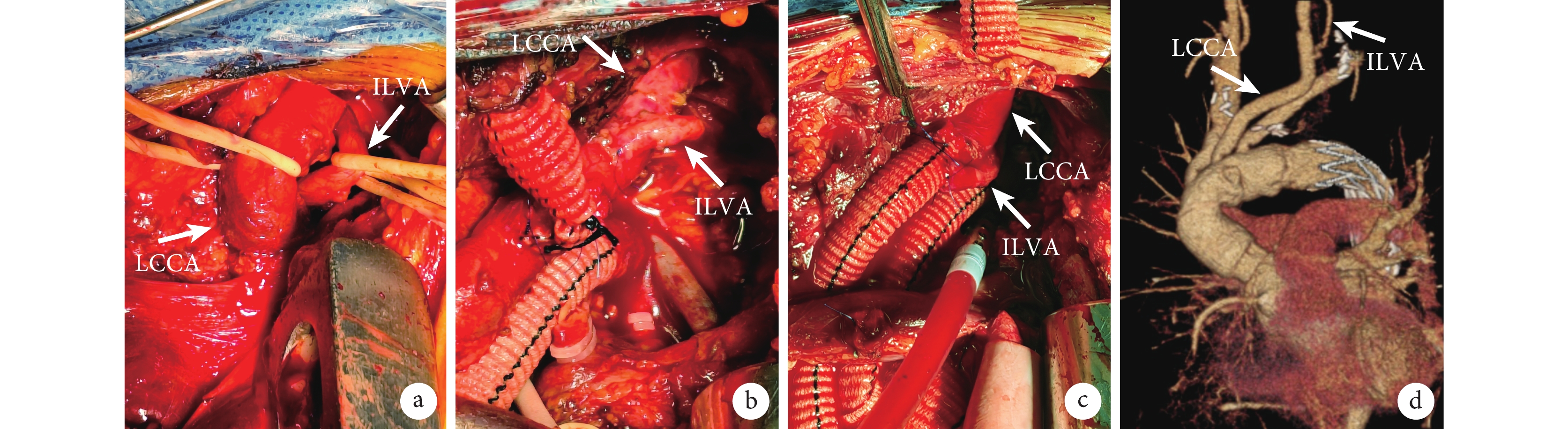 圖2
ILVA重建情況
圖2
ILVA重建情況
a:術中游離LCCA及ILVA;b:ILVA重建至LCCA;c:ILVA重建至分支人工血管;d:術后復查胸腹主動脈CTA;LCCA:左頸總動脈,ILVA:孤立性左椎動脈
1.4 術后復查
所有患者出院前行超聲心動圖及胸腹主動脈CTA,以評估心臟情況,主動脈吻合口情況,包括ILVA在內的弓部分支血管通暢性及降主動脈夾層情況。
1.5 統計學分析
所有分析均使用SPSS 27.0軟件進行,符合正態分布的計量資料以均值±標準差(x±s)描述,兩組間比較采用獨立樣本t檢驗;非正態分布的計量資料以中位數和上下四分位數[M(P25,P75)]描述,兩組間比較采用Mann-Whitney U檢驗。計數資料以例數及百分比描述,兩組間比較采用Fisher精確概率檢驗分析。P≤0.05為差異有統計學意義。
2 結果
2.1 術前資料
經篩選后共納入504例患者,其中ILVA組31例,常規組473例。兩組患者術前資料,包括年齡、性別、BMI、LVEF及高血壓、糖尿病、腦血管病等既往病史差異均無統計學意義(表1)。
2.2 術中情況
兩組全部患者均在全身麻醉體外循環單一胸骨上段小切口下行主動脈全弓置換及象鼻支架植入手術,同時根據主動脈根部情況進行相應根部手術,兩組手術術式、動脈灌注位置差異無統計學意義。除此之外,ILVA組31例患者均在術中成功重建了左椎動脈,且ILVA組中的體外循環時間和主動脈阻斷時間要略短于常規組,但差異無統計學意義(表2)。
ILVA組中有18例經術前胸腹主動脈CTA診斷孤立性左椎動脈(圖1),其余13例在術中游離分支血管時發現(圖2a)。在重建過程中,有17例于體外循環前即完成ILVA-LCCA吻合,有4例因循環不穩定在體外循環下進行ILVA-LCCA吻合,另10例因左頸總動脈夾層,在完成弓部置換后進行ILVA-分支人工血管吻合。17例非體外循環組患者的體外循環時間與主動脈阻斷時間略短于體外循環組,但差異無統計學意義;見表5。ILVA重建時間定義為弓上分支的阻斷時間,ILVA重建時間為(7.31±1.36)min(表3)。
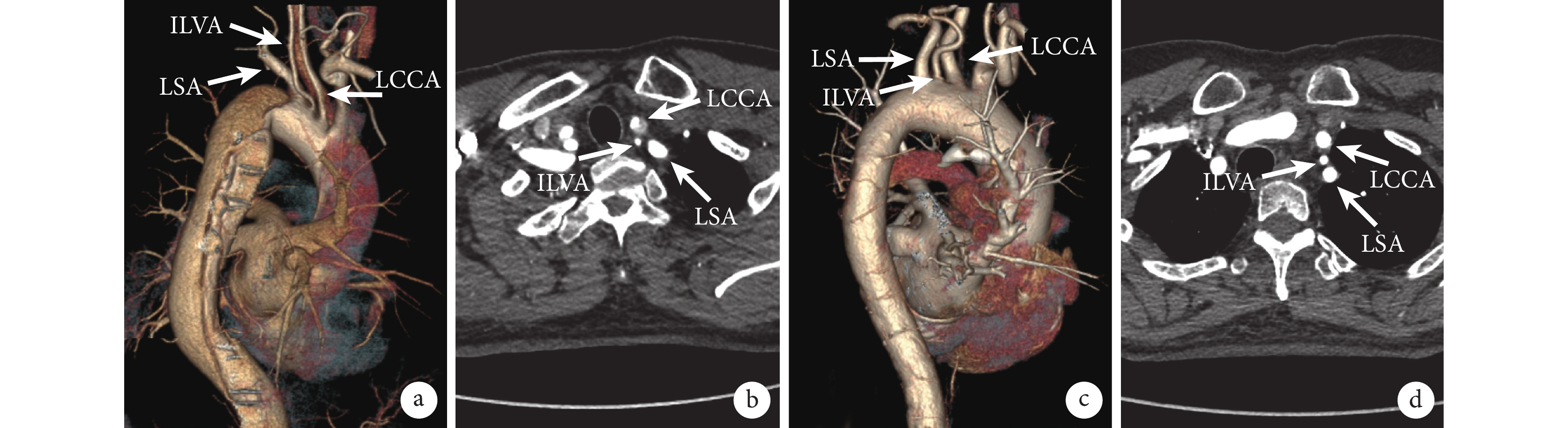
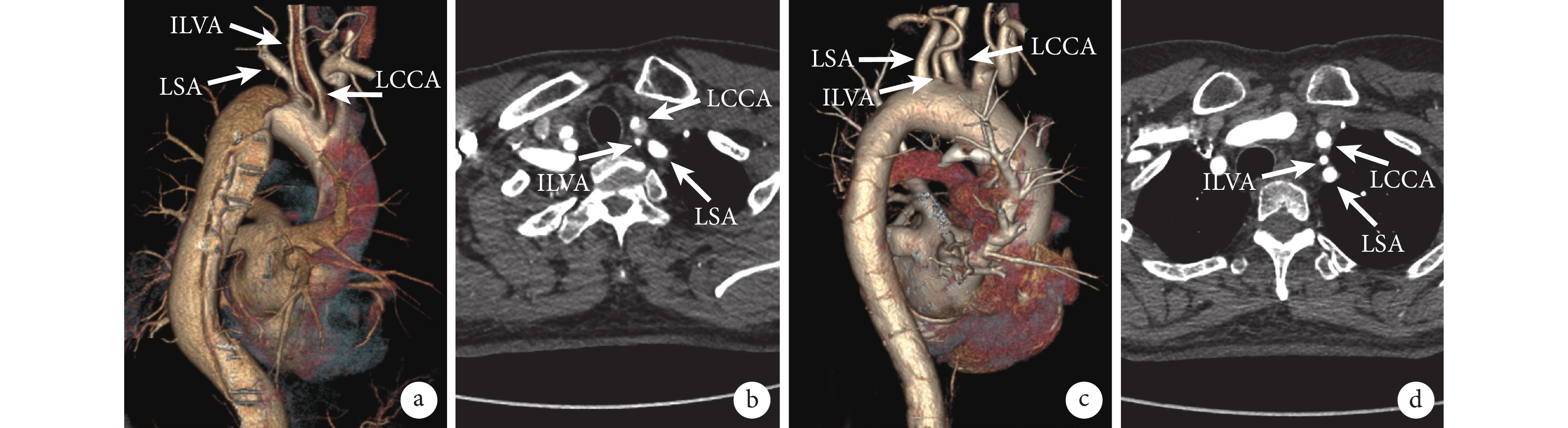 圖1
術前CTA明確ILVA診斷
圖1
術前CTA明確ILVA診斷
a~b:患者1胸腹主動脈CTA橫斷圖及三維重建圖;c~d:患者2胸腹主動脈CTA橫斷圖及三維重建圖;LCCA:左頸總動脈;ILVA:孤立性左椎動脈;LSA:左鎖骨下動脈
2.3 術后情況
兩組患者在術后紅細胞用量、ICU時間及住院時間方面差異無統計學意義(P>0.05),在包括二次開胸止血、肺部感染、惡性心律失常、急性腎衰竭行連續性腎臟替代治療(continuous renal replacement therapy,CRRT)及急性腦梗死在內的圍術期并發癥及在院死亡率等方面差異也無統計學意義。ILVA組中共有2例出現急性腦梗死,其中1例術后突發心臟驟停,經搶救后出現腦梗死,出院前恢復良好,1例術后并發急性腦梗死,神志不清,后因多臟器功能衰竭臨床死亡。另有1例因術中止血困難,失血性休克致死亡,余患者均恢復良好,治愈出院(表4)。所有患者出院前復查胸腹主動脈CTA,結果顯示弓上分支及ILVA均通暢,無吻合口假性動脈瘤或狹窄跡象(圖2d)。
3 討論
急性A型主動脈夾層作為一種危及生命的疾病,每小時死亡率升高約1%,一經診斷后應立即急診開胸手術,且無絕對手術禁忌證。隨著大血管外科技術及體外循環技術的進步,圍術期并發癥率及手術死亡率得到了顯著降低[8]。
主動脈弓部的分支血管畸形對全弓置換提出了挑戰,如果處理不當,可能對術中腦保護造成不良影響,最終導致術后神經系統并發癥出現。目前已知的主要分支畸形有牛型主動脈弓、孤立性左椎動脈及迷走右鎖骨下動脈,ILVA是其中第二常見的解剖變異[9],在胸主動脈疾病患者中,比例可達6.3~6.6%[10],與本研究中的發生率6.15%(31/504)接近。普遍認為ILVA可匯入基底動脈,止于小腦后下動脈,向腦干和小腦供血,因此ILVA處理不當可能導致圍術期腦梗死或脊髓缺血[11]。目前已有相關指南[12]建議在主動脈弓部手術中對異常起源的左椎動脈進行血運重建,但并沒有全弓置換術中ILVA重建的適應癥和策略達成共識。通過相關檢查明確ILVA的優勢情況及Willis環完整情況可指導術中分支處理策略,但TAAD患者往往沒有時間進行這些檢查。在本研究中,有58%(18/31)的患者通過術前胸腹主動脈CTA可診斷ILVA,其余患者均在術中發現。與LCCA及LSA相比,ILVA相對細小,約為3.4~5.1 mm[13-14],因此從診斷到明確ILVA支配地位均有較大難度。考慮到中國人Willis環后循環完整率為31%,而全部完整率更低,僅為27%[15],在全弓置換術中應優先重建ILVA,從而避免犧牲ILVA導致神經功能損傷的風險。
在既往的TAAD術中左椎動脈重建的相關報道中,Yi等[16]采用胸部正中切口,在腋動脈、股動脈轉流基礎上,優先進行體外循環下ILVA-LCCA重建術,但是這種方法仍存在LCCA殘留夾層加重,影響ILVA供血的風險。部分術者將ILVA在術中與LSA或其分支人工血管上進行端側吻合,同樣取得良好的臨床效果[17-18]。更有個別報道采用大隱靜脈在ILVA和LSA間以“搭橋”方式進行重建[19],亦有對ILVA及周圍分支血管進行島狀吻合重建[20],但這種方法并不適用于弓部或分支血管嚴重夾層撕裂的患者。近年來,主動脈腔內修復術(TEVAR)已逐漸應用于累及到主動脈弓部的復雜B型主動脈夾層中。Shen等[14]在鎖骨處做一切口,暴露ILVA,采用原位開窗技術在TEVAR術中對ILVA進行重建,Ding等[21]通過頸部切口進行ILVA到LCCA轉位,隨后進行TEVAR修復B型主動脈夾層,均未觀察到神經系統并發癥。
本研究中全部患者均在單一胸骨上段小切口下完成全主動脈弓置換、象鼻支架植入術及合并手術,該術式的應用我們已在之前進行了詳細報道[22-23]。主要困難來自于小切口帶來的暴露相對不足,尤其是ILVA和LSA。對于術前未診斷ILVA的患者,在游離LSA時務必明確是否發出左椎動脈,以避免遺漏ILVA。雖然將ILVA重建至LSA最符合生理,但在深且窄的LSA區域進行深部吻合是有難度的,且在全弓置換中,左鎖骨下動脈的供血是最后恢復的。因此ILVA-LCCA重建不僅更易于操作,還可以更早恢復ILVA灌注。在本研究中,ILVA組中進一步分為體外循環組與非體外循環組,結果表明非體外循環下進行ILVA重建不增加術后神經系統并發癥發生率,且更易于操作。因此若LCCA未被夾層累及,應優先選擇常溫非體外循環條件下進行ILVA-LCCA端側吻合,不增加體外循環時間,且停循環腦灌注時期IVLA同樣可以得到供血,若LCCA無可以吻合的正常區域,則在全弓置換后進行ILVA-分支人工血管的吻合。在ILVA組中,腦部并發癥發生率較常規組差異無統計學意義,其中僅1例患者術后并發急性腦梗死,神志未清醒,并因多臟器功能衰竭放棄治療,另有一例因心臟驟停行搶救治療,后出現急性腦梗死,經系統治療后恢復良好,順利出院,其余患者均無神經系統并發癥出現,且出院前復查胸腹主動脈CTA均顯示了完整、通暢的弓部分支血管。
然而,本研究中仍存在許多有待完善的局限性。首先,由于本研究的回顧性性質,時間跨度較大,來自單中心且樣本相對較少,具有較高的偏倚風險。其次,隨訪時間較短,隨訪收集資料欠全面。后續可根據情況設計前瞻性研究,同時對已有病例延長隨訪時間,完善相關資料的采集。
綜上所述,對于TAAD合并ILVA的患者,為了降低圍術期腦缺血和脊髓損傷的風險,術中應盡早且完整的重建ILVA,并優先在非體外循環狀態下進行。根據本研究結果表明,在單一胸骨上段小切口下進行TAAD手術及同期ILVA-LCCA重建是安全可行的,但仍需要更長時間的隨訪已明確遠期并發癥及ILVA通暢情況。
利益沖突:無。
作者貢獻:王璐參與研究設計、數據分析、文章撰寫和修改;葛玉光、楊忠路、劉宇參與手術、數據收集;夏麟、劉秩碩參與數據分析,文章修改;姜輝負責手術實施、研究設計、文章撰寫和修改。
A型主動脈夾層(type A aortic dissection,TAAD)是一種極為兇險的心血管病急癥,其起病隱匿,發展迅速,因重要臟器灌注不足導致嚴重并發癥,甚至因主動脈破裂而至死亡[1]。近年來主動脈夾層的發病率呈持續升高趨勢[2],隨著手術技術及腦保護方法的改進,主動脈病變的修復也更積極、更徹底[3-4]。
孤立性左椎動脈(isolated left vertebral artery,ILVA)是指左椎動脈直接起源于主動脈弓的先天性主動脈弓部分支血管變異,發生率約為3.6%[5],而在胸主動脈疾病患者中為6.3%[6]。ILVA對主動脈弓部置換過程中分支吻合策略和腦灌注方法有較大影響,尤其是Willis環不完整的患者,ILVA術中處理不當可能會導致嚴重的腦部并發癥[7]。對于ILVA在主動脈全弓置換術中行血運重建的最佳策略,目前仍沒有達成共識。在本研究回顧性分析了2017年3月—2023年10 月在北部戰區總醫院心血管外科住院,主動脈夾層累及弓部的504例患者,采用單一胸骨上段小切口行主動脈全弓置換、象鼻支架植入及合并手術,其中共有31例患者合并孤立性左椎動脈,根據夾層撕裂情況,在術中不同的時機通過ILVA-左頸總動脈(left common carotid artery,LCCA)或ILVA-分支人工血管吻合進行ILVA重建,通過分析術中資料及圍術期情況以評價ILVA重建效果。
1 資料與方法
1.1 臨床資料和分組
回顧性篩選2017年3月—2023年10月在北部戰區總醫院心血管外科行外科手術治療的主動脈夾層的529例患者,所有患者均經胸腹主動脈CT血管造影(CT angiography,CTA)明確主動脈夾層診斷。納入標準:(1)接受單一胸骨上段小切口行全主動脈弓置換、象鼻支架植入術及其他并行手術;(2)發病到手術時間<14 d。排除標準:(1)合并嚴重肝、腎功能不全;(2)嚴重冠心病、心功能不全或左心室射血分數(left ventricular ejection fraction,LVEF)<0.45;(3)術前嚴重神經系統癥狀,包括腦梗死癥狀、截癱及昏迷。
通過術前胸腹主動脈CTA及術中探查來明確孤立性左椎動脈診斷,根據是否診斷ILVA將患者分為ILVA組及常規組。根據ILVA組中ILVA的重建時機將患者分為非體外循環組與體外循環組。
1.2 數據收集
(1)一般資料:患者性別、年齡、體重指數(body mass index,BMI)、既往病史、LVEF;(2)術中資料:術式、體外循環時間、主動脈阻斷時間、停循環時間、ILVA重建位置、ILVA重建時間;(3)術后資料:紅細胞用量、術后住院時間、術后并發癥(二次止血、二次氣管插管、顱內并發癥、肺部感染、消化道出血、急性腎功能衰竭、惡性心律失常等)、院內死亡率。
1.3 手術方法
全身麻醉成功后,采用單一胸骨上段小切口進行手術,即自上鋸開胸骨至第4肋間水平再橫斷右半胸骨,游離弓上各分支血管。全身肝素化后,經無夾層累及的弓上分支進行動脈插管,首選無名動脈,其次為左、右頸總動脈及左、右鎖骨下動脈,經右心房插腔房管,經右上肺靜脈插左心引流管,建立體外循環并逐步降溫,經冠脈開口直接灌注停跳液,根據近端夾層程度行相應術式(升主動脈置換、Bentall、David等)。待降溫達標后,分別阻斷弓上分支,同時根據腦血氧飽和度情況進行單側或雙側順行性腦灌注,于左頸總動脈和左鎖骨下動脈(left subclavian artery,LSA)間橫斷主動脈弓,將象鼻支架置入遠端主動脈真腔內并撐開,將帶氣囊導管置入象鼻支架內進行下半身灌注。取四分支血管與象鼻支架近心端、主動脈弓遠端進行連續縫合,后經第4分支血管繼續下半身灌注。首先重建左頸總動脈或無名動脈以盡快恢復雙腦灌注,隨后完成四分支血管近心端吻后開放升主動脈,心臟復跳,最后分別吻合剩余分支完成手術。
根據左頸總動脈是否被夾層累及,孤立性左頸總動脈重建方法分為兩種:(1)左頸總動脈無夾層:在充分游離LCCA及ILVA基礎上,轉流前,使用阻斷帶分別阻斷LCCA及ILVA,根據ILVA直徑,在LCCA側壁做一相應大小切口,用類似冠狀動脈近端吻合的方法使用6-0 Prolene線將ILVA近端端側連續縫合至LCCA上,解除阻斷,恢復供血(圖2b)。(2)左頸總動脈夾層: 在心臟復跳后,完成弓部分支血管重建,恢復雙側腦灌注,根據ILVA與LCCA、LSA距離及位置選擇其中一支血管進行吻合。阻斷分支人工血管,使用電灼筆在其上做一開口,在使用同上的方法使用6-0 Prolene線進行ILVA與分支人工血管的吻合,解除阻斷,恢復供血(圖2c)。
 圖2
ILVA重建情況
圖2
ILVA重建情況
a:術中游離LCCA及ILVA;b:ILVA重建至LCCA;c:ILVA重建至分支人工血管;d:術后復查胸腹主動脈CTA;LCCA:左頸總動脈,ILVA:孤立性左椎動脈
1.4 術后復查
所有患者出院前行超聲心動圖及胸腹主動脈CTA,以評估心臟情況,主動脈吻合口情況,包括ILVA在內的弓部分支血管通暢性及降主動脈夾層情況。
1.5 統計學分析
所有分析均使用SPSS 27.0軟件進行,符合正態分布的計量資料以均值±標準差(x±s)描述,兩組間比較采用獨立樣本t檢驗;非正態分布的計量資料以中位數和上下四分位數[M(P25,P75)]描述,兩組間比較采用Mann-Whitney U檢驗。計數資料以例數及百分比描述,兩組間比較采用Fisher精確概率檢驗分析。P≤0.05為差異有統計學意義。
2 結果
2.1 術前資料
經篩選后共納入504例患者,其中ILVA組31例,常規組473例。兩組患者術前資料,包括年齡、性別、BMI、LVEF及高血壓、糖尿病、腦血管病等既往病史差異均無統計學意義(表1)。
2.2 術中情況
兩組全部患者均在全身麻醉體外循環單一胸骨上段小切口下行主動脈全弓置換及象鼻支架植入手術,同時根據主動脈根部情況進行相應根部手術,兩組手術術式、動脈灌注位置差異無統計學意義。除此之外,ILVA組31例患者均在術中成功重建了左椎動脈,且ILVA組中的體外循環時間和主動脈阻斷時間要略短于常規組,但差異無統計學意義(表2)。
ILVA組中有18例經術前胸腹主動脈CTA診斷孤立性左椎動脈(圖1),其余13例在術中游離分支血管時發現(圖2a)。在重建過程中,有17例于體外循環前即完成ILVA-LCCA吻合,有4例因循環不穩定在體外循環下進行ILVA-LCCA吻合,另10例因左頸總動脈夾層,在完成弓部置換后進行ILVA-分支人工血管吻合。17例非體外循環組患者的體外循環時間與主動脈阻斷時間略短于體外循環組,但差異無統計學意義;見表5。ILVA重建時間定義為弓上分支的阻斷時間,ILVA重建時間為(7.31±1.36)min(表3)。
 圖1
術前CTA明確ILVA診斷
圖1
術前CTA明確ILVA診斷
a~b:患者1胸腹主動脈CTA橫斷圖及三維重建圖;c~d:患者2胸腹主動脈CTA橫斷圖及三維重建圖;LCCA:左頸總動脈;ILVA:孤立性左椎動脈;LSA:左鎖骨下動脈
2.3 術后情況
兩組患者在術后紅細胞用量、ICU時間及住院時間方面差異無統計學意義(P>0.05),在包括二次開胸止血、肺部感染、惡性心律失常、急性腎衰竭行連續性腎臟替代治療(continuous renal replacement therapy,CRRT)及急性腦梗死在內的圍術期并發癥及在院死亡率等方面差異也無統計學意義。ILVA組中共有2例出現急性腦梗死,其中1例術后突發心臟驟停,經搶救后出現腦梗死,出院前恢復良好,1例術后并發急性腦梗死,神志不清,后因多臟器功能衰竭臨床死亡。另有1例因術中止血困難,失血性休克致死亡,余患者均恢復良好,治愈出院(表4)。所有患者出院前復查胸腹主動脈CTA,結果顯示弓上分支及ILVA均通暢,無吻合口假性動脈瘤或狹窄跡象(圖2d)。
3 討論
急性A型主動脈夾層作為一種危及生命的疾病,每小時死亡率升高約1%,一經診斷后應立即急診開胸手術,且無絕對手術禁忌證。隨著大血管外科技術及體外循環技術的進步,圍術期并發癥率及手術死亡率得到了顯著降低[8]。
主動脈弓部的分支血管畸形對全弓置換提出了挑戰,如果處理不當,可能對術中腦保護造成不良影響,最終導致術后神經系統并發癥出現。目前已知的主要分支畸形有牛型主動脈弓、孤立性左椎動脈及迷走右鎖骨下動脈,ILVA是其中第二常見的解剖變異[9],在胸主動脈疾病患者中,比例可達6.3~6.6%[10],與本研究中的發生率6.15%(31/504)接近。普遍認為ILVA可匯入基底動脈,止于小腦后下動脈,向腦干和小腦供血,因此ILVA處理不當可能導致圍術期腦梗死或脊髓缺血[11]。目前已有相關指南[12]建議在主動脈弓部手術中對異常起源的左椎動脈進行血運重建,但并沒有全弓置換術中ILVA重建的適應癥和策略達成共識。通過相關檢查明確ILVA的優勢情況及Willis環完整情況可指導術中分支處理策略,但TAAD患者往往沒有時間進行這些檢查。在本研究中,有58%(18/31)的患者通過術前胸腹主動脈CTA可診斷ILVA,其余患者均在術中發現。與LCCA及LSA相比,ILVA相對細小,約為3.4~5.1 mm[13-14],因此從診斷到明確ILVA支配地位均有較大難度。考慮到中國人Willis環后循環完整率為31%,而全部完整率更低,僅為27%[15],在全弓置換術中應優先重建ILVA,從而避免犧牲ILVA導致神經功能損傷的風險。
在既往的TAAD術中左椎動脈重建的相關報道中,Yi等[16]采用胸部正中切口,在腋動脈、股動脈轉流基礎上,優先進行體外循環下ILVA-LCCA重建術,但是這種方法仍存在LCCA殘留夾層加重,影響ILVA供血的風險。部分術者將ILVA在術中與LSA或其分支人工血管上進行端側吻合,同樣取得良好的臨床效果[17-18]。更有個別報道采用大隱靜脈在ILVA和LSA間以“搭橋”方式進行重建[19],亦有對ILVA及周圍分支血管進行島狀吻合重建[20],但這種方法并不適用于弓部或分支血管嚴重夾層撕裂的患者。近年來,主動脈腔內修復術(TEVAR)已逐漸應用于累及到主動脈弓部的復雜B型主動脈夾層中。Shen等[14]在鎖骨處做一切口,暴露ILVA,采用原位開窗技術在TEVAR術中對ILVA進行重建,Ding等[21]通過頸部切口進行ILVA到LCCA轉位,隨后進行TEVAR修復B型主動脈夾層,均未觀察到神經系統并發癥。
本研究中全部患者均在單一胸骨上段小切口下完成全主動脈弓置換、象鼻支架植入術及合并手術,該術式的應用我們已在之前進行了詳細報道[22-23]。主要困難來自于小切口帶來的暴露相對不足,尤其是ILVA和LSA。對于術前未診斷ILVA的患者,在游離LSA時務必明確是否發出左椎動脈,以避免遺漏ILVA。雖然將ILVA重建至LSA最符合生理,但在深且窄的LSA區域進行深部吻合是有難度的,且在全弓置換中,左鎖骨下動脈的供血是最后恢復的。因此ILVA-LCCA重建不僅更易于操作,還可以更早恢復ILVA灌注。在本研究中,ILVA組中進一步分為體外循環組與非體外循環組,結果表明非體外循環下進行ILVA重建不增加術后神經系統并發癥發生率,且更易于操作。因此若LCCA未被夾層累及,應優先選擇常溫非體外循環條件下進行ILVA-LCCA端側吻合,不增加體外循環時間,且停循環腦灌注時期IVLA同樣可以得到供血,若LCCA無可以吻合的正常區域,則在全弓置換后進行ILVA-分支人工血管的吻合。在ILVA組中,腦部并發癥發生率較常規組差異無統計學意義,其中僅1例患者術后并發急性腦梗死,神志未清醒,并因多臟器功能衰竭放棄治療,另有一例因心臟驟停行搶救治療,后出現急性腦梗死,經系統治療后恢復良好,順利出院,其余患者均無神經系統并發癥出現,且出院前復查胸腹主動脈CTA均顯示了完整、通暢的弓部分支血管。
然而,本研究中仍存在許多有待完善的局限性。首先,由于本研究的回顧性性質,時間跨度較大,來自單中心且樣本相對較少,具有較高的偏倚風險。其次,隨訪時間較短,隨訪收集資料欠全面。后續可根據情況設計前瞻性研究,同時對已有病例延長隨訪時間,完善相關資料的采集。
綜上所述,對于TAAD合并ILVA的患者,為了降低圍術期腦缺血和脊髓損傷的風險,術中應盡早且完整的重建ILVA,并優先在非體外循環狀態下進行。根據本研究結果表明,在單一胸骨上段小切口下進行TAAD手術及同期ILVA-LCCA重建是安全可行的,但仍需要更長時間的隨訪已明確遠期并發癥及ILVA通暢情況。
利益沖突:無。
作者貢獻:王璐參與研究設計、數據分析、文章撰寫和修改;葛玉光、楊忠路、劉宇參與手術、數據收集;夏麟、劉秩碩參與數據分析,文章修改;姜輝負責手術實施、研究設計、文章撰寫和修改。