版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
隨著CT分辨率的提高和公眾健康意識的增強,肺結節(pulmonary nodules,PN)檢出人群激增,在我國的檢出率為20%~80%[1]。肺結節是肺癌早期表現形式之一,有30%~40%的肺結節最終發展為肺癌[2],實現超早期、精準診療肺結節是肺癌防治的有效路徑和關鍵策略[3]。然而,現階段以CT檢查為主的肺結節隨訪管理不僅存在接受不必要的輻射等風險,過度診療也加重了患者的心理壓力和社會經濟負擔。因此,在無創層面不斷拓展新的肺結節診療路徑成為近年來諸多團隊持續探索的前沿與熱點,具有重要的臨床意義和應用前景。
大量臨床研究表明,中醫藥能有效干預肺結節[4-6]。《肺結節中西醫結合全程管理專家共識》的發布,進一步明確了中醫藥在肺結節診療中優勢作用[7]。在肺結節的中醫診療體系中,辨證論治是核心策略,而證素辨證則是這一策略的核心所在[8]。證素辨證以證候為基,從宏觀表征層面認識肺結節患者機體狀態,目前尚缺乏可將其量化的微觀指標[9]。隨著16S rRNA等微生物測序技術的不斷發展,微生物在健康與疾病方面的重要作用日益凸顯,微生物組在健康和疾病中到底扮演了什么樣的角色?這一話題作為全世界最前沿的125個科學問題之一,受到持續廣泛關注[10]。Science、Nature等頂級期刊研究均證明口腔菌群作為肺部微生物主要來源,參與塑造了包括肺癌在內的多種疾病的發生和發展[11-13]。課題組前期聚焦于肺癌這一重大疾病前期狀態-肺結節,基于16S rRNA測序技術在屬水平層面亦證實了唾液微生物具有作為肺結節診斷生物標志物的潛力[14]。
證素高度概括疾病外在表征,微生物反映機體內在變化,兩者是疾病發展演變同一狀態下不同層面的宏微觀具象[15]。深入探究中醫證素與微生物之間的相關性,有利于辨識病證的發生發展及病情轉歸。近年來,諸多團隊也積極探索了二者的生物學相關性。黃偉榮團隊[16]發現慢性萎縮性胃炎C-3階段陰虛與普雷沃菌屬(Prevotella)呈正相關,這可能是因為雷沃菌屬(Prevotella)過量定植會促進炎癥反應;沈睿等[17]研究指出“脾胃虛弱型”胃癌患者舌苔菌落中芽孢桿菌(Bacillus)顯著富集,這可能與芽孢桿菌屬(Bacillus)促進胃腸黏膜炎癥,損傷胃腸功能有關。然而,聚焦肺結節,其唾液微生物與中醫證素之間的潛在相關性目前尚缺乏研究證據。
因此,本研究以肺結節患者為研究對象,采集患者證素信息,分析肺結節患者中醫證素分布及唾液菌群特征,采用排序回歸分析、Mantel test分析、Spearman相關性分析等多級關聯分析方法探索兩者的相關性,以期為肺結節的中醫證素辨證提供客觀化生物學依據,亦對肺結節疾病的風險預警、靶向治療、療效評價提供新思路。
1 資料與方法
1.1 研究對象
研究對象來自成都中醫藥大學附屬醫院、四川省腫瘤醫院及成都市中西醫結合醫院2022年7月—2023年3月收治的符合診斷、納入及排除標準的受試者。所有受試者均已簽署書面知情同意書。
1.2 方法
1.2.1 西醫診斷標準
參照《肺結節診治中國專家共識(2018年版)》中肺結節診斷標準[18]:影像學表現為直徑≤3 cm的局灶性、類圓形、密度增高的實性或亞實性肺部陰影,可為孤立性或多發性,不伴肺不張、肺門淋巴結腫大和胸腔積液。
1.2.2 中醫證素辨證標準
參照朱文鋒教授《證素辨證學》中的證素診斷標準[19],根據收集的中醫四診信息,將同一證素對應的所有癥狀-證素權重相加,從而得到證素權重積分;然后通過權重積分與閾值關系確定證素。
1.2.3 受試者納入標準
(1)肺結節患者具有明確的胸部CT影像學異常,符合肺結節診斷標準;(2)健康人胸部CT影像學無肺結節及其他肺部異常現象;(3)無其他腫瘤病史;(4)無呼吸系統相關手術史;(5)年齡18~80歲,性別不限;(6)自愿同意參加本研究。
1.2.4 受試者排除標準
(1)患有惡性腫瘤、其他呼吸系統疾病(肺炎、肺結核等)以及其他嚴重的心血管、內分泌、血液系統等疾病;(2)有自身免疫性疾病病史,或長期免疫抑制劑使用史;(3)有未經治療的傳染性疾病病史;(4)患有口腔疾病等合并疾病;(5)近1個月內使用過抗生素類藥物、酸奶等;(6)存在嚴重的精神障礙(感知障礙、思維障礙等)者。
1.2.5 信息與中醫證素采集
查閱萬方、維普、知網等數據庫中與肺結節相關的中醫文獻,結合《中醫診斷學》、《中醫內科學》等教材中與本病相關的癥狀和體征,統計得到肺結節的常見癥狀,參照既往肺結節中醫證素分布特征的研究[20],制作肺結節中醫證素采集表,記錄患者一般信息(性別、年齡、吸煙史)以及肺結節信息與四診信息。四診信息采集由經培訓過的中醫專業的研究人員肺結節中醫證素采集表根據進行臨床信息采集。舌苔、脈象由課題組2名中醫主任醫師共同判定,如實記錄。以朱文鋒教授《證素辨證學》中“證候辨證素量表”制成證候辨證素計算Excel數據庫,列出肺結節中醫證素采集表中癥狀與體征對應證素的不同權值,累加分值并以分值≥70提取證素。
1.2.6 唾液樣本采集
受試者身體前傾,頭微低,微張口,由采樣者將無菌EP管置于受試者下唇部,使唾液自然流入管中,采集非刺激性唾液2~3 mL,予干冰保存,4 h內轉運至實驗室?80 ℃冰箱等待后續試驗。
1.2.7 唾液菌群16S rRNA檢測
(1)唾液微生物DNA抽提與質檢:根據制造商(Omega Bio-tek,Norcross,GA,U.S.)說明書進行唾液微生物群落總基因組DNA抽提,使用1%的瓊脂糖凝膠電泳檢測對提取的唾液基因組DNA進行質檢,使用NanoDrop2000(美國Thermo Scientific公司)對DNA濃度、純度進行定量檢測。(2)PCR擴增和測序文庫構建:以提取出的唾液微生物群落總基因組DNA為模板,對基因的V3-V4可變區使用攜帶Barcode序列的上游引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和下游引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)進行PCR擴增(PCR儀:ABI GeneAmp?
1.3 數據處理與統計學分析
菌群α多樣性指數(Sobs)由mothur軟件計算分析。Beta多樣性指數采用基于Bray-Curtis算法的主成分分析(principal co-ordinates analysis,PCoA)方法進行分析,菌群多樣性分析使用R軟件(version 3.6.2)對結果進行可視化呈現。菌群結構分析運用R軟件(version 3.6.2)進行分析與繪制物種分析Venn圖,群落Bar圖、共線性網絡圖則通過Python 2.7進行數據分析和圖片繪制。采用R軟件(version 3.6.2)進行Wilcoxon秩和檢驗及線性判別分析(Lineardiscriminant Analysis Effect Size,LEfSe;
運用SPSS26.0版本對數據進行統計分析,連續變量若呈正態分布,則以均數±標準差(x±s)表示,并使用獨立樣本Student’s t檢驗進行組間比較;若為非正態分布,則以中位數(四分位數間距)[M(IQR)]表示,并使用Wilcoxon符號秩和檢驗進行組間比較。計數資料以頻數、百分比表示,組間比較采用χ2檢驗、Fisher精確檢驗。P<0.05表示差異有統計學意義。
1.4 倫理審查
本研究已獲成都中醫藥大學附屬醫院倫理委員會審查批準(批準號:2022KL-051),并在中國臨床試驗注冊中心注冊(注冊號:ChiCTR2200062140)。
2 結果
2.1 受試者臨床特征
本研究共納入肺結節患者173例,男69例(32.4%)、女104例(48.8%),中位年齡是45(32,55)歲。健康人40名,男12名、女28名,男女比例為1∶2.33,中位年齡42(33,48)歲。肺結節組(PN)和健康對照組(HC)組間比較結果見表1,除吸煙史之外,在年齡、性別基線特征方面,兩組間差異均無統計學意義。
2.2 肺結節患者和健康人群的病位證素分布差異
PN組中病位證素根據例數從多到少排序,依次是:肺(90)、肝(79)、脾(45)、腎(45)、表(33)、心(26)和大腸(10)。HC組中病位證素例數最多的是肺(9)和脾(9),其次是肝(7)、腎(2)、表(2)、心(1)和大腸(1)。
兩組病位證素在肺、肝、腎、表、心的分布差異具有統計學意義(P<0.05),其中肺結節患者的比例均更高。兩組在脾、大腸的病位證素分布差異均無統計學意義(P>0.05),見表2。
2.3 肺結節患者和健康人群的病性證素分布差異
肺結節患者中病性證素例數最多是陰虛(97),其次是痰(92)、氣滯(82)、氣虛(78)、濕(79)、血虛(63)、陽虛(52)、熱(33)、瘀(31)、寒(21)、飲(13)、燥(10)。健康人群中例數從多到少排序,依次是:濕(11)、氣虛(8)、痰(8)、氣滯(8)、陽虛(7)、寒(6)、陰虛(5)、血虛(3)、飲(3)、瘀(1)、燥(0)。
肺結節患者和健康人群病性證素在陰虛、痰、氣滯、氣虛、濕、血虛、熱、瘀的分布差異有統計學意義(P<0.05),且肺結節患者以上證素占比更高。兩組病性證素在陽虛、寒、飲、燥的分布差異無統計學意義(P>0.05),見表3。
2.4 肺結節患者與健康人群唾液菌群分析
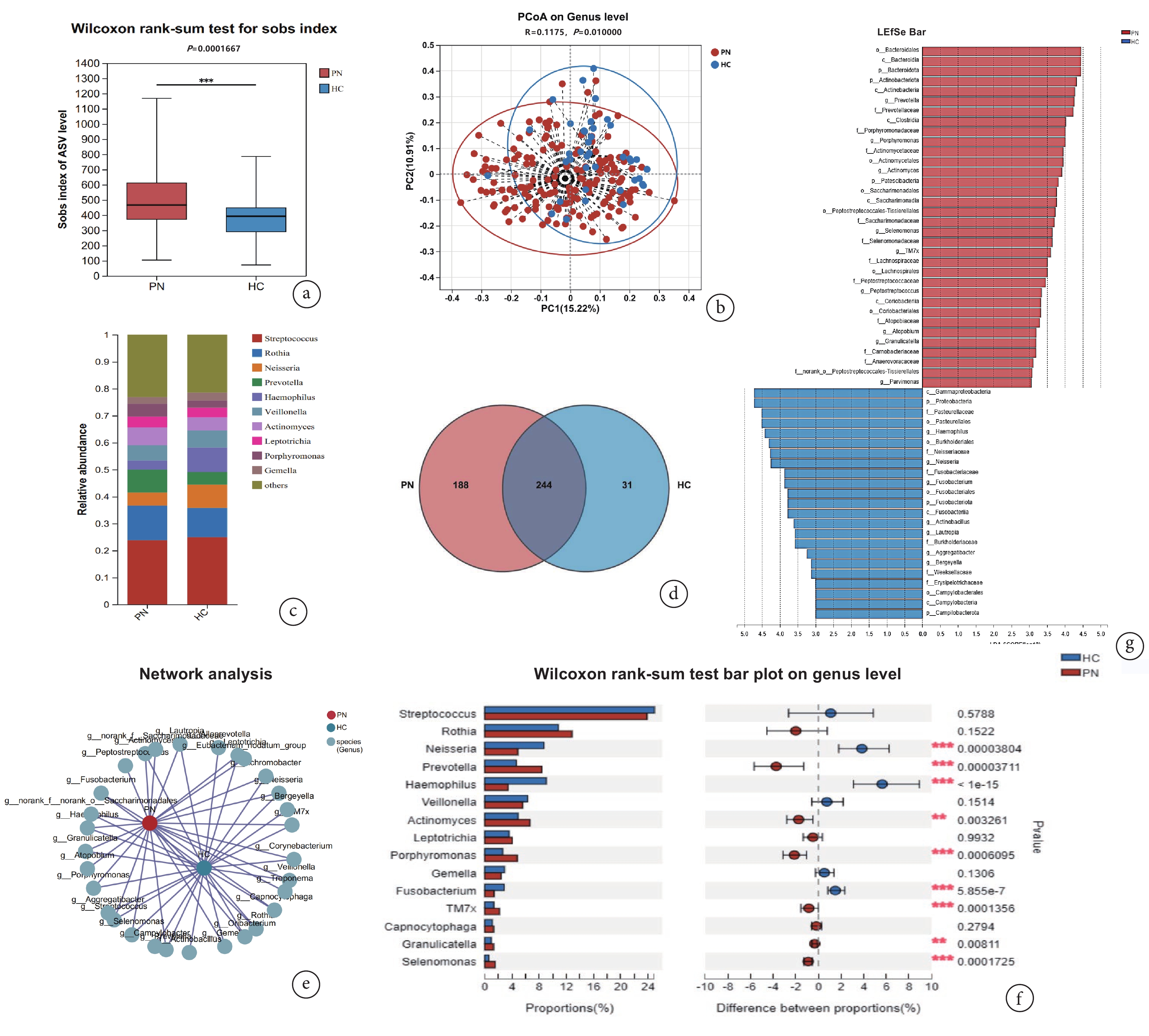
α多樣性分析與β多樣性分析結果提示肺結節患者口腔唾液菌群物種豐富度高于健康人群,兩組之間唾液菌群相似性不同(P<0.05,圖1a、b)。其中,PN組獨有物種188個,HC組有33個獨有物種(圖1c)。物種組成層面,鏈球菌屬(Streptococcus)、羅氏菌屬(Rothia)、奈瑟菌屬(Neisseria)、普雷沃菌屬(Prevotella)、嗜血桿菌屬(Haemophilus)、韋榮球菌屬(Veillonella)、放線菌屬(Actinomyces)、纖毛菌屬(Leptotrichia)、卟啉單胞菌屬(Porphyromonas)、孿生球菌屬(Gemella)為兩組屬水平相對豐度前10的物種(圖1d、e)。基于Wilcoxon秩和檢驗的組間比較結果(圖1f,P<0.05)和LEfSe的判別分析(圖1g,LDA>3)雙重驗證顯示,PN組顯著富集的菌屬包括:普雷沃菌(Prevotella)、卟啉單胞菌屬(Porphyromonas)、放線菌屬(Actinomyces)、月形單胞菌屬(Selenomonas)、顆粒鏈球菌屬(Granulicatella)和TM7x;HC組中主要富集的菌屬為奈瑟菌屬(Neisseria)、嗜血桿菌屬(Haemophilus)、梭桿菌屬(Fusobacterium)、放線桿菌屬(Actinobacillus)、勞特羅普氏菌屬(Lautropia)和團聚桿菌屬(Aggregatibacter)。
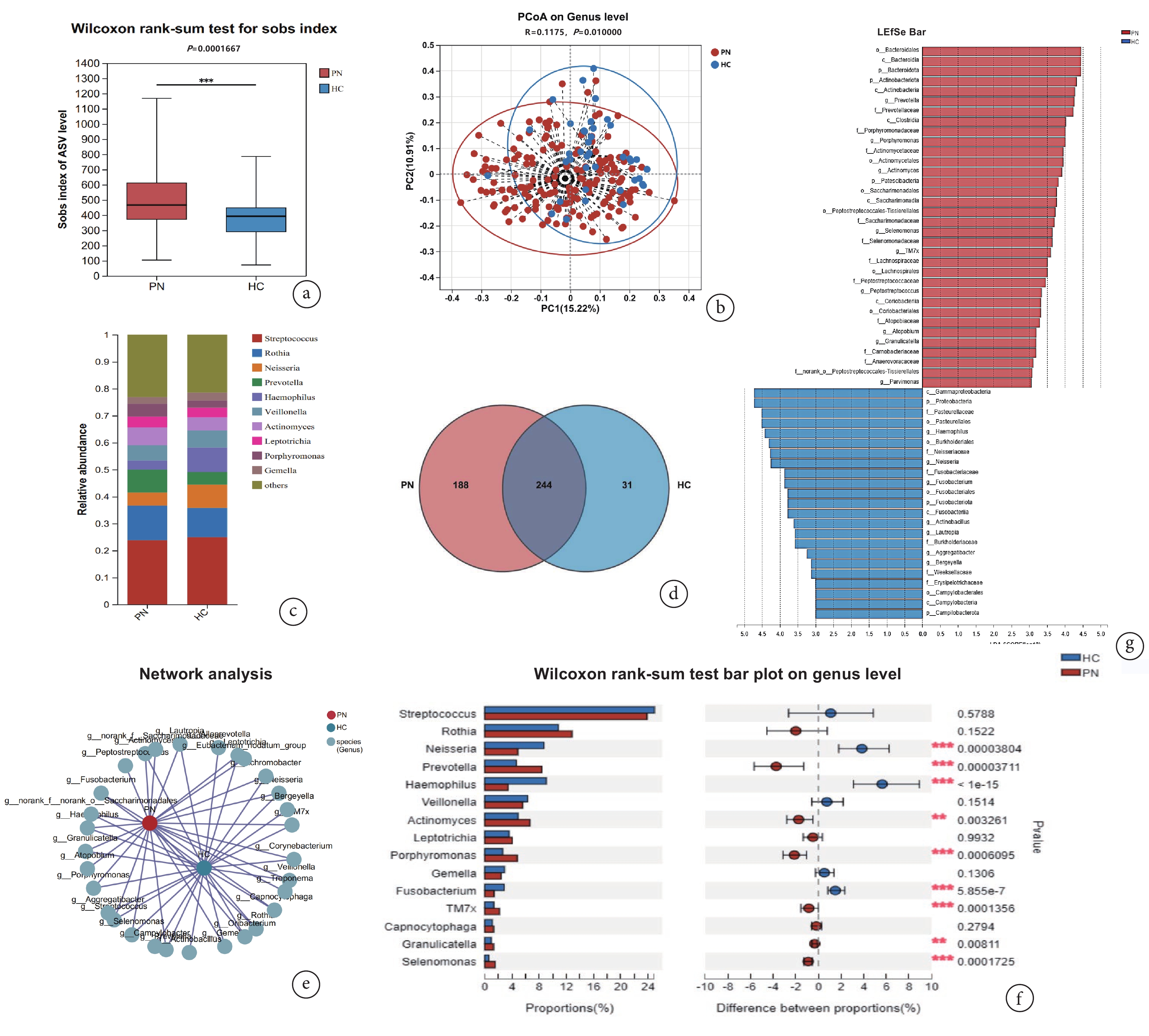 圖1
肺結節患者與健康人群唾液菌群分析結果
圖1
肺結節患者與健康人群唾液菌群分析結果
a:PN組與HC組Sobs指數線箱圖;b:PN組與HC組PCoA散點圖;c:PN組和HC組群落Bar圖;d: PN組和HC組群落Venn圖;e:PN組與HC組共線性網絡圖;f:基于Wilcoxon秩和檢驗的PN組和HC組物種差異分析;g:基于LEfSe分析的PN組和HC組物種差異分析
2.5 中醫證素分布與唾液菌群相關性分析
考慮到與群落分布相關的環境因素復雜、多樣,運用VIF分析篩選出獨立性較強的環境因子。結果顯示,19種證素環境因子在識別前后,其VIF值均<10,因此各變量之間沒有明顯的多重共線性問題,可進行回歸分析;見表4。
將單個病性、病位證素與唾液菌群β多樣性做排序回歸分析,由圖2可知19個證素與唾液樣本群落組成差異具有相關性。其中,病位-肺、病性-陰虛對唾液樣本群落組成差異多樣性具有顯著性影響(P<0.05)。
 圖2
證素與唾液菌群β多樣性排序回歸分析
圖2
證素與唾液菌群β多樣性排序回歸分析
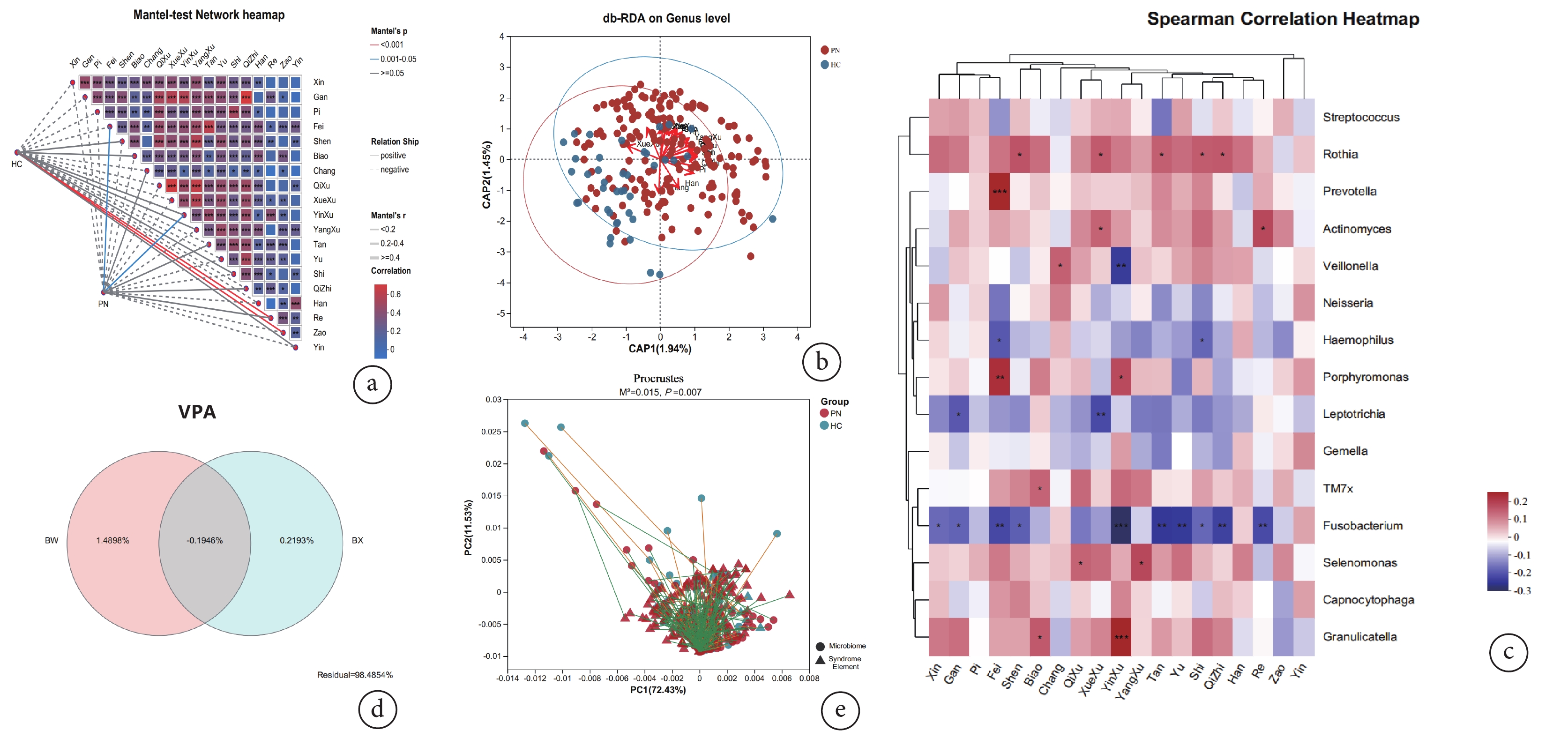
Mantel test分析是檢驗環境因子與菌群結構相關關系的非參數統計方法。由表5可知,證素與唾液菌群組成具有相關性(P<0.05)。進一步進行Mantel test網絡熱圖分析,病位-肺,病性-陰虛對肺結節患者唾液菌群結構組成呈正相關(P<0.05);見圖3a。
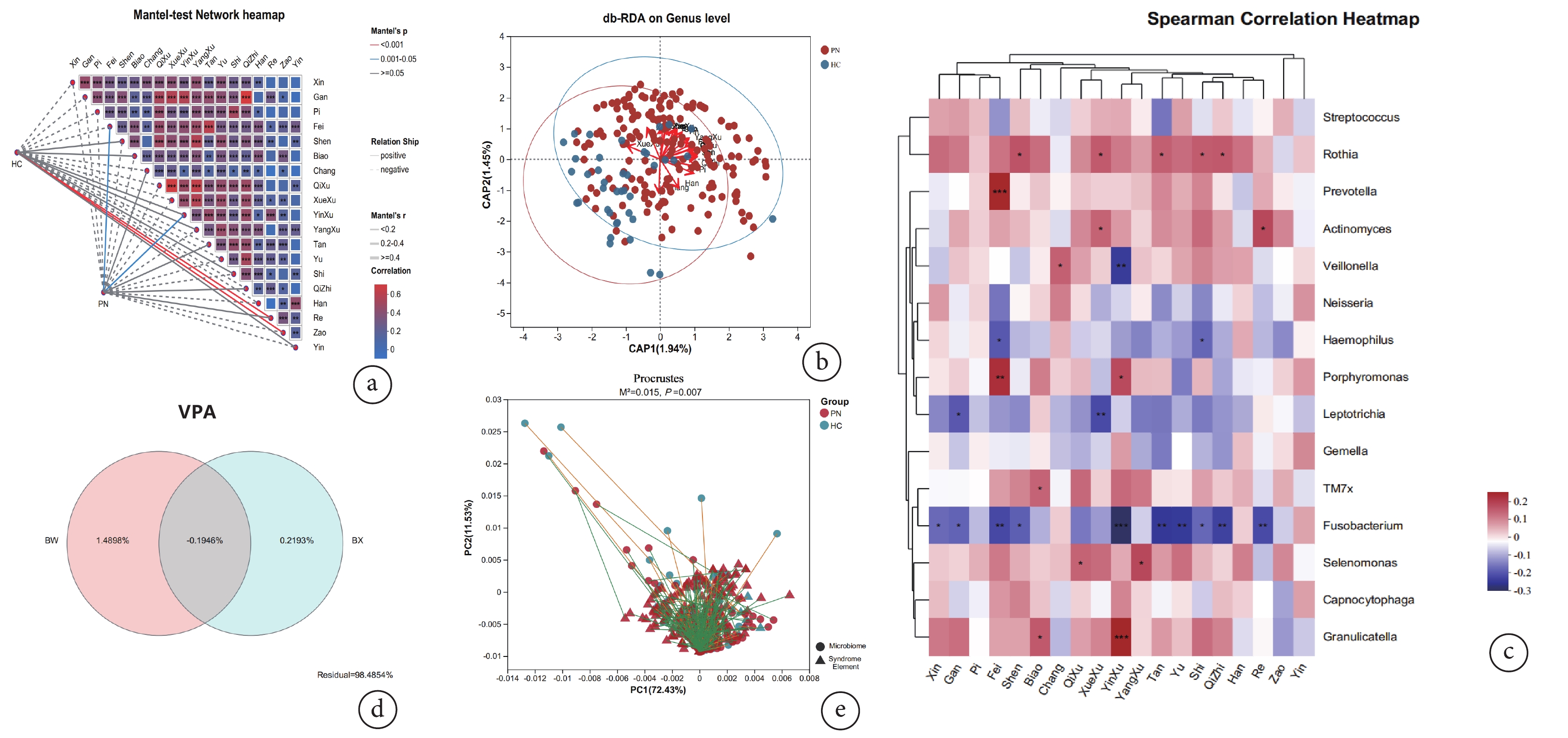 圖3
證素與具體唾液微生物群落組成相關性分析
圖3
證素與具體唾液微生物群落組成相關性分析
a:證素與唾液菌群的網絡熱圖分析;b:基于Bray-Curtis距離的db-RDA分析;c:基于Spearman相關性分析的Heatmap圖;d:證素與唾液菌群的VPA分析;e:證素與唾液菌群的Procrustes分析
基于Bray-Curtis距離算法進行db-RDA分析評估證素對唾液菌群群落組成的影響,全部樣本點聚類形成了兩個cluster(圖3b)。進一步的統計相關性系數及顯著性檢驗結果顯示,病位-心、肺;病性-陰虛、痰、濕、飲和與唾液微生物群落組成具有顯著相關性;見表6。
為探討證素與具體唾液微生物群落組成相關性,采用Spearman相關性分析計算唾液優勢菌屬與證素分布之間的相關性,相關性Heatmap圖顯示(圖3c):病位-肺與普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)呈正相關(r=0.23,P<0.01;r=0.21,P<0.01),與梭桿菌屬(Fusobacterium)呈負相關(r=?0.19,P<0.01)。病性-陰虛與卟啉單胞菌屬(Porphyromonas)、顆粒鏈球菌屬(Granulicatella)呈正相關(r=0.17,P<0.05;r=0.23,P<0.01),與梭桿菌屬(Fusobacterium)、韋榮氏球菌屬(Veillonella)呈負相關(r=?0.25,P<0.01;r=?0.20,P<0.01)。病性-痰與羅氏菌屬(Rothia)呈正相關(r=0.14,P<0.05),與梭桿菌屬(Fusobacterium)呈負相關(r=?0.21,P<0.01)。病性-濕與羅氏菌屬(Rothia)呈正相關(r=0.15,P<0.05),與嗜血桿菌屬(Haemophilus)、梭桿菌屬(Fusobacterium)呈負相關(r=?0.15,P<0.05;r=?0.15,P<0.05)。
病位、病性證素不僅與唾液菌群群落組成具有相關性,通過VPA分析發現證素還對唾液微生物菌群結構變化具有一定解釋度,見圖3d;Procrustes分析進一步證實證素的變化與微生物變化具有一致性(M2=0.015,P<0.05);見圖3e。
3 討論
3.1 中醫證素分布結果與目前中醫對肺結節病因病機的認知相符
肺結節的主要病位證素在肺。肺為華蓋,居胸中,主氣司呼吸,其宣發肅降功能調暢一身氣機。“百病皆生于氣”,氣與津液、血液等有形物質的運行密切相關,肺宣發肅降功能失常是肺結節形成的關鍵病機。肺通調水道依賴于肺氣宣發與肅降,宣降失司則水液代謝失常,不能及時布散,停于肺絡為積;痰留日久,影響肺朝百脈,血行不暢而為瘀,痰瘀互結于肺絡,推動肺結節演進。肺結節僅次于肺病位中醫證素的是肝。一方面,肝主一身之氣機疏泄,氣機正常的升降出入需要肝發揮疏泄功能協同肺宣發肅降共同完成;另一方面,現代快節奏生活方式影響下,學習、工作等競爭愈發激烈,焦慮、抑郁等不良情緒極易產生,情志不暢則肝氣郁結,木火刑金致肺氣郁閉,肺內濁氣停聚壅滯,為肺結節的發生提供條件。在病性證素方面,陰虛、痰病性證素排在前二。肺結節第一病性證素是陰虛。一方面可能是因為是陰虛體質的患者本身是肺結節易感體質[21],另一方面,煙草、霧霾等有毒氣體或環境污染易傷肺陰,導致肺陰虧虛,燥熱內生,煉津成痰成瘀。痰是肺結節次要病性證素。《醫林繩墨·積聚》云:“積者陰也……癥之所因,皆因痰之所起,氣之所結耳……積者,痰之積也”。痰屬陰,為有形之邪,在肺結節形成過程中扮演了重要角色。或因肺失宣肅通調水道失司,或因脾虛無法散津液,或因腎虛無法溫化水液皆可致水液停聚為痰,日久成積。肺、肝為主要病位證素,陰虛、痰為重要病性證素,本研究中的的中醫證素分布結果與目前中醫對肺結節病因病機的認知相符[7]。
3.2 唾液微生物對肺結節診療具有潛在價值
隨著測序技術的發展,唾液微生物作為體液標志物在鑒別肺癌與健康人、肺癌與肺部良性病變等方面的潛力已經被證實[22-23]。我們研究結果表明:與HC組相比,PN組唾液樣本中主要富集的菌屬有:普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)、放線菌屬(Actinomyces)、月形單胞菌屬(Selenomonas)、顆粒鏈球菌屬(Granulicatella)和TM7x。肺結節作為肺癌的早期表現,雖然目前尚缺乏口腔微生物對肺結節發病機制的作用研究,但口腔微生物與肺癌發生發展的關系已被廣泛報道。多項流行病學的證據表明,口腔微生態紊亂的人群患肺癌概率增加[24-25]。普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)、放線菌屬(Actinomyces)、月形單胞菌屬(Selenomonas)、顆粒鏈球菌屬(Granulicatella)、等口腔致病菌可通過吸入、血行轉移入肺內,影響微環境穩態,引起細胞增殖凋亡,免疫炎性反應,促進肺癌細胞侵襲轉移[26-30]。現代研究證實卟啉單胞菌屬(Porphyromonas)中的牙齦卟啉單胞菌(Porphyromonas gingivalis)與包括肺癌在內的多種惡性腫瘤的發生發展相關[31]。一方面,牙齦卟啉單胞菌(Porphyromonas gingivalis)可通過增加促炎因子表達,促進有利于癌癥形成與發展的炎癥環境[32];另一方面,牙齦卟啉單胞菌(Porphyromonas gingivalis)還具有免疫抑制能力,驅動巨噬細胞極化為促腫瘤M2腫瘤相關巨噬細胞(TAM)表型[33],同時能調節p53功能,促進癌細胞的生存和增殖[34-35]。據此推斷牙齦卟啉單胞菌(Porphyromonas gingivalis)可能促進肺結節癌轉化。綜合文獻閱讀及研究成果可見,唾液菌群失調可能推動肺結節惡性演進,對特定菌群的動態監測或可作為未來肺結節和肺癌早期篩查及診斷的重要依據,同時也為利用靶向微生物制劑或微生物移植等手段進行肺結節防治提供了新的切入點。
3.3 肺結節患者中醫證素與唾液菌群特征具有相關性
既往研究證實微生物與慢性萎縮性胃炎、潰瘍性結腸炎、肝硬化等疾病的中醫證素緊密關聯[36-37],表明微生物可作為中醫證素客觀化指標的潛力。我們的相關性分析結果亦顯示肺結節患者證素分布與唾液菌群特征具有顯著相關性:在屬水平6個優勢菌屬中,普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)與病位-肺呈正相關,卟啉單胞菌屬(Porphyromonas)、顆粒鏈球菌屬(Granulicatella)與病性-陰虛呈正相關。李杲亦直言“肺主衛”,肺衛之氣,其與人體抵御病邪的能力有密切關系。中醫之“衛氣”與現代醫學中的免疫系統概念與與不謀而合,其實質可與免疫細胞來源、分布、功能一一對應[38]。大量研究表明,口腔微生物與免疫微環境密切相關。如Wen等[39]發現普雷沃氏菌屬(Prevotella)可能通過誘導腸道上皮細胞環狀核苷酸分泌來調節先天免疫系統及適應性免疫系統。Chopra[40]等發現牙齦卟啉單胞菌(Porphyromonas gingivalis)通過釋放大量黏附素調節中性粒細胞、巨噬細胞、樹突狀細胞、B細胞和T細胞(Th1/Th2/Th17)以調控宿主免疫反應。可見,普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)與病性-肺關聯,既直接參與肺部感染、肺癌等肺部疾病發生發展[41-42],又能夠影響與肺緊密關聯的免疫系統(衛氣)。
陰虛證在病理方面往往表現出炎癥因子增加,相關信號通路激活等特征[43],同時炎癥反應在臨床中通常可表現為發熱、紅、腫、熱痛等一派“火旺”之象,火易迫津外泄、消灼陰液,體內津液耗傷則陰虛。因此,炎癥屬中醫“陰虛”范疇。而口腔微生物與機體炎癥反應同樣有密切的關系。我們研究顯示,顆粒鏈球菌屬(Granulicatella)與病性-陰虛呈正相關。其不僅與口腔黏膜炎、牙周炎、類風濕性關節炎、潰瘍性結腸炎等炎性疾病潛在關聯[44-46],還是IL-1β、IL-6、IL-8、TNF-α等炎癥介質的有效誘導劑[47]。卟啉單胞菌屬(Porphyromonas)不僅與肺結節主要病位證素-肺存在關聯,還與主要病性證素-陰虛具有相關性,因此具有雙重關聯性的卟啉單胞菌屬(Porphyromonas)對于探討中醫證素與唾液菌群特征的相關性更具代表性。牙齦卟啉單胞菌(Porphyromonas gingivalis)與炎癥的發生發展緊密關聯[32]。其既能通過Toll樣受體4(TLR-4)識別自身細菌外膜LPS成分,刺激MyD 88依賴性和非依賴性途徑,釋放NF-κB,導致促炎細胞因子的產生,形成炎癥環境[48];又可通過Toll樣受體2(TLR-2)誘導人支氣管上皮細胞和咽上皮細胞中IL-6和IL-8 mRNA表達,促進促炎細胞因子的產生,誘導炎癥環境形成[49]。炎癥微環境在肺結節的發生發展中占據重要地位,50%的肺結節病理因素由炎癥引起[50]。由此可見,唾液微生物與肺結節中醫證素之間存在密切生物學關聯,口腔微生物的豐度變化或可作為肺結節患者證素的客觀量化指標。
本研究的局限性及研究展望總結如下:(1)樣本量有待進一步擴大:本研究作為研究團隊關于微生物與肺結節(microbiome with pulmonary nodule,MCEPN)系列研究的先導性成果,前期我們共收集了213例臨床樣本,樣本量有限。目前研究團隊正持續開展多中心、大樣本研究,同步進行追蹤隨訪,后續將從結節大小、密度、良惡性等多角度對肺結節的生物學特征進行刻畫。(2)微生物多樣性分析技術有限:基于16S rRNA高通量測序的生物信息學分析,雖能夠顯示肺結節疾病的微生物群落物種組成、物種豐度、富集菌屬,但并未細化到菌種水平、基因及蛋白質的功能,我們目前正在結合宏基因組、蛋白質組學、代謝組學等多組學技術,進一步研究“微生物-宿主”間的相互作用。(3)作用機制有待進一步闡明:本研究對唾液微生物與肺結節的發病機制的探索是初步和預測的,研究團隊正在基于類器官和基因編輯技術,積極探索并構建多基因聯合驅動的肺結節動物模型,開展基礎實驗深入解析肺結節疾病演進背后復雜的作用機制,進一步明確唾液微生物群影響肺結節疾病狀態的關鍵途徑,以期深入探索中醫藥通過靶向唾液菌群阻延肺結節惡性演進的確切效應,為肺結節及早期肺癌的診療提供新的切入點。
肺結節患者和健康人群在肺、肝、陰虛、痰、濕等證素的分布存在差異,在卟啉單胞菌屬(Porphyromonas)、普雷沃菌屬(Prevotella)等唾液菌群的物種豐度組成方面有所不同。其中,卟啉單胞菌屬(Porphyromonas)與病位-肺、病性-陰虛具有顯著雙重關聯性,其豐度變化或可作為陰虛型肺結節患者癥候改善的微觀指標。包括卟啉單胞菌屬(Porphyromonas)在內的唾液微生物組具有作為監測肺結節患者疾病狀態變化的無創性生物標志物的潛力,亦可成為肺結節中醫證素客觀化的量化指標。
利益沖突:無。
作者貢獻:向紅霞和何佳瑋負責數據分析,論文設計和初稿撰寫及修改;譚施言、付西負責數據采集,統計分析;由鳳鳴負責論文設計和審閱、對編輯部的意見進行核修;由麗婷、石薇負責數據整理和分析;任益鋒和馬瓊負責研究方案制定及指導,文章的知識性內容審閱與修改、對編輯部的意見進行核修。
隨著CT分辨率的提高和公眾健康意識的增強,肺結節(pulmonary nodules,PN)檢出人群激增,在我國的檢出率為20%~80%[1]。肺結節是肺癌早期表現形式之一,有30%~40%的肺結節最終發展為肺癌[2],實現超早期、精準診療肺結節是肺癌防治的有效路徑和關鍵策略[3]。然而,現階段以CT檢查為主的肺結節隨訪管理不僅存在接受不必要的輻射等風險,過度診療也加重了患者的心理壓力和社會經濟負擔。因此,在無創層面不斷拓展新的肺結節診療路徑成為近年來諸多團隊持續探索的前沿與熱點,具有重要的臨床意義和應用前景。
大量臨床研究表明,中醫藥能有效干預肺結節[4-6]。《肺結節中西醫結合全程管理專家共識》的發布,進一步明確了中醫藥在肺結節診療中優勢作用[7]。在肺結節的中醫診療體系中,辨證論治是核心策略,而證素辨證則是這一策略的核心所在[8]。證素辨證以證候為基,從宏觀表征層面認識肺結節患者機體狀態,目前尚缺乏可將其量化的微觀指標[9]。隨著16S rRNA等微生物測序技術的不斷發展,微生物在健康與疾病方面的重要作用日益凸顯,微生物組在健康和疾病中到底扮演了什么樣的角色?這一話題作為全世界最前沿的125個科學問題之一,受到持續廣泛關注[10]。Science、Nature等頂級期刊研究均證明口腔菌群作為肺部微生物主要來源,參與塑造了包括肺癌在內的多種疾病的發生和發展[11-13]。課題組前期聚焦于肺癌這一重大疾病前期狀態-肺結節,基于16S rRNA測序技術在屬水平層面亦證實了唾液微生物具有作為肺結節診斷生物標志物的潛力[14]。
證素高度概括疾病外在表征,微生物反映機體內在變化,兩者是疾病發展演變同一狀態下不同層面的宏微觀具象[15]。深入探究中醫證素與微生物之間的相關性,有利于辨識病證的發生發展及病情轉歸。近年來,諸多團隊也積極探索了二者的生物學相關性。黃偉榮團隊[16]發現慢性萎縮性胃炎C-3階段陰虛與普雷沃菌屬(Prevotella)呈正相關,這可能是因為雷沃菌屬(Prevotella)過量定植會促進炎癥反應;沈睿等[17]研究指出“脾胃虛弱型”胃癌患者舌苔菌落中芽孢桿菌(Bacillus)顯著富集,這可能與芽孢桿菌屬(Bacillus)促進胃腸黏膜炎癥,損傷胃腸功能有關。然而,聚焦肺結節,其唾液微生物與中醫證素之間的潛在相關性目前尚缺乏研究證據。
因此,本研究以肺結節患者為研究對象,采集患者證素信息,分析肺結節患者中醫證素分布及唾液菌群特征,采用排序回歸分析、Mantel test分析、Spearman相關性分析等多級關聯分析方法探索兩者的相關性,以期為肺結節的中醫證素辨證提供客觀化生物學依據,亦對肺結節疾病的風險預警、靶向治療、療效評價提供新思路。
1 資料與方法
1.1 研究對象
研究對象來自成都中醫藥大學附屬醫院、四川省腫瘤醫院及成都市中西醫結合醫院2022年7月—2023年3月收治的符合診斷、納入及排除標準的受試者。所有受試者均已簽署書面知情同意書。
1.2 方法
1.2.1 西醫診斷標準
參照《肺結節診治中國專家共識(2018年版)》中肺結節診斷標準[18]:影像學表現為直徑≤3 cm的局灶性、類圓形、密度增高的實性或亞實性肺部陰影,可為孤立性或多發性,不伴肺不張、肺門淋巴結腫大和胸腔積液。
1.2.2 中醫證素辨證標準
參照朱文鋒教授《證素辨證學》中的證素診斷標準[19],根據收集的中醫四診信息,將同一證素對應的所有癥狀-證素權重相加,從而得到證素權重積分;然后通過權重積分與閾值關系確定證素。
1.2.3 受試者納入標準
(1)肺結節患者具有明確的胸部CT影像學異常,符合肺結節診斷標準;(2)健康人胸部CT影像學無肺結節及其他肺部異常現象;(3)無其他腫瘤病史;(4)無呼吸系統相關手術史;(5)年齡18~80歲,性別不限;(6)自愿同意參加本研究。
1.2.4 受試者排除標準
(1)患有惡性腫瘤、其他呼吸系統疾病(肺炎、肺結核等)以及其他嚴重的心血管、內分泌、血液系統等疾病;(2)有自身免疫性疾病病史,或長期免疫抑制劑使用史;(3)有未經治療的傳染性疾病病史;(4)患有口腔疾病等合并疾病;(5)近1個月內使用過抗生素類藥物、酸奶等;(6)存在嚴重的精神障礙(感知障礙、思維障礙等)者。
1.2.5 信息與中醫證素采集
查閱萬方、維普、知網等數據庫中與肺結節相關的中醫文獻,結合《中醫診斷學》、《中醫內科學》等教材中與本病相關的癥狀和體征,統計得到肺結節的常見癥狀,參照既往肺結節中醫證素分布特征的研究[20],制作肺結節中醫證素采集表,記錄患者一般信息(性別、年齡、吸煙史)以及肺結節信息與四診信息。四診信息采集由經培訓過的中醫專業的研究人員肺結節中醫證素采集表根據進行臨床信息采集。舌苔、脈象由課題組2名中醫主任醫師共同判定,如實記錄。以朱文鋒教授《證素辨證學》中“證候辨證素量表”制成證候辨證素計算Excel數據庫,列出肺結節中醫證素采集表中癥狀與體征對應證素的不同權值,累加分值并以分值≥70提取證素。
1.2.6 唾液樣本采集
受試者身體前傾,頭微低,微張口,由采樣者將無菌EP管置于受試者下唇部,使唾液自然流入管中,采集非刺激性唾液2~3 mL,予干冰保存,4 h內轉運至實驗室?80 ℃冰箱等待后續試驗。
1.2.7 唾液菌群16S rRNA檢測
(1)唾液微生物DNA抽提與質檢:根據制造商(Omega Bio-tek,Norcross,GA,U.S.)說明書進行唾液微生物群落總基因組DNA抽提,使用1%的瓊脂糖凝膠電泳檢測對提取的唾液基因組DNA進行質檢,使用NanoDrop2000(美國Thermo Scientific公司)對DNA濃度、純度進行定量檢測。(2)PCR擴增和測序文庫構建:以提取出的唾液微生物群落總基因組DNA為模板,對基因的V3-V4可變區使用攜帶Barcode序列的上游引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和下游引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)進行PCR擴增(PCR儀:ABI GeneAmp?
1.3 數據處理與統計學分析
菌群α多樣性指數(Sobs)由mothur軟件計算分析。Beta多樣性指數采用基于Bray-Curtis算法的主成分分析(principal co-ordinates analysis,PCoA)方法進行分析,菌群多樣性分析使用R軟件(version 3.6.2)對結果進行可視化呈現。菌群結構分析運用R軟件(version 3.6.2)進行分析與繪制物種分析Venn圖,群落Bar圖、共線性網絡圖則通過Python 2.7進行數據分析和圖片繪制。采用R軟件(version 3.6.2)進行Wilcoxon秩和檢驗及線性判別分析(Lineardiscriminant Analysis Effect Size,LEfSe;
運用SPSS26.0版本對數據進行統計分析,連續變量若呈正態分布,則以均數±標準差(x±s)表示,并使用獨立樣本Student’s t檢驗進行組間比較;若為非正態分布,則以中位數(四分位數間距)[M(IQR)]表示,并使用Wilcoxon符號秩和檢驗進行組間比較。計數資料以頻數、百分比表示,組間比較采用χ2檢驗、Fisher精確檢驗。P<0.05表示差異有統計學意義。
1.4 倫理審查
本研究已獲成都中醫藥大學附屬醫院倫理委員會審查批準(批準號:2022KL-051),并在中國臨床試驗注冊中心注冊(注冊號:ChiCTR2200062140)。
2 結果
2.1 受試者臨床特征
本研究共納入肺結節患者173例,男69例(32.4%)、女104例(48.8%),中位年齡是45(32,55)歲。健康人40名,男12名、女28名,男女比例為1∶2.33,中位年齡42(33,48)歲。肺結節組(PN)和健康對照組(HC)組間比較結果見表1,除吸煙史之外,在年齡、性別基線特征方面,兩組間差異均無統計學意義。
2.2 肺結節患者和健康人群的病位證素分布差異
PN組中病位證素根據例數從多到少排序,依次是:肺(90)、肝(79)、脾(45)、腎(45)、表(33)、心(26)和大腸(10)。HC組中病位證素例數最多的是肺(9)和脾(9),其次是肝(7)、腎(2)、表(2)、心(1)和大腸(1)。
兩組病位證素在肺、肝、腎、表、心的分布差異具有統計學意義(P<0.05),其中肺結節患者的比例均更高。兩組在脾、大腸的病位證素分布差異均無統計學意義(P>0.05),見表2。
2.3 肺結節患者和健康人群的病性證素分布差異
肺結節患者中病性證素例數最多是陰虛(97),其次是痰(92)、氣滯(82)、氣虛(78)、濕(79)、血虛(63)、陽虛(52)、熱(33)、瘀(31)、寒(21)、飲(13)、燥(10)。健康人群中例數從多到少排序,依次是:濕(11)、氣虛(8)、痰(8)、氣滯(8)、陽虛(7)、寒(6)、陰虛(5)、血虛(3)、飲(3)、瘀(1)、燥(0)。
肺結節患者和健康人群病性證素在陰虛、痰、氣滯、氣虛、濕、血虛、熱、瘀的分布差異有統計學意義(P<0.05),且肺結節患者以上證素占比更高。兩組病性證素在陽虛、寒、飲、燥的分布差異無統計學意義(P>0.05),見表3。
2.4 肺結節患者與健康人群唾液菌群分析
α多樣性分析與β多樣性分析結果提示肺結節患者口腔唾液菌群物種豐富度高于健康人群,兩組之間唾液菌群相似性不同(P<0.05,圖1a、b)。其中,PN組獨有物種188個,HC組有33個獨有物種(圖1c)。物種組成層面,鏈球菌屬(Streptococcus)、羅氏菌屬(Rothia)、奈瑟菌屬(Neisseria)、普雷沃菌屬(Prevotella)、嗜血桿菌屬(Haemophilus)、韋榮球菌屬(Veillonella)、放線菌屬(Actinomyces)、纖毛菌屬(Leptotrichia)、卟啉單胞菌屬(Porphyromonas)、孿生球菌屬(Gemella)為兩組屬水平相對豐度前10的物種(圖1d、e)。基于Wilcoxon秩和檢驗的組間比較結果(圖1f,P<0.05)和LEfSe的判別分析(圖1g,LDA>3)雙重驗證顯示,PN組顯著富集的菌屬包括:普雷沃菌(Prevotella)、卟啉單胞菌屬(Porphyromonas)、放線菌屬(Actinomyces)、月形單胞菌屬(Selenomonas)、顆粒鏈球菌屬(Granulicatella)和TM7x;HC組中主要富集的菌屬為奈瑟菌屬(Neisseria)、嗜血桿菌屬(Haemophilus)、梭桿菌屬(Fusobacterium)、放線桿菌屬(Actinobacillus)、勞特羅普氏菌屬(Lautropia)和團聚桿菌屬(Aggregatibacter)。
 圖1
肺結節患者與健康人群唾液菌群分析結果
圖1
肺結節患者與健康人群唾液菌群分析結果
a:PN組與HC組Sobs指數線箱圖;b:PN組與HC組PCoA散點圖;c:PN組和HC組群落Bar圖;d: PN組和HC組群落Venn圖;e:PN組與HC組共線性網絡圖;f:基于Wilcoxon秩和檢驗的PN組和HC組物種差異分析;g:基于LEfSe分析的PN組和HC組物種差異分析
2.5 中醫證素分布與唾液菌群相關性分析
考慮到與群落分布相關的環境因素復雜、多樣,運用VIF分析篩選出獨立性較強的環境因子。結果顯示,19種證素環境因子在識別前后,其VIF值均<10,因此各變量之間沒有明顯的多重共線性問題,可進行回歸分析;見表4。
將單個病性、病位證素與唾液菌群β多樣性做排序回歸分析,由圖2可知19個證素與唾液樣本群落組成差異具有相關性。其中,病位-肺、病性-陰虛對唾液樣本群落組成差異多樣性具有顯著性影響(P<0.05)。
 圖2
證素與唾液菌群β多樣性排序回歸分析
圖2
證素與唾液菌群β多樣性排序回歸分析
Mantel test分析是檢驗環境因子與菌群結構相關關系的非參數統計方法。由表5可知,證素與唾液菌群組成具有相關性(P<0.05)。進一步進行Mantel test網絡熱圖分析,病位-肺,病性-陰虛對肺結節患者唾液菌群結構組成呈正相關(P<0.05);見圖3a。
 圖3
證素與具體唾液微生物群落組成相關性分析
圖3
證素與具體唾液微生物群落組成相關性分析
a:證素與唾液菌群的網絡熱圖分析;b:基于Bray-Curtis距離的db-RDA分析;c:基于Spearman相關性分析的Heatmap圖;d:證素與唾液菌群的VPA分析;e:證素與唾液菌群的Procrustes分析
基于Bray-Curtis距離算法進行db-RDA分析評估證素對唾液菌群群落組成的影響,全部樣本點聚類形成了兩個cluster(圖3b)。進一步的統計相關性系數及顯著性檢驗結果顯示,病位-心、肺;病性-陰虛、痰、濕、飲和與唾液微生物群落組成具有顯著相關性;見表6。
為探討證素與具體唾液微生物群落組成相關性,采用Spearman相關性分析計算唾液優勢菌屬與證素分布之間的相關性,相關性Heatmap圖顯示(圖3c):病位-肺與普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)呈正相關(r=0.23,P<0.01;r=0.21,P<0.01),與梭桿菌屬(Fusobacterium)呈負相關(r=?0.19,P<0.01)。病性-陰虛與卟啉單胞菌屬(Porphyromonas)、顆粒鏈球菌屬(Granulicatella)呈正相關(r=0.17,P<0.05;r=0.23,P<0.01),與梭桿菌屬(Fusobacterium)、韋榮氏球菌屬(Veillonella)呈負相關(r=?0.25,P<0.01;r=?0.20,P<0.01)。病性-痰與羅氏菌屬(Rothia)呈正相關(r=0.14,P<0.05),與梭桿菌屬(Fusobacterium)呈負相關(r=?0.21,P<0.01)。病性-濕與羅氏菌屬(Rothia)呈正相關(r=0.15,P<0.05),與嗜血桿菌屬(Haemophilus)、梭桿菌屬(Fusobacterium)呈負相關(r=?0.15,P<0.05;r=?0.15,P<0.05)。
病位、病性證素不僅與唾液菌群群落組成具有相關性,通過VPA分析發現證素還對唾液微生物菌群結構變化具有一定解釋度,見圖3d;Procrustes分析進一步證實證素的變化與微生物變化具有一致性(M2=0.015,P<0.05);見圖3e。
3 討論
3.1 中醫證素分布結果與目前中醫對肺結節病因病機的認知相符
肺結節的主要病位證素在肺。肺為華蓋,居胸中,主氣司呼吸,其宣發肅降功能調暢一身氣機。“百病皆生于氣”,氣與津液、血液等有形物質的運行密切相關,肺宣發肅降功能失常是肺結節形成的關鍵病機。肺通調水道依賴于肺氣宣發與肅降,宣降失司則水液代謝失常,不能及時布散,停于肺絡為積;痰留日久,影響肺朝百脈,血行不暢而為瘀,痰瘀互結于肺絡,推動肺結節演進。肺結節僅次于肺病位中醫證素的是肝。一方面,肝主一身之氣機疏泄,氣機正常的升降出入需要肝發揮疏泄功能協同肺宣發肅降共同完成;另一方面,現代快節奏生活方式影響下,學習、工作等競爭愈發激烈,焦慮、抑郁等不良情緒極易產生,情志不暢則肝氣郁結,木火刑金致肺氣郁閉,肺內濁氣停聚壅滯,為肺結節的發生提供條件。在病性證素方面,陰虛、痰病性證素排在前二。肺結節第一病性證素是陰虛。一方面可能是因為是陰虛體質的患者本身是肺結節易感體質[21],另一方面,煙草、霧霾等有毒氣體或環境污染易傷肺陰,導致肺陰虧虛,燥熱內生,煉津成痰成瘀。痰是肺結節次要病性證素。《醫林繩墨·積聚》云:“積者陰也……癥之所因,皆因痰之所起,氣之所結耳……積者,痰之積也”。痰屬陰,為有形之邪,在肺結節形成過程中扮演了重要角色。或因肺失宣肅通調水道失司,或因脾虛無法散津液,或因腎虛無法溫化水液皆可致水液停聚為痰,日久成積。肺、肝為主要病位證素,陰虛、痰為重要病性證素,本研究中的的中醫證素分布結果與目前中醫對肺結節病因病機的認知相符[7]。
3.2 唾液微生物對肺結節診療具有潛在價值
隨著測序技術的發展,唾液微生物作為體液標志物在鑒別肺癌與健康人、肺癌與肺部良性病變等方面的潛力已經被證實[22-23]。我們研究結果表明:與HC組相比,PN組唾液樣本中主要富集的菌屬有:普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)、放線菌屬(Actinomyces)、月形單胞菌屬(Selenomonas)、顆粒鏈球菌屬(Granulicatella)和TM7x。肺結節作為肺癌的早期表現,雖然目前尚缺乏口腔微生物對肺結節發病機制的作用研究,但口腔微生物與肺癌發生發展的關系已被廣泛報道。多項流行病學的證據表明,口腔微生態紊亂的人群患肺癌概率增加[24-25]。普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)、放線菌屬(Actinomyces)、月形單胞菌屬(Selenomonas)、顆粒鏈球菌屬(Granulicatella)、等口腔致病菌可通過吸入、血行轉移入肺內,影響微環境穩態,引起細胞增殖凋亡,免疫炎性反應,促進肺癌細胞侵襲轉移[26-30]。現代研究證實卟啉單胞菌屬(Porphyromonas)中的牙齦卟啉單胞菌(Porphyromonas gingivalis)與包括肺癌在內的多種惡性腫瘤的發生發展相關[31]。一方面,牙齦卟啉單胞菌(Porphyromonas gingivalis)可通過增加促炎因子表達,促進有利于癌癥形成與發展的炎癥環境[32];另一方面,牙齦卟啉單胞菌(Porphyromonas gingivalis)還具有免疫抑制能力,驅動巨噬細胞極化為促腫瘤M2腫瘤相關巨噬細胞(TAM)表型[33],同時能調節p53功能,促進癌細胞的生存和增殖[34-35]。據此推斷牙齦卟啉單胞菌(Porphyromonas gingivalis)可能促進肺結節癌轉化。綜合文獻閱讀及研究成果可見,唾液菌群失調可能推動肺結節惡性演進,對特定菌群的動態監測或可作為未來肺結節和肺癌早期篩查及診斷的重要依據,同時也為利用靶向微生物制劑或微生物移植等手段進行肺結節防治提供了新的切入點。
3.3 肺結節患者中醫證素與唾液菌群特征具有相關性
既往研究證實微生物與慢性萎縮性胃炎、潰瘍性結腸炎、肝硬化等疾病的中醫證素緊密關聯[36-37],表明微生物可作為中醫證素客觀化指標的潛力。我們的相關性分析結果亦顯示肺結節患者證素分布與唾液菌群特征具有顯著相關性:在屬水平6個優勢菌屬中,普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)與病位-肺呈正相關,卟啉單胞菌屬(Porphyromonas)、顆粒鏈球菌屬(Granulicatella)與病性-陰虛呈正相關。李杲亦直言“肺主衛”,肺衛之氣,其與人體抵御病邪的能力有密切關系。中醫之“衛氣”與現代醫學中的免疫系統概念與與不謀而合,其實質可與免疫細胞來源、分布、功能一一對應[38]。大量研究表明,口腔微生物與免疫微環境密切相關。如Wen等[39]發現普雷沃氏菌屬(Prevotella)可能通過誘導腸道上皮細胞環狀核苷酸分泌來調節先天免疫系統及適應性免疫系統。Chopra[40]等發現牙齦卟啉單胞菌(Porphyromonas gingivalis)通過釋放大量黏附素調節中性粒細胞、巨噬細胞、樹突狀細胞、B細胞和T細胞(Th1/Th2/Th17)以調控宿主免疫反應。可見,普雷沃菌屬(Prevotella)、卟啉單胞菌屬(Porphyromonas)與病性-肺關聯,既直接參與肺部感染、肺癌等肺部疾病發生發展[41-42],又能夠影響與肺緊密關聯的免疫系統(衛氣)。
陰虛證在病理方面往往表現出炎癥因子增加,相關信號通路激活等特征[43],同時炎癥反應在臨床中通常可表現為發熱、紅、腫、熱痛等一派“火旺”之象,火易迫津外泄、消灼陰液,體內津液耗傷則陰虛。因此,炎癥屬中醫“陰虛”范疇。而口腔微生物與機體炎癥反應同樣有密切的關系。我們研究顯示,顆粒鏈球菌屬(Granulicatella)與病性-陰虛呈正相關。其不僅與口腔黏膜炎、牙周炎、類風濕性關節炎、潰瘍性結腸炎等炎性疾病潛在關聯[44-46],還是IL-1β、IL-6、IL-8、TNF-α等炎癥介質的有效誘導劑[47]。卟啉單胞菌屬(Porphyromonas)不僅與肺結節主要病位證素-肺存在關聯,還與主要病性證素-陰虛具有相關性,因此具有雙重關聯性的卟啉單胞菌屬(Porphyromonas)對于探討中醫證素與唾液菌群特征的相關性更具代表性。牙齦卟啉單胞菌(Porphyromonas gingivalis)與炎癥的發生發展緊密關聯[32]。其既能通過Toll樣受體4(TLR-4)識別自身細菌外膜LPS成分,刺激MyD 88依賴性和非依賴性途徑,釋放NF-κB,導致促炎細胞因子的產生,形成炎癥環境[48];又可通過Toll樣受體2(TLR-2)誘導人支氣管上皮細胞和咽上皮細胞中IL-6和IL-8 mRNA表達,促進促炎細胞因子的產生,誘導炎癥環境形成[49]。炎癥微環境在肺結節的發生發展中占據重要地位,50%的肺結節病理因素由炎癥引起[50]。由此可見,唾液微生物與肺結節中醫證素之間存在密切生物學關聯,口腔微生物的豐度變化或可作為肺結節患者證素的客觀量化指標。
本研究的局限性及研究展望總結如下:(1)樣本量有待進一步擴大:本研究作為研究團隊關于微生物與肺結節(microbiome with pulmonary nodule,MCEPN)系列研究的先導性成果,前期我們共收集了213例臨床樣本,樣本量有限。目前研究團隊正持續開展多中心、大樣本研究,同步進行追蹤隨訪,后續將從結節大小、密度、良惡性等多角度對肺結節的生物學特征進行刻畫。(2)微生物多樣性分析技術有限:基于16S rRNA高通量測序的生物信息學分析,雖能夠顯示肺結節疾病的微生物群落物種組成、物種豐度、富集菌屬,但并未細化到菌種水平、基因及蛋白質的功能,我們目前正在結合宏基因組、蛋白質組學、代謝組學等多組學技術,進一步研究“微生物-宿主”間的相互作用。(3)作用機制有待進一步闡明:本研究對唾液微生物與肺結節的發病機制的探索是初步和預測的,研究團隊正在基于類器官和基因編輯技術,積極探索并構建多基因聯合驅動的肺結節動物模型,開展基礎實驗深入解析肺結節疾病演進背后復雜的作用機制,進一步明確唾液微生物群影響肺結節疾病狀態的關鍵途徑,以期深入探索中醫藥通過靶向唾液菌群阻延肺結節惡性演進的確切效應,為肺結節及早期肺癌的診療提供新的切入點。
肺結節患者和健康人群在肺、肝、陰虛、痰、濕等證素的分布存在差異,在卟啉單胞菌屬(Porphyromonas)、普雷沃菌屬(Prevotella)等唾液菌群的物種豐度組成方面有所不同。其中,卟啉單胞菌屬(Porphyromonas)與病位-肺、病性-陰虛具有顯著雙重關聯性,其豐度變化或可作為陰虛型肺結節患者癥候改善的微觀指標。包括卟啉單胞菌屬(Porphyromonas)在內的唾液微生物組具有作為監測肺結節患者疾病狀態變化的無創性生物標志物的潛力,亦可成為肺結節中醫證素客觀化的量化指標。
利益沖突:無。
作者貢獻:向紅霞和何佳瑋負責數據分析,論文設計和初稿撰寫及修改;譚施言、付西負責數據采集,統計分析;由鳳鳴負責論文設計和審閱、對編輯部的意見進行核修;由麗婷、石薇負責數據整理和分析;任益鋒和馬瓊負責研究方案制定及指導,文章的知識性內容審閱與修改、對編輯部的意見進行核修。