版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
主動脈瓣疾病是一種常見的心血管疾病,主要包括主動脈瓣狹窄和關閉不全。相較于正常情況,病變的主動脈瓣膜會導致一系列血流動力學問題,引發相應臨床癥狀[1]。主動脈瓣狹窄(aortic valve stenosis,AS)由各種原因導致主動脈瓣開口變窄,限制血液從左心室流向主動脈[2],易誘發心力衰竭和猝死[3],是最常見的瓣膜性心臟病[4],亦是發達國家中瓣膜置換術最常見的原因[5]。AS在老年人群中更為常見,隨著人口老齡化和各類心血管病因的增加,AS已成為心血管疾病發病率和死亡率的主要原因[6],給世界醫療衛生系統帶來沉重負擔[7]。目前為止,暫無改善疾病的藥物療法[8],外科主動脈瓣置換術(surgical aortic valve replacement,SAVR)依舊是治療這類疾病的主要方法,且具有較高的成功率和長期生存率。隨著醫療技術的發展,新的替代技術,如經導管主動脈瓣置入術(transcatheter aortic valve implantation,TAVI),逐漸成為許多患者,尤其是高風險和不能耐受外科手術患者的選擇。相較于傳統SAVR,TAVI侵入性更小,可顯著縮短住院時間[9]。隨著相關研究的不斷深入,TAVI裝置的性能和瓣膜耐用性得到認可,TAVI已成為嚴重主動脈瓣狹窄患者手術置換瓣膜的有效替代方案[10]。
無縫合瓣膜植入的概念最早于20世紀60年代被提出[11]。近年來,無縫合主動脈瓣置換術(sutureless aortic valve replacement,SU-AVR)作為SAVR的新一種改良技術,吸引了廣泛關注。SU-AVR的主要特點是采用無縫合技術固定生物瓣膜,通常使用彈性金屬支架或聚合物材料,使瓣膜可快速、精確地定位和固定在主動脈瓣環處,手術時免除了瓣環和瓣膜的縫合[12],具備縮短手術時間和體外循環時間的優勢[13],同時可能降低手術并發癥,縮短術后恢復時間。SU-AVR在微創手術中顯示出顯著優勢[14],包括小切口和微創胸腔鏡手術,這些技術的結合使患者術后恢復更快,住院時間更短。此外,SU-AVR在技術上也能夠更好地適應復雜解剖結構患者,尤其是那些由于鈣化或解剖變異而難以進行傳統手術的患者。這些優勢使SU-AVR成為中高風險患者以及無法耐受傳統開胸手術患者的重要治療選擇。這為傳統SAVR帶來了新的挑戰和機遇,也為臨床醫生在治療主動脈瓣疾病時提供了更多選擇。
為了全面評估SU-AVR和TAVI在臨床應用中的安全性和有效性,本研究進行了傾向評分匹配研究的系統評價和Meta分析。傾向評分匹配法通過調整混雜因素,能夠在最大程度上平衡兩組間的基線特征差異,從而提供更為可靠的比較結果。本文將基于此比較SU-AVR和TAVI在短期和長期臨床結局中的差異,包括圍手術期并發癥、心血管事件發生率、瓣膜功能和患者生存率等,明確兩種手術方式的優勢和局限,旨在為臨床決策提供基于證據的參考,幫助臨床醫生選擇最佳的治療方案,提升患者預后。并通過這些分析,促進心臟外科和介入心臟病學領域的發展。
1 資料與方法
1.1 納入標準
1.1.1 研究類型
采用傾向性評分匹配研究設計,提供SU-AVR和TAVI數據的觀察性研究。
1.1.2 研究對象
患者被診斷為具有明確適應證的主動脈瓣疾病【請補充診斷標】,包括但不限于主動脈瓣狹窄和主動脈瓣關閉不全。
1.1.3 干預措施
干預組為接受SU-AVR患者,對照組為TAVI的患者。
1.1.4 結局指標
主要結局指標為不同隨訪時期內的死亡率。次要結局指標包括圍手術期并發癥(如卒中、心臟并發癥、腎功能衰竭等)、術后短期和長期心血管事件發生率、瓣膜功能(如跨瓣壓差、反流等)、術后住ICU時間、住院時間等。
1.1.5 數據資料
具備完整的患者基線數據和結局指標數據,確保數據的完整性和可比性
1.2 排除標準
1.2.1 重復研究
對于重復發表的文獻,納入最完整、最新或數據最詳細的一篇。
1.2.2 設計缺陷
不包括會議摘要、會議記錄、綜述、Meta分析、勘誤、信件、病案報道等研究,缺乏對比組或對比組不適當的研究。
1.2.3 數據不全
排除無法獲取原始數據或關鍵結局指標數據不全的研究。
1.2.4 其他
排除語言為非英文且無法獲取翻譯的研究,排除發表日期過早且技術和手術方式與當前臨床實踐有顯著差異的研究。
1.3 檢索策略
在以下數據庫中進行系統檢索,時間跨度為數據庫建立至2024年3月。中文數據庫包括:中國知網(CNKI)、中國生物醫學文獻數據庫(SinoMed)、萬方數據庫(Wanfang data)、維普數據庫(VIP)。英文數據庫包括:PubMed、Cochrane Library、Web of Science、Embase數據庫。檢索詞包括檢索詞包括但不限于:“Sutureless Aortic Valve Replacement”、“Transcatheter Aortic Valve Implantation”、“Aortic Valve Disease”、“Propensity Score Matching”、“Systematic Review”、“Meta-Analysis”。手工檢索相關文獻的參考文獻列表,以確保盡可能全面地納入相關研究。
1.4 文獻篩選與資料提取
由兩名研究者獨立進行文獻篩選和資料提取。提取的主要內容包括:(1)研究的基本信息,如題目、第一作者、研究類型和來源等;(2)研究對象的基線資料,包括總樣本量、年齡、性別等;(3)偏倚風險評價所需的關鍵要素;(4)觀察到的結局指標及相關數據。數據提取完成后,兩位研究者進行交叉核對。如有分歧,通過討論解決或由第三方裁定。
1.5 納入研究的偏倚風險評價
2名研究者均采用紐卡斯爾-渥太華量表(The Newcastle-Ottawa Scale,NOS)對納入的文獻進行質量評價[15-16],NOS量表共分為8項條目,除可比性一項為2分外,其余各1分,共計9分。本研究認為NOS評分≥7分為高質量研究。
1.6 統計學分析
分類變量使用頻數和頻率描述,符合正態分布連續變量以均數±標準差(x±s)描述。二分類結局變量的合并結果通過Mantel-Haenszel方法,用相對危險度(RR)及95%可信區間(CI)估計。連續變量的合并數據采用逆方差法評估,用標準化均值差(standardized mean difference,SMD)和95% CI表示。
本研究采用Stata18.0軟件進行統計分析。首先以Q統計量和I2統計量對納入的研究進行異質性檢驗,納入文獻較少時檢驗水準α=0.1,若P>0.1且I2≤50%則表明研究間異質性較小,可用固定效應模型進行Meta分析;若P≤0.1或I2≥50%則表明納入研究間異質性明顯,需采用隨機效應模型進行Meta分析,計算合并后效應量及其95%CI。通過敏感性分析逐一排除研究,評估異質性結果的穩健性和潛在影響。使用漏斗圖直觀評估發表偏倚,采用Egger’s檢驗定量分析。P≤0.05為差異有統計學意義。
2 結果
2.1 文獻篩選及結果
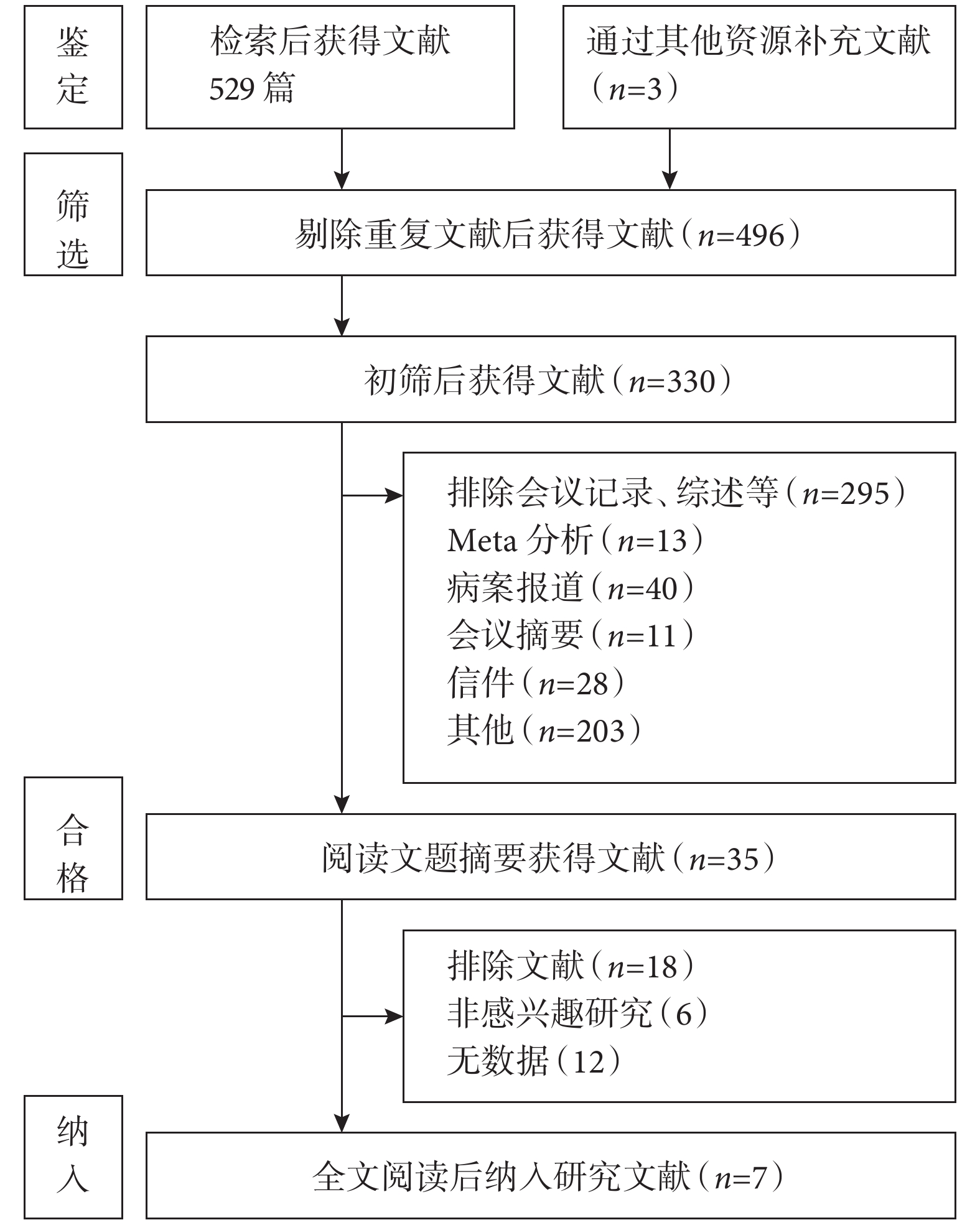
初步檢索文獻共計529篇,通過其他資源補充文獻3篇。所有文獻導入Endnote X9軟件后進行管理。排除重復文獻及綜述等獲得330篇文獻,閱讀題目及摘要,排除非感興趣以及無數據研究后獲得35篇文獻,進一步通過閱讀全文,最終納入17項研究[17-33],文獻篩選流程圖見圖1。基于logistic Euro SCORE [SMD=?0.297,95%CI(?0.661,0.066),P=0.109]、logistic Euro SCOREⅡ [SMD=?0.054,95%CI(?0.164,0.057),P=0.339] 和Society of Thoracic Surgeons score(STS score)[SMD=?0.227,95%CI(?0.921,0.468),P=0.522]的手術風險對比差異均無統計學意義。這為本研究對比兩種手術差異奠定了基礎。
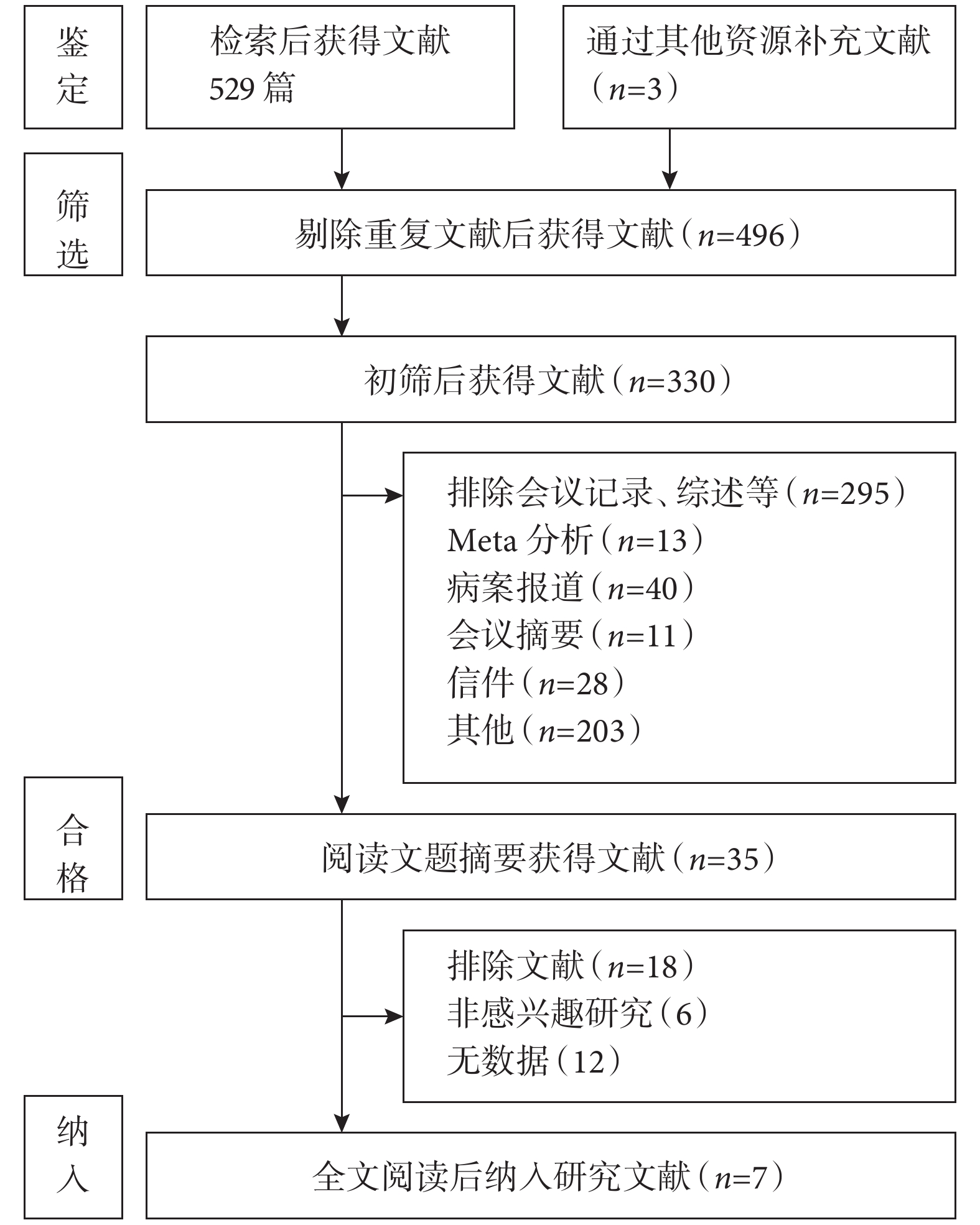 圖1
文獻檢索流程圖
圖1
文獻檢索流程圖
PubMed(
2.2 納入文獻基本特征及質量評價
本研究共納入17篇研究,發表時間為2012年—2023年。納入患者的基線資料及偏倚風險得分見表1。
2.3 Meta分析結果
2.3.1 主要結局指標
2.3.2 次要結局指標
新的永久起搏器植入[RR=0.75,95%CI(0.58,0.98),P=0.037] (附件圖1a);中至重度瓣周漏[RR=0.20,95%CI(0.12,0.32),P=0.000] (附件圖1b);心肌梗死[RR=0.30,95%CI(0.11,0.80),P=0.017](附件圖1c);輕度以上殘余主動脈瓣反流[RR=0.29,95%CI(0.17,0.48),P=0.000](附件圖1d)等合并結果顯示SU-AVR組風險比均低于TAVI組,差異有統計學意義。
兩組卒中[RR=1.23,95%CI(0.88,1.70),P=0.223](附件圖2a)和新的腎臟替代治療(new renal replacement therapy)[RR=1.12,95%CI(0.41,3.04),P=0.823](附件圖2b)差異無統計學意義。而SU-AVR組重大或危及生命的出血事件[RR=3.26,95%CI(1.48,7.20),P=0.003](附件圖2c)和新發心房顫動[RR=3.09,95%CI(1.61,5.95),P=0.001](附件圖2d)發生率均高于TAVI組,差異有統計學意義。
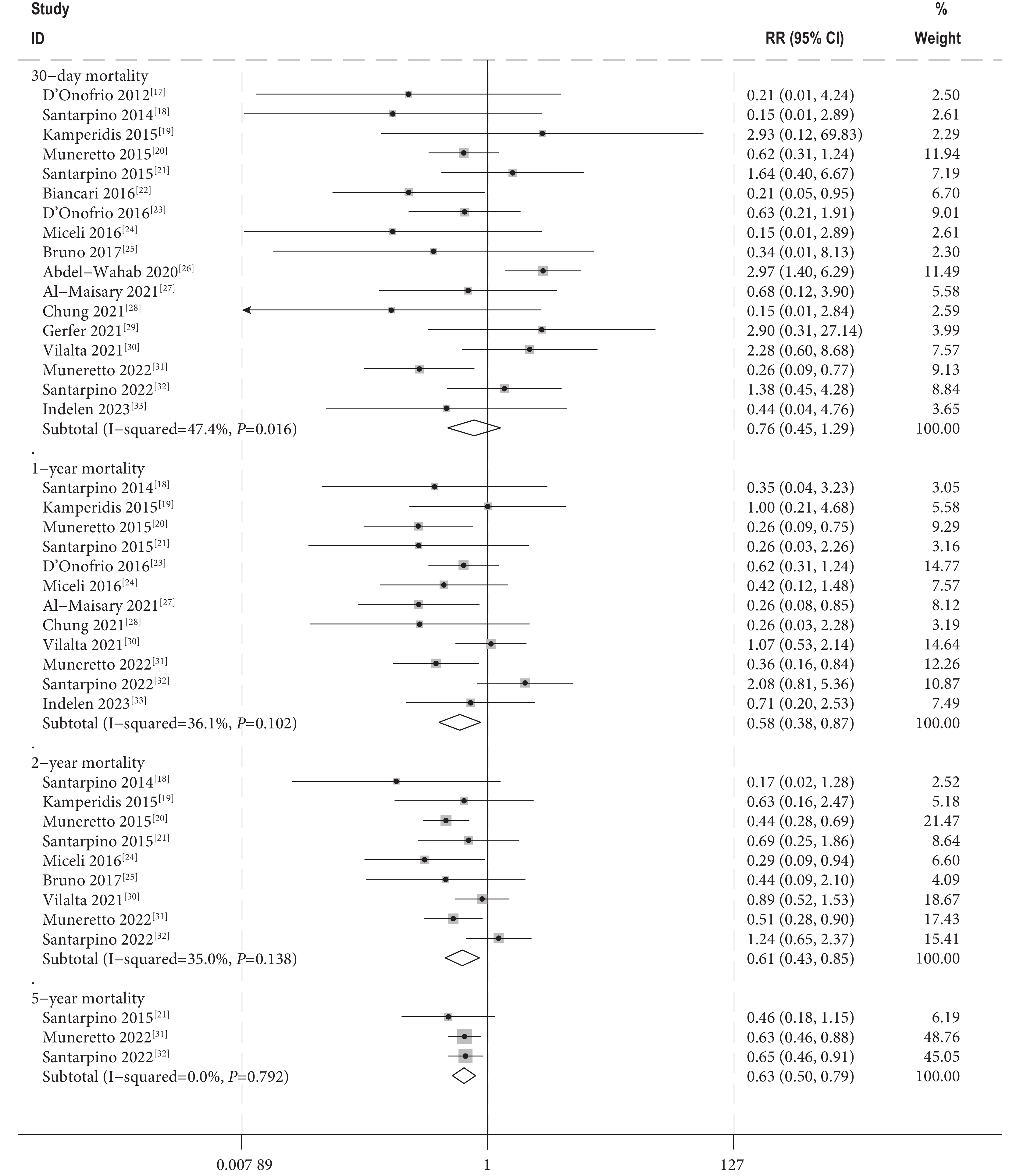
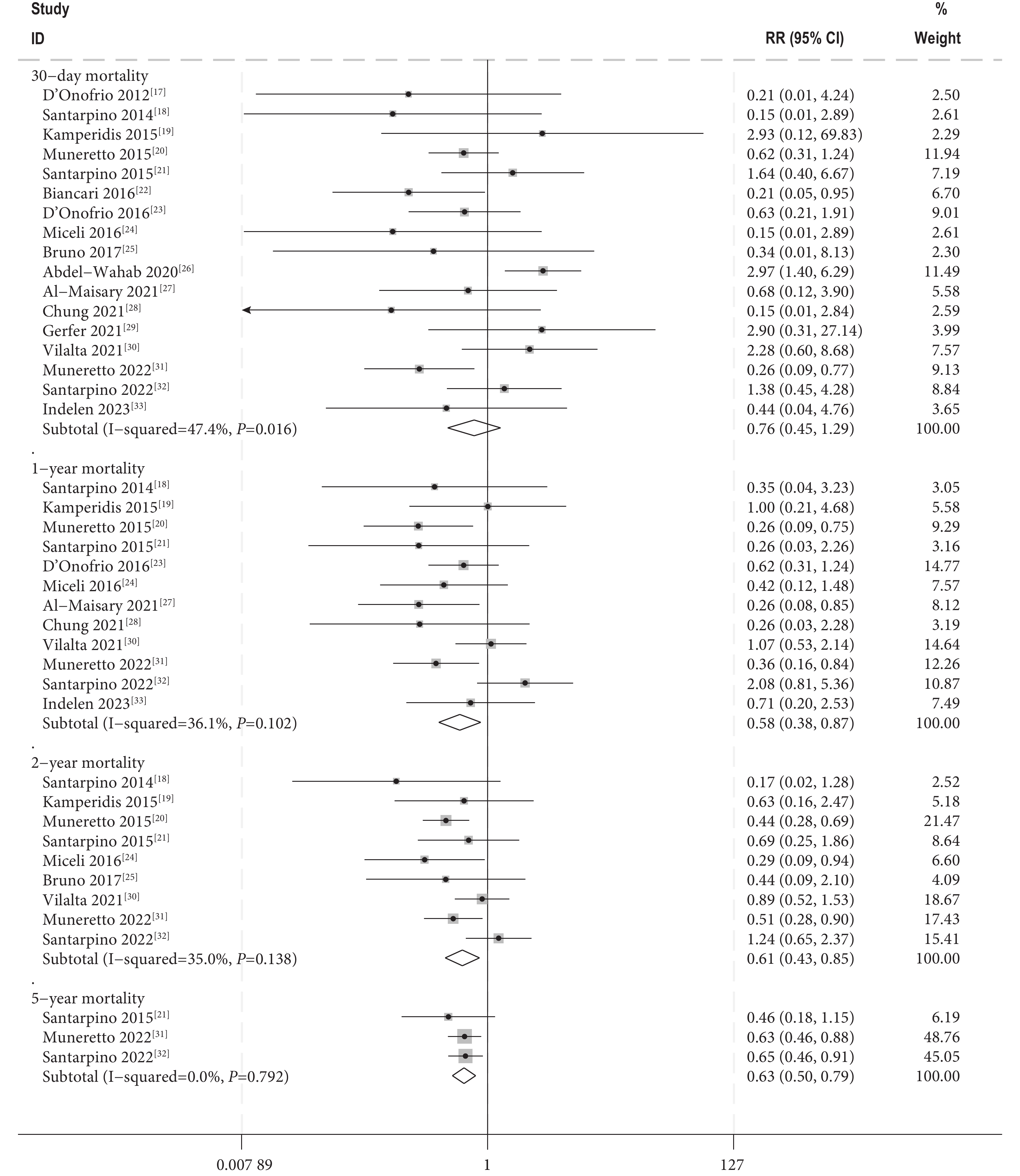 圖2
不同隨訪時期死亡率的Meta分析結果
圖2
不同隨訪時期死亡率的Meta分析結果
Meta分析結果顯示,兩組30 d死亡率[RR=0.76,95%CI(0.45,1.29),
術前平均主動脈壓差[SMD=0.01,95%CI(?0.07,0.10),P=0.792](附件圖3a)在SU-AVR和TAVI組中差異無統計學意義。SU-AVR組術后平均主動脈壓差[SMD=0.39,95%CI(0.17,0.62),P=0.000](附件圖3b)高于TAVI組,差異有統計學意義。而兩組術后ICU住院時間[SMD=0.25,95%CI(?0.10,0.59),P=0.158](附件圖4a)和住院時間[SMD=0.71,95%CI(?0.14,1.56),P=0.102](附件圖4b)差異無統計學意義。
2.4 敏感性分析
逐一剔除所納入研究后,結果并無實質性改變。說明本Meta分析結果相對穩健。
2.5 發表偏倚
本研究中漏斗圖提示均無明顯不對稱。Egger’s檢驗定量分析顯示30 d死亡率(P=0.204)、1年死亡率(P=0.234)、新的永久起搏器植入(P=0.436)、中至重度瓣周漏(P=0.435)、卒中(P=0.326)、新的腎臟替代治療(P=0.631)、重大或危及生命的出血事件(P=0.756)、術后平均主動脈壓差(P=0.287)均無明顯發表偏倚。以30 d死亡率為例繪制的漏斗圖(附件圖5)。
3 討論
本研究發現,SU-AVR組與TAVI組的30 d死亡率差異無統計學意義。然而,在1年、2年和5年死亡率方面,SU-AVR組明顯低于TAVI組,差異具有統計學意義。這表明,SU-AVR在長期預后上可能具有一定的優勢。SU-AVR組在新的永久起搏器植入、中至重度瓣周漏、心肌梗死和輕度以上的殘余主動脈瓣反流方面的風險顯著低于TAVI組。這些結果顯示,SU-AVR在減少這些特定并發癥方面表現更好。在卒中和新的腎臟替代治療的風險方面,兩組差異無統計學意義。這表明,兩種手術在這些特定風險方面具有相似的安全性。SU-AVR組的重大或危及生命的出血事件和新發房顫發生率顯著高于TAVI組。這提示,盡管SU-AVR在某些并發癥方面表現較好,但在出血和心律失常的風險管理上仍需謹慎。兩組在術前平均主動脈壓差方面無顯著差異,但SU-AVR組的術后平均主動脈壓差高于TAVI組。理論上來說,無縫合主動脈瓣可最大化有效口面積,提供更好的血流動力學,改善術后壓差[34],本研究得出的結論可能與納入研究的SU-AVR技術特性和操作過程有關。
隨著技術的不斷迭代更新,SU-AVR不僅成為了傳統胸骨正中開胸手術的有效替代方案,也促進了微創手術瓣膜置換,例如上半胸骨切開術或右側開胸手術的發展[35]。基于免縫合特性,SU-AVR在一些二次手術瓣膜再置換的患者中也得到了應用[36]。無縫合主動脈瓣另一個主要優勢是其人工組織量小,因而具有較低感染風險,甚至可超適應癥應用于感染性心內膜炎患者手術[37]。
盡管無縫合瓣膜的應用逐漸增多[38],但依舊缺乏足夠的臨床研究證實其安全性和有效應,現存大多研究多為觀察性研究,鮮有隨機對照試驗提供證據[39],這也是本研究意義所在。
本研究結果為臨床醫生在選擇SU-AVR和TAVI治療方案時提供了重要的參考依據。SU-AVR在長期生存率和某些并發癥的減少方面表現出色,特別適合那些能夠承受微創手術但不適合傳統開胸手術的患者。然而,SU-AVR也存在出血和新發房顫的較高風險,需在術前評估時特別注意。
本研局限性:盡管本研究采用了嚴格的納排標準,只納入了傾向評分匹配研究,但仍可能存在未測量的混雜因素影響結果。納入的研究數量和樣本量有限,可能影響結果的普遍性和穩健性。不同研究的隨訪時間存在差異,可能對長期結局的比較產生影響。未來的研究應進一步擴大樣本量,延長隨訪時間,以驗證本研究的結論。此外,還需探索SU-AVR和TAVI在不同患者亞組中的效果差異,制定更加個性化的治療策略。
綜上所述,與TAVI相比,SU-AVR組在死亡率、新的永久起搏器植入、中至重度瓣周漏、心肌梗死和輕度以上的殘余主動脈瓣反流等早中期結果均較好,SU-AVR的早中期臨床結局均可接受。
利益沖突:無。
作者貢獻:陳陽負責選題和論文撰寫;衛治理,白淇元,黎旭華負責文獻檢索和篩選和數據提取;何玉園,胡源負責研究設計和統計分析;宋兵,劉世棟負責論文審閱與修改。
主動脈瓣疾病是一種常見的心血管疾病,主要包括主動脈瓣狹窄和關閉不全。相較于正常情況,病變的主動脈瓣膜會導致一系列血流動力學問題,引發相應臨床癥狀[1]。主動脈瓣狹窄(aortic valve stenosis,AS)由各種原因導致主動脈瓣開口變窄,限制血液從左心室流向主動脈[2],易誘發心力衰竭和猝死[3],是最常見的瓣膜性心臟病[4],亦是發達國家中瓣膜置換術最常見的原因[5]。AS在老年人群中更為常見,隨著人口老齡化和各類心血管病因的增加,AS已成為心血管疾病發病率和死亡率的主要原因[6],給世界醫療衛生系統帶來沉重負擔[7]。目前為止,暫無改善疾病的藥物療法[8],外科主動脈瓣置換術(surgical aortic valve replacement,SAVR)依舊是治療這類疾病的主要方法,且具有較高的成功率和長期生存率。隨著醫療技術的發展,新的替代技術,如經導管主動脈瓣置入術(transcatheter aortic valve implantation,TAVI),逐漸成為許多患者,尤其是高風險和不能耐受外科手術患者的選擇。相較于傳統SAVR,TAVI侵入性更小,可顯著縮短住院時間[9]。隨著相關研究的不斷深入,TAVI裝置的性能和瓣膜耐用性得到認可,TAVI已成為嚴重主動脈瓣狹窄患者手術置換瓣膜的有效替代方案[10]。
無縫合瓣膜植入的概念最早于20世紀60年代被提出[11]。近年來,無縫合主動脈瓣置換術(sutureless aortic valve replacement,SU-AVR)作為SAVR的新一種改良技術,吸引了廣泛關注。SU-AVR的主要特點是采用無縫合技術固定生物瓣膜,通常使用彈性金屬支架或聚合物材料,使瓣膜可快速、精確地定位和固定在主動脈瓣環處,手術時免除了瓣環和瓣膜的縫合[12],具備縮短手術時間和體外循環時間的優勢[13],同時可能降低手術并發癥,縮短術后恢復時間。SU-AVR在微創手術中顯示出顯著優勢[14],包括小切口和微創胸腔鏡手術,這些技術的結合使患者術后恢復更快,住院時間更短。此外,SU-AVR在技術上也能夠更好地適應復雜解剖結構患者,尤其是那些由于鈣化或解剖變異而難以進行傳統手術的患者。這些優勢使SU-AVR成為中高風險患者以及無法耐受傳統開胸手術患者的重要治療選擇。這為傳統SAVR帶來了新的挑戰和機遇,也為臨床醫生在治療主動脈瓣疾病時提供了更多選擇。
為了全面評估SU-AVR和TAVI在臨床應用中的安全性和有效性,本研究進行了傾向評分匹配研究的系統評價和Meta分析。傾向評分匹配法通過調整混雜因素,能夠在最大程度上平衡兩組間的基線特征差異,從而提供更為可靠的比較結果。本文將基于此比較SU-AVR和TAVI在短期和長期臨床結局中的差異,包括圍手術期并發癥、心血管事件發生率、瓣膜功能和患者生存率等,明確兩種手術方式的優勢和局限,旨在為臨床決策提供基于證據的參考,幫助臨床醫生選擇最佳的治療方案,提升患者預后。并通過這些分析,促進心臟外科和介入心臟病學領域的發展。
1 資料與方法
1.1 納入標準
1.1.1 研究類型
采用傾向性評分匹配研究設計,提供SU-AVR和TAVI數據的觀察性研究。
1.1.2 研究對象
患者被診斷為具有明確適應證的主動脈瓣疾病【請補充診斷標】,包括但不限于主動脈瓣狹窄和主動脈瓣關閉不全。
1.1.3 干預措施
干預組為接受SU-AVR患者,對照組為TAVI的患者。
1.1.4 結局指標
主要結局指標為不同隨訪時期內的死亡率。次要結局指標包括圍手術期并發癥(如卒中、心臟并發癥、腎功能衰竭等)、術后短期和長期心血管事件發生率、瓣膜功能(如跨瓣壓差、反流等)、術后住ICU時間、住院時間等。
1.1.5 數據資料
具備完整的患者基線數據和結局指標數據,確保數據的完整性和可比性
1.2 排除標準
1.2.1 重復研究
對于重復發表的文獻,納入最完整、最新或數據最詳細的一篇。
1.2.2 設計缺陷
不包括會議摘要、會議記錄、綜述、Meta分析、勘誤、信件、病案報道等研究,缺乏對比組或對比組不適當的研究。
1.2.3 數據不全
排除無法獲取原始數據或關鍵結局指標數據不全的研究。
1.2.4 其他
排除語言為非英文且無法獲取翻譯的研究,排除發表日期過早且技術和手術方式與當前臨床實踐有顯著差異的研究。
1.3 檢索策略
在以下數據庫中進行系統檢索,時間跨度為數據庫建立至2024年3月。中文數據庫包括:中國知網(CNKI)、中國生物醫學文獻數據庫(SinoMed)、萬方數據庫(Wanfang data)、維普數據庫(VIP)。英文數據庫包括:PubMed、Cochrane Library、Web of Science、Embase數據庫。檢索詞包括檢索詞包括但不限于:“Sutureless Aortic Valve Replacement”、“Transcatheter Aortic Valve Implantation”、“Aortic Valve Disease”、“Propensity Score Matching”、“Systematic Review”、“Meta-Analysis”。手工檢索相關文獻的參考文獻列表,以確保盡可能全面地納入相關研究。
1.4 文獻篩選與資料提取
由兩名研究者獨立進行文獻篩選和資料提取。提取的主要內容包括:(1)研究的基本信息,如題目、第一作者、研究類型和來源等;(2)研究對象的基線資料,包括總樣本量、年齡、性別等;(3)偏倚風險評價所需的關鍵要素;(4)觀察到的結局指標及相關數據。數據提取完成后,兩位研究者進行交叉核對。如有分歧,通過討論解決或由第三方裁定。
1.5 納入研究的偏倚風險評價
2名研究者均采用紐卡斯爾-渥太華量表(The Newcastle-Ottawa Scale,NOS)對納入的文獻進行質量評價[15-16],NOS量表共分為8項條目,除可比性一項為2分外,其余各1分,共計9分。本研究認為NOS評分≥7分為高質量研究。
1.6 統計學分析
分類變量使用頻數和頻率描述,符合正態分布連續變量以均數±標準差(x±s)描述。二分類結局變量的合并結果通過Mantel-Haenszel方法,用相對危險度(RR)及95%可信區間(CI)估計。連續變量的合并數據采用逆方差法評估,用標準化均值差(standardized mean difference,SMD)和95% CI表示。
本研究采用Stata18.0軟件進行統計分析。首先以Q統計量和I2統計量對納入的研究進行異質性檢驗,納入文獻較少時檢驗水準α=0.1,若P>0.1且I2≤50%則表明研究間異質性較小,可用固定效應模型進行Meta分析;若P≤0.1或I2≥50%則表明納入研究間異質性明顯,需采用隨機效應模型進行Meta分析,計算合并后效應量及其95%CI。通過敏感性分析逐一排除研究,評估異質性結果的穩健性和潛在影響。使用漏斗圖直觀評估發表偏倚,采用Egger’s檢驗定量分析。P≤0.05為差異有統計學意義。
2 結果
2.1 文獻篩選及結果
初步檢索文獻共計529篇,通過其他資源補充文獻3篇。所有文獻導入Endnote X9軟件后進行管理。排除重復文獻及綜述等獲得330篇文獻,閱讀題目及摘要,排除非感興趣以及無數據研究后獲得35篇文獻,進一步通過閱讀全文,最終納入17項研究[17-33],文獻篩選流程圖見圖1。基于logistic Euro SCORE [SMD=?0.297,95%CI(?0.661,0.066),P=0.109]、logistic Euro SCOREⅡ [SMD=?0.054,95%CI(?0.164,0.057),P=0.339] 和Society of Thoracic Surgeons score(STS score)[SMD=?0.227,95%CI(?0.921,0.468),P=0.522]的手術風險對比差異均無統計學意義。這為本研究對比兩種手術差異奠定了基礎。
 圖1
文獻檢索流程圖
圖1
文獻檢索流程圖
PubMed(
2.2 納入文獻基本特征及質量評價
本研究共納入17篇研究,發表時間為2012年—2023年。納入患者的基線資料及偏倚風險得分見表1。
2.3 Meta分析結果
2.3.1 主要結局指標
2.3.2 次要結局指標
新的永久起搏器植入[RR=0.75,95%CI(0.58,0.98),P=0.037] (附件圖1a);中至重度瓣周漏[RR=0.20,95%CI(0.12,0.32),P=0.000] (附件圖1b);心肌梗死[RR=0.30,95%CI(0.11,0.80),P=0.017](附件圖1c);輕度以上殘余主動脈瓣反流[RR=0.29,95%CI(0.17,0.48),P=0.000](附件圖1d)等合并結果顯示SU-AVR組風險比均低于TAVI組,差異有統計學意義。
兩組卒中[RR=1.23,95%CI(0.88,1.70),P=0.223](附件圖2a)和新的腎臟替代治療(new renal replacement therapy)[RR=1.12,95%CI(0.41,3.04),P=0.823](附件圖2b)差異無統計學意義。而SU-AVR組重大或危及生命的出血事件[RR=3.26,95%CI(1.48,7.20),P=0.003](附件圖2c)和新發心房顫動[RR=3.09,95%CI(1.61,5.95),P=0.001](附件圖2d)發生率均高于TAVI組,差異有統計學意義。
 圖2
不同隨訪時期死亡率的Meta分析結果
圖2
不同隨訪時期死亡率的Meta分析結果
Meta分析結果顯示,兩組30 d死亡率[RR=0.76,95%CI(0.45,1.29),
術前平均主動脈壓差[SMD=0.01,95%CI(?0.07,0.10),P=0.792](附件圖3a)在SU-AVR和TAVI組中差異無統計學意義。SU-AVR組術后平均主動脈壓差[SMD=0.39,95%CI(0.17,0.62),P=0.000](附件圖3b)高于TAVI組,差異有統計學意義。而兩組術后ICU住院時間[SMD=0.25,95%CI(?0.10,0.59),P=0.158](附件圖4a)和住院時間[SMD=0.71,95%CI(?0.14,1.56),P=0.102](附件圖4b)差異無統計學意義。
2.4 敏感性分析
逐一剔除所納入研究后,結果并無實質性改變。說明本Meta分析結果相對穩健。
2.5 發表偏倚
本研究中漏斗圖提示均無明顯不對稱。Egger’s檢驗定量分析顯示30 d死亡率(P=0.204)、1年死亡率(P=0.234)、新的永久起搏器植入(P=0.436)、中至重度瓣周漏(P=0.435)、卒中(P=0.326)、新的腎臟替代治療(P=0.631)、重大或危及生命的出血事件(P=0.756)、術后平均主動脈壓差(P=0.287)均無明顯發表偏倚。以30 d死亡率為例繪制的漏斗圖(附件圖5)。
3 討論
本研究發現,SU-AVR組與TAVI組的30 d死亡率差異無統計學意義。然而,在1年、2年和5年死亡率方面,SU-AVR組明顯低于TAVI組,差異具有統計學意義。這表明,SU-AVR在長期預后上可能具有一定的優勢。SU-AVR組在新的永久起搏器植入、中至重度瓣周漏、心肌梗死和輕度以上的殘余主動脈瓣反流方面的風險顯著低于TAVI組。這些結果顯示,SU-AVR在減少這些特定并發癥方面表現更好。在卒中和新的腎臟替代治療的風險方面,兩組差異無統計學意義。這表明,兩種手術在這些特定風險方面具有相似的安全性。SU-AVR組的重大或危及生命的出血事件和新發房顫發生率顯著高于TAVI組。這提示,盡管SU-AVR在某些并發癥方面表現較好,但在出血和心律失常的風險管理上仍需謹慎。兩組在術前平均主動脈壓差方面無顯著差異,但SU-AVR組的術后平均主動脈壓差高于TAVI組。理論上來說,無縫合主動脈瓣可最大化有效口面積,提供更好的血流動力學,改善術后壓差[34],本研究得出的結論可能與納入研究的SU-AVR技術特性和操作過程有關。
隨著技術的不斷迭代更新,SU-AVR不僅成為了傳統胸骨正中開胸手術的有效替代方案,也促進了微創手術瓣膜置換,例如上半胸骨切開術或右側開胸手術的發展[35]。基于免縫合特性,SU-AVR在一些二次手術瓣膜再置換的患者中也得到了應用[36]。無縫合主動脈瓣另一個主要優勢是其人工組織量小,因而具有較低感染風險,甚至可超適應癥應用于感染性心內膜炎患者手術[37]。
盡管無縫合瓣膜的應用逐漸增多[38],但依舊缺乏足夠的臨床研究證實其安全性和有效應,現存大多研究多為觀察性研究,鮮有隨機對照試驗提供證據[39],這也是本研究意義所在。
本研究結果為臨床醫生在選擇SU-AVR和TAVI治療方案時提供了重要的參考依據。SU-AVR在長期生存率和某些并發癥的減少方面表現出色,特別適合那些能夠承受微創手術但不適合傳統開胸手術的患者。然而,SU-AVR也存在出血和新發房顫的較高風險,需在術前評估時特別注意。
本研局限性:盡管本研究采用了嚴格的納排標準,只納入了傾向評分匹配研究,但仍可能存在未測量的混雜因素影響結果。納入的研究數量和樣本量有限,可能影響結果的普遍性和穩健性。不同研究的隨訪時間存在差異,可能對長期結局的比較產生影響。未來的研究應進一步擴大樣本量,延長隨訪時間,以驗證本研究的結論。此外,還需探索SU-AVR和TAVI在不同患者亞組中的效果差異,制定更加個性化的治療策略。
綜上所述,與TAVI相比,SU-AVR組在死亡率、新的永久起搏器植入、中至重度瓣周漏、心肌梗死和輕度以上的殘余主動脈瓣反流等早中期結果均較好,SU-AVR的早中期臨床結局均可接受。
利益沖突:無。
作者貢獻:陳陽負責選題和論文撰寫;衛治理,白淇元,黎旭華負責文獻檢索和篩選和數據提取;何玉園,胡源負責研究設計和統計分析;宋兵,劉世棟負責論文審閱與修改。