版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
心力衰竭(heart failure,HF)是一種以心臟結構和/或功能損害引發的臨床綜合征,表現為呼吸困難、疲勞、體液潴留,是全球最常見的心血管疾病之一[1]。其病理機制復雜,涉及心肌細胞凋亡、纖維化、能量代謝障礙及免疫炎癥反應[2]。盡管治療有所進展,全球仍有超過
免疫細胞在妊娠期間即駐留于心肌,并持續至成年期,對心臟的構成、發育和功能具有至關重要的作用[4]。免疫細胞在HF中扮演重要角色,不僅調節心臟局部免疫微環境,還通過系統性炎癥反應加劇心臟結構和功能異常[5]。大量單核細胞、巨噬細胞、淋巴細胞和自然殺傷細胞浸潤,通過釋放細胞因子和趨化因子參與炎癥反應和纖維化過程[6]。例如,單核細胞分泌腫瘤壞死因子、白介素-1,參與心肌細胞凋亡、纖維化以及心肌重塑過程[7]。此外,淋巴細胞的慢性激活也與HF密切相關。有研究[8]表明,淋巴細胞減少癥顯著提高死亡率。
血清代謝物是機體代謝狀態的直接反映,其功能異常與HF的發生和進展相關[9]。研究[10]表明,代謝紊亂如脂毒性導致心肌細胞毒性中間體積累,誘發心功能障礙。HF患者的血清代謝物譜中支鏈氨基酸、磷脂[11]等顯著異常,這些代謝物不僅是疾病標志,還可能通過影響免疫細胞活性進一步加劇病情[12]。
然而,目前關于免疫細胞、血清代謝物與HF三者關系的研究仍顯不足,尤其是代謝物在其中可能發揮的中介作用。孟德爾隨機化(Mendelian randomization,MR)是一種利用遺傳變異作為工具變量探究變量與疾病之間因果關系的方法[14],可有效避免混雜因素和反向因果關系的影響。本研究旨在運用MR方法探討免疫細胞、血清代謝物與HF之間的相關性,揭示免疫細胞如何通過特定血清代謝物影響HF的發病和進展,為HF的預防和治療提供新的理論基礎和干預靶點。
1 資料與方法
1.1 研究設計
本研究通過兩樣本 MR 分析,評估731種免疫細胞作為暴露因素與 HF作為結局之間的因果關系,同時探討
具體步驟如下:① 分析731種免疫細胞作為暴露因素與HF作為結局變量之間的單向因果關系,選出與HF因果關系最穩定的免疫細胞;同時,確保當 HF作為暴露因素,選出的免疫細胞作為結局變量時,反向 MR分析無因果關系。② 將選出的免疫細胞作為暴露因素,
1.2 數據來源
1.2.1 免疫細胞數據來源
GWAS目錄提供了731種免疫細胞性狀的匯總統計信息(注冊號 GCST90001391-GCST90002121)[16]。該研究數據來源于
1.2.2 血清代謝物數據來源
1.2.3 HF數據來源
HF數據來自FinnGen項目的歐洲GWAS R10版本,該項目是芬蘭的一個覆蓋全國人口的公私合作項目,旨在探索多種疾病的病因,促進人口健康[18]。該數據集包含
1.3 工具變量的選擇
根據先前類似的研究[19-21],為確保因果關系推測的完整性和準確性,本研究在篩選與731個免疫細胞及
1.4 統計學分析
數據分析采用 R 軟件(版本4.3.2)中的MR-PRESSO和Two Sample MR軟件包。逆方差加權法(inverse variance weighted,IVW)在因果推理中被認為足夠穩健,故選為估計因果效應的主要方法[26-27]。MR-Egger和加權中位數作為補充分析[28]。使用Cochrane’s Q檢驗評估異質性,MR-PRESSO和MR-Egger回歸檢測水平多效性[29]。采用“留一法”進行敏感性分析,通過依次排除每個SNP來評估估計值是否由任何單個SNP驅動。以比值比(odds ratio,OR)及其95%置信區間(confidence interval,CI)評估暴露與結局的效應關系(OR>1視為正相關,OR<1視為負相關)。
通過兩步法中介分析,計算選定的免疫細胞對HF的總效應(β_all)、選定的免疫細胞對確定的中介血清代謝物的影響(β1)、確定的中介血清代謝物對HF的影響(β2)、中介效應(β12)[30]、直接效應(β_dir)及中介效應比。其中,總效應即選定的免疫細胞對HF的整體影響,該影響可以分解為選定的免疫細胞對HF的直接影響和確定的血清代謝物介導的間接影響;中介效應(β12=β1×β2)即選定的免疫細胞通過確定的血清代謝物介導對HF的間接影響;直接效應(β_dir=β_all?β12)即選定的免疫細胞對HF的直接影響;中介效應比(β12_p=β12/β_all)反映中介效應在總效應中的比例,從而揭示選定的免疫細胞通過該血清代謝物對HF的影響百分比。若中介效應與總效應的方向不一致(即OR>1或OR<1),則不可計算中介效應比,單側檢驗水準α=0.05。
2 結果
2.1 731個免疫細胞與心力衰竭的關系
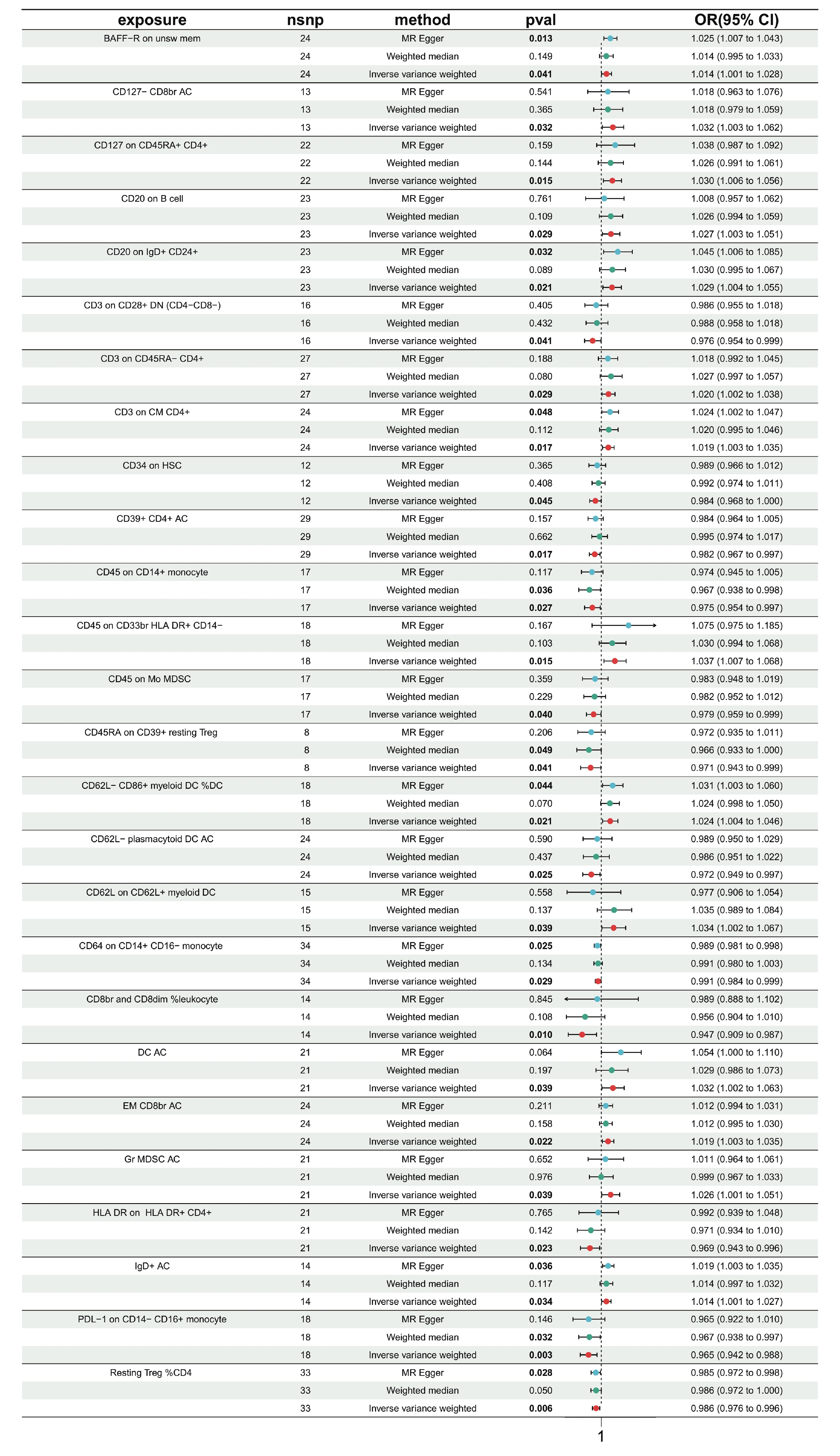
通過剔除免疫細胞連鎖不平衡和弱工具變量后,進行731次兩樣本MR分析,將免疫細胞表型作為暴露,HF作為結局。結果顯示,IVW分析顯示,共有32個免疫細胞表型與HF具有因果關系(P<0.05)。進一步驗證異質性及水平多效性,發現免疫細胞表型IgD+ CD38dim AC(P=0.047)、Resting Treg% CD4 Treg(P=0.035)、CD39+ resting Treg AC(P=0.004)、CD25hi CD45RA+ CD4 not Treg AC(P=0.016)、TD CD4+%T cell存在異質性(P=0.009);免疫細胞表型(CD62L?CD86+ myeloid DC AC)存在水平多效性(P=0.042)。排除上述6個免疫細胞表型后,剩余免疫細胞表型的“留一法”檢驗結果穩定。26種免疫細胞表型3種分析方法的森林圖見圖1。
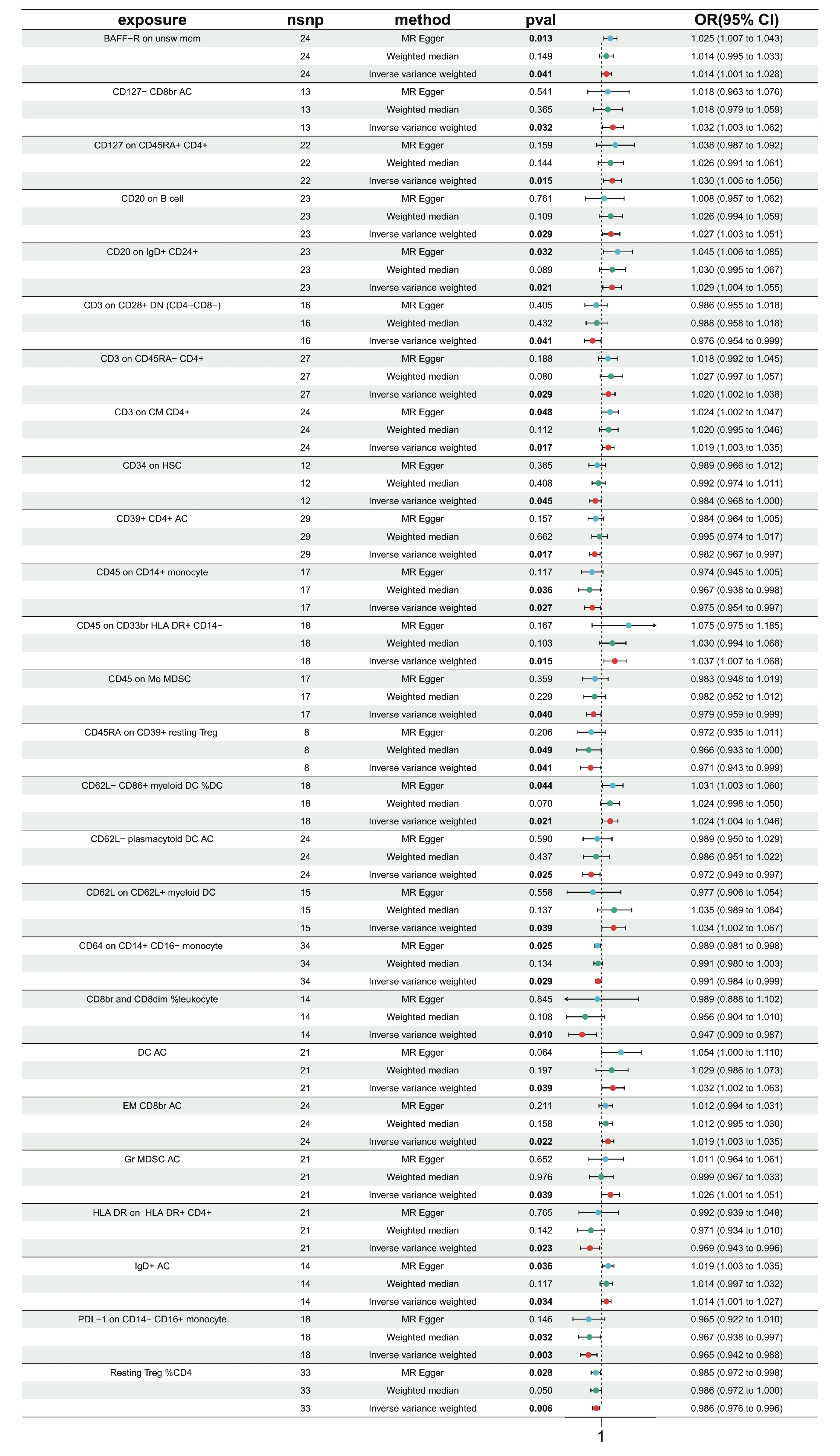 圖1
免疫細胞與HF的MR分析森林圖
圖1
免疫細胞與HF的MR分析森林圖
exposure:免疫細胞表型;nsnp:SNP 數量;method:方法;pval:
為進一步評估結果的可靠性,本研究采用MR-Egger分析和加權中位數分析,發現10個免疫細胞表型與HF的因果關系更可靠,具體來說,免疫細胞表型CD62L?CD86+ myeloid DC%DC、IgD+ AC、Resting Treg%CD4、BAFF-R on unsw mem、CD20 on IgD+ CD24+、CD3 on CM CD4+、CD64 on CD14+ CD16? monocyte在IVW方法P<0.05的前提下,MR-Egger方法P<0.05;此外,免疫細胞表型CD45 on CD14+ monocyte、PD-L1 on CD14?CD16+ monocyte、CD45RA on CD39+ resting Treg在IVW方法P<0.05的前提下,加權中位數法P<0.05。通過比較IVW方法P值后,本研究最終選取因果關系最穩定的免疫細胞表型PD-L1 on CD14?CD16+ monocyte(P=0.003)進行后續分析。
2.2 反向孟德爾隨機化分析
為滿足中介MR研究的要求,本研究將HF作為暴露,免疫細胞表型(PD-L1 on CD14?CD16+ monocyte)作為結局,進行反向MR分析。結果顯示,在5種分析方法中,所有P值均>0.05,差異無統計學意義。這表明,在反向因果關系中,HF與PD-L1 on CD14?CD16+ monocyte無因果關系;見表1。
2.3 PD-L1 on CD14?CD16+與1400 種血清代謝物的關系
本研究剔除連鎖不平衡和弱工具變量后,進行
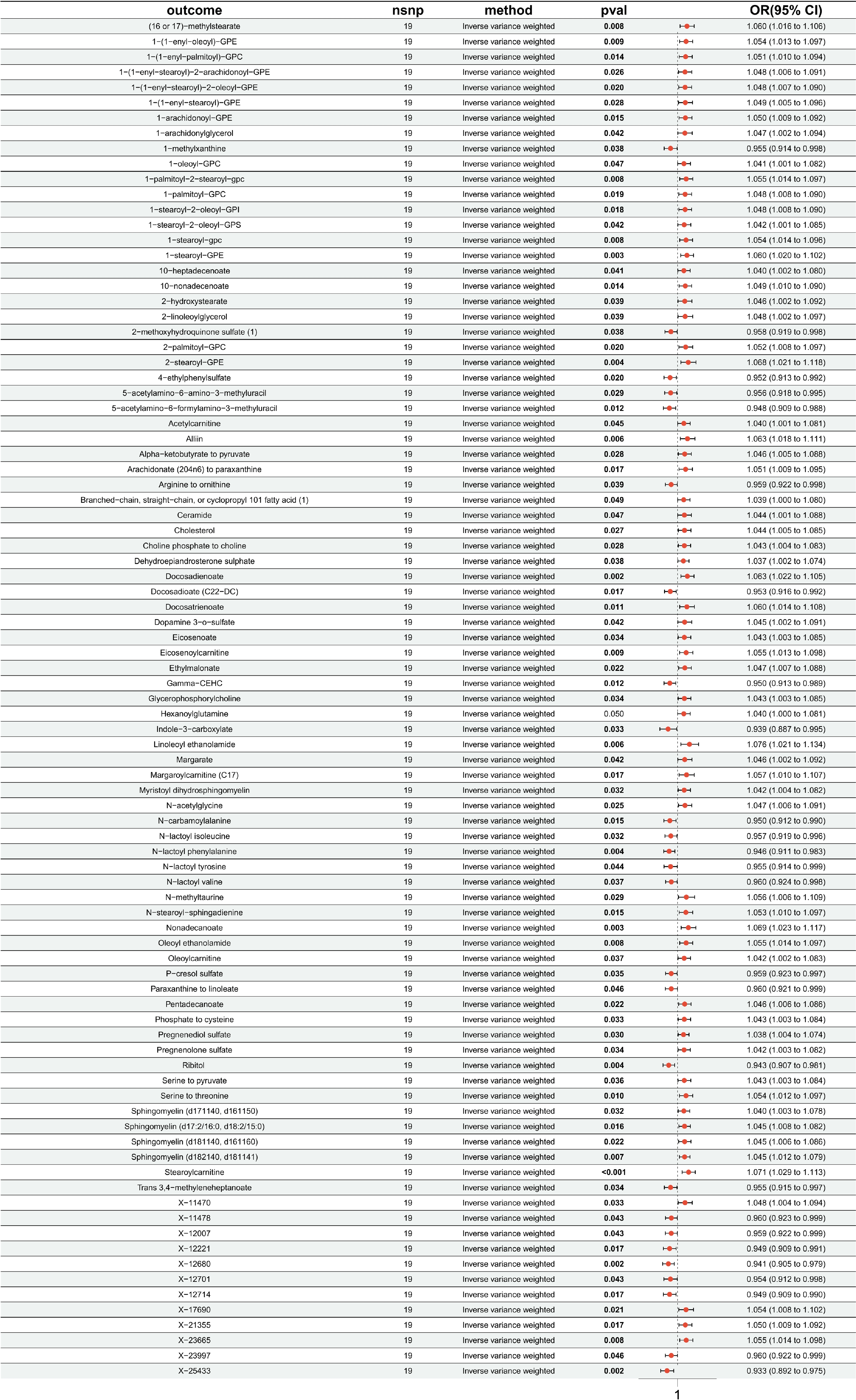
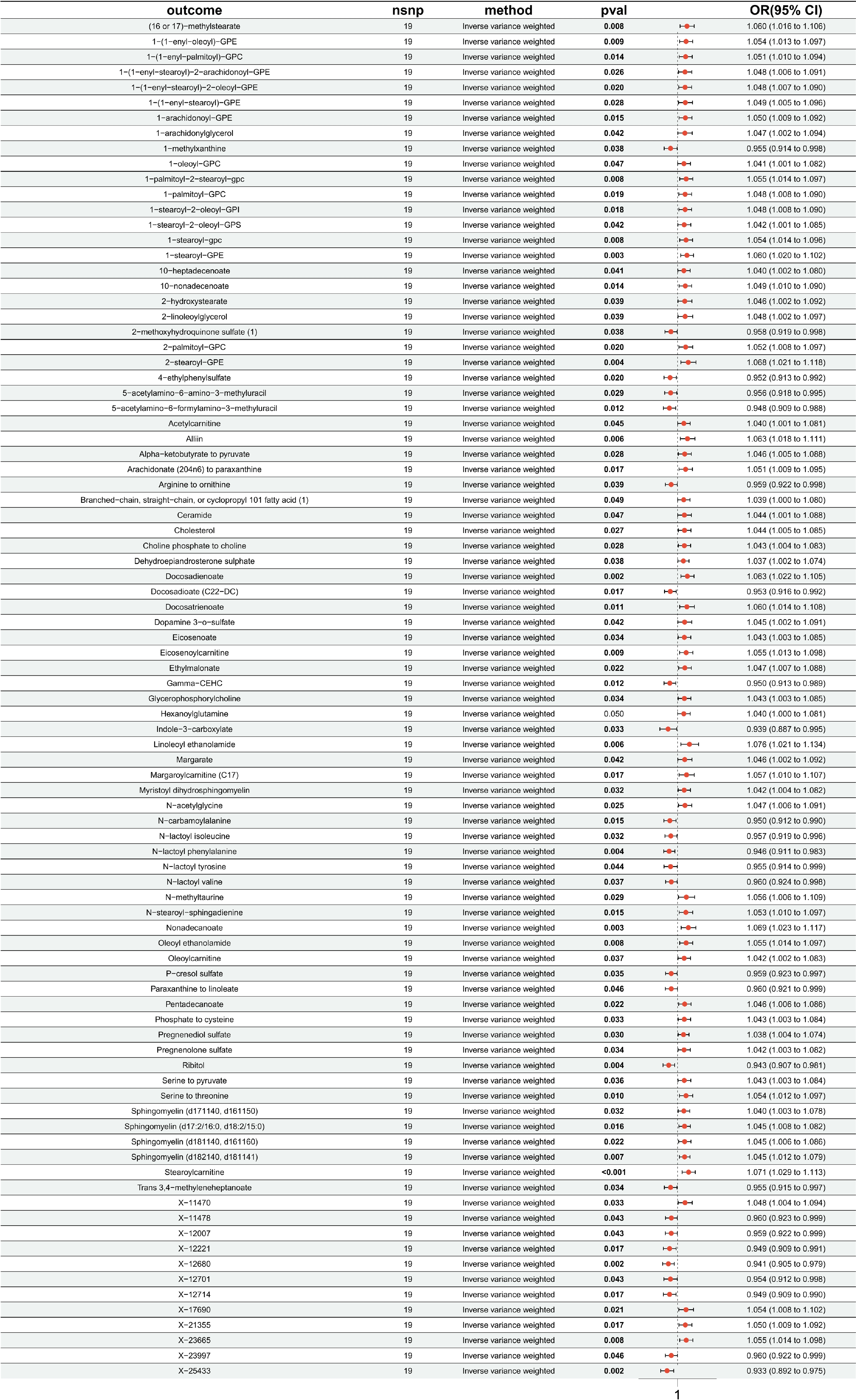 圖2
PD-L1 on CD14?CD16+與血清代謝物的MR分析森林圖
圖2
PD-L1 on CD14?CD16+與血清代謝物的MR分析森林圖
outcome:血清代謝物;nsnp:SNP數量;method:方法;pval:
2.4 PD-L1 on CD14?CD16+相關的89個血清代謝物與HF的關系
在剔除血清代謝物連鎖不平衡和弱工具變量后,本研究以89個血清代謝物為暴露因素,HF為結局,采用IVW方法進行89次兩樣本MR。結果顯示,有2個血清代謝物與HF存在因果關系,敏感性分析進一步驗證了結果的可靠性,未發現水平多效性及異質性問題。其中,1-(1-enyl-stearoyl)-2-oleoyl-GPE與HF呈正相關[OR=1.09,95%CI(1.02,1.16)],鞘磷脂(sphingomyelin,d17:1/14:0,d16:1/15:0)與HF呈負相關[OR=0.94,95%CI(0.89,1.00)]。其余87個血清代謝物與HF不存在顯著的因果關系;見表2。
2.5 血清代謝物介導免疫細胞與HF之間的聯系
通過兩步中介法分析發現,PD-L1 on CD14?CD16+與HF呈負相關[OR=0.96,95%CI(0.94,0.99),β_all=?0.04],PD-L1 on CD14?CD16+與1-(1-enyl-stearoyl)-2-oleoyl-GPE呈正相關[OR=1.05,95%CI(1.01,1.09),β1=0.05],而1-(1-enyl-stearoyl)-2-oleoyl-GPE與HF呈正相關[OR=1.09,95%CI(1.02,1.16),β2=0.08],暴露對結局總效應量(β_all=?0.04)與中介在暴露對結局影響中的中介效應量(β12=0.003)方向不一致,提示暴露可能不通過該中介對結局產生影響;此外,PD-L1 on CD14?CD16+與HF呈負相關[OR=0.96,95%CI(0.94,0.99),β_all=?0.04],PD-L1 on CD14?CD16+與(d17:1/14:0,d16:1/15:0)呈正相關[OR=1.04,95%CI(1.00,1.08),β1=0.04],而鞘磷脂(d17:1/14:0, d16:1/15:0)與HF呈負相關[OR=0.94,95%CI(0.89,1.00),β2=?0.06],暴露對結局總效應量(β_all=?0.04)與中介在暴露對結局影響中的中介效應量(β12=?0.002)方向一致,且中介效應比(β12_p)=6.7%。
3 討論
本研究首次運用中介 MR 分析方法,探討免疫細胞、血清代謝物與HF之間的因果關系。研究結果顯示,PD-L1 on CD14?CD16+與 HF之間存在負向因果關系,而反向 MR 分析未發現 HF 對其影響,表明其可能單向降低HF風險。此外,中介分析表明,PD-L1 on CD14?CD16+可能通過提高鞘磷脂(d17:1/14:0, d16:1/15:0)水平發揮保護作用,降低HF風險,中介效應比為6.7%。本研究為HF發病機制提供了新見解,提示潛在的干預靶點。
程序性死亡受體配體1(programmed death-ligand 1,PD-L1)是一種主要在單核細胞中發揮作用的細胞表面免疫調節分子,而單核細胞在HF的發病和進展中起著關鍵作用[31]。PD-L1通過調節T細胞反應,防止免疫系統的過度活化,在免疫逃逸和免疫耐受中起到重要作用[32]。根據CD14和CD16的表達,單核細胞可分為3個亞群[33],其中CD14?CD16+單核細胞是不表達CD14(脂多糖受體)但表達CD16(Fcγ受體Ⅲ)的“非經典”單核細胞亞群,約占單核細胞的5%~10%[34]。PD-L1是這種“非經典”單核細胞的標志物,并在炎癥調節中促進T細胞的存活[35],在調控免疫反應和HF等炎癥性疾病中具有重要意義。研究[36]表明,在慢性炎癥狀態下,CD14?CD16+單核細胞顯著增加,這可能是由于氧化應激反應誘導促炎轉錄因子核轉錄因子-κB和低氧誘導因子-1α的上調,而低氧誘導因子-1α的上調進一步誘導PD-L1在單核細胞上的表達增加。PD-L1通過抑制T細胞的活化,可能減少HF中的炎癥損傷,這與臨床研究[37]觀察到的高PD-L1表達與較低心血管事件發生率之間的關系一致。此外,實驗研究[38]顯示,干擾素-γ誘導的PD-L1在內皮細胞中的表達上調,可能通過減弱T細胞介導的炎癥反應對心臟提供保護。另一項隊列研究[39]也發現,心臟移植術后PD-L1表達水平較高的患者,其移植存活率顯著提高,進一步支持了PD-L1在心臟保護中的潛在作用。
中介MR分析表明,PD-L1 on CD14?CD16+可能通過影響鞘磷脂(d17:1/14:0,d16:1/15:0)水平,從而影響HF的發病風險。鞘磷脂作為細胞膜的重要組成部分,在細胞信號傳導、膜結構維持及細胞凋亡調控中起關鍵作用[40]。鞘磷脂(d17:1/14:0,d16:1/15:0)是一種特定類型的鞘磷脂,具體指鞘磷脂分子中鞘氨醇和脂肪酸的特定結構組成,其鞘氨醇部分分別為d17:1和d16:1,脂肪酸部分分別為14:0和15:0。雖然較高水平的鞘磷脂曾被視為心血管疾病的危險因素[41]。但近期研究[42]發現,在HF患者中較低的鞘磷脂水平往往暗示預后不良,這提示鞘磷脂在HF病理進程中可能具有保護作用。鞘磷脂通過多種機制保護心肌細胞,防止凋亡,并減緩HF的進展[43]。有研究[44]間接表明,血漿磷脂水平較高與HF發生風險較低有關。代謝組學研究[45]也發現,鞘磷脂水平與HF風險呈負相關,增加鞘磷脂的合成可顯著減緩由壓力超負荷誘導的心肌肥厚和纖維化。一項橫斷面研究[46]進一步證實鞘磷脂與HF發病風險之間的負相關性。鞘磷脂不僅通過維持細胞膜的完整性保護心肌細胞,還調控細胞凋亡途徑和抗氧化應激,減緩HF的進展[47]。這一發現也與現有研究[48]相吻合,即較高的鞘磷脂循環水平可能意味著鞘磷脂在動脈粥樣硬化斑塊中的積累減少,從而導致動脈粥樣硬化負荷較低,這可能解釋了與HF風險的負相關性。此外,鞘磷脂還可能通過調控炎癥反應[49]減少心肌損傷。
然而,本研究也存在一定的局限性。首先,盡管MR方法能夠有效控制混雜因素,其結果仍依賴于工具變量的有效性和假設的合理性。例如,工具變量需要滿足與暴露因素強相關、與結果無直接關聯且不受混雜因素影響的假設,而這些假設在實際研究中可能無法完全滿足。此外,盡管本研究選取了部分代謝物作為分析對象,這些代謝物是否能全面代表HF相關代謝途徑的變化仍存疑,未來研究可以探索更廣泛的代謝物以獲得更全面的機制理解。其次,鞘磷脂在HF中的具體作用機制尚未完全闡明。現有研究多集中于鞘磷脂在細胞水平和動物模型中的作用,未來研究應進一步探討其在人類中的適用性,并開展更大規模的多中心前瞻性隊列研究,以確認鞘磷脂的作用及其與免疫細胞之間的相互作用。最后,雖然本研究的中介效應分析為機制探討提供了初步見解,但仍需通過實驗研究進一步驗證其生物學可行性。未來的研究應結合臨床和實驗研究,深入探討PD-L1 on CD14?CD16+通過鞘磷脂(d17:1/14:0,d16:1/15:0)水平對HF影響的具體機制,此外,應嘗試開發臨床干預策略,以明確調節鞘磷脂水平是否能改善HF的臨床結局。
利益沖突:無。
作者貢獻:朱赟負責選題與研究設計,論文撰寫與修改;林瑞芳、劉泳君、柳岳負責方法整合,查找參考文獻,數據分析;張國華負責論文校對;郭志華、魏佳明負責論文設計和整體修改。
心力衰竭(heart failure,HF)是一種以心臟結構和/或功能損害引發的臨床綜合征,表現為呼吸困難、疲勞、體液潴留,是全球最常見的心血管疾病之一[1]。其病理機制復雜,涉及心肌細胞凋亡、纖維化、能量代謝障礙及免疫炎癥反應[2]。盡管治療有所進展,全球仍有超過
免疫細胞在妊娠期間即駐留于心肌,并持續至成年期,對心臟的構成、發育和功能具有至關重要的作用[4]。免疫細胞在HF中扮演重要角色,不僅調節心臟局部免疫微環境,還通過系統性炎癥反應加劇心臟結構和功能異常[5]。大量單核細胞、巨噬細胞、淋巴細胞和自然殺傷細胞浸潤,通過釋放細胞因子和趨化因子參與炎癥反應和纖維化過程[6]。例如,單核細胞分泌腫瘤壞死因子、白介素-1,參與心肌細胞凋亡、纖維化以及心肌重塑過程[7]。此外,淋巴細胞的慢性激活也與HF密切相關。有研究[8]表明,淋巴細胞減少癥顯著提高死亡率。
血清代謝物是機體代謝狀態的直接反映,其功能異常與HF的發生和進展相關[9]。研究[10]表明,代謝紊亂如脂毒性導致心肌細胞毒性中間體積累,誘發心功能障礙。HF患者的血清代謝物譜中支鏈氨基酸、磷脂[11]等顯著異常,這些代謝物不僅是疾病標志,還可能通過影響免疫細胞活性進一步加劇病情[12]。
然而,目前關于免疫細胞、血清代謝物與HF三者關系的研究仍顯不足,尤其是代謝物在其中可能發揮的中介作用。孟德爾隨機化(Mendelian randomization,MR)是一種利用遺傳變異作為工具變量探究變量與疾病之間因果關系的方法[14],可有效避免混雜因素和反向因果關系的影響。本研究旨在運用MR方法探討免疫細胞、血清代謝物與HF之間的相關性,揭示免疫細胞如何通過特定血清代謝物影響HF的發病和進展,為HF的預防和治療提供新的理論基礎和干預靶點。
1 資料與方法
1.1 研究設計
本研究通過兩樣本 MR 分析,評估731種免疫細胞作為暴露因素與 HF作為結局之間的因果關系,同時探討
具體步驟如下:① 分析731種免疫細胞作為暴露因素與HF作為結局變量之間的單向因果關系,選出與HF因果關系最穩定的免疫細胞;同時,確保當 HF作為暴露因素,選出的免疫細胞作為結局變量時,反向 MR分析無因果關系。② 將選出的免疫細胞作為暴露因素,
1.2 數據來源
1.2.1 免疫細胞數據來源
GWAS目錄提供了731種免疫細胞性狀的匯總統計信息(注冊號 GCST90001391-GCST90002121)[16]。該研究數據來源于
1.2.2 血清代謝物數據來源
1.2.3 HF數據來源
HF數據來自FinnGen項目的歐洲GWAS R10版本,該項目是芬蘭的一個覆蓋全國人口的公私合作項目,旨在探索多種疾病的病因,促進人口健康[18]。該數據集包含
1.3 工具變量的選擇
根據先前類似的研究[19-21],為確保因果關系推測的完整性和準確性,本研究在篩選與731個免疫細胞及
1.4 統計學分析
數據分析采用 R 軟件(版本4.3.2)中的MR-PRESSO和Two Sample MR軟件包。逆方差加權法(inverse variance weighted,IVW)在因果推理中被認為足夠穩健,故選為估計因果效應的主要方法[26-27]。MR-Egger和加權中位數作為補充分析[28]。使用Cochrane’s Q檢驗評估異質性,MR-PRESSO和MR-Egger回歸檢測水平多效性[29]。采用“留一法”進行敏感性分析,通過依次排除每個SNP來評估估計值是否由任何單個SNP驅動。以比值比(odds ratio,OR)及其95%置信區間(confidence interval,CI)評估暴露與結局的效應關系(OR>1視為正相關,OR<1視為負相關)。
通過兩步法中介分析,計算選定的免疫細胞對HF的總效應(β_all)、選定的免疫細胞對確定的中介血清代謝物的影響(β1)、確定的中介血清代謝物對HF的影響(β2)、中介效應(β12)[30]、直接效應(β_dir)及中介效應比。其中,總效應即選定的免疫細胞對HF的整體影響,該影響可以分解為選定的免疫細胞對HF的直接影響和確定的血清代謝物介導的間接影響;中介效應(β12=β1×β2)即選定的免疫細胞通過確定的血清代謝物介導對HF的間接影響;直接效應(β_dir=β_all?β12)即選定的免疫細胞對HF的直接影響;中介效應比(β12_p=β12/β_all)反映中介效應在總效應中的比例,從而揭示選定的免疫細胞通過該血清代謝物對HF的影響百分比。若中介效應與總效應的方向不一致(即OR>1或OR<1),則不可計算中介效應比,單側檢驗水準α=0.05。
2 結果
2.1 731個免疫細胞與心力衰竭的關系
通過剔除免疫細胞連鎖不平衡和弱工具變量后,進行731次兩樣本MR分析,將免疫細胞表型作為暴露,HF作為結局。結果顯示,IVW分析顯示,共有32個免疫細胞表型與HF具有因果關系(P<0.05)。進一步驗證異質性及水平多效性,發現免疫細胞表型IgD+ CD38dim AC(P=0.047)、Resting Treg% CD4 Treg(P=0.035)、CD39+ resting Treg AC(P=0.004)、CD25hi CD45RA+ CD4 not Treg AC(P=0.016)、TD CD4+%T cell存在異質性(P=0.009);免疫細胞表型(CD62L?CD86+ myeloid DC AC)存在水平多效性(P=0.042)。排除上述6個免疫細胞表型后,剩余免疫細胞表型的“留一法”檢驗結果穩定。26種免疫細胞表型3種分析方法的森林圖見圖1。
 圖1
免疫細胞與HF的MR分析森林圖
圖1
免疫細胞與HF的MR分析森林圖
exposure:免疫細胞表型;nsnp:SNP 數量;method:方法;pval:
為進一步評估結果的可靠性,本研究采用MR-Egger分析和加權中位數分析,發現10個免疫細胞表型與HF的因果關系更可靠,具體來說,免疫細胞表型CD62L?CD86+ myeloid DC%DC、IgD+ AC、Resting Treg%CD4、BAFF-R on unsw mem、CD20 on IgD+ CD24+、CD3 on CM CD4+、CD64 on CD14+ CD16? monocyte在IVW方法P<0.05的前提下,MR-Egger方法P<0.05;此外,免疫細胞表型CD45 on CD14+ monocyte、PD-L1 on CD14?CD16+ monocyte、CD45RA on CD39+ resting Treg在IVW方法P<0.05的前提下,加權中位數法P<0.05。通過比較IVW方法P值后,本研究最終選取因果關系最穩定的免疫細胞表型PD-L1 on CD14?CD16+ monocyte(P=0.003)進行后續分析。
2.2 反向孟德爾隨機化分析
為滿足中介MR研究的要求,本研究將HF作為暴露,免疫細胞表型(PD-L1 on CD14?CD16+ monocyte)作為結局,進行反向MR分析。結果顯示,在5種分析方法中,所有P值均>0.05,差異無統計學意義。這表明,在反向因果關系中,HF與PD-L1 on CD14?CD16+ monocyte無因果關系;見表1。
2.3 PD-L1 on CD14?CD16+與1400 種血清代謝物的關系
本研究剔除連鎖不平衡和弱工具變量后,進行
 圖2
PD-L1 on CD14?CD16+與血清代謝物的MR分析森林圖
圖2
PD-L1 on CD14?CD16+與血清代謝物的MR分析森林圖
outcome:血清代謝物;nsnp:SNP數量;method:方法;pval:
2.4 PD-L1 on CD14?CD16+相關的89個血清代謝物與HF的關系
在剔除血清代謝物連鎖不平衡和弱工具變量后,本研究以89個血清代謝物為暴露因素,HF為結局,采用IVW方法進行89次兩樣本MR。結果顯示,有2個血清代謝物與HF存在因果關系,敏感性分析進一步驗證了結果的可靠性,未發現水平多效性及異質性問題。其中,1-(1-enyl-stearoyl)-2-oleoyl-GPE與HF呈正相關[OR=1.09,95%CI(1.02,1.16)],鞘磷脂(sphingomyelin,d17:1/14:0,d16:1/15:0)與HF呈負相關[OR=0.94,95%CI(0.89,1.00)]。其余87個血清代謝物與HF不存在顯著的因果關系;見表2。
2.5 血清代謝物介導免疫細胞與HF之間的聯系
通過兩步中介法分析發現,PD-L1 on CD14?CD16+與HF呈負相關[OR=0.96,95%CI(0.94,0.99),β_all=?0.04],PD-L1 on CD14?CD16+與1-(1-enyl-stearoyl)-2-oleoyl-GPE呈正相關[OR=1.05,95%CI(1.01,1.09),β1=0.05],而1-(1-enyl-stearoyl)-2-oleoyl-GPE與HF呈正相關[OR=1.09,95%CI(1.02,1.16),β2=0.08],暴露對結局總效應量(β_all=?0.04)與中介在暴露對結局影響中的中介效應量(β12=0.003)方向不一致,提示暴露可能不通過該中介對結局產生影響;此外,PD-L1 on CD14?CD16+與HF呈負相關[OR=0.96,95%CI(0.94,0.99),β_all=?0.04],PD-L1 on CD14?CD16+與(d17:1/14:0,d16:1/15:0)呈正相關[OR=1.04,95%CI(1.00,1.08),β1=0.04],而鞘磷脂(d17:1/14:0, d16:1/15:0)與HF呈負相關[OR=0.94,95%CI(0.89,1.00),β2=?0.06],暴露對結局總效應量(β_all=?0.04)與中介在暴露對結局影響中的中介效應量(β12=?0.002)方向一致,且中介效應比(β12_p)=6.7%。
3 討論
本研究首次運用中介 MR 分析方法,探討免疫細胞、血清代謝物與HF之間的因果關系。研究結果顯示,PD-L1 on CD14?CD16+與 HF之間存在負向因果關系,而反向 MR 分析未發現 HF 對其影響,表明其可能單向降低HF風險。此外,中介分析表明,PD-L1 on CD14?CD16+可能通過提高鞘磷脂(d17:1/14:0, d16:1/15:0)水平發揮保護作用,降低HF風險,中介效應比為6.7%。本研究為HF發病機制提供了新見解,提示潛在的干預靶點。
程序性死亡受體配體1(programmed death-ligand 1,PD-L1)是一種主要在單核細胞中發揮作用的細胞表面免疫調節分子,而單核細胞在HF的發病和進展中起著關鍵作用[31]。PD-L1通過調節T細胞反應,防止免疫系統的過度活化,在免疫逃逸和免疫耐受中起到重要作用[32]。根據CD14和CD16的表達,單核細胞可分為3個亞群[33],其中CD14?CD16+單核細胞是不表達CD14(脂多糖受體)但表達CD16(Fcγ受體Ⅲ)的“非經典”單核細胞亞群,約占單核細胞的5%~10%[34]。PD-L1是這種“非經典”單核細胞的標志物,并在炎癥調節中促進T細胞的存活[35],在調控免疫反應和HF等炎癥性疾病中具有重要意義。研究[36]表明,在慢性炎癥狀態下,CD14?CD16+單核細胞顯著增加,這可能是由于氧化應激反應誘導促炎轉錄因子核轉錄因子-κB和低氧誘導因子-1α的上調,而低氧誘導因子-1α的上調進一步誘導PD-L1在單核細胞上的表達增加。PD-L1通過抑制T細胞的活化,可能減少HF中的炎癥損傷,這與臨床研究[37]觀察到的高PD-L1表達與較低心血管事件發生率之間的關系一致。此外,實驗研究[38]顯示,干擾素-γ誘導的PD-L1在內皮細胞中的表達上調,可能通過減弱T細胞介導的炎癥反應對心臟提供保護。另一項隊列研究[39]也發現,心臟移植術后PD-L1表達水平較高的患者,其移植存活率顯著提高,進一步支持了PD-L1在心臟保護中的潛在作用。
中介MR分析表明,PD-L1 on CD14?CD16+可能通過影響鞘磷脂(d17:1/14:0,d16:1/15:0)水平,從而影響HF的發病風險。鞘磷脂作為細胞膜的重要組成部分,在細胞信號傳導、膜結構維持及細胞凋亡調控中起關鍵作用[40]。鞘磷脂(d17:1/14:0,d16:1/15:0)是一種特定類型的鞘磷脂,具體指鞘磷脂分子中鞘氨醇和脂肪酸的特定結構組成,其鞘氨醇部分分別為d17:1和d16:1,脂肪酸部分分別為14:0和15:0。雖然較高水平的鞘磷脂曾被視為心血管疾病的危險因素[41]。但近期研究[42]發現,在HF患者中較低的鞘磷脂水平往往暗示預后不良,這提示鞘磷脂在HF病理進程中可能具有保護作用。鞘磷脂通過多種機制保護心肌細胞,防止凋亡,并減緩HF的進展[43]。有研究[44]間接表明,血漿磷脂水平較高與HF發生風險較低有關。代謝組學研究[45]也發現,鞘磷脂水平與HF風險呈負相關,增加鞘磷脂的合成可顯著減緩由壓力超負荷誘導的心肌肥厚和纖維化。一項橫斷面研究[46]進一步證實鞘磷脂與HF發病風險之間的負相關性。鞘磷脂不僅通過維持細胞膜的完整性保護心肌細胞,還調控細胞凋亡途徑和抗氧化應激,減緩HF的進展[47]。這一發現也與現有研究[48]相吻合,即較高的鞘磷脂循環水平可能意味著鞘磷脂在動脈粥樣硬化斑塊中的積累減少,從而導致動脈粥樣硬化負荷較低,這可能解釋了與HF風險的負相關性。此外,鞘磷脂還可能通過調控炎癥反應[49]減少心肌損傷。
然而,本研究也存在一定的局限性。首先,盡管MR方法能夠有效控制混雜因素,其結果仍依賴于工具變量的有效性和假設的合理性。例如,工具變量需要滿足與暴露因素強相關、與結果無直接關聯且不受混雜因素影響的假設,而這些假設在實際研究中可能無法完全滿足。此外,盡管本研究選取了部分代謝物作為分析對象,這些代謝物是否能全面代表HF相關代謝途徑的變化仍存疑,未來研究可以探索更廣泛的代謝物以獲得更全面的機制理解。其次,鞘磷脂在HF中的具體作用機制尚未完全闡明。現有研究多集中于鞘磷脂在細胞水平和動物模型中的作用,未來研究應進一步探討其在人類中的適用性,并開展更大規模的多中心前瞻性隊列研究,以確認鞘磷脂的作用及其與免疫細胞之間的相互作用。最后,雖然本研究的中介效應分析為機制探討提供了初步見解,但仍需通過實驗研究進一步驗證其生物學可行性。未來的研究應結合臨床和實驗研究,深入探討PD-L1 on CD14?CD16+通過鞘磷脂(d17:1/14:0,d16:1/15:0)水平對HF影響的具體機制,此外,應嘗試開發臨床干預策略,以明確調節鞘磷脂水平是否能改善HF的臨床結局。
利益沖突:無。
作者貢獻:朱赟負責選題與研究設計,論文撰寫與修改;林瑞芳、劉泳君、柳岳負責方法整合,查找參考文獻,數據分析;張國華負責論文校對;郭志華、魏佳明負責論文設計和整體修改。