肺癌是全球發病率最高的惡性腫瘤。對于肺內多發轉移或肺功能不全的肺癌患者,完整切除腫瘤的難度大,預后不佳。肺移植在腫瘤的完全切除、改善患者肺功能及提高生活質量方面展現出潛在的治療價值。PET-CT、ctDNA等腫瘤檢測技術以及肺癌綜合治療手段的發展,為肺移植術后腫瘤復發和治療預后的精準預測提供了有力工具。肺移植治療肺癌的可行性正受到越來越多的關注。本文將對肺癌肺移植的歷史及其臨床管理進行綜述。
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺移植是終末期慢性肺病導致呼吸衰竭患者的最終治療手段 [1,2]。目前,肺移植適應證主要為良性肺病,包括間質性肺病(interstitial lung disease,ILD)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)和支氣管擴張等[2–5]。然而,在惡性腫瘤治療領域,肺移植的應用仍處于探索階段。
肺癌是我國發病率和死亡率最高的癌癥類型,2022年新發病例數高達106.06萬,并呈逐年增長趨勢[6]。免疫治療和靶向治療是晚期肺癌伴轉移或合并肺功能障礙患者的主要治療手段[7-8]。但部分患者因驅動基因陰性或對治療反應性差,長期預后仍不理想[9]。如何為此類患者提供更有效的治療策略,成為亟待解決的問題。既往研究[10–12]表明,對于早期肺癌或局限性肺內轉移患者,肺移植后生存率與良性肺病肺移植受者相當。然而,移植后腫瘤復發風險和免疫抑制治療的潛在影響,仍是限制其廣泛應用的關鍵問題。
1 肺癌肺移植的發展
肺移植治療肺癌歷史悠久。1963年,James Hardy為1例左側中央型肺癌并伴嚴重慢性肺病的患者實施單肺移植,盡管患者因術后早期腎功能衰竭去世,但此舉開啟了肺移植治療肺癌的先河[13]。
早期研究主要集中于支氣管肺泡癌(bronchoalveolar carcinoma,BAC),這是一種起源于細支氣管或肺泡上皮的惡性腫瘤。BAC患者傳統治療效果有限,其晚期患者接受手術治療的5年生存率僅為34%,EGFR靶向藥物Gefitinib治療的3年生存率僅為20%~30% [14–17]。在此背景下,肺移植逐漸成為BAC患者的重要治療選擇之一。1999年,Garver等[18]報道7例晚期BAC患者的2年無病生存率(disease-free survival,DFS)為71.4%,中位復發時間為39個月。2003年,Zorn等[19]報道了9例BAC患者的研究,3年總體生存率(overall survival,OS)和DFS分別為66.7%和55.6%,中位復發時間為19.5個月。2004年,De Perrot等[10]的研究納入了26例因BAC接受肺移植治療的患者,5年無復發生存率為35%,5年OS為39%,中位復發時間為12個月。2010年,Ahmad等[11]基于美國器官共享聯合網絡(United Network for Organ Sharing,UNOS)數據庫的分析表明,1987至2010年間因BAC接受肺移植的患者,其5年生存率與總體肺移植受者人群相當(57% vs. 50%,P=0.66)。總體來看,盡管肺移植治療BAC術后存在復發風險,但生存率與總體肺移植人群相近,表明肺移植可成為BAC患者的潛在治療選擇。
近年來,肺移植治療的研究方向逐漸擴展至其他類型的肺癌。2024年,美國西北大學的Ankit Bharat報道了1例ⅣA期侵襲性黏液性腺癌(invasive mucinous adenocarcinoma,IMA)患者,該患者常規化療及免疫治療均無效,最終通過體外循環下行雙肺移植治療。術后隨訪顯示,患者的CT影像及循環腫瘤DNA(circulating tumor DNA,ctDNA)均未提示腫瘤復發[20]。這一病例首次提出,體外循環下雙肺移植可能為晚期肺內轉移腫瘤患者提供一種潛在的治療選擇。基于此,美國西北大學肺移植中心啟動了一項前瞻性臨床隊列研究(Double lung transplant REgistry Aimed for lung-limited Malignancies,DREAM)(NCT05671887),旨在評估肺移植對綜合治療無效的原發性或轉移性肺部腫瘤患者的療效[21]。DREAM研究特別設計了合并良性肺病的腫瘤患者行肺移植治療的分組。因為既往研究[22–26]表明,這些患者接受常規治療可能導致肺功能進一步惡化,甚至引發呼吸衰竭。DREAM研究的初步結果顯示,在6例IVA期肺癌肺移植患者中,5例術后無復發并存活,1例在術后18個月時出現肺部1 cm的實性結節[27]。結果提示,對于局限于雙肺的晚期腫瘤患者,尤其是常規治療無效或無法耐受者,肺移植可能成為一種重要的治療手段[28]。
目前國際心臟和肺移植學會(International Society for Heart and Lung Transplantation,ISHLT)專家共識將肺移植治療肺癌的適應證嚴格限定為原位腺癌、微浸潤肺腺癌(minimally invasive adenocarcinoma,MIA)以及貼壁生長型腺癌(lepidic predominant adenocarcinoma,LPA)等肺內局限惡性腫瘤。目前接受肺移植治療肺癌患者數量較少,僅占肺移植病例的0.1%[29]。隨著DREAM研究的開展和肺移植技術的不斷完善,未來肺移植適應證有望從肺內局限惡性腫瘤擴展到更多類型的晚期肺癌患者。
2 肺癌肺移植受者管理
器官移植在惡性腫瘤治療中具有重要意義,通過移除受累器官可實現病灶清除和器官功能恢復。然而,移植術后長期免疫抑制治療顯著增加了新發或復發腫瘤的風險[30–32]。以肝癌肝移植為例,盡管術前通過嚴格的適應證評估(如Milan標準)并實施規范化的術后管理,術后5年復發率仍達10%~20%[33]。肝癌肝移植與肺癌肺移植同屬于器官移植治療惡性腫瘤的范疇,但目前肺癌肺移植相關研究仍較為有限,尚未形成統一的管理策略。在肝癌肝移植領域,術前適應證評估、圍手術期治療及術后隨訪管理等方面已積累了較為成熟的經驗。這些經驗對肺癌肺移植的臨床管理具有重要的借鑒意義,尤其是在制定適應證、優化圍手術期治療及長期隨訪策略方面,可為未來的研究和實踐提供重要參考。
2.1 肺癌肺移植術前評估
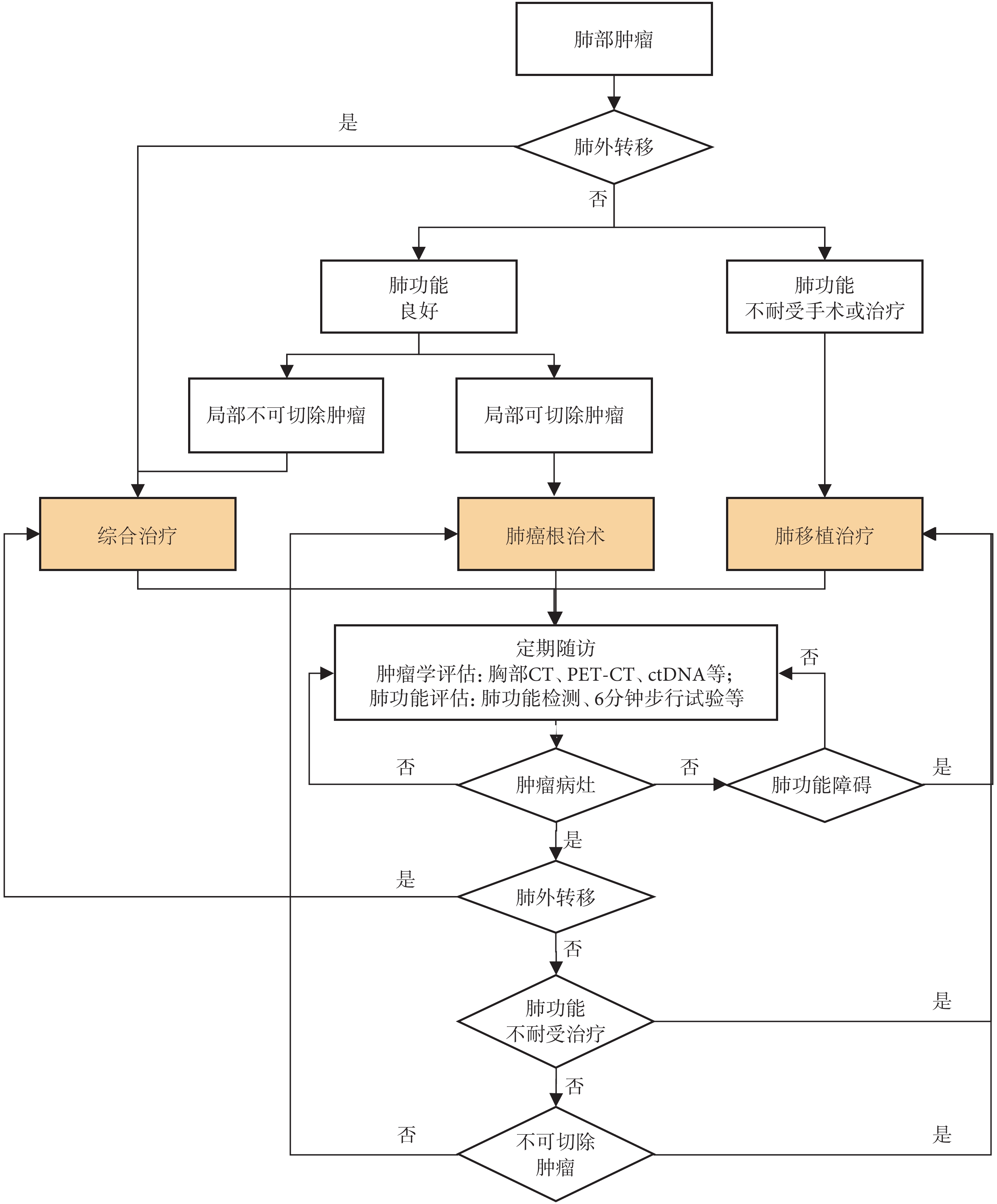
晚期肺癌移植受者的預后顯著差于早期肺癌患者[12]。多項研究[12,34-35]表明,自體肺肺癌患者可能伴隨胸腔內淋巴結或遠處器官轉移。在此背景下,術前腫瘤評估對于預測復發風險、指導圍手術期治療及選擇合適的治療策略具有重要意義。胸部計算機斷層掃描(computer tomography,CT)、全身正電子發射斷層顯像-計算機斷層掃描(positron emission tomography computer tomography,PET-CT)、ctDNA等檢查可明確腫瘤的大小、性質以及是否存在局部或遠處轉移,從而綜合評估腫瘤的分期、選擇合適的治療方案(圖1)。
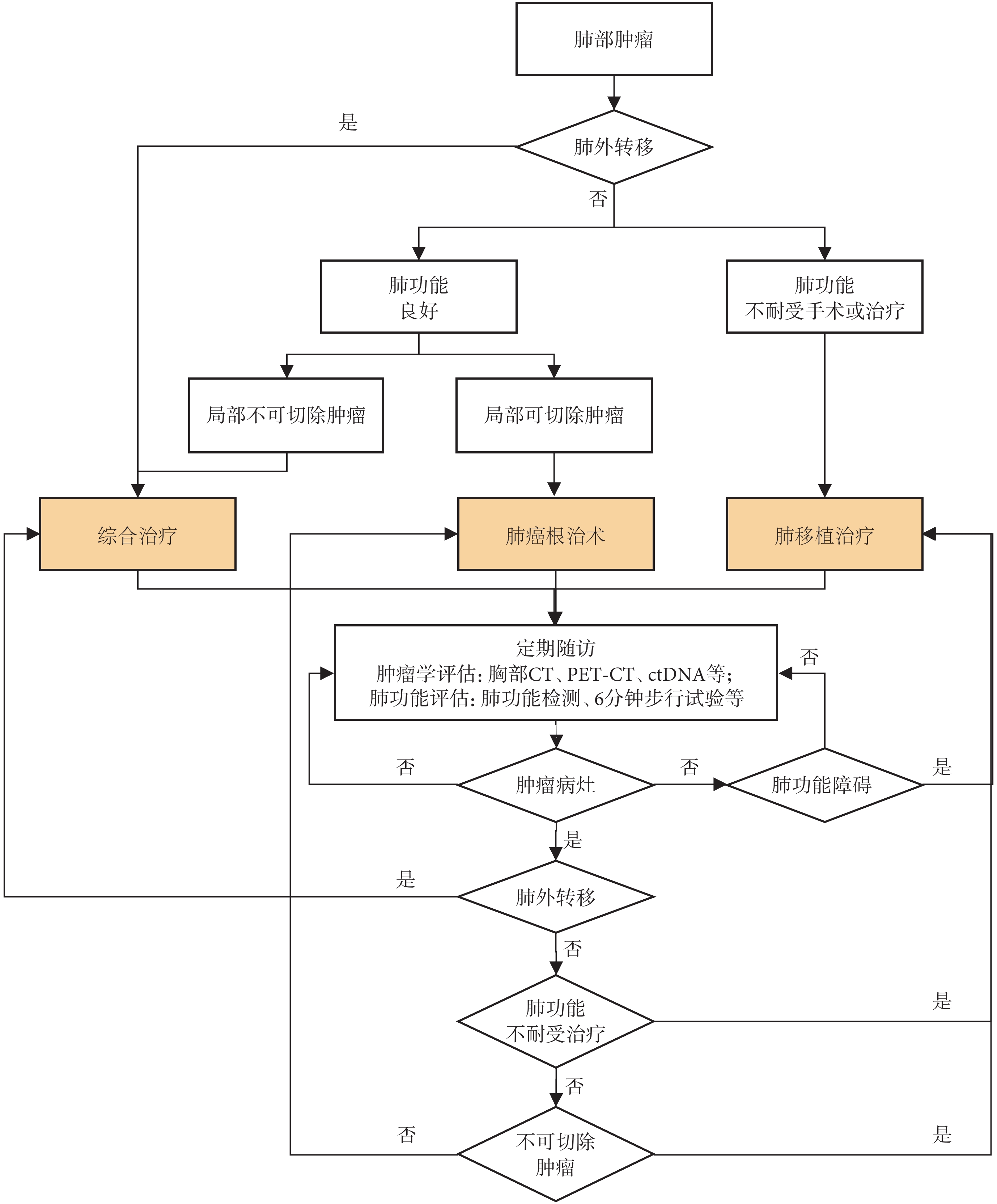 圖1
肺癌肺移植受者管理流程
圖1
肺癌肺移植受者管理流程
PET-CT通過檢測放射性示蹤劑在體內的代謝活動,識別高代謝的腫瘤及其轉移灶,從而幫助識別、定位和監測腫瘤,是評估腫瘤性質和分期的重要輔助工具。基于肝癌肝移植的研究[36]發現,聯合術前PET-CT與腫瘤標志物檢測對預測移植后腫瘤復發具有重要價值。術前胸部CT存在漏診肺癌的風險,PET-CT可及時檢出淋巴結甚至遠處器官轉移[12,34-35]。在器官移植治療惡性腫瘤術前評估中,若PET-CT提示遠處器官或淋巴結轉移,則術后復發風險較高[37]。此類患者可先接受抗腫瘤綜合治療,待腫瘤降級且復發風險降低后,再考慮行移植手術[38]。
ctDNA是指從腫瘤細胞釋放到血液中的DNA片段,可用于無創監測腫瘤負荷和檢測微小殘留病灶,對腫瘤診斷具有較高的敏感性。Huang等[39]的前瞻性隊列研究發現,術前ctDNA檢測陽性的肝癌患者在接受肝臟移植后,其無復發生存時間顯著短于術前ctDNA檢測陰性的患者,移植前低ctDNA水平與較低的移植后腫瘤復發風險相關。盡管該研究以肝癌肝移植為研究對象,其結果提示ctDNA作為術前評估指標的潛力,亦可為肺癌肺移植的術前評估提供重要參考。在肺癌患者中,ctDNA不僅是肺癌早期轉移的重要生物標志物,還在抗腫瘤治療療效監測和復發風險預測中具有重要價值[40–43]。基于此,未來應進一步開展研究,探索ctDNA在肺癌肺移植術后復發預測中的具體作用,以優化術后管理策略并提高患者的長期生存率。
2.2 肺癌肺移植圍手術期治療
免疫治療和靶向治療等抗腫瘤療法在降低惡性腫瘤器官移植受者術后復發風險、提高患者生存率中發揮重要作用[38]。
免疫治療利用免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)阻斷T細胞抑制信號通路,促進T細胞激活,誘導調節T細胞(regulatory T cell,Treg)凋亡,增強免疫系統對腫瘤抗原的反應強度[44–46]。對于腫瘤晚期或存在多灶轉移的患者,移植前免疫治療可控制腫瘤進展,期望實現腫瘤降級,降低腫瘤轉移風險[47-48]。但與此同時,ICIs也會促進免疫細胞對移植物的殺傷。盡管器官移植術后應用免疫抑制藥物抑制T細胞免疫活性。移植前接受免疫治療的患者仍可能因供體人類白細胞抗原(human leukocyte antigen,HLA)免疫反應增強而面臨更高的早期排斥風險[48]。因此,在器官移植治療惡性腫瘤中,平衡免疫治療的抗腫瘤效應與其促排斥的潛在風險至關重要。研究表明,在肝癌肝移植術前免疫治療中,延長免疫治療與移植之間的間隔時間,可有效降低術后急性排斥反應的風險[48-49]。目前,針對肺癌肺移植受者的免疫治療研究仍較為有限,其適應證、藥物選擇及與移植的最佳時間間隔等關鍵問題有待進一步探索。
表皮生長因子受體(epidermal growth factor receptor,EGFR)、鼠肉瘤病毒癌基因同源物(kirsten rat sarcoma viral oncogene homolog,KRAS)、間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、ROS原癌基因1(ros oncogene 1,ROS1)等是主要的肺癌驅動基因突變,均有對應的靶向治療藥物[50]。移植前靶向治療可縮小受者腫瘤病灶,降低遠處轉移風險[38,51]。移植后輔助靶向治療可能降低惡性腫瘤復發風險,并延長復發患者的生存時間[52–54]。然而靶向治療對移植器官排斥的影響尚不明確[55-56]。盡管目前尚無針對肺癌肺移植受者的靶向治療研究,但對于驅動基因陽性肺癌患者,靶向治療或可作為移植前后抗腫瘤治療的重要組成部分。未來研究應進一步探討靶向治療藥物對肺癌肺移植預后的影響,為驅動基因陽性肺癌患者的移植治療策略提供重要依據,并有望改善患者的長期生存預后。
肺癌肺移植需嚴格遵循無瘤原則,以最大限度降低術中及術后腫瘤播散和復發的風險。移植前預先建立體外循環(cardiopulmonary bypass,CPB)阻斷病肺循環,術中依據術前腫瘤分期指導清掃引流淋巴結[20]。術中操作應依據術前腫瘤分期,嚴格按照無瘤原則進行,包括徹底清掃引流淋巴結等[57]。術后需對切除的腫瘤組織及引流淋巴結進行病理檢查和驅動基因檢測,明確術后病理分期,并為后續的綜合治療提供精準指導。
2.3 肺癌肺移植術后隨訪
術后密切隨訪和監測復發性惡性腫瘤的發生情況,并及時采取有效治療措施,是提高肺移植患者遠期生存率的關鍵。
Ahmad和Spies等對自體肺病理診斷為肺癌的肺移植受者進行了隨訪,其術后中位腫瘤復發時間分別為14個月和13個月[12,35]。非局限性肺癌(Ⅱ~Ⅳ期)肺移植受者的總體生存預后顯著差于局限性肺癌患者[12,34]。除了復發腫瘤,肺移植術后原發腫瘤也是肺移植術后腫瘤的主要因素,肺移植受者的肺癌年發病率和死亡率分別為626.4/10萬和 470.3/10萬[58-59]。單肺移植受者術后新發肺癌多見于自體肺,其肺癌發生率是普通人群的13倍,而COPD和ILD等原發病是重要危險因素[60-61]。
針對肺移植術后肺癌的治療,當前主要包括肺癌根治術、二次肺移植及綜合治療等。對于單肺移植受者,若自體肺局限性腫瘤明確,肺癌根治術或自體肺側單肺移植可能是可行的治療選擇。然而,關于這兩種治療方案的優劣及其臨床獲益,目前尚無明確共識。對于原發病為支氣管擴張或矽肺的患者,由于自體肺感染和腫瘤風險較高,治療策略需根據患者具體情況權衡衡[62-64]。對于雙肺移植受者,應依據腫瘤的分級和分期選擇適合的治療方案,如肺癌根治術或綜合治療。若移植肺功能嚴重受損,二次雙肺移植可能是可行的選擇[65]。對于失去手術機會的患者,則需結合具體情況采用免疫治療、放化療及其他綜合治療方案。然而,目前針對肺移植術后肺癌復發的治療尚無明確的指導方案,亟需進一步研究與探索,以優化治療策略并改善患者預后。
3 小結
肺移植作為一種潛在治療方式,或可為局限于肺內轉移及嚴重肺功能損害的患者提供新選擇。借鑒肝移植在肝癌治療中的成功經驗,肺癌肺移植中展現出廣闊應用前景。未來研究應聚焦術前評估技術(如PET-CT和ctDNA)的精準化,優化圍手術期免疫與靶向治療策略,并完善術后復發監測體系,以提升長期療效并改善患者預后。
利益沖突:無。
作者貢獻:譚景洪負責論文初稿撰寫,程超、陳靜瑜對論文進行審閱。
肺移植是終末期慢性肺病導致呼吸衰竭患者的最終治療手段 [1,2]。目前,肺移植適應證主要為良性肺病,包括間質性肺病(interstitial lung disease,ILD)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)和支氣管擴張等[2–5]。然而,在惡性腫瘤治療領域,肺移植的應用仍處于探索階段。
肺癌是我國發病率和死亡率最高的癌癥類型,2022年新發病例數高達106.06萬,并呈逐年增長趨勢[6]。免疫治療和靶向治療是晚期肺癌伴轉移或合并肺功能障礙患者的主要治療手段[7-8]。但部分患者因驅動基因陰性或對治療反應性差,長期預后仍不理想[9]。如何為此類患者提供更有效的治療策略,成為亟待解決的問題。既往研究[10–12]表明,對于早期肺癌或局限性肺內轉移患者,肺移植后生存率與良性肺病肺移植受者相當。然而,移植后腫瘤復發風險和免疫抑制治療的潛在影響,仍是限制其廣泛應用的關鍵問題。
1 肺癌肺移植的發展
肺移植治療肺癌歷史悠久。1963年,James Hardy為1例左側中央型肺癌并伴嚴重慢性肺病的患者實施單肺移植,盡管患者因術后早期腎功能衰竭去世,但此舉開啟了肺移植治療肺癌的先河[13]。
早期研究主要集中于支氣管肺泡癌(bronchoalveolar carcinoma,BAC),這是一種起源于細支氣管或肺泡上皮的惡性腫瘤。BAC患者傳統治療效果有限,其晚期患者接受手術治療的5年生存率僅為34%,EGFR靶向藥物Gefitinib治療的3年生存率僅為20%~30% [14–17]。在此背景下,肺移植逐漸成為BAC患者的重要治療選擇之一。1999年,Garver等[18]報道7例晚期BAC患者的2年無病生存率(disease-free survival,DFS)為71.4%,中位復發時間為39個月。2003年,Zorn等[19]報道了9例BAC患者的研究,3年總體生存率(overall survival,OS)和DFS分別為66.7%和55.6%,中位復發時間為19.5個月。2004年,De Perrot等[10]的研究納入了26例因BAC接受肺移植治療的患者,5年無復發生存率為35%,5年OS為39%,中位復發時間為12個月。2010年,Ahmad等[11]基于美國器官共享聯合網絡(United Network for Organ Sharing,UNOS)數據庫的分析表明,1987至2010年間因BAC接受肺移植的患者,其5年生存率與總體肺移植受者人群相當(57% vs. 50%,P=0.66)。總體來看,盡管肺移植治療BAC術后存在復發風險,但生存率與總體肺移植人群相近,表明肺移植可成為BAC患者的潛在治療選擇。
近年來,肺移植治療的研究方向逐漸擴展至其他類型的肺癌。2024年,美國西北大學的Ankit Bharat報道了1例ⅣA期侵襲性黏液性腺癌(invasive mucinous adenocarcinoma,IMA)患者,該患者常規化療及免疫治療均無效,最終通過體外循環下行雙肺移植治療。術后隨訪顯示,患者的CT影像及循環腫瘤DNA(circulating tumor DNA,ctDNA)均未提示腫瘤復發[20]。這一病例首次提出,體外循環下雙肺移植可能為晚期肺內轉移腫瘤患者提供一種潛在的治療選擇。基于此,美國西北大學肺移植中心啟動了一項前瞻性臨床隊列研究(Double lung transplant REgistry Aimed for lung-limited Malignancies,DREAM)(NCT05671887),旨在評估肺移植對綜合治療無效的原發性或轉移性肺部腫瘤患者的療效[21]。DREAM研究特別設計了合并良性肺病的腫瘤患者行肺移植治療的分組。因為既往研究[22–26]表明,這些患者接受常規治療可能導致肺功能進一步惡化,甚至引發呼吸衰竭。DREAM研究的初步結果顯示,在6例IVA期肺癌肺移植患者中,5例術后無復發并存活,1例在術后18個月時出現肺部1 cm的實性結節[27]。結果提示,對于局限于雙肺的晚期腫瘤患者,尤其是常規治療無效或無法耐受者,肺移植可能成為一種重要的治療手段[28]。
目前國際心臟和肺移植學會(International Society for Heart and Lung Transplantation,ISHLT)專家共識將肺移植治療肺癌的適應證嚴格限定為原位腺癌、微浸潤肺腺癌(minimally invasive adenocarcinoma,MIA)以及貼壁生長型腺癌(lepidic predominant adenocarcinoma,LPA)等肺內局限惡性腫瘤。目前接受肺移植治療肺癌患者數量較少,僅占肺移植病例的0.1%[29]。隨著DREAM研究的開展和肺移植技術的不斷完善,未來肺移植適應證有望從肺內局限惡性腫瘤擴展到更多類型的晚期肺癌患者。
2 肺癌肺移植受者管理
器官移植在惡性腫瘤治療中具有重要意義,通過移除受累器官可實現病灶清除和器官功能恢復。然而,移植術后長期免疫抑制治療顯著增加了新發或復發腫瘤的風險[30–32]。以肝癌肝移植為例,盡管術前通過嚴格的適應證評估(如Milan標準)并實施規范化的術后管理,術后5年復發率仍達10%~20%[33]。肝癌肝移植與肺癌肺移植同屬于器官移植治療惡性腫瘤的范疇,但目前肺癌肺移植相關研究仍較為有限,尚未形成統一的管理策略。在肝癌肝移植領域,術前適應證評估、圍手術期治療及術后隨訪管理等方面已積累了較為成熟的經驗。這些經驗對肺癌肺移植的臨床管理具有重要的借鑒意義,尤其是在制定適應證、優化圍手術期治療及長期隨訪策略方面,可為未來的研究和實踐提供重要參考。
2.1 肺癌肺移植術前評估
晚期肺癌移植受者的預后顯著差于早期肺癌患者[12]。多項研究[12,34-35]表明,自體肺肺癌患者可能伴隨胸腔內淋巴結或遠處器官轉移。在此背景下,術前腫瘤評估對于預測復發風險、指導圍手術期治療及選擇合適的治療策略具有重要意義。胸部計算機斷層掃描(computer tomography,CT)、全身正電子發射斷層顯像-計算機斷層掃描(positron emission tomography computer tomography,PET-CT)、ctDNA等檢查可明確腫瘤的大小、性質以及是否存在局部或遠處轉移,從而綜合評估腫瘤的分期、選擇合適的治療方案(圖1)。
 圖1
肺癌肺移植受者管理流程
圖1
肺癌肺移植受者管理流程
PET-CT通過檢測放射性示蹤劑在體內的代謝活動,識別高代謝的腫瘤及其轉移灶,從而幫助識別、定位和監測腫瘤,是評估腫瘤性質和分期的重要輔助工具。基于肝癌肝移植的研究[36]發現,聯合術前PET-CT與腫瘤標志物檢測對預測移植后腫瘤復發具有重要價值。術前胸部CT存在漏診肺癌的風險,PET-CT可及時檢出淋巴結甚至遠處器官轉移[12,34-35]。在器官移植治療惡性腫瘤術前評估中,若PET-CT提示遠處器官或淋巴結轉移,則術后復發風險較高[37]。此類患者可先接受抗腫瘤綜合治療,待腫瘤降級且復發風險降低后,再考慮行移植手術[38]。
ctDNA是指從腫瘤細胞釋放到血液中的DNA片段,可用于無創監測腫瘤負荷和檢測微小殘留病灶,對腫瘤診斷具有較高的敏感性。Huang等[39]的前瞻性隊列研究發現,術前ctDNA檢測陽性的肝癌患者在接受肝臟移植后,其無復發生存時間顯著短于術前ctDNA檢測陰性的患者,移植前低ctDNA水平與較低的移植后腫瘤復發風險相關。盡管該研究以肝癌肝移植為研究對象,其結果提示ctDNA作為術前評估指標的潛力,亦可為肺癌肺移植的術前評估提供重要參考。在肺癌患者中,ctDNA不僅是肺癌早期轉移的重要生物標志物,還在抗腫瘤治療療效監測和復發風險預測中具有重要價值[40–43]。基于此,未來應進一步開展研究,探索ctDNA在肺癌肺移植術后復發預測中的具體作用,以優化術后管理策略并提高患者的長期生存率。
2.2 肺癌肺移植圍手術期治療
免疫治療和靶向治療等抗腫瘤療法在降低惡性腫瘤器官移植受者術后復發風險、提高患者生存率中發揮重要作用[38]。
免疫治療利用免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)阻斷T細胞抑制信號通路,促進T細胞激活,誘導調節T細胞(regulatory T cell,Treg)凋亡,增強免疫系統對腫瘤抗原的反應強度[44–46]。對于腫瘤晚期或存在多灶轉移的患者,移植前免疫治療可控制腫瘤進展,期望實現腫瘤降級,降低腫瘤轉移風險[47-48]。但與此同時,ICIs也會促進免疫細胞對移植物的殺傷。盡管器官移植術后應用免疫抑制藥物抑制T細胞免疫活性。移植前接受免疫治療的患者仍可能因供體人類白細胞抗原(human leukocyte antigen,HLA)免疫反應增強而面臨更高的早期排斥風險[48]。因此,在器官移植治療惡性腫瘤中,平衡免疫治療的抗腫瘤效應與其促排斥的潛在風險至關重要。研究表明,在肝癌肝移植術前免疫治療中,延長免疫治療與移植之間的間隔時間,可有效降低術后急性排斥反應的風險[48-49]。目前,針對肺癌肺移植受者的免疫治療研究仍較為有限,其適應證、藥物選擇及與移植的最佳時間間隔等關鍵問題有待進一步探索。
表皮生長因子受體(epidermal growth factor receptor,EGFR)、鼠肉瘤病毒癌基因同源物(kirsten rat sarcoma viral oncogene homolog,KRAS)、間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、ROS原癌基因1(ros oncogene 1,ROS1)等是主要的肺癌驅動基因突變,均有對應的靶向治療藥物[50]。移植前靶向治療可縮小受者腫瘤病灶,降低遠處轉移風險[38,51]。移植后輔助靶向治療可能降低惡性腫瘤復發風險,并延長復發患者的生存時間[52–54]。然而靶向治療對移植器官排斥的影響尚不明確[55-56]。盡管目前尚無針對肺癌肺移植受者的靶向治療研究,但對于驅動基因陽性肺癌患者,靶向治療或可作為移植前后抗腫瘤治療的重要組成部分。未來研究應進一步探討靶向治療藥物對肺癌肺移植預后的影響,為驅動基因陽性肺癌患者的移植治療策略提供重要依據,并有望改善患者的長期生存預后。
肺癌肺移植需嚴格遵循無瘤原則,以最大限度降低術中及術后腫瘤播散和復發的風險。移植前預先建立體外循環(cardiopulmonary bypass,CPB)阻斷病肺循環,術中依據術前腫瘤分期指導清掃引流淋巴結[20]。術中操作應依據術前腫瘤分期,嚴格按照無瘤原則進行,包括徹底清掃引流淋巴結等[57]。術后需對切除的腫瘤組織及引流淋巴結進行病理檢查和驅動基因檢測,明確術后病理分期,并為后續的綜合治療提供精準指導。
2.3 肺癌肺移植術后隨訪
術后密切隨訪和監測復發性惡性腫瘤的發生情況,并及時采取有效治療措施,是提高肺移植患者遠期生存率的關鍵。
Ahmad和Spies等對自體肺病理診斷為肺癌的肺移植受者進行了隨訪,其術后中位腫瘤復發時間分別為14個月和13個月[12,35]。非局限性肺癌(Ⅱ~Ⅳ期)肺移植受者的總體生存預后顯著差于局限性肺癌患者[12,34]。除了復發腫瘤,肺移植術后原發腫瘤也是肺移植術后腫瘤的主要因素,肺移植受者的肺癌年發病率和死亡率分別為626.4/10萬和 470.3/10萬[58-59]。單肺移植受者術后新發肺癌多見于自體肺,其肺癌發生率是普通人群的13倍,而COPD和ILD等原發病是重要危險因素[60-61]。
針對肺移植術后肺癌的治療,當前主要包括肺癌根治術、二次肺移植及綜合治療等。對于單肺移植受者,若自體肺局限性腫瘤明確,肺癌根治術或自體肺側單肺移植可能是可行的治療選擇。然而,關于這兩種治療方案的優劣及其臨床獲益,目前尚無明確共識。對于原發病為支氣管擴張或矽肺的患者,由于自體肺感染和腫瘤風險較高,治療策略需根據患者具體情況權衡衡[62-64]。對于雙肺移植受者,應依據腫瘤的分級和分期選擇適合的治療方案,如肺癌根治術或綜合治療。若移植肺功能嚴重受損,二次雙肺移植可能是可行的選擇[65]。對于失去手術機會的患者,則需結合具體情況采用免疫治療、放化療及其他綜合治療方案。然而,目前針對肺移植術后肺癌復發的治療尚無明確的指導方案,亟需進一步研究與探索,以優化治療策略并改善患者預后。
3 小結
肺移植作為一種潛在治療方式,或可為局限于肺內轉移及嚴重肺功能損害的患者提供新選擇。借鑒肝移植在肝癌治療中的成功經驗,肺癌肺移植中展現出廣闊應用前景。未來研究應聚焦術前評估技術(如PET-CT和ctDNA)的精準化,優化圍手術期免疫與靶向治療策略,并完善術后復發監測體系,以提升長期療效并改善患者預后。
利益沖突:無。
作者貢獻:譚景洪負責論文初稿撰寫,程超、陳靜瑜對論文進行審閱。