版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌是我國發病率和死亡率最高的惡性腫瘤[1],也是全球范圍內腫瘤相關死亡率最高的惡性腫瘤[2]。病理學證據是診斷肺癌的“金標準”。經支氣管鏡活檢[3]是獲取肺小結節病理的重要方法,其借助內窺鏡及活檢器械,經自然腔道獲取病灶組織,具有微創、安全、可視等優勢,但是對于肺周病變仍存在路徑丟失、可達性不足、假陰性率高等問題。
支氣管鏡手術導航是解決上述臨床瓶頸行之有效的方案[3]。Herth等[4]發明了一種支氣管鏡下經肺實質結節抵達術,其利用手術導航系統識別遠端病灶和制定術前路徑,并在氣道壁開孔建立到達病灶的通道,以獲取病灶組織。要實現該過程,首先要構建肺部組織的三維(three-dimensional,3D)地圖,其中肺動脈血管的精準分割是關鍵步驟[5]。
肺動脈血管具有復雜的拓撲結構,且與周圍組織呈現緊密的毗鄰關系,肺部疾病常對血管解剖結構產生影響[6],導致肺動脈血管分割具有挑戰性[6-7]。傳統分割方法[8-10]依賴人工判斷,工作量大且嚴重依賴醫師主觀經驗。憑借自動從大量數據中學習目標特征,以端到端的模式獲得預測結果,深度學習驅動的方法得到廣泛應用[11-12]。一個經典的分割范式是U-Net[13-14],這是一種基于U型編碼器-解碼器架構的卷積神經網絡,可以實現準確的特征提取及融合,已經廣泛應用于醫學圖像分割任務。在此基礎上,?i?ek等[15]開發了3D U-Net,實現目標組織的3D分割。Lee等[16]利用3D U-Net增強肺動脈和主動脈與其他結構的對比度,設計級聯的卷積神經網絡分割肺動脈和主動脈。針對肺動脈血管結構復雜、管壁邊界模糊、尺寸差異大等典型特征,本文提出了一種基于形狀和位置先驗的肺動脈分割方法,以優化肺動脈血管的分割。
1 資料與方法
1.1 數據集及數據處理
研究使用的數據來源于公開數據庫(PARSE 2022)[17],數據信息內不含患者個人信息資料。納入標準:可獲得完整影像學資料,包括胸部CT肺窗及縱隔窗;數據為公開可使用資料。排除標準:數據資料損壞或格式異常。注釋工作由10名具有5年以上臨床經驗的專家參與,共分為2組,每組由5名專家進行數據標注。在數據處理過程中,調整窗寬和窗位以清晰顯示肺動脈結構;其次,對標注點進行迭代和人工選取得到粗掩碼結果,所有專家對肺動脈的掩碼結果進行微調,并相互檢查標注;最后,采用投票方式對每次掃描的5個注釋進行合并。每張圖像包含不同數量的切片,厚度為1.0 mm,所有切片的軸向尺寸為512×512像素,空間分辨率為0.500~0.950 mm/像素。將患者影像數據分為3組:訓練集、測試集、驗證集。
1.2 網絡結構設計
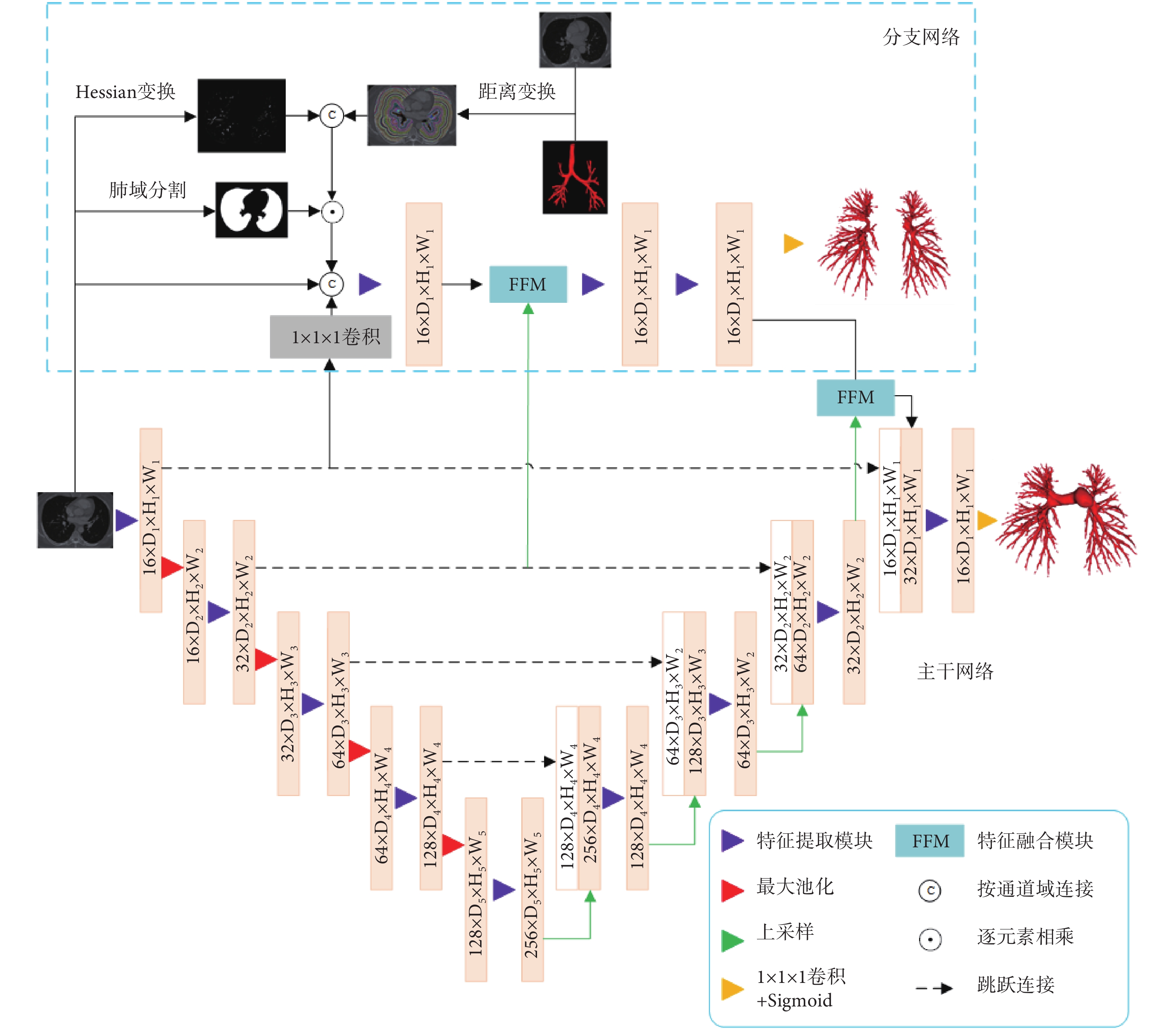
基于肺部動脈形狀位置先驗知識,雖然其拓撲結構復雜,分支結構規律性較弱,但肺部動脈通常伴行于氣道,且動脈與氣道的距離相對靜脈與氣道的距離更近。根據這一特點,可以利用氣道位置獲得肺動脈在CT圖像中的位置分布(圖1)。通過海森(Hessian)矩陣[18](Hessian矩陣公式見附件)對多個尺度圖像進行增強,獲得CT圖像中的管狀結構,聯合氣道位置信息,提高模型對肺內血管的檢出率。
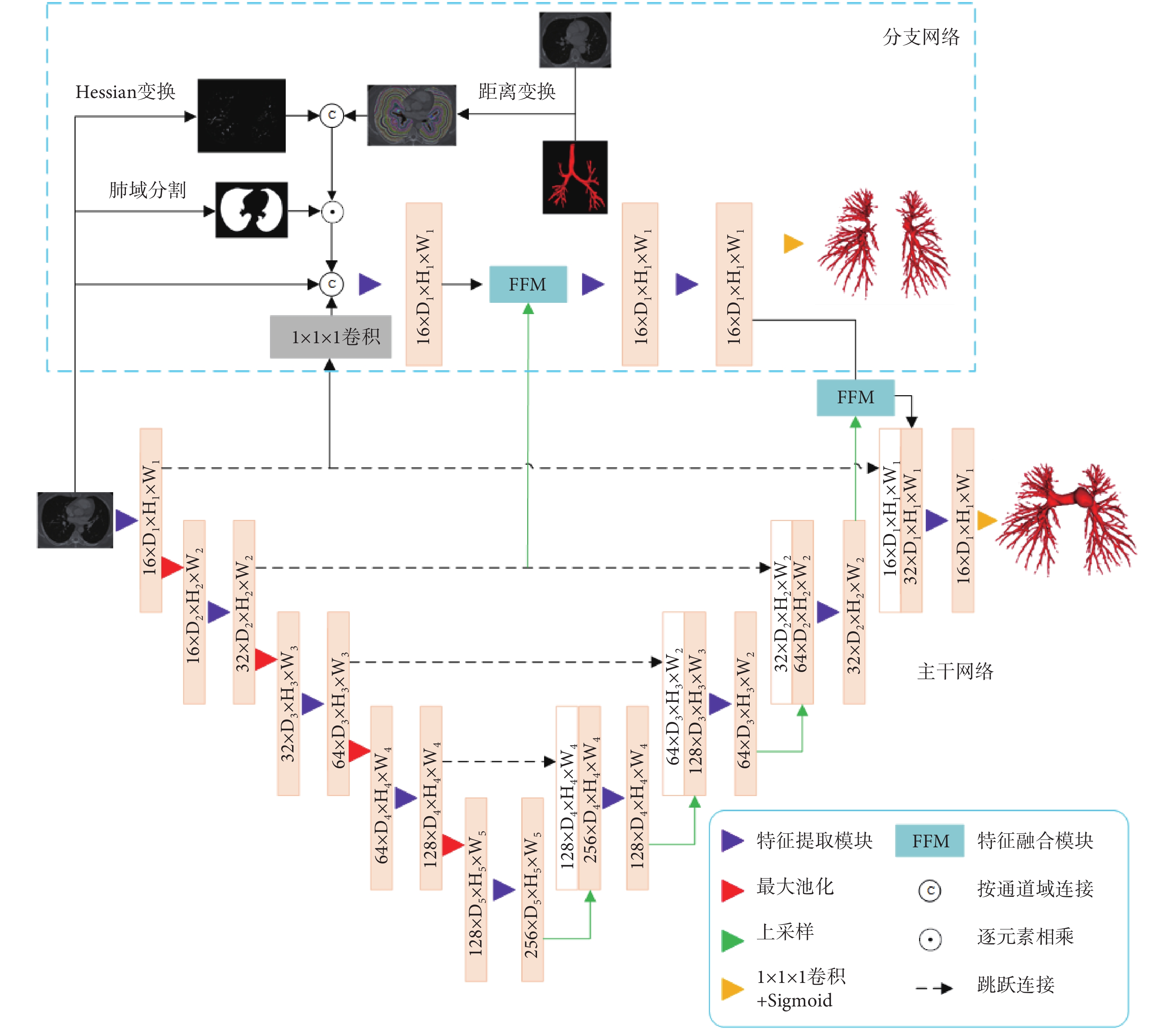 圖1
肺部動脈分割網絡結構圖
圖1
肺部動脈分割網絡結構圖
1.3 特征提取模塊
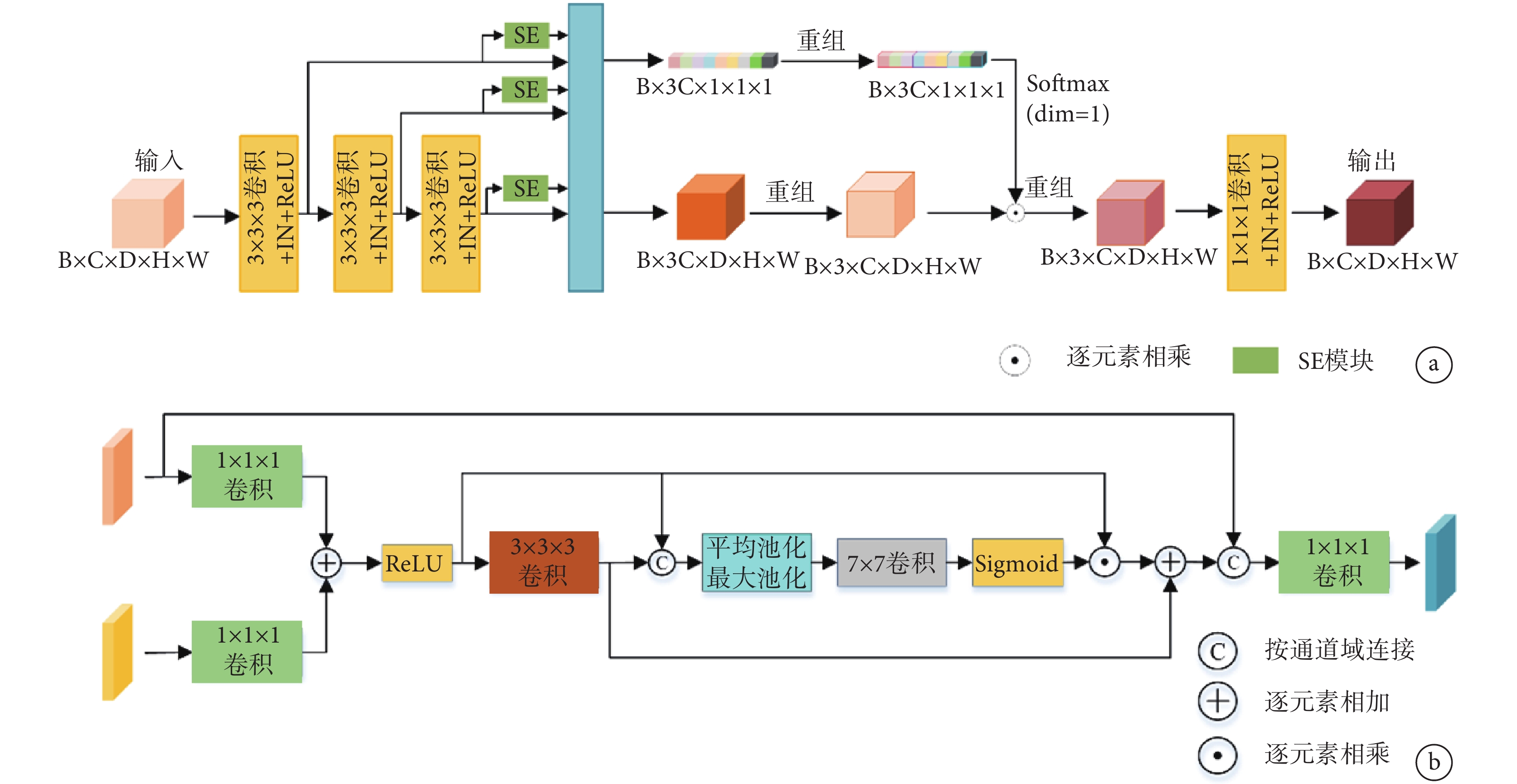
針對肺動脈的多尺度特征設計了特征提取模塊,該模塊由特征提取和特征增強兩部分組成(圖2a)。具體地,其采用深度卷積網絡結構并通過3個3×3×3的卷積塊提取深層特征,同時利用跳躍連接機制整合不同層次的特征信息,最后通過1×1×1卷積融合加權后的不同尺度特征圖。這種結構可以保留豐富的上下文信息,同時有效捕捉肺動脈的細節特征。
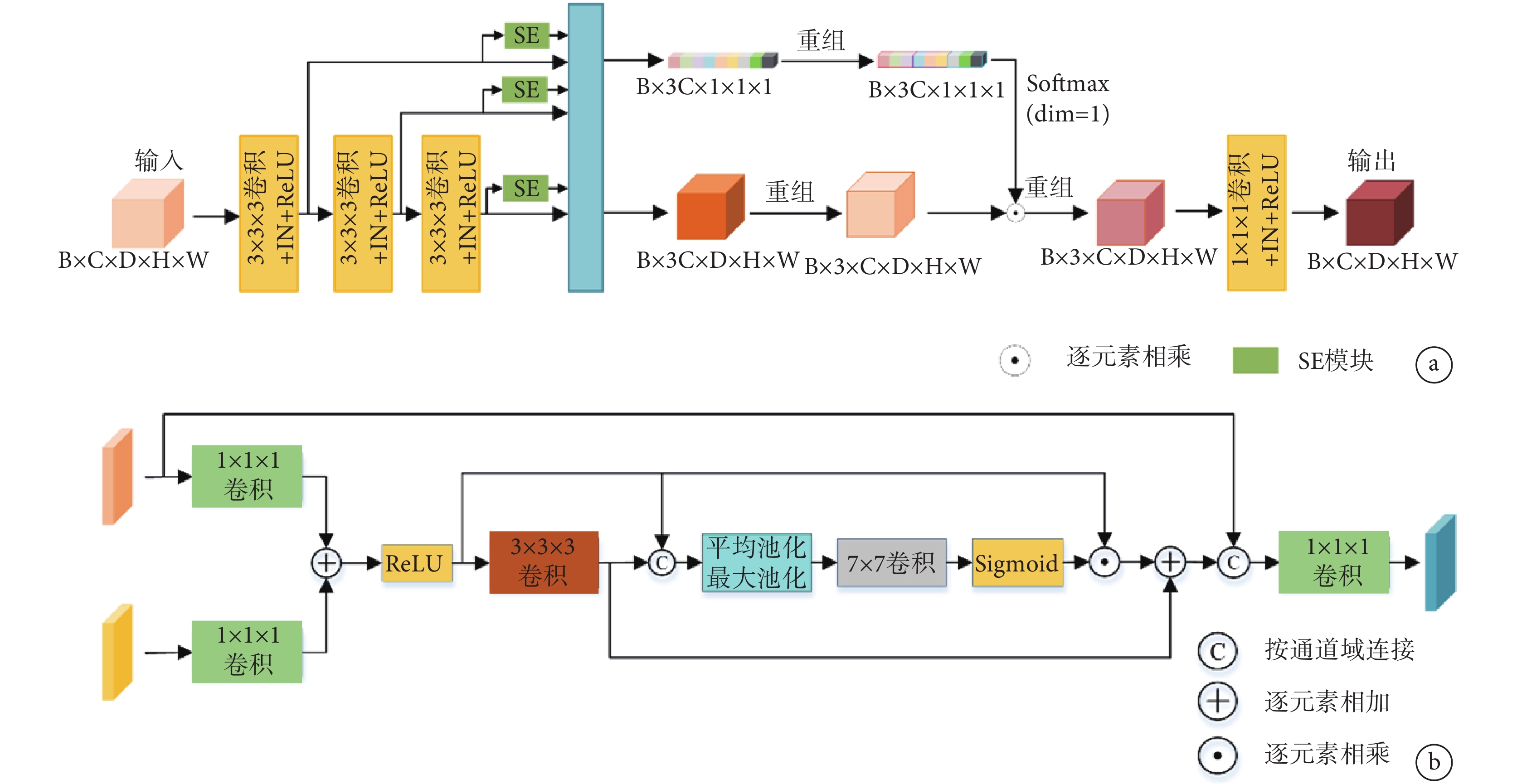 圖2
網絡結構設計
圖2
網絡結構設計
a:特征提取模塊;b:特征融合模塊
1.4 特征融合模塊
特征融合模塊負責實現主干網絡與分支網絡之間的特征信息交流,該模塊包括分支網絡中的特征融合模塊和主干網絡中的特征融合模塊兩個部分(圖2b)。兩個網絡中的特征經過1×1×1卷積調整通道后進行逐元素相加,達到增強感興趣區域的目的,同時互相補充雙方缺失的特征信息。隨后使用3×3×3卷積提取初步融合特征中更具有表征能力的關鍵特征,并與初步融合特征按通道連接。其次,使用空間注意力機制更加精細地篩選目標特征,減少特征初步融合時的噪聲信息。最終,根據融合后的特征用途,將其與對應網絡的特征圖按通道連接,實現多尺度特征的整合。
1.5 對比實驗
為驗證構建網絡模型的分割性能,在相同實驗環境下復現了Wu等[19]提出的基于Transformer的肺血管分割網絡。此外,構建的分割模型與既往研究的3D U-Net、注意力門控網絡(AG U-Net)[20]和V-Net[21]這3種常用醫學圖像分割網絡進行對比。
1.6 評價指標
在訓練過程中,使用Dice Loss函數進行模型訓練,采用Adam優化器進行參數更新。為評估所提模型的性能,選擇Dice相似系數(DSC)、靈敏度和精度評估分割精度,使用豪斯多夫距離(HD95)衡量兩個集合之間的最大距離[22],采用最大類間方差法(Otsu’s method)[18]提取肺部掩碼圖像。數據資料中的計量資料使用均數±標準差(x±s)表示。數據標注使用Mimics軟件(Materialise Mimics,v21.0,Belgium)。
2 結果
2.1 數據預處理
共納入203例患者的肺動脈影像數據,其中訓練集100例,驗證集30例,測試集73例。實驗數據預處理分為4個步驟:掩碼獲取、血管增強、結構變換和數據增強。(1)肺部掩碼圖像獲取:肺動脈與體循環動脈在形態上具有巨大差異,采用肺部掩碼圖像提高肺內血管結構提取效率。肺部區域被標記為白色(值設為1),而非肺部區域則被標記為黑色(值設為0)。使用最大類間方差法及形態學操作提取肺部掩碼圖像。(2)基于Hessian矩陣的血管增強:在CT圖像中,血管通常呈實心的管狀結構,因此處理時通過Hessian矩陣的特征值設計針對管狀結構的濾波器,以獲得圖像中血管的形態結構和相對位置。使用Frangi算法通過Hessian矩陣的特征值對管狀結構進行增強,用于突出血管、組織邊界等重要特征,從而提高模型對肺內血管的檢出率。(3)距離變換:為減少氣道壁對血管結構的影響,在進行血管增強后,對提取的氣道掩碼進行形態學膨脹操作。隨后對分割的氣道進行歐氏距離變換,獲得每個體積元素到氣道的最近距離,然后與肺部掩碼圖像相乘,獲得針對肺內組織的距離圖。(4)數據增強:為增加數據量及提高模型的泛化性能,對圖像塊應用隨機剛性變換和隨機彈性變換,剛性變換包括:在3個方向上的隨機翻轉、0.8~1.2范圍內的隨機縮放、最大10度的隨機3D旋轉(模型構建運行的條件及公式見附件)。
2.2 對比實驗
實驗結果顯示,本研究構建的模型在整體分割性能上表現良好,HD95達9.52 mm,相比文獻[19]中的最小值還要短6.05 mm,證明模型在分割邊界上具有優秀的表現。在為手術導航系統制定手術路線時,可最大程度降低手術路徑穿過肺部動脈的風險。此外,模型的DSC和靈敏度也是最優的,而精度僅次于AG U-Net [20]。AG U-Net模型雖然有最高的分割精度,但靈敏度最低,在手術導航時,其分割結果無法為導航系統提供足夠完整的動脈分布。而本模型相對AG U-Net模型在精度上降低了2.24%,但靈敏度上提高了8.5%,更完整的動脈分布可以大大降低手術路徑穿過動脈的概率(表1)。
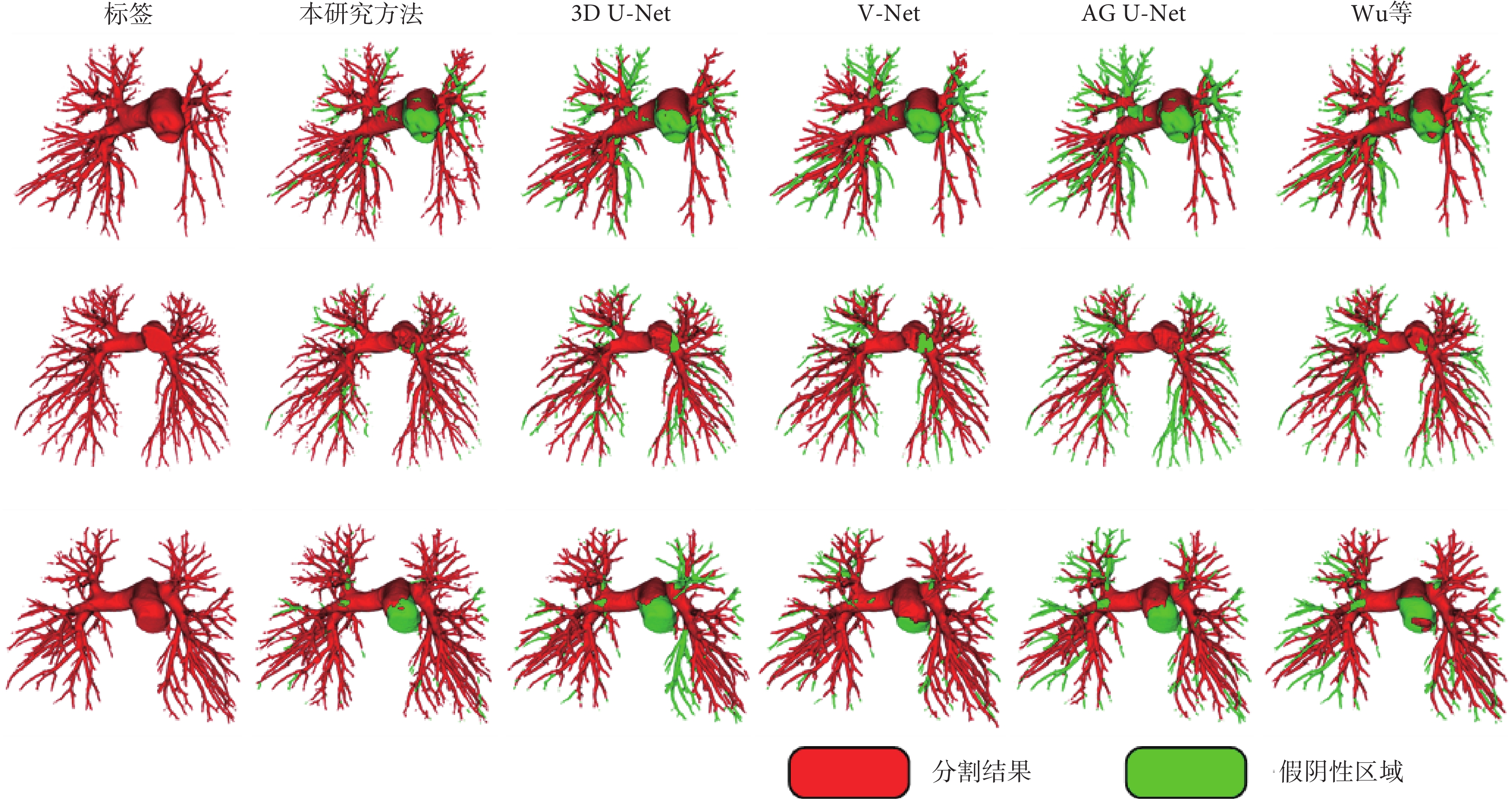
不同方法分割結果的3D可視化結果顯示,本研究分割結果中血管結構相對更完整,尤其是肺內血管結構,可識別大部分的肺內血管結構。AG U-Net的分割精度最高,但靈敏度最差(圖3)。
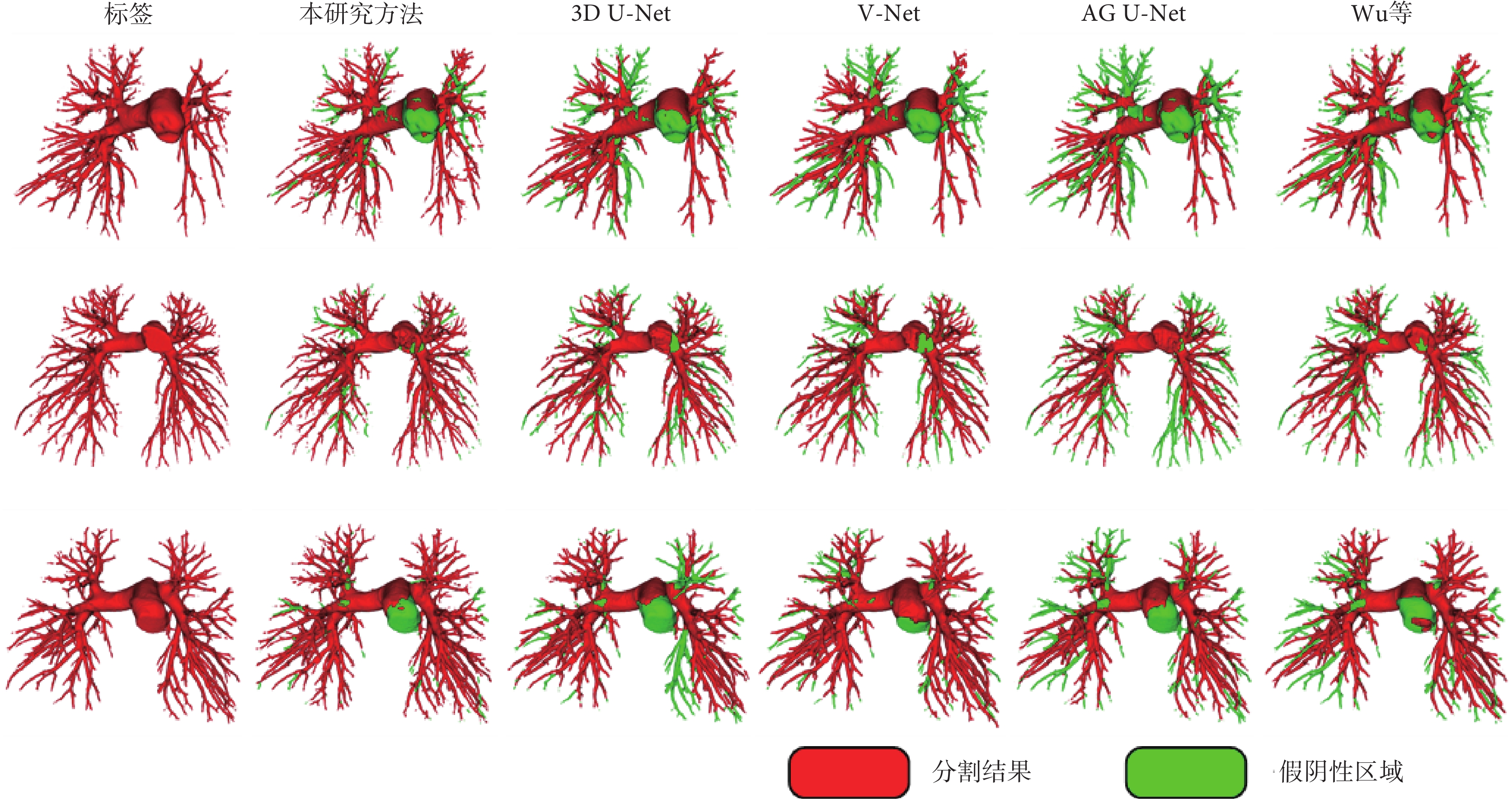 圖3
不同方法的肺部動脈分割結果的三維可視化
圖3
不同方法的肺部動脈分割結果的三維可視化
紅色區域表示模型的分割結果,綠色區域表示假陰性區域
2.3 消融實驗
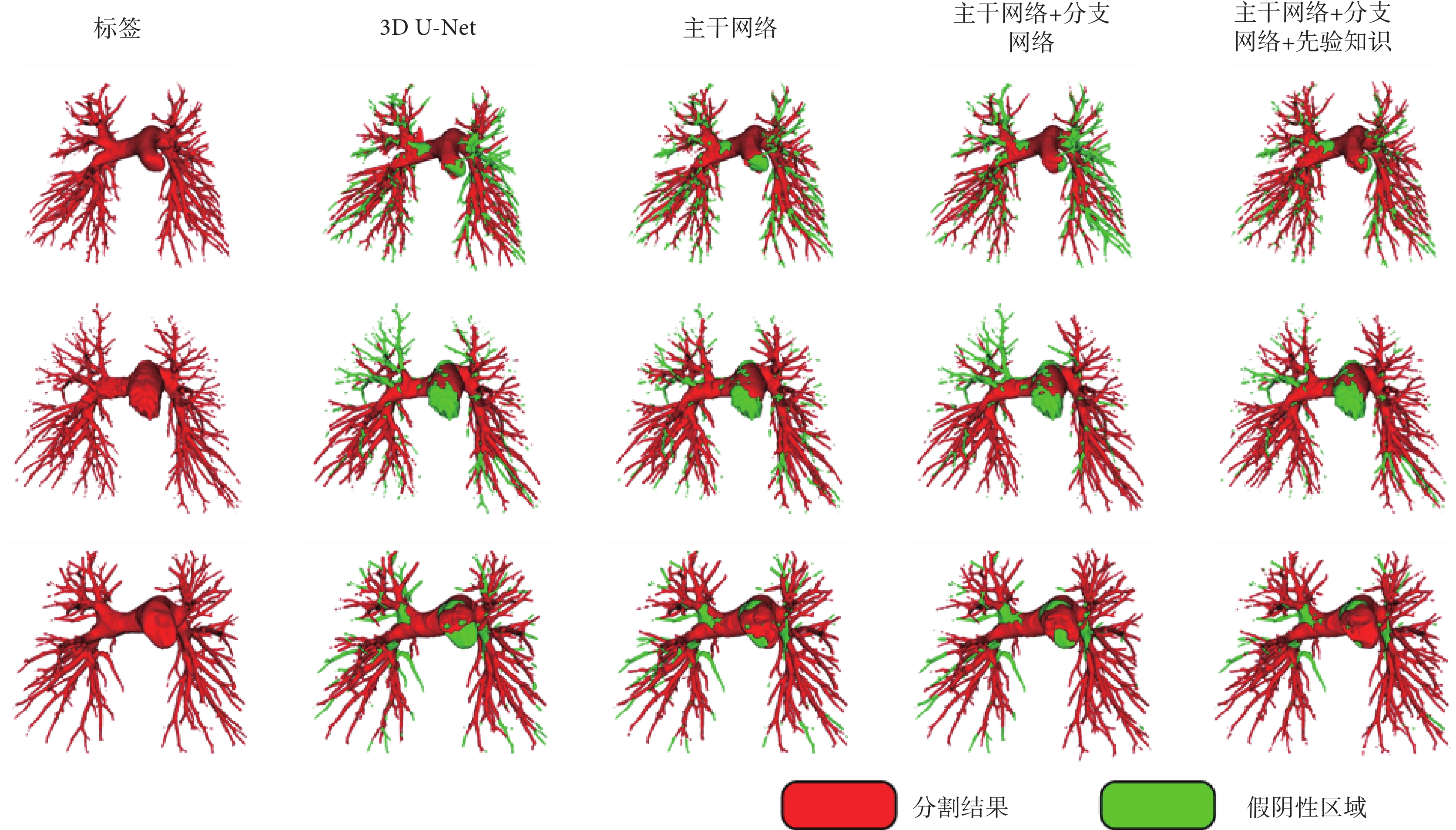
為評估構建的網絡結構及先驗知識的有效性,本研究設計了消融實驗,將測試模型分為4種,分別為(1)3D U-Net:基準網絡;(2)主干網絡:將基準網絡中的卷積塊替換為特征提取模塊;(3)主干網絡+分支網絡:在主干網絡上加入分支網絡;(4)主干網絡+分支網絡+先驗知識:在分支網絡中加入血管的先驗知識。
3D可視化建模(圖4)及測試結果(表2)顯示,加入分支網絡可以大幅度提高模型的性能,尤其是模型的精度。分支網絡提取的肺內血管特征可以補充主干網絡中缺失的特征信息,并加強主干網絡中的肺內血管特征。加入先驗知識后,分支網絡可以直接獲得肺內管狀結構特征及相對氣道的位置信息,更好地識別動脈的結構特征,提高動脈的識別能力。當分支網絡+先驗知識與主干網絡融合時,分支網絡可以提供更多的血管結構特征,從而提高模型的靈敏度。
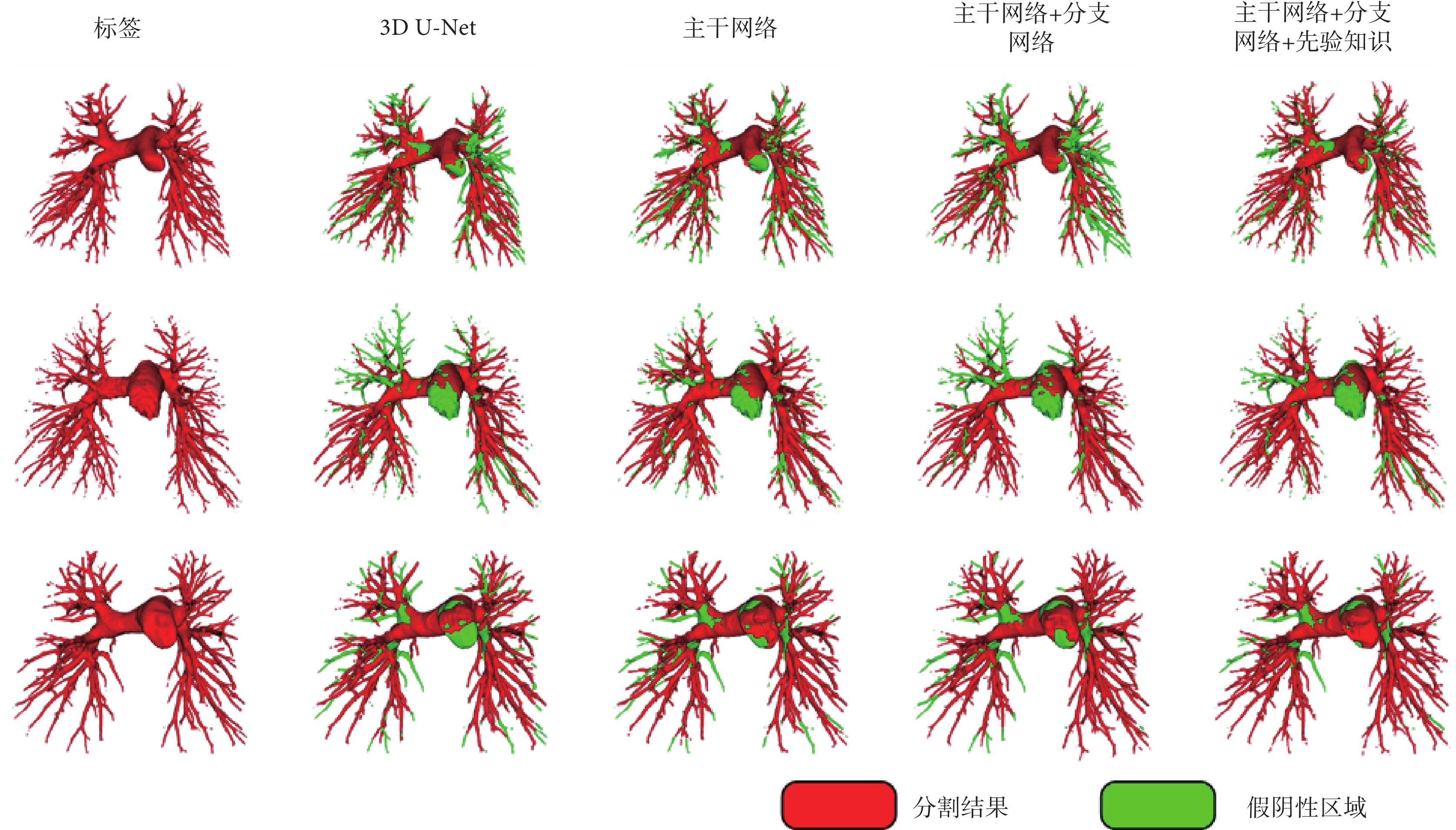 圖4
不同配置網絡的肺部動脈分割結果的三維可視化
圖4
不同配置網絡的肺部動脈分割結果的三維可視化
3 討論
本研究構建了一種基于3D U-Net的肺動脈分割模型,其融合了肺動脈的形狀和位置先驗知識,顯著提高了肺動脈分割的準確性和效率。肺動脈分割的準確性對于術前規劃和術中導航至關重要,因為肺動脈與周圍組織在醫學圖像上具有復雜性和相似性,傳統分割方法常導致結構間的混淆,深度學習模型能通過減少人工手動標注從而提高不同數據集間結果的一致性,達到提高醫學影像分割的效果[23]。
本研究創新性地融合了肺動脈的形狀和位置先驗知識,并采用DSC、靈敏度、精度和HD95作為評估指標,綜合評估模型的性能。先驗知識的應用可顯著提高深度學習模型在醫學影像分割任務中的性能[24]。形狀先驗幫助模型識別肺動脈的管狀結構,而位置先驗則利用了肺動脈與氣道的相對位置關系,這兩者的結合使得模型能夠更準確地區分動脈和靜脈,以及識別出較小的動脈分支,這種融合先驗知識的方法可以減少模型對大量標注數據的依賴。我們使用分支網絡專注于提取肺實質內肺動脈的特征,而主干網絡處理較大的動脈結構。Wu等[25]也曾提出這種雙網絡結構,這種新穎的構建對血管結構有更細致的處理,能提高模型在分割復雜血管網絡中的性能。
在模型構建中使用了特征提取模塊和特征融合模塊的設計,能更好地處理肺動脈的多尺度特征和復雜結構。特征提取模塊通過跳躍連接和不同尺寸的特征圖按通道連接,捕獲了不同尺度的特征信息。特征融合模塊則通過1×1×1卷積調整通道后進行特征相加,加強了感興趣區域的特征,同時互相補充雙方缺失的特征信息,實現了兩個網絡特征的初步融合。這不僅提高了模型的靈敏度,還增強了模型對肺動脈特征的識別能力,能夠顯著降低手術路徑與動脈相交的概率。
盡管本研究取得了積極的結果,但仍有進一步改進和擴展空間。在后續研究中,可以通過集成更多的先驗知識(如肺動脈的紋理信息和方向信息)進一步提高模型的性能;其次,可以探索模型在不同分辨率和不同質量CT圖像上的表現,以評估其在實際臨床環境中的適用性。此外,考慮將本模型與其他類型的醫學影像分割任務相結合,如肺結節檢測和肺腫瘤分割,以驗證其廣泛的適用性。本文提出了一種基于形狀和位置先驗的肺動脈分割方法,實現肺部動脈血管精確分割,在手術導航等場景具有潛在的應用價值,尤其是機器人輔助手術導航領域。該分割方法為機器人支氣管鏡下肺結節活檢的自動導航系統提供了更精確的肺動脈結構信息,有助于更好地規劃手術路線,避免損傷重要血管結構,從而減少術中出血和術后并發癥風險。該研究將深度學習技術與手術導航臨床需求相結合,為未來更多人工智能技術在胸外科領域的應用提供了案例。
利益沖突:無。
作者貢獻:郭超負責論文設計及文章修改;高雪涵、胡啟迪負責論文設計,數據處理,模型構建,文章撰寫及修改;李健、朱海星、趙珂負責數據收集、處理,模型構建;劉衛朋和李單青負責論文設計,文章審核、修改及潤色。
本文附件見本刊網站電子版。
肺癌是我國發病率和死亡率最高的惡性腫瘤[1],也是全球范圍內腫瘤相關死亡率最高的惡性腫瘤[2]。病理學證據是診斷肺癌的“金標準”。經支氣管鏡活檢[3]是獲取肺小結節病理的重要方法,其借助內窺鏡及活檢器械,經自然腔道獲取病灶組織,具有微創、安全、可視等優勢,但是對于肺周病變仍存在路徑丟失、可達性不足、假陰性率高等問題。
支氣管鏡手術導航是解決上述臨床瓶頸行之有效的方案[3]。Herth等[4]發明了一種支氣管鏡下經肺實質結節抵達術,其利用手術導航系統識別遠端病灶和制定術前路徑,并在氣道壁開孔建立到達病灶的通道,以獲取病灶組織。要實現該過程,首先要構建肺部組織的三維(three-dimensional,3D)地圖,其中肺動脈血管的精準分割是關鍵步驟[5]。
肺動脈血管具有復雜的拓撲結構,且與周圍組織呈現緊密的毗鄰關系,肺部疾病常對血管解剖結構產生影響[6],導致肺動脈血管分割具有挑戰性[6-7]。傳統分割方法[8-10]依賴人工判斷,工作量大且嚴重依賴醫師主觀經驗。憑借自動從大量數據中學習目標特征,以端到端的模式獲得預測結果,深度學習驅動的方法得到廣泛應用[11-12]。一個經典的分割范式是U-Net[13-14],這是一種基于U型編碼器-解碼器架構的卷積神經網絡,可以實現準確的特征提取及融合,已經廣泛應用于醫學圖像分割任務。在此基礎上,?i?ek等[15]開發了3D U-Net,實現目標組織的3D分割。Lee等[16]利用3D U-Net增強肺動脈和主動脈與其他結構的對比度,設計級聯的卷積神經網絡分割肺動脈和主動脈。針對肺動脈血管結構復雜、管壁邊界模糊、尺寸差異大等典型特征,本文提出了一種基于形狀和位置先驗的肺動脈分割方法,以優化肺動脈血管的分割。
1 資料與方法
1.1 數據集及數據處理
研究使用的數據來源于公開數據庫(PARSE 2022)[17],數據信息內不含患者個人信息資料。納入標準:可獲得完整影像學資料,包括胸部CT肺窗及縱隔窗;數據為公開可使用資料。排除標準:數據資料損壞或格式異常。注釋工作由10名具有5年以上臨床經驗的專家參與,共分為2組,每組由5名專家進行數據標注。在數據處理過程中,調整窗寬和窗位以清晰顯示肺動脈結構;其次,對標注點進行迭代和人工選取得到粗掩碼結果,所有專家對肺動脈的掩碼結果進行微調,并相互檢查標注;最后,采用投票方式對每次掃描的5個注釋進行合并。每張圖像包含不同數量的切片,厚度為1.0 mm,所有切片的軸向尺寸為512×512像素,空間分辨率為0.500~0.950 mm/像素。將患者影像數據分為3組:訓練集、測試集、驗證集。
1.2 網絡結構設計
基于肺部動脈形狀位置先驗知識,雖然其拓撲結構復雜,分支結構規律性較弱,但肺部動脈通常伴行于氣道,且動脈與氣道的距離相對靜脈與氣道的距離更近。根據這一特點,可以利用氣道位置獲得肺動脈在CT圖像中的位置分布(圖1)。通過海森(Hessian)矩陣[18](Hessian矩陣公式見附件)對多個尺度圖像進行增強,獲得CT圖像中的管狀結構,聯合氣道位置信息,提高模型對肺內血管的檢出率。
 圖1
肺部動脈分割網絡結構圖
圖1
肺部動脈分割網絡結構圖
1.3 特征提取模塊
針對肺動脈的多尺度特征設計了特征提取模塊,該模塊由特征提取和特征增強兩部分組成(圖2a)。具體地,其采用深度卷積網絡結構并通過3個3×3×3的卷積塊提取深層特征,同時利用跳躍連接機制整合不同層次的特征信息,最后通過1×1×1卷積融合加權后的不同尺度特征圖。這種結構可以保留豐富的上下文信息,同時有效捕捉肺動脈的細節特征。
 圖2
網絡結構設計
圖2
網絡結構設計
a:特征提取模塊;b:特征融合模塊
1.4 特征融合模塊
特征融合模塊負責實現主干網絡與分支網絡之間的特征信息交流,該模塊包括分支網絡中的特征融合模塊和主干網絡中的特征融合模塊兩個部分(圖2b)。兩個網絡中的特征經過1×1×1卷積調整通道后進行逐元素相加,達到增強感興趣區域的目的,同時互相補充雙方缺失的特征信息。隨后使用3×3×3卷積提取初步融合特征中更具有表征能力的關鍵特征,并與初步融合特征按通道連接。其次,使用空間注意力機制更加精細地篩選目標特征,減少特征初步融合時的噪聲信息。最終,根據融合后的特征用途,將其與對應網絡的特征圖按通道連接,實現多尺度特征的整合。
1.5 對比實驗
為驗證構建網絡模型的分割性能,在相同實驗環境下復現了Wu等[19]提出的基于Transformer的肺血管分割網絡。此外,構建的分割模型與既往研究的3D U-Net、注意力門控網絡(AG U-Net)[20]和V-Net[21]這3種常用醫學圖像分割網絡進行對比。
1.6 評價指標
在訓練過程中,使用Dice Loss函數進行模型訓練,采用Adam優化器進行參數更新。為評估所提模型的性能,選擇Dice相似系數(DSC)、靈敏度和精度評估分割精度,使用豪斯多夫距離(HD95)衡量兩個集合之間的最大距離[22],采用最大類間方差法(Otsu’s method)[18]提取肺部掩碼圖像。數據資料中的計量資料使用均數±標準差(x±s)表示。數據標注使用Mimics軟件(Materialise Mimics,v21.0,Belgium)。
2 結果
2.1 數據預處理
共納入203例患者的肺動脈影像數據,其中訓練集100例,驗證集30例,測試集73例。實驗數據預處理分為4個步驟:掩碼獲取、血管增強、結構變換和數據增強。(1)肺部掩碼圖像獲取:肺動脈與體循環動脈在形態上具有巨大差異,采用肺部掩碼圖像提高肺內血管結構提取效率。肺部區域被標記為白色(值設為1),而非肺部區域則被標記為黑色(值設為0)。使用最大類間方差法及形態學操作提取肺部掩碼圖像。(2)基于Hessian矩陣的血管增強:在CT圖像中,血管通常呈實心的管狀結構,因此處理時通過Hessian矩陣的特征值設計針對管狀結構的濾波器,以獲得圖像中血管的形態結構和相對位置。使用Frangi算法通過Hessian矩陣的特征值對管狀結構進行增強,用于突出血管、組織邊界等重要特征,從而提高模型對肺內血管的檢出率。(3)距離變換:為減少氣道壁對血管結構的影響,在進行血管增強后,對提取的氣道掩碼進行形態學膨脹操作。隨后對分割的氣道進行歐氏距離變換,獲得每個體積元素到氣道的最近距離,然后與肺部掩碼圖像相乘,獲得針對肺內組織的距離圖。(4)數據增強:為增加數據量及提高模型的泛化性能,對圖像塊應用隨機剛性變換和隨機彈性變換,剛性變換包括:在3個方向上的隨機翻轉、0.8~1.2范圍內的隨機縮放、最大10度的隨機3D旋轉(模型構建運行的條件及公式見附件)。
2.2 對比實驗
實驗結果顯示,本研究構建的模型在整體分割性能上表現良好,HD95達9.52 mm,相比文獻[19]中的最小值還要短6.05 mm,證明模型在分割邊界上具有優秀的表現。在為手術導航系統制定手術路線時,可最大程度降低手術路徑穿過肺部動脈的風險。此外,模型的DSC和靈敏度也是最優的,而精度僅次于AG U-Net [20]。AG U-Net模型雖然有最高的分割精度,但靈敏度最低,在手術導航時,其分割結果無法為導航系統提供足夠完整的動脈分布。而本模型相對AG U-Net模型在精度上降低了2.24%,但靈敏度上提高了8.5%,更完整的動脈分布可以大大降低手術路徑穿過動脈的概率(表1)。
不同方法分割結果的3D可視化結果顯示,本研究分割結果中血管結構相對更完整,尤其是肺內血管結構,可識別大部分的肺內血管結構。AG U-Net的分割精度最高,但靈敏度最差(圖3)。
 圖3
不同方法的肺部動脈分割結果的三維可視化
圖3
不同方法的肺部動脈分割結果的三維可視化
紅色區域表示模型的分割結果,綠色區域表示假陰性區域
2.3 消融實驗
為評估構建的網絡結構及先驗知識的有效性,本研究設計了消融實驗,將測試模型分為4種,分別為(1)3D U-Net:基準網絡;(2)主干網絡:將基準網絡中的卷積塊替換為特征提取模塊;(3)主干網絡+分支網絡:在主干網絡上加入分支網絡;(4)主干網絡+分支網絡+先驗知識:在分支網絡中加入血管的先驗知識。
3D可視化建模(圖4)及測試結果(表2)顯示,加入分支網絡可以大幅度提高模型的性能,尤其是模型的精度。分支網絡提取的肺內血管特征可以補充主干網絡中缺失的特征信息,并加強主干網絡中的肺內血管特征。加入先驗知識后,分支網絡可以直接獲得肺內管狀結構特征及相對氣道的位置信息,更好地識別動脈的結構特征,提高動脈的識別能力。當分支網絡+先驗知識與主干網絡融合時,分支網絡可以提供更多的血管結構特征,從而提高模型的靈敏度。
 圖4
不同配置網絡的肺部動脈分割結果的三維可視化
圖4
不同配置網絡的肺部動脈分割結果的三維可視化
3 討論
本研究構建了一種基于3D U-Net的肺動脈分割模型,其融合了肺動脈的形狀和位置先驗知識,顯著提高了肺動脈分割的準確性和效率。肺動脈分割的準確性對于術前規劃和術中導航至關重要,因為肺動脈與周圍組織在醫學圖像上具有復雜性和相似性,傳統分割方法常導致結構間的混淆,深度學習模型能通過減少人工手動標注從而提高不同數據集間結果的一致性,達到提高醫學影像分割的效果[23]。
本研究創新性地融合了肺動脈的形狀和位置先驗知識,并采用DSC、靈敏度、精度和HD95作為評估指標,綜合評估模型的性能。先驗知識的應用可顯著提高深度學習模型在醫學影像分割任務中的性能[24]。形狀先驗幫助模型識別肺動脈的管狀結構,而位置先驗則利用了肺動脈與氣道的相對位置關系,這兩者的結合使得模型能夠更準確地區分動脈和靜脈,以及識別出較小的動脈分支,這種融合先驗知識的方法可以減少模型對大量標注數據的依賴。我們使用分支網絡專注于提取肺實質內肺動脈的特征,而主干網絡處理較大的動脈結構。Wu等[25]也曾提出這種雙網絡結構,這種新穎的構建對血管結構有更細致的處理,能提高模型在分割復雜血管網絡中的性能。
在模型構建中使用了特征提取模塊和特征融合模塊的設計,能更好地處理肺動脈的多尺度特征和復雜結構。特征提取模塊通過跳躍連接和不同尺寸的特征圖按通道連接,捕獲了不同尺度的特征信息。特征融合模塊則通過1×1×1卷積調整通道后進行特征相加,加強了感興趣區域的特征,同時互相補充雙方缺失的特征信息,實現了兩個網絡特征的初步融合。這不僅提高了模型的靈敏度,還增強了模型對肺動脈特征的識別能力,能夠顯著降低手術路徑與動脈相交的概率。
盡管本研究取得了積極的結果,但仍有進一步改進和擴展空間。在后續研究中,可以通過集成更多的先驗知識(如肺動脈的紋理信息和方向信息)進一步提高模型的性能;其次,可以探索模型在不同分辨率和不同質量CT圖像上的表現,以評估其在實際臨床環境中的適用性。此外,考慮將本模型與其他類型的醫學影像分割任務相結合,如肺結節檢測和肺腫瘤分割,以驗證其廣泛的適用性。本文提出了一種基于形狀和位置先驗的肺動脈分割方法,實現肺部動脈血管精確分割,在手術導航等場景具有潛在的應用價值,尤其是機器人輔助手術導航領域。該分割方法為機器人支氣管鏡下肺結節活檢的自動導航系統提供了更精確的肺動脈結構信息,有助于更好地規劃手術路線,避免損傷重要血管結構,從而減少術中出血和術后并發癥風險。該研究將深度學習技術與手術導航臨床需求相結合,為未來更多人工智能技術在胸外科領域的應用提供了案例。
利益沖突:無。
作者貢獻:郭超負責論文設計及文章修改;高雪涵、胡啟迪負責論文設計,數據處理,模型構建,文章撰寫及修改;李健、朱海星、趙珂負責數據收集、處理,模型構建;劉衛朋和李單青負責論文設計,文章審核、修改及潤色。
本文附件見本刊網站電子版。