版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌是我國發病率和死亡率均居首位的惡性腫瘤[1],同時,隨著肺癌早期篩查的普及,小結節檢出率也不斷增加,肺癌患者外科切除根治術的需求越來越大[2]。電視輔助胸腔鏡術(vision-assisted thoracoscopic,VATS)是早期肺癌最有效和最重要的治療方法[3]。然而,在VATS進行單肺通氣期間可能會損害腦部氧氣供需平衡,導致術后譫妄(postoperative delirium,POD)[4]。POD是一種發生在術后急性、波動性的神經功能障礙,主要表現為認知功能障礙、意識水平紊亂、注意障礙、睡眠-覺醒周期紊亂、神經運動異常和情緒失控[5]。高齡是POD的危險因素,肺癌患者平均診斷年齡為71歲[6]。進行單肺通氣的老年患者術中腦組織氧飽和度降低發生率可高達70%[7],POD發生率為7%~23%[4]。這會導致患者術后其他并發癥發生率增加、住院時間延長、醫療費用增加、死亡率升高、長期認知和社會功能障礙和生活質量下降[5]。
迄今為止,尚未發現某一特效的POD預防手段,因此,術前識別POD易感因素、早期診斷及綜合防治,對降低POD的發生率、減輕癥狀嚴重程度、提高術后恢復質量至關重要[5]。目前,已有研究關注肺切除POD危險因素,然而,各研究結果間存在差異,如Ishibashi等[8]發現,高齡、外周血管疾病、抑郁和當前吸煙狀況是POD的危險因素;Hayashi等[9]發現腦血管疾病史、鱗狀細胞癌和高齡是POD的危險因素;國內早期研究[10]發現,睡眠障礙和白介素-6是POD的危險因素。此外,單一研究存在樣本量不足問題,無法提供全面、可靠的POD危險因素。因此,本研究對肺切除患者POD的危險因素進行系統評價,以期為POD的早期識別和預防提供有效的證據支持。
1 資料與方法
1.1 納入和排除標準
納入標準:① 研究對象:行胸腔鏡或開胸輔助的肺切除術患者;年齡≥18歲;② 暴露因素:與肺切除POD可能相關的患者自身及手術等因素;③ 研究類型:橫斷面研究、病例對照研究和隊列研究。排除標準:① 僅提供單因素回歸分析結果,無多因素回歸分析比值比(odds ratio,OR)及95%置信區間(confidence interval,CI);② 結局指標為術后并發癥,未單獨提供POD多因素回歸分析結果;③ 綜述、個案、共識;④ 重復發表及無法獲取全文的文獻;⑤ 非中英文文獻;⑥ 低質量文獻。
1.2 文獻檢索策略
系統檢索PubMed、Web of Science、The Cochrane Library、知網、萬方和維普數據庫中與肺切除POD危險因素相關的研究。檢索時間為建庫至2024年11月7日。采用主題詞與自由詞結合的檢索方式,并手動檢索納入文獻的參考文獻作為補充。英文檢索詞為“lung surgery OR thoracotomy OR thoracoscopy OR lung resection OR pneumonectomy OR lobectomy OR pulmonary lobectomy OR lung cancer OR lung tumor OR lung neoplasms” AND “postoperative delirium OR POD” AND “risk factors OR influencing factor OR promotive OR prediction OR prognostic OR nomogram OR logistic”,中文檢索詞為“肺癌根治術 OR肺切除術OR肺部手術OR肺葉切除術OR胸腔鏡肺手術OR肺癌OR肺腫瘤” AND “譫妄 OR 術后譫妄” AND “危險因素 OR影響因素 OR 風險因素 OR 預測模型 OR 多因素回歸分析”。
1.3 文獻篩選與資料提取
由2名研究人員根據納入和排除標準,獨立對文獻進行篩選和數據提取。在進行文獻篩選過程中,先閱讀文題和摘要,剔除完全不相干的研究,然后深入閱讀全文,最后決定納入與否。提取以下資料:作者、發表時間、國家、研究類型、樣本量、評估工具、危險因素。
1.4 質量評價
采用循證醫學協作組推薦的非隨機對照試驗的評價方法,通過紐卡斯爾-渥太華量表(Newcastle-Ottawa Scale,NOS)對文獻質量進行評價,該量表包括研究人群的選擇、組間可比性、暴露因素3個類別,總分≥6分為高質量文獻。由2名研究人員獨立對文獻質量進行評價,得分越高文獻質量越高。
1.5 統計學分析
使用Review Manager 5.4.1軟件對納入文獻進行Meta分析。異質性檢驗采用χ2檢驗進行分析,并結合I2值評價異質性大小,若P>0.10,I2≤50%,表明研究間不存在異質性,采用固定效應模型進行Meta分析;若P≤0.10,I2>50%,表明研究異質性較大,采用隨機效應模型進行Meta分析。通過改變效應模型對文獻進行敏感性分析。定性資料的合并效應量采用OR及95%CI描述。雙側P≤0.05為差異有統計學意義。
2 結果
2.1 文獻檢索結果
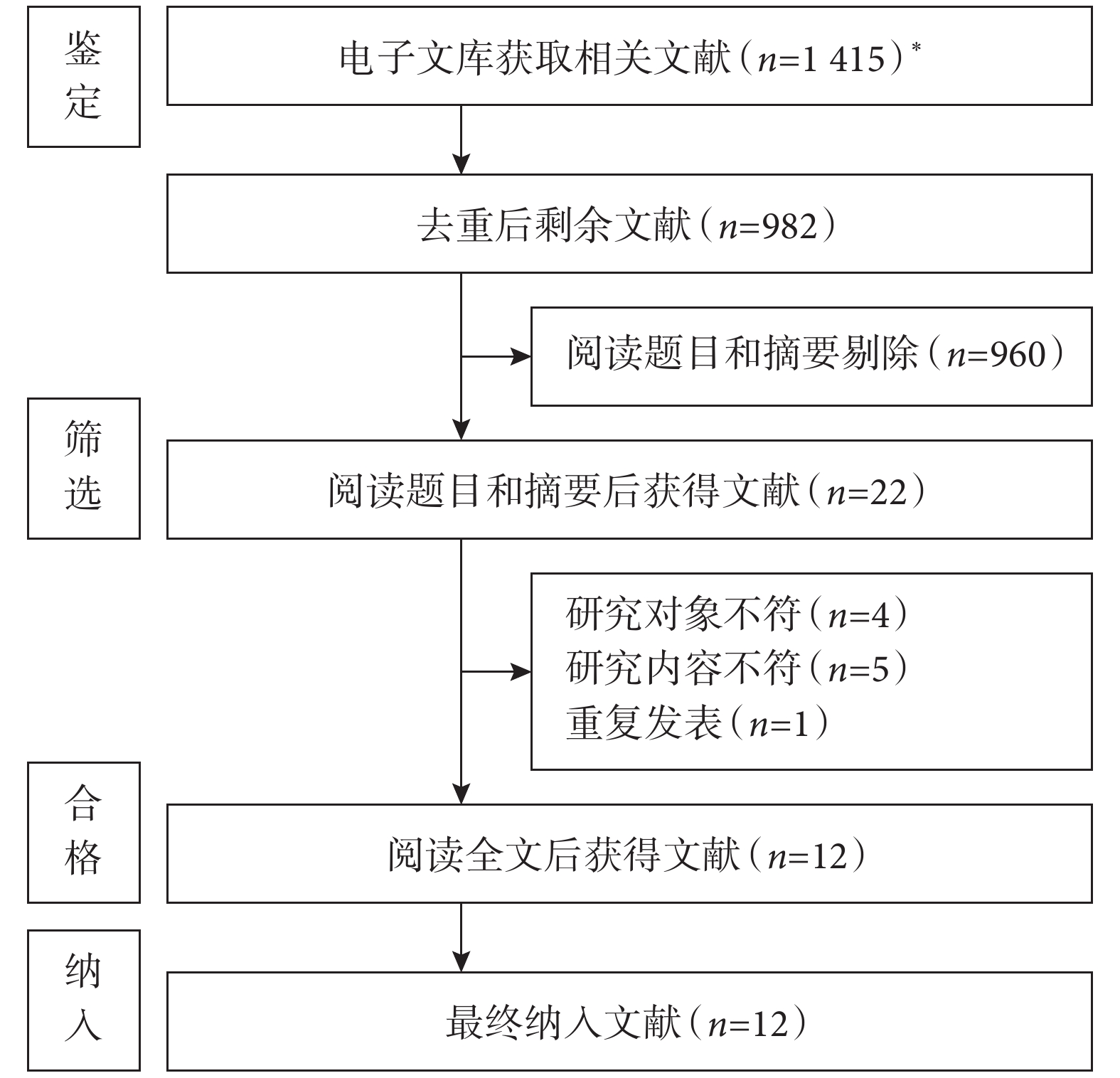
根據預先制定的納入排除標準和文獻檢索策略,初步檢索出文獻
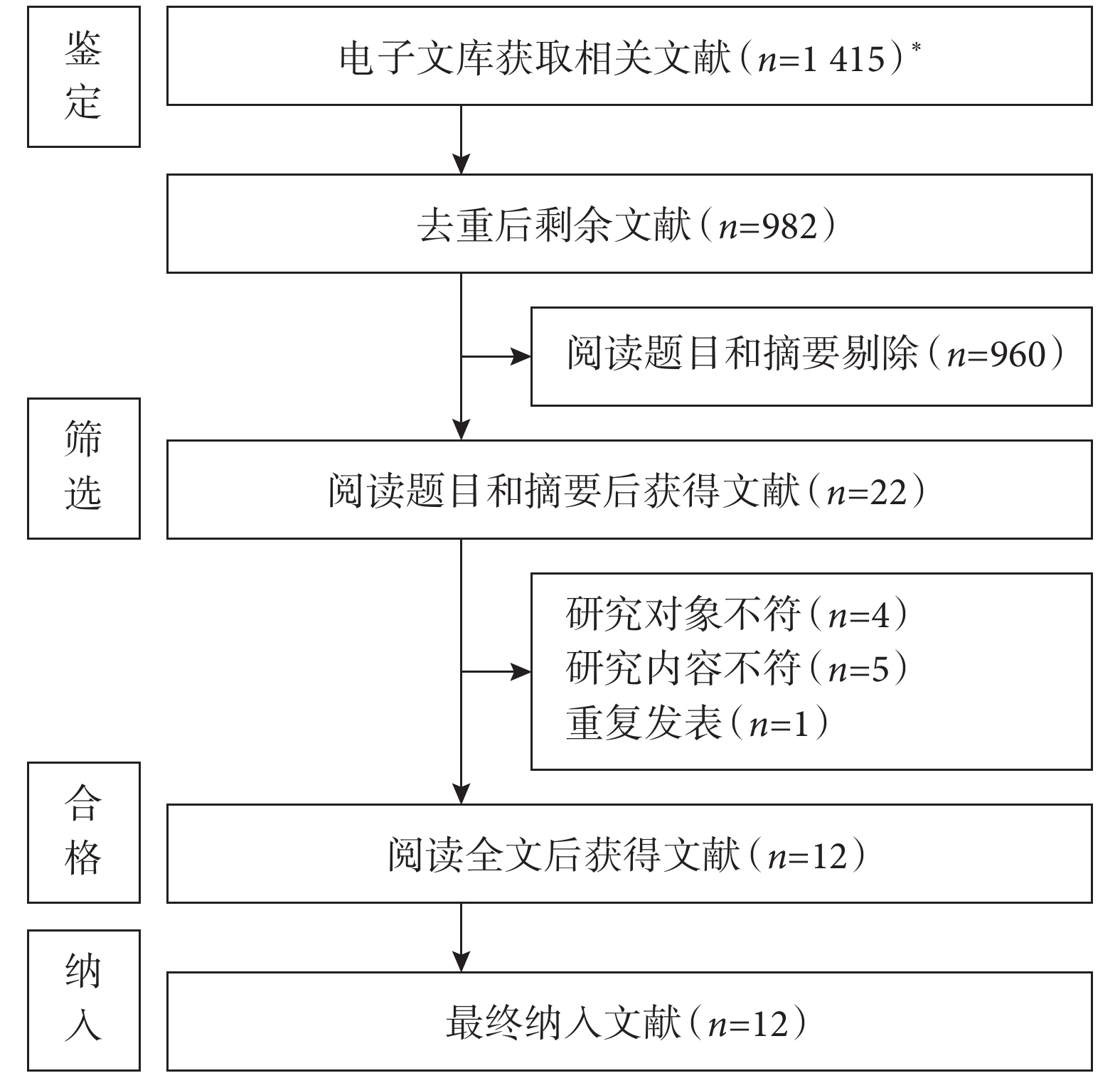 圖1
文獻篩選流程圖
圖1
文獻篩選流程圖
*:知網(
2.2 納入文獻基本特征及質量評價
共納入12篇文獻[8-19],其中1篇來自美國[9],1篇來自日本[8],其余均來自中國[10–19]。研究發表時間為2016—2024年,大部分研究[8,11-19]在2021年后發表。總樣本量5 574例,POD發生率為3.3%~27.9%。11篇為病例對照研究,1篇為隊列研究[14]。12篇文獻方法學質量評價得分均≥6分,納入文獻質量較高。納入文獻的基本特征及方法學質量評價結果見表1~2。
2.3 Meta 分析結果
2.3.1 患者自身因素
2.3.1.1 年齡
6項研究[8-9,11,13,15,17]報告年齡(>60歲)與POD的關系,研究間不存在異質性(I2=0,P=0.51),采用固定效應模型進行分析。Meta分析結果顯示:年齡(>60歲)是POD的危險因素,差異有統計學意義[OR=2.43,95%CI(2.01,2.93),P<0.01];見表2。
2.3.1.2 ASA分級
3項研究[12,14,18]報告ASA分級與POD的關系,但僅有2項研究報告了具體分級(Ⅳ級),對其進行合并,研究間不存在異質性(I2=0,P=0.92),采用固定效應模型進行分析。Meta 分析結果顯示:ASA分級(Ⅳ級)是POD的危險因素,差異有統計學意義[OR=8.74,95%CI(5.23,14.61),P<0.01];見表2。
2.3.1.3 糖尿病病史
2項研究[11,17]報告糖尿病與POD的關系,研究間不存在異質性(I2=0,P=1.00),采用固定效應模型進行分析。Meta 分析結果顯示:糖尿病是POD的危險因素,差異有統計學意義[OR=12.81,95%CI(10.45,15.71),P<0.01];見表2。
2.3.1.4 COPD病史
2項研究[12,18]報告COPD病史與POD的關系,研究間異質性較大(I2=89%,P<0.002),未找到異質性來源,采用隨機效應模型進行分析。Meta 分析結果顯示:COPD病史不是POD的危險因素,差異無統計學意義[OR=1.45,95%CI(0.98,0.97),P=0.07];見表2。
2.3.1.5 高體重指數(body mass index,BMI)
2項研究[12,18]報告高BMI與POD的關系,研究間不存在異質性(I2=0,P=0.78),采用固定效應模型進行分析。Meta 分析結果顯示:高BMI是POD的保護因素,差異有統計學意義[OR=0.96,95%CI(0.95,0.97),P<0.01];見表2。
2.3.1.6 腦血管疾病
2項研究[8-9]報告腦血管疾病與POD的關系,研究間不存在異質性(I2=0,P=0.48),采用固定效應模型進行分析。Meta 分析結果顯示:腦血管疾病是POD的危險因素,差異有統計學意義[OR=3.00,95%CI(2.46,3.67),P<0.01];見表2。
2.3.1.7 抑郁
2項研究[8,17]報告抑郁與POD的關系,研究間不存在異質性(I2=0,P=0.70),采用固定效應模型進行分析。Meta 分析結果顯示:抑郁是POD的危險因素,差異有統計學意義[OR=7.27,95%CI(5.46,9.67),P<0.01];見表2。
2.3.1.8 鱗狀細胞癌
2項研究[9,15]報告鱗狀細胞癌與POD的關系,研究間不存在異質性(I2=0,P=0.79),采用固定效應模型進行分析。Meta 分析結果顯示:鱗狀細胞癌是POD的危險因素,差異有統計學意義[OR=4.79,95%CI(1.83,12.51),P<0.01];見表2。
2.3.1.9 營養不良
2項研究[15-16]報告營養不良與POD的關系,研究間不存在異質性(I2=0,P=0.33),采用固定效應模型進行分析。Meta 分析結果顯示:抑郁是POD的危險因素,差異有統計學意義[OR=5.25,95%CI(3.35,8.25),P<0.01];見表2。
2.3.1.10 睡眠障礙
3項研究報告睡眠障礙與POD的關系,但有2項研究[11,17]提供了睡眠障礙作為危險因素的數據;另一項提供了保護因素的數據。對提供危險因素數據的研究合并,研究間不存在異質性(I2=0,P=1.00),采用固定效應模型進行分析。Meta 分析結果顯示:睡眠障礙是POD的危險因素,差異有統計學意義[OR=2.79,95%CI(2.28,3.42),P<0.01];見表2。
2.3.2 手術相關因素
2.3.2.1 術中丙泊酚用量
2項研究[12,18]報告術中丙泊酚用量POD的關系,研究間異質性較大(I2=75%,P=0.05),未找到異質性來源,采用隨機效應模型進行分析。Meta 分析結果顯示:術中丙泊酚用量不是POD的危險因素,差異無統計學意義[OR=1.16,95%CI(0.82,1.65),P=0.40];見表2。
2.3.2.2 術后地佐辛用量
2項研究[12,18]報告術后地佐辛用量與POD的關系,研究間異質性較大(I2=94%,P<0.01),未找到異質性來源,采用隨機效應模型進行分析。Meta 分析結果顯示:術后地佐辛用量不是POD的危險因素,差異無統計學意義[OR=1.79,95%CI(0.60,5.38),P=0.30];見表2。
2.3.2.3 術中單肺通氣時間
2項研究[12,18]報告術中單肺通氣時間與POD的關系,研究間不存在異質性(I2=0,P=0.33),采用固定效應模型進行分析。Meta 分析結果顯示:術中單肺通氣時間是POD的危險因素,差異有統計學意義[OR=1.32,95%CI(1.11,1.57),P<0.01];見表2。
2.4 描述性分析
2項研究[12,13]報告低血氧分壓(partial pressure of oxygen,PO2)是POD的危險因素,研究間存在顯著異質性(I2=77,P=0.04)可能與研究對PO2的分類標準不同有關,因此進行描述性分析。納入研究還識別了其他危險因素,包括血清甲狀腺激素(甲狀腺素原氨酸、游離三碘甲狀腺原氨酸)、炎癥因子(中性粒細胞淋巴細胞比值≥7.79、C反應蛋白/白蛋白比值>0.120、白介素-6≥50 pg/mL)、基質金屬蛋白酶-9、補體1q、脂聯素、衰弱、當前吸煙狀態、術后第1天疼痛程度、腦組織氧飽和度。然而,這些因素僅在單個研究中被提及,無法進行Meta整合,因此進行描述性分析。
2.5 敏感性分析
分別采用隨機效應模型和固定效應模型對各因素效應量進行敏感性分析,結果顯示,各因素不同效應模型的合并效應量均較接近,說明Meta分析結果較為穩定;見表3。
3 討論
早期識別POD高風險患者,并采取個性化預防措施對降低POD發生率尤為重要,但目前臨床實踐中仍缺乏有效的POD風險評估工具。目前,有關肺切除 POD 影響因素的研究逐漸受到關注,但不同研究的結果并不一致。據我們所知,這是首次對肺切除POD風險因素進行Meta分析的研究。結果表明,年齡(≥60歲)、ASA分級(Ⅳ級)、糖尿病史、腦血管病史、抑郁、鱗狀細胞癌、營養不良、睡眠障礙、術中單肺通氣時間是肺切除患者POD的獨立危險因素,而高BMI是保護因素。
3.1 患者自身相關因素
3.1.1 年齡(≥60歲)、糖尿病史、腦血管病史和ASA分級
隨著年齡增長而發生的神經退行性改變會引起神經遞質,如乙酰膽堿和膽堿能受體水平降低,導致中樞神經系統的傳遞功能減弱。研究[20]顯示,POD患者血漿和腦脊液中乙酰膽堿的濃度降低。肺癌患者確診時的中位年齡為71歲[6],且大多患者在確診時至少有1種共病,如呼吸疾病、心腦血管疾病、高血糖,這些疾病都受到炎癥過程影響。然而,與這些炎癥相關的細胞因子、趨化因子和同源受體也會導致POD。炎癥被認為是POD的驅動因素,炎癥狀態可能通過破壞血腦屏障、激活小膠質細胞和神經炎癥導致譫妄[21]。譚文斐等[10]、尚明煦等[11]的研究也發現,炎癥標志物白介素-6、中性粒細胞/淋巴細胞比和C反應蛋白/白蛋白比是POD的獨立危險因素。Meta分析[21]也顯示,老年患者術前炎癥介質白介素-6與POD顯著相關。
同時,本Meta分析結果也顯示,腦血管疾病、高血糖是POD的獨立危險因素。除共病引起的身體炎癥狀態外,糖尿病導致血管粥樣硬化、腦血管疾病,進而引起腦白質病變、腦萎縮、神經元密度降低、血流減少和神經遞質水平降,這些均會增加POD發生風險[22]。研究[23]顯示,在接受手術切除的非小細胞肺癌患者中,與年齡、性別匹配的對照組相比,POD患者腦白質病變率更高,且腦白質病變是POD的危險因素。ASA分級Ⅳ級患者合并嚴重并發癥,功能代償不全,已威脅生命安全。這類患者對麻醉和手術的耐受性、系統儲備和生理自我調節能力均明顯下降,導致麻醉和手術過程中腦細胞功能易損性增加。
3.1.2 鱗狀細胞癌
鱗狀細胞癌常與高度吸煙有關,煙霧中的尼古丁會對大腦產生直接神經毒性作用并引起微血管變化,進而導致大腦的執行功能和認知儲備降低[9]。Ishibashi等[8]的研究結果顯示,戒煙時間<4周的肺切除患者POD發生率是從不吸煙、曾經吸煙和戒煙8~12周患者的2.35倍,提示術前應至少戒煙4周。其次,與其他患者相比,鱗狀細胞癌患者更容易受到氧代謝紊亂的影響,術后發生精神錯亂概率更高[9]。
研究[12-13]顯示,低PO2是POD的危險因素,其中Lu等[13]發現,PO2>100 mm Hg(1 mm Hg=0.133 kPa)的患者發生譫妄的風險是PO2為60~80 mm Hg患者的7%。Cui等[19]采用多元logistic回歸和多重測試校正后發現,當左腦組織氧飽和度(cerebral tissue oxygen saturation,SctO2)低于基線的90%(患者清醒呼吸室內空氣時的SctO2)或右腦組織氧飽和度SctO2低于基線的85%時,可能與開胸后POD的風險增加有關。然而,由于納入研究數據有限,無法得出PO2和SctO2對POD的具體影響,未來還需要開展進一步的研究進行驗證。
3.1.3 抑郁
本研究發現,抑郁是肺切除POD的獨立危險因素,最新一項納入42項研究(共4 664 051例患者),探討術前抑郁與POD相關性的Meta分析[24]結果顯示,術前抑郁患者POD發生率為29%,而非抑郁患者發生率為15%,且術前抑郁患者譫妄風險是無抑郁患者的1.91倍[95%CI(1.68,2.17),I2=42.0%]。如上所述,POD更有可能發生在已存在神經損傷、認知障礙、慢性應激和炎癥狀態的患者身上,而所有這些現象也是抑郁癥患者的癥狀反應[25]。抑郁癥與譫妄的共病機制主要為:尾狀核和基底神經節等注意力集中的腦區容量減少或功能失調;膽堿能和多巴胺能神經遞質系統失衡;或邊緣-下丘腦-垂體-腎上腺軸和應激反應長期失調[25-26]。這強調了術前需要加強對患者抑郁風險的篩查并采取治療策略,包括藥物治療、心理支持和圍手術期護理的改進,以減少POD的發生。
3.1.4 高BMI和營養不良
本Meta分析結果表明,BMI升高是POD的保護因素。一項納入
3.2 手術相關因素
在手術因素方面,本Meta結果顯示,術中單肺通氣時間是POD的獨立危險因素。單肺通氣是一種滿足手術需要的非生理性通氣方式,會增加肺內分流,導致通氣/血流比例失衡,導致低氧血癥,進而導致譫妄的發生[18]。此外,隨著通氣時間的延長,手術操作對肺組織及胸膜的機械牽拉作用增強,易導致迷走神經刺激反應,影響患者腦部供氧,從而導致POD的發生[12]。
本研究存在一些局限性:① 某些潛在的影響因素僅在1項研究中報告,無法進行Meta分析,只能進行描述性分析;② 由于漏斗圖在納入的研究數量為10項或更少時不可靠[32],因此未將其作為衡量發表偏倚的指標;③ 僅檢索中英文研究,可能遺漏了以其他語言發表的相關研究;④ 除年齡外,其他危險因素合并時納入文獻較少,穩定性和可靠性可能不佳,未來還需更多的前瞻性研究驗證;⑤ 部分研究對POD的診斷標準、評估時間、納入患者年齡、腫瘤分期存在差異,可能會增加研究的異質性。
綜上所述,本Meta分析揭示了肺切除患者POD的關鍵風險因素,包括年齡(≥60歲)、ASA分級(Ⅳ級)、糖尿病史、腦血管病史、抑郁、鱗狀細胞癌、營養不良、睡眠障礙、術中單肺通氣時間、高BMI。本研究結果表明,未來對POD的防控策略應側重于相關風險因素的管理,特別是可控因素,如糖尿病、抑郁、營養不良、BMI、睡眠障礙。雖然年齡(≥60歲)、ASA分級(Ⅳ級)、腦血管病史、鱗狀細胞癌等是不可控因素,但它們可作為有價值的預測因素,幫助醫護人員識別高危患者。其他證據有限的風險因素,包括PO2和血液生物標志物,需要在未來的研究中進一步探討,以更全面地闡明其作用。
肺癌是我國發病率和死亡率均居首位的惡性腫瘤[1],同時,隨著肺癌早期篩查的普及,小結節檢出率也不斷增加,肺癌患者外科切除根治術的需求越來越大[2]。電視輔助胸腔鏡術(vision-assisted thoracoscopic,VATS)是早期肺癌最有效和最重要的治療方法[3]。然而,在VATS進行單肺通氣期間可能會損害腦部氧氣供需平衡,導致術后譫妄(postoperative delirium,POD)[4]。POD是一種發生在術后急性、波動性的神經功能障礙,主要表現為認知功能障礙、意識水平紊亂、注意障礙、睡眠-覺醒周期紊亂、神經運動異常和情緒失控[5]。高齡是POD的危險因素,肺癌患者平均診斷年齡為71歲[6]。進行單肺通氣的老年患者術中腦組織氧飽和度降低發生率可高達70%[7],POD發生率為7%~23%[4]。這會導致患者術后其他并發癥發生率增加、住院時間延長、醫療費用增加、死亡率升高、長期認知和社會功能障礙和生活質量下降[5]。
迄今為止,尚未發現某一特效的POD預防手段,因此,術前識別POD易感因素、早期診斷及綜合防治,對降低POD的發生率、減輕癥狀嚴重程度、提高術后恢復質量至關重要[5]。目前,已有研究關注肺切除POD危險因素,然而,各研究結果間存在差異,如Ishibashi等[8]發現,高齡、外周血管疾病、抑郁和當前吸煙狀況是POD的危險因素;Hayashi等[9]發現腦血管疾病史、鱗狀細胞癌和高齡是POD的危險因素;國內早期研究[10]發現,睡眠障礙和白介素-6是POD的危險因素。此外,單一研究存在樣本量不足問題,無法提供全面、可靠的POD危險因素。因此,本研究對肺切除患者POD的危險因素進行系統評價,以期為POD的早期識別和預防提供有效的證據支持。
1 資料與方法
1.1 納入和排除標準
納入標準:① 研究對象:行胸腔鏡或開胸輔助的肺切除術患者;年齡≥18歲;② 暴露因素:與肺切除POD可能相關的患者自身及手術等因素;③ 研究類型:橫斷面研究、病例對照研究和隊列研究。排除標準:① 僅提供單因素回歸分析結果,無多因素回歸分析比值比(odds ratio,OR)及95%置信區間(confidence interval,CI);② 結局指標為術后并發癥,未單獨提供POD多因素回歸分析結果;③ 綜述、個案、共識;④ 重復發表及無法獲取全文的文獻;⑤ 非中英文文獻;⑥ 低質量文獻。
1.2 文獻檢索策略
系統檢索PubMed、Web of Science、The Cochrane Library、知網、萬方和維普數據庫中與肺切除POD危險因素相關的研究。檢索時間為建庫至2024年11月7日。采用主題詞與自由詞結合的檢索方式,并手動檢索納入文獻的參考文獻作為補充。英文檢索詞為“lung surgery OR thoracotomy OR thoracoscopy OR lung resection OR pneumonectomy OR lobectomy OR pulmonary lobectomy OR lung cancer OR lung tumor OR lung neoplasms” AND “postoperative delirium OR POD” AND “risk factors OR influencing factor OR promotive OR prediction OR prognostic OR nomogram OR logistic”,中文檢索詞為“肺癌根治術 OR肺切除術OR肺部手術OR肺葉切除術OR胸腔鏡肺手術OR肺癌OR肺腫瘤” AND “譫妄 OR 術后譫妄” AND “危險因素 OR影響因素 OR 風險因素 OR 預測模型 OR 多因素回歸分析”。
1.3 文獻篩選與資料提取
由2名研究人員根據納入和排除標準,獨立對文獻進行篩選和數據提取。在進行文獻篩選過程中,先閱讀文題和摘要,剔除完全不相干的研究,然后深入閱讀全文,最后決定納入與否。提取以下資料:作者、發表時間、國家、研究類型、樣本量、評估工具、危險因素。
1.4 質量評價
采用循證醫學協作組推薦的非隨機對照試驗的評價方法,通過紐卡斯爾-渥太華量表(Newcastle-Ottawa Scale,NOS)對文獻質量進行評價,該量表包括研究人群的選擇、組間可比性、暴露因素3個類別,總分≥6分為高質量文獻。由2名研究人員獨立對文獻質量進行評價,得分越高文獻質量越高。
1.5 統計學分析
使用Review Manager 5.4.1軟件對納入文獻進行Meta分析。異質性檢驗采用χ2檢驗進行分析,并結合I2值評價異質性大小,若P>0.10,I2≤50%,表明研究間不存在異質性,采用固定效應模型進行Meta分析;若P≤0.10,I2>50%,表明研究異質性較大,采用隨機效應模型進行Meta分析。通過改變效應模型對文獻進行敏感性分析。定性資料的合并效應量采用OR及95%CI描述。雙側P≤0.05為差異有統計學意義。
2 結果
2.1 文獻檢索結果
根據預先制定的納入排除標準和文獻檢索策略,初步檢索出文獻
 圖1
文獻篩選流程圖
圖1
文獻篩選流程圖
*:知網(
2.2 納入文獻基本特征及質量評價
共納入12篇文獻[8-19],其中1篇來自美國[9],1篇來自日本[8],其余均來自中國[10–19]。研究發表時間為2016—2024年,大部分研究[8,11-19]在2021年后發表。總樣本量5 574例,POD發生率為3.3%~27.9%。11篇為病例對照研究,1篇為隊列研究[14]。12篇文獻方法學質量評價得分均≥6分,納入文獻質量較高。納入文獻的基本特征及方法學質量評價結果見表1~2。
2.3 Meta 分析結果
2.3.1 患者自身因素
2.3.1.1 年齡
6項研究[8-9,11,13,15,17]報告年齡(>60歲)與POD的關系,研究間不存在異質性(I2=0,P=0.51),采用固定效應模型進行分析。Meta分析結果顯示:年齡(>60歲)是POD的危險因素,差異有統計學意義[OR=2.43,95%CI(2.01,2.93),P<0.01];見表2。
2.3.1.2 ASA分級
3項研究[12,14,18]報告ASA分級與POD的關系,但僅有2項研究報告了具體分級(Ⅳ級),對其進行合并,研究間不存在異質性(I2=0,P=0.92),采用固定效應模型進行分析。Meta 分析結果顯示:ASA分級(Ⅳ級)是POD的危險因素,差異有統計學意義[OR=8.74,95%CI(5.23,14.61),P<0.01];見表2。
2.3.1.3 糖尿病病史
2項研究[11,17]報告糖尿病與POD的關系,研究間不存在異質性(I2=0,P=1.00),采用固定效應模型進行分析。Meta 分析結果顯示:糖尿病是POD的危險因素,差異有統計學意義[OR=12.81,95%CI(10.45,15.71),P<0.01];見表2。
2.3.1.4 COPD病史
2項研究[12,18]報告COPD病史與POD的關系,研究間異質性較大(I2=89%,P<0.002),未找到異質性來源,采用隨機效應模型進行分析。Meta 分析結果顯示:COPD病史不是POD的危險因素,差異無統計學意義[OR=1.45,95%CI(0.98,0.97),P=0.07];見表2。
2.3.1.5 高體重指數(body mass index,BMI)
2項研究[12,18]報告高BMI與POD的關系,研究間不存在異質性(I2=0,P=0.78),采用固定效應模型進行分析。Meta 分析結果顯示:高BMI是POD的保護因素,差異有統計學意義[OR=0.96,95%CI(0.95,0.97),P<0.01];見表2。
2.3.1.6 腦血管疾病
2項研究[8-9]報告腦血管疾病與POD的關系,研究間不存在異質性(I2=0,P=0.48),采用固定效應模型進行分析。Meta 分析結果顯示:腦血管疾病是POD的危險因素,差異有統計學意義[OR=3.00,95%CI(2.46,3.67),P<0.01];見表2。
2.3.1.7 抑郁
2項研究[8,17]報告抑郁與POD的關系,研究間不存在異質性(I2=0,P=0.70),采用固定效應模型進行分析。Meta 分析結果顯示:抑郁是POD的危險因素,差異有統計學意義[OR=7.27,95%CI(5.46,9.67),P<0.01];見表2。
2.3.1.8 鱗狀細胞癌
2項研究[9,15]報告鱗狀細胞癌與POD的關系,研究間不存在異質性(I2=0,P=0.79),采用固定效應模型進行分析。Meta 分析結果顯示:鱗狀細胞癌是POD的危險因素,差異有統計學意義[OR=4.79,95%CI(1.83,12.51),P<0.01];見表2。
2.3.1.9 營養不良
2項研究[15-16]報告營養不良與POD的關系,研究間不存在異質性(I2=0,P=0.33),采用固定效應模型進行分析。Meta 分析結果顯示:抑郁是POD的危險因素,差異有統計學意義[OR=5.25,95%CI(3.35,8.25),P<0.01];見表2。
2.3.1.10 睡眠障礙
3項研究報告睡眠障礙與POD的關系,但有2項研究[11,17]提供了睡眠障礙作為危險因素的數據;另一項提供了保護因素的數據。對提供危險因素數據的研究合并,研究間不存在異質性(I2=0,P=1.00),采用固定效應模型進行分析。Meta 分析結果顯示:睡眠障礙是POD的危險因素,差異有統計學意義[OR=2.79,95%CI(2.28,3.42),P<0.01];見表2。
2.3.2 手術相關因素
2.3.2.1 術中丙泊酚用量
2項研究[12,18]報告術中丙泊酚用量POD的關系,研究間異質性較大(I2=75%,P=0.05),未找到異質性來源,采用隨機效應模型進行分析。Meta 分析結果顯示:術中丙泊酚用量不是POD的危險因素,差異無統計學意義[OR=1.16,95%CI(0.82,1.65),P=0.40];見表2。
2.3.2.2 術后地佐辛用量
2項研究[12,18]報告術后地佐辛用量與POD的關系,研究間異質性較大(I2=94%,P<0.01),未找到異質性來源,采用隨機效應模型進行分析。Meta 分析結果顯示:術后地佐辛用量不是POD的危險因素,差異無統計學意義[OR=1.79,95%CI(0.60,5.38),P=0.30];見表2。
2.3.2.3 術中單肺通氣時間
2項研究[12,18]報告術中單肺通氣時間與POD的關系,研究間不存在異質性(I2=0,P=0.33),采用固定效應模型進行分析。Meta 分析結果顯示:術中單肺通氣時間是POD的危險因素,差異有統計學意義[OR=1.32,95%CI(1.11,1.57),P<0.01];見表2。
2.4 描述性分析
2項研究[12,13]報告低血氧分壓(partial pressure of oxygen,PO2)是POD的危險因素,研究間存在顯著異質性(I2=77,P=0.04)可能與研究對PO2的分類標準不同有關,因此進行描述性分析。納入研究還識別了其他危險因素,包括血清甲狀腺激素(甲狀腺素原氨酸、游離三碘甲狀腺原氨酸)、炎癥因子(中性粒細胞淋巴細胞比值≥7.79、C反應蛋白/白蛋白比值>0.120、白介素-6≥50 pg/mL)、基質金屬蛋白酶-9、補體1q、脂聯素、衰弱、當前吸煙狀態、術后第1天疼痛程度、腦組織氧飽和度。然而,這些因素僅在單個研究中被提及,無法進行Meta整合,因此進行描述性分析。
2.5 敏感性分析
分別采用隨機效應模型和固定效應模型對各因素效應量進行敏感性分析,結果顯示,各因素不同效應模型的合并效應量均較接近,說明Meta分析結果較為穩定;見表3。
3 討論
早期識別POD高風險患者,并采取個性化預防措施對降低POD發生率尤為重要,但目前臨床實踐中仍缺乏有效的POD風險評估工具。目前,有關肺切除 POD 影響因素的研究逐漸受到關注,但不同研究的結果并不一致。據我們所知,這是首次對肺切除POD風險因素進行Meta分析的研究。結果表明,年齡(≥60歲)、ASA分級(Ⅳ級)、糖尿病史、腦血管病史、抑郁、鱗狀細胞癌、營養不良、睡眠障礙、術中單肺通氣時間是肺切除患者POD的獨立危險因素,而高BMI是保護因素。
3.1 患者自身相關因素
3.1.1 年齡(≥60歲)、糖尿病史、腦血管病史和ASA分級
隨著年齡增長而發生的神經退行性改變會引起神經遞質,如乙酰膽堿和膽堿能受體水平降低,導致中樞神經系統的傳遞功能減弱。研究[20]顯示,POD患者血漿和腦脊液中乙酰膽堿的濃度降低。肺癌患者確診時的中位年齡為71歲[6],且大多患者在確診時至少有1種共病,如呼吸疾病、心腦血管疾病、高血糖,這些疾病都受到炎癥過程影響。然而,與這些炎癥相關的細胞因子、趨化因子和同源受體也會導致POD。炎癥被認為是POD的驅動因素,炎癥狀態可能通過破壞血腦屏障、激活小膠質細胞和神經炎癥導致譫妄[21]。譚文斐等[10]、尚明煦等[11]的研究也發現,炎癥標志物白介素-6、中性粒細胞/淋巴細胞比和C反應蛋白/白蛋白比是POD的獨立危險因素。Meta分析[21]也顯示,老年患者術前炎癥介質白介素-6與POD顯著相關。
同時,本Meta分析結果也顯示,腦血管疾病、高血糖是POD的獨立危險因素。除共病引起的身體炎癥狀態外,糖尿病導致血管粥樣硬化、腦血管疾病,進而引起腦白質病變、腦萎縮、神經元密度降低、血流減少和神經遞質水平降,這些均會增加POD發生風險[22]。研究[23]顯示,在接受手術切除的非小細胞肺癌患者中,與年齡、性別匹配的對照組相比,POD患者腦白質病變率更高,且腦白質病變是POD的危險因素。ASA分級Ⅳ級患者合并嚴重并發癥,功能代償不全,已威脅生命安全。這類患者對麻醉和手術的耐受性、系統儲備和生理自我調節能力均明顯下降,導致麻醉和手術過程中腦細胞功能易損性增加。
3.1.2 鱗狀細胞癌
鱗狀細胞癌常與高度吸煙有關,煙霧中的尼古丁會對大腦產生直接神經毒性作用并引起微血管變化,進而導致大腦的執行功能和認知儲備降低[9]。Ishibashi等[8]的研究結果顯示,戒煙時間<4周的肺切除患者POD發生率是從不吸煙、曾經吸煙和戒煙8~12周患者的2.35倍,提示術前應至少戒煙4周。其次,與其他患者相比,鱗狀細胞癌患者更容易受到氧代謝紊亂的影響,術后發生精神錯亂概率更高[9]。
研究[12-13]顯示,低PO2是POD的危險因素,其中Lu等[13]發現,PO2>100 mm Hg(1 mm Hg=0.133 kPa)的患者發生譫妄的風險是PO2為60~80 mm Hg患者的7%。Cui等[19]采用多元logistic回歸和多重測試校正后發現,當左腦組織氧飽和度(cerebral tissue oxygen saturation,SctO2)低于基線的90%(患者清醒呼吸室內空氣時的SctO2)或右腦組織氧飽和度SctO2低于基線的85%時,可能與開胸后POD的風險增加有關。然而,由于納入研究數據有限,無法得出PO2和SctO2對POD的具體影響,未來還需要開展進一步的研究進行驗證。
3.1.3 抑郁
本研究發現,抑郁是肺切除POD的獨立危險因素,最新一項納入42項研究(共4 664 051例患者),探討術前抑郁與POD相關性的Meta分析[24]結果顯示,術前抑郁患者POD發生率為29%,而非抑郁患者發生率為15%,且術前抑郁患者譫妄風險是無抑郁患者的1.91倍[95%CI(1.68,2.17),I2=42.0%]。如上所述,POD更有可能發生在已存在神經損傷、認知障礙、慢性應激和炎癥狀態的患者身上,而所有這些現象也是抑郁癥患者的癥狀反應[25]。抑郁癥與譫妄的共病機制主要為:尾狀核和基底神經節等注意力集中的腦區容量減少或功能失調;膽堿能和多巴胺能神經遞質系統失衡;或邊緣-下丘腦-垂體-腎上腺軸和應激反應長期失調[25-26]。這強調了術前需要加強對患者抑郁風險的篩查并采取治療策略,包括藥物治療、心理支持和圍手術期護理的改進,以減少POD的發生。
3.1.4 高BMI和營養不良
本Meta分析結果表明,BMI升高是POD的保護因素。一項納入
3.2 手術相關因素
在手術因素方面,本Meta結果顯示,術中單肺通氣時間是POD的獨立危險因素。單肺通氣是一種滿足手術需要的非生理性通氣方式,會增加肺內分流,導致通氣/血流比例失衡,導致低氧血癥,進而導致譫妄的發生[18]。此外,隨著通氣時間的延長,手術操作對肺組織及胸膜的機械牽拉作用增強,易導致迷走神經刺激反應,影響患者腦部供氧,從而導致POD的發生[12]。
本研究存在一些局限性:① 某些潛在的影響因素僅在1項研究中報告,無法進行Meta分析,只能進行描述性分析;② 由于漏斗圖在納入的研究數量為10項或更少時不可靠[32],因此未將其作為衡量發表偏倚的指標;③ 僅檢索中英文研究,可能遺漏了以其他語言發表的相關研究;④ 除年齡外,其他危險因素合并時納入文獻較少,穩定性和可靠性可能不佳,未來還需更多的前瞻性研究驗證;⑤ 部分研究對POD的診斷標準、評估時間、納入患者年齡、腫瘤分期存在差異,可能會增加研究的異質性。
綜上所述,本Meta分析揭示了肺切除患者POD的關鍵風險因素,包括年齡(≥60歲)、ASA分級(Ⅳ級)、糖尿病史、腦血管病史、抑郁、鱗狀細胞癌、營養不良、睡眠障礙、術中單肺通氣時間、高BMI。本研究結果表明,未來對POD的防控策略應側重于相關風險因素的管理,特別是可控因素,如糖尿病、抑郁、營養不良、BMI、睡眠障礙。雖然年齡(≥60歲)、ASA分級(Ⅳ級)、腦血管病史、鱗狀細胞癌等是不可控因素,但它們可作為有價值的預測因素,幫助醫護人員識別高危患者。其他證據有限的風險因素,包括PO2和血液生物標志物,需要在未來的研究中進一步探討,以更全面地闡明其作用。