引用本文: 康濤, 陸耀良, 李曉強, 孟慶友. 超順磁性氧化鐵標記內皮祖細胞治療靜脈血栓的示蹤研究. 中國普外基礎與臨床雜志, 2014, 21(5): 593-598. doi: 10.7507/1007-9424.20140143 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
內皮祖細胞(endothelial progenitor cells,EPCs)促進靜脈血栓機化再通已逐漸成為研究熱點[1-2]。如何在活體動態監測EPCs的分化、遷移,從而指導臨床治療已成為研究的主要內容。目前細胞磁共振成像(MRI)已被用于活體干細胞示蹤。本研究旨在討論通過超順磁性氧化鐵(SPIO)、碳青花染料(Dil)標記EPCs后并遷移歸巢至血栓中,尋找一種能無創、動態、活體監測干細胞遷移時間和路徑的最佳方法,初步探索MRI活體示蹤EPCs對靜脈血栓的治療作用。
1 材料與方法
1.1 動物、主要試劑與儀器
SD大鼠,中科院上海動物實驗中心;SPIO,美國泛華醫藥公司;EGM-2-MV-SingleQuots培養基,美國Lonza公司;Olympus相差顯微鏡、超凈工作臺、細胞培養箱及全自動化酶標儀,美國Themro公司。
1.2 大鼠骨髓源EPCs的分離、培養與鑒定
采用梯密度離心結合差速貼壁法分離培養大鼠血管EPCs,流式細胞術和免疫組織化學染色鑒定細胞表面標志,如CD34、CD133、血管內皮生長因子-2、血管性血友病因子(vWF)。具體操作方法見本研究小組前期實驗文獻[3-5]。
1.3 EPCs體外標記
1.3.1 SPIO標記EPCs
參照相關文獻[6]制備SPIO。取第3代細胞,制成細胞懸液,接種到含有25μg/mL SPIO的EGM-2-MV-SingleQuots培養基中,孵育24 h后,PBS清洗3遍,重懸于1 mL EGM-2-MV-SingleQuots培養基中。
1.3.2 Dil標記EPCs
取第3代細胞,制成細胞懸液,每1 mL細胞懸液加入配好的2μL 1,1′雙十八烷-3,3,3′,3′四甲基吲哚羧花青高氯酸鹽(CM-Dil),孵育5 min,4℃冰箱放置15 min,離心,PBS洗2遍,重懸于1 mL EGM-2-MV-SingleQuots培養基中。
1.4 大鼠下腔靜脈血栓模型制作
SD大鼠,4%水合氯醛(0.8 mL/100 g)腹腔注射麻醉后,消毒進腹。游離腎下段下腔靜脈,遠近端阻斷,縱形切開下腔靜脈前壁,取無菌明膠海綿條(直徑1 mm,長度5 mm),填入下腔靜脈內,縫合前壁切口,恢復血流,檢查切口無出血,當管腔內由暗紅色變為黑色,表明下腔靜脈血栓形成。關腹。手術時間(21±3.4)min,其中阻斷下腔靜脈血流時間(9±4.2)min。
1.5 實驗動物分組
將40只制作成功的下腔靜脈血栓大鼠模型依次編號1~40,將編號及體質量分別錄入SPSS 17.0軟件進行隨機分組,共分4組(每組10只):移植SPIO標記的EPCs(簡稱“SPIO組”)、移植Dil標記的EPCs(簡稱“Dil組”)、移植單純EPCs(簡稱“對照組”)、移植1 mL培養基(空白對照組)。
1.6 移植方法及途徑
血栓模型制備成功后2 d,將4組制備好的1 mL移植物從大鼠尾靜脈進行注射,分組標記后繼續飼養至第28 d。分別于移植術后第7、14、21及28 d取4組實驗動物行MRI、蘇木精-伊紅(HE)及免疫組織化學檢查。
1.7 移植術后MRI檢查
以水合氯醛于大鼠腹腔注射麻醉后,體外標記大鼠下腔靜脈血栓段,采用小型相控陣線圈,固定于膝關節線圈中,采用1.5 T荷蘭Philips磁共振掃描儀對此段血栓進行掃描,并完成影像處理與分析。分別觀察4組大鼠模型下腔靜脈內的SPIO信號強度及解剖形態變化。
1.8 移植術后取血栓標本行HE染色檢查
取移植術后第14 d的血栓標本,甲醛固定,石蠟包埋、切片、蘇木精染色、1%氨水返藍,伊紅染色,梯度乙醇脫水,二甲苯固定,中性樹膠封片。
1.9 移植術后取血栓標本行vWF免疫組織化學染色
取移植術后第14 d的血栓標本,甲醛固定,石蠟包埋、切片、脫蠟、抗原修復、封閉。滴加vWF一抗,孵育過夜,滴加生物素標記二抗,DAB顯色,蘇木精復染,梯度乙醇脫水,二甲苯透明,中性樹膠封片。鏡下隨機選取5個(×200)視野行毛細血管計數。
1.10 統計學方法
采用SPSS 17.0軟件對數據進行分析,計數數據以均數±標準差(
2 結果
2.1 血管EPCs原代培養結果
原代細胞接種后1 d內呈圓形,大小不一。4 d后首次換液得到晚期EPCs,形態呈多角形、三角形、短梭狀、紡錘狀或不規則形,并可觀察到形態類似于血島的干細胞集落。傳代至第6代后,細胞形態與內皮細胞形態相似,排列為典型鋪路鵝卵石樣,并可觀察到新生血管管腔。
2.2 MRI檢查結果
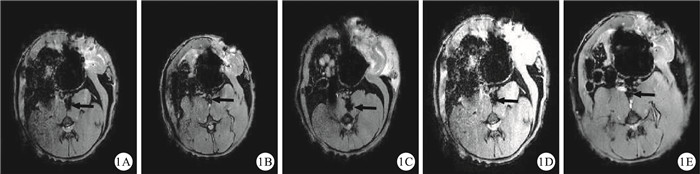
SPIO組移植術后第7 d,T2WI序列掃描在下腔靜脈內觀察到低信號影像(圖 1A),較空白對照組明顯(圖 1B);術后第14 d,顆粒狀低信號影增多,向周圍散開,邊緣不規則(圖 1C);術后第21 d,顆粒狀低信號影進一步增多,散開(圖 1D);術后第28 d,低信號影較前逐漸變淡變模糊,未出現顆粒狀低信號影,下腔靜脈恢復原來管腔結構,表明血栓逐漸機化再通(圖 1E)。Dil組、對照組及空白對照組在MRI下可見下腔靜脈管腔,但并未檢測到低密度金屬信號影像。
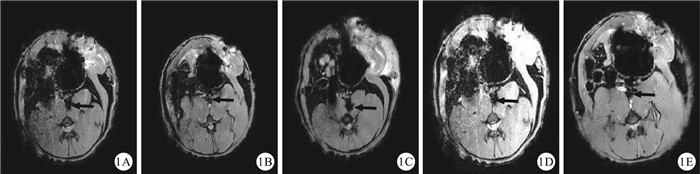 圖1
MRI檢查結果。1A:SPIO組,于移植術后第7 d,可見下腔靜脈內有一低密度信號影像(箭頭);1B:空白對照組,未移植SPIO標記的EPCs之前下腔靜脈管腔(箭頭);1C:SPIO組,移植術后第14 d,可見下腔靜脈內有一低密度信號影像,較第7 d擴大(箭頭);1D:SPIO組,移植術后第21 d,觀察到下腔靜脈內出現一低密度信號影像,其信號強度與第14 d基本相似(箭頭);1E:SPIO組,移植術后第28 d,觀察到下腔靜脈內信號強度明顯變弱,呈現原下腔靜脈管腔結構,血栓部分再通(箭頭)
Figure1.
Results of MRI examination. 1A:In SPIO group, on day 7 after transplantation, there was a low signal shade image inside inferior vena cava (arrow); 1B:In blank control group, before transplantation of EPC, inferior vena cava lumen was seen (arrow); 1C:In SPIO group, on day 14 after transplantation, there were more obvious low signal images than image on day 7 inside inferior vena cava (arrow); 1D:In SPIO group, on day 21 after transplantation, there was low density metal signal image inside inferior vena cava, and as same size as image on day 14 (arrow); 1E:In SPIO group, on day 28 after transplantation, low signal image obviously decreased inside inferior vena cava, and came back into original lumen structure, showed that thrombosis had recanalized partly (arrow)
圖1
MRI檢查結果。1A:SPIO組,于移植術后第7 d,可見下腔靜脈內有一低密度信號影像(箭頭);1B:空白對照組,未移植SPIO標記的EPCs之前下腔靜脈管腔(箭頭);1C:SPIO組,移植術后第14 d,可見下腔靜脈內有一低密度信號影像,較第7 d擴大(箭頭);1D:SPIO組,移植術后第21 d,觀察到下腔靜脈內出現一低密度信號影像,其信號強度與第14 d基本相似(箭頭);1E:SPIO組,移植術后第28 d,觀察到下腔靜脈內信號強度明顯變弱,呈現原下腔靜脈管腔結構,血栓部分再通(箭頭)
Figure1.
Results of MRI examination. 1A:In SPIO group, on day 7 after transplantation, there was a low signal shade image inside inferior vena cava (arrow); 1B:In blank control group, before transplantation of EPC, inferior vena cava lumen was seen (arrow); 1C:In SPIO group, on day 14 after transplantation, there were more obvious low signal images than image on day 7 inside inferior vena cava (arrow); 1D:In SPIO group, on day 21 after transplantation, there was low density metal signal image inside inferior vena cava, and as same size as image on day 14 (arrow); 1E:In SPIO group, on day 28 after transplantation, low signal image obviously decreased inside inferior vena cava, and came back into original lumen structure, showed that thrombosis had recanalized partly (arrow)
2.3 HE染色檢查結果
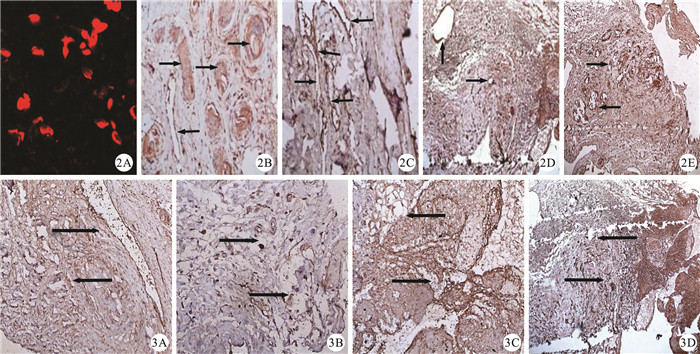
Dil組血栓標本切片在光鏡下觀察到紅色熒光,為結合了紅色細胞膜探針Dil的EPCs(圖 2A);其余組均未見紅色熒光。取第14 d血栓標本行HE染色示SPIO組(圖 2B)、Dil組(圖 2C)、對照組(圖 2D)3組血栓內出現管腔樣結構,管腔內可見大量紅細胞,血栓被新生血管分割裂解后再通,空白對照組(圖 2E)管腔樣新生血管少,血栓基本保持原狀,無明顯機化再通。
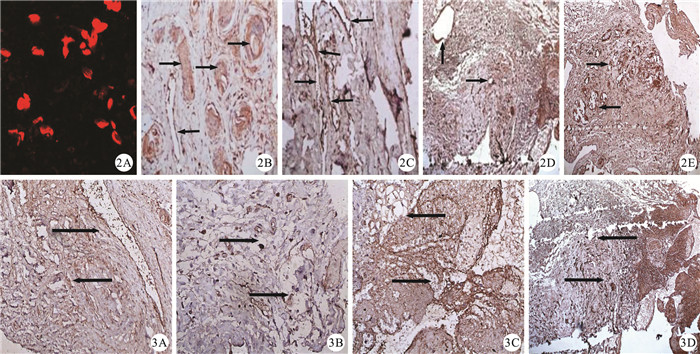 圖2
移植術后第14 d HE染色結果。2A:Dil組,血栓冰凍切片可追蹤到散在紅色熒光,即為結合了Dil的EPCs(HE×100);2B:SPIO組,血栓內有管腔結構出現(箭頭,HE×200);2C:Dil組,血栓內也可見大量管腔結構的縱切面(箭頭,HE×200);2D:對照組,血栓內也可見新生粗大血管管腔(箭頭,HE×200);2E:空白對照組,管腔樣新生血管較少,血栓基本保持原狀,無明顯機化再通(箭頭,HE×200)??圖 3?移植術后第14 d vWF免疫組織化學染色結果(×200)。3A:SPIO組,示血栓內有粗大管腔結構縱切面,管壁為褐色的內皮細胞層(箭頭);3B:Dil組,血栓內也可見大量管腔結構的橫切面(箭頭);3C:對照組,血栓內可見新生血管管腔結構(箭頭);3D:空白對照組,未見明顯新生血管,血栓無明顯機化再通(箭頭)
Figure2.
Results of HE dyeing on day 14 after transplantation. 2A:In Dil group, scattered fluorescent red was traced, which was EPCs combined with Dil (HE×100);2B:In SPIO group, there were a large of lumen structures in thrombosis (arrows, HE×200);2C:In Dil group, many longitudinal sections of lumen structures in thrombosis lumen were seen (arrows, HE×200);2D:In control group, there were a large number of new lumen structures in thrombosis (arrows, HE×200);2E:In blank control group, there were few lumen structures in thrombosis and thrombosis stayed the same and no obvious organization and recanalization (arrows, HE×200)??Figure 3?Results of immunohistochemical dyeing on day 14 after transplantation (×200). 3A:In SPIO group, there were a large of longitudinal sections of thick lumen structures in thrombosis, whose endothelial cells were dyed brown (arrows); 3B:In Dil group, there were many transverse sections of lumen structures in thrombosis (arrows); 3C:In control group, a large of new lumen structures in thrombosis (arrows); 3D:In blank control group, there were no new lumen structures in thrombosis and no obvious organization and recanalization (arrows)
圖2
移植術后第14 d HE染色結果。2A:Dil組,血栓冰凍切片可追蹤到散在紅色熒光,即為結合了Dil的EPCs(HE×100);2B:SPIO組,血栓內有管腔結構出現(箭頭,HE×200);2C:Dil組,血栓內也可見大量管腔結構的縱切面(箭頭,HE×200);2D:對照組,血栓內也可見新生粗大血管管腔(箭頭,HE×200);2E:空白對照組,管腔樣新生血管較少,血栓基本保持原狀,無明顯機化再通(箭頭,HE×200)??圖 3?移植術后第14 d vWF免疫組織化學染色結果(×200)。3A:SPIO組,示血栓內有粗大管腔結構縱切面,管壁為褐色的內皮細胞層(箭頭);3B:Dil組,血栓內也可見大量管腔結構的橫切面(箭頭);3C:對照組,血栓內可見新生血管管腔結構(箭頭);3D:空白對照組,未見明顯新生血管,血栓無明顯機化再通(箭頭)
Figure2.
Results of HE dyeing on day 14 after transplantation. 2A:In Dil group, scattered fluorescent red was traced, which was EPCs combined with Dil (HE×100);2B:In SPIO group, there were a large of lumen structures in thrombosis (arrows, HE×200);2C:In Dil group, many longitudinal sections of lumen structures in thrombosis lumen were seen (arrows, HE×200);2D:In control group, there were a large number of new lumen structures in thrombosis (arrows, HE×200);2E:In blank control group, there were few lumen structures in thrombosis and thrombosis stayed the same and no obvious organization and recanalization (arrows, HE×200)??Figure 3?Results of immunohistochemical dyeing on day 14 after transplantation (×200). 3A:In SPIO group, there were a large of longitudinal sections of thick lumen structures in thrombosis, whose endothelial cells were dyed brown (arrows); 3B:In Dil group, there were many transverse sections of lumen structures in thrombosis (arrows); 3C:In control group, a large of new lumen structures in thrombosis (arrows); 3D:In blank control group, there were no new lumen structures in thrombosis and no obvious organization and recanalization (arrows)
2.4 免疫組織化學染色結果
移植術后第14 d,血栓標本行vWF免疫組織化學染色結果顯示,SPIO組(圖 3A)、Dil組(圖 3B)、對照組(圖 3C)3組觀察到大量新生毛細血管生長,其內皮細胞被染成棕褐色;空白對照組(圖 3D)僅見少量的新生毛細血管。
2.5 免疫組織化學染色下血栓中新生毛細血管計數結果
結果見表 1。從表 1可見,SPIO組、Dil組、對照組血栓標本中的平均新生毛細血管數量較空白對照組明顯增多(P < 0.05),但3組之間差異無統計學意義(P > 0.05),3組的血栓被新生血管裂解分割,完成機化再通;空白對照組血栓形成后通過動員自體骨髓中的EPCs進入外周血,遷移至血栓中發揮促血栓機化作用,我們只觀察到少量新生毛細血管管腔。
3 討論
3.1 EPCs的體外分離與培養
1997年Asahara等[7]證實人體血管損傷后,外周血CD34+細胞可動員、遷移、募集至損傷處,參與血管新生過程。EPCs存在于骨髓、外周血、臍帶血、胚胎組織及脂肪組織[8]。其中以骨髓中的EPCs含量最高,增殖能力最強[9]。在本研究中,我們取3周齡的大鼠骨髓約1 mL,結合梯密度離心與貼壁培養法,能夠分離出充足的EPCs,經過誘導、分化、純化、傳代,細胞總數能夠達到106以上,為我們后續干細胞移植研究奠定基礎,且同種異體移植干細胞不存在免疫排斥反應,是理想的種子細胞來源。
3.2 EPCs的SPIO標記
SPIO是一種通過葡聚糖高分子包裹Fe304晶體形成核殼式結構的SPIO納米材料對比劑,主要產生較強的T2負性對比效應,其特點是粒徑小、穿透力強且弛豫率約為同樣條件下釓噴酸葡胺對比劑的7~10倍,低濃度即可在MRI上形成對比,且具有生物可降解性,能進入細胞內后將被轉移到溶酶體中被細胞代謝后進入正常血漿鐵池與紅細胞血紅蛋白結合或通過鐵蛋白的形式貯存以供細胞再利用,生物安全性較高,是目前較理想的MRI示蹤劑[10-12]。Dil是一種親脂性碳花青熒光膜染料,容易嵌入生物質膜內并在膜內做側向擴散運動從而標記整個細胞[13]。研究[14]表明,Dil無細胞毒性,對標記細胞的存活、遷移、增殖、分化等生物學特性均無影響,比較適合短期的標記示蹤。
Moldovan [1]證實,EPCs在血管形成、血栓的機化及再通中起重要作用,增加單核細胞或EPCs能夠加速栓子的再通。Peichev等[15]認為,骨髓可以產生間充質干細胞和EPCs,EPCs具備形成血管襯里的能力,間充質干細胞形成襯里附近起到支撐作用的細胞,它們能靶向于缺血組織和血栓部位,參與新生血管的形成。施森等[16]通過鼠尾膠原凝液在體外誘導EPCs建立了EPCs三維血管新生模型。但我們目前卻缺少一種對EPCs促進血管新生、加速血栓再通的有效監測方法。有文獻[17-19]報道,SPIO早已應用于神經細胞、肝臟細胞、腫瘤血管新生的干細胞示蹤研究中。Bos等[20]用SPIO標記的骨髓間充質干細胞注射至大鼠體內后進行MR干細胞示蹤,結果證實,SPIO標記的骨髓間充質干細胞具有良好的MR對比特性,標記細胞的半衰期可以維持11 d以上。Anderson等[21]通過MR細胞成像追蹤SPIO標記的EPCs向腫瘤遷移及參與血管新生的過程,其優點具有分辨率高,安全性良好,不影響EPCs的遷移、分化、轉歸等生物學特性,從而避免了傳統實驗中必須解剖實驗動物、在離體狀態下獲取組織標本進行切片分析和觀察。司逸等[22]將SPIO和綠色熒光蛋白雙標記的EPCs局部注入損傷頸動脈段腔內,術后行MR掃描,證實SPIO標記EPCs可促進動脈損傷內皮的修復,并可為MRI示蹤。
本研究中采用SPIO標記大鼠EPCs,從大鼠尾靜脈移植入下腔靜脈血栓中,MR下觀察到只有SPIO組實驗動物顯示下腔靜脈內低信號影像,Dil組、對照組和空白對照組在MRI可見下腔靜脈管腔,但并未檢測到低信號影像。SPIO組信號密度隨時間延長而增強,第14~21 d磁信號達到最強,并由此開始轉弱,第28 d,MRI觀察到下腔靜脈內信號強度明顯變弱,呈現原下腔靜脈管腔結構,血栓部分再通。這充分證明了我們最初認為SPIO組細胞中SPIO會隨著細胞有絲分裂而被平均分配至子代細胞,那么MRI信號隨之減弱,不利于細胞的長期觀察。我們在鏡下觀察發現唯有Dil組細胞顯示紅色熒光,因為Dil本身帶有紅色熒光,熒光隨時間逐漸增強,移植后第14 d熒光最強,繼而轉弱,但是其缺點是需要處死實驗動物取離體組織進行病理檢查才能得到結果。由于SPIO組、Dil組及對照組移植的EPCs的量是相同的(均為1 mL),故3組EPCs對血栓的治療作用差異無統計學意義(P > 0.05),但MRI看不到Dil組紅色熒光,只有SPIO組可以使用臨床廣泛應用的MR進行的活體追蹤,體現出實時、無創、活體監測優勢,將來有望可用于人體研究。在取材時機上我們選擇移植術后第14 d取血栓標本行HE及免疫組織化學染色是因為14 d后血栓開始進入慢性期,血栓機化再通比較明顯,這也與MRI下觀察到的干細胞分化趨勢相類似。HE染色及vWF免疫組織化學結果證明SPIO組、Dil組及對照組3組血栓標本中出現的新生毛細血管數目明顯多于空白對照組,差異有統計學意義(P < 0.01),說明EPCs能促進血管新生,加速血栓機化再通。而SPIO組、Dil組及對照組3組間新生毛細血管數目差異不具有統計學意義(P > 0.05)。
根據MRI影像結果及病理結果我們認為,SPIO組、Dil組、對照組3組EPCs均能夠分化、遷移、歸巢至血栓中,促進血管新生,加速血栓機化再通。Dil雖然也能很好地標記EPCs,但需要處死實驗動物取血栓標本進行體外病理檢查,相比之下,SPIO作為標記物進行MRI檢查更符合實驗與臨床的要求。把細胞MRI與EPCs促進血栓機化再通結合起來對干細胞移植數量、路徑及時間進行優化整合是一個新的研究思路和方向,達到了我們預期的實驗目的。
3.3 問題與展望
SPIO在干細胞MRI中的應用極大地促進了細胞示蹤技術及細胞治療的發展,但目前MRI示蹤干細胞仍有許多不足之處,如標記物對細胞的遠期安全性;標記物隨著細胞分裂,其濃度逐漸降低,缺乏長期動態MRI細胞觀察研究,因此我們未來需要提高MR硬件及軟件并結合體外病理及免疫組織化學技術,提升磁場強度、空間分辨率以及時間分辨率,利用EPCs靶向歸巢特性,將攜帶治療基因和藥物的EPCs移植入病變部位發揮其治療作用。MR細胞成像技術將為EPCs活體示蹤提供一種無創、安全、有效的方法。
內皮祖細胞(endothelial progenitor cells,EPCs)促進靜脈血栓機化再通已逐漸成為研究熱點[1-2]。如何在活體動態監測EPCs的分化、遷移,從而指導臨床治療已成為研究的主要內容。目前細胞磁共振成像(MRI)已被用于活體干細胞示蹤。本研究旨在討論通過超順磁性氧化鐵(SPIO)、碳青花染料(Dil)標記EPCs后并遷移歸巢至血栓中,尋找一種能無創、動態、活體監測干細胞遷移時間和路徑的最佳方法,初步探索MRI活體示蹤EPCs對靜脈血栓的治療作用。
1 材料與方法
1.1 動物、主要試劑與儀器
SD大鼠,中科院上海動物實驗中心;SPIO,美國泛華醫藥公司;EGM-2-MV-SingleQuots培養基,美國Lonza公司;Olympus相差顯微鏡、超凈工作臺、細胞培養箱及全自動化酶標儀,美國Themro公司。
1.2 大鼠骨髓源EPCs的分離、培養與鑒定
采用梯密度離心結合差速貼壁法分離培養大鼠血管EPCs,流式細胞術和免疫組織化學染色鑒定細胞表面標志,如CD34、CD133、血管內皮生長因子-2、血管性血友病因子(vWF)。具體操作方法見本研究小組前期實驗文獻[3-5]。
1.3 EPCs體外標記
1.3.1 SPIO標記EPCs
參照相關文獻[6]制備SPIO。取第3代細胞,制成細胞懸液,接種到含有25μg/mL SPIO的EGM-2-MV-SingleQuots培養基中,孵育24 h后,PBS清洗3遍,重懸于1 mL EGM-2-MV-SingleQuots培養基中。
1.3.2 Dil標記EPCs
取第3代細胞,制成細胞懸液,每1 mL細胞懸液加入配好的2μL 1,1′雙十八烷-3,3,3′,3′四甲基吲哚羧花青高氯酸鹽(CM-Dil),孵育5 min,4℃冰箱放置15 min,離心,PBS洗2遍,重懸于1 mL EGM-2-MV-SingleQuots培養基中。
1.4 大鼠下腔靜脈血栓模型制作
SD大鼠,4%水合氯醛(0.8 mL/100 g)腹腔注射麻醉后,消毒進腹。游離腎下段下腔靜脈,遠近端阻斷,縱形切開下腔靜脈前壁,取無菌明膠海綿條(直徑1 mm,長度5 mm),填入下腔靜脈內,縫合前壁切口,恢復血流,檢查切口無出血,當管腔內由暗紅色變為黑色,表明下腔靜脈血栓形成。關腹。手術時間(21±3.4)min,其中阻斷下腔靜脈血流時間(9±4.2)min。
1.5 實驗動物分組
將40只制作成功的下腔靜脈血栓大鼠模型依次編號1~40,將編號及體質量分別錄入SPSS 17.0軟件進行隨機分組,共分4組(每組10只):移植SPIO標記的EPCs(簡稱“SPIO組”)、移植Dil標記的EPCs(簡稱“Dil組”)、移植單純EPCs(簡稱“對照組”)、移植1 mL培養基(空白對照組)。
1.6 移植方法及途徑
血栓模型制備成功后2 d,將4組制備好的1 mL移植物從大鼠尾靜脈進行注射,分組標記后繼續飼養至第28 d。分別于移植術后第7、14、21及28 d取4組實驗動物行MRI、蘇木精-伊紅(HE)及免疫組織化學檢查。
1.7 移植術后MRI檢查
以水合氯醛于大鼠腹腔注射麻醉后,體外標記大鼠下腔靜脈血栓段,采用小型相控陣線圈,固定于膝關節線圈中,采用1.5 T荷蘭Philips磁共振掃描儀對此段血栓進行掃描,并完成影像處理與分析。分別觀察4組大鼠模型下腔靜脈內的SPIO信號強度及解剖形態變化。
1.8 移植術后取血栓標本行HE染色檢查
取移植術后第14 d的血栓標本,甲醛固定,石蠟包埋、切片、蘇木精染色、1%氨水返藍,伊紅染色,梯度乙醇脫水,二甲苯固定,中性樹膠封片。
1.9 移植術后取血栓標本行vWF免疫組織化學染色
取移植術后第14 d的血栓標本,甲醛固定,石蠟包埋、切片、脫蠟、抗原修復、封閉。滴加vWF一抗,孵育過夜,滴加生物素標記二抗,DAB顯色,蘇木精復染,梯度乙醇脫水,二甲苯透明,中性樹膠封片。鏡下隨機選取5個(×200)視野行毛細血管計數。
1.10 統計學方法
采用SPSS 17.0軟件對數據進行分析,計數數據以均數±標準差(
2 結果
2.1 血管EPCs原代培養結果
原代細胞接種后1 d內呈圓形,大小不一。4 d后首次換液得到晚期EPCs,形態呈多角形、三角形、短梭狀、紡錘狀或不規則形,并可觀察到形態類似于血島的干細胞集落。傳代至第6代后,細胞形態與內皮細胞形態相似,排列為典型鋪路鵝卵石樣,并可觀察到新生血管管腔。
2.2 MRI檢查結果
SPIO組移植術后第7 d,T2WI序列掃描在下腔靜脈內觀察到低信號影像(圖 1A),較空白對照組明顯(圖 1B);術后第14 d,顆粒狀低信號影增多,向周圍散開,邊緣不規則(圖 1C);術后第21 d,顆粒狀低信號影進一步增多,散開(圖 1D);術后第28 d,低信號影較前逐漸變淡變模糊,未出現顆粒狀低信號影,下腔靜脈恢復原來管腔結構,表明血栓逐漸機化再通(圖 1E)。Dil組、對照組及空白對照組在MRI下可見下腔靜脈管腔,但并未檢測到低密度金屬信號影像。
 圖1
MRI檢查結果。1A:SPIO組,于移植術后第7 d,可見下腔靜脈內有一低密度信號影像(箭頭);1B:空白對照組,未移植SPIO標記的EPCs之前下腔靜脈管腔(箭頭);1C:SPIO組,移植術后第14 d,可見下腔靜脈內有一低密度信號影像,較第7 d擴大(箭頭);1D:SPIO組,移植術后第21 d,觀察到下腔靜脈內出現一低密度信號影像,其信號強度與第14 d基本相似(箭頭);1E:SPIO組,移植術后第28 d,觀察到下腔靜脈內信號強度明顯變弱,呈現原下腔靜脈管腔結構,血栓部分再通(箭頭)
Figure1.
Results of MRI examination. 1A:In SPIO group, on day 7 after transplantation, there was a low signal shade image inside inferior vena cava (arrow); 1B:In blank control group, before transplantation of EPC, inferior vena cava lumen was seen (arrow); 1C:In SPIO group, on day 14 after transplantation, there were more obvious low signal images than image on day 7 inside inferior vena cava (arrow); 1D:In SPIO group, on day 21 after transplantation, there was low density metal signal image inside inferior vena cava, and as same size as image on day 14 (arrow); 1E:In SPIO group, on day 28 after transplantation, low signal image obviously decreased inside inferior vena cava, and came back into original lumen structure, showed that thrombosis had recanalized partly (arrow)
圖1
MRI檢查結果。1A:SPIO組,于移植術后第7 d,可見下腔靜脈內有一低密度信號影像(箭頭);1B:空白對照組,未移植SPIO標記的EPCs之前下腔靜脈管腔(箭頭);1C:SPIO組,移植術后第14 d,可見下腔靜脈內有一低密度信號影像,較第7 d擴大(箭頭);1D:SPIO組,移植術后第21 d,觀察到下腔靜脈內出現一低密度信號影像,其信號強度與第14 d基本相似(箭頭);1E:SPIO組,移植術后第28 d,觀察到下腔靜脈內信號強度明顯變弱,呈現原下腔靜脈管腔結構,血栓部分再通(箭頭)
Figure1.
Results of MRI examination. 1A:In SPIO group, on day 7 after transplantation, there was a low signal shade image inside inferior vena cava (arrow); 1B:In blank control group, before transplantation of EPC, inferior vena cava lumen was seen (arrow); 1C:In SPIO group, on day 14 after transplantation, there were more obvious low signal images than image on day 7 inside inferior vena cava (arrow); 1D:In SPIO group, on day 21 after transplantation, there was low density metal signal image inside inferior vena cava, and as same size as image on day 14 (arrow); 1E:In SPIO group, on day 28 after transplantation, low signal image obviously decreased inside inferior vena cava, and came back into original lumen structure, showed that thrombosis had recanalized partly (arrow)
2.3 HE染色檢查結果
Dil組血栓標本切片在光鏡下觀察到紅色熒光,為結合了紅色細胞膜探針Dil的EPCs(圖 2A);其余組均未見紅色熒光。取第14 d血栓標本行HE染色示SPIO組(圖 2B)、Dil組(圖 2C)、對照組(圖 2D)3組血栓內出現管腔樣結構,管腔內可見大量紅細胞,血栓被新生血管分割裂解后再通,空白對照組(圖 2E)管腔樣新生血管少,血栓基本保持原狀,無明顯機化再通。
 圖2
移植術后第14 d HE染色結果。2A:Dil組,血栓冰凍切片可追蹤到散在紅色熒光,即為結合了Dil的EPCs(HE×100);2B:SPIO組,血栓內有管腔結構出現(箭頭,HE×200);2C:Dil組,血栓內也可見大量管腔結構的縱切面(箭頭,HE×200);2D:對照組,血栓內也可見新生粗大血管管腔(箭頭,HE×200);2E:空白對照組,管腔樣新生血管較少,血栓基本保持原狀,無明顯機化再通(箭頭,HE×200)??圖 3?移植術后第14 d vWF免疫組織化學染色結果(×200)。3A:SPIO組,示血栓內有粗大管腔結構縱切面,管壁為褐色的內皮細胞層(箭頭);3B:Dil組,血栓內也可見大量管腔結構的橫切面(箭頭);3C:對照組,血栓內可見新生血管管腔結構(箭頭);3D:空白對照組,未見明顯新生血管,血栓無明顯機化再通(箭頭)
Figure2.
Results of HE dyeing on day 14 after transplantation. 2A:In Dil group, scattered fluorescent red was traced, which was EPCs combined with Dil (HE×100);2B:In SPIO group, there were a large of lumen structures in thrombosis (arrows, HE×200);2C:In Dil group, many longitudinal sections of lumen structures in thrombosis lumen were seen (arrows, HE×200);2D:In control group, there were a large number of new lumen structures in thrombosis (arrows, HE×200);2E:In blank control group, there were few lumen structures in thrombosis and thrombosis stayed the same and no obvious organization and recanalization (arrows, HE×200)??Figure 3?Results of immunohistochemical dyeing on day 14 after transplantation (×200). 3A:In SPIO group, there were a large of longitudinal sections of thick lumen structures in thrombosis, whose endothelial cells were dyed brown (arrows); 3B:In Dil group, there were many transverse sections of lumen structures in thrombosis (arrows); 3C:In control group, a large of new lumen structures in thrombosis (arrows); 3D:In blank control group, there were no new lumen structures in thrombosis and no obvious organization and recanalization (arrows)
圖2
移植術后第14 d HE染色結果。2A:Dil組,血栓冰凍切片可追蹤到散在紅色熒光,即為結合了Dil的EPCs(HE×100);2B:SPIO組,血栓內有管腔結構出現(箭頭,HE×200);2C:Dil組,血栓內也可見大量管腔結構的縱切面(箭頭,HE×200);2D:對照組,血栓內也可見新生粗大血管管腔(箭頭,HE×200);2E:空白對照組,管腔樣新生血管較少,血栓基本保持原狀,無明顯機化再通(箭頭,HE×200)??圖 3?移植術后第14 d vWF免疫組織化學染色結果(×200)。3A:SPIO組,示血栓內有粗大管腔結構縱切面,管壁為褐色的內皮細胞層(箭頭);3B:Dil組,血栓內也可見大量管腔結構的橫切面(箭頭);3C:對照組,血栓內可見新生血管管腔結構(箭頭);3D:空白對照組,未見明顯新生血管,血栓無明顯機化再通(箭頭)
Figure2.
Results of HE dyeing on day 14 after transplantation. 2A:In Dil group, scattered fluorescent red was traced, which was EPCs combined with Dil (HE×100);2B:In SPIO group, there were a large of lumen structures in thrombosis (arrows, HE×200);2C:In Dil group, many longitudinal sections of lumen structures in thrombosis lumen were seen (arrows, HE×200);2D:In control group, there were a large number of new lumen structures in thrombosis (arrows, HE×200);2E:In blank control group, there were few lumen structures in thrombosis and thrombosis stayed the same and no obvious organization and recanalization (arrows, HE×200)??Figure 3?Results of immunohistochemical dyeing on day 14 after transplantation (×200). 3A:In SPIO group, there were a large of longitudinal sections of thick lumen structures in thrombosis, whose endothelial cells were dyed brown (arrows); 3B:In Dil group, there were many transverse sections of lumen structures in thrombosis (arrows); 3C:In control group, a large of new lumen structures in thrombosis (arrows); 3D:In blank control group, there were no new lumen structures in thrombosis and no obvious organization and recanalization (arrows)
2.4 免疫組織化學染色結果
移植術后第14 d,血栓標本行vWF免疫組織化學染色結果顯示,SPIO組(圖 3A)、Dil組(圖 3B)、對照組(圖 3C)3組觀察到大量新生毛細血管生長,其內皮細胞被染成棕褐色;空白對照組(圖 3D)僅見少量的新生毛細血管。
2.5 免疫組織化學染色下血栓中新生毛細血管計數結果
結果見表 1。從表 1可見,SPIO組、Dil組、對照組血栓標本中的平均新生毛細血管數量較空白對照組明顯增多(P < 0.05),但3組之間差異無統計學意義(P > 0.05),3組的血栓被新生血管裂解分割,完成機化再通;空白對照組血栓形成后通過動員自體骨髓中的EPCs進入外周血,遷移至血栓中發揮促血栓機化作用,我們只觀察到少量新生毛細血管管腔。
3 討論
3.1 EPCs的體外分離與培養
1997年Asahara等[7]證實人體血管損傷后,外周血CD34+細胞可動員、遷移、募集至損傷處,參與血管新生過程。EPCs存在于骨髓、外周血、臍帶血、胚胎組織及脂肪組織[8]。其中以骨髓中的EPCs含量最高,增殖能力最強[9]。在本研究中,我們取3周齡的大鼠骨髓約1 mL,結合梯密度離心與貼壁培養法,能夠分離出充足的EPCs,經過誘導、分化、純化、傳代,細胞總數能夠達到106以上,為我們后續干細胞移植研究奠定基礎,且同種異體移植干細胞不存在免疫排斥反應,是理想的種子細胞來源。
3.2 EPCs的SPIO標記
SPIO是一種通過葡聚糖高分子包裹Fe304晶體形成核殼式結構的SPIO納米材料對比劑,主要產生較強的T2負性對比效應,其特點是粒徑小、穿透力強且弛豫率約為同樣條件下釓噴酸葡胺對比劑的7~10倍,低濃度即可在MRI上形成對比,且具有生物可降解性,能進入細胞內后將被轉移到溶酶體中被細胞代謝后進入正常血漿鐵池與紅細胞血紅蛋白結合或通過鐵蛋白的形式貯存以供細胞再利用,生物安全性較高,是目前較理想的MRI示蹤劑[10-12]。Dil是一種親脂性碳花青熒光膜染料,容易嵌入生物質膜內并在膜內做側向擴散運動從而標記整個細胞[13]。研究[14]表明,Dil無細胞毒性,對標記細胞的存活、遷移、增殖、分化等生物學特性均無影響,比較適合短期的標記示蹤。
Moldovan [1]證實,EPCs在血管形成、血栓的機化及再通中起重要作用,增加單核細胞或EPCs能夠加速栓子的再通。Peichev等[15]認為,骨髓可以產生間充質干細胞和EPCs,EPCs具備形成血管襯里的能力,間充質干細胞形成襯里附近起到支撐作用的細胞,它們能靶向于缺血組織和血栓部位,參與新生血管的形成。施森等[16]通過鼠尾膠原凝液在體外誘導EPCs建立了EPCs三維血管新生模型。但我們目前卻缺少一種對EPCs促進血管新生、加速血栓再通的有效監測方法。有文獻[17-19]報道,SPIO早已應用于神經細胞、肝臟細胞、腫瘤血管新生的干細胞示蹤研究中。Bos等[20]用SPIO標記的骨髓間充質干細胞注射至大鼠體內后進行MR干細胞示蹤,結果證實,SPIO標記的骨髓間充質干細胞具有良好的MR對比特性,標記細胞的半衰期可以維持11 d以上。Anderson等[21]通過MR細胞成像追蹤SPIO標記的EPCs向腫瘤遷移及參與血管新生的過程,其優點具有分辨率高,安全性良好,不影響EPCs的遷移、分化、轉歸等生物學特性,從而避免了傳統實驗中必須解剖實驗動物、在離體狀態下獲取組織標本進行切片分析和觀察。司逸等[22]將SPIO和綠色熒光蛋白雙標記的EPCs局部注入損傷頸動脈段腔內,術后行MR掃描,證實SPIO標記EPCs可促進動脈損傷內皮的修復,并可為MRI示蹤。
本研究中采用SPIO標記大鼠EPCs,從大鼠尾靜脈移植入下腔靜脈血栓中,MR下觀察到只有SPIO組實驗動物顯示下腔靜脈內低信號影像,Dil組、對照組和空白對照組在MRI可見下腔靜脈管腔,但并未檢測到低信號影像。SPIO組信號密度隨時間延長而增強,第14~21 d磁信號達到最強,并由此開始轉弱,第28 d,MRI觀察到下腔靜脈內信號強度明顯變弱,呈現原下腔靜脈管腔結構,血栓部分再通。這充分證明了我們最初認為SPIO組細胞中SPIO會隨著細胞有絲分裂而被平均分配至子代細胞,那么MRI信號隨之減弱,不利于細胞的長期觀察。我們在鏡下觀察發現唯有Dil組細胞顯示紅色熒光,因為Dil本身帶有紅色熒光,熒光隨時間逐漸增強,移植后第14 d熒光最強,繼而轉弱,但是其缺點是需要處死實驗動物取離體組織進行病理檢查才能得到結果。由于SPIO組、Dil組及對照組移植的EPCs的量是相同的(均為1 mL),故3組EPCs對血栓的治療作用差異無統計學意義(P > 0.05),但MRI看不到Dil組紅色熒光,只有SPIO組可以使用臨床廣泛應用的MR進行的活體追蹤,體現出實時、無創、活體監測優勢,將來有望可用于人體研究。在取材時機上我們選擇移植術后第14 d取血栓標本行HE及免疫組織化學染色是因為14 d后血栓開始進入慢性期,血栓機化再通比較明顯,這也與MRI下觀察到的干細胞分化趨勢相類似。HE染色及vWF免疫組織化學結果證明SPIO組、Dil組及對照組3組血栓標本中出現的新生毛細血管數目明顯多于空白對照組,差異有統計學意義(P < 0.01),說明EPCs能促進血管新生,加速血栓機化再通。而SPIO組、Dil組及對照組3組間新生毛細血管數目差異不具有統計學意義(P > 0.05)。
根據MRI影像結果及病理結果我們認為,SPIO組、Dil組、對照組3組EPCs均能夠分化、遷移、歸巢至血栓中,促進血管新生,加速血栓機化再通。Dil雖然也能很好地標記EPCs,但需要處死實驗動物取血栓標本進行體外病理檢查,相比之下,SPIO作為標記物進行MRI檢查更符合實驗與臨床的要求。把細胞MRI與EPCs促進血栓機化再通結合起來對干細胞移植數量、路徑及時間進行優化整合是一個新的研究思路和方向,達到了我們預期的實驗目的。
3.3 問題與展望
SPIO在干細胞MRI中的應用極大地促進了細胞示蹤技術及細胞治療的發展,但目前MRI示蹤干細胞仍有許多不足之處,如標記物對細胞的遠期安全性;標記物隨著細胞分裂,其濃度逐漸降低,缺乏長期動態MRI細胞觀察研究,因此我們未來需要提高MR硬件及軟件并結合體外病理及免疫組織化學技術,提升磁場強度、空間分辨率以及時間分辨率,利用EPCs靶向歸巢特性,將攜帶治療基因和藥物的EPCs移植入病變部位發揮其治療作用。MR細胞成像技術將為EPCs活體示蹤提供一種無創、安全、有效的方法。