引用本文: 張蔚, 楊帆, 陳衛霞, 趙一珺. 腹部惡性腫瘤術后灶性脂肪壞死的CT表現特征. 中國普外基礎與臨床雜志, 2014, 21(9): 1161-1166. doi: 10.7507/1007-9424.20140279 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
脂肪組織主要是由甘油三酯匯聚而成的微小葉結構,周圍繞以毛細血管網供養微小葉。當脂肪組織遇到突然和集中的外界壓力時,會導致小葉間隔斷裂和供養血管通路中斷;隨之脂肪細胞受損,脂肪細胞內成分釋放于周圍基質中,引起局部組織反應,導致外傷部位的不可逆病理學改變,這個病理過程即為脂肪壞死[1-2]。灶性脂肪壞死系一種包膜完整、邊界清晰的局限性脂肪壞死[3-4]。外傷[5]、凍傷[6-7]、外科手術[8-10]、放療[11]、肌肉注射[12]或其他原因所致的缺氧缺血性損傷[13-15]均是引起局部脂肪變性并繼發壞死的常見原因。1975年首次有文獻[16]報道了灶性脂肪壞死,其為1例乳腺灶性脂肪壞死的個案。最初,此類病變沒有統一的術語[3],有學者稱之為“結節-囊性脂肪壞死”[17-18]、“移動的灶性脂肪瘤”[19-20]等。隨著對此類病變認識的加深,越來越多的學者[4, 21-23]認為,“灶性脂肪壞死”這一術語最能高度概括此類病變的特征。灶性脂肪壞死的病灶大小會隨時間延長而縮小,是一種自限性疾病[24],不會引起嚴重的病理學改變[2, 24],大多在腹部影像學檢查時偶然發現,在無明顯臨床癥狀時不需要采取手術切除或其他特殊治療[2]。關于腹部惡性腫瘤術后繼發灶性脂肪壞死的影像學診斷和鑒別診斷,文獻報道得較少。由于惡性腫瘤術后灶性脂肪壞死和腫瘤復發及轉移在影像學上的表現具有一些相似之處,而其轉歸和后續治療措施卻截然不同,所以正確診斷灶性脂肪壞死至關重要。本研究旨在總結惡性腫瘤術后灶性脂肪壞死的CT表現特征,并總結其與術后復發或轉移的鑒別要點,以避免不必要的手術干預或其他治療措施,從而減少患者的生理創傷,消除心理恐懼。
1 資料與方法
1.1 臨床資料
回顧性收集2012年2月至2014年5月期間因腹部惡性腫瘤于筆者所在醫院或外院行外科手術切除、術后在筆者所在醫院放射科行CT檢查隨訪的連續性病例,共納入了腹部手術后繼發灶性脂肪壞死患者36例。其原發腫瘤包括:胃癌患者14例(男9例,女5例),結腸癌患者8例(男4例,女4例),直腸癌患者14例(男9例,女5例);年齡29~80歲,平均年齡為55歲(其中45歲及以上患者34例)。14例胃癌患者中,7例行根治性全胃切除術,6例行遠端胃癌根治術,1例行根治性賁門癌切除術。8例結腸癌患者中,6例行右半結腸癌根治術,2例行左半結腸癌根治術。14例直腸癌患者中,8例行直腸癌低位前切術,3例行直腸癌高位前切術,3例具體術式不明。
1.2 檢查設備及參數
本組病例中有24例采用Siemens Somatom Definition AS+128層螺旋CT掃描儀掃描。掃描參數:管電壓120 kV,管電流104 mA,螺距(pitch)1.000,準直0.60 mm,掃描層厚2 mm,重建層厚2 mm,矩陣512×512。12例采用Philips Brilliance 64排螺旋CT掃描儀掃描,掃描參數:管電壓120 kV,管電流200 mA,螺距0.969,準直1.25 mm,掃描層厚2 mm,重建層厚2 mm,矩陣512×512。所有患者掃描時均取仰臥位,掃描范圍為全腹。先行平掃,增強掃描時采用高壓注射器經肘正中靜脈注射碘海醇注射液(碘含量為370 mg/mL)90 mL,注射速率為2.5 mL/s。分別于注射對比劑開始后25 s和50 s行動脈期和門靜脈期掃描。
1.3 影像學評價
由從事腹部影像診斷的3名醫師獨立對CT圖像進行分析,所有醫師均知曉患者的腹部惡性腫瘤手術史,但不知曉患者術后的臨床癥狀、體征及腫瘤標志物檢測結果。3名醫師結論一致時即達成診斷,不一致時經協商達到共識。為減少誤差,由其中1名醫師測量并記錄全部病灶的部位、大小、密度及增強表現特征。
1.4 隨訪時間
本組患者中有25例患者(胃癌術后11例,結腸癌術后5例,直腸癌術后9例)術后接受了>3次的CT隨訪(隨訪次數超過3次的患者也僅記錄符
合后述時間要求的3次連續隨訪CT結果,見表 1),有11例患者(胃癌術后3例,結腸癌術后3例,直腸癌術后5例)接受了3次CT隨訪。首次隨訪時間為術后2個月內,第2次隨訪時間為術后2~8個月,第3次隨訪時間為術后9~15個月。
2 結果
2.1 CT掃描征象
CT檢查所示灶性脂肪壞死的CT征象有以下幾個方面。①數目:有3例患者(8.3%,直腸癌術后1例,結腸癌術后2例)發現2個腹腔內灶性脂肪壞死灶,其余33例患者(91.7%)皆為單發病灶,共計39個病灶。②位置:39個病灶(100%)的位置皆與手術路徑一致,脂肪壞死灶分別位于手術切口下方大網膜、手術經過的腸系膜、原腫瘤周圍脂肪間隙或結腸旁溝區。其中有2個單發病灶(5.1%)經多次隨訪,其位置發生改變,提示病灶在腹腔內呈現一定的游走性(圖 1)。③形態:39個病灶(100%)均表現為形態規則、輪廓光整的團塊,呈圓形或類圓形,無分葉,均具有厚度均勻的完整包膜。④CT平掃密度:初次隨訪時,39個病灶(100%)均表現為由外周脂肪密度環包繞的不均勻軟組織密度團塊,環外包膜表現為較均勻的軟組織密度;隨時間推移,有2個病灶(5.1%)中心軟組織結節消失(圖 2),即表現為包膜完整的脂肪密度團塊,包膜密度不變。16個病灶(41.0%)伴點狀、小結節狀或斑片狀鈣化(圖 3)。⑤強化特征:動脈期病灶內軟組織結節均未見強化,包膜呈輕度強化;門靜脈期病灶內軟組織結節呈不均勻輕度強化,包膜持續強化,強化程度較動脈期稍增強。比較雙期強化特征,可知灶內軟組織結節均具有延遲輕度強化的特點。⑥邊緣及周圍改變:邊緣均較清晰(14個病灶邊緣見少許條索狀影,占35.9%),周圍脂肪間隙密度未見增高,周圍器官未見受侵。⑦大小:初次隨訪病灶長徑為1.5~5.0 cm,短徑為0.9~4.1 cm;其中37個病灶(94.8%)隨著隨訪時間的延長逐漸縮小,1個病灶(2.6%)3次隨訪其大小無變化,1個病灶(2.6%)先稍增大后縮小。術后病灶大小的3次隨訪結果見表 1,由表 1可見,胃癌、結腸癌及直腸癌術后繼發灶性脂肪壞死者,其病灶大小隨隨訪時間延長呈縮小趨勢。⑧原發腫瘤手術部位的表現:胃腸和腸道吻合口無增厚,管腔無狹窄,增強掃描未見異常強化;吻合口周圍脂肪間隙清晰。
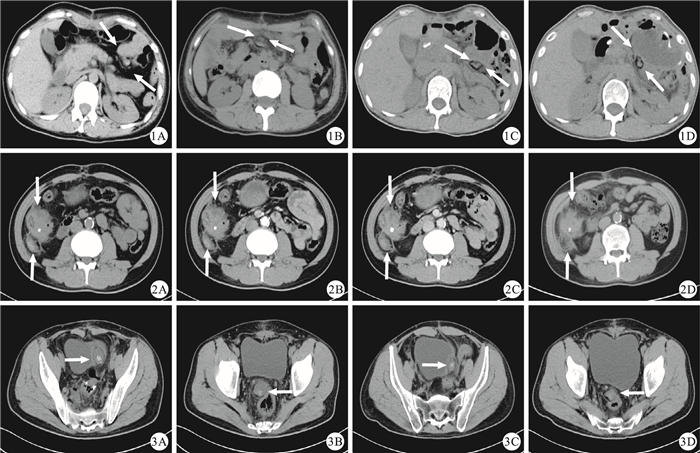
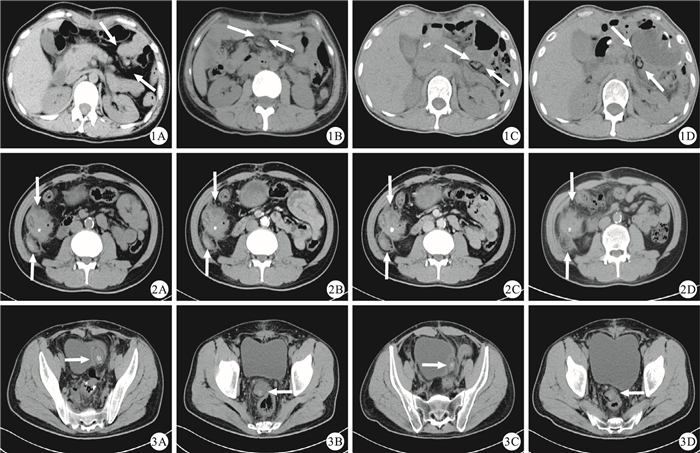 圖1
示39歲女性胃癌患者行遠端胃癌根治術后繼發性灶性脂肪壞死(白箭)的CT檢查隨訪結果。1A:術后1.5個月,CT檢查示胰尾前方有一2.8 cm×1.8 cm大的混雜密度結節,外周見脂肪密度環及包膜;1B、1C及1D:術后9.0(1B)、15.0(1C)及17.0個月(1D)的CT檢查圖片示灶性脂肪壞死灶的位置發生改變,在腸系膜區呈現一定的“游走性”,病灶隨隨訪時間的延長稍縮小??圖 2??示49歲男性升結腸癌患者術后繼發性灶性脂肪壞死(下白箭)的CT檢查隨訪結果,該患者同時合并吻合口下方結腸轉移癌(上白箭)。2A:術后0.5個月,CT平掃圖像示升結腸近段有一不規則腫塊向腔內突出,與盲腸和末端回腸相粘連,周圍脂肪間隙模糊,右側腹膜增厚,此為升結腸癌轉移表現,且轉移灶右后方見一邊緣清晰的卵圓形混雜密度結節,最大截面為4.2 cm×2.5 cm大,外周見環狀脂肪密度影,包膜完整,此為灶性脂肪壞死;2B:術后0.5個月,CT增強掃描動脈期圖像示轉移瘤輕度且不均勻強化,灶性脂肪壞死未見強化;2C:術后0.5個月,CT增強掃描門靜脈期圖像示轉移瘤不均勻且持續強化,且強化較動脈期明顯,灶性脂肪壞死輕度強化,且強化較為均勻;2D:術后5.0個月,CT檢查示轉移瘤大小未見明顯變化,而脂肪壞死灶稍減小(3.1 cm×2.5 cm大),中央密度減低,以脂肪密度為主??圖 3??示45歲男性直腸癌患者術后2個灶性脂肪壞死(白箭)的CT隨訪結果。3A和3B:術后1.0個月,CT檢查示直腸右旁及膀胱左旁分別見一最大截面為3.6 cm×3.2 cm大(3A)和3.3 cm×2.7 cm(3B)大的混雜密度團塊,內見斑片狀鈣化影,外周見環狀脂肪密度影及稍高密度包膜;3C和3D:術后5.0個月,CT檢查示前述2個病灶減小,大小分別為2.9 cm×1.8 cm(3C)和3.2 cm×2.4 cm(3D)
Figure1.
The CT images of a 39-year-old woman who had experienced encapsulated fat necrosis (white arrow) secondary to a distal gastrectomy for gastric cancer.1A:CT image obtained 1.5 months after the operation showed that there was an mixed density nodule which matched 2.8 cm×1.8 cm, with fat density ring and capsule encircling it; 1B, 1C and 1D:CT images obtained in 9.0 (1B), 15.0 (1C), and 17.0 (1D) months after the operation showed that encapsulated fat necrosis had changed position, which turned out to "mobility" within the mesentery, and the size of the lesion had decreased slightly over time??Figure 2??The CT images of a 49-year-old man who had encapsulated fat necrosis secondary surgery (lower white arrow)for ascending colon carcinoma.The patient also had metastases below the anastomotic stoma(upper white arrow).2A:Plain CT image which obtained in half a month after operation showed that there was an irregular mass sited in inferior ascending colon(below the anastomotic), with blurry perivisceral fat clearance and mesenteric lymphatic nodes enlargement, which was considered as metastasis and later be confirmed by surgery and pathology, yet another nodule also be found on the right of above-mentioned mass (maximum cross-section was about 4.2 cm×2.5 cm) and it was a well-defined oval nodule with peripheral fat attenuation, which was diagnosed as postoperative intra-abdominal encapsulated fat necrosis; 2B:Arterial phase CT enhanced image obtained in half a month after operation showed that the metastatic tumor enhanced slightly and unevenly, while the encapsulated fat necrosis was not seen strengthening; 2C:The portal vein phase CT enhanced image obtained in half a month after operation showed that metastatic tumor was intensified more obviously than that of arterial period, while the encapsulated fat necrosis showed slight enforcement; 2D:The CT image obtained in 5.0 months after operation showed that the metastasis changed non-significantly, however, the central density of well-capsulated nodule turned to predominantly fat density and the size of the lesion decreased to some extent (3.1 cm×2.5 cm)??Figure 3??The CT images of a 45-year-old man who had experienced encapsulated fat necrosis (white arrow) secondary to rectal high anterior resection.3A and 3B:Plain CT image obtained in a month after operation revealed that both the left side of the bladder and the right side of the rectum had a lesion, and the sizes of the two lesions were 3.6 cm×3.2 cm (3A) and 3.3 cm×2.7 cm (3B) respectively; 3C and 3D:CT image obtained in 5.0 months after operation showed that the sizes of 2 lesions decreased, which were 2.9 cm×1.8 cm (3C) and 3.2 cm×2.4 cm (3D) respectively
圖1
示39歲女性胃癌患者行遠端胃癌根治術后繼發性灶性脂肪壞死(白箭)的CT檢查隨訪結果。1A:術后1.5個月,CT檢查示胰尾前方有一2.8 cm×1.8 cm大的混雜密度結節,外周見脂肪密度環及包膜;1B、1C及1D:術后9.0(1B)、15.0(1C)及17.0個月(1D)的CT檢查圖片示灶性脂肪壞死灶的位置發生改變,在腸系膜區呈現一定的“游走性”,病灶隨隨訪時間的延長稍縮小??圖 2??示49歲男性升結腸癌患者術后繼發性灶性脂肪壞死(下白箭)的CT檢查隨訪結果,該患者同時合并吻合口下方結腸轉移癌(上白箭)。2A:術后0.5個月,CT平掃圖像示升結腸近段有一不規則腫塊向腔內突出,與盲腸和末端回腸相粘連,周圍脂肪間隙模糊,右側腹膜增厚,此為升結腸癌轉移表現,且轉移灶右后方見一邊緣清晰的卵圓形混雜密度結節,最大截面為4.2 cm×2.5 cm大,外周見環狀脂肪密度影,包膜完整,此為灶性脂肪壞死;2B:術后0.5個月,CT增強掃描動脈期圖像示轉移瘤輕度且不均勻強化,灶性脂肪壞死未見強化;2C:術后0.5個月,CT增強掃描門靜脈期圖像示轉移瘤不均勻且持續強化,且強化較動脈期明顯,灶性脂肪壞死輕度強化,且強化較為均勻;2D:術后5.0個月,CT檢查示轉移瘤大小未見明顯變化,而脂肪壞死灶稍減小(3.1 cm×2.5 cm大),中央密度減低,以脂肪密度為主??圖 3??示45歲男性直腸癌患者術后2個灶性脂肪壞死(白箭)的CT隨訪結果。3A和3B:術后1.0個月,CT檢查示直腸右旁及膀胱左旁分別見一最大截面為3.6 cm×3.2 cm大(3A)和3.3 cm×2.7 cm(3B)大的混雜密度團塊,內見斑片狀鈣化影,外周見環狀脂肪密度影及稍高密度包膜;3C和3D:術后5.0個月,CT檢查示前述2個病灶減小,大小分別為2.9 cm×1.8 cm(3C)和3.2 cm×2.4 cm(3D)
Figure1.
The CT images of a 39-year-old woman who had experienced encapsulated fat necrosis (white arrow) secondary to a distal gastrectomy for gastric cancer.1A:CT image obtained 1.5 months after the operation showed that there was an mixed density nodule which matched 2.8 cm×1.8 cm, with fat density ring and capsule encircling it; 1B, 1C and 1D:CT images obtained in 9.0 (1B), 15.0 (1C), and 17.0 (1D) months after the operation showed that encapsulated fat necrosis had changed position, which turned out to "mobility" within the mesentery, and the size of the lesion had decreased slightly over time??Figure 2??The CT images of a 49-year-old man who had encapsulated fat necrosis secondary surgery (lower white arrow)for ascending colon carcinoma.The patient also had metastases below the anastomotic stoma(upper white arrow).2A:Plain CT image which obtained in half a month after operation showed that there was an irregular mass sited in inferior ascending colon(below the anastomotic), with blurry perivisceral fat clearance and mesenteric lymphatic nodes enlargement, which was considered as metastasis and later be confirmed by surgery and pathology, yet another nodule also be found on the right of above-mentioned mass (maximum cross-section was about 4.2 cm×2.5 cm) and it was a well-defined oval nodule with peripheral fat attenuation, which was diagnosed as postoperative intra-abdominal encapsulated fat necrosis; 2B:Arterial phase CT enhanced image obtained in half a month after operation showed that the metastatic tumor enhanced slightly and unevenly, while the encapsulated fat necrosis was not seen strengthening; 2C:The portal vein phase CT enhanced image obtained in half a month after operation showed that metastatic tumor was intensified more obviously than that of arterial period, while the encapsulated fat necrosis showed slight enforcement; 2D:The CT image obtained in 5.0 months after operation showed that the metastasis changed non-significantly, however, the central density of well-capsulated nodule turned to predominantly fat density and the size of the lesion decreased to some extent (3.1 cm×2.5 cm)??Figure 3??The CT images of a 45-year-old man who had experienced encapsulated fat necrosis (white arrow) secondary to rectal high anterior resection.3A and 3B:Plain CT image obtained in a month after operation revealed that both the left side of the bladder and the right side of the rectum had a lesion, and the sizes of the two lesions were 3.6 cm×3.2 cm (3A) and 3.3 cm×2.7 cm (3B) respectively; 3C and 3D:CT image obtained in 5.0 months after operation showed that the sizes of 2 lesions decreased, which were 2.9 cm×1.8 cm (3C) and 3.2 cm×2.4 cm (3D) respectively
2.2 術后臨床表現及隨訪結果
本組患者獲訪36例,隨訪時間為0.5~15個月,中位數為10個月。隨訪期間,5例術后發生腫瘤轉移,其余31例未發生復發或轉移。未發生復發轉移的31例患者中,僅1例男性患者于術后持續存在腹部鈍痛,但不伴惡心、嘔吐、發熱、黃疸、腹瀉等其他癥狀;其余30例患者術后無不適,一般情況良好。
2.3 術前及術后血清癌胚抗原(CEA)和CA-125水平
對納入病例術前及術后(最接近手術日期的一次)血清CEA和CA-125水平的評估,均依據的是四川大學華西醫院的標準:CEA低于3.4 ng/mL即為陰性,CA-125低于35 U/mL即為陰性。術后5例臨床確診發生腫瘤轉移。①3例結腸癌患者術后發生肝轉移,其術前CEA都為陽性,CA-125都為陰性。術后1例CEA轉為陰性(下降),CA-125轉為陽性(升高),另2例CEA和CA-125水平與術前基本一致。②1例結腸癌患者術后發生吻合口近端結腸轉移,其術前CEA陽性、CA-125陰性,術后兩者水平與術前基本一致。③1例胃癌患者術后發生雙側卵巢轉移,術前CEA和CA-125都為陰性,術后CA-125轉為陽性(升高),CEA仍為陰性。
31例未發生復發或轉移。①1例手術前后的CEA和CA-125水平未知。②11例術前的CEA和CA-125水平未知。術后有10例該2個指標均為陰性;1例CA-125陽性,但水平有逐漸降低的趨勢(該例患者術后CEA為陰性)。③8例手術前后的CEA和CA-125皆為陰性。④7例術前CEA陽性,術后陰性(其CA-125始終陰性)。⑤1例術前CA-125陽性,術后陰性(CEA始終陰性)。⑥1例術前CEA和CA-125皆為陽性,術后皆為陰性。⑦2例術前CEA陽性、CA-125陰性,術后CEA轉為陰性(下降),CA-125轉為陽性(升高)。綜上所述,除1例患者手術前后的CEA和CA-125水平未知外,另外30例腹部惡性腫瘤術后未合并腫瘤復發和轉移的灶性脂肪壞死患者中,有90.0%(27/30)的患者術后血清CEA和CA-125均陰性。其余10.0%(3/30)的患者術后血清CA-125陽性,該3例患者均為中老年男性胃癌術后患者:1例有慢性肝炎(44年)和術后出血史;1例有術后粘連性腸梗阻史;1例術后無特殊臨床表現,但主訴睡眠和飲食情況差。
3 討論
脂肪是一種代謝活躍的組織,可能在一系列的機理作用下發生壞死[25]。它可以引起腹部疼痛(臨床表現與急腹癥相似),也可能不出現任何臨床癥狀而僅伴隨其他病理學變化[25]。脂肪壞死是由于脂肪組織損傷而產生的一種少見的良性非化膿性炎性病變,在全身各部位均可發生。其臨床表現不具特征性,加之對其認識不足,臨床誤診率及漏診率均較高[26]。對其的診斷主要依靠影像學檢查和臨床病史[23, 25]。筆者主要針對腹部惡性腫瘤術后灶性脂肪壞死進行討論,共回顧性納入了36例胃腸道惡性腫瘤術后繼發灶性脂肪壞死病例,現將其特征性表現總結如下。
3.1 CT表現
脂肪壞死灶在CT圖像上顯示為單發或者多發[25, 27],有一定游走性[24, 28],病灶包膜完整[4, 5, 23, 27-28],中心結節密度不均勻,病灶大小可隨隨訪時間的延長而縮小(即呈現一定的自限性),周圍伴或不伴少許條索狀影;增強掃描表現為動脈期無確切強化,門靜脈期輕度強化。不同于術后復發、轉移等惡性病變,術后灶性脂肪壞死具有以下特征性表現:可見環狀脂肪密度影,病變較局限、不會侵襲鄰近器官;其形態規則,包膜完整,病灶隨病程遷延可縮小或消失。環狀脂肪影可能與泡沫細胞或壞死的細胞碎片將殘存的正常脂肪細胞推擠至外圍有關,但有待進一步證實。當脂肪細胞受損時,脂肪被分解為甘油和脂肪酸;游離脂肪酸與游離鈣離子結合后,形成難溶于水的脂肪酸鈣,呈點狀或斑片樣鈣化[29]。包膜主要由纖維結締組織構成[22, 30-31],其細胞排列致密,血流分布較慢,所以表現為延遲強化。除纖維結締組織外,鈣化、排列緊密的泡沫細胞也會減慢血流的灌注和彌散,此種病理學變化可以解釋中心結節的延遲強化。
3.2 腫瘤標志物及臨床表現
除上述典型的CT表現外,本研究還發現,手術前后腫瘤標志物水平的變化和臨床表現也有助于對腹部惡性腫瘤術后灶性脂肪壞死與腫瘤復發或轉移的鑒別。灶性脂肪壞死的患者常不伴明顯的臨床表現,或僅出現單純性腹痛(無惡心、嘔吐、發熱、黃疸、腹瀉等伴隨癥狀)。灶性脂肪壞死患者的術后CEA和CA-125通常呈陰性,偶爾會出現術后CA-125輕度升高的情況,其具體原因不明,可能與術后出血或感染有關,亦有可能已有潛在的微小轉移或復發灶,只是此次檢查尚未能發現,甚至尚不能由目前的影像學檢查手段發現,其準確機理有待進一步研究。
對大多數病例,結合手術史和CT特征性表現,診斷腹部惡性腫瘤術后灶性脂肪壞死并不困難。對于一些診斷或鑒別診斷困難的病例,結合腫瘤標志物水平(CEA和CA-125)及術后臨床表現,均有助于與復發相鑒別;多次檢查病灶位置和觀察病灶形態變化亦有助于明確診斷。各層次的影像診斷醫師應對該術后繼發性改變有清醒的認識。在特殊情況下,小而局限的復發癌和轉移癌也會呈現出與灶性脂肪壞相似的影像學表現,定期復查甚至組織活檢可助于明確診斷。灶性脂肪壞死在大體病理學上的表現類似于“煮熟的雞蛋”:整體外觀光滑,切面中心部分為黃色固體,形似“煮熟的蛋黃”;包膜為質韌纖維組織,形似“煮熟的蛋清”[30-31]。
3.3 本研究的不足
本研究存在以下不足:首先,CT掃描儀及處理技術不統一,但符合真實臨床情況;其次,本研究CT圖像上病灶大小的測量存在一定的測量誤差;第三,本研究患者為行胃腸道惡性腫瘤手術的患者,以中老年居多,存在選擇性偏倚。
綜上所述,腹部惡性腫瘤手術可繼發腹腔內灶性脂肪壞死,其CT表現具有一定的特征性,只要影像檢查醫生對此類繼發性改變有充分的認識,大多能明確診斷。對部分診斷困難的病例,結合術后多次隨訪CT圖像顯示的病灶大小、位置變化、密度等特征,以及手術前后的CEA、CA-125水平和臨床表現,均有助于明確診斷及其與腫瘤復發或轉移的鑒別診斷,從而避免不必要的臨床干預(尤其是手術干預),以減少患者的生理創傷,消除心理恐懼。
脂肪組織主要是由甘油三酯匯聚而成的微小葉結構,周圍繞以毛細血管網供養微小葉。當脂肪組織遇到突然和集中的外界壓力時,會導致小葉間隔斷裂和供養血管通路中斷;隨之脂肪細胞受損,脂肪細胞內成分釋放于周圍基質中,引起局部組織反應,導致外傷部位的不可逆病理學改變,這個病理過程即為脂肪壞死[1-2]。灶性脂肪壞死系一種包膜完整、邊界清晰的局限性脂肪壞死[3-4]。外傷[5]、凍傷[6-7]、外科手術[8-10]、放療[11]、肌肉注射[12]或其他原因所致的缺氧缺血性損傷[13-15]均是引起局部脂肪變性并繼發壞死的常見原因。1975年首次有文獻[16]報道了灶性脂肪壞死,其為1例乳腺灶性脂肪壞死的個案。最初,此類病變沒有統一的術語[3],有學者稱之為“結節-囊性脂肪壞死”[17-18]、“移動的灶性脂肪瘤”[19-20]等。隨著對此類病變認識的加深,越來越多的學者[4, 21-23]認為,“灶性脂肪壞死”這一術語最能高度概括此類病變的特征。灶性脂肪壞死的病灶大小會隨時間延長而縮小,是一種自限性疾病[24],不會引起嚴重的病理學改變[2, 24],大多在腹部影像學檢查時偶然發現,在無明顯臨床癥狀時不需要采取手術切除或其他特殊治療[2]。關于腹部惡性腫瘤術后繼發灶性脂肪壞死的影像學診斷和鑒別診斷,文獻報道得較少。由于惡性腫瘤術后灶性脂肪壞死和腫瘤復發及轉移在影像學上的表現具有一些相似之處,而其轉歸和后續治療措施卻截然不同,所以正確診斷灶性脂肪壞死至關重要。本研究旨在總結惡性腫瘤術后灶性脂肪壞死的CT表現特征,并總結其與術后復發或轉移的鑒別要點,以避免不必要的手術干預或其他治療措施,從而減少患者的生理創傷,消除心理恐懼。
1 資料與方法
1.1 臨床資料
回顧性收集2012年2月至2014年5月期間因腹部惡性腫瘤于筆者所在醫院或外院行外科手術切除、術后在筆者所在醫院放射科行CT檢查隨訪的連續性病例,共納入了腹部手術后繼發灶性脂肪壞死患者36例。其原發腫瘤包括:胃癌患者14例(男9例,女5例),結腸癌患者8例(男4例,女4例),直腸癌患者14例(男9例,女5例);年齡29~80歲,平均年齡為55歲(其中45歲及以上患者34例)。14例胃癌患者中,7例行根治性全胃切除術,6例行遠端胃癌根治術,1例行根治性賁門癌切除術。8例結腸癌患者中,6例行右半結腸癌根治術,2例行左半結腸癌根治術。14例直腸癌患者中,8例行直腸癌低位前切術,3例行直腸癌高位前切術,3例具體術式不明。
1.2 檢查設備及參數
本組病例中有24例采用Siemens Somatom Definition AS+128層螺旋CT掃描儀掃描。掃描參數:管電壓120 kV,管電流104 mA,螺距(pitch)1.000,準直0.60 mm,掃描層厚2 mm,重建層厚2 mm,矩陣512×512。12例采用Philips Brilliance 64排螺旋CT掃描儀掃描,掃描參數:管電壓120 kV,管電流200 mA,螺距0.969,準直1.25 mm,掃描層厚2 mm,重建層厚2 mm,矩陣512×512。所有患者掃描時均取仰臥位,掃描范圍為全腹。先行平掃,增強掃描時采用高壓注射器經肘正中靜脈注射碘海醇注射液(碘含量為370 mg/mL)90 mL,注射速率為2.5 mL/s。分別于注射對比劑開始后25 s和50 s行動脈期和門靜脈期掃描。
1.3 影像學評價
由從事腹部影像診斷的3名醫師獨立對CT圖像進行分析,所有醫師均知曉患者的腹部惡性腫瘤手術史,但不知曉患者術后的臨床癥狀、體征及腫瘤標志物檢測結果。3名醫師結論一致時即達成診斷,不一致時經協商達到共識。為減少誤差,由其中1名醫師測量并記錄全部病灶的部位、大小、密度及增強表現特征。
1.4 隨訪時間
本組患者中有25例患者(胃癌術后11例,結腸癌術后5例,直腸癌術后9例)術后接受了>3次的CT隨訪(隨訪次數超過3次的患者也僅記錄符
合后述時間要求的3次連續隨訪CT結果,見表 1),有11例患者(胃癌術后3例,結腸癌術后3例,直腸癌術后5例)接受了3次CT隨訪。首次隨訪時間為術后2個月內,第2次隨訪時間為術后2~8個月,第3次隨訪時間為術后9~15個月。
2 結果
2.1 CT掃描征象
CT檢查所示灶性脂肪壞死的CT征象有以下幾個方面。①數目:有3例患者(8.3%,直腸癌術后1例,結腸癌術后2例)發現2個腹腔內灶性脂肪壞死灶,其余33例患者(91.7%)皆為單發病灶,共計39個病灶。②位置:39個病灶(100%)的位置皆與手術路徑一致,脂肪壞死灶分別位于手術切口下方大網膜、手術經過的腸系膜、原腫瘤周圍脂肪間隙或結腸旁溝區。其中有2個單發病灶(5.1%)經多次隨訪,其位置發生改變,提示病灶在腹腔內呈現一定的游走性(圖 1)。③形態:39個病灶(100%)均表現為形態規則、輪廓光整的團塊,呈圓形或類圓形,無分葉,均具有厚度均勻的完整包膜。④CT平掃密度:初次隨訪時,39個病灶(100%)均表現為由外周脂肪密度環包繞的不均勻軟組織密度團塊,環外包膜表現為較均勻的軟組織密度;隨時間推移,有2個病灶(5.1%)中心軟組織結節消失(圖 2),即表現為包膜完整的脂肪密度團塊,包膜密度不變。16個病灶(41.0%)伴點狀、小結節狀或斑片狀鈣化(圖 3)。⑤強化特征:動脈期病灶內軟組織結節均未見強化,包膜呈輕度強化;門靜脈期病灶內軟組織結節呈不均勻輕度強化,包膜持續強化,強化程度較動脈期稍增強。比較雙期強化特征,可知灶內軟組織結節均具有延遲輕度強化的特點。⑥邊緣及周圍改變:邊緣均較清晰(14個病灶邊緣見少許條索狀影,占35.9%),周圍脂肪間隙密度未見增高,周圍器官未見受侵。⑦大小:初次隨訪病灶長徑為1.5~5.0 cm,短徑為0.9~4.1 cm;其中37個病灶(94.8%)隨著隨訪時間的延長逐漸縮小,1個病灶(2.6%)3次隨訪其大小無變化,1個病灶(2.6%)先稍增大后縮小。術后病灶大小的3次隨訪結果見表 1,由表 1可見,胃癌、結腸癌及直腸癌術后繼發灶性脂肪壞死者,其病灶大小隨隨訪時間延長呈縮小趨勢。⑧原發腫瘤手術部位的表現:胃腸和腸道吻合口無增厚,管腔無狹窄,增強掃描未見異常強化;吻合口周圍脂肪間隙清晰。
 圖1
示39歲女性胃癌患者行遠端胃癌根治術后繼發性灶性脂肪壞死(白箭)的CT檢查隨訪結果。1A:術后1.5個月,CT檢查示胰尾前方有一2.8 cm×1.8 cm大的混雜密度結節,外周見脂肪密度環及包膜;1B、1C及1D:術后9.0(1B)、15.0(1C)及17.0個月(1D)的CT檢查圖片示灶性脂肪壞死灶的位置發生改變,在腸系膜區呈現一定的“游走性”,病灶隨隨訪時間的延長稍縮小??圖 2??示49歲男性升結腸癌患者術后繼發性灶性脂肪壞死(下白箭)的CT檢查隨訪結果,該患者同時合并吻合口下方結腸轉移癌(上白箭)。2A:術后0.5個月,CT平掃圖像示升結腸近段有一不規則腫塊向腔內突出,與盲腸和末端回腸相粘連,周圍脂肪間隙模糊,右側腹膜增厚,此為升結腸癌轉移表現,且轉移灶右后方見一邊緣清晰的卵圓形混雜密度結節,最大截面為4.2 cm×2.5 cm大,外周見環狀脂肪密度影,包膜完整,此為灶性脂肪壞死;2B:術后0.5個月,CT增強掃描動脈期圖像示轉移瘤輕度且不均勻強化,灶性脂肪壞死未見強化;2C:術后0.5個月,CT增強掃描門靜脈期圖像示轉移瘤不均勻且持續強化,且強化較動脈期明顯,灶性脂肪壞死輕度強化,且強化較為均勻;2D:術后5.0個月,CT檢查示轉移瘤大小未見明顯變化,而脂肪壞死灶稍減小(3.1 cm×2.5 cm大),中央密度減低,以脂肪密度為主??圖 3??示45歲男性直腸癌患者術后2個灶性脂肪壞死(白箭)的CT隨訪結果。3A和3B:術后1.0個月,CT檢查示直腸右旁及膀胱左旁分別見一最大截面為3.6 cm×3.2 cm大(3A)和3.3 cm×2.7 cm(3B)大的混雜密度團塊,內見斑片狀鈣化影,外周見環狀脂肪密度影及稍高密度包膜;3C和3D:術后5.0個月,CT檢查示前述2個病灶減小,大小分別為2.9 cm×1.8 cm(3C)和3.2 cm×2.4 cm(3D)
Figure1.
The CT images of a 39-year-old woman who had experienced encapsulated fat necrosis (white arrow) secondary to a distal gastrectomy for gastric cancer.1A:CT image obtained 1.5 months after the operation showed that there was an mixed density nodule which matched 2.8 cm×1.8 cm, with fat density ring and capsule encircling it; 1B, 1C and 1D:CT images obtained in 9.0 (1B), 15.0 (1C), and 17.0 (1D) months after the operation showed that encapsulated fat necrosis had changed position, which turned out to "mobility" within the mesentery, and the size of the lesion had decreased slightly over time??Figure 2??The CT images of a 49-year-old man who had encapsulated fat necrosis secondary surgery (lower white arrow)for ascending colon carcinoma.The patient also had metastases below the anastomotic stoma(upper white arrow).2A:Plain CT image which obtained in half a month after operation showed that there was an irregular mass sited in inferior ascending colon(below the anastomotic), with blurry perivisceral fat clearance and mesenteric lymphatic nodes enlargement, which was considered as metastasis and later be confirmed by surgery and pathology, yet another nodule also be found on the right of above-mentioned mass (maximum cross-section was about 4.2 cm×2.5 cm) and it was a well-defined oval nodule with peripheral fat attenuation, which was diagnosed as postoperative intra-abdominal encapsulated fat necrosis; 2B:Arterial phase CT enhanced image obtained in half a month after operation showed that the metastatic tumor enhanced slightly and unevenly, while the encapsulated fat necrosis was not seen strengthening; 2C:The portal vein phase CT enhanced image obtained in half a month after operation showed that metastatic tumor was intensified more obviously than that of arterial period, while the encapsulated fat necrosis showed slight enforcement; 2D:The CT image obtained in 5.0 months after operation showed that the metastasis changed non-significantly, however, the central density of well-capsulated nodule turned to predominantly fat density and the size of the lesion decreased to some extent (3.1 cm×2.5 cm)??Figure 3??The CT images of a 45-year-old man who had experienced encapsulated fat necrosis (white arrow) secondary to rectal high anterior resection.3A and 3B:Plain CT image obtained in a month after operation revealed that both the left side of the bladder and the right side of the rectum had a lesion, and the sizes of the two lesions were 3.6 cm×3.2 cm (3A) and 3.3 cm×2.7 cm (3B) respectively; 3C and 3D:CT image obtained in 5.0 months after operation showed that the sizes of 2 lesions decreased, which were 2.9 cm×1.8 cm (3C) and 3.2 cm×2.4 cm (3D) respectively
圖1
示39歲女性胃癌患者行遠端胃癌根治術后繼發性灶性脂肪壞死(白箭)的CT檢查隨訪結果。1A:術后1.5個月,CT檢查示胰尾前方有一2.8 cm×1.8 cm大的混雜密度結節,外周見脂肪密度環及包膜;1B、1C及1D:術后9.0(1B)、15.0(1C)及17.0個月(1D)的CT檢查圖片示灶性脂肪壞死灶的位置發生改變,在腸系膜區呈現一定的“游走性”,病灶隨隨訪時間的延長稍縮小??圖 2??示49歲男性升結腸癌患者術后繼發性灶性脂肪壞死(下白箭)的CT檢查隨訪結果,該患者同時合并吻合口下方結腸轉移癌(上白箭)。2A:術后0.5個月,CT平掃圖像示升結腸近段有一不規則腫塊向腔內突出,與盲腸和末端回腸相粘連,周圍脂肪間隙模糊,右側腹膜增厚,此為升結腸癌轉移表現,且轉移灶右后方見一邊緣清晰的卵圓形混雜密度結節,最大截面為4.2 cm×2.5 cm大,外周見環狀脂肪密度影,包膜完整,此為灶性脂肪壞死;2B:術后0.5個月,CT增強掃描動脈期圖像示轉移瘤輕度且不均勻強化,灶性脂肪壞死未見強化;2C:術后0.5個月,CT增強掃描門靜脈期圖像示轉移瘤不均勻且持續強化,且強化較動脈期明顯,灶性脂肪壞死輕度強化,且強化較為均勻;2D:術后5.0個月,CT檢查示轉移瘤大小未見明顯變化,而脂肪壞死灶稍減小(3.1 cm×2.5 cm大),中央密度減低,以脂肪密度為主??圖 3??示45歲男性直腸癌患者術后2個灶性脂肪壞死(白箭)的CT隨訪結果。3A和3B:術后1.0個月,CT檢查示直腸右旁及膀胱左旁分別見一最大截面為3.6 cm×3.2 cm大(3A)和3.3 cm×2.7 cm(3B)大的混雜密度團塊,內見斑片狀鈣化影,外周見環狀脂肪密度影及稍高密度包膜;3C和3D:術后5.0個月,CT檢查示前述2個病灶減小,大小分別為2.9 cm×1.8 cm(3C)和3.2 cm×2.4 cm(3D)
Figure1.
The CT images of a 39-year-old woman who had experienced encapsulated fat necrosis (white arrow) secondary to a distal gastrectomy for gastric cancer.1A:CT image obtained 1.5 months after the operation showed that there was an mixed density nodule which matched 2.8 cm×1.8 cm, with fat density ring and capsule encircling it; 1B, 1C and 1D:CT images obtained in 9.0 (1B), 15.0 (1C), and 17.0 (1D) months after the operation showed that encapsulated fat necrosis had changed position, which turned out to "mobility" within the mesentery, and the size of the lesion had decreased slightly over time??Figure 2??The CT images of a 49-year-old man who had encapsulated fat necrosis secondary surgery (lower white arrow)for ascending colon carcinoma.The patient also had metastases below the anastomotic stoma(upper white arrow).2A:Plain CT image which obtained in half a month after operation showed that there was an irregular mass sited in inferior ascending colon(below the anastomotic), with blurry perivisceral fat clearance and mesenteric lymphatic nodes enlargement, which was considered as metastasis and later be confirmed by surgery and pathology, yet another nodule also be found on the right of above-mentioned mass (maximum cross-section was about 4.2 cm×2.5 cm) and it was a well-defined oval nodule with peripheral fat attenuation, which was diagnosed as postoperative intra-abdominal encapsulated fat necrosis; 2B:Arterial phase CT enhanced image obtained in half a month after operation showed that the metastatic tumor enhanced slightly and unevenly, while the encapsulated fat necrosis was not seen strengthening; 2C:The portal vein phase CT enhanced image obtained in half a month after operation showed that metastatic tumor was intensified more obviously than that of arterial period, while the encapsulated fat necrosis showed slight enforcement; 2D:The CT image obtained in 5.0 months after operation showed that the metastasis changed non-significantly, however, the central density of well-capsulated nodule turned to predominantly fat density and the size of the lesion decreased to some extent (3.1 cm×2.5 cm)??Figure 3??The CT images of a 45-year-old man who had experienced encapsulated fat necrosis (white arrow) secondary to rectal high anterior resection.3A and 3B:Plain CT image obtained in a month after operation revealed that both the left side of the bladder and the right side of the rectum had a lesion, and the sizes of the two lesions were 3.6 cm×3.2 cm (3A) and 3.3 cm×2.7 cm (3B) respectively; 3C and 3D:CT image obtained in 5.0 months after operation showed that the sizes of 2 lesions decreased, which were 2.9 cm×1.8 cm (3C) and 3.2 cm×2.4 cm (3D) respectively
2.2 術后臨床表現及隨訪結果
本組患者獲訪36例,隨訪時間為0.5~15個月,中位數為10個月。隨訪期間,5例術后發生腫瘤轉移,其余31例未發生復發或轉移。未發生復發轉移的31例患者中,僅1例男性患者于術后持續存在腹部鈍痛,但不伴惡心、嘔吐、發熱、黃疸、腹瀉等其他癥狀;其余30例患者術后無不適,一般情況良好。
2.3 術前及術后血清癌胚抗原(CEA)和CA-125水平
對納入病例術前及術后(最接近手術日期的一次)血清CEA和CA-125水平的評估,均依據的是四川大學華西醫院的標準:CEA低于3.4 ng/mL即為陰性,CA-125低于35 U/mL即為陰性。術后5例臨床確診發生腫瘤轉移。①3例結腸癌患者術后發生肝轉移,其術前CEA都為陽性,CA-125都為陰性。術后1例CEA轉為陰性(下降),CA-125轉為陽性(升高),另2例CEA和CA-125水平與術前基本一致。②1例結腸癌患者術后發生吻合口近端結腸轉移,其術前CEA陽性、CA-125陰性,術后兩者水平與術前基本一致。③1例胃癌患者術后發生雙側卵巢轉移,術前CEA和CA-125都為陰性,術后CA-125轉為陽性(升高),CEA仍為陰性。
31例未發生復發或轉移。①1例手術前后的CEA和CA-125水平未知。②11例術前的CEA和CA-125水平未知。術后有10例該2個指標均為陰性;1例CA-125陽性,但水平有逐漸降低的趨勢(該例患者術后CEA為陰性)。③8例手術前后的CEA和CA-125皆為陰性。④7例術前CEA陽性,術后陰性(其CA-125始終陰性)。⑤1例術前CA-125陽性,術后陰性(CEA始終陰性)。⑥1例術前CEA和CA-125皆為陽性,術后皆為陰性。⑦2例術前CEA陽性、CA-125陰性,術后CEA轉為陰性(下降),CA-125轉為陽性(升高)。綜上所述,除1例患者手術前后的CEA和CA-125水平未知外,另外30例腹部惡性腫瘤術后未合并腫瘤復發和轉移的灶性脂肪壞死患者中,有90.0%(27/30)的患者術后血清CEA和CA-125均陰性。其余10.0%(3/30)的患者術后血清CA-125陽性,該3例患者均為中老年男性胃癌術后患者:1例有慢性肝炎(44年)和術后出血史;1例有術后粘連性腸梗阻史;1例術后無特殊臨床表現,但主訴睡眠和飲食情況差。
3 討論
脂肪是一種代謝活躍的組織,可能在一系列的機理作用下發生壞死[25]。它可以引起腹部疼痛(臨床表現與急腹癥相似),也可能不出現任何臨床癥狀而僅伴隨其他病理學變化[25]。脂肪壞死是由于脂肪組織損傷而產生的一種少見的良性非化膿性炎性病變,在全身各部位均可發生。其臨床表現不具特征性,加之對其認識不足,臨床誤診率及漏診率均較高[26]。對其的診斷主要依靠影像學檢查和臨床病史[23, 25]。筆者主要針對腹部惡性腫瘤術后灶性脂肪壞死進行討論,共回顧性納入了36例胃腸道惡性腫瘤術后繼發灶性脂肪壞死病例,現將其特征性表現總結如下。
3.1 CT表現
脂肪壞死灶在CT圖像上顯示為單發或者多發[25, 27],有一定游走性[24, 28],病灶包膜完整[4, 5, 23, 27-28],中心結節密度不均勻,病灶大小可隨隨訪時間的延長而縮小(即呈現一定的自限性),周圍伴或不伴少許條索狀影;增強掃描表現為動脈期無確切強化,門靜脈期輕度強化。不同于術后復發、轉移等惡性病變,術后灶性脂肪壞死具有以下特征性表現:可見環狀脂肪密度影,病變較局限、不會侵襲鄰近器官;其形態規則,包膜完整,病灶隨病程遷延可縮小或消失。環狀脂肪影可能與泡沫細胞或壞死的細胞碎片將殘存的正常脂肪細胞推擠至外圍有關,但有待進一步證實。當脂肪細胞受損時,脂肪被分解為甘油和脂肪酸;游離脂肪酸與游離鈣離子結合后,形成難溶于水的脂肪酸鈣,呈點狀或斑片樣鈣化[29]。包膜主要由纖維結締組織構成[22, 30-31],其細胞排列致密,血流分布較慢,所以表現為延遲強化。除纖維結締組織外,鈣化、排列緊密的泡沫細胞也會減慢血流的灌注和彌散,此種病理學變化可以解釋中心結節的延遲強化。
3.2 腫瘤標志物及臨床表現
除上述典型的CT表現外,本研究還發現,手術前后腫瘤標志物水平的變化和臨床表現也有助于對腹部惡性腫瘤術后灶性脂肪壞死與腫瘤復發或轉移的鑒別。灶性脂肪壞死的患者常不伴明顯的臨床表現,或僅出現單純性腹痛(無惡心、嘔吐、發熱、黃疸、腹瀉等伴隨癥狀)。灶性脂肪壞死患者的術后CEA和CA-125通常呈陰性,偶爾會出現術后CA-125輕度升高的情況,其具體原因不明,可能與術后出血或感染有關,亦有可能已有潛在的微小轉移或復發灶,只是此次檢查尚未能發現,甚至尚不能由目前的影像學檢查手段發現,其準確機理有待進一步研究。
對大多數病例,結合手術史和CT特征性表現,診斷腹部惡性腫瘤術后灶性脂肪壞死并不困難。對于一些診斷或鑒別診斷困難的病例,結合腫瘤標志物水平(CEA和CA-125)及術后臨床表現,均有助于與復發相鑒別;多次檢查病灶位置和觀察病灶形態變化亦有助于明確診斷。各層次的影像診斷醫師應對該術后繼發性改變有清醒的認識。在特殊情況下,小而局限的復發癌和轉移癌也會呈現出與灶性脂肪壞相似的影像學表現,定期復查甚至組織活檢可助于明確診斷。灶性脂肪壞死在大體病理學上的表現類似于“煮熟的雞蛋”:整體外觀光滑,切面中心部分為黃色固體,形似“煮熟的蛋黃”;包膜為質韌纖維組織,形似“煮熟的蛋清”[30-31]。
3.3 本研究的不足
本研究存在以下不足:首先,CT掃描儀及處理技術不統一,但符合真實臨床情況;其次,本研究CT圖像上病灶大小的測量存在一定的測量誤差;第三,本研究患者為行胃腸道惡性腫瘤手術的患者,以中老年居多,存在選擇性偏倚。
綜上所述,腹部惡性腫瘤手術可繼發腹腔內灶性脂肪壞死,其CT表現具有一定的特征性,只要影像檢查醫生對此類繼發性改變有充分的認識,大多能明確診斷。對部分診斷困難的病例,結合術后多次隨訪CT圖像顯示的病灶大小、位置變化、密度等特征,以及手術前后的CEA、CA-125水平和臨床表現,均有助于明確診斷及其與腫瘤復發或轉移的鑒別診斷,從而避免不必要的臨床干預(尤其是手術干預),以減少患者的生理創傷,消除心理恐懼。