引用本文: 林浩銘, 李國林, 常瑞明, 周銳, 閔軍. 動脈入路腹腔鏡胰十二指腸切除19例報道. 中國普外基礎與臨床雜志, 2014, 21(10): 1237-1240. doi: 10.7507/1007-9424.20140296 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
近年來,腹腔鏡外科技術日益成熟,在某些疾病的治療中甚至已取代開放手術,成為臨床治療的首選。然而在胰腺外科領域,腹腔鏡技術的發展較為遲緩,尤其是高度復雜的腹腔鏡胰十二指腸切除術(LPD),目前仍處于探索階段,能大規模開展該手術的醫療機構仍屈指可數,如何依照腫瘤根治的原則安全地切除并順利重建消化道仍需要深入研究。影響LPD發展的主要原因有以下3點:①LPD手術難度高,耗時較長,增加了患者的手術風險;②LPD對適應證有較為嚴格的要求,目前僅適用于膽管下段癌、壺腹周圍癌、十二指腸癌以及直徑較小的胰頭癌;③LPD的療效及并發癥發生率與開放手術相比,并未顯示出明顯優勢[1-4]。
為簡化手術方法,縮短手術時間,提高手術的安全性,自2010年9月至2013年7月,筆者采用新的動脈入路方式完成LPD 19例,取得了較好的效果,現將經驗體會報道如下。
1 資料與方法
1.1 臨床資料
本組19例患者中男14例,女5例;年齡34~71歲,中位年齡52歲。其中壺腹周圍癌9例,膽總管下段癌6例,早期胰頭癌4例。全部病例術前均行MRCP或CT檢查,證實無門靜脈、下腔靜脈及腸系膜上血管侵犯,無遠處轉移;7例患者術前行ERCP檢查,發現壺腹周圍癌5例,膽總管下段癌2例。
1.2 體位及操作孔位置
患者取分腿平臥位,頭部抬高30°,術者立于患者兩腿之間。臍下緣置10 mm Trocar為觀察孔,左右鎖骨中線臍水平分別置12 mm Trocar為主操作孔,右腋前線肋緣下和左鎖骨中線外側肋緣下分別置5 mm Trocar為輔助操作孔。
1.3 手術方法
1.3.1 探查
首先探查腹腔,觀察肝臟、腹腔及網膜有無轉移結節;沿橫結腸上緣切開胃結腸韌帶,顯露胰腺,切開胰腺下緣漿膜,顯露并探查腸系膜上靜脈(SMV),判斷腫瘤的可切除性。
1.3.2 完成胰十二指腸切除術
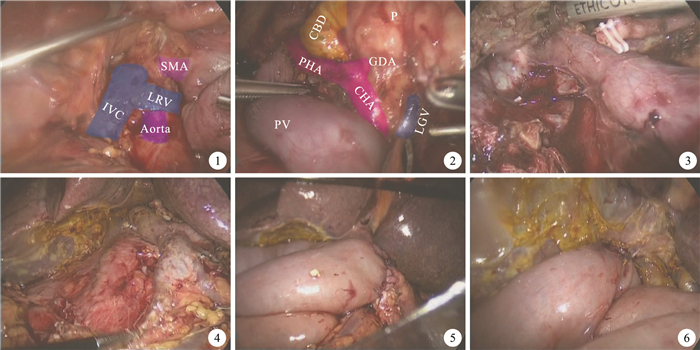
擴展Kocher切口,打開十二指腸外側腹膜,沿下腔靜脈和左腎靜脈前方向左側充分游離胰頭及十二指腸,直至腸系膜下靜脈右側(圖 1)。以左腎靜脈上緣為標志,于腹主動脈前方尋找腸系膜上動脈(SMA)根部。向頭側牽拉十二指腸,充分游離十二指腸水平部,切斷屈氏韌帶,將上段空腸自腸系膜上血管后方拖至右側,距屈氏韌帶15 cm以Endo-Cutter切斷近段空腸。將已離斷的空腸上段、十二指腸連同胰頭部向內上方充分牽引,從后方顯露胰腺鉤突及SMA,鉤突下方切開SMA血管鞘,自下而上,沿SMA血管鞘內將SMA胰后段全程游離(圖 2),同時將鉤突與SMV間的小分支連同SMA右側血管鞘用LigaSure凝閉切斷,直至十二指腸、胰頭與鉤突部同腸系膜上血管完全分離。切開肝十二指腸韌帶下側漿膜,沿門靜脈(PV)向肝門解剖,直至PV完全游離(圖 3)。用Endo-Cutter離斷遠端胃,胰頸處用超聲刀離斷。于胰腺上緣顯露肝總動脈鞘,切開肝總動脈鞘,以肝動脈為軸自下而上向肝門方向解剖,結扎并離斷胃十二指腸動脈和胃右動脈,直至肝固有動脈,肝左、右動脈完全游離。切除膽囊,離斷肝總管,移除標本完成切除手術(圖 4)。
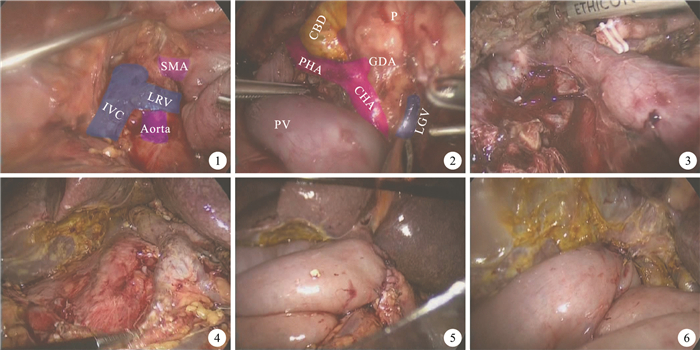 圖1
向左側擴展Kocher切口??圖 2??游離胰頭后方??圖 3??向肝門部解剖門靜脈??圖 4??標本切除后??圖 5??胰腸吻合完成后??圖 6??膽腸吻合完成后。SMA:腸系膜上動脈;LRV:左腎靜脈;IVC:下腔靜脈;Aorta:腹主動脈;GDA:胃十二指腸動脈;CHA:肝總動脈;PHA:肝固有動脈;CBD:膽總管;PV:門靜脈;P:胰腺;LGV:胃左靜脈
Figure1.
Kocher incision was extended toward the left side??Figure 2??The posterior part of the pancreatic head was isolated??Figure 3??The portal vein was isolated toward the hepatic portal??Figure 4??The specimen was removed??Figure 5??Pancreatic-intestinal anastomosis was completed??Figure 6??Bilioenteric anastomosis was completed. SMA:Superior mesenteric artery; LRV:Left renal vein; IVC:Iinferior vena cava; Aorta:Abdominal aorta; GDA:Dastroduodenal artery; CHA:Gommon hepatic artery; PHA:Proper hepatic artery; CBD:Common bile duct; PV:Portal vein; P:Pancrease; LGV:Left gastric vein
圖1
向左側擴展Kocher切口??圖 2??游離胰頭后方??圖 3??向肝門部解剖門靜脈??圖 4??標本切除后??圖 5??胰腸吻合完成后??圖 6??膽腸吻合完成后。SMA:腸系膜上動脈;LRV:左腎靜脈;IVC:下腔靜脈;Aorta:腹主動脈;GDA:胃十二指腸動脈;CHA:肝總動脈;PHA:肝固有動脈;CBD:膽總管;PV:門靜脈;P:胰腺;LGV:胃左靜脈
Figure1.
Kocher incision was extended toward the left side??Figure 2??The posterior part of the pancreatic head was isolated??Figure 3??The portal vein was isolated toward the hepatic portal??Figure 4??The specimen was removed??Figure 5??Pancreatic-intestinal anastomosis was completed??Figure 6??Bilioenteric anastomosis was completed. SMA:Superior mesenteric artery; LRV:Left renal vein; IVC:Iinferior vena cava; Aorta:Abdominal aorta; GDA:Dastroduodenal artery; CHA:Gommon hepatic artery; PHA:Proper hepatic artery; CBD:Common bile duct; PV:Portal vein; P:Pancrease; LGV:Left gastric vein
1.3.3 消化道重建
胰腺與空腸行端-側胰管空腸吻合,先于吻合口后壁以4-0 Prolene線連續縫合胰腺與空腸漿肌層,再以5-0 Prolene線行胰管空腸全層連續縫合,前壁再以4-0 Prolene線連續縫合(圖 5)。在胰-腸吻合口下方約10 cm,以5-0 PDS線行膽管-空腸一層連續吻合(圖 6);距膽-腸吻合口約50 cm用Endo-Cutter行空胰-殘胃后壁吻合(結腸前),上腹正中做4~6 cm切口取出標本。
2 結果
本組19例患者均以腹膜后入路方式順利完成胰十二指腸切除術,其中17例行全腔鏡消化道重建,2例利用上腹正中小切口行開放消化道重建。手術時間5~10.5 h,平均6.3 h,最初8例手術時間較長,后11例手術時間明顯縮短(5~7 h)。術中出血170~430 mL,平均250 mL。全組術中無輸血。
本組患者均在術后2~6 d肛門排氣,平均4.7 d,排氣后拔除胃管,進流質飲食,術后平均開始進食時間為5.6 d(4~14 d)。圍手術期并發癥發生率為42.1%(8/19),其中胰瘺5例,3例為A級,予生長抑素治療后,引流液淀粉酶水平恢復正常;B級2例,經生長抑素治療并腹腔沖洗引流后恢復正常。胃排空延遲1例,經禁食,洗胃等治療后于術后14 d恢復。1例小切口開放吻合患者術后出現膽汁漏(早期病例),經沖洗引流后好轉并帶管出院,術后6周造影無異常后于門診拔管。1例于術后8 d出現胃十二指腸動脈殘端假性動脈瘤,經介入治療后痊愈出院。本組患者術后住院時間7~21 d,平均10.7 d,無圍手術期死亡病例。
本組患者術后病理學檢查示膽總管下段癌6例,壺腹癌7例,十二指腸乳頭腺癌2例,胰頭腺癌4例。19例患者術后病理學檢查平均檢出淋巴結13.7枚(11~18枚)。18例為R0切除,1例胰頭癌患者術后病理學檢查證實為R1切除。
19例患者術后均定期隨訪,平均隨訪期為7.5個月(2~28個月),2例胰腺癌患者分別于術后3個月和7個月出現腹膜后淋巴結轉移,1例胰腺癌患者術后8個月出現局部復發,存活時間分別為6、11和22個月;3例膽管癌患者術后分別隨訪8、13和15個月后因肝臟和腹膜后淋巴結轉移死亡,其余患者仍在隨訪中。
3 討論
本組19例LPD全部采用動脈入路方式完成,該方法的要點有以下3方面:①通過向左側擴展Kocher切口,最大限度地將十二指腸、胰頭及鉤突部游離,從后方充分顯露SMA根部,并繼續向左側將十二指腸水平部與空腸上段完全游離,空腸于腸系膜血管右側離斷。②離斷空腸后,將十二指腸、胰頭及鉤突部向內上方充分牽引,可將SMA由SMV左側由其后方牽引至右側,從而充分顯露SMA胰后段及胰腺鉤突,沿SMA血管鞘內解剖可安全將SMA與鉤突分離;SMA與鉤突部分離后,SMV與鉤突之間間隙增大,可降低SMV解剖難度,將SMV與鉤突間的血管分支同SMA鞘一起離斷,不僅可徹底清除胰周淋巴和神經組織,且能有效避免SMA撕裂出血的風險。③自下而上,沿血管軸向走行清掃區域淋巴結,清掃過程中僅游離血管,其周圍脂肪結締組織在肝門處與膽管一并整塊切除。該方法簡化了解剖游離的步驟,可顯著縮短切除手術時間;同時,自下而上沿血管走行的解剖方法,既有利于鉤突的完整切除,也使淋巴結清掃尤其是肝十二指腸韌帶淋巴結清掃難度大大降低。
在胰十二指腸切除術中,腸系膜上血管的處理是整個手術的核心部分,也是手術成功的關鍵[5]。在LPD中,采用與開腹手術同樣的方法解剖腸系膜上血管,視角會明顯受限,且缺乏手的觸感及長桿器械操作不夠靈活等特點,不僅會極大地增加血管損傷概率,胰周淋巴結清掃難度也會增加,進而延長手術時間。通過擴展Kocher切口,利用十二指腸與其后方組織間的天然解剖間隙,自右向左充分游離胰頭及十二指腸環后方的疏松結締組織,可以很容易地顯露SMA和SMV。受觀察角度限制,這一操作在開放手術中很難實現,而腹腔鏡靈活的視角及較大的放大倍率恰恰可以幫助我們完成。在筆者完成的19例手術中,均采用了這一方法,以左腎靜脈為標志,在其上方可以完整顯露SMA根部,而SMV則隨著胰頭的游離與上抬自然顯露。
是否符合腫瘤根治的原則并徹底清除區域淋巴結,是決定LPD臨床價值的關鍵因素。筆者嘗試采用新的思路降低淋巴結清掃難度:①十二指腸、胰腺與腸系膜上血管完全分離后,沿SMV繼續向肝門方向解剖,可輕易將PV完全游離。②切斷胰腺頸部后,在胰腺上緣暴露肝總動脈主干,超聲刀切開動脈鞘,沿肝總動脈向肝門部解剖,將動脈鞘連同周圍組織一并切除,僅需保留肝動脈和PV。這種自下而上,沿血管軸向進行的淋巴結清掃,簡化了清掃過程,不需要頻繁更換視角,能保證將毗鄰淋巴結和軟組織整塊切除,使肝十二指腸韌帶淋巴結的清掃變得尤為容易。本組18例惡性腫瘤患者中,17例為R0切除,僅1例為R1切除,檢出的淋巴結數與開放手術相仿[6-8]。提示該方法完全符合腫瘤的根治性原則,可徹底清掃區域淋巴結。
本組病例術后總體并發癥發生率為42.1%,與開放手術相當,也與其他作者[9-11]報道的相仿。考慮到我們所選的病例均為早期,表明LPD技術仍有待完善。全腔鏡胰腸吻合技術難度極大,一旦出現胰瘺通常后果非常嚴重[12-17],因此在最早開展的2例中筆者采用了開放吻合的方式,隨著技術的不斷熟練,近期完成的5例患者中胰腸吻合的時間已可以控制在1~1.5 h之內。
本組病例的相關數據并未顯示出相對于開腹手術的明顯優勢,但考慮到LPD仍處于發展的早期階段[18-21],隨著技術及器械的不斷完善,其存在較大的改善空間[22-25]。因此應對該術式的前景充滿信心。筆者采用的方法不僅降低了切除的難度,也保證了腫瘤的根治性,對于LPD技術的普及推廣具有一定的意義。
近年來,腹腔鏡外科技術日益成熟,在某些疾病的治療中甚至已取代開放手術,成為臨床治療的首選。然而在胰腺外科領域,腹腔鏡技術的發展較為遲緩,尤其是高度復雜的腹腔鏡胰十二指腸切除術(LPD),目前仍處于探索階段,能大規模開展該手術的醫療機構仍屈指可數,如何依照腫瘤根治的原則安全地切除并順利重建消化道仍需要深入研究。影響LPD發展的主要原因有以下3點:①LPD手術難度高,耗時較長,增加了患者的手術風險;②LPD對適應證有較為嚴格的要求,目前僅適用于膽管下段癌、壺腹周圍癌、十二指腸癌以及直徑較小的胰頭癌;③LPD的療效及并發癥發生率與開放手術相比,并未顯示出明顯優勢[1-4]。
為簡化手術方法,縮短手術時間,提高手術的安全性,自2010年9月至2013年7月,筆者采用新的動脈入路方式完成LPD 19例,取得了較好的效果,現將經驗體會報道如下。
1 資料與方法
1.1 臨床資料
本組19例患者中男14例,女5例;年齡34~71歲,中位年齡52歲。其中壺腹周圍癌9例,膽總管下段癌6例,早期胰頭癌4例。全部病例術前均行MRCP或CT檢查,證實無門靜脈、下腔靜脈及腸系膜上血管侵犯,無遠處轉移;7例患者術前行ERCP檢查,發現壺腹周圍癌5例,膽總管下段癌2例。
1.2 體位及操作孔位置
患者取分腿平臥位,頭部抬高30°,術者立于患者兩腿之間。臍下緣置10 mm Trocar為觀察孔,左右鎖骨中線臍水平分別置12 mm Trocar為主操作孔,右腋前線肋緣下和左鎖骨中線外側肋緣下分別置5 mm Trocar為輔助操作孔。
1.3 手術方法
1.3.1 探查
首先探查腹腔,觀察肝臟、腹腔及網膜有無轉移結節;沿橫結腸上緣切開胃結腸韌帶,顯露胰腺,切開胰腺下緣漿膜,顯露并探查腸系膜上靜脈(SMV),判斷腫瘤的可切除性。
1.3.2 完成胰十二指腸切除術
擴展Kocher切口,打開十二指腸外側腹膜,沿下腔靜脈和左腎靜脈前方向左側充分游離胰頭及十二指腸,直至腸系膜下靜脈右側(圖 1)。以左腎靜脈上緣為標志,于腹主動脈前方尋找腸系膜上動脈(SMA)根部。向頭側牽拉十二指腸,充分游離十二指腸水平部,切斷屈氏韌帶,將上段空腸自腸系膜上血管后方拖至右側,距屈氏韌帶15 cm以Endo-Cutter切斷近段空腸。將已離斷的空腸上段、十二指腸連同胰頭部向內上方充分牽引,從后方顯露胰腺鉤突及SMA,鉤突下方切開SMA血管鞘,自下而上,沿SMA血管鞘內將SMA胰后段全程游離(圖 2),同時將鉤突與SMV間的小分支連同SMA右側血管鞘用LigaSure凝閉切斷,直至十二指腸、胰頭與鉤突部同腸系膜上血管完全分離。切開肝十二指腸韌帶下側漿膜,沿門靜脈(PV)向肝門解剖,直至PV完全游離(圖 3)。用Endo-Cutter離斷遠端胃,胰頸處用超聲刀離斷。于胰腺上緣顯露肝總動脈鞘,切開肝總動脈鞘,以肝動脈為軸自下而上向肝門方向解剖,結扎并離斷胃十二指腸動脈和胃右動脈,直至肝固有動脈,肝左、右動脈完全游離。切除膽囊,離斷肝總管,移除標本完成切除手術(圖 4)。
 圖1
向左側擴展Kocher切口??圖 2??游離胰頭后方??圖 3??向肝門部解剖門靜脈??圖 4??標本切除后??圖 5??胰腸吻合完成后??圖 6??膽腸吻合完成后。SMA:腸系膜上動脈;LRV:左腎靜脈;IVC:下腔靜脈;Aorta:腹主動脈;GDA:胃十二指腸動脈;CHA:肝總動脈;PHA:肝固有動脈;CBD:膽總管;PV:門靜脈;P:胰腺;LGV:胃左靜脈
Figure1.
Kocher incision was extended toward the left side??Figure 2??The posterior part of the pancreatic head was isolated??Figure 3??The portal vein was isolated toward the hepatic portal??Figure 4??The specimen was removed??Figure 5??Pancreatic-intestinal anastomosis was completed??Figure 6??Bilioenteric anastomosis was completed. SMA:Superior mesenteric artery; LRV:Left renal vein; IVC:Iinferior vena cava; Aorta:Abdominal aorta; GDA:Dastroduodenal artery; CHA:Gommon hepatic artery; PHA:Proper hepatic artery; CBD:Common bile duct; PV:Portal vein; P:Pancrease; LGV:Left gastric vein
圖1
向左側擴展Kocher切口??圖 2??游離胰頭后方??圖 3??向肝門部解剖門靜脈??圖 4??標本切除后??圖 5??胰腸吻合完成后??圖 6??膽腸吻合完成后。SMA:腸系膜上動脈;LRV:左腎靜脈;IVC:下腔靜脈;Aorta:腹主動脈;GDA:胃十二指腸動脈;CHA:肝總動脈;PHA:肝固有動脈;CBD:膽總管;PV:門靜脈;P:胰腺;LGV:胃左靜脈
Figure1.
Kocher incision was extended toward the left side??Figure 2??The posterior part of the pancreatic head was isolated??Figure 3??The portal vein was isolated toward the hepatic portal??Figure 4??The specimen was removed??Figure 5??Pancreatic-intestinal anastomosis was completed??Figure 6??Bilioenteric anastomosis was completed. SMA:Superior mesenteric artery; LRV:Left renal vein; IVC:Iinferior vena cava; Aorta:Abdominal aorta; GDA:Dastroduodenal artery; CHA:Gommon hepatic artery; PHA:Proper hepatic artery; CBD:Common bile duct; PV:Portal vein; P:Pancrease; LGV:Left gastric vein
1.3.3 消化道重建
胰腺與空腸行端-側胰管空腸吻合,先于吻合口后壁以4-0 Prolene線連續縫合胰腺與空腸漿肌層,再以5-0 Prolene線行胰管空腸全層連續縫合,前壁再以4-0 Prolene線連續縫合(圖 5)。在胰-腸吻合口下方約10 cm,以5-0 PDS線行膽管-空腸一層連續吻合(圖 6);距膽-腸吻合口約50 cm用Endo-Cutter行空胰-殘胃后壁吻合(結腸前),上腹正中做4~6 cm切口取出標本。
2 結果
本組19例患者均以腹膜后入路方式順利完成胰十二指腸切除術,其中17例行全腔鏡消化道重建,2例利用上腹正中小切口行開放消化道重建。手術時間5~10.5 h,平均6.3 h,最初8例手術時間較長,后11例手術時間明顯縮短(5~7 h)。術中出血170~430 mL,平均250 mL。全組術中無輸血。
本組患者均在術后2~6 d肛門排氣,平均4.7 d,排氣后拔除胃管,進流質飲食,術后平均開始進食時間為5.6 d(4~14 d)。圍手術期并發癥發生率為42.1%(8/19),其中胰瘺5例,3例為A級,予生長抑素治療后,引流液淀粉酶水平恢復正常;B級2例,經生長抑素治療并腹腔沖洗引流后恢復正常。胃排空延遲1例,經禁食,洗胃等治療后于術后14 d恢復。1例小切口開放吻合患者術后出現膽汁漏(早期病例),經沖洗引流后好轉并帶管出院,術后6周造影無異常后于門診拔管。1例于術后8 d出現胃十二指腸動脈殘端假性動脈瘤,經介入治療后痊愈出院。本組患者術后住院時間7~21 d,平均10.7 d,無圍手術期死亡病例。
本組患者術后病理學檢查示膽總管下段癌6例,壺腹癌7例,十二指腸乳頭腺癌2例,胰頭腺癌4例。19例患者術后病理學檢查平均檢出淋巴結13.7枚(11~18枚)。18例為R0切除,1例胰頭癌患者術后病理學檢查證實為R1切除。
19例患者術后均定期隨訪,平均隨訪期為7.5個月(2~28個月),2例胰腺癌患者分別于術后3個月和7個月出現腹膜后淋巴結轉移,1例胰腺癌患者術后8個月出現局部復發,存活時間分別為6、11和22個月;3例膽管癌患者術后分別隨訪8、13和15個月后因肝臟和腹膜后淋巴結轉移死亡,其余患者仍在隨訪中。
3 討論
本組19例LPD全部采用動脈入路方式完成,該方法的要點有以下3方面:①通過向左側擴展Kocher切口,最大限度地將十二指腸、胰頭及鉤突部游離,從后方充分顯露SMA根部,并繼續向左側將十二指腸水平部與空腸上段完全游離,空腸于腸系膜血管右側離斷。②離斷空腸后,將十二指腸、胰頭及鉤突部向內上方充分牽引,可將SMA由SMV左側由其后方牽引至右側,從而充分顯露SMA胰后段及胰腺鉤突,沿SMA血管鞘內解剖可安全將SMA與鉤突分離;SMA與鉤突部分離后,SMV與鉤突之間間隙增大,可降低SMV解剖難度,將SMV與鉤突間的血管分支同SMA鞘一起離斷,不僅可徹底清除胰周淋巴和神經組織,且能有效避免SMA撕裂出血的風險。③自下而上,沿血管軸向走行清掃區域淋巴結,清掃過程中僅游離血管,其周圍脂肪結締組織在肝門處與膽管一并整塊切除。該方法簡化了解剖游離的步驟,可顯著縮短切除手術時間;同時,自下而上沿血管走行的解剖方法,既有利于鉤突的完整切除,也使淋巴結清掃尤其是肝十二指腸韌帶淋巴結清掃難度大大降低。
在胰十二指腸切除術中,腸系膜上血管的處理是整個手術的核心部分,也是手術成功的關鍵[5]。在LPD中,采用與開腹手術同樣的方法解剖腸系膜上血管,視角會明顯受限,且缺乏手的觸感及長桿器械操作不夠靈活等特點,不僅會極大地增加血管損傷概率,胰周淋巴結清掃難度也會增加,進而延長手術時間。通過擴展Kocher切口,利用十二指腸與其后方組織間的天然解剖間隙,自右向左充分游離胰頭及十二指腸環后方的疏松結締組織,可以很容易地顯露SMA和SMV。受觀察角度限制,這一操作在開放手術中很難實現,而腹腔鏡靈活的視角及較大的放大倍率恰恰可以幫助我們完成。在筆者完成的19例手術中,均采用了這一方法,以左腎靜脈為標志,在其上方可以完整顯露SMA根部,而SMV則隨著胰頭的游離與上抬自然顯露。
是否符合腫瘤根治的原則并徹底清除區域淋巴結,是決定LPD臨床價值的關鍵因素。筆者嘗試采用新的思路降低淋巴結清掃難度:①十二指腸、胰腺與腸系膜上血管完全分離后,沿SMV繼續向肝門方向解剖,可輕易將PV完全游離。②切斷胰腺頸部后,在胰腺上緣暴露肝總動脈主干,超聲刀切開動脈鞘,沿肝總動脈向肝門部解剖,將動脈鞘連同周圍組織一并切除,僅需保留肝動脈和PV。這種自下而上,沿血管軸向進行的淋巴結清掃,簡化了清掃過程,不需要頻繁更換視角,能保證將毗鄰淋巴結和軟組織整塊切除,使肝十二指腸韌帶淋巴結的清掃變得尤為容易。本組18例惡性腫瘤患者中,17例為R0切除,僅1例為R1切除,檢出的淋巴結數與開放手術相仿[6-8]。提示該方法完全符合腫瘤的根治性原則,可徹底清掃區域淋巴結。
本組病例術后總體并發癥發生率為42.1%,與開放手術相當,也與其他作者[9-11]報道的相仿。考慮到我們所選的病例均為早期,表明LPD技術仍有待完善。全腔鏡胰腸吻合技術難度極大,一旦出現胰瘺通常后果非常嚴重[12-17],因此在最早開展的2例中筆者采用了開放吻合的方式,隨著技術的不斷熟練,近期完成的5例患者中胰腸吻合的時間已可以控制在1~1.5 h之內。
本組病例的相關數據并未顯示出相對于開腹手術的明顯優勢,但考慮到LPD仍處于發展的早期階段[18-21],隨著技術及器械的不斷完善,其存在較大的改善空間[22-25]。因此應對該術式的前景充滿信心。筆者采用的方法不僅降低了切除的難度,也保證了腫瘤的根治性,對于LPD技術的普及推廣具有一定的意義。