引用本文: 陳卉嬌, 張波, 張紅英. 胃腸間質瘤危險度評估系統比較——從NIH共識標準到預后等高熱線圖. 中國普外基礎與臨床雜志, 2017, 24(2): 163-168. doi: 10.7507/1007-9424.201702005 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胃腸間質瘤(gastrointestinal stromal tumor,GIST)是胃腸道最常見的間葉源性腫瘤,由突變的KIT 或血小板源性生長因子受體 α(PDGFRA)基因驅動,其生物學行為多樣,可表現為良性、惡性潛能未定或惡性[1]。在當前的臨床實踐中,多采用對完全切除的原發 GIST 進行危險度分級,以評估特定病例的復發或轉移風險(進展風險),并指導術后輔助治療(靶向治療)的選擇[2-5]。
中國 GIST 診斷治療專家共識中介紹的改良 NIH 標準與 AFIP 標準對 GIST 危險度劃分存在一定的差異[5,7-8,10],這可能給 GIST 患者的危險度分級及后續治療帶來差別。因此,診治醫生不僅應認識到這兩個系統差異的存在,同時也需認識其產生的本質,才能幫助患者合理地制定輔助治療方案。現對上述危險度評估系統的提出依據、數據來源、危險度劃分區間、指南推薦使用情況等細節進行梳理(表 1),重點討論 AFIP 標準和改良 NIH 標準危險度劃分的差異、原因以及其在實際應用中的注意事項。
1 GIST 危險度評估系統
1.1 2002 年 NIH 標準
NIH 標準(又稱 Fletcher 標準),是 2001 年 4 月 NIH 召集 Fletcher 等 12 名美國病理專家討論 GIST 的診斷和預后標準時制定的,它是自 1998 年 Hirota 等[11]報道 GIST 病例中存在KIT 基因激活突變、Kindblom 等[12]報道多數 GIST 病例表達KIT 基因的產物 CD117 并且 WHO[13]將 GIST 作為一個獨立的腫瘤實體進行定義后,第一個被提出并廣泛使用的危險度評估標準[6]。該標準是由 12 名病理專家在個人經驗的基礎上提出來的,它可能在一定程度上參考了一些早期研究[6,14-19],但是沒有獨立的研究數據作為其依據。由此,它雖然將 GIST 劃分為高、中、低和極低 4 個危險組,但并沒有詳細給出各個組的進展風險率。對于核分裂象計數范圍,該標準采用 50 個高倍視野(high-power field,HPF)。雖然專家組認為應根據顯微鏡 HPF 的大小對 50 個 HPF 的范圍進行標準化,但因為沒達成共識而未界定標準。專家組希望并相信 NIH 標準能夠被改進且有更多有效的預測參數可以建立起來。目前,此標準已不再在臨床工作中使用。
1.2 2006 年 AFIP 標準
AFIP 標準(又稱 Miettinen 標準),是由美國病理學家 Miettinen 等[7]提出的。Miettinen 是 NIH 標準專家組成員之一,他從 1999 年起發表了一系列關于不同部位 GIST 及其復發風險的研究[7,19-25]。2006 年,Miettinen 等[7]基于之前自身的研究數據,包括 AFIP 單中心診治的 1 939 例完全切除且未經靶向治療的 GIST 病例(1 055 例胃,629 例空腸和回腸,144 例十二指腸,111 例直腸),提出了 AFIP 標準。
與 NIH 標準不同,AFIP 標準是在對 AFIP 單中心大樣本具有隨訪信息的 GIST 病例進行相關性研究的基礎上提出的,隨訪時間為 1~34.5 年,中位年限達 10 年以上。因此它為研究中的各個 GIST 分組提供了直觀的進展風險率并提示了風險度劃分的區間值,其中極低風險為 1.9%,低風險為 3.6%~8.5%,中風險為 12%~24%,高風險則大于等于 34%。
在 AFIP 標準中,Miettinen 明確指出核分裂象計數范圍為 5 mm2;同時,需選擇最活躍區進行計數[21-22]。顯微鏡的視野直徑和面積因其視場數不同而不同[26],這使同一 GIST 病例可能因選用不同視場數的顯微鏡而得到不同的核分裂象計數進而影響危險度分級。因此 Miettinen 等[7]強調,若使用現代的大視野顯微鏡,只需計數 25 個 HPF。實際上,我們目前使用顯微鏡的視場數多為 18~22,當計數范圍確定(標準化)為 5 mm2 時,可根據使用顯微鏡視場數的不同確定相應需計數的視野數,見表 2。
NCCN 指南[2]、WHO 軟組織腫瘤分類[1]、WHO 消化道腫瘤分類[27]、CAP GIST 標本檢測指南[28]及 NCI-NIH 的官方網站[29]上均采用了 AFIP 標準。ESMO GIST 診治和隨訪指南[3]、2013 年版中國 GIST 診斷治療專家共識[5]和亞洲 GIST 診治共識[4]也對 AFIP 標準進行了介紹。
1.3 2008 年改良 NIH 標準
改良 NIH 標準(又稱 Joensuu 標準),是我國目前使用最為廣泛的 GIST 危險度評估標準,它是芬蘭腫瘤學家 Joensuu[8]在 2008 年的一篇綜述中提出的。Joensuu 是全球使用伊馬替尼治療進展期 GIST 患者并獲得成功的第一人[30]。改良 NIH 標準提出的初衷是為了對 GIST 患者進行分層,以篩選可以從靶向治療中獲益的患者。
和 NIH 標準一樣,改良 NIH 標準并沒有獨立的研究數據基礎,它是對基于或未基于 NIH 標準的各類研究(包括 Miettinen 的系列研究)[21-22,31-39]進行總結后的提議,但也不同于 meta 分析。改良 NIH 標準最主要的改變是引入了腫瘤部位和腫瘤破裂兩個參數,這兩個參數是多項研究[21-22,31-35,39]的重要發現。其后的大樣本驗證研究[9,40]顯示,改良 NIH 標準可以準確預測 GIST 患者預后。近期一項日本的研究[41]顯示,在預測 GIST 復發方面,在包括 NIH、AFIP、改良 NIH 標準等 5 個 GIST 危險度評估標準中,改良 NIH 標準最具敏感性。同時由于該標準較 AFIP 標準簡明、易于記憶和操作,中國 GIST 診治共識主要推薦這一標準。2016 年亞洲 GIST 診治共識則推薦使用該標準來篩選需要進行輔助靶向治療的 GIST 患者[4]。
在改良 NIH 標準中,與 AFIP 標準不同,Joensuu 將高風險定義為 10~15 年間復發風險率在 15%~20% 之上的 GIST 分組,對其他危險組沒有提及明確的劃分區間。
Joensuu 對核分裂象計數范圍未進行標準化界定,雖然他也指出這是 2002 年 NIH 標準的不足。參考 Joensuu 在提出改良 NIH 標準時所參考的各項研究[21-22,32-39],除 Miettinen 的研究外,多數研究未對 50 個 HPF 的范圍進行界定,僅個別界定為 8 mm2[37]或 10 mm2[38];而 Miettinen 的研究是其中重要組成部分,其他各單項研究的病例數(142~335 例)遠低于前者。因此筆者認為,使用改良 NIH 標準時,核分裂象計數范圍使用 Miettinen 界定的 5 mm2 是合理的。
1.4 AFIP 標準與改良 NIH 標準危險度評估的差異
AFIP 標準與改良 NIH 標準對部分 GIST 病例的危險度劃分存在差異(表 3)。總體看來,在差異分組中,改良 NIH 標準較 AFIP 標準高評危險度,這更多的是源于進展或復發風險率區間選擇的差別(表 1)而不是研究數據上的根本差異。
在差異分組中,僅一組病例即“最大徑≤2 cm、核分裂象計數>5 個/50 HPF 的非胃原發 GIST”在改良 NIH 標準中低于 AFIP 標準。改良 NIH 標準將核分裂象計數在(6~10)個/50 HPF 者劃分為中危組,而 AFIP 標準則顯示其進展風險率為 50% 或 54%,屬高危組。在 Joensuu 本人其后的熱圖研究[9]中顯示這組病例的復發風險率為 20%~40%,符合改良 NIH 標準高危組定義,與 AFIP 標準接近。
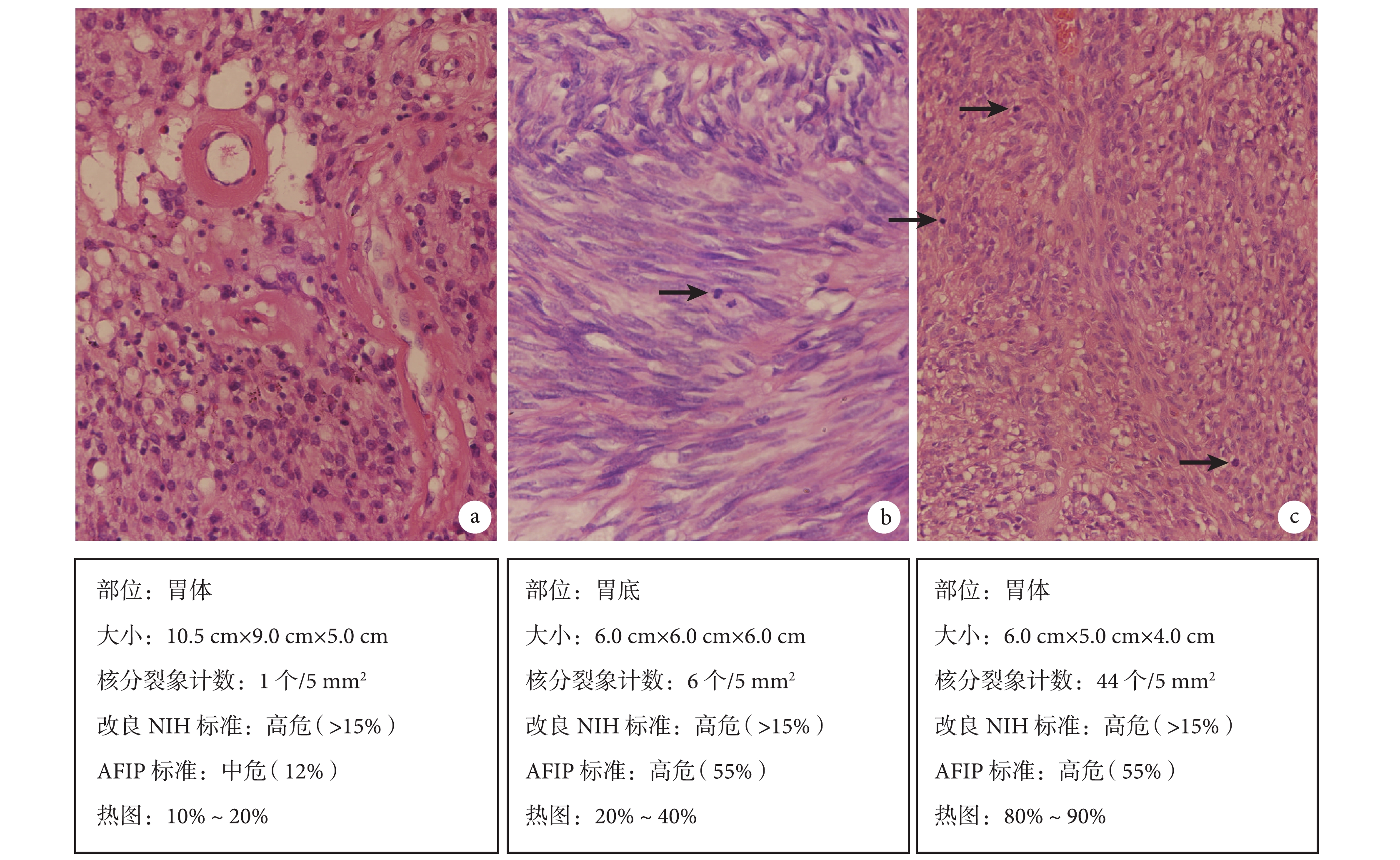
改良 NIH 標準另一個需要注意的地方是,即使同為高危 GIST,其復發風險率則介于 15%~100% 之間。圖 1 是筆者臨床實踐中 3 例具有代表性的病例,同為胃原發 GIST,根據 AFIP 標準,病例 A 的進展風險率為 12%,屬于中危組;病例 B 和病例 C 的進展風險率為 55%,屬于高危組。但 3 例病例在改良 NIH 標準中均屬于高危組。這樣的劃分,可能如 Joensuu 提出改良 NIH 標準的初衷那樣,可以篩選出能夠從靶向治療中獲益的患者,但在實際臨床工作中,它所提供的分層信息顯然不夠,不利于醫生對特定 GIST 病例進行更精準的預后判斷,也不利于患者本人對自身腫瘤的正確認知。因此,如 2013 年版中國 GIST 診斷治療專家共識[5]建議:在使用改良 NIH 標準進行危險度評估時,可將 AFIP 標準作為補充和參考。
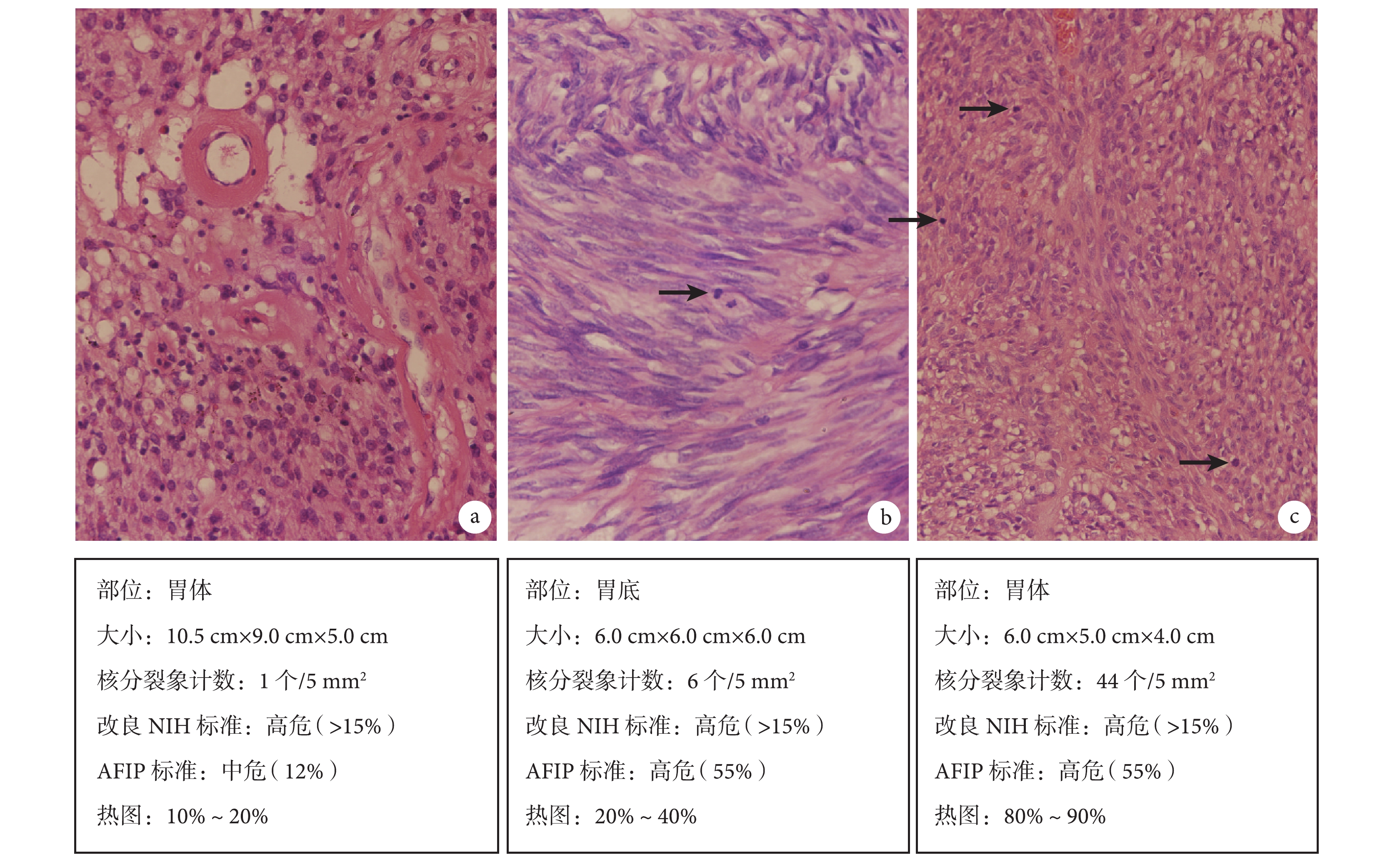 圖1
3 例胃原發 GIST 在不同危險度評估系統中的分組和(或)進展或復發風險率 a:病例 A;b:病例 B;c:病例 C。箭頭示核分裂象。染色方法: HE 染色,原始放大倍數×400
圖1
3 例胃原發 GIST 在不同危險度評估系統中的分組和(或)進展或復發風險率 a:病例 A;b:病例 B;c:病例 C。箭頭示核分裂象。染色方法: HE 染色,原始放大倍數×400
2 2012 年 Joensuu 熱圖
熱圖是由 Joensuu 主導的研究組在 2012 年提出的,他們從 2000~2010 年期間 GIST 相關文獻中篩選出 10 項基于人群的預后研究[33-37,42-46]并聯系研究者得到原始數據,最終納入 2 560 例 GIST 病例并建模,從而提出了熱圖。他們將熱圖用于預測 GIST 患者術后 10 年間的復發風險率。熱圖隨即被 ESMO GIST 診治和隨訪指南[3]介紹,國內也陸續有文獻[47-48]對其進行介紹。
與 AFIP 標準相似,熱圖是在對大樣本的 GIST 病例進行預后指標相關性研究的基礎上提出的,所有病例均接受了完全切除治療且未進行靶向治療,隨訪年限為 0~45.8 年,中位年限為 4 年。
與 AFIP 標準和改良 NIH 標準相比,熱圖在腫瘤大小和核分裂象計數兩項指標上以及對腫瘤的復發風險率的顯示上都不再使用人為的截斷值,而是通過建模得出了一個連續的對應關系;同時,熱圖將腫瘤最大徑區間擴展至 25 cm,核分裂象計數擴展至 50 個,腫瘤的復發風險率也擴展為 0~100% 的連續區間。這些改變減少了前者可能導致的預后信息損失,也改變了當評估指標臨近截斷值時所估計的風險率大幅度變化的情況,因而可能為臨床甚至各項相關研究提供更細致的分層信息。如圖 1,熱圖對病例 A 的復發風險率評估為 10%~20%,與 AFIP 標準基本一致;而對 AFIP 標準提示進展風險率均為 55% 的病例 B 和 C,熱圖的復發風險率則分別評估為 20%~40% 和 80%~90%。筆者認為,這是熱圖中將核分裂象計數由 AFIP 標準的 4 個區間擴展至 0~50 的連續區間所帶來的更細致的分層結果。
熱圖系統其他變化還包括:增加了獨立的“胃腸外 GIST 組”以及“不明確腫瘤是否破裂組”的風險率評估;此外,在 AFIP 評估系統中,“胃≤2 cm、>5 個核分裂象組”因數據少,其風險率為 0;而在熱圖中,其風險率則根據核分裂象數的不同分布在 10%~80% 之間。
Joensuu 的此項研究中還采用了另一組源于獨立中心的 920 例 GIST 患者數據[46]對本文中討論的 4 個評估系統進行了驗證,發現 4 個系統都能準確進行預后評估,而熱圖可提供更為準確的信息。
熱圖沒有詳細界定危險組,目前也沒有指南使用這一系統指導選擇輔助靶向治療方案。但在筆者的臨床實踐中,它提供的復發風險率區間評估的確可以輔助常規的 GIST 危險度評估標準,幫助醫生預測每例獨立的 GIST 病例的預后,進而影響到患者自身對輔助靶向治療方案的選擇。
熱圖仍未對 50 個 HPF 進行標準化界定,從其數據來源的原始文獻[33-35,39-40,42-46]看,僅有 3 項研究對其進行了界定,分別為 7.95 mm2[46]、8 mm2[37]和 10 mm2[42]。而同時對 AFIP 標準和熱圖進行介紹的 2014 年 ESMO 指南則將計數范圍界定在 Miettinen 設定的 5 mm2。筆者認為,若沿用范圍較小的 Miettinen 標準,因其在計數過程中選擇了核分裂象最活躍區,即使直接將 5 mm2 時的實際計數值乘以 2 來推測 10 mm2 時的計數值,按照熱圖的區間分布特點,兩個計數值對應的復發風險率區間可能無變化或僅相差一個區間。
3 小結
對 GIST 進行危險度評估,其實用意義在于指導制定輔助靶向治療方案。應該認識到,由于劃分危險度所采用的復發或進展百分率區間的不同,同一個病例在不同評估標準中可能處于不同的危險度分組中,而不同的診治指南、臨床試驗研究、病理報告則可能采用不同的評估標準。因此,在參考不同的指南/共識或研究結果制定輔助治療方案時,首先需要使用相應指南/共識或研究采用的危險度評估系統對病例進行評估。
AFIP 標準和改良 NIH 標準,是在研究顯示的腫瘤復發或進展風險率的基礎上人為進行的危險度分級或分組。我們需認識到,相同危險度分組(特別是高危組)的腫瘤可能具有差別較大的復發或進展風險率。熱圖在腫瘤大小、核分裂象計數等信息區間上的擴展,強調了這兩項指標對 GIST 進展風險率的影響。因此,病理醫生在進行 GIST 診斷時,應準確報告腫瘤大小、核分裂象計數的具體數值,為臨床提供更多的預后信息。
可能影響 GIST 危險度分級的另一個因素是對核分裂象計數 50 HPF 范圍的界定,文獻報道從 5~10 mm2 不等。雖然目前中國 GIST 診治共識尚未進行標準化界定,但筆者認為使用與國際接軌的 5 mm2 將是趨勢,標準的統一必將更有利于國內外同行間進行交流及進一步的科學研究。在現階段,病理醫生可根據所在單位的實際情況在病理報告中注明計數的實際面積大小或計數的實際 HPF 數目及所用顯微鏡視場數,以供臨床醫生參考。
胃腸間質瘤(gastrointestinal stromal tumor,GIST)是胃腸道最常見的間葉源性腫瘤,由突變的KIT 或血小板源性生長因子受體 α(PDGFRA)基因驅動,其生物學行為多樣,可表現為良性、惡性潛能未定或惡性[1]。在當前的臨床實踐中,多采用對完全切除的原發 GIST 進行危險度分級,以評估特定病例的復發或轉移風險(進展風險),并指導術后輔助治療(靶向治療)的選擇[2-5]。
中國 GIST 診斷治療專家共識中介紹的改良 NIH 標準與 AFIP 標準對 GIST 危險度劃分存在一定的差異[5,7-8,10],這可能給 GIST 患者的危險度分級及后續治療帶來差別。因此,診治醫生不僅應認識到這兩個系統差異的存在,同時也需認識其產生的本質,才能幫助患者合理地制定輔助治療方案。現對上述危險度評估系統的提出依據、數據來源、危險度劃分區間、指南推薦使用情況等細節進行梳理(表 1),重點討論 AFIP 標準和改良 NIH 標準危險度劃分的差異、原因以及其在實際應用中的注意事項。
1 GIST 危險度評估系統
1.1 2002 年 NIH 標準
NIH 標準(又稱 Fletcher 標準),是 2001 年 4 月 NIH 召集 Fletcher 等 12 名美國病理專家討論 GIST 的診斷和預后標準時制定的,它是自 1998 年 Hirota 等[11]報道 GIST 病例中存在KIT 基因激活突變、Kindblom 等[12]報道多數 GIST 病例表達KIT 基因的產物 CD117 并且 WHO[13]將 GIST 作為一個獨立的腫瘤實體進行定義后,第一個被提出并廣泛使用的危險度評估標準[6]。該標準是由 12 名病理專家在個人經驗的基礎上提出來的,它可能在一定程度上參考了一些早期研究[6,14-19],但是沒有獨立的研究數據作為其依據。由此,它雖然將 GIST 劃分為高、中、低和極低 4 個危險組,但并沒有詳細給出各個組的進展風險率。對于核分裂象計數范圍,該標準采用 50 個高倍視野(high-power field,HPF)。雖然專家組認為應根據顯微鏡 HPF 的大小對 50 個 HPF 的范圍進行標準化,但因為沒達成共識而未界定標準。專家組希望并相信 NIH 標準能夠被改進且有更多有效的預測參數可以建立起來。目前,此標準已不再在臨床工作中使用。
1.2 2006 年 AFIP 標準
AFIP 標準(又稱 Miettinen 標準),是由美國病理學家 Miettinen 等[7]提出的。Miettinen 是 NIH 標準專家組成員之一,他從 1999 年起發表了一系列關于不同部位 GIST 及其復發風險的研究[7,19-25]。2006 年,Miettinen 等[7]基于之前自身的研究數據,包括 AFIP 單中心診治的 1 939 例完全切除且未經靶向治療的 GIST 病例(1 055 例胃,629 例空腸和回腸,144 例十二指腸,111 例直腸),提出了 AFIP 標準。
與 NIH 標準不同,AFIP 標準是在對 AFIP 單中心大樣本具有隨訪信息的 GIST 病例進行相關性研究的基礎上提出的,隨訪時間為 1~34.5 年,中位年限達 10 年以上。因此它為研究中的各個 GIST 分組提供了直觀的進展風險率并提示了風險度劃分的區間值,其中極低風險為 1.9%,低風險為 3.6%~8.5%,中風險為 12%~24%,高風險則大于等于 34%。
在 AFIP 標準中,Miettinen 明確指出核分裂象計數范圍為 5 mm2;同時,需選擇最活躍區進行計數[21-22]。顯微鏡的視野直徑和面積因其視場數不同而不同[26],這使同一 GIST 病例可能因選用不同視場數的顯微鏡而得到不同的核分裂象計數進而影響危險度分級。因此 Miettinen 等[7]強調,若使用現代的大視野顯微鏡,只需計數 25 個 HPF。實際上,我們目前使用顯微鏡的視場數多為 18~22,當計數范圍確定(標準化)為 5 mm2 時,可根據使用顯微鏡視場數的不同確定相應需計數的視野數,見表 2。
NCCN 指南[2]、WHO 軟組織腫瘤分類[1]、WHO 消化道腫瘤分類[27]、CAP GIST 標本檢測指南[28]及 NCI-NIH 的官方網站[29]上均采用了 AFIP 標準。ESMO GIST 診治和隨訪指南[3]、2013 年版中國 GIST 診斷治療專家共識[5]和亞洲 GIST 診治共識[4]也對 AFIP 標準進行了介紹。
1.3 2008 年改良 NIH 標準
改良 NIH 標準(又稱 Joensuu 標準),是我國目前使用最為廣泛的 GIST 危險度評估標準,它是芬蘭腫瘤學家 Joensuu[8]在 2008 年的一篇綜述中提出的。Joensuu 是全球使用伊馬替尼治療進展期 GIST 患者并獲得成功的第一人[30]。改良 NIH 標準提出的初衷是為了對 GIST 患者進行分層,以篩選可以從靶向治療中獲益的患者。
和 NIH 標準一樣,改良 NIH 標準并沒有獨立的研究數據基礎,它是對基于或未基于 NIH 標準的各類研究(包括 Miettinen 的系列研究)[21-22,31-39]進行總結后的提議,但也不同于 meta 分析。改良 NIH 標準最主要的改變是引入了腫瘤部位和腫瘤破裂兩個參數,這兩個參數是多項研究[21-22,31-35,39]的重要發現。其后的大樣本驗證研究[9,40]顯示,改良 NIH 標準可以準確預測 GIST 患者預后。近期一項日本的研究[41]顯示,在預測 GIST 復發方面,在包括 NIH、AFIP、改良 NIH 標準等 5 個 GIST 危險度評估標準中,改良 NIH 標準最具敏感性。同時由于該標準較 AFIP 標準簡明、易于記憶和操作,中國 GIST 診治共識主要推薦這一標準。2016 年亞洲 GIST 診治共識則推薦使用該標準來篩選需要進行輔助靶向治療的 GIST 患者[4]。
在改良 NIH 標準中,與 AFIP 標準不同,Joensuu 將高風險定義為 10~15 年間復發風險率在 15%~20% 之上的 GIST 分組,對其他危險組沒有提及明確的劃分區間。
Joensuu 對核分裂象計數范圍未進行標準化界定,雖然他也指出這是 2002 年 NIH 標準的不足。參考 Joensuu 在提出改良 NIH 標準時所參考的各項研究[21-22,32-39],除 Miettinen 的研究外,多數研究未對 50 個 HPF 的范圍進行界定,僅個別界定為 8 mm2[37]或 10 mm2[38];而 Miettinen 的研究是其中重要組成部分,其他各單項研究的病例數(142~335 例)遠低于前者。因此筆者認為,使用改良 NIH 標準時,核分裂象計數范圍使用 Miettinen 界定的 5 mm2 是合理的。
1.4 AFIP 標準與改良 NIH 標準危險度評估的差異
AFIP 標準與改良 NIH 標準對部分 GIST 病例的危險度劃分存在差異(表 3)。總體看來,在差異分組中,改良 NIH 標準較 AFIP 標準高評危險度,這更多的是源于進展或復發風險率區間選擇的差別(表 1)而不是研究數據上的根本差異。
在差異分組中,僅一組病例即“最大徑≤2 cm、核分裂象計數>5 個/50 HPF 的非胃原發 GIST”在改良 NIH 標準中低于 AFIP 標準。改良 NIH 標準將核分裂象計數在(6~10)個/50 HPF 者劃分為中危組,而 AFIP 標準則顯示其進展風險率為 50% 或 54%,屬高危組。在 Joensuu 本人其后的熱圖研究[9]中顯示這組病例的復發風險率為 20%~40%,符合改良 NIH 標準高危組定義,與 AFIP 標準接近。
改良 NIH 標準另一個需要注意的地方是,即使同為高危 GIST,其復發風險率則介于 15%~100% 之間。圖 1 是筆者臨床實踐中 3 例具有代表性的病例,同為胃原發 GIST,根據 AFIP 標準,病例 A 的進展風險率為 12%,屬于中危組;病例 B 和病例 C 的進展風險率為 55%,屬于高危組。但 3 例病例在改良 NIH 標準中均屬于高危組。這樣的劃分,可能如 Joensuu 提出改良 NIH 標準的初衷那樣,可以篩選出能夠從靶向治療中獲益的患者,但在實際臨床工作中,它所提供的分層信息顯然不夠,不利于醫生對特定 GIST 病例進行更精準的預后判斷,也不利于患者本人對自身腫瘤的正確認知。因此,如 2013 年版中國 GIST 診斷治療專家共識[5]建議:在使用改良 NIH 標準進行危險度評估時,可將 AFIP 標準作為補充和參考。
 圖1
3 例胃原發 GIST 在不同危險度評估系統中的分組和(或)進展或復發風險率 a:病例 A;b:病例 B;c:病例 C。箭頭示核分裂象。染色方法: HE 染色,原始放大倍數×400
圖1
3 例胃原發 GIST 在不同危險度評估系統中的分組和(或)進展或復發風險率 a:病例 A;b:病例 B;c:病例 C。箭頭示核分裂象。染色方法: HE 染色,原始放大倍數×400
2 2012 年 Joensuu 熱圖
熱圖是由 Joensuu 主導的研究組在 2012 年提出的,他們從 2000~2010 年期間 GIST 相關文獻中篩選出 10 項基于人群的預后研究[33-37,42-46]并聯系研究者得到原始數據,最終納入 2 560 例 GIST 病例并建模,從而提出了熱圖。他們將熱圖用于預測 GIST 患者術后 10 年間的復發風險率。熱圖隨即被 ESMO GIST 診治和隨訪指南[3]介紹,國內也陸續有文獻[47-48]對其進行介紹。
與 AFIP 標準相似,熱圖是在對大樣本的 GIST 病例進行預后指標相關性研究的基礎上提出的,所有病例均接受了完全切除治療且未進行靶向治療,隨訪年限為 0~45.8 年,中位年限為 4 年。
與 AFIP 標準和改良 NIH 標準相比,熱圖在腫瘤大小和核分裂象計數兩項指標上以及對腫瘤的復發風險率的顯示上都不再使用人為的截斷值,而是通過建模得出了一個連續的對應關系;同時,熱圖將腫瘤最大徑區間擴展至 25 cm,核分裂象計數擴展至 50 個,腫瘤的復發風險率也擴展為 0~100% 的連續區間。這些改變減少了前者可能導致的預后信息損失,也改變了當評估指標臨近截斷值時所估計的風險率大幅度變化的情況,因而可能為臨床甚至各項相關研究提供更細致的分層信息。如圖 1,熱圖對病例 A 的復發風險率評估為 10%~20%,與 AFIP 標準基本一致;而對 AFIP 標準提示進展風險率均為 55% 的病例 B 和 C,熱圖的復發風險率則分別評估為 20%~40% 和 80%~90%。筆者認為,這是熱圖中將核分裂象計數由 AFIP 標準的 4 個區間擴展至 0~50 的連續區間所帶來的更細致的分層結果。
熱圖系統其他變化還包括:增加了獨立的“胃腸外 GIST 組”以及“不明確腫瘤是否破裂組”的風險率評估;此外,在 AFIP 評估系統中,“胃≤2 cm、>5 個核分裂象組”因數據少,其風險率為 0;而在熱圖中,其風險率則根據核分裂象數的不同分布在 10%~80% 之間。
Joensuu 的此項研究中還采用了另一組源于獨立中心的 920 例 GIST 患者數據[46]對本文中討論的 4 個評估系統進行了驗證,發現 4 個系統都能準確進行預后評估,而熱圖可提供更為準確的信息。
熱圖沒有詳細界定危險組,目前也沒有指南使用這一系統指導選擇輔助靶向治療方案。但在筆者的臨床實踐中,它提供的復發風險率區間評估的確可以輔助常規的 GIST 危險度評估標準,幫助醫生預測每例獨立的 GIST 病例的預后,進而影響到患者自身對輔助靶向治療方案的選擇。
熱圖仍未對 50 個 HPF 進行標準化界定,從其數據來源的原始文獻[33-35,39-40,42-46]看,僅有 3 項研究對其進行了界定,分別為 7.95 mm2[46]、8 mm2[37]和 10 mm2[42]。而同時對 AFIP 標準和熱圖進行介紹的 2014 年 ESMO 指南則將計數范圍界定在 Miettinen 設定的 5 mm2。筆者認為,若沿用范圍較小的 Miettinen 標準,因其在計數過程中選擇了核分裂象最活躍區,即使直接將 5 mm2 時的實際計數值乘以 2 來推測 10 mm2 時的計數值,按照熱圖的區間分布特點,兩個計數值對應的復發風險率區間可能無變化或僅相差一個區間。
3 小結
對 GIST 進行危險度評估,其實用意義在于指導制定輔助靶向治療方案。應該認識到,由于劃分危險度所采用的復發或進展百分率區間的不同,同一個病例在不同評估標準中可能處于不同的危險度分組中,而不同的診治指南、臨床試驗研究、病理報告則可能采用不同的評估標準。因此,在參考不同的指南/共識或研究結果制定輔助治療方案時,首先需要使用相應指南/共識或研究采用的危險度評估系統對病例進行評估。
AFIP 標準和改良 NIH 標準,是在研究顯示的腫瘤復發或進展風險率的基礎上人為進行的危險度分級或分組。我們需認識到,相同危險度分組(特別是高危組)的腫瘤可能具有差別較大的復發或進展風險率。熱圖在腫瘤大小、核分裂象計數等信息區間上的擴展,強調了這兩項指標對 GIST 進展風險率的影響。因此,病理醫生在進行 GIST 診斷時,應準確報告腫瘤大小、核分裂象計數的具體數值,為臨床提供更多的預后信息。
可能影響 GIST 危險度分級的另一個因素是對核分裂象計數 50 HPF 范圍的界定,文獻報道從 5~10 mm2 不等。雖然目前中國 GIST 診治共識尚未進行標準化界定,但筆者認為使用與國際接軌的 5 mm2 將是趨勢,標準的統一必將更有利于國內外同行間進行交流及進一步的科學研究。在現階段,病理醫生可根據所在單位的實際情況在病理報告中注明計數的實際面積大小或計數的實際 HPF 數目及所用顯微鏡視場數,以供臨床醫生參考。