引用本文: 梁妍雯, 吳宇. 侖伐替尼治療局晚期甲狀腺癌的單中心前瞻性研究. 中國普外基礎與臨床雜志, 2024, 31(11): 1364-1369. doi: 10.7507/1007-9424.202404054 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
在過去的幾十年中,甲狀腺癌的發病率在全世界范圍內飆升,但90%以上的患者是分化型甲狀腺癌(differentiated thyroid cancer,DTC),其預后良好,病死率相對低,所以手術切除是目前主要的治療方式,且遠處轉移的患者仍能從根治性手術結合術后同位素治療方案中獲得良好的效果。然而,當腫瘤侵犯鄰近結構時,可能會嚴重影響生活質量。據報道,在DTC患者中,原發灶累及喉、氣管、食管、喉返神經或頸總動脈的發生率為13%~15%[1-2],淋巴結轉移的發生率為15%~30%[3],這些特征是預后不良的重要危險因素,與生存率降低顯著相關[4-5];因此,對局晚期甲狀腺癌患者制定除手術外的輔助治療方案尤為重要。
新輔助治療,包括放療、化療、靶向治療和免疫治療已廣泛實施,并在幾種腫瘤的治療中取得了顯著的治療效果。目前幾種酪氨酸激酶抑制劑(tyrosine kinase inhibitor,TKI),如安羅替尼、索拉非尼、拉羅替尼正在成為DTC、甲狀腺髓樣癌(medullary thyroid cancer,MTC)和甲狀腺未分化癌(anaplastic thyroid cancer,ATC)的治療新方法,且已獲得臨床有效性并穩定疾病的發展。例如侖伐替尼可顯著延長放射性碘難治性分化型甲狀腺癌(radioiodine-refractory differentiated thyroid cancer,RR-DTC)患者的無進展生存期[6],不僅可以作為新輔助治療用于術前降期、降低手術風險以及增加器官保留率,還可以用于腫瘤學意義上的轉化治療,使無手術機會、碘抵抗及預后差的患者恢復攝碘能力、延長生存期甚至重獲手術機會。然而,我們還需要進行更大規模的研究來確定侖伐替尼的最佳治療周期、手術時間和安全性。因此,筆者進行了一項前瞻性、觀察性、基于真實世界的研究,以評估侖伐替尼的療效和安全性,并探索該方案作為轉化治療的可行性。
1 資料與方法
1.1 臨床資料
前瞻性收集福建省腫瘤醫院頭頸外科2021年9月至2023年6月期間收治的17例局晚期甲狀腺癌患者的臨床資料。本研究的納入標準:① 年齡18~75歲;② 功能狀態(performance status,PS)評分:0~1分;③ 經粗針穿刺病理學活檢證實為甲狀腺癌(包括DTC和ATC);④ 臨床分期Ⅱ~Ⅲ期、cT4a~bN0~1M0~1(美國癌癥聯合委員會分期手冊第八版);⑤ 至少有1個可測量的目標病變(最長直徑≥10 mm或淋巴結最短直徑≥15 mm),符合實體瘤療效評價(RECIST)標準1.1;⑥ 簽署書面知情同意書。排除標準:① 其他惡性腫瘤病史;② 既往接受過抗血管生成藥物;③ 活動性出血或異常凝血;④ 患有需要治療的嚴重心臟病;⑤ 懷孕或哺乳期。所有患者均由筆者所在醫院頭頸外科收入院,每例患者均簽署了知情同意書。本研究已獲得中國臨床試驗注冊倫理委員會的批準 [審查文號:ChiECRCT20210247],符合赫爾辛基宣言及藥物臨床試驗質量管理規范。
1.2 治療方案
入選的患者均口服侖伐替尼、1次/d,起始劑量為24 mg,28 d為1個周期。基于ATC患者具有腫瘤突變負荷增加、程序性死亡配體1(pro- grammed death-ligand 1,PD-L1)水平升高的特征,且ATC可能對免疫檢查點抑制劑敏感,因此入選的ATC患者另外予聯合帕博利珠單抗(每 3 周給藥200 mg)治療[7]。當出現藥物相關不良事件時,根據不良事件通用術語標準(4.0版本)調整劑量或終止治療。
1.3 數據整理
所有患者在納入研究前需具備基礎資料,例如詳細的病史、頸部超聲、頸胸部增強CT以及全套化驗結果;根據粗針活檢得出病理診斷。通過閱讀超聲及CT檢查結果以確定目標病變直徑。
1.4 研究終點指標
本研究的主要終點指標是按照RECIST 1.1標準規定的客觀緩解率(objective response rate,ORR),次要終點指標包括疾病控制率(disease control rate,DCR)、R0/1切除率和安全性。每個治療周期結束評估1次,最后一次治療周期結束的評估結果納入數據統計。
ORR定義為完全緩解(complete response,CR)和部分緩解(partial responses,PR)的患者比例。DCR定義為CR、PR或病情穩定(stable disease,SD)的患者比例,SD需要持續3周或更長時間。R0切除定義為完全切除,R1切除定義為病理檢查發現鏡下殘留。
1.5 分析數據集
本研究最終的統計是在接受了至少1個治療周期的患者群體中進行,基礎特征、療效和安全性分析是在所有接受了侖伐替尼治療的患者群體中進行。安全性分析即治療相關不良事件的發生率。
2 結果
根據納入和排除標準,17例接受侖伐替尼治療的患者被納入研究,并全部進入安全性和有效性分析。17例患者的最大腫瘤直徑為17~84 mm,中位直徑43 mm,其他臨床病理資料見表1。
侖伐替尼的中位治療時間為8周(4~32周)。5例患者達到PR,11例患者達到SD,1例患者疾病進展(progressive disease,PD)。侖伐替尼的ORR和DCR分別為29.4%(5/17)和94.1%(16/17)。治療相關不良事件的發生率為100%,用藥期間最常見的不良事件依次是高血壓(7例,41.2%)、腹瀉(6例,35.3%)、蛋白尿(5例,29.4%)和乏力(4例,23.5%),沒有發生重大治療相關不良事件。4例患者(23.5%)因腹瀉和高血壓需要中斷治療,平均中斷2周(1~4周)。所有患者均因不良事件而減少用藥劑量,盡管初始劑量為24 mg,但中位劑量為16 mg。
在接受侖伐替尼治療后,17例患者中有12例(70.6%)患者進行了手術切除,其中包括4例PR和8例SD,影像學評估及術中情況如圖1。5例患者未行手術治療,包括2例術前評估腫瘤無法切除,3例患者拒絕手術。即便未接受根治性手術,該5例患者也均在轉化治療中獲益,如1例患者從輪椅入院到可以正常行走,其生存質量明顯改善(圖2);余4例患者訴不同程度的疼痛減輕。瀑布圖(圖3a)描繪了目標病變治療前后最長直徑及其差異,中位腫瘤直徑從治療前的43 mm退縮為治療后的12 mm。完成最后1次新輔助治療和手術之間的中位間隔時間為9 d(7~12 d)。11例患者實現了R0/R1切除,1例因頸總動脈受侵而進行了R2切除。
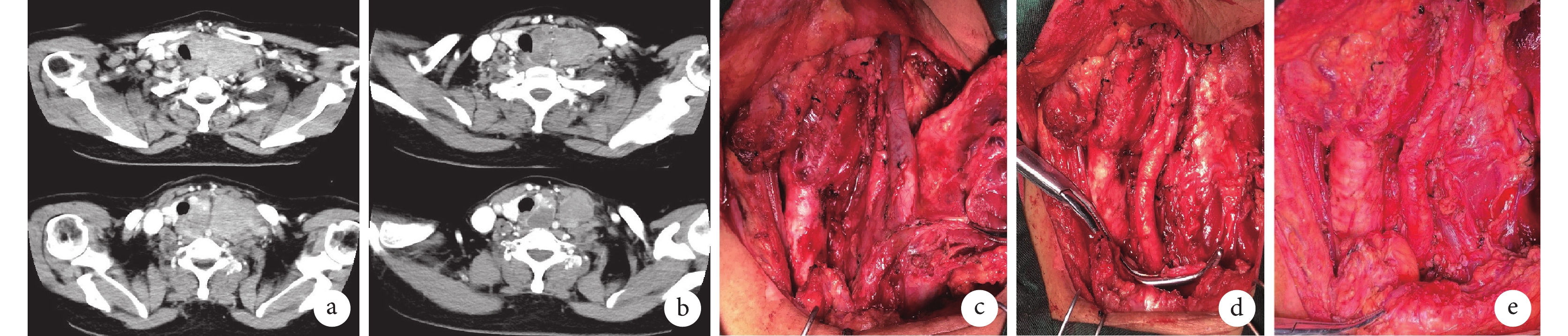
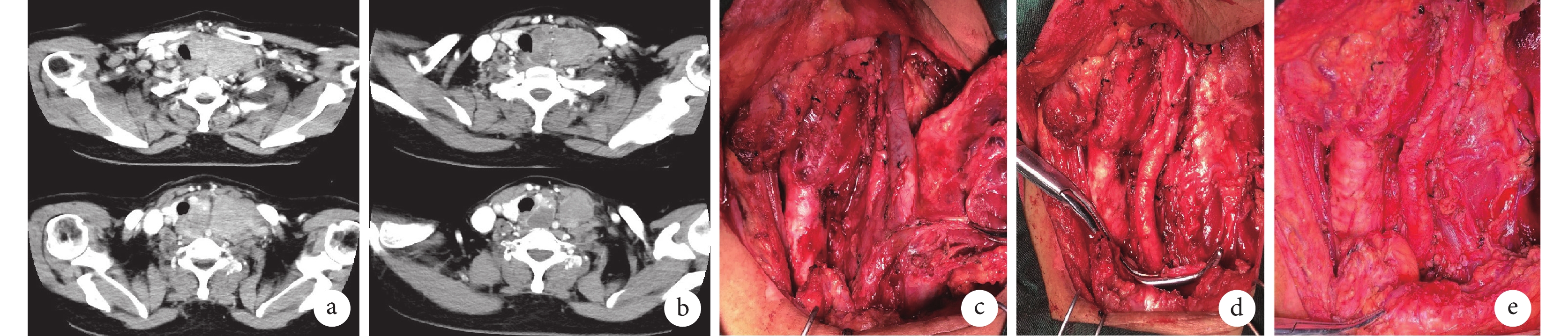 圖1
示根據RECIST 1.1標準療效尚未達PR,但增強CT圖像提示已獲得手術機會
圖1
示根據RECIST 1.1標準療效尚未達PR,但增強CT圖像提示已獲得手術機會
a:治療前腫瘤內部均勻強化,與動脈邊界不清;b:治療后腫瘤內部出現壞死,與動脈邊界清晰;c~e:術中所見,c圖從左向右依次為氣管、頸總動脈、頸內靜脈;d圖顯示去除頸內靜脈及迷走神經,血管夾處可見靜脈斷端,e圖顯示縫扎斷端及頭臂靜脈的部分靜脈壁
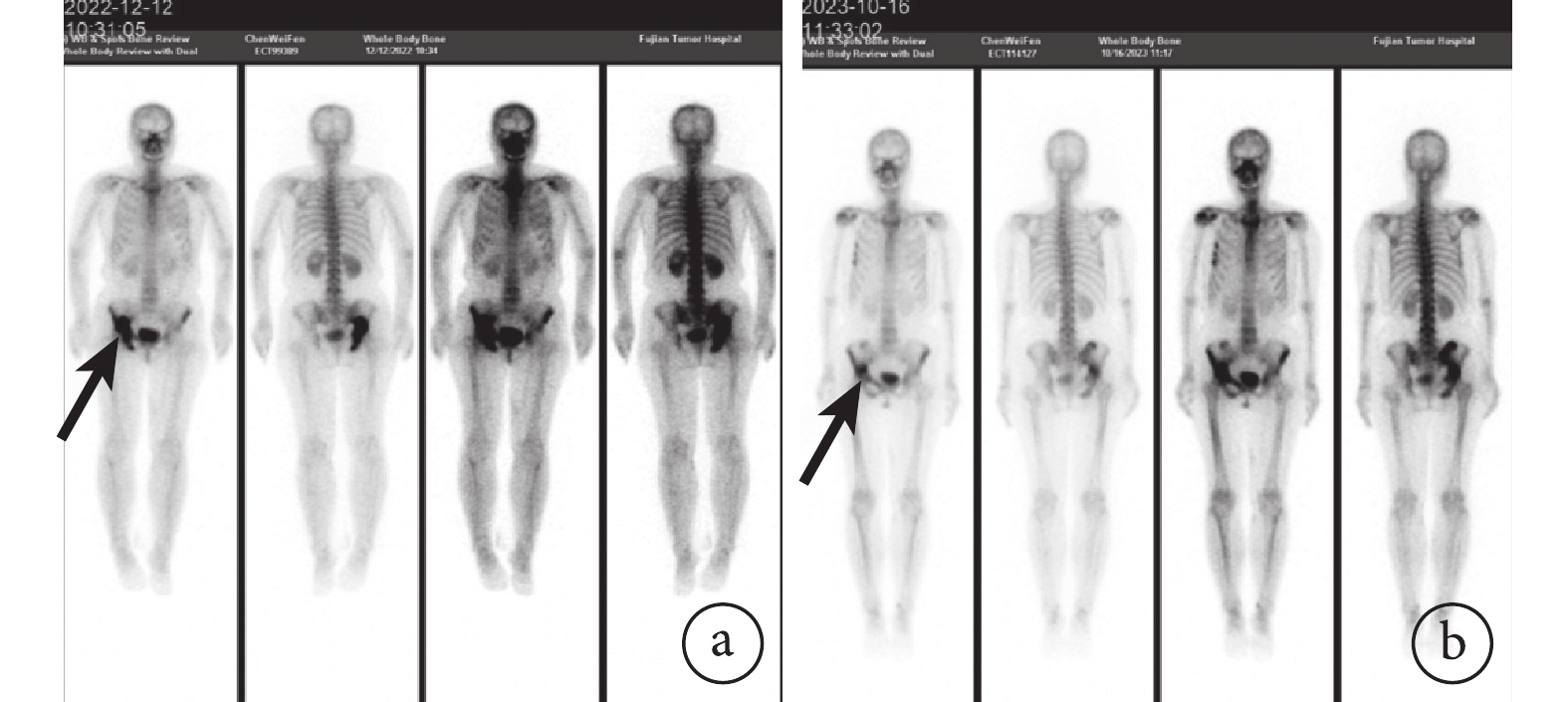
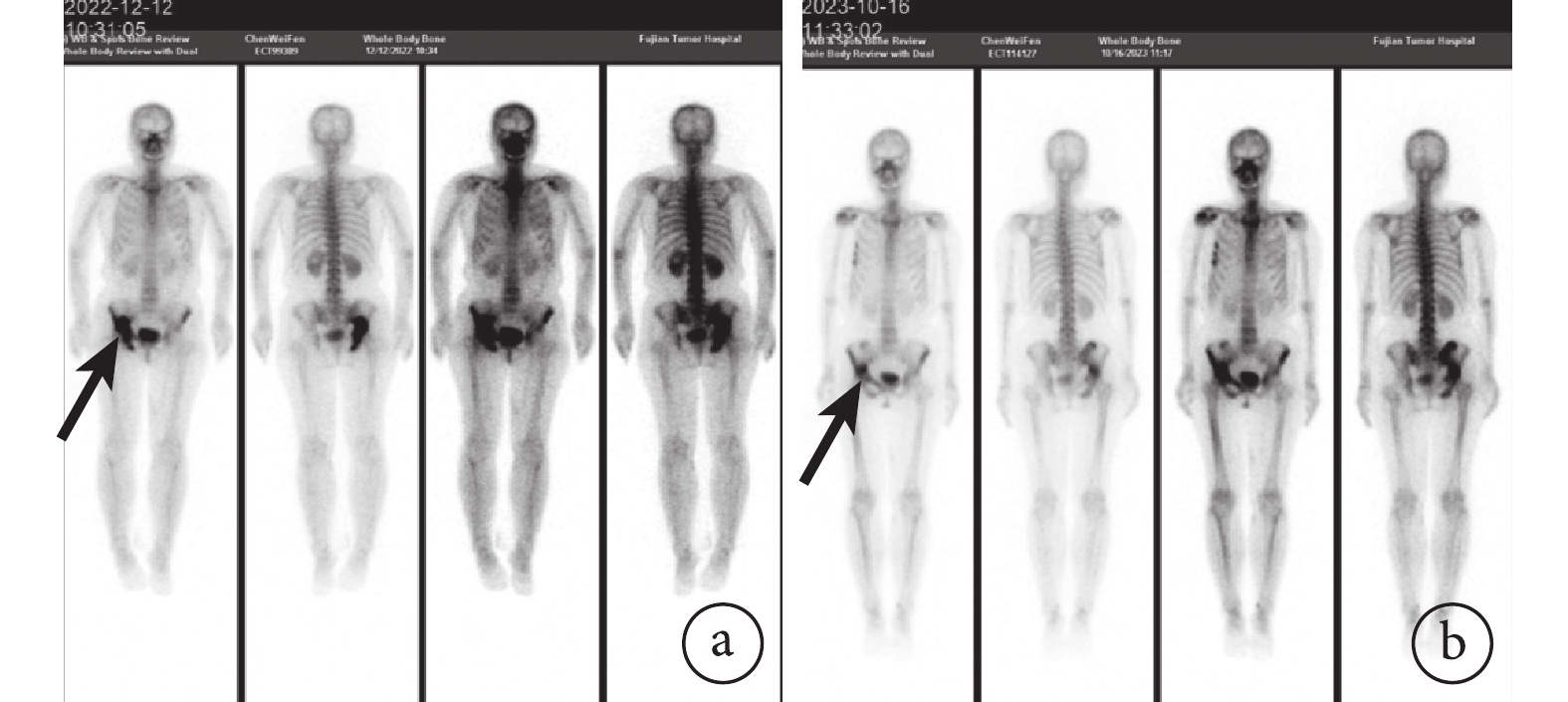 圖2
示治療后髖骨轉移灶(黑箭)明顯退縮
圖2
示治療后髖骨轉移灶(黑箭)明顯退縮
a:治療前;b:治療后
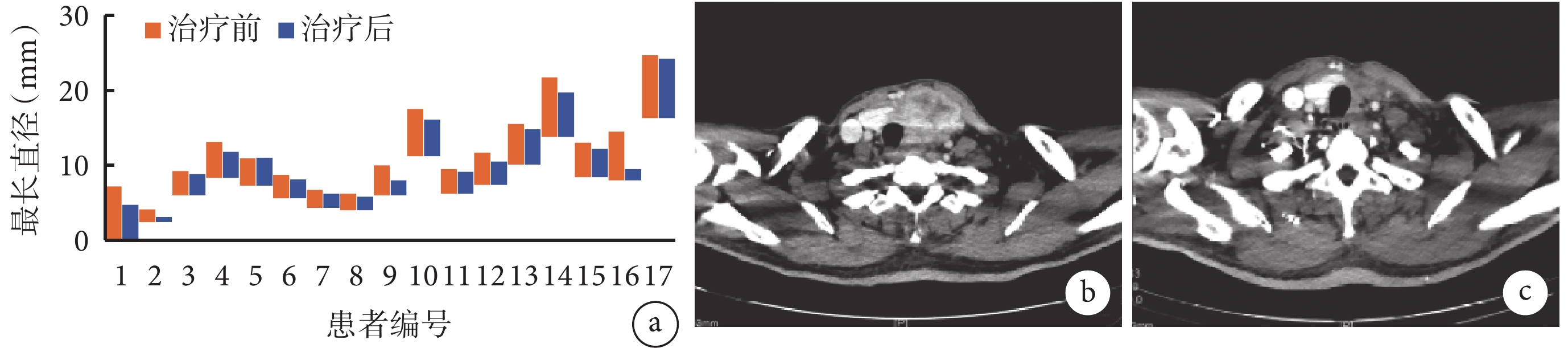
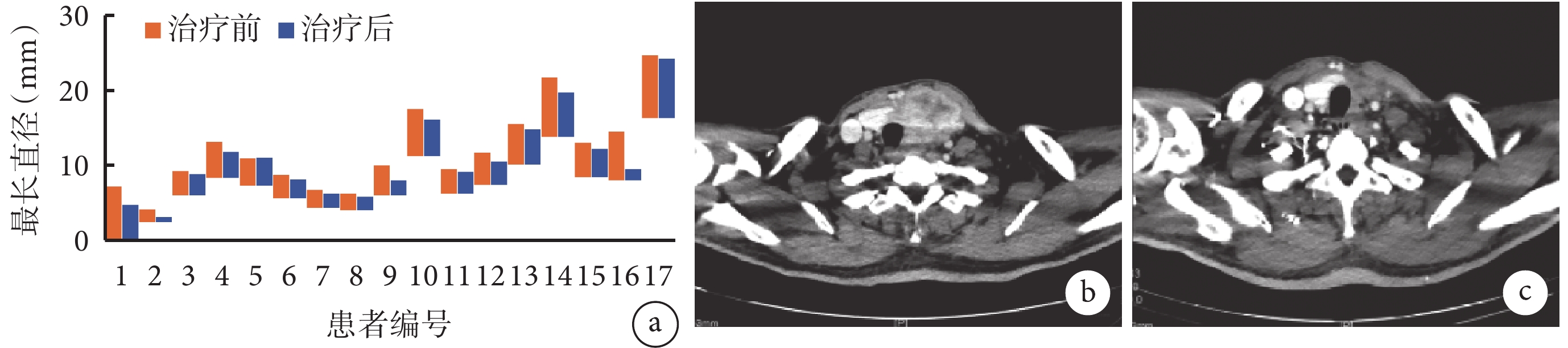 圖3
示17例患者目標病變治療前后最長直徑的變化,以及某ATC病例治療前后的增強CT圖像
圖3
示17例患者目標病變治療前后最長直徑的變化,以及某ATC病例治療前后的增強CT圖像
a:17例患者目標病變治療前后最長直徑的變化;b和c:增強CT圖像示“左ATC局部切除術后復發”患者,治療前腫瘤占位效應致氣管、動脈移位(b),經歷2年靶向治療聯合免疫治療后腫瘤明顯退縮,氣管、動脈復位(c)
本研究中有5例聯用帕博利珠單抗的患者,其中1例達到PR,3例達到SD,1例PD,影像學評估可見該方案具有效性(圖3b和3c)。
3 討論
3.1 局晚期甲狀腺癌的治療
局晚期甲狀腺癌,尤其是惡性程度高、復發轉移快及生存時間短的ATC,通常已失去手術機會或手術治療效果欠佳,其治療較困難[8]。轉化治療是一種腫瘤治療方案,其目的是通過非手術手段(如化療、放療、靶向治療、免疫治療等)使原本不可切除的腫瘤縮小或降期,從而轉變為可切除的狀態。換言之,針對可手術的病例,轉化治療及所謂的新輔助治療,可達到術前降期、降低手術難度及風險、增加器官保留率;對于暫無手術機會的病例,通過轉化治療重獲手術的可能性或者延長生存期同樣重要。轉化治療的成功不僅取決于腫瘤的縮小,還包括患者在治療后的長期生存和生活質量。
研究[9]表明,甲狀腺癌的發生、發展和去分化與不同受體酪氨酸激酶介導的信號通路密切相關,幾種TKI作為局晚期甲狀腺癌轉化治療的新方法,已獲得臨床有效性并穩定疾病的發展。本研究是為數不多的評估侖伐替尼對于局晚期甲狀腺癌的療效和安全性的研究之一。本研究發現侖伐替尼達到的ORR相對較低,但DCR和R0/1切除率以及類似于先前報道[6, 10-11]的治療相關不良事件的發生率均在可接受范圍內。換言之,侖伐替尼可能更適用于局晚期甲狀腺癌的轉化治療。在SELECT試驗[6]中,RR-DTC患者對侖伐替尼的有效率為64.8%。據報道,中國RR-DTC患者對侖伐替尼的ORR為69.9%[12]。一項安羅替尼新輔助治療局晚期甲狀腺癌的研究得出了76.9%的ORR[13]。這些研究結果之間的差異可能歸因于患者特征和用藥的差異。
因此,明確侖伐替尼的獲益群體是當前值得探索的方向。侖伐替尼顯著的抗腫瘤活性是由于其對成纖維細胞生長因子受體(fibroblast growth factor receptor,FGFR)的酪氨酸激酶的抑制作用。FGFR是濾泡源性甲狀腺腫瘤的一種重要的信號通路[14],但侖伐替尼的療效與腫瘤細胞的BRAF和RAS突變狀態無關,這可能是由于侖伐替尼影響的靶點范圍廣泛,或其具有靶向FGFR等特異位點的能力[6]。患者是否接受過其他的靶向治療,如索拉非尼,以及這些治療的效果如何,都是選擇侖伐替尼時需要考慮的因素。盡管侖伐替尼在一些研究中顯示出對既往接受過TKI治療的患者仍有益處,但仍需評估患者對這些治療的反應和耐受性。另一方面,侖伐替尼可能對年齡較大(如65歲以上)患者的總體生存期效果更好。患者的整體健康狀況和心血管風險因素也應在考慮范疇內。每例患者的情況都是獨特的,因此治療方案也應結合患者的特定需求個體化制定[15]。
3.2 侖伐替尼的療效
本研究中ORR較低的潛在原因可能與患者的入組標準有關。SELECT試驗中的所有患者均診斷為RR-DTC,約305例(89.3%)患有肺轉移[8]。研究[6, 16]發現,新輔助治療對沒有轉移的患者更有效,這種差異可能歸因于沒有轉移的腫瘤侵襲性較低。本研究隊列中有4例(23.5%)患者曾接受過手術治療,7例(41.2%)患者有肺轉移,這似乎也可以解釋目前ORR較低的原因。另一個潛在原因可能是侖伐替尼的劑量差異。一項針對RR-DTC患者的研究[17]結果表明,18 mg/d和24 mg/d起始劑量侖伐替尼的效果是有所差異的(ORR:18 mg組比24 mg組,40.3%比57.3%)。如前所述,本研究中所有的患者均需減少劑量,盡管初始劑量為24 mg,但中位劑量為每天16 mg,且有4例患者中斷了治療。因此,大多數患者接受的侖伐替尼的劑量不足。在另一項評估侖伐替尼臨床療效和安全性的研究[18]中,晚期未分化甲狀腺癌患者每天接受中位12 mg的侖伐替尼維持劑量,得出的ORR和DCR與本研究接近,分別為29%和93%。此外,據報道[19],在某些情況下,即使是10 mg/d的侖伐替尼也能使腫瘤消退。相比之下,24 mg的初始劑量對一些患者來說似乎太高了,尤其是亞洲患者[18, 20]。至少在一些患者中,劑量的減少或中斷似乎與療效呈負相關[5, 21]。因此,侖伐替尼對于不同治療方案的最佳劑量需要進一步研究,例如其作為新輔助治療時,建議從高劑量起始、根據不良反應再做下調;以轉化治療為目的時,療效和不良反應的平衡才是關鍵,所以建議低劑量起始,酌情上調。
不同病理類型的甲狀腺癌對新輔助治療的反應也不同。Takahashi等[11]進行了一項研究侖伐替尼對局晚期甲狀腺癌患者療效的Ⅱ期臨床試驗,發現RR-DTC患者(68%)的緩解率高于MTC(22%)或晚期ATC患者(24%)。Taylor等[22]報道了侖伐替尼治療RR-DTC患者的PS評分和中性粒細胞-淋巴細胞比率(neutrophil-lymphocyte ratio,NLR)與療效之間的相關性,他們發現,PS評分為0且NLR≤3的患者比PS評分≥1且NLR>3的患者有更高的無進展生存率和ORR。
通過根治性切除實現R0是新輔助治療的最重要目標。多項研究[23-25]表明,與R2切除相比,R0/1切除明顯提高了生存率。Brauckhoff等[23]評估了174例接受透壁性切除手術(82例)、非透壁性切除手術(65例)或姑息性手術(27例)的患者,平均隨訪35.3個月,顯微鏡下不完全切除的10例(46%)患者和顯微鏡下完全切除的18例(15%)患者發生局部復發(P=0.001),這闡明了R0切除的臨床意義。此外,另一項研究報道[26]稱與R0切除的患者相比,R1切除的侵襲性甲狀腺癌患者的局部控制率較低。因此,新輔助治療后手術時機的把握至關重要[27-28]。例如,當重要的解剖結構界限清晰時,正是R0/1切除的最佳時間(圖1~2);另外,病灶出現明顯液化壞死、RECIST 1.1標準評價連續2個周期為SD、出現可能影響手術的不良反應且難以控制時,均可視為新輔助治療的結點,但需要注意停藥后到手術時的間隔時間,停藥期間的快速反彈必須重視。
目前,根據RECIST規定,腫瘤大小的退縮是判斷治療有效率的最重要因素[7, 29]。但筆者發現,腫瘤大小并不反映轉化治療的真實療效,患者的生存質量也可以成為重要的參考因素。例如1例曾接受轉化治療的患者,入組臨床研究3個月,因頸部淋巴結進展出組,但髖骨轉移灶明顯修復,患者從輪椅入院到可以正常行走,其生存質量明顯改善(圖3)。另外,原發灶和淋巴結本身對抗血管生成類靶向藥物的響應程度就是不同的,原發灶由于血供豐富,響應率更高,淋巴結一旦較大,往往多伴有液化壞死,因此縮瘤率不如原發灶。綜上,更適合評估局晚期甲狀腺癌患者新輔助治療的評價體系尚待開發。
3.3 侖伐替尼的安全性
本研究隊列的不良事件與先前發表的研究結果類似[6, 23-24],表明侖伐替尼的安全性是可接受的。高血壓和腹瀉是最常見的治療相關不良事件。筆者發現不良事件的緩解與劑量減少甚至治療中斷密切相關。一項研究[30]發現,RR-DTC患者在治療期間高血壓的發展與預后的改善有關,這表明高血壓是侖伐替尼療效的潛在預測因素,有必要在治療期間和圍手術期嚴格控制血壓。另一方面,作為血管內皮生長因子抑制劑,侖伐替尼對傷口愈合的影響鮮有報道,可能是因為迄今為止的研究太少,需要更大規模的研究來準確識別與治療相關的不良事件。
雖然單藥治療已被證實有一定的效果,但靶向治療聯合免疫治療的效果更好。研究表明,侖伐替尼和帕博利珠單抗聯合治療未分化及低分化甲狀腺癌是一種有效的治療選擇[7, 31-32],6例晚期ATC患者中CR 4例,SD 1例,PD 1例[28]。本研究結果與上述研究結果差異較大的原因很可能是樣本量較小,因此,擴大樣本量、延長隨訪時間是該治療方案的進一步研究重點。此外,卡瑞利珠單抗和阿帕替尼、托里帕利單抗和蘇魯法替尼聯合治療局晚期甲狀腺癌的研究也在進行中,期待這些研究的結果。
3.4 研究局限
本研究具有局限性。首先,本研究是一項小型單臂研究;該研究設計使筆者無法將侖伐替尼的獲益程度與其他治療方法進行比較。第二,本研究可能低估了侖伐替尼對甲狀腺這個靶器官的ORR,因為劑量的減少和治療中斷也影響藥物的療效。最后,由于隨訪時間短,本研究沒有評估生存結果。
總之,本項基于真實世界的研究結果顯示,侖伐替尼用于轉化治療局晚期甲狀腺癌的效果是可以接受的,其在安全范圍內擁有相對較高的R0/1切除率。隨著靶免時代的到來,進一步的前瞻性研究是很有必要的,以確定合適的患者群體及恰當的手術時機。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:梁妍雯進行臨床資料收集、數據分析及撰寫稿件;吳宇負責研究方案設計、研究過程管理和稿件的修改。
倫理聲明:本研究已獲得中國臨床試驗注冊倫理委員會的批準[審查文號:ChiECRCT20210247]。
在過去的幾十年中,甲狀腺癌的發病率在全世界范圍內飆升,但90%以上的患者是分化型甲狀腺癌(differentiated thyroid cancer,DTC),其預后良好,病死率相對低,所以手術切除是目前主要的治療方式,且遠處轉移的患者仍能從根治性手術結合術后同位素治療方案中獲得良好的效果。然而,當腫瘤侵犯鄰近結構時,可能會嚴重影響生活質量。據報道,在DTC患者中,原發灶累及喉、氣管、食管、喉返神經或頸總動脈的發生率為13%~15%[1-2],淋巴結轉移的發生率為15%~30%[3],這些特征是預后不良的重要危險因素,與生存率降低顯著相關[4-5];因此,對局晚期甲狀腺癌患者制定除手術外的輔助治療方案尤為重要。
新輔助治療,包括放療、化療、靶向治療和免疫治療已廣泛實施,并在幾種腫瘤的治療中取得了顯著的治療效果。目前幾種酪氨酸激酶抑制劑(tyrosine kinase inhibitor,TKI),如安羅替尼、索拉非尼、拉羅替尼正在成為DTC、甲狀腺髓樣癌(medullary thyroid cancer,MTC)和甲狀腺未分化癌(anaplastic thyroid cancer,ATC)的治療新方法,且已獲得臨床有效性并穩定疾病的發展。例如侖伐替尼可顯著延長放射性碘難治性分化型甲狀腺癌(radioiodine-refractory differentiated thyroid cancer,RR-DTC)患者的無進展生存期[6],不僅可以作為新輔助治療用于術前降期、降低手術風險以及增加器官保留率,還可以用于腫瘤學意義上的轉化治療,使無手術機會、碘抵抗及預后差的患者恢復攝碘能力、延長生存期甚至重獲手術機會。然而,我們還需要進行更大規模的研究來確定侖伐替尼的最佳治療周期、手術時間和安全性。因此,筆者進行了一項前瞻性、觀察性、基于真實世界的研究,以評估侖伐替尼的療效和安全性,并探索該方案作為轉化治療的可行性。
1 資料與方法
1.1 臨床資料
前瞻性收集福建省腫瘤醫院頭頸外科2021年9月至2023年6月期間收治的17例局晚期甲狀腺癌患者的臨床資料。本研究的納入標準:① 年齡18~75歲;② 功能狀態(performance status,PS)評分:0~1分;③ 經粗針穿刺病理學活檢證實為甲狀腺癌(包括DTC和ATC);④ 臨床分期Ⅱ~Ⅲ期、cT4a~bN0~1M0~1(美國癌癥聯合委員會分期手冊第八版);⑤ 至少有1個可測量的目標病變(最長直徑≥10 mm或淋巴結最短直徑≥15 mm),符合實體瘤療效評價(RECIST)標準1.1;⑥ 簽署書面知情同意書。排除標準:① 其他惡性腫瘤病史;② 既往接受過抗血管生成藥物;③ 活動性出血或異常凝血;④ 患有需要治療的嚴重心臟病;⑤ 懷孕或哺乳期。所有患者均由筆者所在醫院頭頸外科收入院,每例患者均簽署了知情同意書。本研究已獲得中國臨床試驗注冊倫理委員會的批準 [審查文號:ChiECRCT20210247],符合赫爾辛基宣言及藥物臨床試驗質量管理規范。
1.2 治療方案
入選的患者均口服侖伐替尼、1次/d,起始劑量為24 mg,28 d為1個周期。基于ATC患者具有腫瘤突變負荷增加、程序性死亡配體1(pro- grammed death-ligand 1,PD-L1)水平升高的特征,且ATC可能對免疫檢查點抑制劑敏感,因此入選的ATC患者另外予聯合帕博利珠單抗(每 3 周給藥200 mg)治療[7]。當出現藥物相關不良事件時,根據不良事件通用術語標準(4.0版本)調整劑量或終止治療。
1.3 數據整理
所有患者在納入研究前需具備基礎資料,例如詳細的病史、頸部超聲、頸胸部增強CT以及全套化驗結果;根據粗針活檢得出病理診斷。通過閱讀超聲及CT檢查結果以確定目標病變直徑。
1.4 研究終點指標
本研究的主要終點指標是按照RECIST 1.1標準規定的客觀緩解率(objective response rate,ORR),次要終點指標包括疾病控制率(disease control rate,DCR)、R0/1切除率和安全性。每個治療周期結束評估1次,最后一次治療周期結束的評估結果納入數據統計。
ORR定義為完全緩解(complete response,CR)和部分緩解(partial responses,PR)的患者比例。DCR定義為CR、PR或病情穩定(stable disease,SD)的患者比例,SD需要持續3周或更長時間。R0切除定義為完全切除,R1切除定義為病理檢查發現鏡下殘留。
1.5 分析數據集
本研究最終的統計是在接受了至少1個治療周期的患者群體中進行,基礎特征、療效和安全性分析是在所有接受了侖伐替尼治療的患者群體中進行。安全性分析即治療相關不良事件的發生率。
2 結果
根據納入和排除標準,17例接受侖伐替尼治療的患者被納入研究,并全部進入安全性和有效性分析。17例患者的最大腫瘤直徑為17~84 mm,中位直徑43 mm,其他臨床病理資料見表1。
侖伐替尼的中位治療時間為8周(4~32周)。5例患者達到PR,11例患者達到SD,1例患者疾病進展(progressive disease,PD)。侖伐替尼的ORR和DCR分別為29.4%(5/17)和94.1%(16/17)。治療相關不良事件的發生率為100%,用藥期間最常見的不良事件依次是高血壓(7例,41.2%)、腹瀉(6例,35.3%)、蛋白尿(5例,29.4%)和乏力(4例,23.5%),沒有發生重大治療相關不良事件。4例患者(23.5%)因腹瀉和高血壓需要中斷治療,平均中斷2周(1~4周)。所有患者均因不良事件而減少用藥劑量,盡管初始劑量為24 mg,但中位劑量為16 mg。
在接受侖伐替尼治療后,17例患者中有12例(70.6%)患者進行了手術切除,其中包括4例PR和8例SD,影像學評估及術中情況如圖1。5例患者未行手術治療,包括2例術前評估腫瘤無法切除,3例患者拒絕手術。即便未接受根治性手術,該5例患者也均在轉化治療中獲益,如1例患者從輪椅入院到可以正常行走,其生存質量明顯改善(圖2);余4例患者訴不同程度的疼痛減輕。瀑布圖(圖3a)描繪了目標病變治療前后最長直徑及其差異,中位腫瘤直徑從治療前的43 mm退縮為治療后的12 mm。完成最后1次新輔助治療和手術之間的中位間隔時間為9 d(7~12 d)。11例患者實現了R0/R1切除,1例因頸總動脈受侵而進行了R2切除。
 圖1
示根據RECIST 1.1標準療效尚未達PR,但增強CT圖像提示已獲得手術機會
圖1
示根據RECIST 1.1標準療效尚未達PR,但增強CT圖像提示已獲得手術機會
a:治療前腫瘤內部均勻強化,與動脈邊界不清;b:治療后腫瘤內部出現壞死,與動脈邊界清晰;c~e:術中所見,c圖從左向右依次為氣管、頸總動脈、頸內靜脈;d圖顯示去除頸內靜脈及迷走神經,血管夾處可見靜脈斷端,e圖顯示縫扎斷端及頭臂靜脈的部分靜脈壁
 圖2
示治療后髖骨轉移灶(黑箭)明顯退縮
圖2
示治療后髖骨轉移灶(黑箭)明顯退縮
a:治療前;b:治療后
 圖3
示17例患者目標病變治療前后最長直徑的變化,以及某ATC病例治療前后的增強CT圖像
圖3
示17例患者目標病變治療前后最長直徑的變化,以及某ATC病例治療前后的增強CT圖像
a:17例患者目標病變治療前后最長直徑的變化;b和c:增強CT圖像示“左ATC局部切除術后復發”患者,治療前腫瘤占位效應致氣管、動脈移位(b),經歷2年靶向治療聯合免疫治療后腫瘤明顯退縮,氣管、動脈復位(c)
本研究中有5例聯用帕博利珠單抗的患者,其中1例達到PR,3例達到SD,1例PD,影像學評估可見該方案具有效性(圖3b和3c)。
3 討論
3.1 局晚期甲狀腺癌的治療
局晚期甲狀腺癌,尤其是惡性程度高、復發轉移快及生存時間短的ATC,通常已失去手術機會或手術治療效果欠佳,其治療較困難[8]。轉化治療是一種腫瘤治療方案,其目的是通過非手術手段(如化療、放療、靶向治療、免疫治療等)使原本不可切除的腫瘤縮小或降期,從而轉變為可切除的狀態。換言之,針對可手術的病例,轉化治療及所謂的新輔助治療,可達到術前降期、降低手術難度及風險、增加器官保留率;對于暫無手術機會的病例,通過轉化治療重獲手術的可能性或者延長生存期同樣重要。轉化治療的成功不僅取決于腫瘤的縮小,還包括患者在治療后的長期生存和生活質量。
研究[9]表明,甲狀腺癌的發生、發展和去分化與不同受體酪氨酸激酶介導的信號通路密切相關,幾種TKI作為局晚期甲狀腺癌轉化治療的新方法,已獲得臨床有效性并穩定疾病的發展。本研究是為數不多的評估侖伐替尼對于局晚期甲狀腺癌的療效和安全性的研究之一。本研究發現侖伐替尼達到的ORR相對較低,但DCR和R0/1切除率以及類似于先前報道[6, 10-11]的治療相關不良事件的發生率均在可接受范圍內。換言之,侖伐替尼可能更適用于局晚期甲狀腺癌的轉化治療。在SELECT試驗[6]中,RR-DTC患者對侖伐替尼的有效率為64.8%。據報道,中國RR-DTC患者對侖伐替尼的ORR為69.9%[12]。一項安羅替尼新輔助治療局晚期甲狀腺癌的研究得出了76.9%的ORR[13]。這些研究結果之間的差異可能歸因于患者特征和用藥的差異。
因此,明確侖伐替尼的獲益群體是當前值得探索的方向。侖伐替尼顯著的抗腫瘤活性是由于其對成纖維細胞生長因子受體(fibroblast growth factor receptor,FGFR)的酪氨酸激酶的抑制作用。FGFR是濾泡源性甲狀腺腫瘤的一種重要的信號通路[14],但侖伐替尼的療效與腫瘤細胞的BRAF和RAS突變狀態無關,這可能是由于侖伐替尼影響的靶點范圍廣泛,或其具有靶向FGFR等特異位點的能力[6]。患者是否接受過其他的靶向治療,如索拉非尼,以及這些治療的效果如何,都是選擇侖伐替尼時需要考慮的因素。盡管侖伐替尼在一些研究中顯示出對既往接受過TKI治療的患者仍有益處,但仍需評估患者對這些治療的反應和耐受性。另一方面,侖伐替尼可能對年齡較大(如65歲以上)患者的總體生存期效果更好。患者的整體健康狀況和心血管風險因素也應在考慮范疇內。每例患者的情況都是獨特的,因此治療方案也應結合患者的特定需求個體化制定[15]。
3.2 侖伐替尼的療效
本研究中ORR較低的潛在原因可能與患者的入組標準有關。SELECT試驗中的所有患者均診斷為RR-DTC,約305例(89.3%)患有肺轉移[8]。研究[6, 16]發現,新輔助治療對沒有轉移的患者更有效,這種差異可能歸因于沒有轉移的腫瘤侵襲性較低。本研究隊列中有4例(23.5%)患者曾接受過手術治療,7例(41.2%)患者有肺轉移,這似乎也可以解釋目前ORR較低的原因。另一個潛在原因可能是侖伐替尼的劑量差異。一項針對RR-DTC患者的研究[17]結果表明,18 mg/d和24 mg/d起始劑量侖伐替尼的效果是有所差異的(ORR:18 mg組比24 mg組,40.3%比57.3%)。如前所述,本研究中所有的患者均需減少劑量,盡管初始劑量為24 mg,但中位劑量為每天16 mg,且有4例患者中斷了治療。因此,大多數患者接受的侖伐替尼的劑量不足。在另一項評估侖伐替尼臨床療效和安全性的研究[18]中,晚期未分化甲狀腺癌患者每天接受中位12 mg的侖伐替尼維持劑量,得出的ORR和DCR與本研究接近,分別為29%和93%。此外,據報道[19],在某些情況下,即使是10 mg/d的侖伐替尼也能使腫瘤消退。相比之下,24 mg的初始劑量對一些患者來說似乎太高了,尤其是亞洲患者[18, 20]。至少在一些患者中,劑量的減少或中斷似乎與療效呈負相關[5, 21]。因此,侖伐替尼對于不同治療方案的最佳劑量需要進一步研究,例如其作為新輔助治療時,建議從高劑量起始、根據不良反應再做下調;以轉化治療為目的時,療效和不良反應的平衡才是關鍵,所以建議低劑量起始,酌情上調。
不同病理類型的甲狀腺癌對新輔助治療的反應也不同。Takahashi等[11]進行了一項研究侖伐替尼對局晚期甲狀腺癌患者療效的Ⅱ期臨床試驗,發現RR-DTC患者(68%)的緩解率高于MTC(22%)或晚期ATC患者(24%)。Taylor等[22]報道了侖伐替尼治療RR-DTC患者的PS評分和中性粒細胞-淋巴細胞比率(neutrophil-lymphocyte ratio,NLR)與療效之間的相關性,他們發現,PS評分為0且NLR≤3的患者比PS評分≥1且NLR>3的患者有更高的無進展生存率和ORR。
通過根治性切除實現R0是新輔助治療的最重要目標。多項研究[23-25]表明,與R2切除相比,R0/1切除明顯提高了生存率。Brauckhoff等[23]評估了174例接受透壁性切除手術(82例)、非透壁性切除手術(65例)或姑息性手術(27例)的患者,平均隨訪35.3個月,顯微鏡下不完全切除的10例(46%)患者和顯微鏡下完全切除的18例(15%)患者發生局部復發(P=0.001),這闡明了R0切除的臨床意義。此外,另一項研究報道[26]稱與R0切除的患者相比,R1切除的侵襲性甲狀腺癌患者的局部控制率較低。因此,新輔助治療后手術時機的把握至關重要[27-28]。例如,當重要的解剖結構界限清晰時,正是R0/1切除的最佳時間(圖1~2);另外,病灶出現明顯液化壞死、RECIST 1.1標準評價連續2個周期為SD、出現可能影響手術的不良反應且難以控制時,均可視為新輔助治療的結點,但需要注意停藥后到手術時的間隔時間,停藥期間的快速反彈必須重視。
目前,根據RECIST規定,腫瘤大小的退縮是判斷治療有效率的最重要因素[7, 29]。但筆者發現,腫瘤大小并不反映轉化治療的真實療效,患者的生存質量也可以成為重要的參考因素。例如1例曾接受轉化治療的患者,入組臨床研究3個月,因頸部淋巴結進展出組,但髖骨轉移灶明顯修復,患者從輪椅入院到可以正常行走,其生存質量明顯改善(圖3)。另外,原發灶和淋巴結本身對抗血管生成類靶向藥物的響應程度就是不同的,原發灶由于血供豐富,響應率更高,淋巴結一旦較大,往往多伴有液化壞死,因此縮瘤率不如原發灶。綜上,更適合評估局晚期甲狀腺癌患者新輔助治療的評價體系尚待開發。
3.3 侖伐替尼的安全性
本研究隊列的不良事件與先前發表的研究結果類似[6, 23-24],表明侖伐替尼的安全性是可接受的。高血壓和腹瀉是最常見的治療相關不良事件。筆者發現不良事件的緩解與劑量減少甚至治療中斷密切相關。一項研究[30]發現,RR-DTC患者在治療期間高血壓的發展與預后的改善有關,這表明高血壓是侖伐替尼療效的潛在預測因素,有必要在治療期間和圍手術期嚴格控制血壓。另一方面,作為血管內皮生長因子抑制劑,侖伐替尼對傷口愈合的影響鮮有報道,可能是因為迄今為止的研究太少,需要更大規模的研究來準確識別與治療相關的不良事件。
雖然單藥治療已被證實有一定的效果,但靶向治療聯合免疫治療的效果更好。研究表明,侖伐替尼和帕博利珠單抗聯合治療未分化及低分化甲狀腺癌是一種有效的治療選擇[7, 31-32],6例晚期ATC患者中CR 4例,SD 1例,PD 1例[28]。本研究結果與上述研究結果差異較大的原因很可能是樣本量較小,因此,擴大樣本量、延長隨訪時間是該治療方案的進一步研究重點。此外,卡瑞利珠單抗和阿帕替尼、托里帕利單抗和蘇魯法替尼聯合治療局晚期甲狀腺癌的研究也在進行中,期待這些研究的結果。
3.4 研究局限
本研究具有局限性。首先,本研究是一項小型單臂研究;該研究設計使筆者無法將侖伐替尼的獲益程度與其他治療方法進行比較。第二,本研究可能低估了侖伐替尼對甲狀腺這個靶器官的ORR,因為劑量的減少和治療中斷也影響藥物的療效。最后,由于隨訪時間短,本研究沒有評估生存結果。
總之,本項基于真實世界的研究結果顯示,侖伐替尼用于轉化治療局晚期甲狀腺癌的效果是可以接受的,其在安全范圍內擁有相對較高的R0/1切除率。隨著靶免時代的到來,進一步的前瞻性研究是很有必要的,以確定合適的患者群體及恰當的手術時機。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:梁妍雯進行臨床資料收集、數據分析及撰寫稿件;吳宇負責研究方案設計、研究過程管理和稿件的修改。
倫理聲明:本研究已獲得中國臨床試驗注冊倫理委員會的批準[審查文號:ChiECRCT20210247]。