版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
近年來,全球肝癌發病率逐年升高,預計2020–2040年每年新發肝癌病例將增長55.0%,至2040年全球將有140萬人確診肝癌[1-2]。2022年全球肝癌新發病例順位第6位,而中國則順位第4位;全球肝癌死亡順位第3位,而中國則順位第2位[3-4],對全球人類的生命和健康構成了嚴重威脅[5]。肝細胞癌(hepatocellular carcinoma,HCC)是原發性肝癌最常見類型,對于早期HCC患者,根治性手術切除或肝移植是獲得長期生存的重要手段[6-7]。但由于受肝功能、基礎疾病、腫瘤大小、腫瘤位置等影響,即使早期HCC仍有43%的患者無法手術切除或移植[8],只能接受局部治療,如射頻消融(radiofrequency ablation,RFA)、微波消融、經肝動脈化療栓塞或外部放射治療(external beam radiation,XRT),如立體定向放射治療[6, 9-12]。目前缺乏對RFA與XRT遠期預后的比較研究,這兩種治療方法的優劣存在爭議[13-14]。因此,本研究采用SEER數據庫中的數據比較分析了RFA和XRT治療HCC患者的遠期治療效果,為臨床決策提供參考。
1 資料與方法
1.1 研究資料
本研究回顧性收集2010–2015年期間美國國家癌癥研究所的“Surveillance,Epidemiology,and End Results(SEER)”數據庫中行XRT或RFA治療的HCC患者的臨床資料(ttps://seer.cancer.gov/)。納入標準:① 經穿刺活檢病理結果證實為HCC;② 美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)第7版分期[7]Ⅰ或Ⅱ期患者;③ 無轉移癌證據;④ 主要治療方案為RFA或XRT;⑤ 基于ICD-O-3 組織學編碼8170/3-8175/3結合肝臟部位編碼C22.0.20篩選患者。排除標準:① 確診并接受治療后3個月內死亡患者;② 治療情況及隨訪信息不完整(比如種族、婚姻、分期和腫瘤大小未知的患者)。數據篩選流程及結果見圖1。簽署數據使用協議后,采用美國國家癌癥研究所的SEER*Stat 8.4.3軟件進行數據提取。更多詳細信息在https://seer.cancer.gov/中獲取。本研究符合赫爾辛基宣言。
 圖1
示數據篩選流程圖
圖1
示數據篩選流程圖
1.2 研究方法
① 提取人口學資料(年齡、性別、種族及婚姻狀態),肝硬化、甲胎蛋白(alpha-fetoprotein,AFP)水平、腫瘤直徑、AJCC分期及主要治療方案和輔助治療相關數據(比如是否化療)。② 依據患者所接受的治療方案將患者分為RFA組和XRT組。治療方案的定義:未行手術或消融的患者而接受XRT在數據庫中被歸類為“beam radiation”,接受RFA治療的患者在變量表“surgery of the main site”中的編碼為16。③ 按年齡、性別、種族、AFP、肝硬化和腫瘤直徑進行1∶4傾向評分匹配(propensity score matching,PSM),以平衡基線水平,降低混雜偏倚。④ 繪制Kaplan-Meier(K-M)生存曲線比較RFA組和XRT組患者的總生存情況;同時采用Cox比例風險回歸模型分析影響總生存期的風險因素。⑤ 將各自變量分為不同水平的亞組進行交互檢驗,分析RFA和XRT的干預效果在不同水平的亞組間結論的一致性。
1.3 隨訪信息
包括患者的生存狀態及總生存時間。總生存時間定義為第1次治療(RFA或XRT)開始后至因任何原因死亡或隨訪結束的時間。
1.4 統計學方法
使用R 4.3.2和RStudio 2023.12.0軟件進行統計學分析。計數資料以頻數及百分率(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。符合正態分布的計量資料采用均數±標準差(x±s)描述且2組間比較采用獨立樣本比較的Student t檢驗,不符合正態分布者采用中位數(median,M)和上下四分位數(P25,P75)描述且采用Mann-Whitney U檢驗。采用K-M方法繪制生存曲線進行生存分析并采用log-rank檢驗。將Cox比例風險回歸模型單因素分析中P<0.05和臨床認為有意義或其他研究中認為有意義的變量納入多因素Cox比例風險回歸模型分析,以確定影響總生存期的風險因素。雙尾檢驗,檢驗水準α=0.05。
2 結果
2.1 人口學特征
本研究共收集到2 861例HCC患者,其中RFA組2 513例,XRT組348例;經PSM后共納入了1 582例患者,其中XRT組343例,RFA組1 239例,PSM后仍發現XRT組中腫瘤直徑更大(>5 cm)者占比仍高于RFA組(P<0.001),2組在其他臨床病理特征方面比較差異未見有統計學意義(P>0.05),見表1。
2.2 生存情況
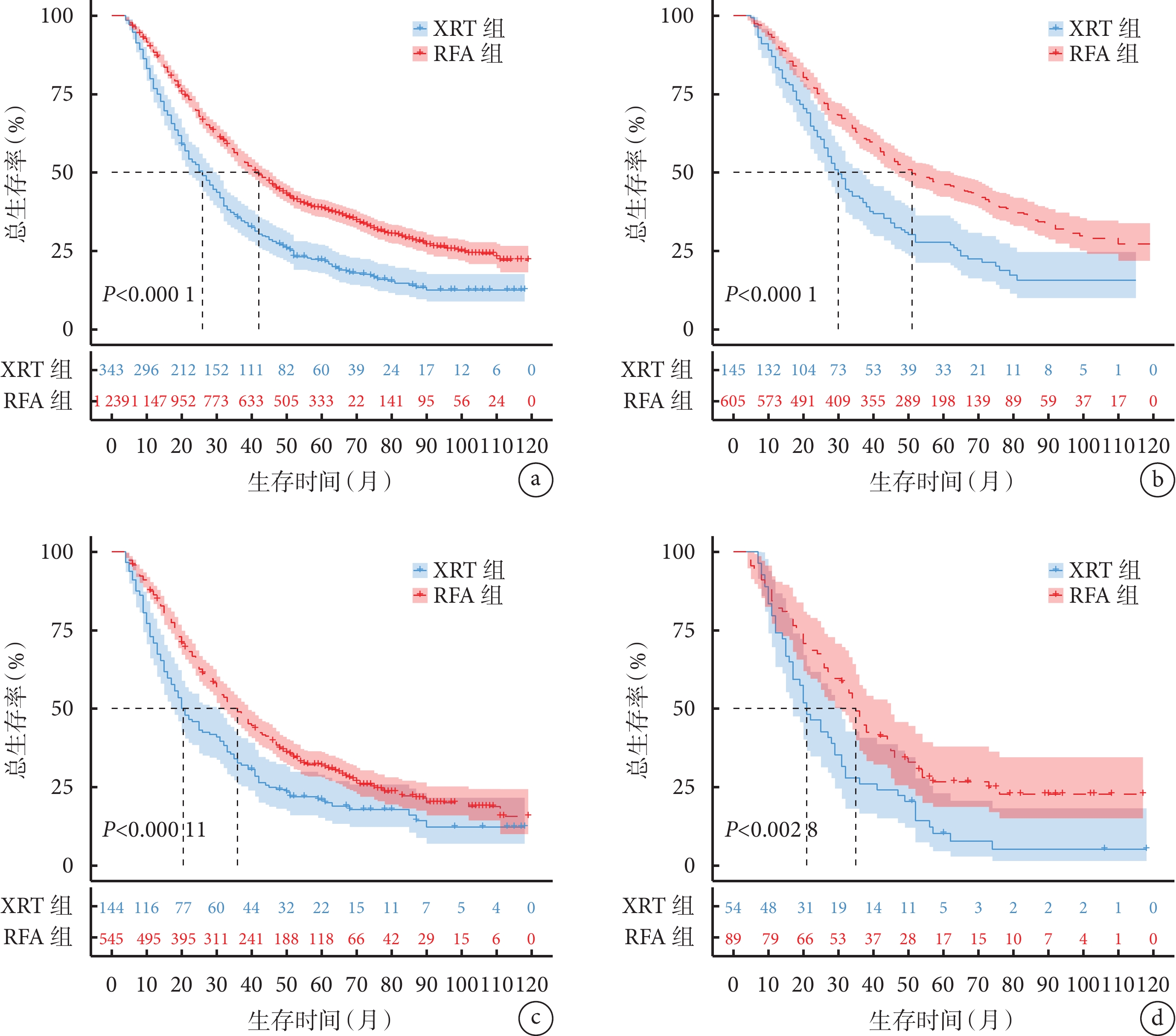
全部HCC患者中RFA組和XRT組的K-M生存曲線見圖2a,RFA組的生存情況優于XRT組(HR=1.65,P<0.001)。按腫瘤直徑進行分層分析,在腫瘤直徑<3 cm、3~5 cm、 >5 cm的HCC患者中RFA組和XRT組的K-M生存曲線見圖2b~2d,均發現RFA組的生存情況優于XRT組(<3 cm:HR=1.79、P<0.001;3~5 cm:HR=1.50、P<0.001;>5 cm:HR=1.67、P=0.003)。全部HCC患者和按腫瘤直徑分層的HCC患者的中位總生存時間及3年和5年累積總生存率結果見表2。
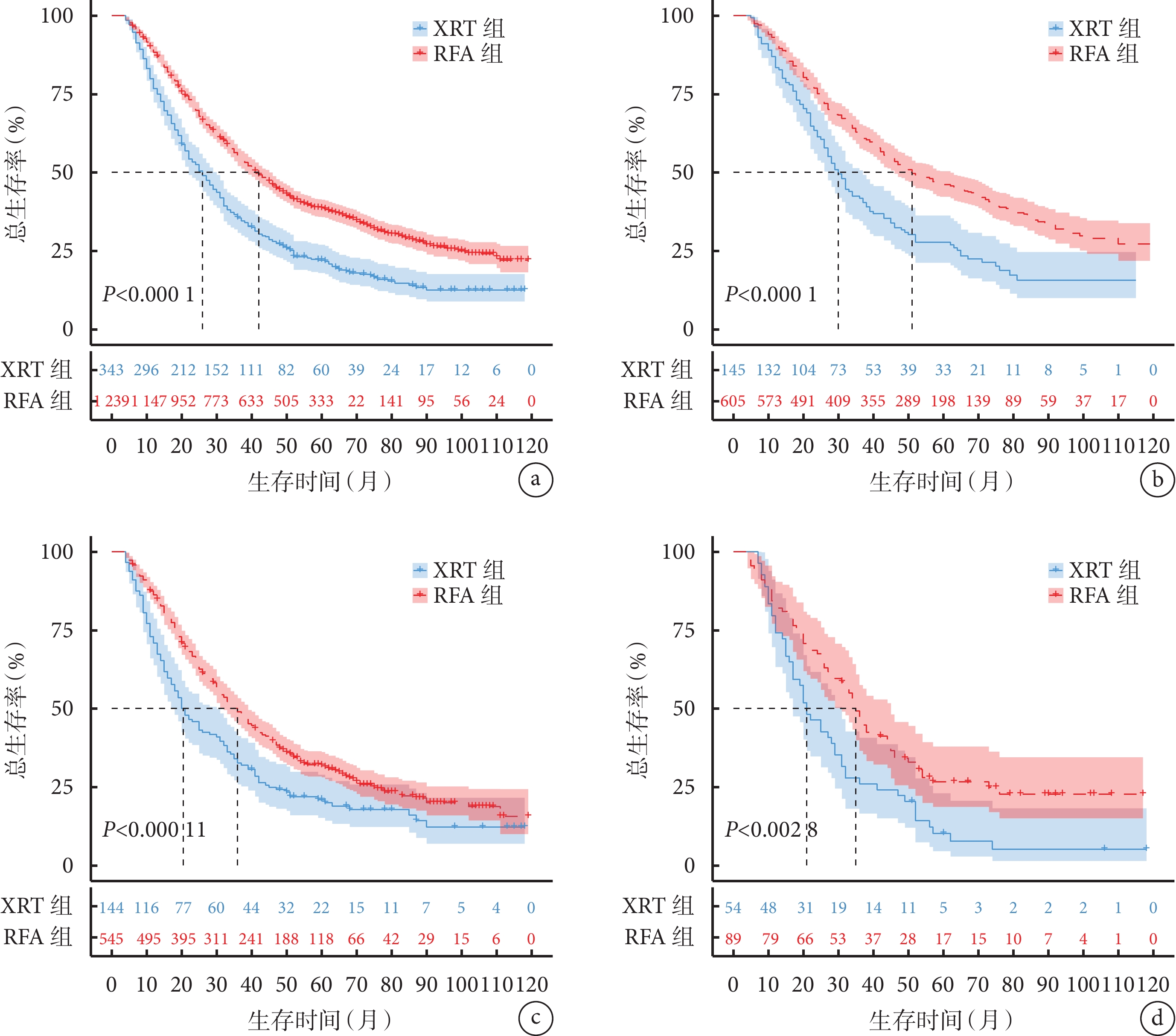 圖1
全部HCC患者(a)和腫瘤直徑<3 cm(b)、3~5 cm(c)、>5 cm(d)分層的HCC患者中RFA組和XRT組的K-M生存曲線
圖1
全部HCC患者(a)和腫瘤直徑<3 cm(b)、3~5 cm(c)、>5 cm(d)分層的HCC患者中RFA組和XRT組的K-M生存曲線
2.3 影響HCC患者總生存期的風險因素
PSM后的HCC患者總生存期的單因素分析結果見表3。從表3可見,患者的年齡、種族、術前AFP水平、腫瘤直徑、AJCC分期及治療方案與HCC患者總生存期有關(P<0.05);將單因素分析有統計學意義的因素和專業上認為有影響的因素(性別、種族、化療和肝硬化)同時納入多因素Cox比例風險回歸模型分析的結果顯示,HCC患者的年齡大(≥65歲)、AFP水平高(≥400 μg/L)、腫瘤直徑大(≥3 cm)、AJCC分期晚(Ⅱ期)是影響其總生存期的風險因素(HR>1,P<0.05),采用XRT治療是HCC患者總生存期縮短的風險因素(HR=1.61,P<0.001)。
以隨訪期內因任何原因死亡為結局事件進行亞組分析并交互檢驗后發現,各亞組間交互的P>0.05, 可以認為兩種治療方案(RFA與XRT)的效果在不同亞組之間的差異無統計學意義,即治療效果與亞組因素之間無交互作用,見圖3。
 圖3
示全部HCC患者中各變量分層后的亞組分析及森林圖
圖3
示全部HCC患者中各變量分層后的亞組分析及森林圖
3 討論
RFA和XRT是不可切除的HCC患者的兩種常見治療方法,目前在隨機對照試驗尚未發表的情況下,消融治療被認為是除手術切除之外治療小肝癌的最優選擇之一[15-16]。RFA是一種熱消融技術,通過將針形電極插入腫瘤組織內部導入高頻電流并形成局部電場,使組織內離子產生快速振動而使局部組織中蛋白質熱變性,最終導致腫瘤組織和細胞以及周邊血管凝固[17]。Maeda等[18]報道,對于HCC患者采用RFA治療的死亡率僅為0.064%,嚴重并發癥率為2.92%,它是一種安全且微創的治療方式,具有操作方便、住院時間短、療效確切和消融范圍可控性好等優點,特別適用于高齡、合并其他疾病、嚴重肝硬化、腫瘤位于肝臟深部或中央型HCC患者。另有研究[16, 19]顯示,RFA治療直徑<5 cm的HCC的5年存活率為60%~62%,對單個直徑≤2 cm HCC的療效與手術切除類似,特別是中央型HCC。
傳統體外放療由于不能精確遞送足夠的放射劑量,有導致嚴重肝損傷的風險,限制了其臨床應用。隨著新型放射治療技術的進步,包括三維適形放射治療、調強放射治療、立體定向放射治療等,可以進行精準定位,高選擇性地對腫瘤部位進行高劑量照射,減少周圍血管和膽管損傷,可以彌補幾種特定情況下RFA不完全消融率高的缺陷[20-21]。有關放射治療的研究[22-23]中報道了立體定向放射治療的生存率與RFA的相當,但立體定向放射治療的局部控制率更好,特別是對于>2 cm的腫瘤。甚至在一項回顧性研究[24]中報道,接受立體定向放射治療患者的局部控制率達到100%。推測其原因可能是由于納入了放療聯合化療的患者,從而高估了XRT的療效。但在Wahl等[22]的研究中也報道,對于直徑<2 cm的HCC,RFA組相較于XRT組有更好的疾病控制率和總體生存率。雖然這些研究都是小樣本量的單中心研究存在各種偏倚,但在隨機對照試驗的結果發表之前,通過觀察性研究探索各種可能的結果來填補空白,為隨機對照試驗的開展提供了一些研究基礎。
然而在本研究中HCC的直徑無論是>3 cm還是<3 cm,RFA組的總生存率均優于XRT組,此外多因素Cox回歸分析提示,AFP升高與更高的死亡風險相關,可能的機制為高水平的AFP可能與HCC的腫瘤微環境調節有關,包括炎癥、氧化應激及細胞信號傳導通路的激活,這些都可能促進腫瘤的發生和進展[25]。同樣腫瘤分期晚、腫瘤直徑大也與更高的死亡風險相關,因為這部分患者的腫瘤負荷相對較大,治療效果不佳導致預后較差[26]。亞組分析結果與主要結果一致,證明我們的研究結果是穩健的。本研究與Rajyaguru等[27]對美國國家癌癥數據庫中的3 980例患者的研究結果一致,因此有理由認為,XRT對大肝癌的局部控制率高但并不一定轉化為更高的生存率,未來的研究更應關注生存相關的終點。
SEER數據庫具有一定的局限性:數據不包括 Child-Pugh評分、XRT的亞型、血管浸潤和腫瘤位置,但這些未統計的混雜因素可能會影響患者的總生存情況;無腫瘤進展的數據,因此無法評估無進展生存期。盡管本研究受數據庫和回顧性研究設計中固有偏倚的影響,但仍具有以下優勢:SEER為多中心大數據庫,可以全面評估全國的HCC患者,降低了選擇偏倚,使結果更具有代表性;SEER 具有嚴格的數據質量控制系統,可以保證相關病例識別的準確性。本研究使用PSM控制了一些可能影響治療方案分配的變量,降低了分配偏倚,使用亞組分析及交互檢驗來驗證結果的一致性,因此認為對于未接受手術切除的AJCC Ⅰ期或Ⅱ期的HCC患者,RFA治療后的遠期療效優于XRT治療。但需要注意的是,對于鄰近肝門、膽管和腹腔內重要器官的腫瘤,RFA治療時容易損傷上述器官,或對于鄰近大血管的腫瘤,RFA的療效可能會降低。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:楊俊負責研究的設計與構思,并撰寫了初稿;李璐陽、李浩銘和夏添參與了數據收集與分析,提供了重要的見解;王成、張書涵和蒲猛負責文獻回顧,并對草稿進行了關鍵性的編輯和修改;馬英博協助進行數據的解釋,確保了研究的準確性;劉承利審核了最終稿,并提供了重要的理論支持和建議。
近年來,全球肝癌發病率逐年升高,預計2020–2040年每年新發肝癌病例將增長55.0%,至2040年全球將有140萬人確診肝癌[1-2]。2022年全球肝癌新發病例順位第6位,而中國則順位第4位;全球肝癌死亡順位第3位,而中國則順位第2位[3-4],對全球人類的生命和健康構成了嚴重威脅[5]。肝細胞癌(hepatocellular carcinoma,HCC)是原發性肝癌最常見類型,對于早期HCC患者,根治性手術切除或肝移植是獲得長期生存的重要手段[6-7]。但由于受肝功能、基礎疾病、腫瘤大小、腫瘤位置等影響,即使早期HCC仍有43%的患者無法手術切除或移植[8],只能接受局部治療,如射頻消融(radiofrequency ablation,RFA)、微波消融、經肝動脈化療栓塞或外部放射治療(external beam radiation,XRT),如立體定向放射治療[6, 9-12]。目前缺乏對RFA與XRT遠期預后的比較研究,這兩種治療方法的優劣存在爭議[13-14]。因此,本研究采用SEER數據庫中的數據比較分析了RFA和XRT治療HCC患者的遠期治療效果,為臨床決策提供參考。
1 資料與方法
1.1 研究資料
本研究回顧性收集2010–2015年期間美國國家癌癥研究所的“Surveillance,Epidemiology,and End Results(SEER)”數據庫中行XRT或RFA治療的HCC患者的臨床資料(ttps://seer.cancer.gov/)。納入標準:① 經穿刺活檢病理結果證實為HCC;② 美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)第7版分期[7]Ⅰ或Ⅱ期患者;③ 無轉移癌證據;④ 主要治療方案為RFA或XRT;⑤ 基于ICD-O-3 組織學編碼8170/3-8175/3結合肝臟部位編碼C22.0.20篩選患者。排除標準:① 確診并接受治療后3個月內死亡患者;② 治療情況及隨訪信息不完整(比如種族、婚姻、分期和腫瘤大小未知的患者)。數據篩選流程及結果見圖1。簽署數據使用協議后,采用美國國家癌癥研究所的SEER*Stat 8.4.3軟件進行數據提取。更多詳細信息在https://seer.cancer.gov/中獲取。本研究符合赫爾辛基宣言。
 圖1
示數據篩選流程圖
圖1
示數據篩選流程圖
1.2 研究方法
① 提取人口學資料(年齡、性別、種族及婚姻狀態),肝硬化、甲胎蛋白(alpha-fetoprotein,AFP)水平、腫瘤直徑、AJCC分期及主要治療方案和輔助治療相關數據(比如是否化療)。② 依據患者所接受的治療方案將患者分為RFA組和XRT組。治療方案的定義:未行手術或消融的患者而接受XRT在數據庫中被歸類為“beam radiation”,接受RFA治療的患者在變量表“surgery of the main site”中的編碼為16。③ 按年齡、性別、種族、AFP、肝硬化和腫瘤直徑進行1∶4傾向評分匹配(propensity score matching,PSM),以平衡基線水平,降低混雜偏倚。④ 繪制Kaplan-Meier(K-M)生存曲線比較RFA組和XRT組患者的總生存情況;同時采用Cox比例風險回歸模型分析影響總生存期的風險因素。⑤ 將各自變量分為不同水平的亞組進行交互檢驗,分析RFA和XRT的干預效果在不同水平的亞組間結論的一致性。
1.3 隨訪信息
包括患者的生存狀態及總生存時間。總生存時間定義為第1次治療(RFA或XRT)開始后至因任何原因死亡或隨訪結束的時間。
1.4 統計學方法
使用R 4.3.2和RStudio 2023.12.0軟件進行統計學分析。計數資料以頻數及百分率(%)描述,組間比較采用χ2檢驗或Fisher確切概率法。符合正態分布的計量資料采用均數±標準差(x±s)描述且2組間比較采用獨立樣本比較的Student t檢驗,不符合正態分布者采用中位數(median,M)和上下四分位數(P25,P75)描述且采用Mann-Whitney U檢驗。采用K-M方法繪制生存曲線進行生存分析并采用log-rank檢驗。將Cox比例風險回歸模型單因素分析中P<0.05和臨床認為有意義或其他研究中認為有意義的變量納入多因素Cox比例風險回歸模型分析,以確定影響總生存期的風險因素。雙尾檢驗,檢驗水準α=0.05。
2 結果
2.1 人口學特征
本研究共收集到2 861例HCC患者,其中RFA組2 513例,XRT組348例;經PSM后共納入了1 582例患者,其中XRT組343例,RFA組1 239例,PSM后仍發現XRT組中腫瘤直徑更大(>5 cm)者占比仍高于RFA組(P<0.001),2組在其他臨床病理特征方面比較差異未見有統計學意義(P>0.05),見表1。
2.2 生存情況
全部HCC患者中RFA組和XRT組的K-M生存曲線見圖2a,RFA組的生存情況優于XRT組(HR=1.65,P<0.001)。按腫瘤直徑進行分層分析,在腫瘤直徑<3 cm、3~5 cm、 >5 cm的HCC患者中RFA組和XRT組的K-M生存曲線見圖2b~2d,均發現RFA組的生存情況優于XRT組(<3 cm:HR=1.79、P<0.001;3~5 cm:HR=1.50、P<0.001;>5 cm:HR=1.67、P=0.003)。全部HCC患者和按腫瘤直徑分層的HCC患者的中位總生存時間及3年和5年累積總生存率結果見表2。
 圖1
全部HCC患者(a)和腫瘤直徑<3 cm(b)、3~5 cm(c)、>5 cm(d)分層的HCC患者中RFA組和XRT組的K-M生存曲線
圖1
全部HCC患者(a)和腫瘤直徑<3 cm(b)、3~5 cm(c)、>5 cm(d)分層的HCC患者中RFA組和XRT組的K-M生存曲線
2.3 影響HCC患者總生存期的風險因素
PSM后的HCC患者總生存期的單因素分析結果見表3。從表3可見,患者的年齡、種族、術前AFP水平、腫瘤直徑、AJCC分期及治療方案與HCC患者總生存期有關(P<0.05);將單因素分析有統計學意義的因素和專業上認為有影響的因素(性別、種族、化療和肝硬化)同時納入多因素Cox比例風險回歸模型分析的結果顯示,HCC患者的年齡大(≥65歲)、AFP水平高(≥400 μg/L)、腫瘤直徑大(≥3 cm)、AJCC分期晚(Ⅱ期)是影響其總生存期的風險因素(HR>1,P<0.05),采用XRT治療是HCC患者總生存期縮短的風險因素(HR=1.61,P<0.001)。
以隨訪期內因任何原因死亡為結局事件進行亞組分析并交互檢驗后發現,各亞組間交互的P>0.05, 可以認為兩種治療方案(RFA與XRT)的效果在不同亞組之間的差異無統計學意義,即治療效果與亞組因素之間無交互作用,見圖3。
 圖3
示全部HCC患者中各變量分層后的亞組分析及森林圖
圖3
示全部HCC患者中各變量分層后的亞組分析及森林圖
3 討論
RFA和XRT是不可切除的HCC患者的兩種常見治療方法,目前在隨機對照試驗尚未發表的情況下,消融治療被認為是除手術切除之外治療小肝癌的最優選擇之一[15-16]。RFA是一種熱消融技術,通過將針形電極插入腫瘤組織內部導入高頻電流并形成局部電場,使組織內離子產生快速振動而使局部組織中蛋白質熱變性,最終導致腫瘤組織和細胞以及周邊血管凝固[17]。Maeda等[18]報道,對于HCC患者采用RFA治療的死亡率僅為0.064%,嚴重并發癥率為2.92%,它是一種安全且微創的治療方式,具有操作方便、住院時間短、療效確切和消融范圍可控性好等優點,特別適用于高齡、合并其他疾病、嚴重肝硬化、腫瘤位于肝臟深部或中央型HCC患者。另有研究[16, 19]顯示,RFA治療直徑<5 cm的HCC的5年存活率為60%~62%,對單個直徑≤2 cm HCC的療效與手術切除類似,特別是中央型HCC。
傳統體外放療由于不能精確遞送足夠的放射劑量,有導致嚴重肝損傷的風險,限制了其臨床應用。隨著新型放射治療技術的進步,包括三維適形放射治療、調強放射治療、立體定向放射治療等,可以進行精準定位,高選擇性地對腫瘤部位進行高劑量照射,減少周圍血管和膽管損傷,可以彌補幾種特定情況下RFA不完全消融率高的缺陷[20-21]。有關放射治療的研究[22-23]中報道了立體定向放射治療的生存率與RFA的相當,但立體定向放射治療的局部控制率更好,特別是對于>2 cm的腫瘤。甚至在一項回顧性研究[24]中報道,接受立體定向放射治療患者的局部控制率達到100%。推測其原因可能是由于納入了放療聯合化療的患者,從而高估了XRT的療效。但在Wahl等[22]的研究中也報道,對于直徑<2 cm的HCC,RFA組相較于XRT組有更好的疾病控制率和總體生存率。雖然這些研究都是小樣本量的單中心研究存在各種偏倚,但在隨機對照試驗的結果發表之前,通過觀察性研究探索各種可能的結果來填補空白,為隨機對照試驗的開展提供了一些研究基礎。
然而在本研究中HCC的直徑無論是>3 cm還是<3 cm,RFA組的總生存率均優于XRT組,此外多因素Cox回歸分析提示,AFP升高與更高的死亡風險相關,可能的機制為高水平的AFP可能與HCC的腫瘤微環境調節有關,包括炎癥、氧化應激及細胞信號傳導通路的激活,這些都可能促進腫瘤的發生和進展[25]。同樣腫瘤分期晚、腫瘤直徑大也與更高的死亡風險相關,因為這部分患者的腫瘤負荷相對較大,治療效果不佳導致預后較差[26]。亞組分析結果與主要結果一致,證明我們的研究結果是穩健的。本研究與Rajyaguru等[27]對美國國家癌癥數據庫中的3 980例患者的研究結果一致,因此有理由認為,XRT對大肝癌的局部控制率高但并不一定轉化為更高的生存率,未來的研究更應關注生存相關的終點。
SEER數據庫具有一定的局限性:數據不包括 Child-Pugh評分、XRT的亞型、血管浸潤和腫瘤位置,但這些未統計的混雜因素可能會影響患者的總生存情況;無腫瘤進展的數據,因此無法評估無進展生存期。盡管本研究受數據庫和回顧性研究設計中固有偏倚的影響,但仍具有以下優勢:SEER為多中心大數據庫,可以全面評估全國的HCC患者,降低了選擇偏倚,使結果更具有代表性;SEER 具有嚴格的數據質量控制系統,可以保證相關病例識別的準確性。本研究使用PSM控制了一些可能影響治療方案分配的變量,降低了分配偏倚,使用亞組分析及交互檢驗來驗證結果的一致性,因此認為對于未接受手術切除的AJCC Ⅰ期或Ⅱ期的HCC患者,RFA治療后的遠期療效優于XRT治療。但需要注意的是,對于鄰近肝門、膽管和腹腔內重要器官的腫瘤,RFA治療時容易損傷上述器官,或對于鄰近大血管的腫瘤,RFA的療效可能會降低。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:楊俊負責研究的設計與構思,并撰寫了初稿;李璐陽、李浩銘和夏添參與了數據收集與分析,提供了重要的見解;王成、張書涵和蒲猛負責文獻回顧,并對草稿進行了關鍵性的編輯和修改;馬英博協助進行數據的解釋,確保了研究的準確性;劉承利審核了最終稿,并提供了重要的理論支持和建議。