版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
2020年全球新發肝癌(下文均指“原發性肝癌”)90.57萬例(順位第6位)、死亡83.02萬例(順位第4位),而我國新發肝癌36.77萬例(順位第4位)、死亡31.65萬例(順位第2位)[1-4]。肝細胞癌(hepatocellular carcinoma,HCC)占所有肝癌的75%~85%,其治療方式主要還是手術治療,但對于不可切除或可切除而因其他原因不接受手術切除HCC采用經動脈化療栓塞(transcatheter arterial chemoembolization,TACE)是最常采用的局部治療方法,但仍有部分患者預后較差[5-6]。因此,亟需篩選出對TACE治療效果較好的患者意義重大。最近有研究者[7-8]報道,熱休克蛋白(heat shock protein,HSP)、營養狀況和炎癥反應在肝癌發生及發展過程中發揮著重要作用。HSP成員中的HSP90α是一種分子伴侶,能通過影響多條信號通路參與惡性腫瘤過程[9]。比如,有研究者[10]報道,血清HSP90α水平升高有助于原發性肝癌早期診斷。此外,評價營養狀況和炎癥反應的指標即預后營養指數(prognostic nutritional index,PNI)[11]與晚期肝癌患者病情程度和預后相關[12]。因此,若將患者血清中HSP90α水平與PNI聯合,它對HCC患者TACE術后預后是否具有預測價值值得探討,本研究對此進行了研究,現報道如下。
1 資料與方法
1.1 臨床資料
選取2022年1月至2023年6月期間在貴港市人民醫院行TACE治療的HCC患者作為研究組。納入標準:① 年齡≥18歲;② 經活檢病理確診為HCC[13],且處于不可切除階段[包括中國肝癌分期(China liver cancer staging,CNLC) Ⅱb~Ⅲb期或可手術但因其他原因(如嚴重肝硬化、高齡等)不能或不愿接受手術的CNLC Ⅰ~Ⅱa期][14];③ 美國東部腫瘤協助組(Eastern Cooperative Oncology Group,ECOG)功能狀態評分0~2分、Child-Pugh分級A~B級HCC。排除標準:① 肝移植者;② 伴自身免疫性疾病;③ 預期生存期<3個月、多臟器功能衰竭或惡液質、≥Ⅱ級的碘對比劑過敏、嚴重肝腎功能障礙等;④ 伴血液系統疾病;⑤ 妊娠及哺乳期婦女;⑥ 門靜脈主干完全栓塞;⑦ 依從性差、不能接受隨訪。根據統計學效能分析原則,選擇與研究組患者數量接近的100名體檢健康者作為對照組。本研究經貴港市人民醫院倫理委員會批準(批文編號:GYLLPJ-
1.2 方法
1.2.1 血液學指標檢測
采集HCC患者TACE術前1 d和體檢健康者體檢時3 mL空腹外周靜脈血,部分血液標本1 500×g離心15 min留存血清。采用酶聯免疫吸附法檢測HSP90α(廣州威佳科技有限公司,貨號CSB-E13462h)、白蛋白(上海瓦蘭生物科技有限公司,貨號A7243)及甲胎蛋白(杭州聯科生物技術股份有限公司,貨號EK1175)水平。剩余血液標本抗凝后采用全自動五分類血液分析儀(邁瑞醫療,型號BC-760CS)檢測淋巴細胞計數。計算PNI值,其公式為“PNI=白蛋白(g/L)+5×淋巴細胞計數(×109/L)”。
1.2.2 TACE術
HCC患者入院后,由具備3年以上相關臨床經驗的主治醫師參考《中國肝細胞癌經動脈化療栓塞治療(TACE)臨床實踐指南》[14]進行TACE治療:指導患者仰臥位,對穿刺部位消毒、鋪巾、局部浸潤麻醉后,Seldinger法穿刺橈動脈或股動脈置入管鞘,行肝總動脈或腹腔動脈造影(荷蘭飛利浦X線數字減影血管造影機,型號Azurion 7M20),了解病灶形態、大小、數目、血供等情況后,導管超選進入病灶供血動脈,注入化療藥物碘化油乳劑[注射用順鉑20 mg(齊魯制藥有限公司,國藥準字H20023461)+注射用鹽酸吡柔比星20 mg(深圳萬樂藥業有限公司,國藥準字H10930105)+碘化油注射液20 mL(煙臺魯銀藥業有限公司,國藥準字H37022398)],然后注入適量的顆粒栓塞劑(明膠海綿懸浮液或微球)進行化療和栓塞。栓塞結束后5 min再次造影驗證,若血管造影顯示仍存在腫瘤染色即腫瘤富血供則再次行TACE操作,待血管造影顯示染色消失后結束手術。
1.3 資料收集及觀察指標
收集HCC患者臨床資料,包括性別、年齡、肝癌家族史、乙肝或丙肝炎病毒感染、Child-Pugh分級、飲酒史、吸煙史、CNLC分期、ECOG評分、腫瘤直徑、分化程度、血管侵犯、TACE次數。
1.4 隨訪方法
HCC患者TACE術后通過電話或門診復查隨訪1年,截至2024年6月或研究終點(腫瘤進展或死亡),將發生終點事件定義為預后不良。
1.5 統計學方法
采用SPSS 28.0統計學軟件對數據進行分析。符合正態分布的計量數據采用均數±標準差(x±s)描述并采用獨立樣本比較的t檢驗,不符合正態分布者采用中位數和上下四分位數描述并采用秩和檢驗;計數資料采用頻數和百分率(%)描述,并且采用四格表或成組χ2檢驗,不符合χ2檢驗條件者采用Fisher確切概率法檢驗;采用多因素非條件logistic回歸分析影響預后不良的風險因素;采用受試者操作特征(receiver operating characteristic,ROC)曲線下面積(area under ROC curve,AUC)評價血清HSP90α水平聯合PNI區別預后不良的預測價值,AUC比較采用DeLong檢驗。檢驗水準α=0.05。
2 結果
2.1 納入對象的基本情況及研究組和對照組血清HSP90α水平和PNI值比較結果
研究組178例,年齡44~79歲,女56例、男122例;有肝癌家族史44例,乙型或丙型肝炎病毒感染陽性者145例,Child-Pugh分級A級者57例、B級者121例,甲胎蛋白≥400 μg/L者107例、<400 μg/L者71例,CNLC分期Ⅰb期者6例、Ⅱa期者21例、Ⅱb期者90例、Ⅲa期者53例、Ⅲb期者8例;美國ECOG評分0分者78例、1~2分者100例;腫瘤直徑≥2 cm者105例、<2 cm者73例;分化程度低分化者45例、中高分化者133例;血管侵犯者73例。對照組100名,年齡27~73歲;女30名、男70名。2組對象的年齡和性別有可比性(P>0.05)。與對照組人群比較,研究組患者的血清HSP90α水平升高(P<0.001)、PNI降低(P<0.001)。
2.2 影響HCC患者TACE治療后預后不良的單因素和多因素分析結果
隨訪1年過程中無失訪患者,178例HCC患者TACE術后預后不良發生率為39.33%(70/178),其中進展42例、死亡28例。單因素分析結果顯示,年齡、Child-Pugh分級、CNLC分期、分化程度、血管侵犯、HSP90α水平、PNI與HCC患者TACE治療后預后不良有關(P<0.05),而未發現其他臨床病理特征與此有關(P>0.05),見表2;對這些因素進一步進行多因素非條件logistic回歸的結果顯示,CNLC分期Ⅲa~Ⅲb相對于Ⅰ~Ⅱa期預后不良發生概率更高[OR(95%CI)=5.332(1.058,26.875),P=0.043],隨著年齡和HSP90α水平增高以及PNI值降低,TACE治療后預后不良發生概率增高 [年齡:OR(95%CI)=1.100(1.025,1.180),P=0.008;HSP90α水平:OR(95%CI)=1.049(1.029,1.070),P<0.001;PNI:OR(95%CI)=0.772(0.686,0.869),P<0.001],見表3。
2.3 血清HSP90α水平聯合PNI對HCC患者TACE治療后預后不良的區分能力
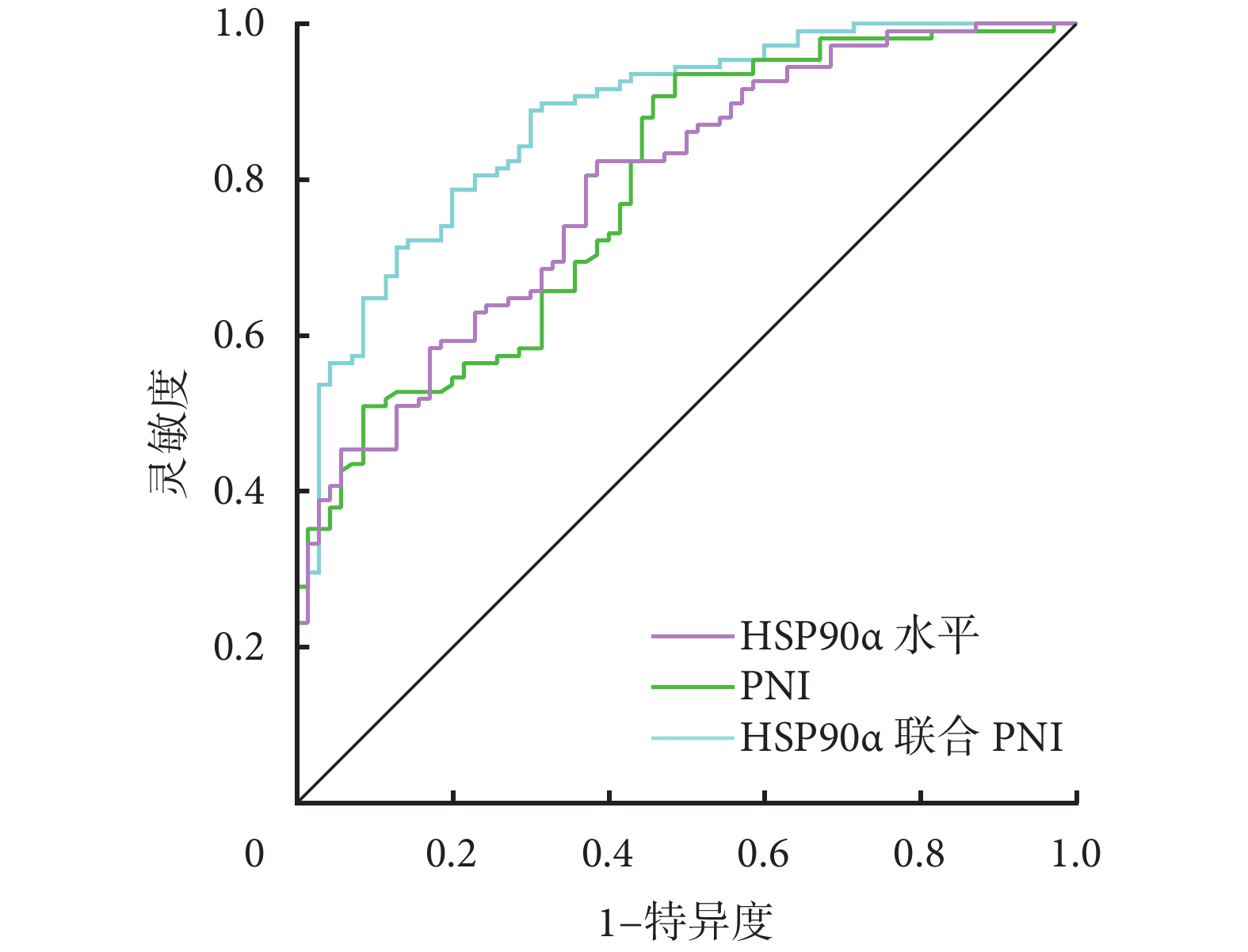
通過logistic回歸擬合血清HSP90α水平聯合PNI預測HCC患者TACE治療后預后不良的概率[Logit(P)=6.968+0.044×HSP90α水平(g/L)–0.273×PNI]。ROC曲線顯示,血清HSP90α水平聯合PNI預測HCC患者TACE治療后預后不良的AUC大于血清HSP90α水平、PNI單獨的AUC(Z=3.341、P=0.001;Z=3.565、P<0.001)。見表4和圖1。
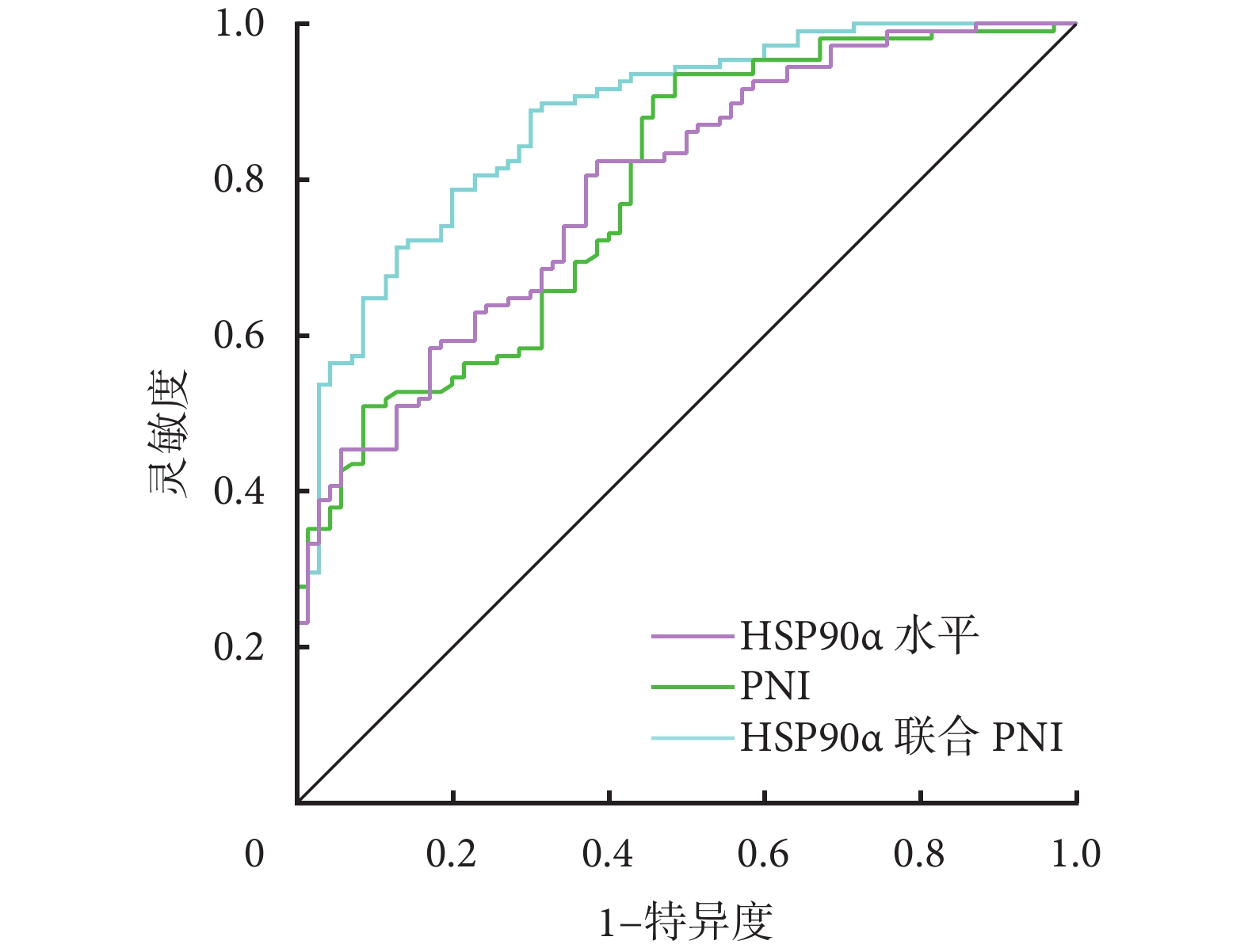 圖1
示血清HSP90α水平聯合PNI區分HCC患者TACE治療后預后不良的ROC曲線
圖1
示血清HSP90α水平聯合PNI區分HCC患者TACE治療后預后不良的ROC曲線
3 討論
外科根治性切除仍然是HCC實現長期生存最可靠的手段,但我國64%的HCC患者初診即為中晚期,不適宜手術切除,且即使手術切除后5年進展率(復發或轉移)仍高達70%[15]。針對中晚期不能手術的HCC患者或者不愿手術的早期HCC患者,TACE是公認最常用的治療方法之一,其作用機制是通過化療藥物碘化油乳劑阻斷腫瘤供血動脈和藥物殺傷腫瘤細胞,以達到抑制HCC生長的作用[6]。但受到HCC高異質性、腫瘤耐藥性等因素影響,TACE并不能完全殺傷腫瘤細胞,在其他因素影響下持續生長導致腫瘤進展,危及患者生命[16]。因此,有必要尋找可靠的指標進行預測,以指導臨床防治。
HCC的發生及發展是多基因改變的復雜過程,多種基因異常表達能促進腫瘤細胞增殖、分化、遷移、侵襲、血管生成、免疫逃逸、凋亡等行為,從而促進TACE后殘留腫瘤細胞惡性進展[17]。HSP90是指相對分子質量為90×103的HSP,作為一種腺嘌呤核苷三磷酸依賴的分子伴侶,它在細胞凋亡、細胞周期控制、細胞信號傳導、細胞活力、蛋白質折疊、降解等基本細胞過程和調控途徑中發揮重要作用[9]。其中HSP90α是HSP90家族的應激誘導型成員,由HSP90AA1基因所編碼,在應激條件下(如熱應激、氧化應激、低氧、放射等)上調,能穩定和激活許多腫瘤相關信號蛋白和受體,從而參與腫瘤的發生發展[9]。有研究者[18-20]報道,HCC細胞模型中HSP90α表達上調,下調HSP90α表達能促進索拉非尼誘導的HCC細胞凋亡和線粒體功能障礙[18],能抑制肝癌HepG2.2.15細胞遷移和侵襲[19]和DNA依賴性蛋白激酶催化亞基的蛋白穩定性和mRNA轉錄,從而增強HCC細胞對熱療誘導DNA損傷的敏感性,發揮更強的抗腫瘤作用[20]。提示,HSP90α參與HCC發生及發展過程。近年來國內有研究者[20-21]報道,血漿或血清HSP90α水平有助于肝癌的早期診斷和預后評估。在本研究中發現,HCC患者血清HSP90α水平較對照組明顯升高(P<0.001),其水平升高是HCC患者TACE術后不良預后的風險因素,分析原因,HSP90α作為抗應激蛋白,能通過抑制凋亡基因表達和募集,保護腫瘤細胞免受TACE過程中化療、栓塞等應激損傷,這種抗應激功能使HCC細胞更具抗藥性和存活能力,從而促進殘留腫瘤細胞持續生長,導致TACE術后不良預后風險增加[22];同時HSP90α能作為分子伴侶,能穩定和激活許多腫瘤相關信號蛋白和受體,通過改變腫瘤微環境、免疫逃逸、血管生成等促進殘留腫瘤細胞惡性進展[9]。
營養不良和炎癥在腫瘤發生和發展中起著關鍵作用,二者相互作用能通過降低免疫系統功能、改變腫瘤微環境、促進腫瘤血管生成等促進腫瘤細胞惡性進展[23]。惡性腫瘤患者康復期營養管理專家共識(2023版)[24]也指出,合理的膳食營養管理改善惡性腫瘤患者臨床獲益和預后。白蛋白水平是評價營養狀況的常用指標,蛋白質攝入不足時可減少白蛋白合成,且炎癥狀態下機體優先合成急性期反應蛋白也會減少白蛋白合成,從而引起營養不良;淋巴細胞計數反映了機體的免疫功能,營養不良會導致免疫系統功能下降,且炎癥能抑制淋巴細胞增殖和功能,降低淋巴細胞計數;PNI通過綜合評估白蛋白水平和血淋巴細胞計數的一個指標,相較于單一指標能更有效地反映患者營養不良和炎癥反應狀態[11]。有研究者[25-26]報道,PNI降低與肝癌患者術后出現營養風險有關[25],PNI有助于預測早期肝癌射頻治療術后復發和生存期有關[26]。因此推測,PNI可能與HCC患者TACE術后預后有關。本研究中,HCC患者PNI較對照組降低,且PNI低是TACE術后不良預后的風險因素。分析原因,高PNI反映患者營養狀態和免疫功能更好,良好的免疫功能可更有效地識別和殺傷腫瘤細胞,抑制腫瘤細胞生長,良好的營養狀態也在增強免疫功能的同時能加速術后康復,進而降低TACE術后不良預后風險[23]。
此外,在本研究中采用AUC評估血清HSP90α水平聯合PNI預測HCC患者TACE治療后預后不良的區分能力,發現它優于這兩個指標單獨應用的能力。考慮是,單獨依靠HSP90α與PNI無法全面評估HCC患者整體健康情況,而HSP90α與PNI分別反映了腫瘤生物學行為和患者營養、免疫功能,二者聯合能更加全面的反映uHCC患者整體健康情況,進而更加精準地識別高風險患者,提高預后預測的準確性。此外,在本研究中分析還發現年齡增長和CNLC分期Ⅲa~Ⅲb期是影響HCC患者TACE術后不良預后的風險因素,考慮與高齡患者身體狀況差、基礎疾病多以及Ⅲa~Ⅲb期反映HCC患者腫瘤細胞惡性程度更高有關。今后還可考慮將這這兩個因素也聯合加入,是否能進一步提高區分能力。
總之,從本研究結果得出,HCC患者的血清HSP90α水平較正常人群明顯升高及PNI明顯降低,而且這二者聯合評價HCC患者TACE術后不良預后的區分能力較好。但本研究存在一些不足:首先,本研究為單中心研究,樣本量相對有限,可能影響結果的普適性;其次,本研究未動態觀察監測HSP90α和PNI變化趨勢,缺乏對對長期預后的評價;同時,本研究未納入其他潛在預后影響因素。因此,未來研究應擴大樣本量開展多中心研究,增加術后動態監測,并結合更多因素構建更全面的預后評估模型,以提高結果的準確性和臨床應用價值。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:陳培升負責文章撰寫及文稿審閱;林澤毅負責臨床數據收集;覃柯璋和鄧鈺城負責患者隨訪。
倫理聲明:本研究通過了貴港市人民醫院倫理委員會審批(批文編號:GYLLPJ-20211130-39)。
2020年全球新發肝癌(下文均指“原發性肝癌”)90.57萬例(順位第6位)、死亡83.02萬例(順位第4位),而我國新發肝癌36.77萬例(順位第4位)、死亡31.65萬例(順位第2位)[1-4]。肝細胞癌(hepatocellular carcinoma,HCC)占所有肝癌的75%~85%,其治療方式主要還是手術治療,但對于不可切除或可切除而因其他原因不接受手術切除HCC采用經動脈化療栓塞(transcatheter arterial chemoembolization,TACE)是最常采用的局部治療方法,但仍有部分患者預后較差[5-6]。因此,亟需篩選出對TACE治療效果較好的患者意義重大。最近有研究者[7-8]報道,熱休克蛋白(heat shock protein,HSP)、營養狀況和炎癥反應在肝癌發生及發展過程中發揮著重要作用。HSP成員中的HSP90α是一種分子伴侶,能通過影響多條信號通路參與惡性腫瘤過程[9]。比如,有研究者[10]報道,血清HSP90α水平升高有助于原發性肝癌早期診斷。此外,評價營養狀況和炎癥反應的指標即預后營養指數(prognostic nutritional index,PNI)[11]與晚期肝癌患者病情程度和預后相關[12]。因此,若將患者血清中HSP90α水平與PNI聯合,它對HCC患者TACE術后預后是否具有預測價值值得探討,本研究對此進行了研究,現報道如下。
1 資料與方法
1.1 臨床資料
選取2022年1月至2023年6月期間在貴港市人民醫院行TACE治療的HCC患者作為研究組。納入標準:① 年齡≥18歲;② 經活檢病理確診為HCC[13],且處于不可切除階段[包括中國肝癌分期(China liver cancer staging,CNLC) Ⅱb~Ⅲb期或可手術但因其他原因(如嚴重肝硬化、高齡等)不能或不愿接受手術的CNLC Ⅰ~Ⅱa期][14];③ 美國東部腫瘤協助組(Eastern Cooperative Oncology Group,ECOG)功能狀態評分0~2分、Child-Pugh分級A~B級HCC。排除標準:① 肝移植者;② 伴自身免疫性疾病;③ 預期生存期<3個月、多臟器功能衰竭或惡液質、≥Ⅱ級的碘對比劑過敏、嚴重肝腎功能障礙等;④ 伴血液系統疾病;⑤ 妊娠及哺乳期婦女;⑥ 門靜脈主干完全栓塞;⑦ 依從性差、不能接受隨訪。根據統計學效能分析原則,選擇與研究組患者數量接近的100名體檢健康者作為對照組。本研究經貴港市人民醫院倫理委員會批準(批文編號:GYLLPJ-
1.2 方法
1.2.1 血液學指標檢測
采集HCC患者TACE術前1 d和體檢健康者體檢時3 mL空腹外周靜脈血,部分血液標本1 500×g離心15 min留存血清。采用酶聯免疫吸附法檢測HSP90α(廣州威佳科技有限公司,貨號CSB-E13462h)、白蛋白(上海瓦蘭生物科技有限公司,貨號A7243)及甲胎蛋白(杭州聯科生物技術股份有限公司,貨號EK1175)水平。剩余血液標本抗凝后采用全自動五分類血液分析儀(邁瑞醫療,型號BC-760CS)檢測淋巴細胞計數。計算PNI值,其公式為“PNI=白蛋白(g/L)+5×淋巴細胞計數(×109/L)”。
1.2.2 TACE術
HCC患者入院后,由具備3年以上相關臨床經驗的主治醫師參考《中國肝細胞癌經動脈化療栓塞治療(TACE)臨床實踐指南》[14]進行TACE治療:指導患者仰臥位,對穿刺部位消毒、鋪巾、局部浸潤麻醉后,Seldinger法穿刺橈動脈或股動脈置入管鞘,行肝總動脈或腹腔動脈造影(荷蘭飛利浦X線數字減影血管造影機,型號Azurion 7M20),了解病灶形態、大小、數目、血供等情況后,導管超選進入病灶供血動脈,注入化療藥物碘化油乳劑[注射用順鉑20 mg(齊魯制藥有限公司,國藥準字H20023461)+注射用鹽酸吡柔比星20 mg(深圳萬樂藥業有限公司,國藥準字H10930105)+碘化油注射液20 mL(煙臺魯銀藥業有限公司,國藥準字H37022398)],然后注入適量的顆粒栓塞劑(明膠海綿懸浮液或微球)進行化療和栓塞。栓塞結束后5 min再次造影驗證,若血管造影顯示仍存在腫瘤染色即腫瘤富血供則再次行TACE操作,待血管造影顯示染色消失后結束手術。
1.3 資料收集及觀察指標
收集HCC患者臨床資料,包括性別、年齡、肝癌家族史、乙肝或丙肝炎病毒感染、Child-Pugh分級、飲酒史、吸煙史、CNLC分期、ECOG評分、腫瘤直徑、分化程度、血管侵犯、TACE次數。
1.4 隨訪方法
HCC患者TACE術后通過電話或門診復查隨訪1年,截至2024年6月或研究終點(腫瘤進展或死亡),將發生終點事件定義為預后不良。
1.5 統計學方法
采用SPSS 28.0統計學軟件對數據進行分析。符合正態分布的計量數據采用均數±標準差(x±s)描述并采用獨立樣本比較的t檢驗,不符合正態分布者采用中位數和上下四分位數描述并采用秩和檢驗;計數資料采用頻數和百分率(%)描述,并且采用四格表或成組χ2檢驗,不符合χ2檢驗條件者采用Fisher確切概率法檢驗;采用多因素非條件logistic回歸分析影響預后不良的風險因素;采用受試者操作特征(receiver operating characteristic,ROC)曲線下面積(area under ROC curve,AUC)評價血清HSP90α水平聯合PNI區別預后不良的預測價值,AUC比較采用DeLong檢驗。檢驗水準α=0.05。
2 結果
2.1 納入對象的基本情況及研究組和對照組血清HSP90α水平和PNI值比較結果
研究組178例,年齡44~79歲,女56例、男122例;有肝癌家族史44例,乙型或丙型肝炎病毒感染陽性者145例,Child-Pugh分級A級者57例、B級者121例,甲胎蛋白≥400 μg/L者107例、<400 μg/L者71例,CNLC分期Ⅰb期者6例、Ⅱa期者21例、Ⅱb期者90例、Ⅲa期者53例、Ⅲb期者8例;美國ECOG評分0分者78例、1~2分者100例;腫瘤直徑≥2 cm者105例、<2 cm者73例;分化程度低分化者45例、中高分化者133例;血管侵犯者73例。對照組100名,年齡27~73歲;女30名、男70名。2組對象的年齡和性別有可比性(P>0.05)。與對照組人群比較,研究組患者的血清HSP90α水平升高(P<0.001)、PNI降低(P<0.001)。
2.2 影響HCC患者TACE治療后預后不良的單因素和多因素分析結果
隨訪1年過程中無失訪患者,178例HCC患者TACE術后預后不良發生率為39.33%(70/178),其中進展42例、死亡28例。單因素分析結果顯示,年齡、Child-Pugh分級、CNLC分期、分化程度、血管侵犯、HSP90α水平、PNI與HCC患者TACE治療后預后不良有關(P<0.05),而未發現其他臨床病理特征與此有關(P>0.05),見表2;對這些因素進一步進行多因素非條件logistic回歸的結果顯示,CNLC分期Ⅲa~Ⅲb相對于Ⅰ~Ⅱa期預后不良發生概率更高[OR(95%CI)=5.332(1.058,26.875),P=0.043],隨著年齡和HSP90α水平增高以及PNI值降低,TACE治療后預后不良發生概率增高 [年齡:OR(95%CI)=1.100(1.025,1.180),P=0.008;HSP90α水平:OR(95%CI)=1.049(1.029,1.070),P<0.001;PNI:OR(95%CI)=0.772(0.686,0.869),P<0.001],見表3。
2.3 血清HSP90α水平聯合PNI對HCC患者TACE治療后預后不良的區分能力
通過logistic回歸擬合血清HSP90α水平聯合PNI預測HCC患者TACE治療后預后不良的概率[Logit(P)=6.968+0.044×HSP90α水平(g/L)–0.273×PNI]。ROC曲線顯示,血清HSP90α水平聯合PNI預測HCC患者TACE治療后預后不良的AUC大于血清HSP90α水平、PNI單獨的AUC(Z=3.341、P=0.001;Z=3.565、P<0.001)。見表4和圖1。
 圖1
示血清HSP90α水平聯合PNI區分HCC患者TACE治療后預后不良的ROC曲線
圖1
示血清HSP90α水平聯合PNI區分HCC患者TACE治療后預后不良的ROC曲線
3 討論
外科根治性切除仍然是HCC實現長期生存最可靠的手段,但我國64%的HCC患者初診即為中晚期,不適宜手術切除,且即使手術切除后5年進展率(復發或轉移)仍高達70%[15]。針對中晚期不能手術的HCC患者或者不愿手術的早期HCC患者,TACE是公認最常用的治療方法之一,其作用機制是通過化療藥物碘化油乳劑阻斷腫瘤供血動脈和藥物殺傷腫瘤細胞,以達到抑制HCC生長的作用[6]。但受到HCC高異質性、腫瘤耐藥性等因素影響,TACE并不能完全殺傷腫瘤細胞,在其他因素影響下持續生長導致腫瘤進展,危及患者生命[16]。因此,有必要尋找可靠的指標進行預測,以指導臨床防治。
HCC的發生及發展是多基因改變的復雜過程,多種基因異常表達能促進腫瘤細胞增殖、分化、遷移、侵襲、血管生成、免疫逃逸、凋亡等行為,從而促進TACE后殘留腫瘤細胞惡性進展[17]。HSP90是指相對分子質量為90×103的HSP,作為一種腺嘌呤核苷三磷酸依賴的分子伴侶,它在細胞凋亡、細胞周期控制、細胞信號傳導、細胞活力、蛋白質折疊、降解等基本細胞過程和調控途徑中發揮重要作用[9]。其中HSP90α是HSP90家族的應激誘導型成員,由HSP90AA1基因所編碼,在應激條件下(如熱應激、氧化應激、低氧、放射等)上調,能穩定和激活許多腫瘤相關信號蛋白和受體,從而參與腫瘤的發生發展[9]。有研究者[18-20]報道,HCC細胞模型中HSP90α表達上調,下調HSP90α表達能促進索拉非尼誘導的HCC細胞凋亡和線粒體功能障礙[18],能抑制肝癌HepG2.2.15細胞遷移和侵襲[19]和DNA依賴性蛋白激酶催化亞基的蛋白穩定性和mRNA轉錄,從而增強HCC細胞對熱療誘導DNA損傷的敏感性,發揮更強的抗腫瘤作用[20]。提示,HSP90α參與HCC發生及發展過程。近年來國內有研究者[20-21]報道,血漿或血清HSP90α水平有助于肝癌的早期診斷和預后評估。在本研究中發現,HCC患者血清HSP90α水平較對照組明顯升高(P<0.001),其水平升高是HCC患者TACE術后不良預后的風險因素,分析原因,HSP90α作為抗應激蛋白,能通過抑制凋亡基因表達和募集,保護腫瘤細胞免受TACE過程中化療、栓塞等應激損傷,這種抗應激功能使HCC細胞更具抗藥性和存活能力,從而促進殘留腫瘤細胞持續生長,導致TACE術后不良預后風險增加[22];同時HSP90α能作為分子伴侶,能穩定和激活許多腫瘤相關信號蛋白和受體,通過改變腫瘤微環境、免疫逃逸、血管生成等促進殘留腫瘤細胞惡性進展[9]。
營養不良和炎癥在腫瘤發生和發展中起著關鍵作用,二者相互作用能通過降低免疫系統功能、改變腫瘤微環境、促進腫瘤血管生成等促進腫瘤細胞惡性進展[23]。惡性腫瘤患者康復期營養管理專家共識(2023版)[24]也指出,合理的膳食營養管理改善惡性腫瘤患者臨床獲益和預后。白蛋白水平是評價營養狀況的常用指標,蛋白質攝入不足時可減少白蛋白合成,且炎癥狀態下機體優先合成急性期反應蛋白也會減少白蛋白合成,從而引起營養不良;淋巴細胞計數反映了機體的免疫功能,營養不良會導致免疫系統功能下降,且炎癥能抑制淋巴細胞增殖和功能,降低淋巴細胞計數;PNI通過綜合評估白蛋白水平和血淋巴細胞計數的一個指標,相較于單一指標能更有效地反映患者營養不良和炎癥反應狀態[11]。有研究者[25-26]報道,PNI降低與肝癌患者術后出現營養風險有關[25],PNI有助于預測早期肝癌射頻治療術后復發和生存期有關[26]。因此推測,PNI可能與HCC患者TACE術后預后有關。本研究中,HCC患者PNI較對照組降低,且PNI低是TACE術后不良預后的風險因素。分析原因,高PNI反映患者營養狀態和免疫功能更好,良好的免疫功能可更有效地識別和殺傷腫瘤細胞,抑制腫瘤細胞生長,良好的營養狀態也在增強免疫功能的同時能加速術后康復,進而降低TACE術后不良預后風險[23]。
此外,在本研究中采用AUC評估血清HSP90α水平聯合PNI預測HCC患者TACE治療后預后不良的區分能力,發現它優于這兩個指標單獨應用的能力。考慮是,單獨依靠HSP90α與PNI無法全面評估HCC患者整體健康情況,而HSP90α與PNI分別反映了腫瘤生物學行為和患者營養、免疫功能,二者聯合能更加全面的反映uHCC患者整體健康情況,進而更加精準地識別高風險患者,提高預后預測的準確性。此外,在本研究中分析還發現年齡增長和CNLC分期Ⅲa~Ⅲb期是影響HCC患者TACE術后不良預后的風險因素,考慮與高齡患者身體狀況差、基礎疾病多以及Ⅲa~Ⅲb期反映HCC患者腫瘤細胞惡性程度更高有關。今后還可考慮將這這兩個因素也聯合加入,是否能進一步提高區分能力。
總之,從本研究結果得出,HCC患者的血清HSP90α水平較正常人群明顯升高及PNI明顯降低,而且這二者聯合評價HCC患者TACE術后不良預后的區分能力較好。但本研究存在一些不足:首先,本研究為單中心研究,樣本量相對有限,可能影響結果的普適性;其次,本研究未動態觀察監測HSP90α和PNI變化趨勢,缺乏對對長期預后的評價;同時,本研究未納入其他潛在預后影響因素。因此,未來研究應擴大樣本量開展多中心研究,增加術后動態監測,并結合更多因素構建更全面的預后評估模型,以提高結果的準確性和臨床應用價值。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:陳培升負責文章撰寫及文稿審閱;林澤毅負責臨床數據收集;覃柯璋和鄧鈺城負責患者隨訪。
倫理聲明:本研究通過了貴港市人民醫院倫理委員會審批(批文編號:GYLLPJ-20211130-39)。