引用本文: 仝夢婷, 王靜, 姜南宇, 潘宏銘, 李達. pSTAT3 過表達與肺癌預后相關性的 Meta 分析. 中國循證醫學雜志, 2017, 17(9): 1021-1028. doi: 10.7507/1672-2531.201702019 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
2012 年全球統計數據顯示,腫瘤發病人數由 2008 年 1 600 萬人上升至 1 800 萬人。肺癌作為最常見的惡性腫瘤之一,其發病率約為 13%,死亡率高達 80%,5 年生存率僅為 17.7%,是全球發病率第二,死亡率高居首位的惡性腫瘤[1-3]。因我國特殊的居住環境和生活習慣[4-6],中國肺癌發生率和死亡率均高于全球平均值[7]。目前,隨著肺癌診療技術的突破,肺癌 5 年生存率已提高了 7.3%,對于早期肺癌患者,5 年生存率可達 55.2%,然而超過一半的肺癌患者在確診時已處于進展期[3]。近些年,許多研究者致力于分子預測指標的研究,以發現其與肺癌預后的相關性和尋找潛在的治療靶點。目前國外已推廣的 gene panel 和 cell cycle progression 正在進行大規模的隨機對照試驗(randomized controlled trial,RCT)以尋找有效的分子預測指標[8]。肺癌作為高發病率和高致死率的惡性腫瘤,發現并識別重要的分子預測指標是目前迫切的需要。
信號轉導及轉錄活化因子(signal transducer and activator of transcription,STAT)是細胞質轉錄因子的一個家族,包括 7 個成員,分別為 STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b 和 STAT6[9],其中認為 STAT3 的異常活化與腫瘤的形成關系密切[10, 11]。STAT3 在細胞內主要有兩種活化形式,一種是形成二聚體(SH2),穩定的二聚體形式使 STAT3 在細胞內不易被降解[12];二是通過活化間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、生長因子受體(growth factor receptor),包括表皮生長因子受體(epidermal growth factor receptor,EGFR),血小板源性生長因子受體(platelet derived growth factor,PDGF)等,進而激活 Janus 激酶(Janus kinases,JAK)使 STAT3 轉變成磷酸化 STAT3(pSTAT3),從而促進腫瘤細胞生存、遠處轉移、產生耐藥或抑制細胞凋亡[13-17]。已有研究顯示,pSTAT3 過表達與胃癌[18]、結直腸癌[19]、胰腺癌[20]和肺癌[21]等多種惡性腫瘤預后不良有關,但結論不盡相同[22-24]。其與肺癌的相關性值得進一步研究,因此,我們采用 Meta 分析方法研究 pSTAT3 過表達與肺癌的相關性。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型 隊列研究和橫斷面研究。
1.1.2 研究對象 病理明確診斷為肺癌的患者。
1.1.3 暴露因素 pSTAT3 表達情況,結果判讀根據原始文獻臨界值區分。pSTAT3 檢測方法為免疫組織化學染色法(IHC)。
1.1.4 結局指標 pSTAT3 過表達與肺癌患者總生存率及臨床預后特征(TNM 分期、淋巴結轉移和分化程度)的相關性。
1.1.5 排除標準 ① 非中、英文文獻;② 只有摘要而無法獲取全文的文獻;③ 資料、數據錯誤或不全,聯系作者無果的研究;④ 無法提取數據的文獻;⑤ 來自同一人群的不同研究報告,只納入數據最全、最新的報道。
1.2 文獻檢索策略
計算機檢索 PubMed、EMbase、Web of Science、CNKI、VIP 和 WanFang Data 等數據庫,搜集公開發表的關于 pSTAT3 過表達與肺癌預后相關性的研究,檢索時限為建庫至 2016 年 11 月。同時,追溯納入研究的參考文獻,以補充獲取相關文獻。中文檢索詞包括:pSTAT3、磷酸化、STAT3 和肺癌等。英文檢索詞包括:lung cancer、STAT3、pSTAT3、signal transducer and activator of transcription 3 和 phosphoralated signal transducer and activator of transcription 3 等。以 PubMed 為例,具體檢索策略見框 1。

1.3 文獻篩選和資料提取
由兩位研究者獨立篩選文獻、提取資料并交叉核對,如遇分歧,則討論解決或交由第三位研究者決定。對文獻中不清楚或未提供的資料,采用電子郵件與主要作者聯系并獲取確切數據信息,若未獲回復,作為資料缺失處理。資料提取內容主要包括:① 納入研究的基本信息:第一作者、發表時間等;② 研究對象的基線特征,包括年齡、性別、隨訪時間、TNM 分期、淋巴結轉移及分化程度情況等;③ 偏倚風險評價的關鍵要素;④ 所關注的結局指標。
1.4 納入研究的偏倚風險評價
納入隊列研究的偏倚風險采用 NOS 量表(Newcastle-Ottawa scale)[25]進行評價,納入橫斷面研究的偏倚風險采用 AHRQ 量表(Agency for Heathcare Research and Quality)評價。
1.5 統計分析
采用 RevMan 5.2 軟件進行 Meta 分析,以風險比(HR)及其 95% 可信區間(CI)為生存率的效應分析統計量。如文獻中給出具體數據,直接提取;如文獻中只提供 K-M 生存曲線(Kaplan-Meier 生存曲線),則通過 Engauge Digitizer version 4.1 軟件(http://sourceforge.net/projects/digitizer)及 Jayne F Tierney 表(http://www.biomedcentral.com/content/ supplementary/1745-6215-8-16-S1.xls)計算。以比值比(OR)及其 95%CI 為肺癌預后特征的效應分析統計量。納入研究結果間的異質性采用卡方檢驗進行分析(檢驗水準為 α=0.1),并結合 I2判斷異質性的大小。若各研究間無統計學異質性(P>0.10,I2<50%),則采用固定效應模型進行合并分析;若各研究間有統計學異質性(P<0.10,I2>50%),在排除明顯臨床異質性的影響后,采用隨機效應模型進行合并分析,明顯的臨床異質性采用亞組分析方法進行處理。檢驗水準為 α=0.05。
2 結果
2.1 文獻篩選流程及結果
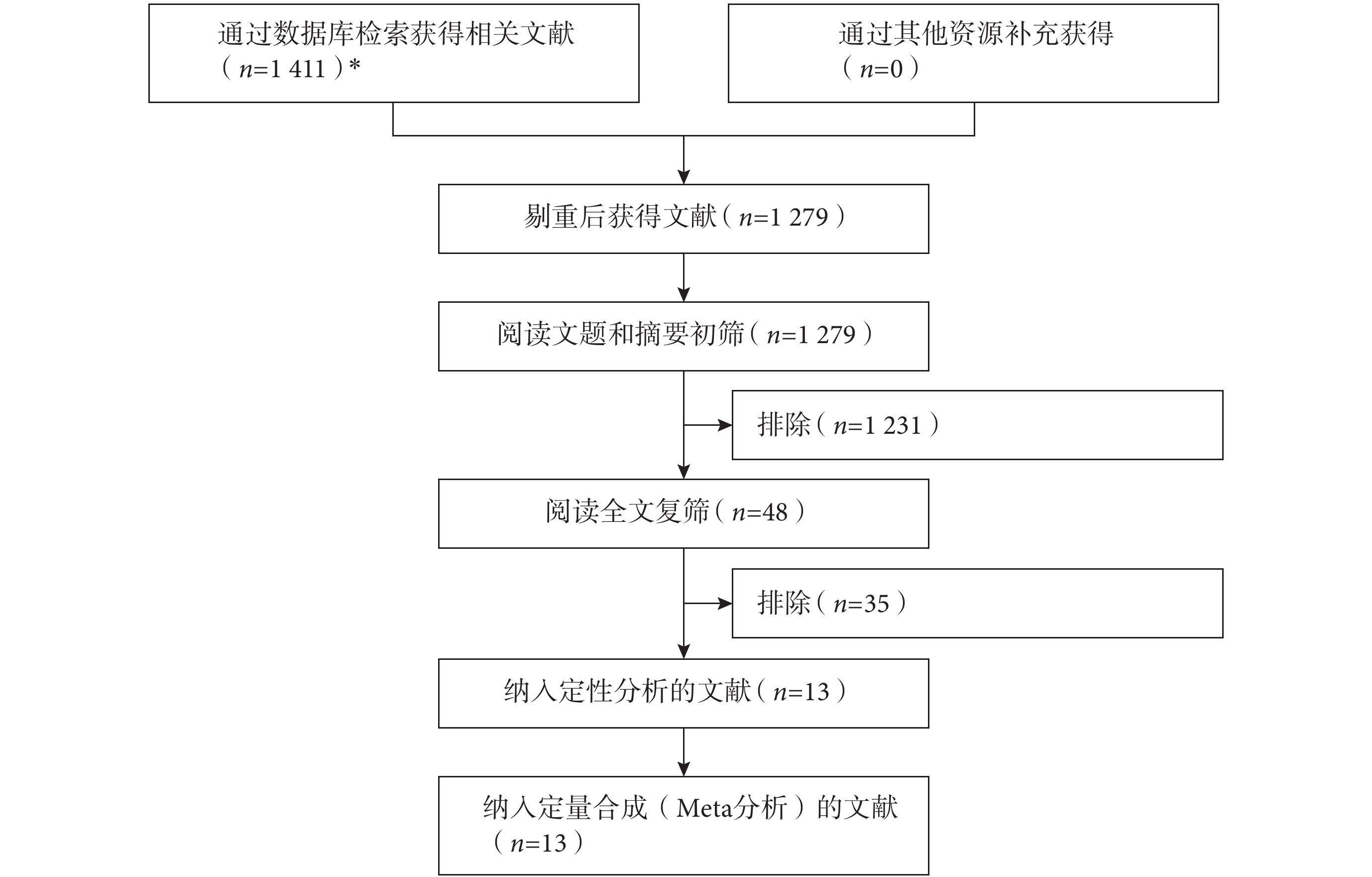
初檢共獲得相關文獻 1 411 篇,經逐層篩選后,最終納入 13 個研究[15, 22, 24, 26-35]。文獻篩選流程及結果見圖 1。
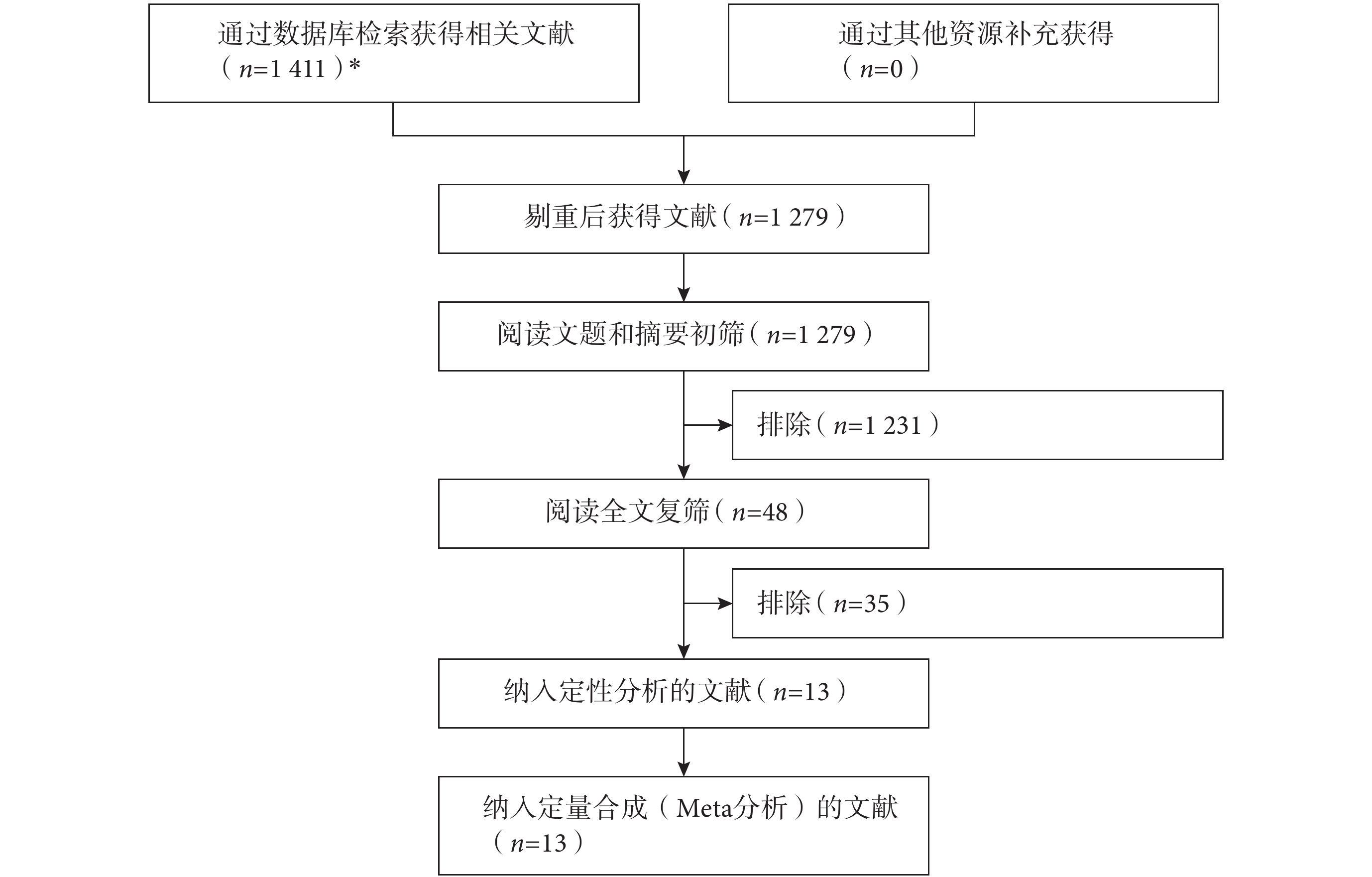 圖1
文獻篩選流程及結果 *所檢索的數據庫及檢出文獻數具體如下:EMbase(n=229)、PubMed(n=589)、Web of Science(n=553)、CNKI(n=8)、VIP(n=4)、WanFang Data(n=28)
圖1
文獻篩選流程及結果 *所檢索的數據庫及檢出文獻數具體如下:EMbase(n=229)、PubMed(n=589)、Web of Science(n=553)、CNKI(n=8)、VIP(n=4)、WanFang Data(n=28)
2.2 納入研究的基本特征
見表 1。
2.3 納入研究的偏倚風險評價結果
2.4 Meta分析結果
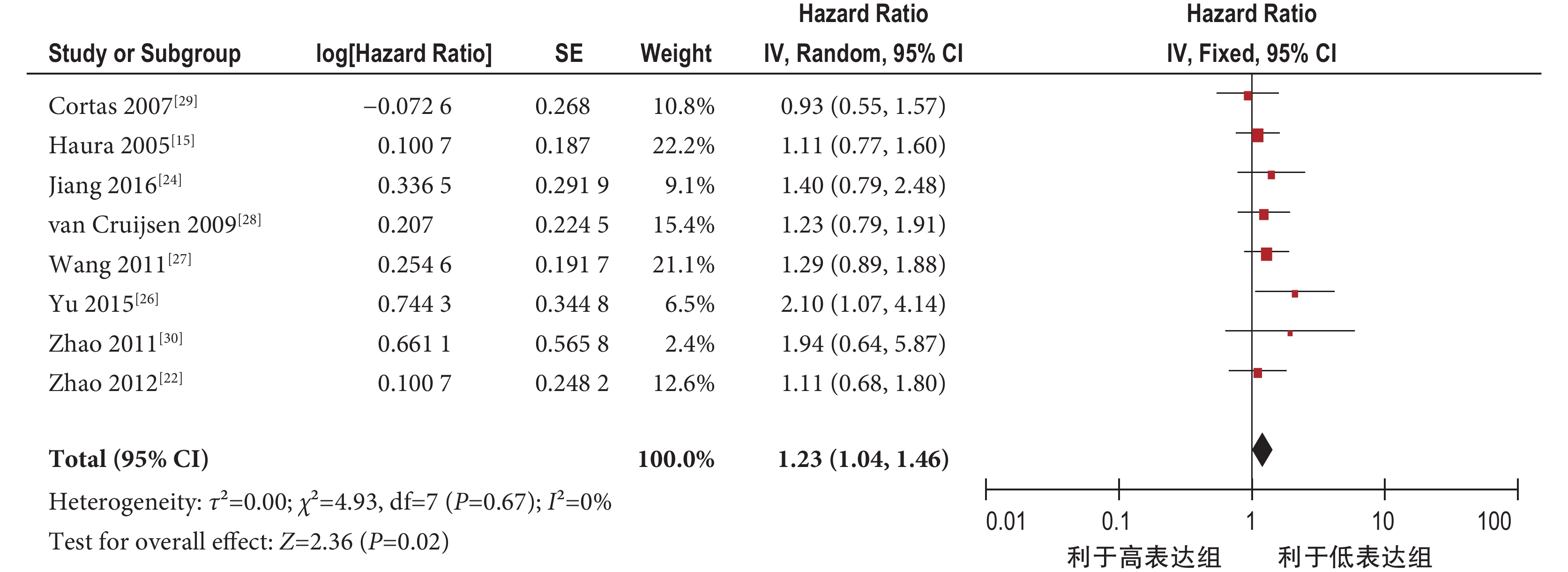
2.4.1 pSTAT3 過表達與肺癌患者總生存率 共納入 8 個研究[15, 22, 24, 26-30]。固定效應模型 Meta 分析結果顯示,肺癌 pSTAT3 過表達組總生存率明顯低于 pSTAT3 低表達組,兩組差異有統計學意義[HR=1.23,95%CI(1.04,1.46),P=0.02](圖 2)。
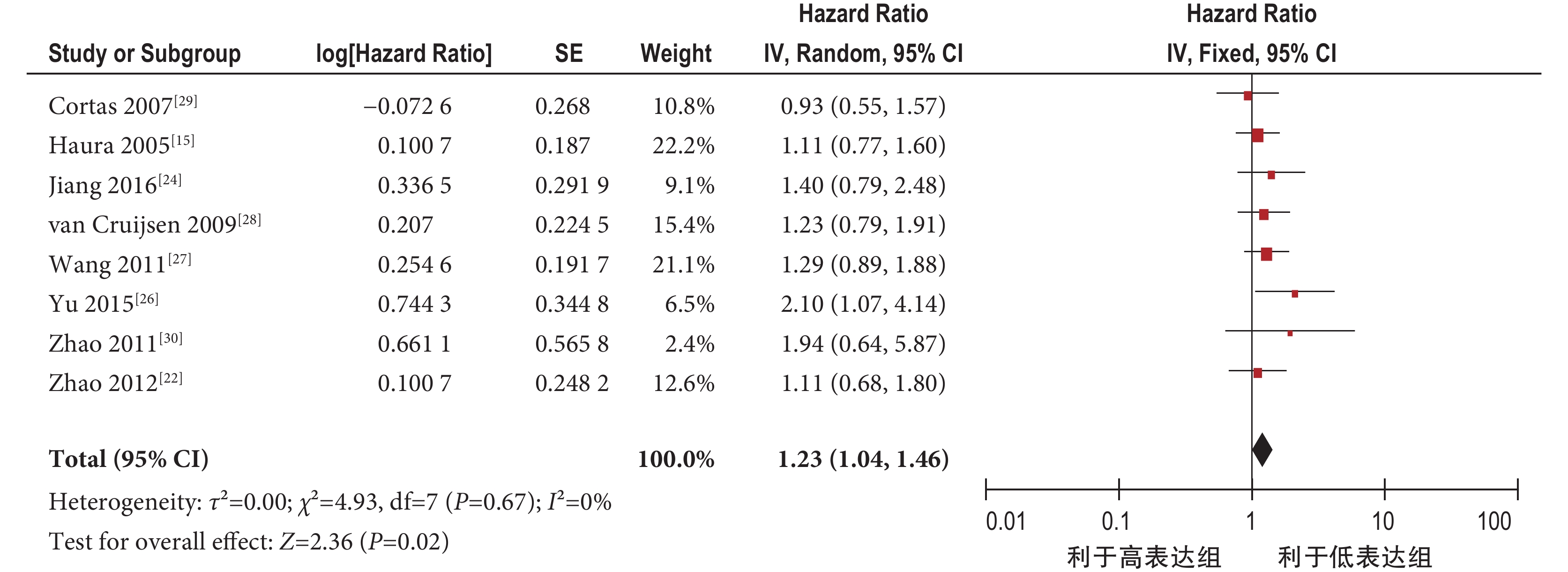 圖2
pSTAT3 過表達與肺癌總生存率的 Meta 分析
圖2
pSTAT3 過表達與肺癌總生存率的 Meta 分析
2.4.2 pSTAT3 過表達與肺癌患者預后特征
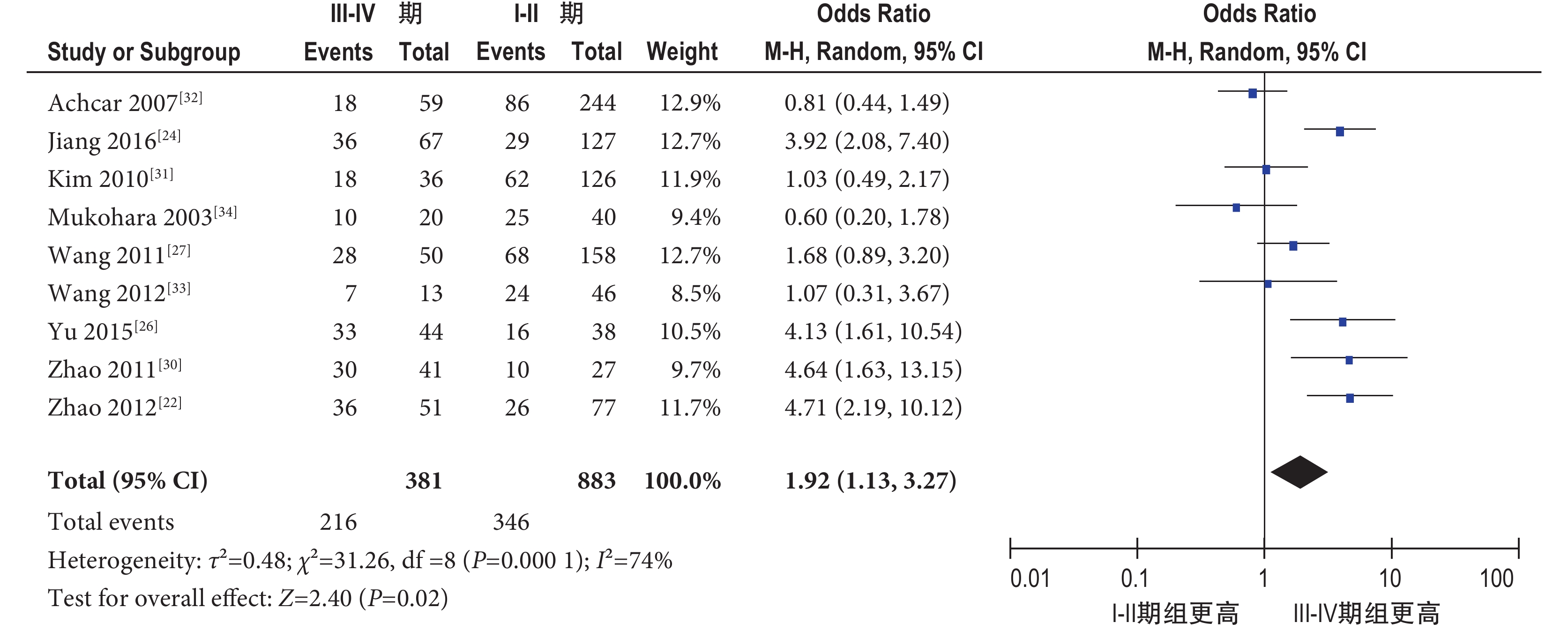
2.4.2.1 TNM 分期 共納入 9 個研究[22, 24, 26, 27, 30-34],包括 1 264 例肺癌患者,其中 Ⅰ~Ⅱ 期 883 例,Ⅲ~Ⅳ 期 381 例。隨機效應模型 Meta 分析結果顯示,肺癌 Ⅲ~Ⅳ 期組 pSTAT3 過表達陽性率明顯高于 Ⅰ~Ⅱ 期組,其差異有統計學意義[OR=1.92,95%CI(1.13,3.27),P=0.02](圖 3)。
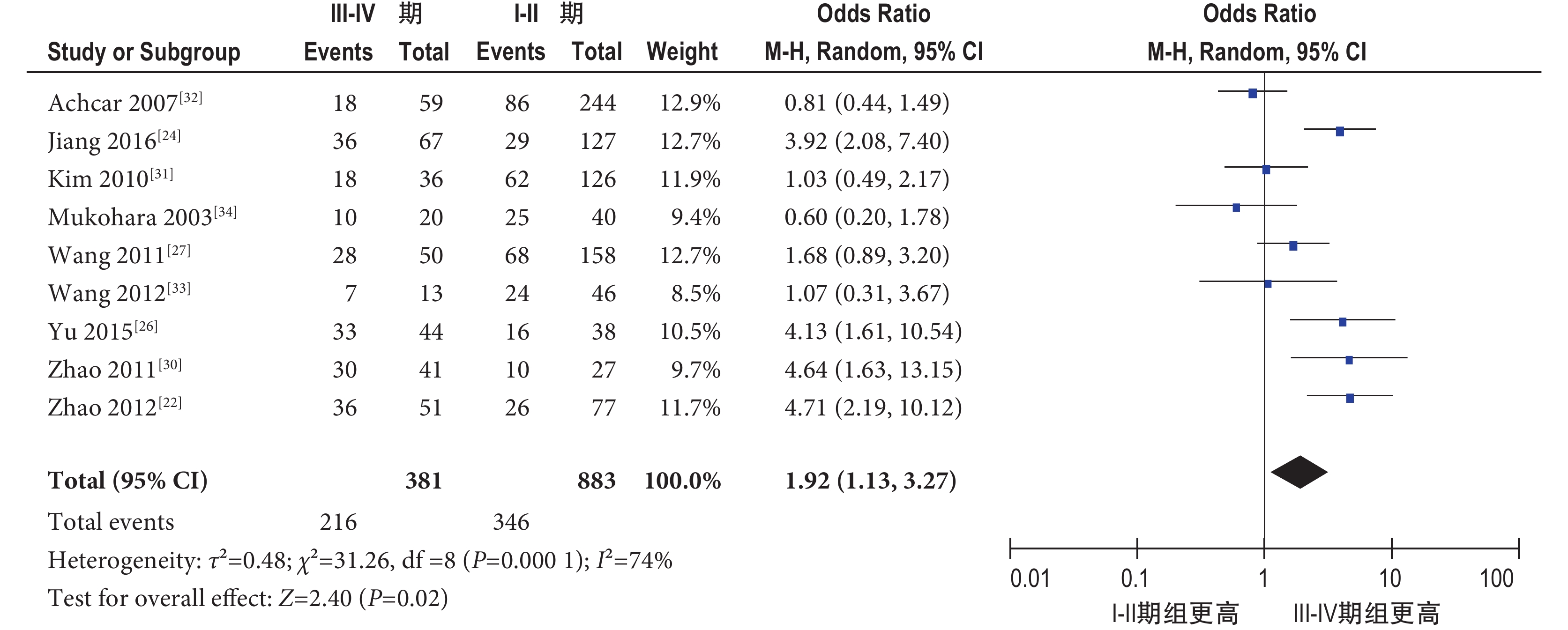 圖3
pSTAT3 過表達與肺癌 TNM 分期的 Meta 分析
圖3
pSTAT3 過表達與肺癌 TNM 分期的 Meta 分析
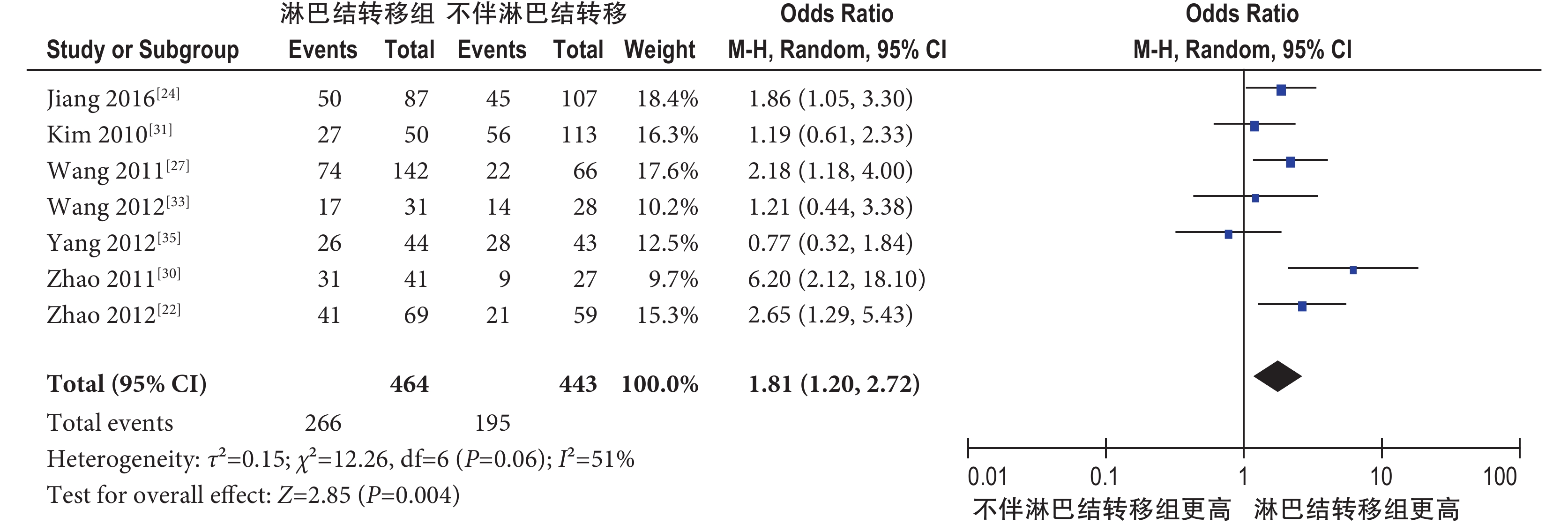
2.4.2.2 淋巴結轉移 共納入 7 個研究[22, 24, 27, 30, 31, 33, 35],包括 907 例肺癌患者,其中無淋巴結轉移 443 例,有淋巴結轉移 464 例。隨機效應模型 Meta 分析結果顯示,肺癌伴淋巴結轉移組 pSTAT3 陽性率明顯高于不伴淋巴結轉移組,其差異有統計學意義[OR=1.81,95%CI(1.20,2.72),P=0.004](圖 4)。
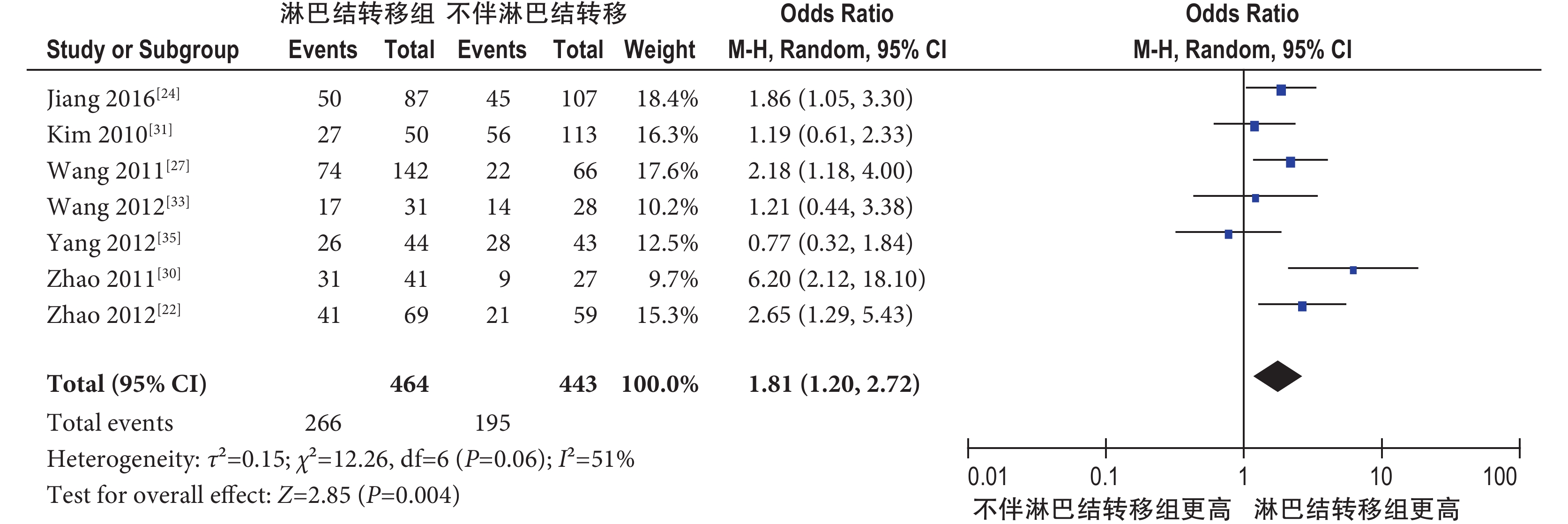 圖4
pSTAT3 過表達與肺癌淋巴結轉移的 Meta 分析
圖4
pSTAT3 過表達與肺癌淋巴結轉移的 Meta 分析
2.4.2.3 肺癌分化程度 共納入 7 個研究[24, 27, 30, 31, 33-35],包括 822 例肺癌患者,其中高中分化 476 例,低分化 346 例。隨機效應模型 Meta 分析結果顯示,兩組差異無統計學意義[OR=0.82,95%CI(0.44,1.53),P=0.54](圖 5)。
 圖5
pSTAT3 過表達與肺癌分化程度的 Meta 分析
圖5
pSTAT3 過表達與肺癌分化程度的 Meta 分析
2.5 敏感性分析和發表偏倚
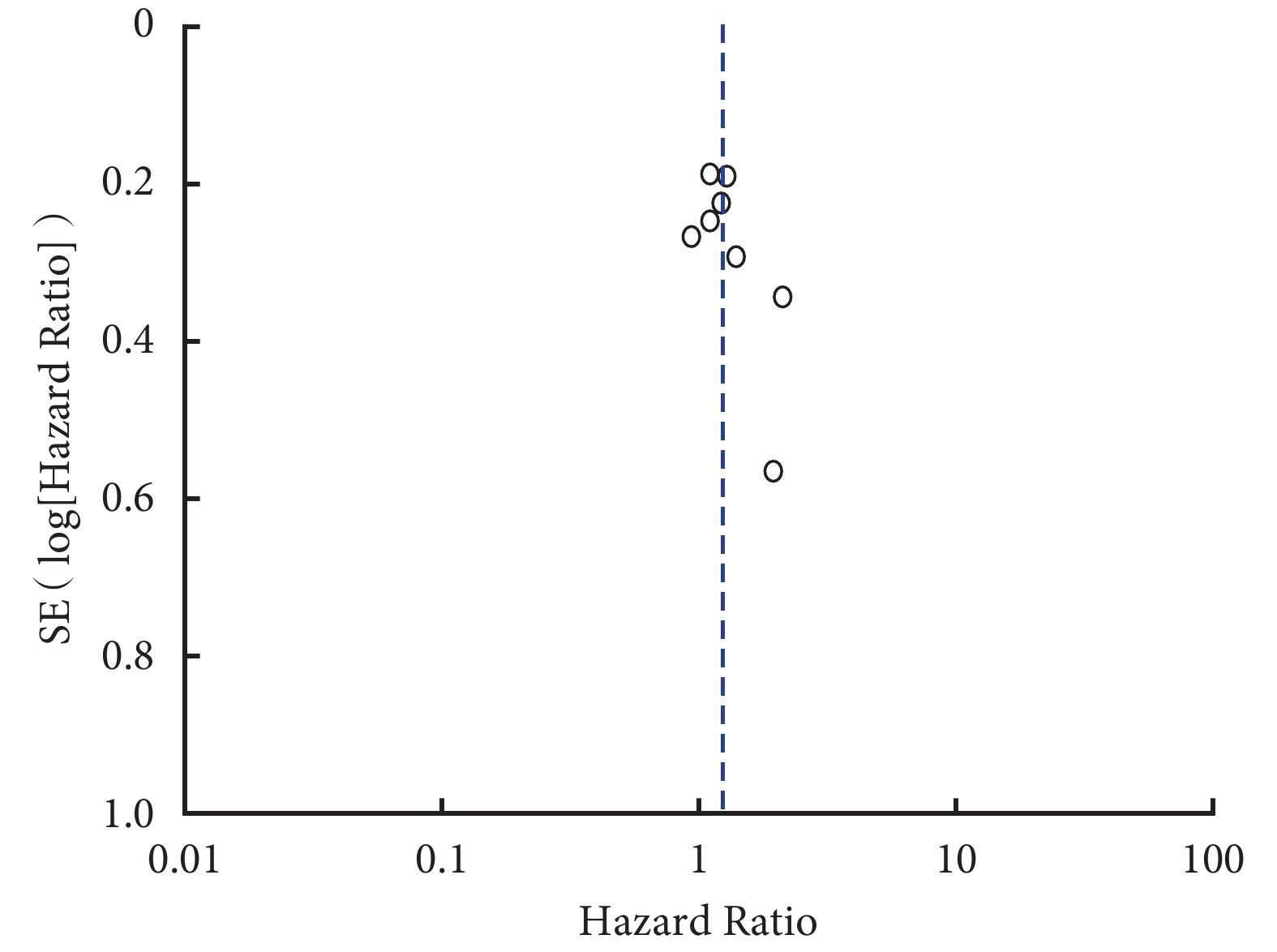
對 Meta 分析合并采用的固定效應模型和隨機效應模型切換進行敏感性分析,其結果顯示 Meta 分析結果穩定。pSTAT3 過表達與肺癌總生存率相關性的漏斗圖結果顯示,各研究在漏斗圖兩側的分布不完全對稱,提示可能存在發表偏倚(圖 6)。
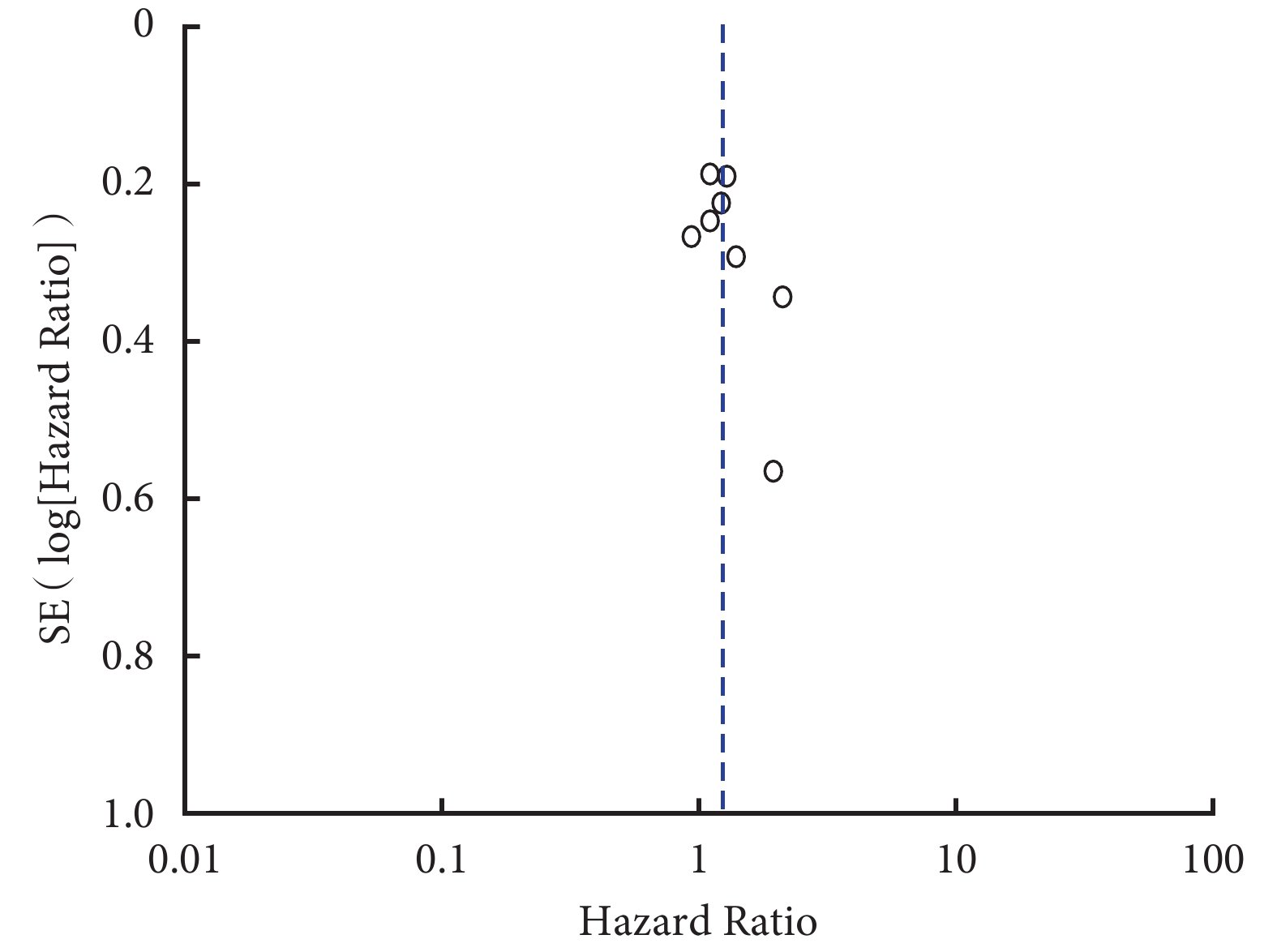 圖6
pSTAT3 過表達與肺癌總生存率的漏斗圖結果
圖6
pSTAT3 過表達與肺癌總生存率的漏斗圖結果
3 討論
1986 年 Mountain 第一次提出 TNM 分期[36],這一分期標準經過多次修訂已被美國癌癥聯合委員會和工會國際癌癥中心采用,并沿用至今。而后研究發現,具有相同 TNM 分期的肺癌患者,預后也有一定差異。近些年,許多學者發現一些分子標志物與肺癌預后有一定的相關性,如 Koh 等[37]研究發現 PD-1 高表達的肺癌患者,總生存期及無進展生存期明顯短于低表達組;Wang 等[38]也發現肺癌患者中 miR-133a 低表達組的預后更差,包括較高淋巴結轉移率及較差的 TNM 分期。而更多的研究觀察到 pSTAT3 過表達與惡性腫瘤預后具有不同的相關性。其中發現,pSTAT3 過表達與實體瘤[39]、消化道腫瘤[40]、胃癌[41]、結直腸癌[42]、肺癌[21]預后不良有關。但 Kong 等[43]的 Meta 分析結果卻與之相反。因此,到目前為止,pSTAT3 過表達與腫瘤預后的相關性尚未達成統一定論。
1999 年,Golob 等[44]發現 p38MAP 激酶可完全抑制 pSTAT3 表達。還有一些研究表明,通過抑制細胞核外 STAT3 磷酸化以及 pSTAT3 介導的 DNA 轉錄和復制可抑制腫瘤細胞生長、促進凋亡或者抑制轉移[45, 46]。Shou 等[47]也發現,在使用 EGFR-TKI 治療的肺癌患者中,pSTAT3 過表達組的 PFS 明顯縮短(9 月 vs. 26 月,P<0.05)。目前,國際上正在開展多項關于 pSTAT3 抑制劑治療腫瘤的 Ⅰ 期臨床試驗(https://clinicaltrials.gov/)。因此我們進行 pSTAT3 過表達與肺癌預后相關性的 Meta 分析可能具有部分引導作用。
本 Meta 分析在 Xu 等[21]的研究基礎上,新增 3 個陰性研究結果[22, 24, 30],最終結果顯示,pSTAT3 過表達與肺癌患者總生存率具有相關性[HR=1.23,95%CI(1.04,1.46),P=0.02]。在其他預后特征方面,pSTAT3 過表達僅與 TNM 分期及淋巴結轉移有關,而與分化程度無明顯相關性。該研究結果顯示 pSTAT3 過表達可能是肺癌患者的不良預后因素。
我們的研究也存在一定的局限性:① 不同研究對 pSTAT3 過表達定義不同。② pSTAT3 檢測方法單一,僅限定為 IHC 檢測。③ pSTAT3 表達情況不甚明了,大部分研究檢測了細胞核 pSTAT3 表達,另一些未明確描述。研究表明細胞質內少量的 pSTAT3 會干擾檢測結果。④ 對于未提供具體數據者,通過 K-M 曲線提取可能會與真實數據之間存在差異。⑤ 納入的部分研究樣本量較小,可能檢驗效能不足。
綜上所述,pSTAT3 過表達的肺癌患者總生存率較差,且有較差的 TNM 分期及較高的淋巴結轉移率,可能是預后不良的指征。受納入研究質量和數量的限制,上述結果尚需開展大規格高質量的研究予以驗證。
2012 年全球統計數據顯示,腫瘤發病人數由 2008 年 1 600 萬人上升至 1 800 萬人。肺癌作為最常見的惡性腫瘤之一,其發病率約為 13%,死亡率高達 80%,5 年生存率僅為 17.7%,是全球發病率第二,死亡率高居首位的惡性腫瘤[1-3]。因我國特殊的居住環境和生活習慣[4-6],中國肺癌發生率和死亡率均高于全球平均值[7]。目前,隨著肺癌診療技術的突破,肺癌 5 年生存率已提高了 7.3%,對于早期肺癌患者,5 年生存率可達 55.2%,然而超過一半的肺癌患者在確診時已處于進展期[3]。近些年,許多研究者致力于分子預測指標的研究,以發現其與肺癌預后的相關性和尋找潛在的治療靶點。目前國外已推廣的 gene panel 和 cell cycle progression 正在進行大規模的隨機對照試驗(randomized controlled trial,RCT)以尋找有效的分子預測指標[8]。肺癌作為高發病率和高致死率的惡性腫瘤,發現并識別重要的分子預測指標是目前迫切的需要。
信號轉導及轉錄活化因子(signal transducer and activator of transcription,STAT)是細胞質轉錄因子的一個家族,包括 7 個成員,分別為 STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b 和 STAT6[9],其中認為 STAT3 的異常活化與腫瘤的形成關系密切[10, 11]。STAT3 在細胞內主要有兩種活化形式,一種是形成二聚體(SH2),穩定的二聚體形式使 STAT3 在細胞內不易被降解[12];二是通過活化間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、生長因子受體(growth factor receptor),包括表皮生長因子受體(epidermal growth factor receptor,EGFR),血小板源性生長因子受體(platelet derived growth factor,PDGF)等,進而激活 Janus 激酶(Janus kinases,JAK)使 STAT3 轉變成磷酸化 STAT3(pSTAT3),從而促進腫瘤細胞生存、遠處轉移、產生耐藥或抑制細胞凋亡[13-17]。已有研究顯示,pSTAT3 過表達與胃癌[18]、結直腸癌[19]、胰腺癌[20]和肺癌[21]等多種惡性腫瘤預后不良有關,但結論不盡相同[22-24]。其與肺癌的相關性值得進一步研究,因此,我們采用 Meta 分析方法研究 pSTAT3 過表達與肺癌的相關性。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型 隊列研究和橫斷面研究。
1.1.2 研究對象 病理明確診斷為肺癌的患者。
1.1.3 暴露因素 pSTAT3 表達情況,結果判讀根據原始文獻臨界值區分。pSTAT3 檢測方法為免疫組織化學染色法(IHC)。
1.1.4 結局指標 pSTAT3 過表達與肺癌患者總生存率及臨床預后特征(TNM 分期、淋巴結轉移和分化程度)的相關性。
1.1.5 排除標準 ① 非中、英文文獻;② 只有摘要而無法獲取全文的文獻;③ 資料、數據錯誤或不全,聯系作者無果的研究;④ 無法提取數據的文獻;⑤ 來自同一人群的不同研究報告,只納入數據最全、最新的報道。
1.2 文獻檢索策略
計算機檢索 PubMed、EMbase、Web of Science、CNKI、VIP 和 WanFang Data 等數據庫,搜集公開發表的關于 pSTAT3 過表達與肺癌預后相關性的研究,檢索時限為建庫至 2016 年 11 月。同時,追溯納入研究的參考文獻,以補充獲取相關文獻。中文檢索詞包括:pSTAT3、磷酸化、STAT3 和肺癌等。英文檢索詞包括:lung cancer、STAT3、pSTAT3、signal transducer and activator of transcription 3 和 phosphoralated signal transducer and activator of transcription 3 等。以 PubMed 為例,具體檢索策略見框 1。

1.3 文獻篩選和資料提取
由兩位研究者獨立篩選文獻、提取資料并交叉核對,如遇分歧,則討論解決或交由第三位研究者決定。對文獻中不清楚或未提供的資料,采用電子郵件與主要作者聯系并獲取確切數據信息,若未獲回復,作為資料缺失處理。資料提取內容主要包括:① 納入研究的基本信息:第一作者、發表時間等;② 研究對象的基線特征,包括年齡、性別、隨訪時間、TNM 分期、淋巴結轉移及分化程度情況等;③ 偏倚風險評價的關鍵要素;④ 所關注的結局指標。
1.4 納入研究的偏倚風險評價
納入隊列研究的偏倚風險采用 NOS 量表(Newcastle-Ottawa scale)[25]進行評價,納入橫斷面研究的偏倚風險采用 AHRQ 量表(Agency for Heathcare Research and Quality)評價。
1.5 統計分析
采用 RevMan 5.2 軟件進行 Meta 分析,以風險比(HR)及其 95% 可信區間(CI)為生存率的效應分析統計量。如文獻中給出具體數據,直接提取;如文獻中只提供 K-M 生存曲線(Kaplan-Meier 生存曲線),則通過 Engauge Digitizer version 4.1 軟件(http://sourceforge.net/projects/digitizer)及 Jayne F Tierney 表(http://www.biomedcentral.com/content/ supplementary/1745-6215-8-16-S1.xls)計算。以比值比(OR)及其 95%CI 為肺癌預后特征的效應分析統計量。納入研究結果間的異質性采用卡方檢驗進行分析(檢驗水準為 α=0.1),并結合 I2判斷異質性的大小。若各研究間無統計學異質性(P>0.10,I2<50%),則采用固定效應模型進行合并分析;若各研究間有統計學異質性(P<0.10,I2>50%),在排除明顯臨床異質性的影響后,采用隨機效應模型進行合并分析,明顯的臨床異質性采用亞組分析方法進行處理。檢驗水準為 α=0.05。
2 結果
2.1 文獻篩選流程及結果
初檢共獲得相關文獻 1 411 篇,經逐層篩選后,最終納入 13 個研究[15, 22, 24, 26-35]。文獻篩選流程及結果見圖 1。
 圖1
文獻篩選流程及結果 *所檢索的數據庫及檢出文獻數具體如下:EMbase(n=229)、PubMed(n=589)、Web of Science(n=553)、CNKI(n=8)、VIP(n=4)、WanFang Data(n=28)
圖1
文獻篩選流程及結果 *所檢索的數據庫及檢出文獻數具體如下:EMbase(n=229)、PubMed(n=589)、Web of Science(n=553)、CNKI(n=8)、VIP(n=4)、WanFang Data(n=28)
2.2 納入研究的基本特征
見表 1。
2.3 納入研究的偏倚風險評價結果
2.4 Meta分析結果
2.4.1 pSTAT3 過表達與肺癌患者總生存率 共納入 8 個研究[15, 22, 24, 26-30]。固定效應模型 Meta 分析結果顯示,肺癌 pSTAT3 過表達組總生存率明顯低于 pSTAT3 低表達組,兩組差異有統計學意義[HR=1.23,95%CI(1.04,1.46),P=0.02](圖 2)。
 圖2
pSTAT3 過表達與肺癌總生存率的 Meta 分析
圖2
pSTAT3 過表達與肺癌總生存率的 Meta 分析
2.4.2 pSTAT3 過表達與肺癌患者預后特征
2.4.2.1 TNM 分期 共納入 9 個研究[22, 24, 26, 27, 30-34],包括 1 264 例肺癌患者,其中 Ⅰ~Ⅱ 期 883 例,Ⅲ~Ⅳ 期 381 例。隨機效應模型 Meta 分析結果顯示,肺癌 Ⅲ~Ⅳ 期組 pSTAT3 過表達陽性率明顯高于 Ⅰ~Ⅱ 期組,其差異有統計學意義[OR=1.92,95%CI(1.13,3.27),P=0.02](圖 3)。
 圖3
pSTAT3 過表達與肺癌 TNM 分期的 Meta 分析
圖3
pSTAT3 過表達與肺癌 TNM 分期的 Meta 分析
2.4.2.2 淋巴結轉移 共納入 7 個研究[22, 24, 27, 30, 31, 33, 35],包括 907 例肺癌患者,其中無淋巴結轉移 443 例,有淋巴結轉移 464 例。隨機效應模型 Meta 分析結果顯示,肺癌伴淋巴結轉移組 pSTAT3 陽性率明顯高于不伴淋巴結轉移組,其差異有統計學意義[OR=1.81,95%CI(1.20,2.72),P=0.004](圖 4)。
 圖4
pSTAT3 過表達與肺癌淋巴結轉移的 Meta 分析
圖4
pSTAT3 過表達與肺癌淋巴結轉移的 Meta 分析
2.4.2.3 肺癌分化程度 共納入 7 個研究[24, 27, 30, 31, 33-35],包括 822 例肺癌患者,其中高中分化 476 例,低分化 346 例。隨機效應模型 Meta 分析結果顯示,兩組差異無統計學意義[OR=0.82,95%CI(0.44,1.53),P=0.54](圖 5)。
 圖5
pSTAT3 過表達與肺癌分化程度的 Meta 分析
圖5
pSTAT3 過表達與肺癌分化程度的 Meta 分析
2.5 敏感性分析和發表偏倚
對 Meta 分析合并采用的固定效應模型和隨機效應模型切換進行敏感性分析,其結果顯示 Meta 分析結果穩定。pSTAT3 過表達與肺癌總生存率相關性的漏斗圖結果顯示,各研究在漏斗圖兩側的分布不完全對稱,提示可能存在發表偏倚(圖 6)。
 圖6
pSTAT3 過表達與肺癌總生存率的漏斗圖結果
圖6
pSTAT3 過表達與肺癌總生存率的漏斗圖結果
3 討論
1986 年 Mountain 第一次提出 TNM 分期[36],這一分期標準經過多次修訂已被美國癌癥聯合委員會和工會國際癌癥中心采用,并沿用至今。而后研究發現,具有相同 TNM 分期的肺癌患者,預后也有一定差異。近些年,許多學者發現一些分子標志物與肺癌預后有一定的相關性,如 Koh 等[37]研究發現 PD-1 高表達的肺癌患者,總生存期及無進展生存期明顯短于低表達組;Wang 等[38]也發現肺癌患者中 miR-133a 低表達組的預后更差,包括較高淋巴結轉移率及較差的 TNM 分期。而更多的研究觀察到 pSTAT3 過表達與惡性腫瘤預后具有不同的相關性。其中發現,pSTAT3 過表達與實體瘤[39]、消化道腫瘤[40]、胃癌[41]、結直腸癌[42]、肺癌[21]預后不良有關。但 Kong 等[43]的 Meta 分析結果卻與之相反。因此,到目前為止,pSTAT3 過表達與腫瘤預后的相關性尚未達成統一定論。
1999 年,Golob 等[44]發現 p38MAP 激酶可完全抑制 pSTAT3 表達。還有一些研究表明,通過抑制細胞核外 STAT3 磷酸化以及 pSTAT3 介導的 DNA 轉錄和復制可抑制腫瘤細胞生長、促進凋亡或者抑制轉移[45, 46]。Shou 等[47]也發現,在使用 EGFR-TKI 治療的肺癌患者中,pSTAT3 過表達組的 PFS 明顯縮短(9 月 vs. 26 月,P<0.05)。目前,國際上正在開展多項關于 pSTAT3 抑制劑治療腫瘤的 Ⅰ 期臨床試驗(https://clinicaltrials.gov/)。因此我們進行 pSTAT3 過表達與肺癌預后相關性的 Meta 分析可能具有部分引導作用。
本 Meta 分析在 Xu 等[21]的研究基礎上,新增 3 個陰性研究結果[22, 24, 30],最終結果顯示,pSTAT3 過表達與肺癌患者總生存率具有相關性[HR=1.23,95%CI(1.04,1.46),P=0.02]。在其他預后特征方面,pSTAT3 過表達僅與 TNM 分期及淋巴結轉移有關,而與分化程度無明顯相關性。該研究結果顯示 pSTAT3 過表達可能是肺癌患者的不良預后因素。
我們的研究也存在一定的局限性:① 不同研究對 pSTAT3 過表達定義不同。② pSTAT3 檢測方法單一,僅限定為 IHC 檢測。③ pSTAT3 表達情況不甚明了,大部分研究檢測了細胞核 pSTAT3 表達,另一些未明確描述。研究表明細胞質內少量的 pSTAT3 會干擾檢測結果。④ 對于未提供具體數據者,通過 K-M 曲線提取可能會與真實數據之間存在差異。⑤ 納入的部分研究樣本量較小,可能檢驗效能不足。
綜上所述,pSTAT3 過表達的肺癌患者總生存率較差,且有較差的 TNM 分期及較高的淋巴結轉移率,可能是預后不良的指征。受納入研究質量和數量的限制,上述結果尚需開展大規格高質量的研究予以驗證。