引用本文: 熊巧華, 陳思超, 張文杰, 朱家永, 張冉, 翁鴻, 曾憲濤. HIST1H1B 在膀胱癌中的表達及其臨床意義. 中國循證醫學雜志, 2020, 20(7): 845-850. doi: 10.7507/1672-2531.201905028 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
膀胱癌是我國泌尿系統最常見的惡性腫瘤之一。據 2018 年美國癌癥統計數據顯示,膀胱癌將成為世界第六大常見腫瘤[1]。按照腫瘤浸潤膀胱壁的深度,膀胱癌可分為非肌層浸潤性膀胱癌(non muscle-invasive bladder cancer,NMIBC)和肌層浸潤性膀胱癌(muscle-invasive bladder cancer,MIBC)[2],其中 MIBC 具有較高死亡率。有研究表明吸煙、飲酒、有毒物質等職業暴露、慢性尿路感染、血吸蟲病感染、家族史及特定的生殖細胞遺傳易感性等因素均可誘發膀胱癌[3-5]。在我國,城市人口的膀胱癌發病率和死亡率均高于農村人口,男性膀胱癌發病率和死亡率高于女性。
H1 組蛋白是高等真核生物中染色質纖維的主要結構成分。有研究表明[6-9],它們可穩定緊密的高階染色質結構,并調節基于染色質的過程,如轉錄、DNA 修復和復制。H1 蛋白包含 11 種不同的同工酶[10],對應有 11 種基因變體,HIST1H1B 是 11 種組蛋白 H1 基因變體中的 1 種。除 H1(0)基因外,所有已知的人類 H1 組蛋白基因都聚集在 6 號染色體上。HIST1H1B 又名 H1.5、H1、H1B、H1F,存在于染色體 6p22~p21.3 上的小組蛋白基因簇中,無內含子,編碼復制依賴性組蛋白。HIST1H1B 已經報道其在前列腺癌[11]、乳腺癌[12]和肺神經內分泌癌[13]中可作為良好的診斷和預后標志物;另外該蛋白和早幼粒細胞白血病鋅指(PLZF)蛋白組合可用于平滑肌肉瘤[14]、卵巢濾泡顆粒細胞瘤[15]的診斷。但對于 HIST1H1B 與膀胱癌的發生發展相關性的研究較少,本文利用基因表達公共數據庫(gene expression omnibus,GEO)中與膀胱癌有關的數據簡要探討 HIST1H1B 與膀胱癌的臨床病理特征和預后之間的關系。
1 資料與方法
1.1 數據來源
GSE13507 是 NCBI(http://www.ncbi.nlm.nih.gov/geo)GEO 數據庫中的一個基因表達矩陣。數據集 GSE13507 使用了 Illumina 公司的 Illumina human-6 v2.0 expression beadchip 基因表達芯片,包含了 165 例原發性膀胱癌和 68 例正常膀胱組織(其中包括癌旁組織)的基因表達譜及患者性別、年齡、TNM 分期等臨床信息。在 GSE13507 中,HIST1H1B基因對應的探針為 ILMN_1653251。
1.2 臨床相關性研究
利用 GSE13507 中膀胱癌患者信息,以基因表達量的中位數為依據進行分組,表達量在中位數以下的為 HIST1H1B 低表達組,中位數以上的(含中位數)為 HIST1H1B 高表達組,據此分組進行生存分析和臨床病理特征分析。
1.3 富集分析
利用 GSEA 3.0 進行基因集富集分析(gene set enrichment analysis,GSEA)。以 GSEA 網站 MsigDB 數據庫中的 hallmark 基因集為參照基因集,利用默認加權富集統計方法,單次分析置換次數為 1 000 次,初步探究 HIST1H1B 基因對膀胱癌的可能作用機制。
1.4 統計分析
利用 SPSS 20.0 軟件對數據進行統計分析,采用 GraphPad Prism 5 作圖。設定 P<0.05 時為差異有統計學意義。采用兩個樣本的獨立t檢驗進行差異分析,利用 Log-rank 算法進行生存分析,利用卡方檢驗分析 HIST1H1B 表達與臨床病理特征的相關性。基因富集分析時以 P<0.05、FDR(false discovery rates)<0.25 為標準為顯著富集基因集標準。
2 結果
2.1 HIST1H1B 在膀胱癌組織和正常組織中的表達情況
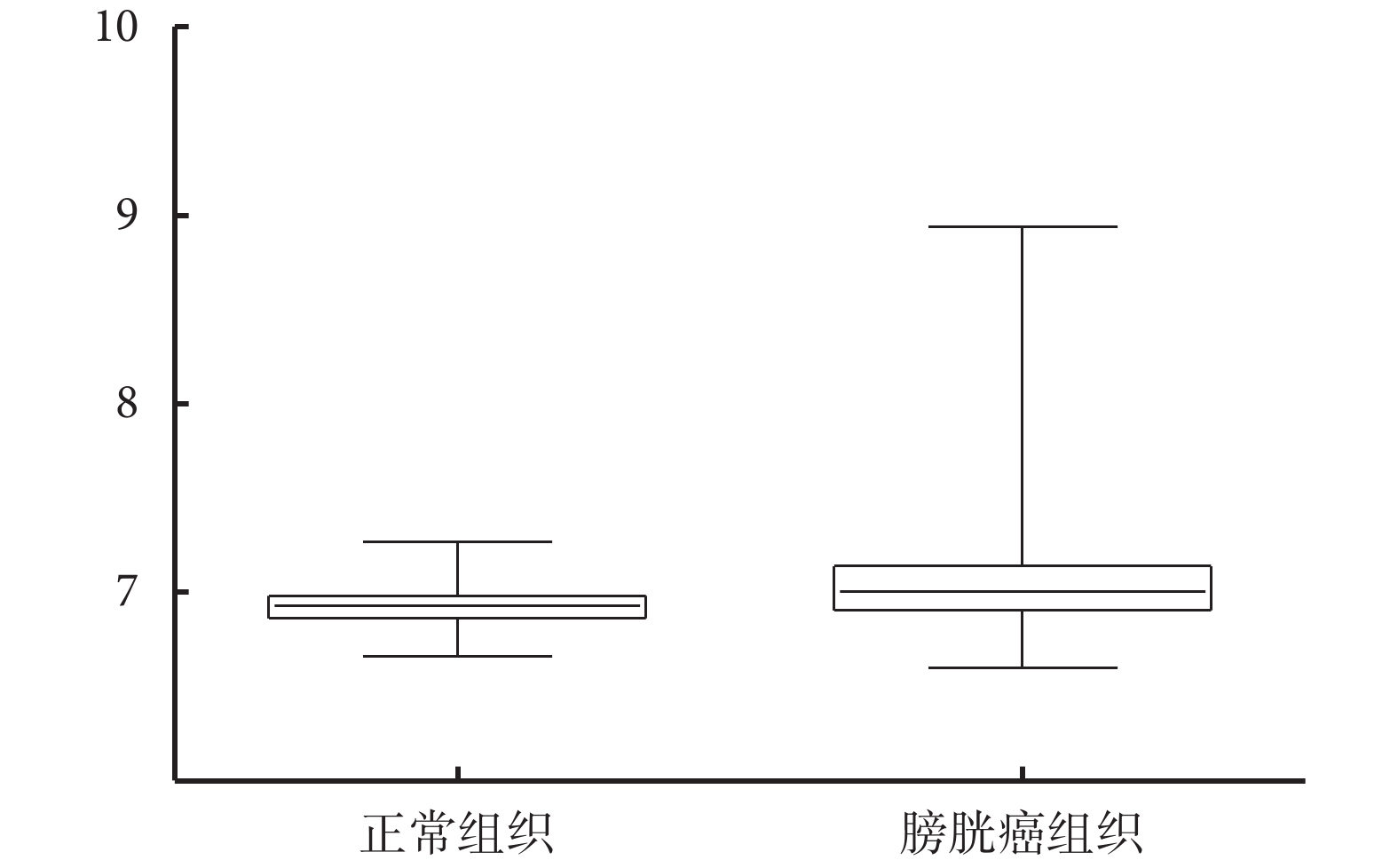
HIST1H1B 在正常組織中的表達水平為 6.929±0.014 39(n=68),在膀胱癌組織中的表達水平為 7.086±0.023 97(n=165),HIST1H1B 在正常組織中的表達量顯著低于在膀胱癌組織中的表達量(P=0.002 5)(圖 1)。
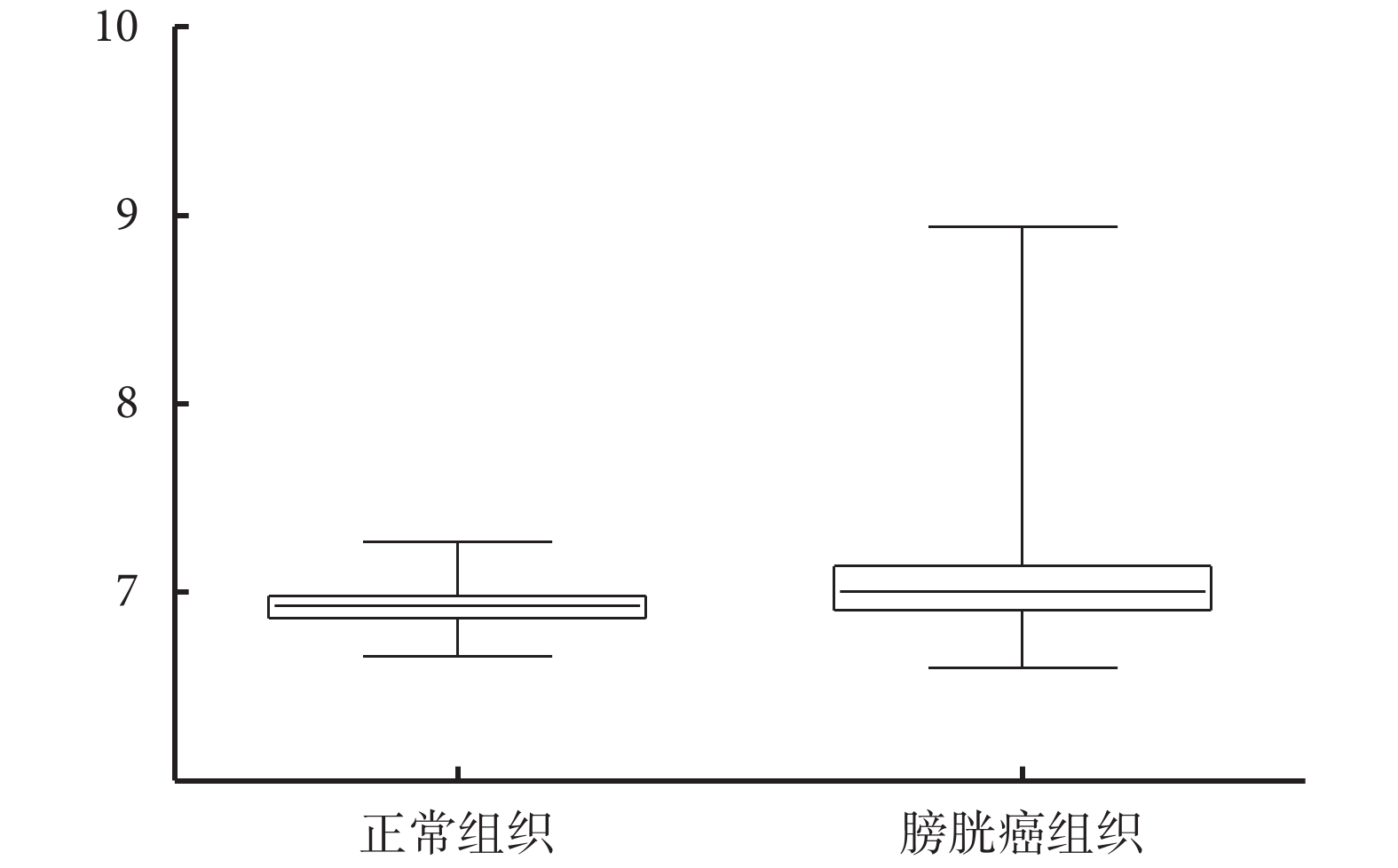 圖1
HIST1H1B 在膀胱癌組織和正常組織中的表達水平
圖1
HIST1H1B 在膀胱癌組織和正常組織中的表達水平
2.2 HIST1H1B 與臨床病理特征
膀胱癌患者中 HIST1H1B 高、低表達組在年齡(P=0.007)、性別、T 分期、M 分期、N 分期、疾病分期(P<0.001)方面均具有顯著差異,而兩組在侵襲性、和進展是否的差異均沒有統計學意義(表 1)。
2.3 HIST1H1B 與膀胱癌預后的相關性分析
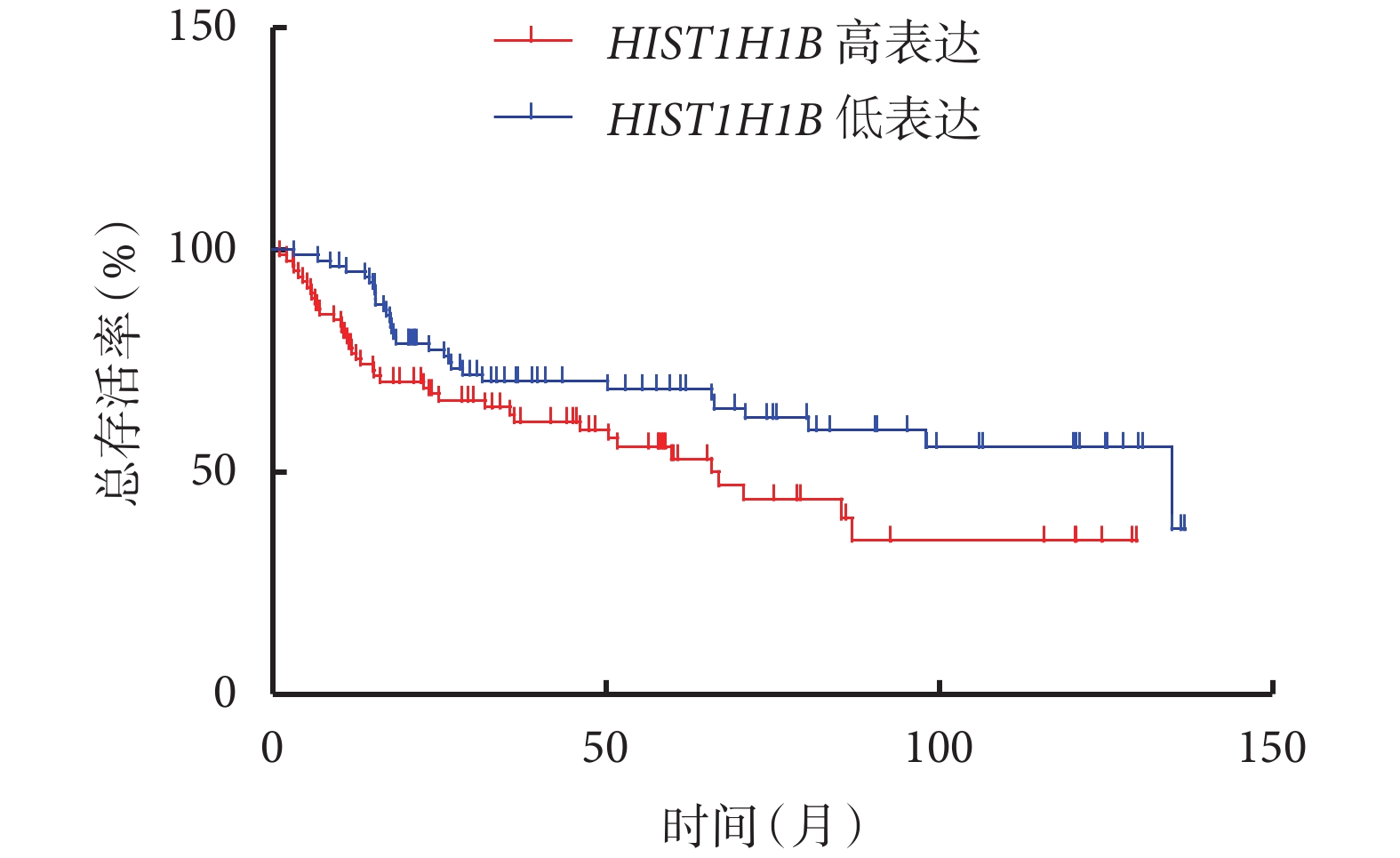
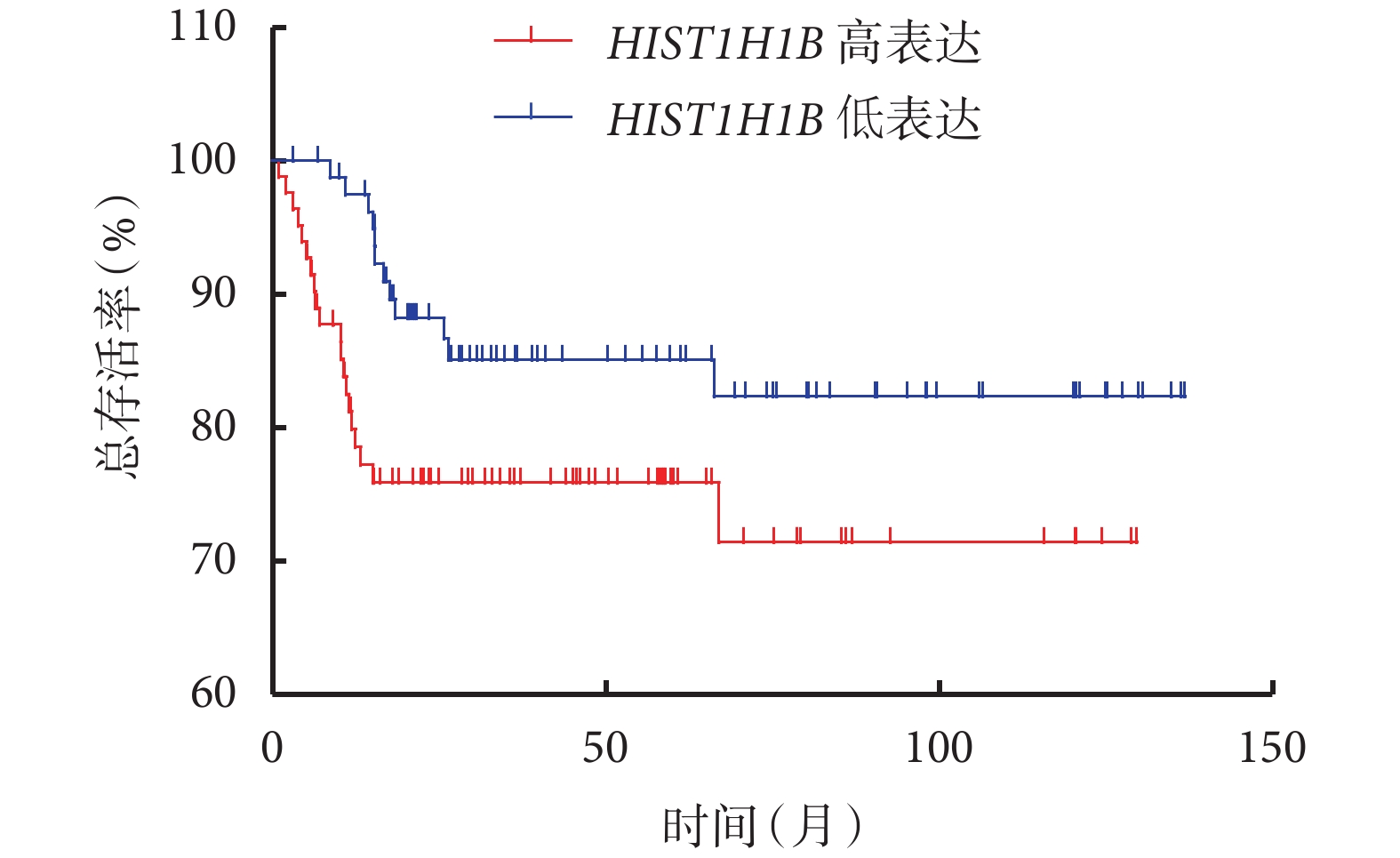
對總生存結局和腫瘤患者的特異性生存結局進行分析,結果顯示,HIST1H1B 表達水平高的患者和表達水平低的患者的總生存率分別為 34.652% 和 37.154%[Log-rank=4.999,P=0.025 4,HR=1.732,95%CI(1.070,2.803)],特異性生存率分別為 71.431% 和 82.346%[Log-rank=3.792,P=0.020 1,HR=2.000,95%CI(0.996,4.017)],分別見圖 2、圖 3。
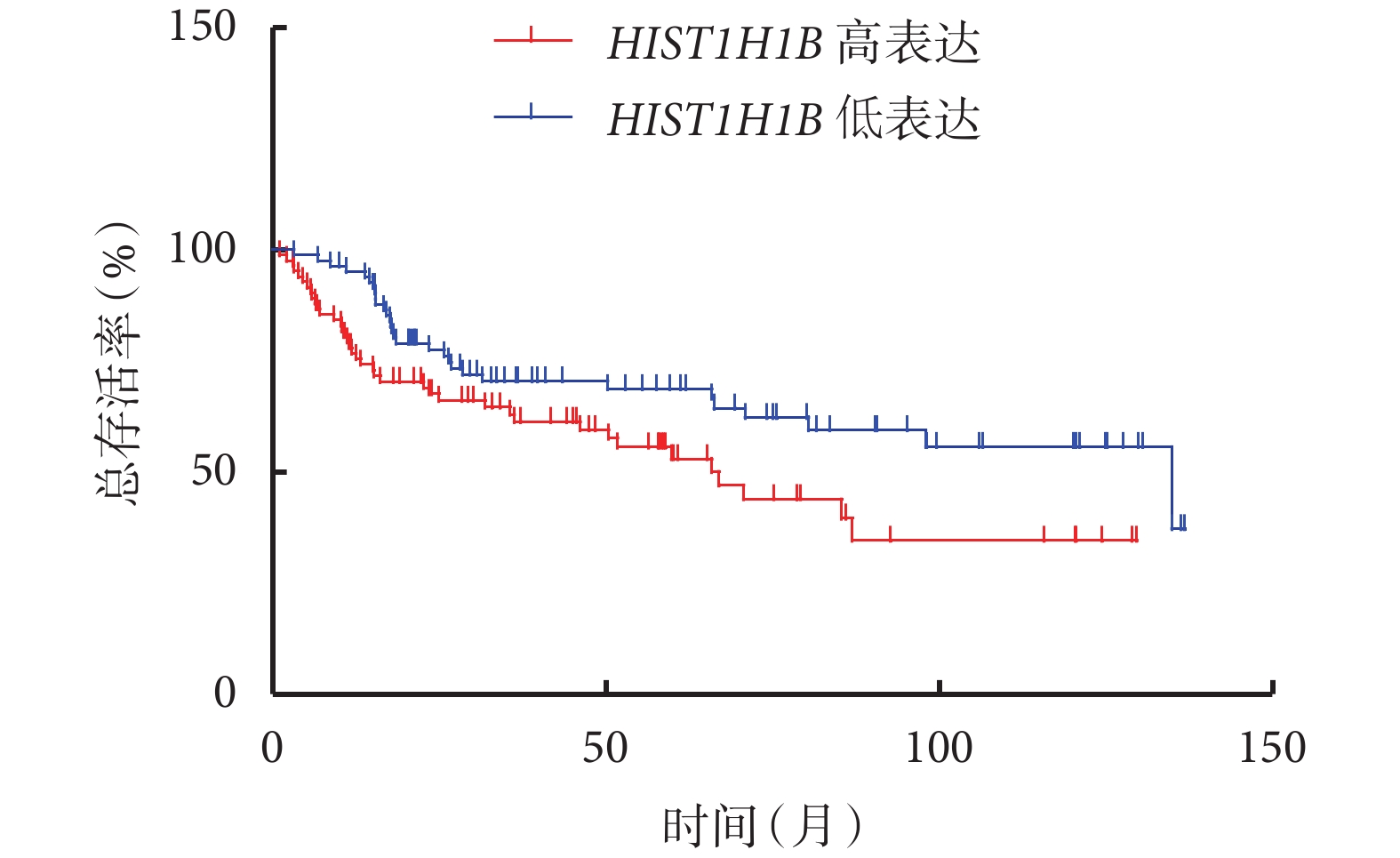 圖2
HIST1H1B 表達水平高的患者和表達水平低的患者總生存期曲線
圖2
HIST1H1B 表達水平高的患者和表達水平低的患者總生存期曲線
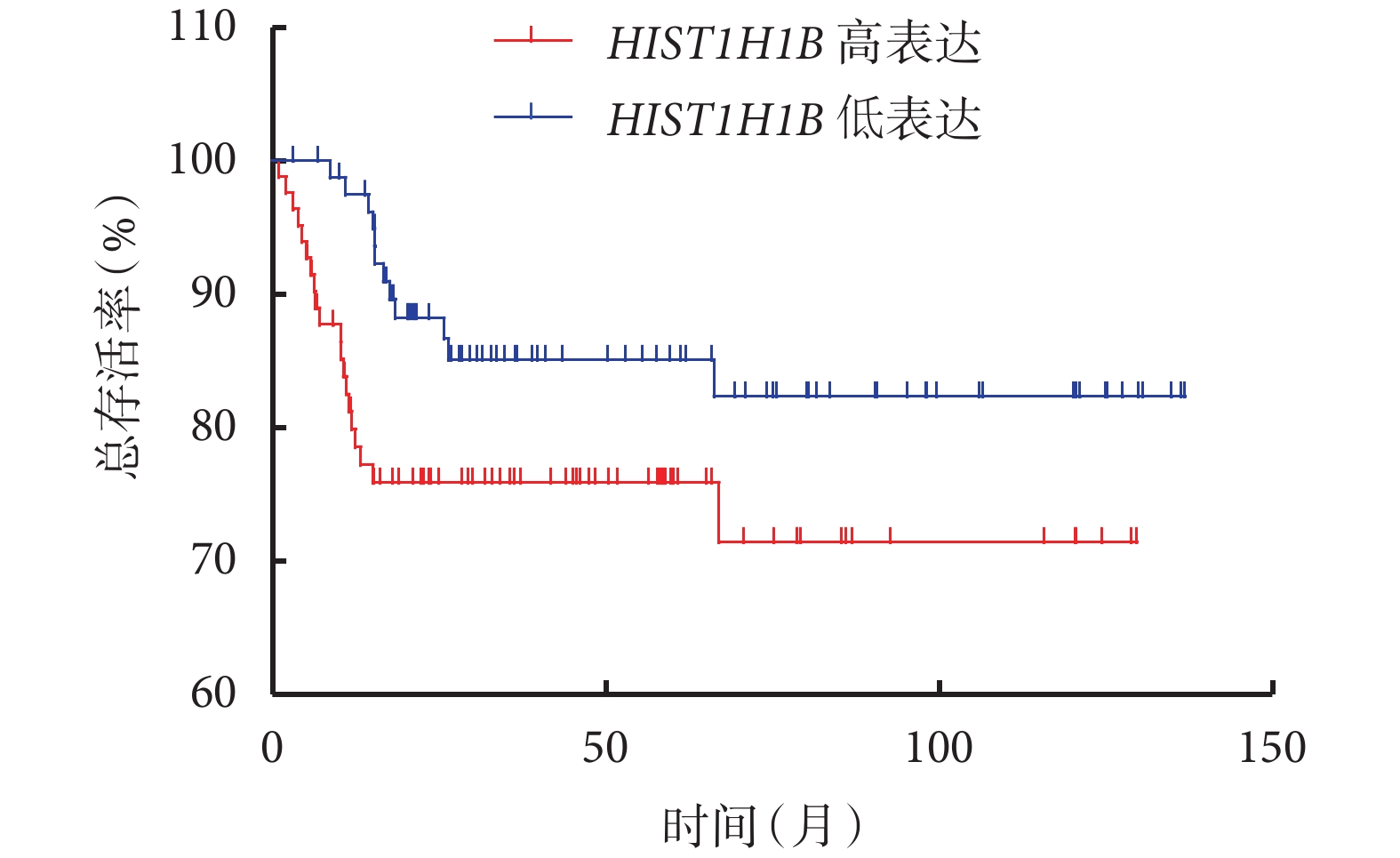 圖3
HIST1H1B 表達水平高的患者和表達水平低的患者特異性生存曲線
圖3
HIST1H1B 表達水平高的患者和表達水平低的患者特異性生存曲線
2.4 HIST1H1B 基因高表達的基因富集分析
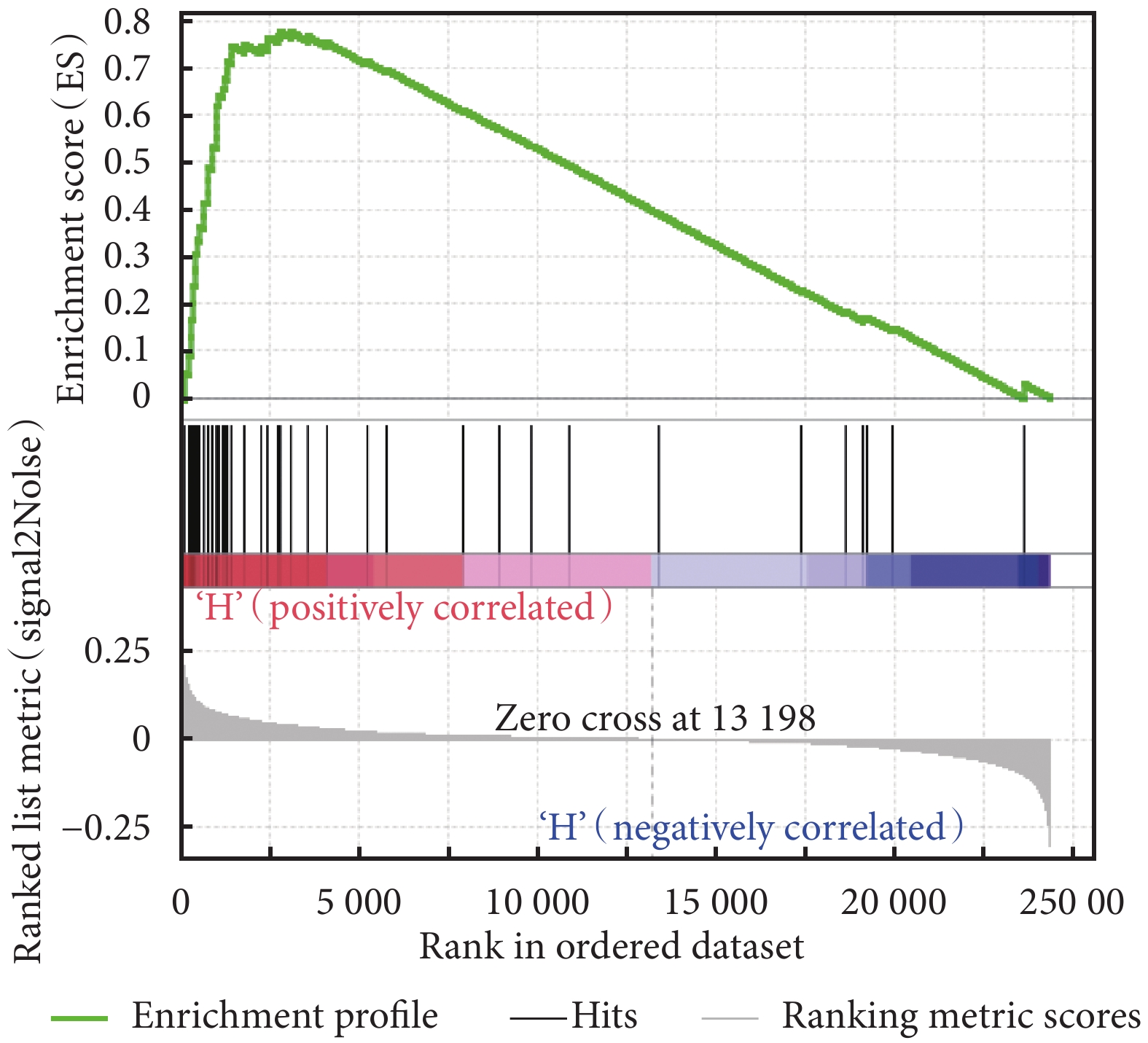
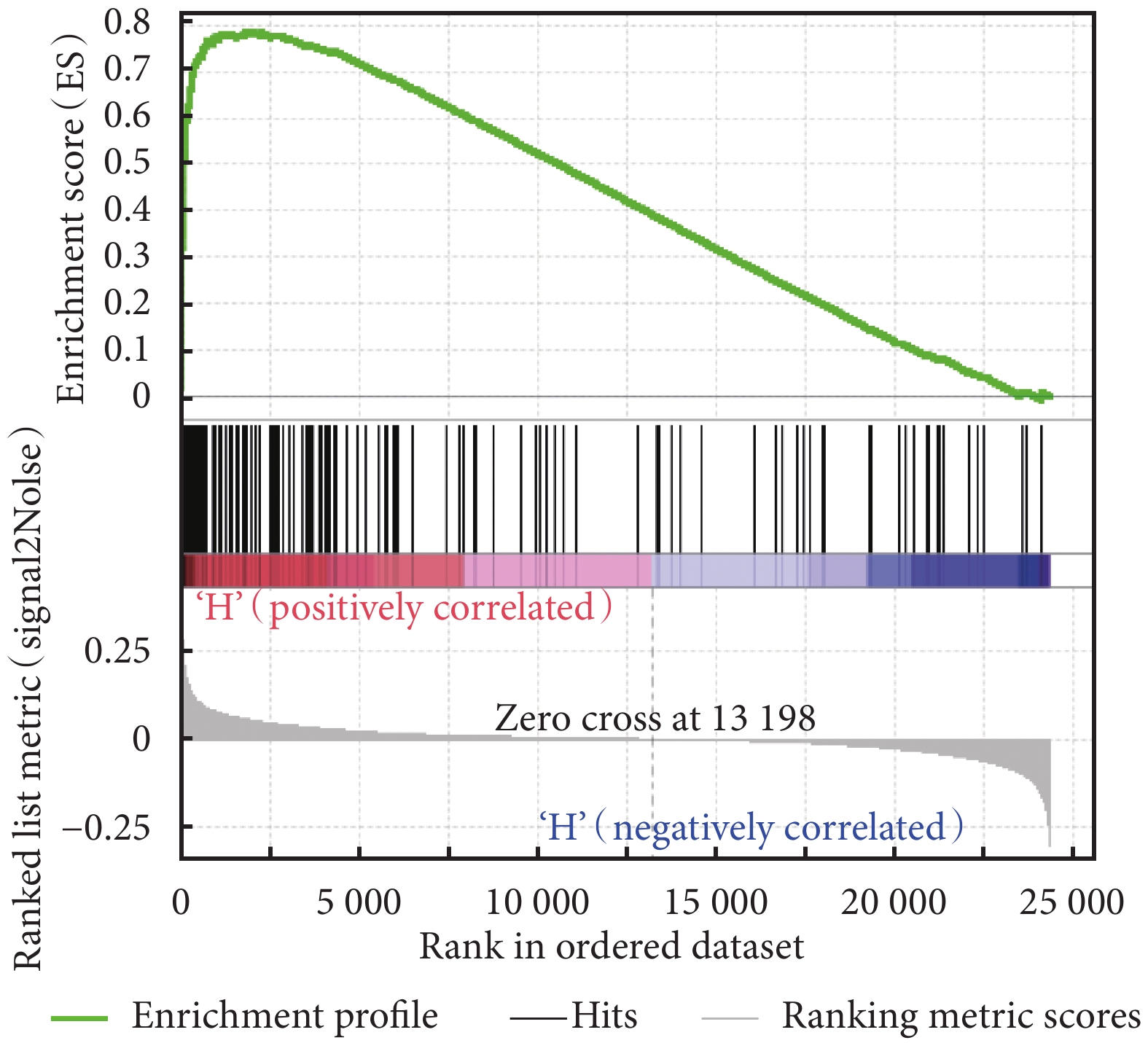
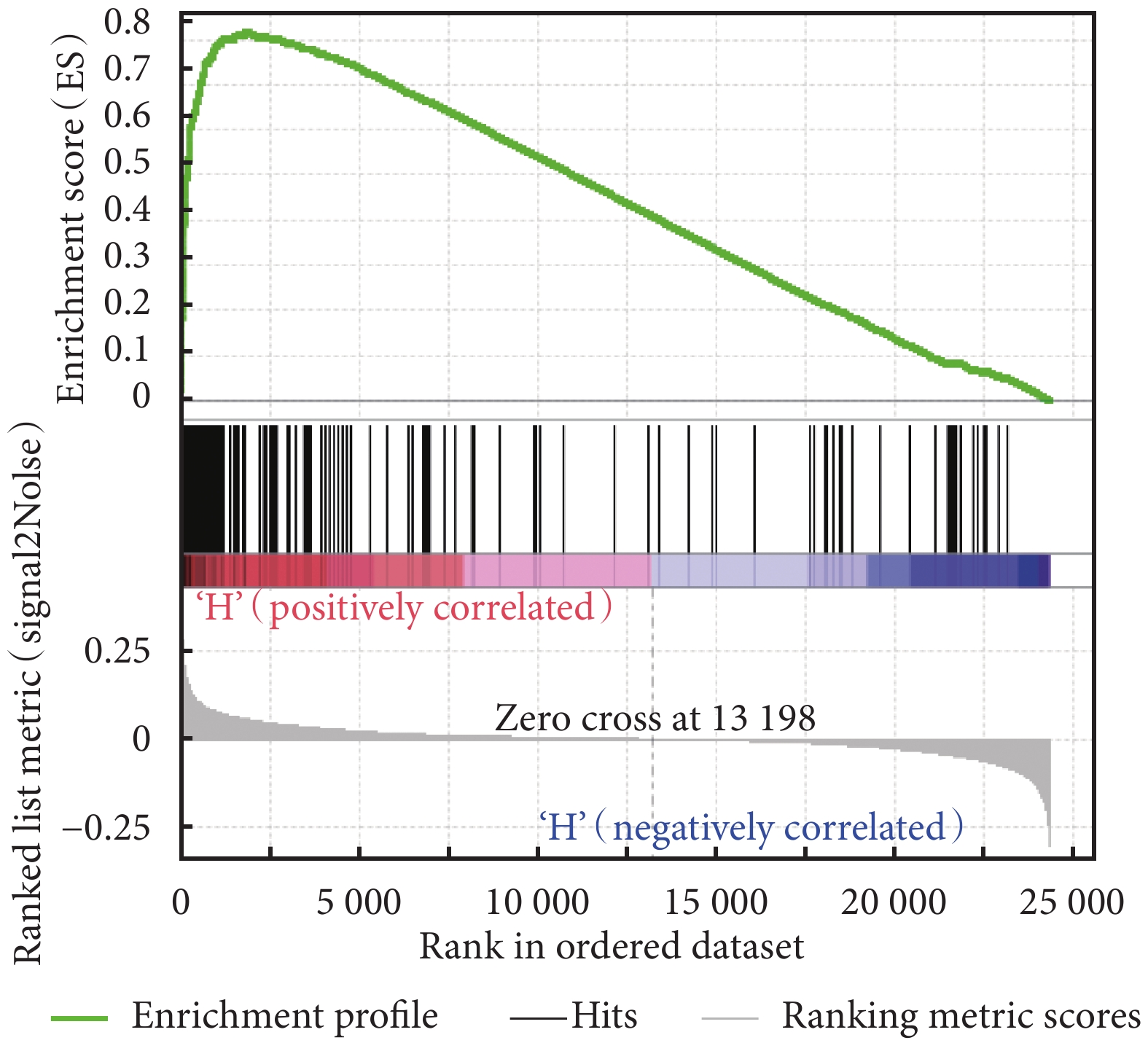
利用 GSEA 富集分析了 HIST1H1B 基因對膀胱癌患者體內的生物通路基因集,結果見表 2。MYC 信號通路 V2、G2M 檢查點、E2F 信號通路富集結果見圖 4~圖 6。表 2 結果提示我們 HIST1H1B 基因可能通過影響 MYC 信號通路 V2、G2M 檢查點、E2F 信號通路、精子發生、有絲分裂紡錘體有關的基因集來調控膀胱癌的發生及進展。
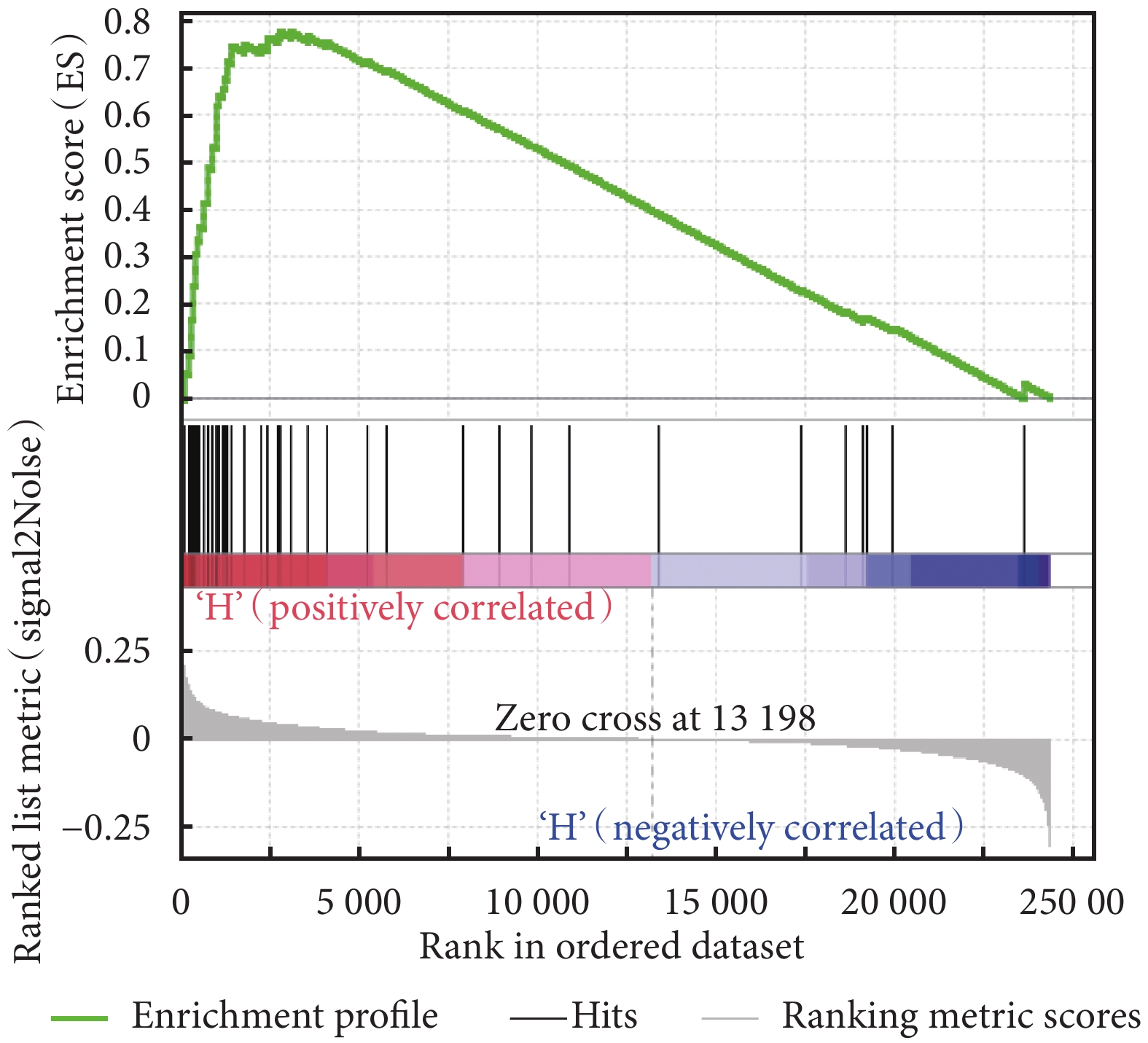 圖4
HIST1H1B 高表達的膀胱癌樣本基因 MYC 信號通路 V2 富集結果
圖4
HIST1H1B 高表達的膀胱癌樣本基因 MYC 信號通路 V2 富集結果
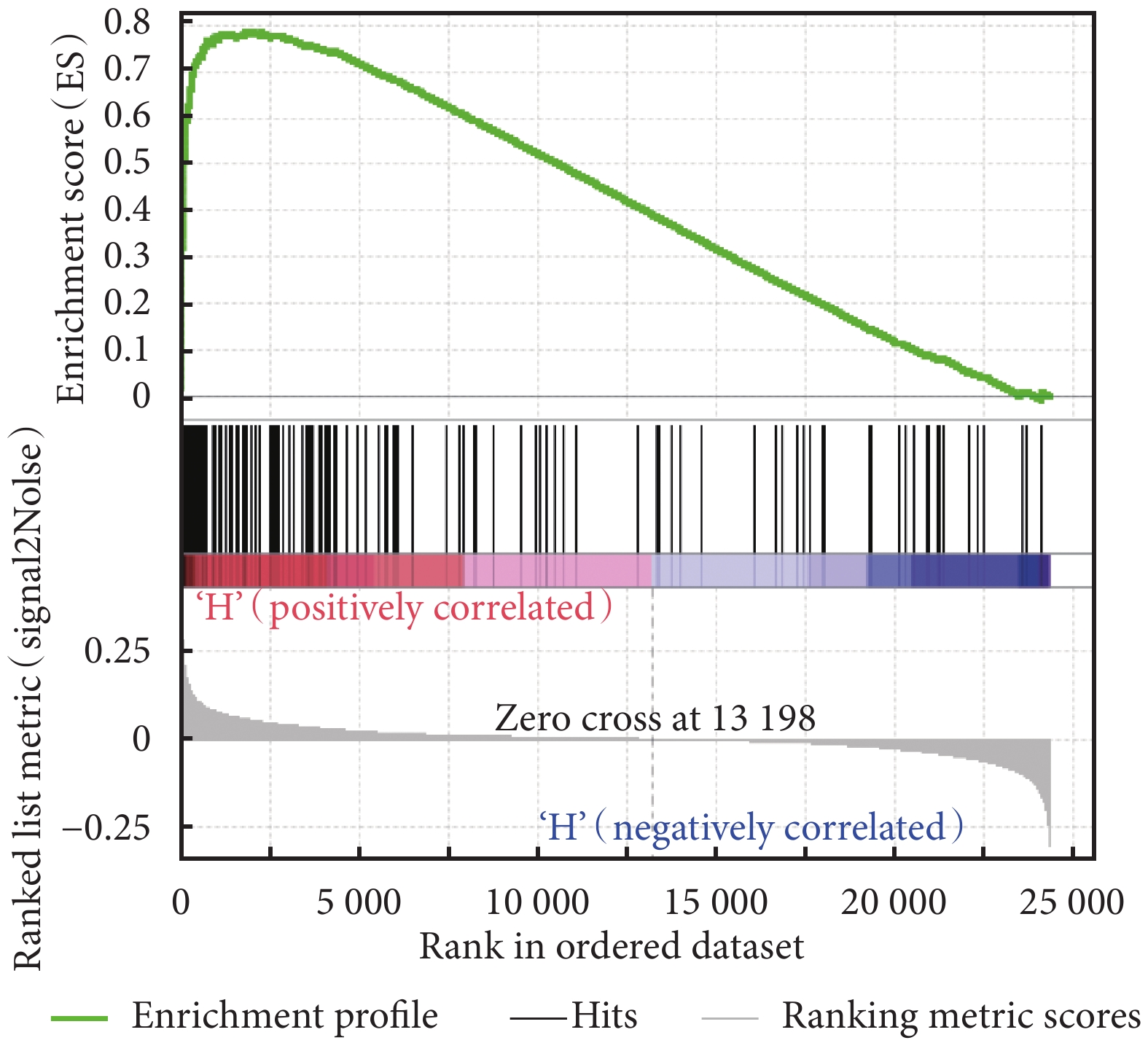 圖5
HIST1H1B 高表達的膀胱癌樣本基因 G2M 檢查點富集結果
圖5
HIST1H1B 高表達的膀胱癌樣本基因 G2M 檢查點富集結果
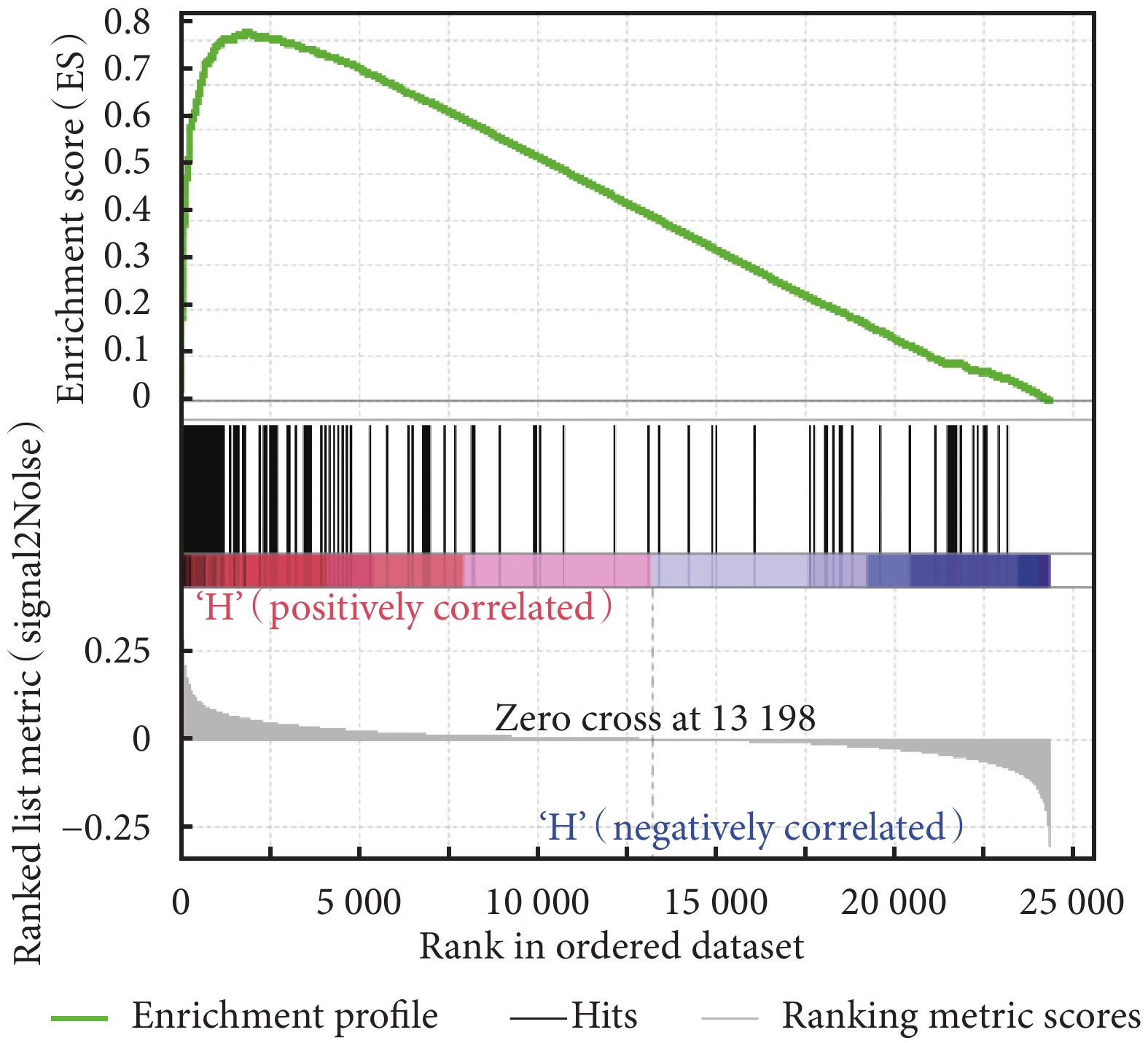 圖6
HIST1H1B 高表達的膀胱癌樣本基因 E2F 信號通路富集結果
圖6
HIST1H1B 高表達的膀胱癌樣本基因 E2F 信號通路富集結果
3 討論
核小體和組蛋白 H1 的復合物被稱為染色體,染色體的本質是含 168 bp 的 DNA[16]。HIST1H1B 的表達產物組蛋白 H1.5 蛋白是組蛋白 H1 的 11 種同工酶之一,是一組連接蛋白,可使染色體材料形成高級結構,同時調節基因表達。組蛋白 H1.5 存在于人類所有細胞類型中但在多能細胞及某些惡性腫瘤中表達量有所改變[17]。許多研究采用免疫組化方法檢測不同類型的癌癥組織中 H1 的變化,發現 H1 在癌癥組織中的表達存在高度異質,其組織病理學分級和異質性程度在一定程度上有利于腫瘤的侵襲性。有研究表明,組蛋白 H1.5 的核表達隨著肺神經內分泌腫瘤(PNT)等級的增加而增加[18]。H1.5 在大部分高級別和轉移性前列腺癌[10](格里森模式 4 和 5)細胞中顯示出強免疫反應性,而在良性前列腺上皮和低分級癌癥僅表現出局灶性和弱免疫反應性;且 H1.5 在平滑肌肉瘤中會過度表達[12]。由此我們可以推測,HIST1H1B 在細胞中的表達產物或許可用于膀胱癌診斷。
H1 必須經過磷酸化,才能在有絲分裂期間參與染色質濃縮[19]和限制調節蛋白獲取核小體組分[20]。Alexandrow 等[21]證明了復制時 DNA 和磷酸化的 H1 在體內共定位,表明 H1 磷酸化促進 DNA 去濃縮是 DNA 復制的前提。Maresca 等[22]也證明了 H1 組蛋白在有絲分裂時染色體的結構和功能中起重要作用。另有實驗證明,在致癌基因誘導的轉化中組蛋白 H1 磷酸化通常會增加[23,24]。根據以上研究結果,我們可以預測在治療膀胱癌時或許可以通過抑制 H1 的磷酸化來阻斷膀胱癌細胞的分裂,這為靶向治療膀胱癌提供了一定思路。
本研究中基因富集結果表明,HIST1H1B 很可能通過影響 G2M 檢查點來調控膀胱癌的發生及進展。據相關文獻報道,G2M 檢查點在存在 DNA 損傷的情況下可以阻止細胞進入分裂期,給予細胞 DNA 修復的時間從而維持基因組的穩定性[23],確保遺傳物質被精確復制并遺傳至下一代。相關研究表明組蛋白 H1 可以影響染色質的壓實程度[25]從而在基因毒性應激時影響 DNA 的損傷概率[26,27]。一些結合蛋白質組學的分級提取實驗和體外試驗已經將組蛋白 H1 鑒定為 NHEJ 因子,認為其可以增強 DNA 連接酶Ⅳ和 DNA 連接酶Ⅲ活性[28],在一定程度上促進 DNA 的修復。據此我們可以大膽做出猜想,HIST1H1B 在細胞中高表達出的組蛋白 H1 可以在降低 DNA 損傷概率同時促進損傷 DNA 的修復,使膀胱癌細胞不斷有絲分裂,從而影響膀胱癌的發生及發展。
根據本次基因富集結果,HIST1H1B 也很可能通過影響 E2F 信號通路來調控膀胱癌的發生及進展。實驗證明,在細胞有絲分裂的 G1 期和 S 期發揮作用的一系列基因的上游均存在 E2F 結合位點的同源序列。巧合的是在研究癌癥與 H1 表達水平的實驗中有學者發現 HIST1H1B(H1.5)主要在 S 期轉錄,即該基因僅在分裂細胞中高水平表達[29]。由此我們可以進行大膽的聯想,HIST1H1B 正是通過在膀胱癌細胞有絲分裂的 S 期過度表達從而調節細胞有絲分裂中與 E2F 結合有關的基因的表達,從而促進膀胱癌細胞的增殖分裂,最終影響膀胱癌的發生及發展。
有研究報道染色質纖維的高階折疊取決于連接組蛋白的存在和核小體之間的相互作用[30]。組蛋白 H1 有助于形成 30 nm 的螺線管結構[31],而 30 nm 螺線管纖維可以體內形成更高階的結構。查閱相關文獻我們得知 70~80 nm 纖維或珠子結構存在于間期[32]和有絲分裂細胞[33-36]。由此我們可以推測 HIST1H1B 在膀胱癌組織中的高表達通過促進染色質纖維的高階折疊來促進細胞進行增殖分裂,最終促進癌癥的發展。
本次研究還表明,HIST1H1B 可通過影響 MYC-V2、精子發生以及有絲分裂紡錘體等信號通路來調控膀胱癌的進程,但是具體機制有待深究。根據本次探究結果,HIST1H1B 在膀胱癌細胞中高表達且與多種臨床病例特征有緊密聯系,且可以通過多種途徑影響膀胱癌的發生發展,故 HIST1H1B 有可能成為潛在的預后標志物,同時有望成為腫瘤防治的新靶標和診斷依據,其調控腫瘤細胞的相關原理也為腫瘤細胞防治提供新思路。
本研究的局限性:① 本研究只對部分機制做出了理論假設,實際作用機制還受環境等因素的影響;② 本研究僅涉及 165 例原發性膀胱癌和 68 例正常膀胱組織,樣本量相對較小,盡管研究結果顯示本次調查具有統計學意義,但該基因在正常組織和膀胱癌組織中的表達水平差異不大,且 HIST1H1B表達水平高的患者和表達水平低的患者總生存率差異并不大,出現此結果極有可能是因為樣本量過小導致抽樣存在選擇性偏倚,若要將此次分析的結果應用于臨床,應該擴大樣本進行進一步分析,以增強結果的可信度;③ 由此次分析可見,即使研究從統計學的角度來講存在意義,但由于表型是基因和環境共同作用的結果,在討論其是否具有臨床意義時也應該考慮多方面的因素。HIST1H1B 是否能作為潛在預后標志物以及腫瘤防治新靶點還需要大量的臨床試驗進行深入探究。
綜上所述,HIST1H1B 可作為判斷膀胱癌患者預后的標志物和治療的靶標。但受當前證據數量和質量限制,此結論仍需進一步研究證實。
膀胱癌是我國泌尿系統最常見的惡性腫瘤之一。據 2018 年美國癌癥統計數據顯示,膀胱癌將成為世界第六大常見腫瘤[1]。按照腫瘤浸潤膀胱壁的深度,膀胱癌可分為非肌層浸潤性膀胱癌(non muscle-invasive bladder cancer,NMIBC)和肌層浸潤性膀胱癌(muscle-invasive bladder cancer,MIBC)[2],其中 MIBC 具有較高死亡率。有研究表明吸煙、飲酒、有毒物質等職業暴露、慢性尿路感染、血吸蟲病感染、家族史及特定的生殖細胞遺傳易感性等因素均可誘發膀胱癌[3-5]。在我國,城市人口的膀胱癌發病率和死亡率均高于農村人口,男性膀胱癌發病率和死亡率高于女性。
H1 組蛋白是高等真核生物中染色質纖維的主要結構成分。有研究表明[6-9],它們可穩定緊密的高階染色質結構,并調節基于染色質的過程,如轉錄、DNA 修復和復制。H1 蛋白包含 11 種不同的同工酶[10],對應有 11 種基因變體,HIST1H1B 是 11 種組蛋白 H1 基因變體中的 1 種。除 H1(0)基因外,所有已知的人類 H1 組蛋白基因都聚集在 6 號染色體上。HIST1H1B 又名 H1.5、H1、H1B、H1F,存在于染色體 6p22~p21.3 上的小組蛋白基因簇中,無內含子,編碼復制依賴性組蛋白。HIST1H1B 已經報道其在前列腺癌[11]、乳腺癌[12]和肺神經內分泌癌[13]中可作為良好的診斷和預后標志物;另外該蛋白和早幼粒細胞白血病鋅指(PLZF)蛋白組合可用于平滑肌肉瘤[14]、卵巢濾泡顆粒細胞瘤[15]的診斷。但對于 HIST1H1B 與膀胱癌的發生發展相關性的研究較少,本文利用基因表達公共數據庫(gene expression omnibus,GEO)中與膀胱癌有關的數據簡要探討 HIST1H1B 與膀胱癌的臨床病理特征和預后之間的關系。
1 資料與方法
1.1 數據來源
GSE13507 是 NCBI(http://www.ncbi.nlm.nih.gov/geo)GEO 數據庫中的一個基因表達矩陣。數據集 GSE13507 使用了 Illumina 公司的 Illumina human-6 v2.0 expression beadchip 基因表達芯片,包含了 165 例原發性膀胱癌和 68 例正常膀胱組織(其中包括癌旁組織)的基因表達譜及患者性別、年齡、TNM 分期等臨床信息。在 GSE13507 中,HIST1H1B基因對應的探針為 ILMN_1653251。
1.2 臨床相關性研究
利用 GSE13507 中膀胱癌患者信息,以基因表達量的中位數為依據進行分組,表達量在中位數以下的為 HIST1H1B 低表達組,中位數以上的(含中位數)為 HIST1H1B 高表達組,據此分組進行生存分析和臨床病理特征分析。
1.3 富集分析
利用 GSEA 3.0 進行基因集富集分析(gene set enrichment analysis,GSEA)。以 GSEA 網站 MsigDB 數據庫中的 hallmark 基因集為參照基因集,利用默認加權富集統計方法,單次分析置換次數為 1 000 次,初步探究 HIST1H1B 基因對膀胱癌的可能作用機制。
1.4 統計分析
利用 SPSS 20.0 軟件對數據進行統計分析,采用 GraphPad Prism 5 作圖。設定 P<0.05 時為差異有統計學意義。采用兩個樣本的獨立t檢驗進行差異分析,利用 Log-rank 算法進行生存分析,利用卡方檢驗分析 HIST1H1B 表達與臨床病理特征的相關性。基因富集分析時以 P<0.05、FDR(false discovery rates)<0.25 為標準為顯著富集基因集標準。
2 結果
2.1 HIST1H1B 在膀胱癌組織和正常組織中的表達情況
HIST1H1B 在正常組織中的表達水平為 6.929±0.014 39(n=68),在膀胱癌組織中的表達水平為 7.086±0.023 97(n=165),HIST1H1B 在正常組織中的表達量顯著低于在膀胱癌組織中的表達量(P=0.002 5)(圖 1)。
 圖1
HIST1H1B 在膀胱癌組織和正常組織中的表達水平
圖1
HIST1H1B 在膀胱癌組織和正常組織中的表達水平
2.2 HIST1H1B 與臨床病理特征
膀胱癌患者中 HIST1H1B 高、低表達組在年齡(P=0.007)、性別、T 分期、M 分期、N 分期、疾病分期(P<0.001)方面均具有顯著差異,而兩組在侵襲性、和進展是否的差異均沒有統計學意義(表 1)。
2.3 HIST1H1B 與膀胱癌預后的相關性分析
對總生存結局和腫瘤患者的特異性生存結局進行分析,結果顯示,HIST1H1B 表達水平高的患者和表達水平低的患者的總生存率分別為 34.652% 和 37.154%[Log-rank=4.999,P=0.025 4,HR=1.732,95%CI(1.070,2.803)],特異性生存率分別為 71.431% 和 82.346%[Log-rank=3.792,P=0.020 1,HR=2.000,95%CI(0.996,4.017)],分別見圖 2、圖 3。
 圖2
HIST1H1B 表達水平高的患者和表達水平低的患者總生存期曲線
圖2
HIST1H1B 表達水平高的患者和表達水平低的患者總生存期曲線
 圖3
HIST1H1B 表達水平高的患者和表達水平低的患者特異性生存曲線
圖3
HIST1H1B 表達水平高的患者和表達水平低的患者特異性生存曲線
2.4 HIST1H1B 基因高表達的基因富集分析
利用 GSEA 富集分析了 HIST1H1B 基因對膀胱癌患者體內的生物通路基因集,結果見表 2。MYC 信號通路 V2、G2M 檢查點、E2F 信號通路富集結果見圖 4~圖 6。表 2 結果提示我們 HIST1H1B 基因可能通過影響 MYC 信號通路 V2、G2M 檢查點、E2F 信號通路、精子發生、有絲分裂紡錘體有關的基因集來調控膀胱癌的發生及進展。
 圖4
HIST1H1B 高表達的膀胱癌樣本基因 MYC 信號通路 V2 富集結果
圖4
HIST1H1B 高表達的膀胱癌樣本基因 MYC 信號通路 V2 富集結果
 圖5
HIST1H1B 高表達的膀胱癌樣本基因 G2M 檢查點富集結果
圖5
HIST1H1B 高表達的膀胱癌樣本基因 G2M 檢查點富集結果
 圖6
HIST1H1B 高表達的膀胱癌樣本基因 E2F 信號通路富集結果
圖6
HIST1H1B 高表達的膀胱癌樣本基因 E2F 信號通路富集結果
3 討論
核小體和組蛋白 H1 的復合物被稱為染色體,染色體的本質是含 168 bp 的 DNA[16]。HIST1H1B 的表達產物組蛋白 H1.5 蛋白是組蛋白 H1 的 11 種同工酶之一,是一組連接蛋白,可使染色體材料形成高級結構,同時調節基因表達。組蛋白 H1.5 存在于人類所有細胞類型中但在多能細胞及某些惡性腫瘤中表達量有所改變[17]。許多研究采用免疫組化方法檢測不同類型的癌癥組織中 H1 的變化,發現 H1 在癌癥組織中的表達存在高度異質,其組織病理學分級和異質性程度在一定程度上有利于腫瘤的侵襲性。有研究表明,組蛋白 H1.5 的核表達隨著肺神經內分泌腫瘤(PNT)等級的增加而增加[18]。H1.5 在大部分高級別和轉移性前列腺癌[10](格里森模式 4 和 5)細胞中顯示出強免疫反應性,而在良性前列腺上皮和低分級癌癥僅表現出局灶性和弱免疫反應性;且 H1.5 在平滑肌肉瘤中會過度表達[12]。由此我們可以推測,HIST1H1B 在細胞中的表達產物或許可用于膀胱癌診斷。
H1 必須經過磷酸化,才能在有絲分裂期間參與染色質濃縮[19]和限制調節蛋白獲取核小體組分[20]。Alexandrow 等[21]證明了復制時 DNA 和磷酸化的 H1 在體內共定位,表明 H1 磷酸化促進 DNA 去濃縮是 DNA 復制的前提。Maresca 等[22]也證明了 H1 組蛋白在有絲分裂時染色體的結構和功能中起重要作用。另有實驗證明,在致癌基因誘導的轉化中組蛋白 H1 磷酸化通常會增加[23,24]。根據以上研究結果,我們可以預測在治療膀胱癌時或許可以通過抑制 H1 的磷酸化來阻斷膀胱癌細胞的分裂,這為靶向治療膀胱癌提供了一定思路。
本研究中基因富集結果表明,HIST1H1B 很可能通過影響 G2M 檢查點來調控膀胱癌的發生及進展。據相關文獻報道,G2M 檢查點在存在 DNA 損傷的情況下可以阻止細胞進入分裂期,給予細胞 DNA 修復的時間從而維持基因組的穩定性[23],確保遺傳物質被精確復制并遺傳至下一代。相關研究表明組蛋白 H1 可以影響染色質的壓實程度[25]從而在基因毒性應激時影響 DNA 的損傷概率[26,27]。一些結合蛋白質組學的分級提取實驗和體外試驗已經將組蛋白 H1 鑒定為 NHEJ 因子,認為其可以增強 DNA 連接酶Ⅳ和 DNA 連接酶Ⅲ活性[28],在一定程度上促進 DNA 的修復。據此我們可以大膽做出猜想,HIST1H1B 在細胞中高表達出的組蛋白 H1 可以在降低 DNA 損傷概率同時促進損傷 DNA 的修復,使膀胱癌細胞不斷有絲分裂,從而影響膀胱癌的發生及發展。
根據本次基因富集結果,HIST1H1B 也很可能通過影響 E2F 信號通路來調控膀胱癌的發生及進展。實驗證明,在細胞有絲分裂的 G1 期和 S 期發揮作用的一系列基因的上游均存在 E2F 結合位點的同源序列。巧合的是在研究癌癥與 H1 表達水平的實驗中有學者發現 HIST1H1B(H1.5)主要在 S 期轉錄,即該基因僅在分裂細胞中高水平表達[29]。由此我們可以進行大膽的聯想,HIST1H1B 正是通過在膀胱癌細胞有絲分裂的 S 期過度表達從而調節細胞有絲分裂中與 E2F 結合有關的基因的表達,從而促進膀胱癌細胞的增殖分裂,最終影響膀胱癌的發生及發展。
有研究報道染色質纖維的高階折疊取決于連接組蛋白的存在和核小體之間的相互作用[30]。組蛋白 H1 有助于形成 30 nm 的螺線管結構[31],而 30 nm 螺線管纖維可以體內形成更高階的結構。查閱相關文獻我們得知 70~80 nm 纖維或珠子結構存在于間期[32]和有絲分裂細胞[33-36]。由此我們可以推測 HIST1H1B 在膀胱癌組織中的高表達通過促進染色質纖維的高階折疊來促進細胞進行增殖分裂,最終促進癌癥的發展。
本次研究還表明,HIST1H1B 可通過影響 MYC-V2、精子發生以及有絲分裂紡錘體等信號通路來調控膀胱癌的進程,但是具體機制有待深究。根據本次探究結果,HIST1H1B 在膀胱癌細胞中高表達且與多種臨床病例特征有緊密聯系,且可以通過多種途徑影響膀胱癌的發生發展,故 HIST1H1B 有可能成為潛在的預后標志物,同時有望成為腫瘤防治的新靶標和診斷依據,其調控腫瘤細胞的相關原理也為腫瘤細胞防治提供新思路。
本研究的局限性:① 本研究只對部分機制做出了理論假設,實際作用機制還受環境等因素的影響;② 本研究僅涉及 165 例原發性膀胱癌和 68 例正常膀胱組織,樣本量相對較小,盡管研究結果顯示本次調查具有統計學意義,但該基因在正常組織和膀胱癌組織中的表達水平差異不大,且 HIST1H1B表達水平高的患者和表達水平低的患者總生存率差異并不大,出現此結果極有可能是因為樣本量過小導致抽樣存在選擇性偏倚,若要將此次分析的結果應用于臨床,應該擴大樣本進行進一步分析,以增強結果的可信度;③ 由此次分析可見,即使研究從統計學的角度來講存在意義,但由于表型是基因和環境共同作用的結果,在討論其是否具有臨床意義時也應該考慮多方面的因素。HIST1H1B 是否能作為潛在預后標志物以及腫瘤防治新靶點還需要大量的臨床試驗進行深入探究。
綜上所述,HIST1H1B 可作為判斷膀胱癌患者預后的標志物和治療的靶標。但受當前證據數量和質量限制,此結論仍需進一步研究證實。