版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
癌癥患者普遍存在營養不良問題,其發生率高達30%~90%[1,2],直接影響患者的預后、不良反應發生率和生存質量[3,4]。盡管有多種營養不良評估工具,但目前尚無公認的金標準。患者主觀整體評估工具(PG-SGA)是專門用于評估癌癥患者營養狀況的工具[5],集營養篩查、評估、分類和監測于一體的綜合評估工具,已被美國腸外和腸內營養協會(ASPEN)和歐洲臨床營養與代謝協會(ESPEN)在其癌癥患者營養指南中推薦用于癌癥患者的營養評估[6,7]。然而,PG-SGA的主要局限在于其主觀性較強,評估結果在很大程度上取決于評估者的經驗和患者的自我報告[5]。因此,不同評估者之間可能存在一致性問題。此外,PG-SGA的評估過程相對復雜,一定程度上影響臨床應用的便捷性。全球領導人營養不良倡議(GLIM)標準于2019年發布,旨在建立一個營養不良診斷的國際共識[8]。該標準包含篩查、診斷兩個步驟。要確診營養不良,需滿足至少一個表型標準和一個病因學標準。三個表型標準包括體重指數降低、體重減輕和肌肉質量減少,兩個病因學標準包括食物攝入與吸收減少、炎癥。GLIM推出后,作者呼吁進行驗證研究和反饋。近年來,GLIM已在多項癌癥患者研究中得到驗證[9,10]。本研究旨在評估GLIM相對于PG-SGA在診斷營養不良時的準確性,為臨床實踐提供有效指導。
1 資料與方法
本系統評價已在PROSPERO系統注冊,注冊號:CRD42024521358;并遵循系統評價和Meta分析的首選報告條目(PRISMA)進行。
1.1 納入與排除標準
1.1.1 研究類型
診斷性試驗。
1.1.2 研究對象
≥18歲癌癥患者。
1.1.3 診斷方法
待診斷試驗為GLIM;金標準為PG-SGA。
1.1.4 結局指標
靈敏度(Sen)、特異度(Spe)、陽性似然比(+LR)、陰性似然比(?LR)、診斷比值比(DOR)及合并受試者工作特征曲線下面積(AUC)。
1.1.5 排除標準
① 重復發表的文獻;② 無法獲取全文文獻;③ 無可用數據的文獻;④ 未遵循PG-SGA標準對營養狀況分類。
1.2 文獻檢索策略
計算機檢索PubMed、Web of Science、Cochrane Library、Embase、CNKI、WanFang Data、CBM、VIP數據庫,搜集與研究目的相關的診斷性試驗,檢索時限均為2019年1月至2024年3月。檢索采用自由詞與主題詞相結合的方式進行,英文檢索詞包括:neoplasms、GLIM、malnutrition等;中文檢索詞包括:腫瘤、全球領導人營養不良倡議等。以PubMed為例,其具體檢索策略見附件框1。
1.3 文獻篩選與資料提取
由2名研究者獨立篩選文獻、提取資料并交叉核對。如有分歧,則通過討論或與第三方協商解決。資料提取內容包括:作者、年份、國家、癌種、樣本量、營養不良/營養良好、年齡、肌肉質量評估方法、營養風險篩查工具、Sen、Spe、真陽性(TP)、假陰性(FP)、假陽性(FN)、真陰性(TN)。
1.4 納入研究的偏倚風險評價
由2名研究者獨立評價納入研究的偏倚風險,并交叉核對結果。偏倚風險評價采用診斷準確性研究的質量評價工具2(QUADAS-2)[11]。
1.5 統計分析
采用Stata 15.0軟件進行合并Sen、Sep、+LR、?LR、DOR、AUC,95%可信區間(CI)用于評估效應量之間的統計學差異[12]。通過計算納入研究的Sen與Spe之間的Spearman相關系數來確定是否存在閾值效應[13]。Q檢驗和I2用于評估納入研究的異質性,當各研究結果間存在統計學異質性時,則采用亞組分析方法進行處理[14]。應用Deek’s漏斗圖評估納入研究的發表偏倚。采用逐篇剔除法進行敏感性分析,來判斷研究結果的穩定性。
2 結果
2.1 文獻篩選流程及結果
初檢共獲得文獻704篇,包括PubMed(n=131)、Web of Science(n=192)、Cochrane Library(n=7)、Embase(n=267)、CNKI(n=8)、WanFang Data(n=42)、VIP(n=16)、CBM(n=41),經逐層篩選后,最終納入12篇文獻[1,9,10,15-23]。文獻篩選流程及結果見附件圖1。
2.2 納入研究的基本特征及偏倚風險評價結果
納入研究的基本特征見表1,偏倚風險評價結果見附件表1。
2.3 閾值效應分析和Meta分析結果
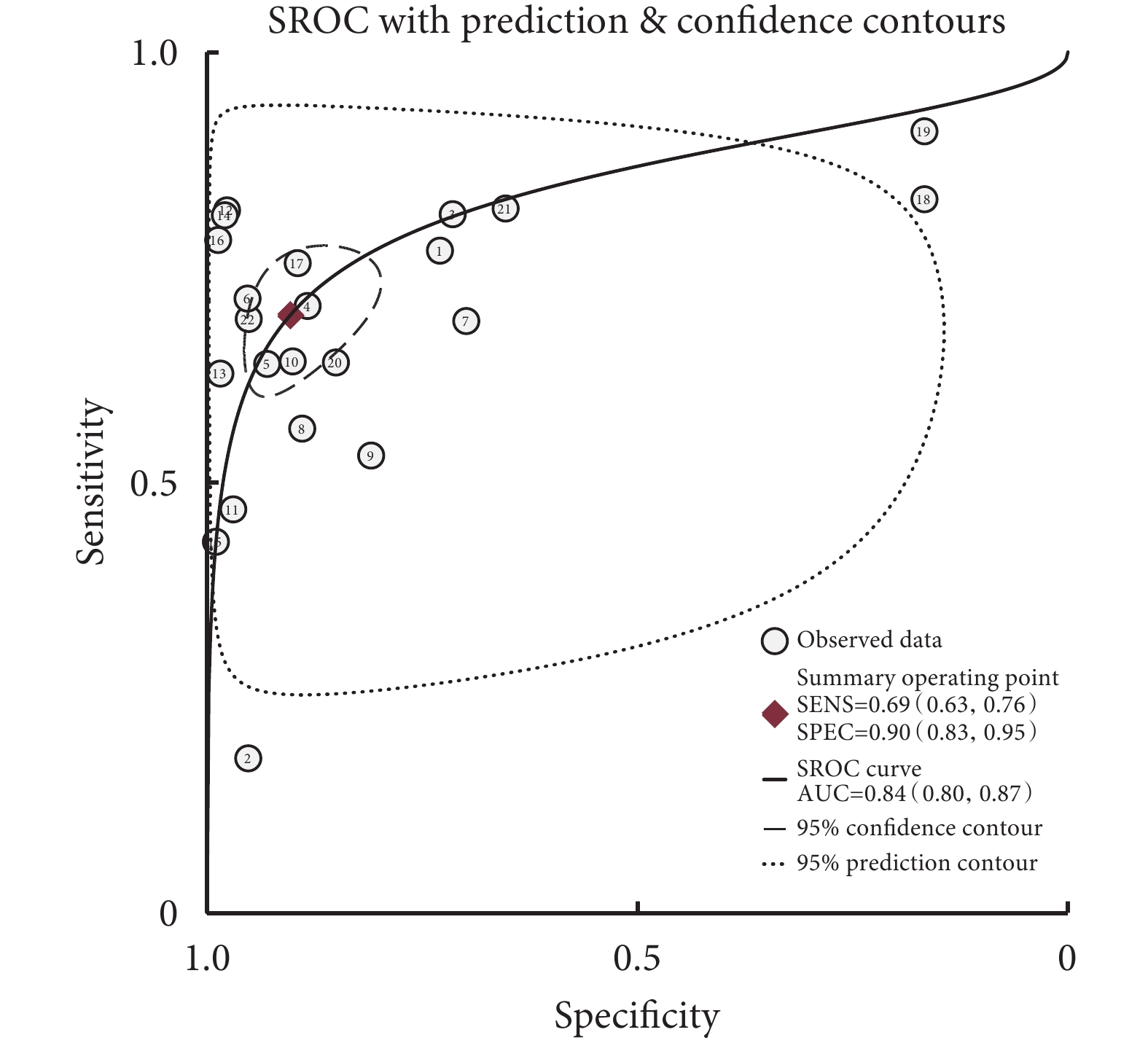
Sen與Spe之間的Spearman相關系數=0.417,P=0.054,表明不存在閾值效應。Meta分析結果顯示,與PG-SGA相比,GLIM診斷營養不良的Sen=0.69[95%CI(0.63,0.76)]、Spe=0.90[95%CI(0.83,0.95)]、+LR=7.18[95%CI(4.17,12.35)]、?LR=0.34[95%CI(0.28,0.41)]、DOR=21.21[95%CI(11.96,37.62)]、AUC=0.84[95%CI(0.80,0.87)],SROC曲線見圖1。根據營養風險篩查工具、肌肉質量評估方法、癌種、國家、樣本量進行亞組分析,結果見表2。
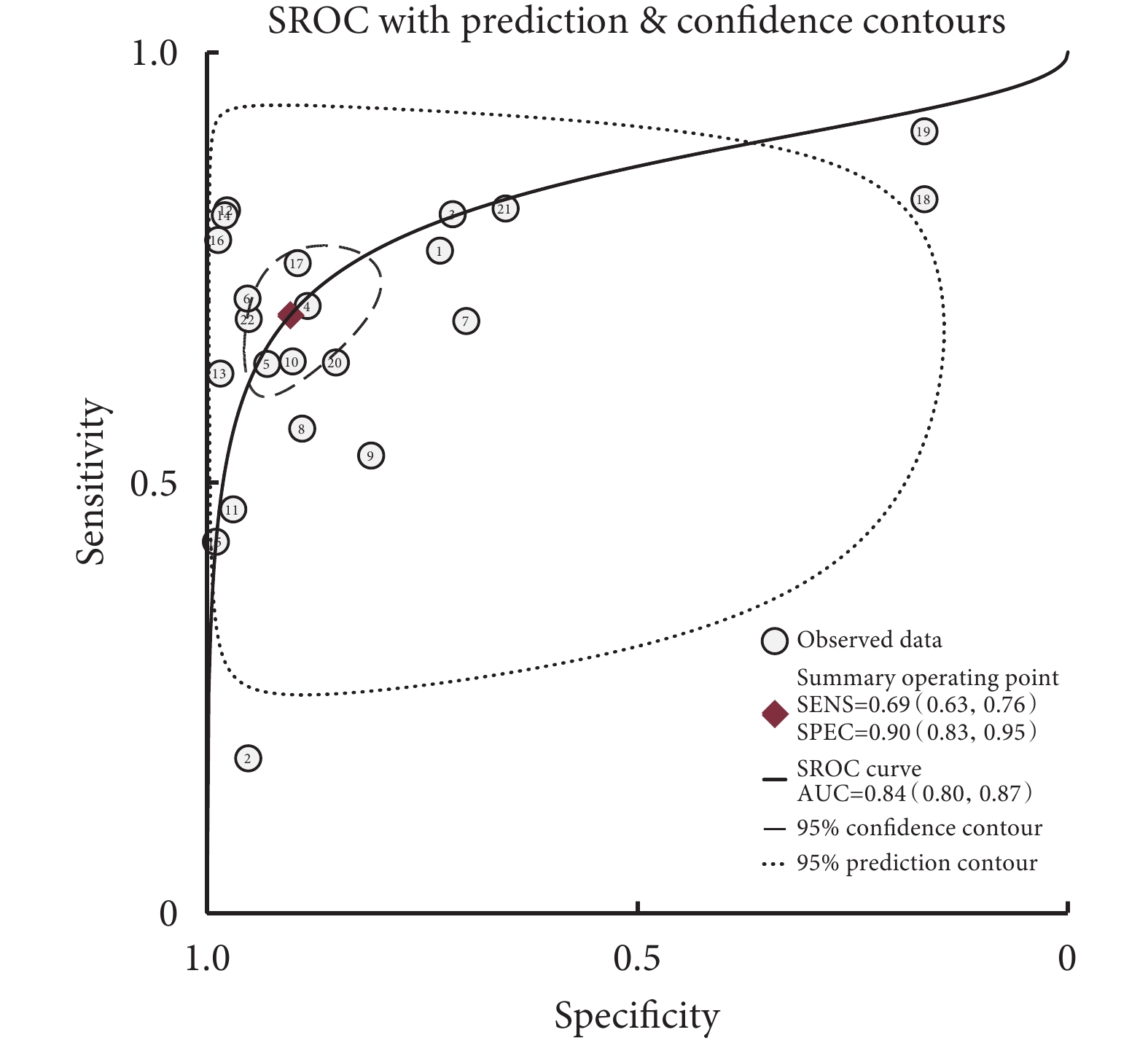 圖1
全球領導人營養不良倡議用于癌癥患者營養不良診斷準確性的SROC曲線
圖1
全球領導人營養不良倡議用于癌癥患者營養不良診斷準確性的SROC曲線
2.4 敏感性分析和發表偏倚
采用逐一排除單個研究的方法進行敏感性分析,合并效應值AUC基本穩定在83%~85%,表明研究結果比較可靠。納入研究的Deek's漏斗圖兩側基本對稱(P>0.05),表明無明顯的發表偏倚(附件圖2)。
3 討論
識別、預防和改善營養不良對癌癥患者具有重要意義[24,25]。規范化的營養不良評估工具是準確識別營養不良患者并及時采取干預措施的基礎。GLIM就成人營養不良的診斷達成了全球共識,目的是為了在全球范圍內比較營養不良的患病率、推動標準化護理措施的制定,并促進結果的改善[8]。因此,評估GLIM在診斷營養不良方面的準確性至關重要。
本研究結果顯示,GLIM診斷癌癥患者營養不良的Sen和Spe分別為0.69和0.90,表明GLIM可以診斷出69%的存在營養不良的癌癥患者,漏診率為31%,誤診率10%。擬合SROC曲線,其AUC值為0.84,表明該評估工具有中等診斷效能。這一結果表明,在使用GLIM診斷癌癥患者營養不良時,誤診率相對較低,但漏診率較高。可能的原因包括:首先,與GLIM相比[8],PG-SGA除了考慮身體成分、體重減輕史、食物攝入與吸收及炎癥等指標外,還考慮了影響營養的癥狀和身體活動等指標[5]。其次,這兩種工具之間的評估過程存在主客觀差異,在身體成分評估方面,PG-SGA采用的是專業人士的主觀判斷方法,容易產生偏差。最后,根據GLIM流程,在第一步進行營養不良風險篩查,僅存在營養不良風險的癌癥患者才進入到第二步營養不良診斷,但所有癌癥患者都完成了PG-SGA評估,這可能導致按GLIM評估的營養不良患病率被低估。在對營養風險篩查工具亞組分析中也印證了這一點,沒有進行第一步營養風險篩查的研究Sen更高。
根據GLIM流程[8],第一步的營養不良風險篩查可以使用任何現有的、經過驗證的篩查工具進行。ESPEN癌癥患者營養指南推薦了幾種篩查工具,例如MST、NRS-2002和MUST[6]。PG-SGA SF是PG-SGA的一個組成部分[5],只保留了患者報告的部分(包括體重、食物攝入量、癥狀、活動),省略需要專業評估的部分,也可以用作篩查工具。目前,關于第一步篩查的現有研究仍有爭議。納入文獻中,有2項研究[1,9]探討了使用不同的篩查工具或不進行篩查對結果的影響;另外10項研究中5項研究[15,16,20,22,23]未進行任何篩查,5項研究[10,17-19,21]分別使用MST、NRS-2002、PG-SGA SF進行篩查。但由于納入研究數量有限,本研究只合并了使用NRS-2002的數據,AUC值為0.86。
根據GLIM標準[8],精確評估肌肉質量是診斷成人營養不良的關鍵組成部分。推薦使用雙能X射線吸收測定法(DXA)或其他已驗證的身體成分測量技術,如生物電阻抗分析(BIA)、超聲、計算機斷層掃描(CT)或磁共振成像(MRI),以獲得準確的測量結果。在資源受限的情況下,可采用小腿或手臂肌肉周長等其他簡易的人體測量學指標作為替代方法。在特殊情況下無法評估肌肉質量時,可以考慮測量肌肉力量,如握力,以補充評估。根據使用的肌肉質量評估方法的亞組分析顯示,綜合評估(FFMI、CC、ASMI)診斷效能最高,其AUC值高達0.99。
在對營養不良風險較高的胃腸道腫瘤患者的研究中,合并結果顯示:Sen、Spe、AUC分別為0.64、0.70和0.79,均相對較低。如前文所述,PG-SGA包括影響營養的癥狀如腹痛、便秘、腹瀉等,而這些內容并未被包含在GLIM中,而在胃腸道腫瘤患者出現相關癥狀的概率尤其大,因此可能是導致Sen相對較低的原因。此外,在身體成分評估方面,PG-SGA依賴于醫療專業人士的主觀評估,而GLIM推薦使用更為客觀的方法。40%到60%的癌癥患者患有超重或肥胖癥,脂肪組織可能掩蓋了肌肉量的減少,從而使得患者的實際營養和功能狀態難以準確評估[26]。因此,根據GLIM標準可能被判斷為營養不良的患者,在PG-SGA評估中卻可能被認為營養良好,這也解釋了為什么Spe相對較低。
PG-SGA是一種主觀評估工具[5],尤其體現在其第一部分的篩查中,主要依賴患者的自我報告。而在身體成分評估方面,則依賴專業人士的主觀判斷,這種主觀性可能導致評估者之間存在一致性差異。相比之下,GLIM的診斷標準結合了客觀的臨床指標[8],如肌肉質量減少和炎癥指標,減少了主觀因素的影響。隨著營養研究的深入,BMI已不能簡單地作為營養狀況良好的唯一指標。GLIM中對肌肉量的測量在發現隱性營養不良(如肥胖型肌肉減少癥)方面具有重要意義[27]。盡管PG-SGA提供了全面的信息,其評估過程相對復雜且耗時,可能增加臨床工作負擔。而GLIM則更加簡便,通過簡化的篩查和診斷流程,即便在資源有限的環境中也能有效實施。對于臨床胃腸道腫瘤患者,GLIM標準可用于營養不良的初步診斷,而在必要時,PG-SGA可進一步評估影響患者的營養相關癥狀和代謝狀態,以便制定個體化的營養干預方案[23]。
本研究的局限性包括:① 由于納入研究數量較少,故在對營養風險篩查工具亞組分析時,MST、MUST、PG-SGA SF的數據無法合并分析,因此,目前還不清楚哪種篩查工具最適合使用。② 盡管GLIM推薦了多種肌肉質量評估方法,但除了如FFMI和ASMI等個別方法明確了截斷值外,其他方法的截斷值尚不一致,因此,根據肌肉質量評估方法的亞組分析結果應謹慎解釋。③ 本研究納入的癌癥患者,年齡集中在60歲,現階癌癥患者趨于年輕化,在未來的研究中有待在年輕癌癥患者中驗證。
綜上所述,GLIM診斷營養不良存在一定的誤差,其中在評估肌肉質量時應用綜合評估的方法,診斷效能最高。此外,由于納入的研究數量有限,目前還不清楚哪種篩查工具最為適合。最后,一些肌肉質量評估方法的截斷值尚未明確,未來需要通過更多高質量的研究予以驗證。
癌癥患者普遍存在營養不良問題,其發生率高達30%~90%[1,2],直接影響患者的預后、不良反應發生率和生存質量[3,4]。盡管有多種營養不良評估工具,但目前尚無公認的金標準。患者主觀整體評估工具(PG-SGA)是專門用于評估癌癥患者營養狀況的工具[5],集營養篩查、評估、分類和監測于一體的綜合評估工具,已被美國腸外和腸內營養協會(ASPEN)和歐洲臨床營養與代謝協會(ESPEN)在其癌癥患者營養指南中推薦用于癌癥患者的營養評估[6,7]。然而,PG-SGA的主要局限在于其主觀性較強,評估結果在很大程度上取決于評估者的經驗和患者的自我報告[5]。因此,不同評估者之間可能存在一致性問題。此外,PG-SGA的評估過程相對復雜,一定程度上影響臨床應用的便捷性。全球領導人營養不良倡議(GLIM)標準于2019年發布,旨在建立一個營養不良診斷的國際共識[8]。該標準包含篩查、診斷兩個步驟。要確診營養不良,需滿足至少一個表型標準和一個病因學標準。三個表型標準包括體重指數降低、體重減輕和肌肉質量減少,兩個病因學標準包括食物攝入與吸收減少、炎癥。GLIM推出后,作者呼吁進行驗證研究和反饋。近年來,GLIM已在多項癌癥患者研究中得到驗證[9,10]。本研究旨在評估GLIM相對于PG-SGA在診斷營養不良時的準確性,為臨床實踐提供有效指導。
1 資料與方法
本系統評價已在PROSPERO系統注冊,注冊號:CRD42024521358;并遵循系統評價和Meta分析的首選報告條目(PRISMA)進行。
1.1 納入與排除標準
1.1.1 研究類型
診斷性試驗。
1.1.2 研究對象
≥18歲癌癥患者。
1.1.3 診斷方法
待診斷試驗為GLIM;金標準為PG-SGA。
1.1.4 結局指標
靈敏度(Sen)、特異度(Spe)、陽性似然比(+LR)、陰性似然比(?LR)、診斷比值比(DOR)及合并受試者工作特征曲線下面積(AUC)。
1.1.5 排除標準
① 重復發表的文獻;② 無法獲取全文文獻;③ 無可用數據的文獻;④ 未遵循PG-SGA標準對營養狀況分類。
1.2 文獻檢索策略
計算機檢索PubMed、Web of Science、Cochrane Library、Embase、CNKI、WanFang Data、CBM、VIP數據庫,搜集與研究目的相關的診斷性試驗,檢索時限均為2019年1月至2024年3月。檢索采用自由詞與主題詞相結合的方式進行,英文檢索詞包括:neoplasms、GLIM、malnutrition等;中文檢索詞包括:腫瘤、全球領導人營養不良倡議等。以PubMed為例,其具體檢索策略見附件框1。
1.3 文獻篩選與資料提取
由2名研究者獨立篩選文獻、提取資料并交叉核對。如有分歧,則通過討論或與第三方協商解決。資料提取內容包括:作者、年份、國家、癌種、樣本量、營養不良/營養良好、年齡、肌肉質量評估方法、營養風險篩查工具、Sen、Spe、真陽性(TP)、假陰性(FP)、假陽性(FN)、真陰性(TN)。
1.4 納入研究的偏倚風險評價
由2名研究者獨立評價納入研究的偏倚風險,并交叉核對結果。偏倚風險評價采用診斷準確性研究的質量評價工具2(QUADAS-2)[11]。
1.5 統計分析
采用Stata 15.0軟件進行合并Sen、Sep、+LR、?LR、DOR、AUC,95%可信區間(CI)用于評估效應量之間的統計學差異[12]。通過計算納入研究的Sen與Spe之間的Spearman相關系數來確定是否存在閾值效應[13]。Q檢驗和I2用于評估納入研究的異質性,當各研究結果間存在統計學異質性時,則采用亞組分析方法進行處理[14]。應用Deek’s漏斗圖評估納入研究的發表偏倚。采用逐篇剔除法進行敏感性分析,來判斷研究結果的穩定性。
2 結果
2.1 文獻篩選流程及結果
初檢共獲得文獻704篇,包括PubMed(n=131)、Web of Science(n=192)、Cochrane Library(n=7)、Embase(n=267)、CNKI(n=8)、WanFang Data(n=42)、VIP(n=16)、CBM(n=41),經逐層篩選后,最終納入12篇文獻[1,9,10,15-23]。文獻篩選流程及結果見附件圖1。
2.2 納入研究的基本特征及偏倚風險評價結果
納入研究的基本特征見表1,偏倚風險評價結果見附件表1。
2.3 閾值效應分析和Meta分析結果
Sen與Spe之間的Spearman相關系數=0.417,P=0.054,表明不存在閾值效應。Meta分析結果顯示,與PG-SGA相比,GLIM診斷營養不良的Sen=0.69[95%CI(0.63,0.76)]、Spe=0.90[95%CI(0.83,0.95)]、+LR=7.18[95%CI(4.17,12.35)]、?LR=0.34[95%CI(0.28,0.41)]、DOR=21.21[95%CI(11.96,37.62)]、AUC=0.84[95%CI(0.80,0.87)],SROC曲線見圖1。根據營養風險篩查工具、肌肉質量評估方法、癌種、國家、樣本量進行亞組分析,結果見表2。
 圖1
全球領導人營養不良倡議用于癌癥患者營養不良診斷準確性的SROC曲線
圖1
全球領導人營養不良倡議用于癌癥患者營養不良診斷準確性的SROC曲線
2.4 敏感性分析和發表偏倚
采用逐一排除單個研究的方法進行敏感性分析,合并效應值AUC基本穩定在83%~85%,表明研究結果比較可靠。納入研究的Deek's漏斗圖兩側基本對稱(P>0.05),表明無明顯的發表偏倚(附件圖2)。
3 討論
識別、預防和改善營養不良對癌癥患者具有重要意義[24,25]。規范化的營養不良評估工具是準確識別營養不良患者并及時采取干預措施的基礎。GLIM就成人營養不良的診斷達成了全球共識,目的是為了在全球范圍內比較營養不良的患病率、推動標準化護理措施的制定,并促進結果的改善[8]。因此,評估GLIM在診斷營養不良方面的準確性至關重要。
本研究結果顯示,GLIM診斷癌癥患者營養不良的Sen和Spe分別為0.69和0.90,表明GLIM可以診斷出69%的存在營養不良的癌癥患者,漏診率為31%,誤診率10%。擬合SROC曲線,其AUC值為0.84,表明該評估工具有中等診斷效能。這一結果表明,在使用GLIM診斷癌癥患者營養不良時,誤診率相對較低,但漏診率較高。可能的原因包括:首先,與GLIM相比[8],PG-SGA除了考慮身體成分、體重減輕史、食物攝入與吸收及炎癥等指標外,還考慮了影響營養的癥狀和身體活動等指標[5]。其次,這兩種工具之間的評估過程存在主客觀差異,在身體成分評估方面,PG-SGA采用的是專業人士的主觀判斷方法,容易產生偏差。最后,根據GLIM流程,在第一步進行營養不良風險篩查,僅存在營養不良風險的癌癥患者才進入到第二步營養不良診斷,但所有癌癥患者都完成了PG-SGA評估,這可能導致按GLIM評估的營養不良患病率被低估。在對營養風險篩查工具亞組分析中也印證了這一點,沒有進行第一步營養風險篩查的研究Sen更高。
根據GLIM流程[8],第一步的營養不良風險篩查可以使用任何現有的、經過驗證的篩查工具進行。ESPEN癌癥患者營養指南推薦了幾種篩查工具,例如MST、NRS-2002和MUST[6]。PG-SGA SF是PG-SGA的一個組成部分[5],只保留了患者報告的部分(包括體重、食物攝入量、癥狀、活動),省略需要專業評估的部分,也可以用作篩查工具。目前,關于第一步篩查的現有研究仍有爭議。納入文獻中,有2項研究[1,9]探討了使用不同的篩查工具或不進行篩查對結果的影響;另外10項研究中5項研究[15,16,20,22,23]未進行任何篩查,5項研究[10,17-19,21]分別使用MST、NRS-2002、PG-SGA SF進行篩查。但由于納入研究數量有限,本研究只合并了使用NRS-2002的數據,AUC值為0.86。
根據GLIM標準[8],精確評估肌肉質量是診斷成人營養不良的關鍵組成部分。推薦使用雙能X射線吸收測定法(DXA)或其他已驗證的身體成分測量技術,如生物電阻抗分析(BIA)、超聲、計算機斷層掃描(CT)或磁共振成像(MRI),以獲得準確的測量結果。在資源受限的情況下,可采用小腿或手臂肌肉周長等其他簡易的人體測量學指標作為替代方法。在特殊情況下無法評估肌肉質量時,可以考慮測量肌肉力量,如握力,以補充評估。根據使用的肌肉質量評估方法的亞組分析顯示,綜合評估(FFMI、CC、ASMI)診斷效能最高,其AUC值高達0.99。
在對營養不良風險較高的胃腸道腫瘤患者的研究中,合并結果顯示:Sen、Spe、AUC分別為0.64、0.70和0.79,均相對較低。如前文所述,PG-SGA包括影響營養的癥狀如腹痛、便秘、腹瀉等,而這些內容并未被包含在GLIM中,而在胃腸道腫瘤患者出現相關癥狀的概率尤其大,因此可能是導致Sen相對較低的原因。此外,在身體成分評估方面,PG-SGA依賴于醫療專業人士的主觀評估,而GLIM推薦使用更為客觀的方法。40%到60%的癌癥患者患有超重或肥胖癥,脂肪組織可能掩蓋了肌肉量的減少,從而使得患者的實際營養和功能狀態難以準確評估[26]。因此,根據GLIM標準可能被判斷為營養不良的患者,在PG-SGA評估中卻可能被認為營養良好,這也解釋了為什么Spe相對較低。
PG-SGA是一種主觀評估工具[5],尤其體現在其第一部分的篩查中,主要依賴患者的自我報告。而在身體成分評估方面,則依賴專業人士的主觀判斷,這種主觀性可能導致評估者之間存在一致性差異。相比之下,GLIM的診斷標準結合了客觀的臨床指標[8],如肌肉質量減少和炎癥指標,減少了主觀因素的影響。隨著營養研究的深入,BMI已不能簡單地作為營養狀況良好的唯一指標。GLIM中對肌肉量的測量在發現隱性營養不良(如肥胖型肌肉減少癥)方面具有重要意義[27]。盡管PG-SGA提供了全面的信息,其評估過程相對復雜且耗時,可能增加臨床工作負擔。而GLIM則更加簡便,通過簡化的篩查和診斷流程,即便在資源有限的環境中也能有效實施。對于臨床胃腸道腫瘤患者,GLIM標準可用于營養不良的初步診斷,而在必要時,PG-SGA可進一步評估影響患者的營養相關癥狀和代謝狀態,以便制定個體化的營養干預方案[23]。
本研究的局限性包括:① 由于納入研究數量較少,故在對營養風險篩查工具亞組分析時,MST、MUST、PG-SGA SF的數據無法合并分析,因此,目前還不清楚哪種篩查工具最適合使用。② 盡管GLIM推薦了多種肌肉質量評估方法,但除了如FFMI和ASMI等個別方法明確了截斷值外,其他方法的截斷值尚不一致,因此,根據肌肉質量評估方法的亞組分析結果應謹慎解釋。③ 本研究納入的癌癥患者,年齡集中在60歲,現階癌癥患者趨于年輕化,在未來的研究中有待在年輕癌癥患者中驗證。
綜上所述,GLIM診斷營養不良存在一定的誤差,其中在評估肌肉質量時應用綜合評估的方法,診斷效能最高。此外,由于納入的研究數量有限,目前還不清楚哪種篩查工具最為適合。最后,一些肌肉質量評估方法的截斷值尚未明確,未來需要通過更多高質量的研究予以驗證。