引用本文: 邱文超, 王小姍. 彌散張量成像揭示失神癲癇患兒的默認模式腦區結構異常. 癲癇雜志, 2017, 3(3): 187-192. doi: 10.7507/2096-0247.20170028 復制
版權信息: ?四川大學華西醫院華西期刊社《癲癇雜志》版權所有,未經授權不得轉載、改編
兒童失神癲癇(Childhood absence epilepsy, CAE)是一組以突發短暫的(5~30 s)意識喪失,同時腦電圖(EEG)伴有雙側同步對稱的3Hz棘-慢復合波(Spike-and-wave discharges,SWDs)為特征的臨床綜合征,發作時無肢體抽搐[1]。失神發作一般在3~8歲期間起病(高峰期6~7歲),約占所有兒童期癲癇的10%~17%[2]。30%的CAE患兒在發作間期存在注意力缺陷或者其他類型的認知功能障礙,這使對CAE的研究顯得尤為重要[3]。
EEG-功能磁共振(fMRI)等功能影像學方法已經被用于探討全面性癲癇SWDs的病理機制[4, 5]。研究發現,CAE患者在默認模式網絡(Default mode network,DMN)內的功能連接發生了改變[6]。我們課題組前期一項腦磁圖(MEG)研究也提示失神發作涉及DMN功能異常[7]。但患者的DMN節點腦區解剖結構是否存在異常改變仍然不是很清楚。
彌散張量成像(Diffusion tensor imaging,DTI)是以水分子布朗運動為基礎的一項新型影像技術[8]。腦組織中水分子的布朗運動受到生物大分子和細胞膜等神經元結構的限制,表現為特有的彌散張量。在眾多DTI研究中,部分各向異性(Fractional anisotropy,FA)和表觀彌散系數(Apparent diffusion coefficient,ADC)作為成像的兩個主要參數,常常被用來評估各種神經或精神疾病的腦組織微結構變化[9]。這些研究提示,DTI作為一種無創檢查手段,可以用來揭示常規磁共振(MRI)檢查陰性的CAE患兒的腦組織微結構是否存在異常。
我們提出如下假設:CAE患兒的大腦可能存在結構損害,并且利用DTI對CAE患兒的全腦彌散張量參數進行定量評估,并與性別、年齡匹配的健康對照組進行比較。分析差異腦區的FA值和ADC值與發病頻率、病程等臨床資料是否存在相關性,以期獲得更多臨床意義的研究。
1 資料與方法
1.1 研究對象
研究納入2014年10月-2016年4月就診的14例CAE患兒,患兒全部接受了正規教育,年齡7~14歲(9.64±2.62) 歲。典型失神發作的診斷參考國際抗癲癇聯盟(ILAE)的診斷標準[1]。納入標準包括:① EEG在正常背景波上記錄到3Hz雙側同步對稱的棘慢復合波;② 普通內科查體和神經科專科查體正常;③ 常規MRI檢查未見異常。存在精神障礙或認知功能缺陷為排除標準。納入13名性別、年齡匹配的健康對照者參加研究,年齡6~13歲(9.88±2.37) 歲,男7名,女6名,既往無神經和精神類疾病史,常規MRI檢查未見異常。病例組和對照組間性別(P=0.84)、年齡(P=0.81) 無統計學差異。所有研究對象均為右利手。
采集數據時,6例患兒未服用任何抗癲癇藥(AEDs),8例患兒正在服用單一AEDs(表 1)。所有參與研究患兒的法定監護人均簽署了知情同意書,本項研究已獲南京腦科醫院和南京醫科大學倫理委員會同意。
1.2 圖像采集
使用西門子3.0T磁共振機和8通道頭顱線圈采集所有患兒和健康對照組的MRI圖像。采集圖像時要求被試者安靜閉目,盡量避免頭動。首先,采用快速梯度回波采集3D T1像數據:TR 1 900 ms TE 2.48ms,視野250 mm × 250 mm,偏轉角12°,矩陣512×512,每個被試采集176層矢狀位圖像。然后,采用單激發平面回波序列采集DTI數據:TR 6600 ms,TE 93 ms,層厚3 mm,層間距0 mm,視野240 mm×240 mm,矩陣128×128,共30個梯度方向。最后,由兩名影像醫師檢查所有被試者的T1像和DTI圖像是否存在明顯的頭動或機器偽影。
1.3 數據處理
首先通過FSL軟件(FMRIB Software Library,http://www.fmrib.ox.ac.uk/fsl/)對原始DTI數據進行頭動渦流矯正,并在個體空間下計算每個體素的FA和ADC值。再用SPM12軟件包(Statistical Parametric Mapping, http://www.fil.ion.ucl.ac.uk/spm/software/spm12/)將個體空間下的DTI參數圖像配準到蒙特利爾標準空間(MNI152),最后采用FWHM為6mm的高斯核進行平滑、降噪處理。
1.4 統計學方法
基于SPM12軟件包,采用一般線性模型(GLM)對兩組間的DTI參數圖進行比較分析。鑒于有研究提示年齡和性別可能對大腦發育產生影響[10],本研究將年齡和性別作為協方差納入統計分析。統計閾值設置為P < 0.05 (FDR矯正)[11]。最后,在MNI標準空間下報告顯著性差異團簇的坐標位置。另外兩組間比較的結果中存在顯著差異的團簇為感興趣區(Region of interest,ROI),在SPSS19.0統計軟件中對ROI內的平均FA和ADC值與病程和發病頻率分別做Pearson相關分析。
2 結果
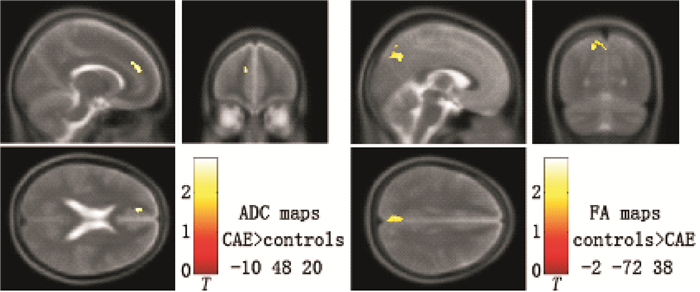
對CAE病例組與對照組的DTI參數圖進行比較發現,差異具有統計學意義的腦區主要包括:① ADC值增高位于左內側前額葉;② FA值降低位于左楔前葉(圖 1、表 2)。未發現ADC值降低或者FA值增高的腦區。
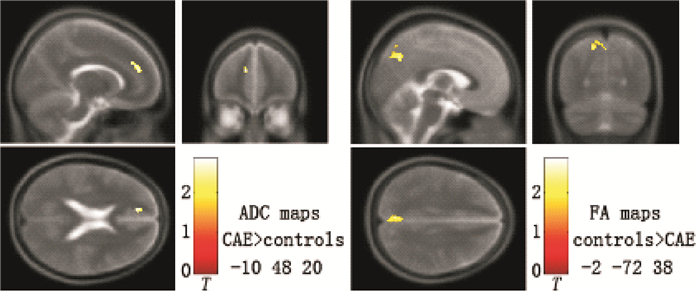 圖1
CAE病例組與對照組ADC、FA值比較結果以及MNI空間坐標位置
Figure1.
Comparison of ADC, FA value and MNI spatial coordinates between CAE patients and the controls
圖1
CAE病例組與對照組ADC、FA值比較結果以及MNI空間坐標位置
Figure1.
Comparison of ADC, FA value and MNI spatial coordinates between CAE patients and the controls
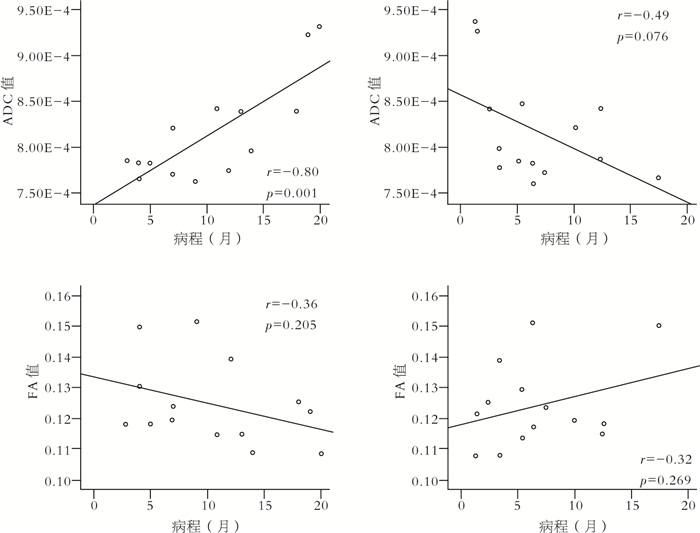
Pearson相關分析顯示,患兒的ADC值與病程存在顯著性正相關(R =0.80,P=0.001),見圖 2。FA值與病程或發病頻率均未發現明顯的相關性。
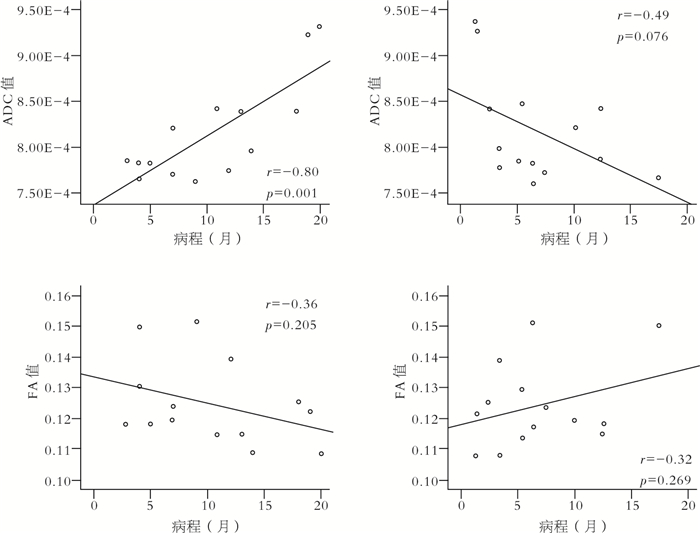 圖2
兒童失神癲癇患者的DTI參數改變與臨床癥狀相關性分析
Figure2.
Correlation analysis of DTI changes and clinical symptoms in CAE children
圖2
兒童失神癲癇患者的DTI參數改變與臨床癥狀相關性分析
Figure2.
Correlation analysis of DTI changes and clinical symptoms in CAE children
3 討論
本研究發現,與健康對照組相比,CAE患兒的大腦結構異常主要位于DMN節點腦區。不僅如此,患兒的ADC值與病程還存在明顯的相關性。所有這些結果均提示DMN節點腦區在失神發作中發揮了重要作用,而且很可能與患兒的認知、語言、行為或情趣障礙有關。
DTI可以非常準確地揭示基于橢球模型的水分子彌散運動特征。已有研究證明,聯合應用FA和ADC值有助于發現各種微結構損傷的病理機制[12]。FA是反映水分子彌散方向的指標,而ADC是反映彌散大小的指標。FA值下降表示水分子彌散運動的失方向性,往往提示組織結構完整性受損[13];ADC值增高表示水分子彌散運動范圍的擴大,有研究表明ADC值增高可能與免疫損傷或組織退行性變導致的細胞結構改變有關[14]。
DTI在癲癇研究中的應用越來越廣泛,它可以用來定位癲癇灶,揭示癇樣放電擴散的傳播通路,甚至還可以發現一些常規MRI檢查難以發現的異常變化[11, 15-18]。既往研究發現,在多種類型癲癇患者組成的病例組中FA值較正常對照低[19],而在單一失神癲癇組中,不僅FA值發生了變化,ADC值也出現了改變[20]。我們的研究進一步證實,健康對照組,CAE病例組這兩項主要DTI參數均出現了異常,而且這些異常改變主要位于DMN節點腦區。
我們前期的一項腦磁圖(MEG)研究發現,內側前額葉和楔前葉的異常活動在失神發作的起始階段發揮了重要作用[7],鑒于內側前額葉和楔前葉都是DMN的重要節點,我們認為失神發作與DMN有關。而該研究發現的結構異常也主要位于DMN節點腦區,包括:內側前額葉ADC值的升高和楔前葉FA值的降低,與我們之前的MEG研究結果相一致。基于以上結果,我們認為DMN腦區的結構異常很可能與其在電生理上表現出的過度興奮性有關。
既往EEG-fMRI研究也提示,CAE發作可能是涉及多個腦區的腦網絡的異常活動[21]。例如,在失神癲癇患者中,與EEG棘慢波同時出現的fMRI信號增高的腦區就有丘腦、額葉皮層、初級視覺皮層、聽覺皮層、運動皮層和體感中樞皮層;與EEG棘慢波同時出現的fMRI信號降低的腦區包括內側和外側頂葉皮層、扣帶回、基底節區[4]。
已有研究表明,在失神癲癇的發作期和發作間期,DMN都存在異常活動[22],這可能與短暫的癇性放電有關[23]。fMRI研究發現,CAE患兒DMN節點腦區間的功能連接強度發生了改變[6]。但是據我們所知,很少有研究關注CAE患兒DMN節點腦區的結構異常。本研究發現的DTI參數異常主要就位于DMN腦區。既往有研究認為在一些精神疾病患者中,DMN異常很可能與他們的認知障礙有關[24]。也有報道說CAE患兒同樣存在認知功能缺陷[25],而且某些患者的心理障礙可能與DTI參數異常有關[26]。這些研究結果提示,DMN節點腦區的結構異常不僅與局部皮層的異常興奮性有關,還可能與CAE患兒的認知功能缺陷有關。
特別需要注意的是,本研究的陽性結果全部落在左側大腦半球,這可能與優勢半球更容易受損有關,既往基于人類[27, 28]和動物模型[29, 30]的研究支持這一觀點。
許多研究都認為DTI參數和癲癇患者的臨床特征之間存在統計學上的相關性[31, 32]。我們研究也發現,患者內側前額葉的ADC值與病程存在明顯的相關性。Buckner等[24]認為DMN腦區的損害與認知功能缺陷有關。由于對CAE患兒的長程管理首先要考慮到記憶力障礙可能對患兒未來學習、生活的影響,所以,為了避免或者減輕認知功能受損程度,早期、積極、合理的治療對此類患者就顯得尤為重要。
本研究納入了14例CAE患兒,樣本量較小,應進一步擴大樣本量,以期獲得更穩定的結果和更可靠的結論。本研究中部分患兒在采集數據時正在服用AEDs,而AEDs會影響腦組織的正常代謝,但是否會導致腦結構改變尚不明確,我們將在后期的研究中予以分析。另外,本研究采用基于體素(Voxel-based analysis,VBA)的全腦分析,雖然避免了手工勾畫感興趣區可能導致的人為誤差,但是在VBA過程中對個體空間下的DTI參數圖進行空間標準化時可能會導致最后結果中出現假陽性團簇。我們在最后的統計中對結果進行了嚴格的矯正P < 0.05(FDR矯正),該方法可以很大程度上減少了假陽性率[11]。
綜上,本研究發現CAE患兒的DMN節點腦區存在結構異常,且內側前額葉的ADC值與患兒病程存在正相關。CAE患兒的這些結構改變為理解發作期和發作間期的功能異常提供了有力的證據,可能成為診斷CAE的新生物學標記。我們的研究將有助于進一步理解CAE患兒神經損傷的病理機制,并為開發新的AEDs提供可能。
兒童失神癲癇(Childhood absence epilepsy, CAE)是一組以突發短暫的(5~30 s)意識喪失,同時腦電圖(EEG)伴有雙側同步對稱的3Hz棘-慢復合波(Spike-and-wave discharges,SWDs)為特征的臨床綜合征,發作時無肢體抽搐[1]。失神發作一般在3~8歲期間起病(高峰期6~7歲),約占所有兒童期癲癇的10%~17%[2]。30%的CAE患兒在發作間期存在注意力缺陷或者其他類型的認知功能障礙,這使對CAE的研究顯得尤為重要[3]。
EEG-功能磁共振(fMRI)等功能影像學方法已經被用于探討全面性癲癇SWDs的病理機制[4, 5]。研究發現,CAE患者在默認模式網絡(Default mode network,DMN)內的功能連接發生了改變[6]。我們課題組前期一項腦磁圖(MEG)研究也提示失神發作涉及DMN功能異常[7]。但患者的DMN節點腦區解剖結構是否存在異常改變仍然不是很清楚。
彌散張量成像(Diffusion tensor imaging,DTI)是以水分子布朗運動為基礎的一項新型影像技術[8]。腦組織中水分子的布朗運動受到生物大分子和細胞膜等神經元結構的限制,表現為特有的彌散張量。在眾多DTI研究中,部分各向異性(Fractional anisotropy,FA)和表觀彌散系數(Apparent diffusion coefficient,ADC)作為成像的兩個主要參數,常常被用來評估各種神經或精神疾病的腦組織微結構變化[9]。這些研究提示,DTI作為一種無創檢查手段,可以用來揭示常規磁共振(MRI)檢查陰性的CAE患兒的腦組織微結構是否存在異常。
我們提出如下假設:CAE患兒的大腦可能存在結構損害,并且利用DTI對CAE患兒的全腦彌散張量參數進行定量評估,并與性別、年齡匹配的健康對照組進行比較。分析差異腦區的FA值和ADC值與發病頻率、病程等臨床資料是否存在相關性,以期獲得更多臨床意義的研究。
1 資料與方法
1.1 研究對象
研究納入2014年10月-2016年4月就診的14例CAE患兒,患兒全部接受了正規教育,年齡7~14歲(9.64±2.62) 歲。典型失神發作的診斷參考國際抗癲癇聯盟(ILAE)的診斷標準[1]。納入標準包括:① EEG在正常背景波上記錄到3Hz雙側同步對稱的棘慢復合波;② 普通內科查體和神經科專科查體正常;③ 常規MRI檢查未見異常。存在精神障礙或認知功能缺陷為排除標準。納入13名性別、年齡匹配的健康對照者參加研究,年齡6~13歲(9.88±2.37) 歲,男7名,女6名,既往無神經和精神類疾病史,常規MRI檢查未見異常。病例組和對照組間性別(P=0.84)、年齡(P=0.81) 無統計學差異。所有研究對象均為右利手。
采集數據時,6例患兒未服用任何抗癲癇藥(AEDs),8例患兒正在服用單一AEDs(表 1)。所有參與研究患兒的法定監護人均簽署了知情同意書,本項研究已獲南京腦科醫院和南京醫科大學倫理委員會同意。
1.2 圖像采集
使用西門子3.0T磁共振機和8通道頭顱線圈采集所有患兒和健康對照組的MRI圖像。采集圖像時要求被試者安靜閉目,盡量避免頭動。首先,采用快速梯度回波采集3D T1像數據:TR 1 900 ms TE 2.48ms,視野250 mm × 250 mm,偏轉角12°,矩陣512×512,每個被試采集176層矢狀位圖像。然后,采用單激發平面回波序列采集DTI數據:TR 6600 ms,TE 93 ms,層厚3 mm,層間距0 mm,視野240 mm×240 mm,矩陣128×128,共30個梯度方向。最后,由兩名影像醫師檢查所有被試者的T1像和DTI圖像是否存在明顯的頭動或機器偽影。
1.3 數據處理
首先通過FSL軟件(FMRIB Software Library,http://www.fmrib.ox.ac.uk/fsl/)對原始DTI數據進行頭動渦流矯正,并在個體空間下計算每個體素的FA和ADC值。再用SPM12軟件包(Statistical Parametric Mapping, http://www.fil.ion.ucl.ac.uk/spm/software/spm12/)將個體空間下的DTI參數圖像配準到蒙特利爾標準空間(MNI152),最后采用FWHM為6mm的高斯核進行平滑、降噪處理。
1.4 統計學方法
基于SPM12軟件包,采用一般線性模型(GLM)對兩組間的DTI參數圖進行比較分析。鑒于有研究提示年齡和性別可能對大腦發育產生影響[10],本研究將年齡和性別作為協方差納入統計分析。統計閾值設置為P < 0.05 (FDR矯正)[11]。最后,在MNI標準空間下報告顯著性差異團簇的坐標位置。另外兩組間比較的結果中存在顯著差異的團簇為感興趣區(Region of interest,ROI),在SPSS19.0統計軟件中對ROI內的平均FA和ADC值與病程和發病頻率分別做Pearson相關分析。
2 結果
對CAE病例組與對照組的DTI參數圖進行比較發現,差異具有統計學意義的腦區主要包括:① ADC值增高位于左內側前額葉;② FA值降低位于左楔前葉(圖 1、表 2)。未發現ADC值降低或者FA值增高的腦區。
 圖1
CAE病例組與對照組ADC、FA值比較結果以及MNI空間坐標位置
Figure1.
Comparison of ADC, FA value and MNI spatial coordinates between CAE patients and the controls
圖1
CAE病例組與對照組ADC、FA值比較結果以及MNI空間坐標位置
Figure1.
Comparison of ADC, FA value and MNI spatial coordinates between CAE patients and the controls
Pearson相關分析顯示,患兒的ADC值與病程存在顯著性正相關(R =0.80,P=0.001),見圖 2。FA值與病程或發病頻率均未發現明顯的相關性。
 圖2
兒童失神癲癇患者的DTI參數改變與臨床癥狀相關性分析
Figure2.
Correlation analysis of DTI changes and clinical symptoms in CAE children
圖2
兒童失神癲癇患者的DTI參數改變與臨床癥狀相關性分析
Figure2.
Correlation analysis of DTI changes and clinical symptoms in CAE children
3 討論
本研究發現,與健康對照組相比,CAE患兒的大腦結構異常主要位于DMN節點腦區。不僅如此,患兒的ADC值與病程還存在明顯的相關性。所有這些結果均提示DMN節點腦區在失神發作中發揮了重要作用,而且很可能與患兒的認知、語言、行為或情趣障礙有關。
DTI可以非常準確地揭示基于橢球模型的水分子彌散運動特征。已有研究證明,聯合應用FA和ADC值有助于發現各種微結構損傷的病理機制[12]。FA是反映水分子彌散方向的指標,而ADC是反映彌散大小的指標。FA值下降表示水分子彌散運動的失方向性,往往提示組織結構完整性受損[13];ADC值增高表示水分子彌散運動范圍的擴大,有研究表明ADC值增高可能與免疫損傷或組織退行性變導致的細胞結構改變有關[14]。
DTI在癲癇研究中的應用越來越廣泛,它可以用來定位癲癇灶,揭示癇樣放電擴散的傳播通路,甚至還可以發現一些常規MRI檢查難以發現的異常變化[11, 15-18]。既往研究發現,在多種類型癲癇患者組成的病例組中FA值較正常對照低[19],而在單一失神癲癇組中,不僅FA值發生了變化,ADC值也出現了改變[20]。我們的研究進一步證實,健康對照組,CAE病例組這兩項主要DTI參數均出現了異常,而且這些異常改變主要位于DMN節點腦區。
我們前期的一項腦磁圖(MEG)研究發現,內側前額葉和楔前葉的異常活動在失神發作的起始階段發揮了重要作用[7],鑒于內側前額葉和楔前葉都是DMN的重要節點,我們認為失神發作與DMN有關。而該研究發現的結構異常也主要位于DMN節點腦區,包括:內側前額葉ADC值的升高和楔前葉FA值的降低,與我們之前的MEG研究結果相一致。基于以上結果,我們認為DMN腦區的結構異常很可能與其在電生理上表現出的過度興奮性有關。
既往EEG-fMRI研究也提示,CAE發作可能是涉及多個腦區的腦網絡的異常活動[21]。例如,在失神癲癇患者中,與EEG棘慢波同時出現的fMRI信號增高的腦區就有丘腦、額葉皮層、初級視覺皮層、聽覺皮層、運動皮層和體感中樞皮層;與EEG棘慢波同時出現的fMRI信號降低的腦區包括內側和外側頂葉皮層、扣帶回、基底節區[4]。
已有研究表明,在失神癲癇的發作期和發作間期,DMN都存在異常活動[22],這可能與短暫的癇性放電有關[23]。fMRI研究發現,CAE患兒DMN節點腦區間的功能連接強度發生了改變[6]。但是據我們所知,很少有研究關注CAE患兒DMN節點腦區的結構異常。本研究發現的DTI參數異常主要就位于DMN腦區。既往有研究認為在一些精神疾病患者中,DMN異常很可能與他們的認知障礙有關[24]。也有報道說CAE患兒同樣存在認知功能缺陷[25],而且某些患者的心理障礙可能與DTI參數異常有關[26]。這些研究結果提示,DMN節點腦區的結構異常不僅與局部皮層的異常興奮性有關,還可能與CAE患兒的認知功能缺陷有關。
特別需要注意的是,本研究的陽性結果全部落在左側大腦半球,這可能與優勢半球更容易受損有關,既往基于人類[27, 28]和動物模型[29, 30]的研究支持這一觀點。
許多研究都認為DTI參數和癲癇患者的臨床特征之間存在統計學上的相關性[31, 32]。我們研究也發現,患者內側前額葉的ADC值與病程存在明顯的相關性。Buckner等[24]認為DMN腦區的損害與認知功能缺陷有關。由于對CAE患兒的長程管理首先要考慮到記憶力障礙可能對患兒未來學習、生活的影響,所以,為了避免或者減輕認知功能受損程度,早期、積極、合理的治療對此類患者就顯得尤為重要。
本研究納入了14例CAE患兒,樣本量較小,應進一步擴大樣本量,以期獲得更穩定的結果和更可靠的結論。本研究中部分患兒在采集數據時正在服用AEDs,而AEDs會影響腦組織的正常代謝,但是否會導致腦結構改變尚不明確,我們將在后期的研究中予以分析。另外,本研究采用基于體素(Voxel-based analysis,VBA)的全腦分析,雖然避免了手工勾畫感興趣區可能導致的人為誤差,但是在VBA過程中對個體空間下的DTI參數圖進行空間標準化時可能會導致最后結果中出現假陽性團簇。我們在最后的統計中對結果進行了嚴格的矯正P < 0.05(FDR矯正),該方法可以很大程度上減少了假陽性率[11]。
綜上,本研究發現CAE患兒的DMN節點腦區存在結構異常,且內側前額葉的ADC值與患兒病程存在正相關。CAE患兒的這些結構改變為理解發作期和發作間期的功能異常提供了有力的證據,可能成為診斷CAE的新生物學標記。我們的研究將有助于進一步理解CAE患兒神經損傷的病理機制,并為開發新的AEDs提供可能。