引用本文: 楊陽, 孫洪英, 策樂木格, 車力格爾. Krüppel樣因子4在谷氨酸誘導小鼠海馬神經元氧化損傷模型中的表達及其作用機制. 癲癇雜志, 2025, 11(1): 41-44. doi: 10.7507/2096-0247.202411005 復制
版權信息: ?四川大學華西醫院華西期刊社《癲癇雜志》版權所有,未經授權不得轉載、改編
癲癇是常見的神經系統疾病,全世界大約有7 000萬癲癇患者,癲癇的發病率也在逐年上升[1],然而,癲癇的病因復雜,發病機制尚不明確。因此,尋找潛在的原因和更有效的治療方法以提高患者的生活質量就變得尤為重要。許多相關研究在癲癇動物模型和癲癇患者中發現與氧化應激密切相關。癲癇發作時會刺激產生大量活性氧(reactive oxygen species,ROS),ROS可以加重氧化應激系統的紊亂,進一步加重癲癇腦損傷[2]。
在癲癇的發病機制中,伴隨著多種與氧化功能相關的分子標志物的改變。其中包括KLF4 ,KLF4是一種多功能轉錄因子,其富集于內皮細胞中且介導炎癥信號的激活[3],其參與癲癇的機制可能與神經炎癥、軸突再生、神經保護作用和神經遞質及其受體功能異常等相關[4]。本研究為進一步探討KLF4在癲癇發病中的作用機制,驗證是否通過氧化應激參與癲癇發病,為尋找癲癇新的治療靶點提供依據。
1 材料與方法
1.1 材料
1.1.1 實驗細胞
選取小鼠海馬神經元細胞系(HT22細胞),購于中科院細胞庫。 HT22細胞培養于DMEM培養基中。
1.1.2 主要儀器及試劑
熒光定量PCR儀(ABI,美國)、生物安全柜(Thermo,美國)、二氧化碳培養箱(Thermo,美國)、核酸蛋白分析儀(Eppendorf,德國)、SYNER GTMX酶標儀(Biotek,美國)、流式細胞儀FACSAria(BD,美國)、胎牛血清(Thermo,美國)、細胞裂解液(北京Solarbio公司)、L-谷氨酸(glutamic acid,Glu)(Sigma,美國)、Kainic acid(Abcam,美國)、KLF4 siRNA(通用生物,中國)。
1.2 方法
1.2.1 細胞培養
HT22細胞分別種植在6孔板或96孔板中,并在37℃、5% CO2的環境中預培養24 h后進行實驗。實驗分成兩組:對照組、谷氨酸誘導模型組[該組用谷氨酸(Glu)處理24 h,終濃度為5 mM]。
1.2.2 Real-Time PCR
HT22細胞中加入1ml TRIzol裂解液提取細胞中總RNA,將其逆轉錄為cDNA,配置PCR反應體系并設置反應條件,用GAPDH作為內參對照。引物信息見表1。
1.2.3 KLF4特異性siRNA轉染HT-22細胞
復蘇HT22細胞,準備50 μL不含血清培養基Opti-MEM培養液分別和2 μL lipofactamine 2000,1.25 μL 20 μM siRNA混合,混勻,室溫放置5 min備用;將混勻后的兩種培養液混合,混勻,室溫放置20 min,然后加入到細胞培養液中,充分混勻,細胞箱子中培養6 h換新鮮培養液。
1.2.4 Western blot
從各組HT22細胞和裂解緩沖液中分離出蛋白質提取物,BCA法測定蛋白含量,100℃變性10 min,配置SDS膠,上樣,80 V恒壓電泳60 min,轉為120 V恒壓電泳80 min。300 mA恒流轉膜130 min,室溫牛奶封閉2 h,洗滌緩沖液(tris buffered saline with tween 20,TBST)洗,裁條帶,一抗4℃孵育過夜,二抗室溫孵育2 h,TBST洗,配制發光液,曝光,利用Image J軟件分析灰度值。
1.2.5 CCK-8法
收集轉染以及藥物處理后的HT22細胞,調整細胞懸液濃度,96孔板每孔加入100 ml, 5% CO2,37℃ 培養細胞 24 h,每孔加入10 ml CCK-8 溶液。繼續孵育 1 h,目測染色程度,酶標儀于450 nm測定每孔吸光度。
1.2.6 統計學方法
實驗作圖采用GraphPad Prism 9.5軟件。數據分析采用spss 26.0軟件進行數據的統計學處理,所有的數據記錄為均數±標準誤。計量資料兩組間比較采用獨立樣本t檢驗,P≤0.05 為差異具有統計學意義。
2 結果
2.1 Glu誘導的HT22癲癇細胞模型中KLF4的表達情況
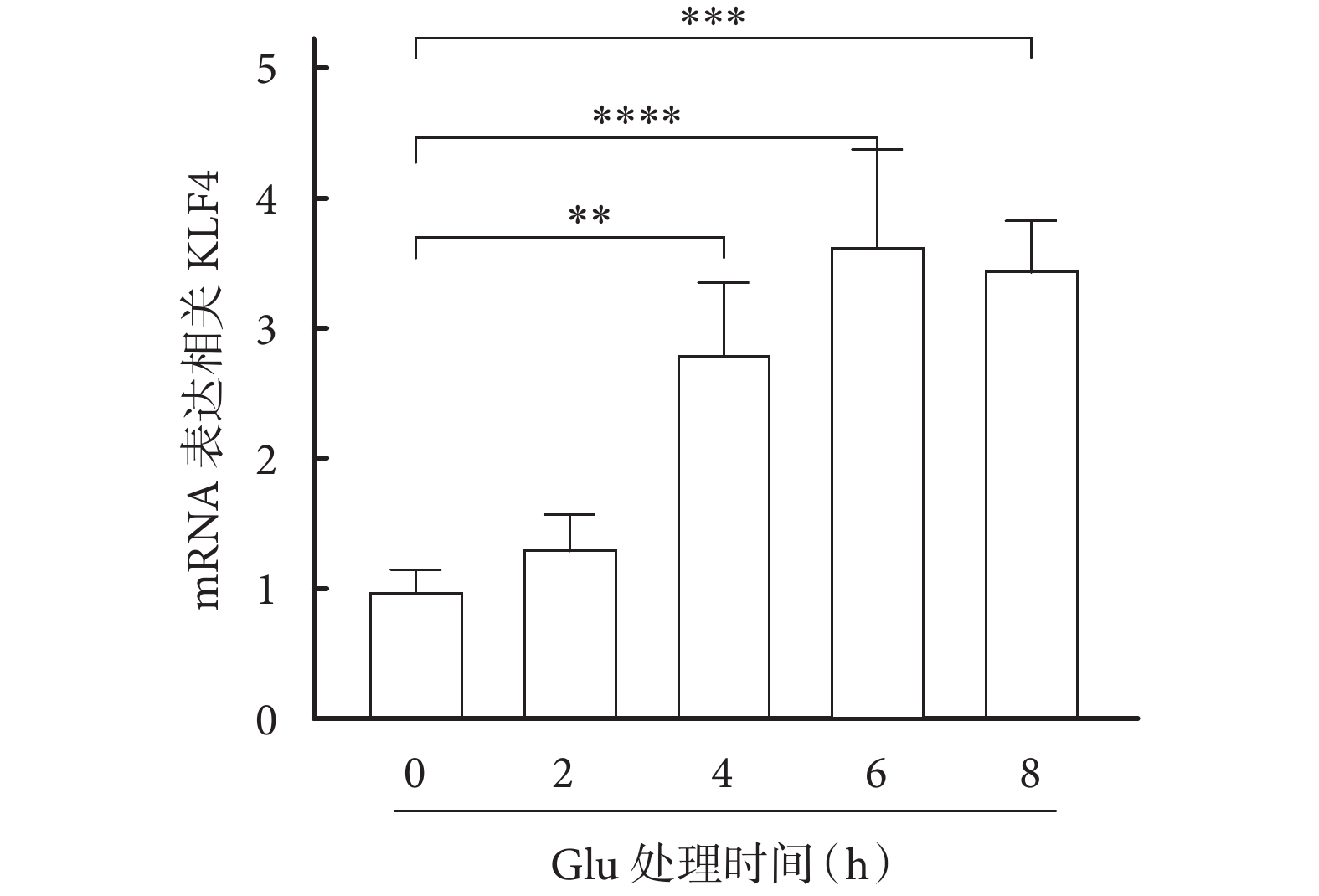
運用Real-Time PCR 檢測谷氨酸誘導HT22細胞癲癇模型中KLF4不同時間表達情況,結果顯示:Glu誘導的HT22細胞癲癇模型中KLF4的表達增加(見圖1),且差異有統計學意義(P<0.05)。
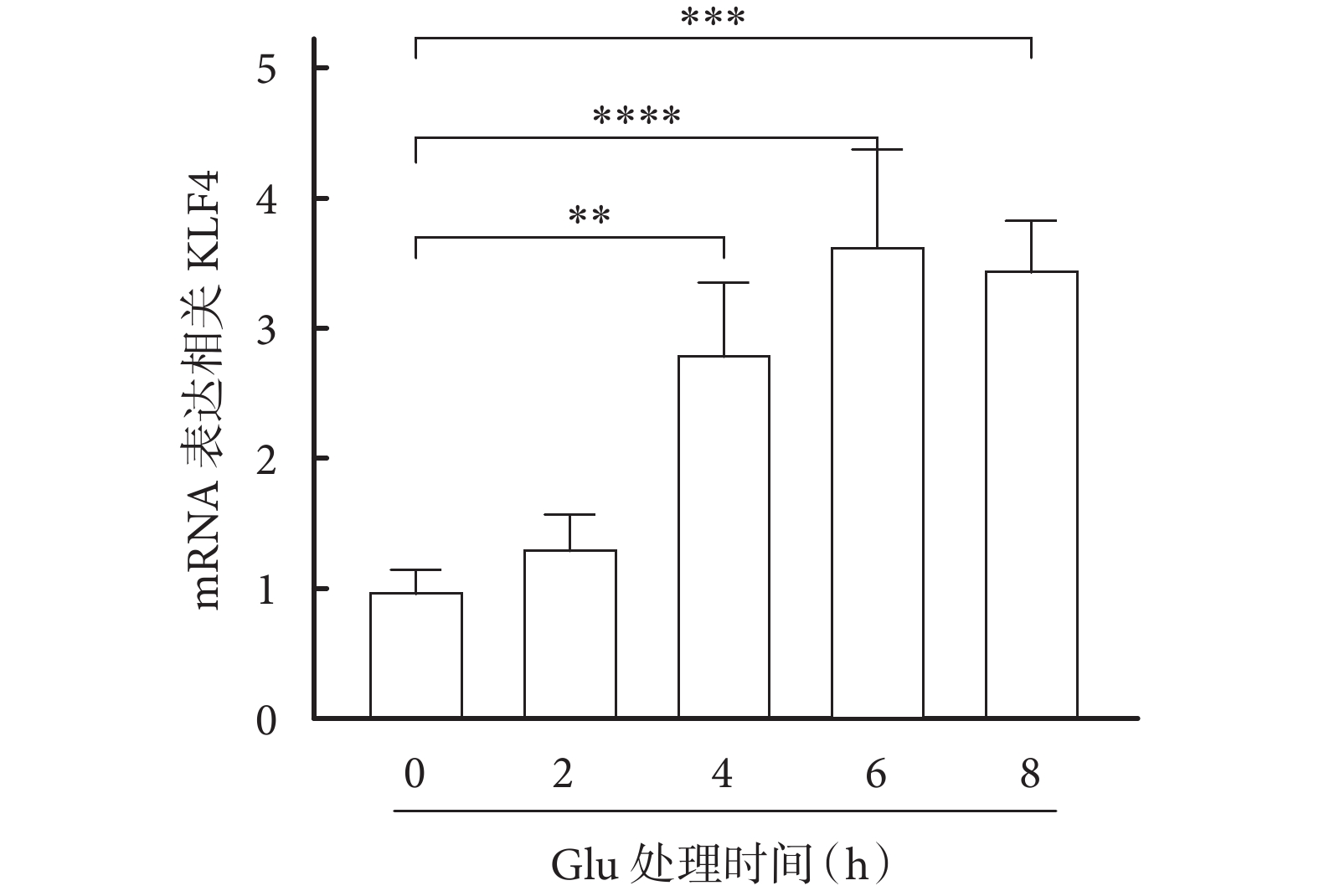 圖1
Glu誘導的HT22癲癇細胞模型中KLF4的表達情況
圖1
Glu誘導的HT22癲癇細胞模型中KLF4的表達情況
2.2 Western blot 檢測KLF4特異性siRNA轉染HT-22細胞
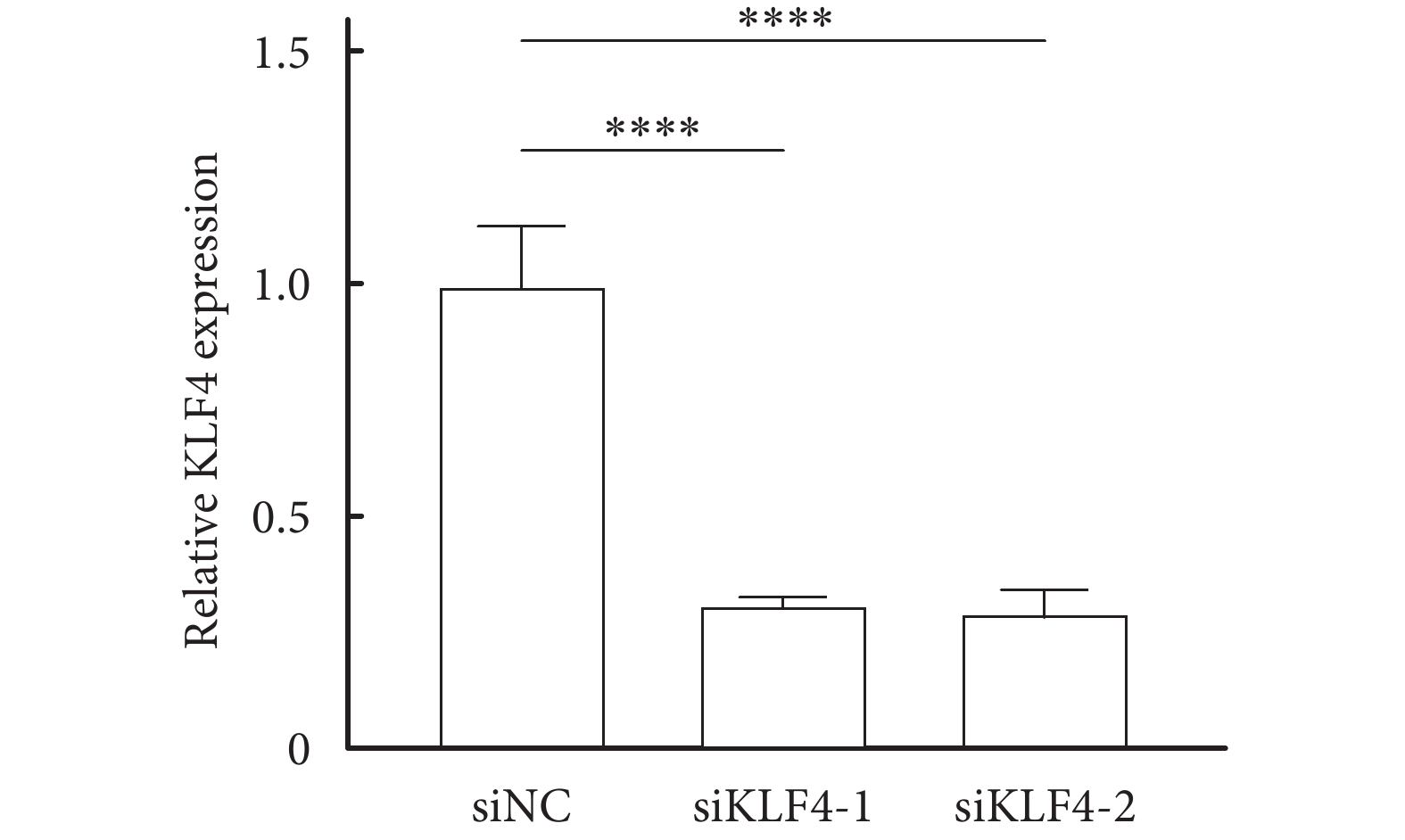
運用Western blot 檢測KLF4特異性siRNA轉染HT-22細胞,結果顯示:與對照組相比,KLF4的表達顯著下調,見圖2,且差異有統計學意義(P<0.05)。
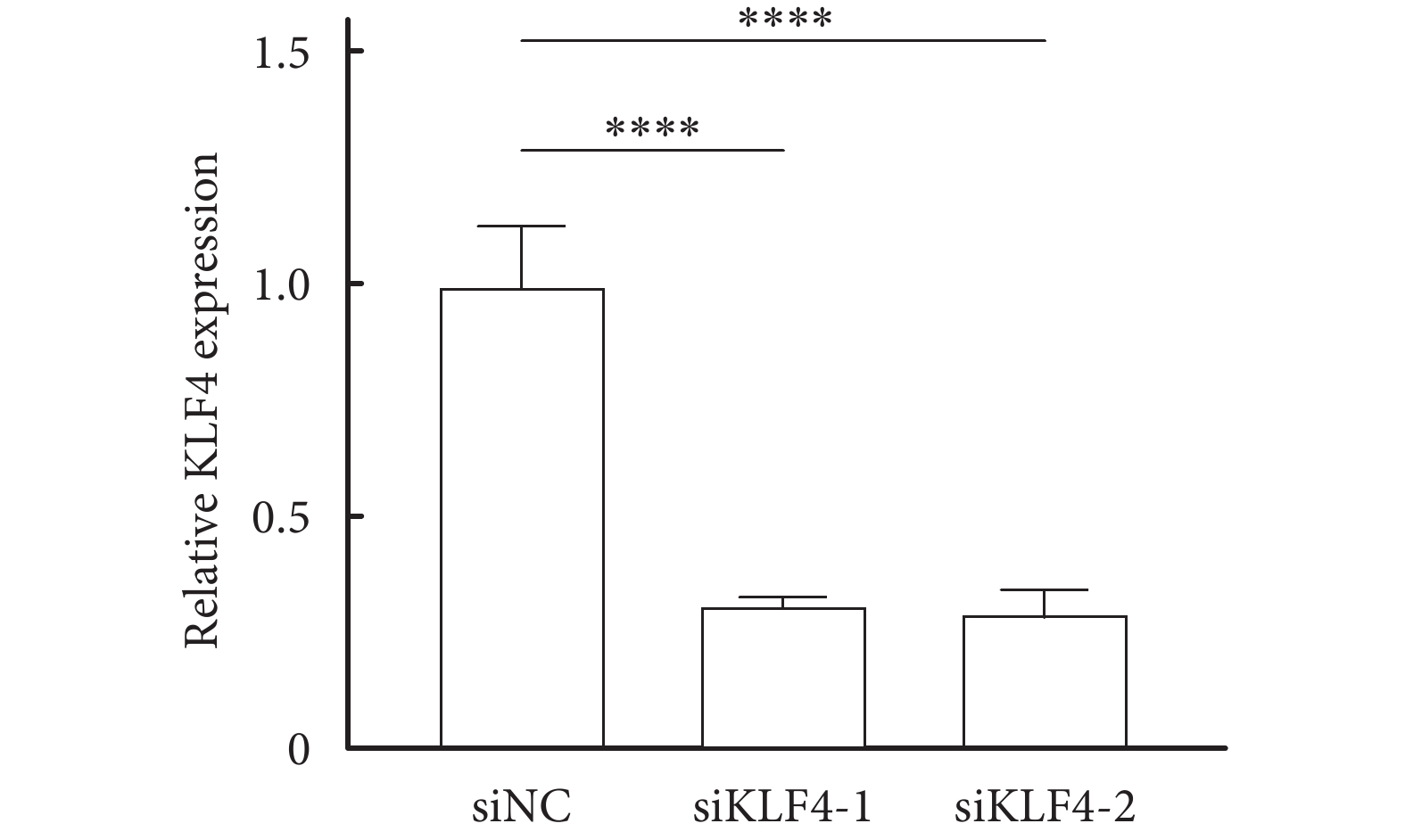 圖2
Western blot 檢測KLF4特異性siRNA轉染HT-22細胞
圖2
Western blot 檢測KLF4特異性siRNA轉染HT-22細胞
2.3 CCK-8法檢測HT-22細胞活力
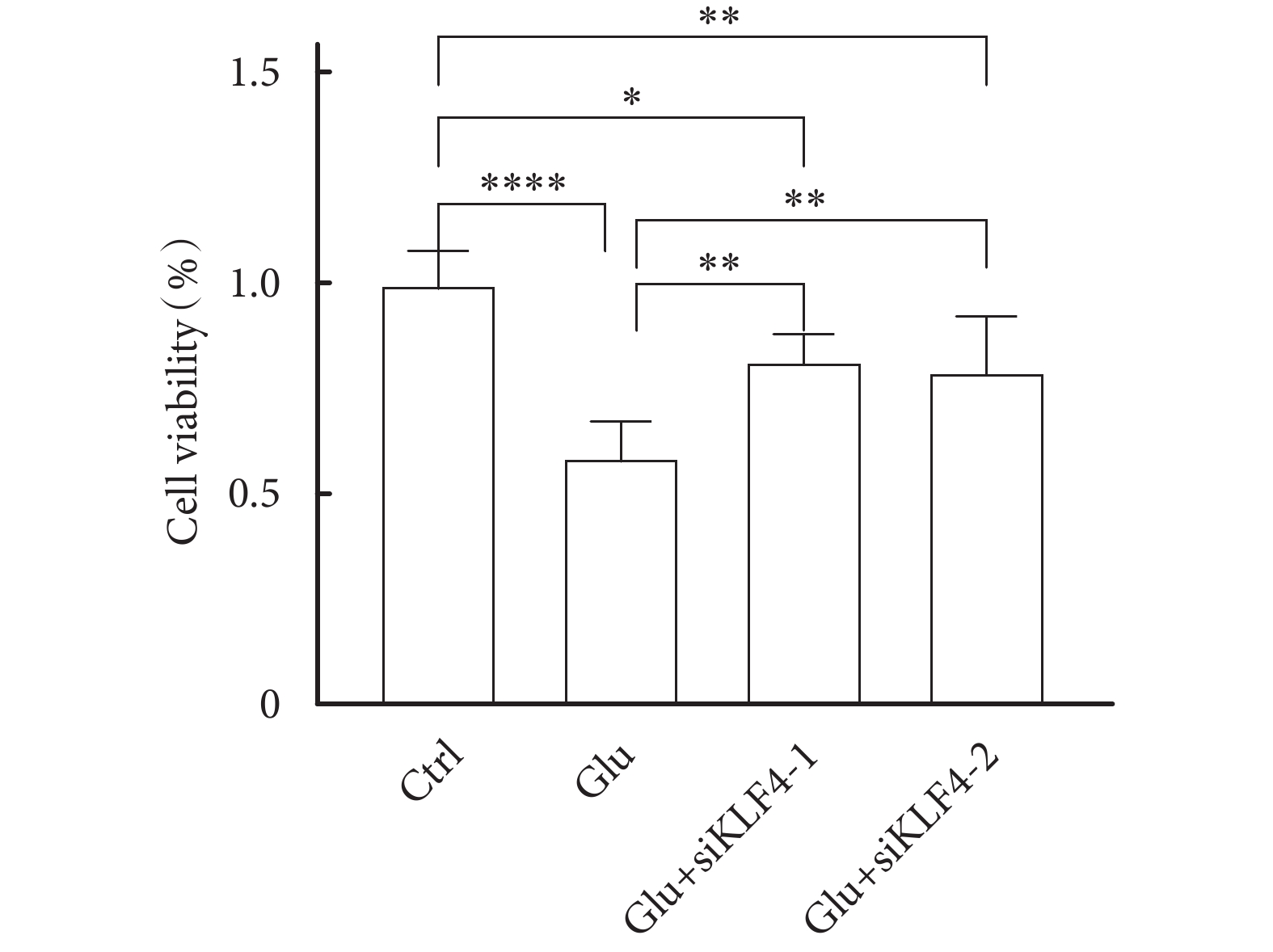
CCK8試劑盒檢測各組細胞活力,結果顯示:與對照組相比,Glu組細胞增殖能力明顯降低,而Glu+siKLF4-1組、Glu+siKLF4-2組細胞增殖能力相對降低,與Glu組相比,Glu+siKLF4-1組、Glu+siKLF4-2組細胞增殖能力相對提升,見圖3,且差異有統計學意義(P<0.05)。
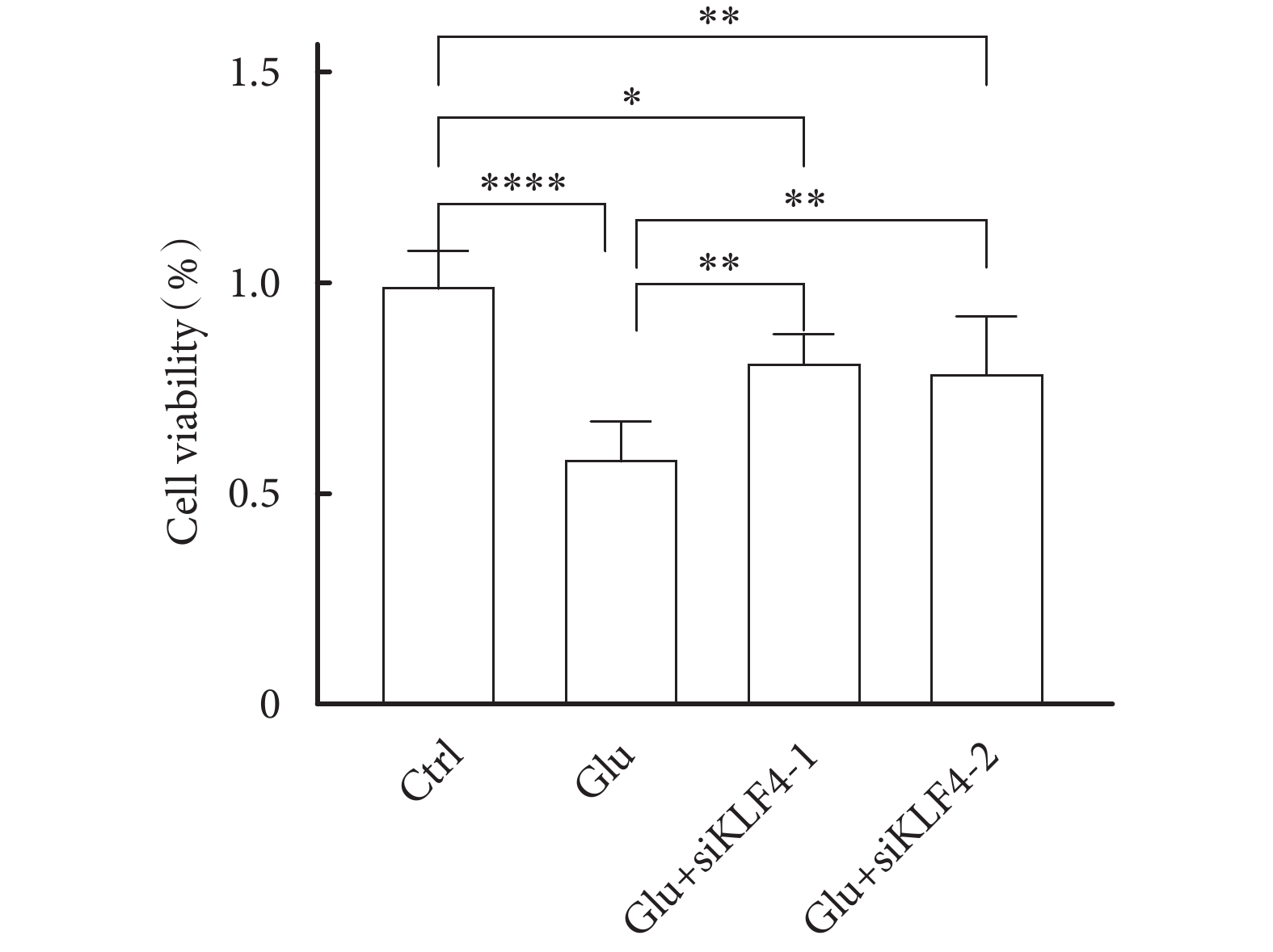 圖3
CCK8法檢測各組細胞增殖能力
圖3
CCK8法檢測各組細胞增殖能力
3 討論
癲癇的發病機制十分復雜,普遍的學說認為是大腦中興奮性和抑制性神經遞質的相對不平衡而發生的,Glu是中樞神經系統中具有興奮作用的主要神經遞質之一,可引起神經元過度興奮而導致癲癇。同時,癲癇發生過程中Glu的毒性作用可加重神經元細胞的氧化應激,進一步加重癲癇的活動[5]。與其他器官相比,大腦具有高代謝的特性,神經元大量消耗氧氣,產生大量的ROS,這些潛在的分子引起了氧化應激,氧化應激又與癲癇的許多生理和分子機制交織在一起[6]。因此,神經元興奮性增加導致癲癇發作,伴隨著ROS的產生和由此形成的氧化應激加重了神經元的死亡;這些因素可能就是癲癇發作的關鍵性特征。探索這些關鍵性特征可能為癲癇病因以及抑制癇性發作提供新思路。
癲癇、氧化應激也與神經炎癥有關,缺氧-氧化應激-炎癥是一個相互激活的惡性循環,炎癥的惡性循環進一步加重了神經細胞的功能障礙和細胞凋亡,導致了癲癇的加重。抗氧化應激和抗炎作用在癲癇的治療中就顯得尤為重要。許多轉錄因子參與了氧化應激這一生理過程,KLF4在其中扮演重要的角色,KLF4是一種多功能轉錄因子,參與調節神經炎癥、神經元凋亡和突觸再生等多種細胞過程[7]。結合國內外研究發現,KLF4參與癲癇的機制可能與神經炎癥、軸突再生、神經保護作用和神經遞質及其受體功能異常等相關。目前的研究表明,KLF4敲除小鼠海馬中,小膠質細胞標志物、星形膠質細胞標志物顯著升高并且補體信號通路亢進,這表明KLF4敲除會參與誘導炎癥反應發作[8],其可能通過介導炎癥信號參與了癲癇的氧化應激。也有研究發現,Glu能刺激觸發神經元中KLF4 mRNA和蛋白水平的快速升高[9],KLF4可能通過調控Glu興奮性信號傳遞等影響癲癇發作。然而其中的因果關系尚不明確,我們據此設計體內體外實驗試闡明KLF4-氧化應激-Glu參與癲癇發生的關系。
本研究為了探討KLF4對癲癇誘導的神經元死亡的影響,使用Glu誘導的神經元死亡興奮毒性細胞模型作為體外癲癇實驗模型,運用Real-Time PCR檢測KLF4的表達水平顯著升高,初步提示了KLF4可能調控氧化應激來參與癲癇。為了進一步驗證,使用KLF4特異性siRNA轉染HT-22細胞來沉默KLF4,采用CCK8法檢測各組的細胞功能,我們得出結論:沉默KLF4能增強HT22細胞對Glu氧化毒性的拮抗作用,提高細胞活力。上述研究初步說明KLF4可能通過參與調控氧化應激反應來影響癲癇的發生發展。
但本研究存在一定的局限性,僅在KLF4對癲癇的作用機制在Glu的氧化毒性層面進行初步探討,那么KLF4是否會通過調節ROS的水平從而發揮細胞保護作用?后續可以通過測定ROS相關因子及通路進一步明確KLF4在癲癇細胞模型中參與氧化應激的作用機制。
利益沖突聲明 所有作者無利益沖突。
癲癇是常見的神經系統疾病,全世界大約有7 000萬癲癇患者,癲癇的發病率也在逐年上升[1],然而,癲癇的病因復雜,發病機制尚不明確。因此,尋找潛在的原因和更有效的治療方法以提高患者的生活質量就變得尤為重要。許多相關研究在癲癇動物模型和癲癇患者中發現與氧化應激密切相關。癲癇發作時會刺激產生大量活性氧(reactive oxygen species,ROS),ROS可以加重氧化應激系統的紊亂,進一步加重癲癇腦損傷[2]。
在癲癇的發病機制中,伴隨著多種與氧化功能相關的分子標志物的改變。其中包括KLF4 ,KLF4是一種多功能轉錄因子,其富集于內皮細胞中且介導炎癥信號的激活[3],其參與癲癇的機制可能與神經炎癥、軸突再生、神經保護作用和神經遞質及其受體功能異常等相關[4]。本研究為進一步探討KLF4在癲癇發病中的作用機制,驗證是否通過氧化應激參與癲癇發病,為尋找癲癇新的治療靶點提供依據。
1 材料與方法
1.1 材料
1.1.1 實驗細胞
選取小鼠海馬神經元細胞系(HT22細胞),購于中科院細胞庫。 HT22細胞培養于DMEM培養基中。
1.1.2 主要儀器及試劑
熒光定量PCR儀(ABI,美國)、生物安全柜(Thermo,美國)、二氧化碳培養箱(Thermo,美國)、核酸蛋白分析儀(Eppendorf,德國)、SYNER GTMX酶標儀(Biotek,美國)、流式細胞儀FACSAria(BD,美國)、胎牛血清(Thermo,美國)、細胞裂解液(北京Solarbio公司)、L-谷氨酸(glutamic acid,Glu)(Sigma,美國)、Kainic acid(Abcam,美國)、KLF4 siRNA(通用生物,中國)。
1.2 方法
1.2.1 細胞培養
HT22細胞分別種植在6孔板或96孔板中,并在37℃、5% CO2的環境中預培養24 h后進行實驗。實驗分成兩組:對照組、谷氨酸誘導模型組[該組用谷氨酸(Glu)處理24 h,終濃度為5 mM]。
1.2.2 Real-Time PCR
HT22細胞中加入1ml TRIzol裂解液提取細胞中總RNA,將其逆轉錄為cDNA,配置PCR反應體系并設置反應條件,用GAPDH作為內參對照。引物信息見表1。
1.2.3 KLF4特異性siRNA轉染HT-22細胞
復蘇HT22細胞,準備50 μL不含血清培養基Opti-MEM培養液分別和2 μL lipofactamine 2000,1.25 μL 20 μM siRNA混合,混勻,室溫放置5 min備用;將混勻后的兩種培養液混合,混勻,室溫放置20 min,然后加入到細胞培養液中,充分混勻,細胞箱子中培養6 h換新鮮培養液。
1.2.4 Western blot
從各組HT22細胞和裂解緩沖液中分離出蛋白質提取物,BCA法測定蛋白含量,100℃變性10 min,配置SDS膠,上樣,80 V恒壓電泳60 min,轉為120 V恒壓電泳80 min。300 mA恒流轉膜130 min,室溫牛奶封閉2 h,洗滌緩沖液(tris buffered saline with tween 20,TBST)洗,裁條帶,一抗4℃孵育過夜,二抗室溫孵育2 h,TBST洗,配制發光液,曝光,利用Image J軟件分析灰度值。
1.2.5 CCK-8法
收集轉染以及藥物處理后的HT22細胞,調整細胞懸液濃度,96孔板每孔加入100 ml, 5% CO2,37℃ 培養細胞 24 h,每孔加入10 ml CCK-8 溶液。繼續孵育 1 h,目測染色程度,酶標儀于450 nm測定每孔吸光度。
1.2.6 統計學方法
實驗作圖采用GraphPad Prism 9.5軟件。數據分析采用spss 26.0軟件進行數據的統計學處理,所有的數據記錄為均數±標準誤。計量資料兩組間比較采用獨立樣本t檢驗,P≤0.05 為差異具有統計學意義。
2 結果
2.1 Glu誘導的HT22癲癇細胞模型中KLF4的表達情況
運用Real-Time PCR 檢測谷氨酸誘導HT22細胞癲癇模型中KLF4不同時間表達情況,結果顯示:Glu誘導的HT22細胞癲癇模型中KLF4的表達增加(見圖1),且差異有統計學意義(P<0.05)。
 圖1
Glu誘導的HT22癲癇細胞模型中KLF4的表達情況
圖1
Glu誘導的HT22癲癇細胞模型中KLF4的表達情況
2.2 Western blot 檢測KLF4特異性siRNA轉染HT-22細胞
運用Western blot 檢測KLF4特異性siRNA轉染HT-22細胞,結果顯示:與對照組相比,KLF4的表達顯著下調,見圖2,且差異有統計學意義(P<0.05)。
 圖2
Western blot 檢測KLF4特異性siRNA轉染HT-22細胞
圖2
Western blot 檢測KLF4特異性siRNA轉染HT-22細胞
2.3 CCK-8法檢測HT-22細胞活力
CCK8試劑盒檢測各組細胞活力,結果顯示:與對照組相比,Glu組細胞增殖能力明顯降低,而Glu+siKLF4-1組、Glu+siKLF4-2組細胞增殖能力相對降低,與Glu組相比,Glu+siKLF4-1組、Glu+siKLF4-2組細胞增殖能力相對提升,見圖3,且差異有統計學意義(P<0.05)。
 圖3
CCK8法檢測各組細胞增殖能力
圖3
CCK8法檢測各組細胞增殖能力
3 討論
癲癇的發病機制十分復雜,普遍的學說認為是大腦中興奮性和抑制性神經遞質的相對不平衡而發生的,Glu是中樞神經系統中具有興奮作用的主要神經遞質之一,可引起神經元過度興奮而導致癲癇。同時,癲癇發生過程中Glu的毒性作用可加重神經元細胞的氧化應激,進一步加重癲癇的活動[5]。與其他器官相比,大腦具有高代謝的特性,神經元大量消耗氧氣,產生大量的ROS,這些潛在的分子引起了氧化應激,氧化應激又與癲癇的許多生理和分子機制交織在一起[6]。因此,神經元興奮性增加導致癲癇發作,伴隨著ROS的產生和由此形成的氧化應激加重了神經元的死亡;這些因素可能就是癲癇發作的關鍵性特征。探索這些關鍵性特征可能為癲癇病因以及抑制癇性發作提供新思路。
癲癇、氧化應激也與神經炎癥有關,缺氧-氧化應激-炎癥是一個相互激活的惡性循環,炎癥的惡性循環進一步加重了神經細胞的功能障礙和細胞凋亡,導致了癲癇的加重。抗氧化應激和抗炎作用在癲癇的治療中就顯得尤為重要。許多轉錄因子參與了氧化應激這一生理過程,KLF4在其中扮演重要的角色,KLF4是一種多功能轉錄因子,參與調節神經炎癥、神經元凋亡和突觸再生等多種細胞過程[7]。結合國內外研究發現,KLF4參與癲癇的機制可能與神經炎癥、軸突再生、神經保護作用和神經遞質及其受體功能異常等相關。目前的研究表明,KLF4敲除小鼠海馬中,小膠質細胞標志物、星形膠質細胞標志物顯著升高并且補體信號通路亢進,這表明KLF4敲除會參與誘導炎癥反應發作[8],其可能通過介導炎癥信號參與了癲癇的氧化應激。也有研究發現,Glu能刺激觸發神經元中KLF4 mRNA和蛋白水平的快速升高[9],KLF4可能通過調控Glu興奮性信號傳遞等影響癲癇發作。然而其中的因果關系尚不明確,我們據此設計體內體外實驗試闡明KLF4-氧化應激-Glu參與癲癇發生的關系。
本研究為了探討KLF4對癲癇誘導的神經元死亡的影響,使用Glu誘導的神經元死亡興奮毒性細胞模型作為體外癲癇實驗模型,運用Real-Time PCR檢測KLF4的表達水平顯著升高,初步提示了KLF4可能調控氧化應激來參與癲癇。為了進一步驗證,使用KLF4特異性siRNA轉染HT-22細胞來沉默KLF4,采用CCK8法檢測各組的細胞功能,我們得出結論:沉默KLF4能增強HT22細胞對Glu氧化毒性的拮抗作用,提高細胞活力。上述研究初步說明KLF4可能通過參與調控氧化應激反應來影響癲癇的發生發展。
但本研究存在一定的局限性,僅在KLF4對癲癇的作用機制在Glu的氧化毒性層面進行初步探討,那么KLF4是否會通過調節ROS的水平從而發揮細胞保護作用?后續可以通過測定ROS相關因子及通路進一步明確KLF4在癲癇細胞模型中參與氧化應激的作用機制。
利益沖突聲明 所有作者無利益沖突。